Contents
Identifying and targeting pathogenic PI3K/AKT/mTOR signaling in IL-6 blockade–refractory idiopathic multicentric Castleman disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC6763254/
要旨
背景
特発性多中心キャッスルマン病(iMCD)は、サイトカイン誘発性リンパ増殖、全身炎症、細胞減少、生命を脅かす多臓器不全を伴う血液疾患である。インターロイキン-6(IL-6)遮断薬不応症患者の分子基盤は不明のままであり、標的とする治療法は存在しない。本研究では、血小板減少症、アナザルカ、発熱/C反応性蛋白質上昇、網状筋線維症、腎機能障害、オルガノメガリー(TAFRO)の臨床サブタイプを有するIL-6阻害薬難治性iMCD患者を対象に、治療標的を探索した。
方法
IL-6 ブロッカド抵抗性の iMCD-TAFRO 患者 3 名の組織と血液サンプルを解析した。サイトカインパネル、定量的血清プロテオミクス、PBMCs のフローサイトメトリー、パスウェイ解析を用いて新規治療標的を同定した。上記のアッセイから治療標的の候補であるmTORシグナ
ル伝達の上昇を確認するために、3人のiMCDリンパ節組織サンプルとコントロールにおいて、mTOR活性化のリードアウトであるリン酸化S6の免疫組織化学を行った。プロテオミクス、免疫フェノタイプ、臨床反応の評価を行い、mTOR阻害剤シロリムスの投与効果を定量化した。
結果
IL-6遮断薬に抵抗性のiMCD症例3例を対象とした研究では、CD8+ T細胞活性化、VEGF-A、PI3K/Akt/mTOR経路活性の増加が認められた。シロリムス投与はCD8+ T細胞活性化を大幅に減少させ、VEGF-Aレベルを低下させた。シロリムスは、3人の患者全員に臨床的有用性のある反応を誘導し、66ヵ月、19ヵ月、19ヵ月の持続的かつ継続的な寛解を示した。
結論
この精密医学的アプローチにより、PI3K/Akt/mTORシグナリングがIL-6阻害薬難治性iMCDにおける最初の薬理学的標的化可能な病態プロセスであることが明らかになった。治療抵抗性のiMCDにおけるsirolimusのプロスペクティブ評価が計画されている(NCT03933904)。
資金提供
本研究は、Castleman’s Awareness & Research Effort/Castleman Disease Collaborative Network、Penn Center for Precision Medicine、University Research Foundation、Intramural NIH funding、National Heart Lung and Blood Instituteの支援を受けた。
キーワード
血液学、免疫学、サイトカイン, リンパ腫
序論
多中心性キャッスルマン病(MCD)は、多クローン性リンパ増殖、異形性生殖中心を含む過血管性リンパ節、サイトカイン主導の全身炎症、細胞弁膜症、多臓器機能障害を特徴とする。米国におけるMCDの年間推定発生率は1500~1800であり、少なくとも2つのサブタイプが含まれている(1)。カポジ肉腫ヘルペスウイルス(ヒトヘルペスウイルス-8[HHV-8]としても知られている)は、MCD症例の42%~67%で病因となっている(2)。残りのMCD症例はHHV-8陰性であり、病因は特発性(iMCD)である(3)。iMCDの国際的なエビデンスに基づくコンセンサス基準が確立されており、iMCDを分類するための枠組みを提供し、この疾患の臨床的および病理組織学的な多様性を説明している(4)。iMCDの最も重篤な症例は、しばしば血小板減少症、アナザルカ、発熱、網状線維症、および臓器巨大症(TAFRO症候群)の臨床サブタイプに分類される(5)。iMCDの予後は悪く、35%の患者が診断から5年以内に死亡し、60%の患者が10年以内に死亡する(6)。
いくつかの証拠から、インターロイキン-6 (IL-6)の上昇がiMCDのいくつかの症例の病態に関与していることが示唆されている(7, 8)。唯一FDAに承認されているiMCD治療薬であるシルツキシマブや、日本ではiMCD治療薬として承認されているトシリズマブによるIL-6シグナル伝達の遮断は、症状を軽減し、リンパ節腫脹を改善することができる(9, 10)。これらの薬剤は、iMCD治療の第一選択薬として推奨されている(11)。しかし、iMCDにおけるIL-6遮断薬の唯一の無作為化比較試験では、66%の患者が治療に反応しなかった(10)し、最近の研究では、iMCD患者の血清IL-6レベルは健常者と比較して有意な差は認められていない(12)。これらの観察は、他の経路がこれらの患者の疾患発症を促進している可能性を示唆している。しかし、iMCDにおける病理学的細胞型、制御不能なシグナル伝達経路、およびドライバーとなるサイトカインは未だに不明である。IL-6 遮断薬に抵抗性の iMCD 患者は、コルチコステロイド、リツキシマブ、細胞毒性化学療法などの適応外の治療法を用いて経験的に治療されているが、これらの治療法には様々な効果と重大な毒性がある(3)。TAFROの臨床サブタイプを有することが多い最も重篤な症例では、多剤併用の細胞毒性化学療法が頻繁に必要とされる(11)。IL-6遮断薬難治性のiMCD患者に対しては、治療標的となる分子や細胞の異常を同定することが緊急に必要である。しかし、IL-6遮断薬難治性iMCDの細胞株、動物モデル、ゲノム、トランスクリプトーム、プロテオームのデータセットは、ハイスループットな標的同定のためには利用できない。患者サンプルの詳細なプロファイリングを含む精密医学的アプローチは、新規の標的同定の機会を提供する。
ここでは、炎症性サイトカインパネル、定量的血清プロテオミクス、PBMCのフローサイトメトリー、経路解析、免疫組織化学を用いて、薬理学的に標的となる疾患経路を同定するために、iMCD患者の生物試料を包括的に評価したことを報告する。その結果、IL-6阻害薬不応性のTAFROサブタイプの3人のiMCD患者において、CD8+ T細胞活性化、VEGF-Aレベル、PI3K/Akt/mTOR経路活性が疾患フレア時に増加していることが明らかになった。
PI3K/Akt/mTORは、T細胞受容体(TCR)やVEGF受容体を含む複数の細胞表面受容体の下流にある中心的な経路である(13)。PI3K/Akt/mTORシグナル伝達は、自己免疫疾患(14)および悪性疾患(15)に関与しており、VEGF-A発現(13)を含む細胞増殖、生存、および血管新生に重要である。シロリムスは、臓器移植拒絶反応の予防のために一般的に処方される強力なmTOR阻害薬であるが、iMCDでは報告されていない。我々は、iMCD患者にシロリムスを投与することで、細胞、プロテオミクス、臨床的に有意な効果が得られたことを初めて報告する。
研究成果
IL-6遮断薬不応性iMCDの3例の臨床的説明
IL-6遮断薬に難治性で、複数回の多剤併用細胞毒性化学療法を受けた3例のiMCD患者は、新しい治療法を必要としていたため、当院に来院した。臨床情報は表1にまとめられている。指標症例(iMCD-1)では詳細な標的同定を行い、治療標的候補の検証と更なる標的発見のための直交的な手法を 3 人の患者(iMCD-1,iMCD-2,iMCD-3)に渡って実施した(図 1)。
図1 研究スキーマ

TAFRO症候群を有するIL-6遮断薬難治性iMCD患者3例(iMCD-1,iMCD-2,iMCD-3)を対象にトランスレーショナルスタディを実施し、シロリムスを投与したフロー。iMCDの臨床評価は、MCD Overall Symptom Score、Clinical Benefit Response、Cheson Criteriaで行った。
表1 iMCD-1,iMCD-2,iMCD-3の人口統計、病歴、治療歴
iMCD-1は25歳の男性で 2010年に最初に1週間の体質症状、多中心性リンパ節腫脹、腹痛を呈し、アナザルカ、臓器肥大、血小板減少、発疹性チェリー血管腫症、多臓器不全へと急速に進行した病歴を持っていた。リンパ節生検では、iMCDと一致する病理組織学が明らかになり、顕著な血管過多を含んでいた(補足図1;は本論文と一緒にオンラインで入手可能;…doi.org/10.1172/JCI126091DS1)。iMCD-1の臨床病理学的特徴は、iMCDのTAFRO臨床サブタイプ(4)と一致していた。3.5年の間に、iMCD-1は
図2 iMCD-1の疾患フレア前の臨床経過とVEGF-AおよびsIL-2Rαの上昇

A)選択した臨床検査値、疾患フレアの開始日(点線の垂直線;低アルブミン血症(< 3.5 g/dL)CRP上昇(> 10 mg/L)貧血(ヘモグロビン< 13.5 g/dL)腎機能障害(クレアチニン> 1.3 mg/dL)体質症状、および体液の蓄積によって定義される)およびiMCD-1の疾患経過を通して投与された治療レジメン(n = 1)によって定義される)。CRPは病状と密接に関連している。IVIg、静脈内免疫グロブリン、ACE、ドキソルビシン(アドリアマイシン)-シクロホスファミド-エトポシド、VDT、ボルテゾミブ(ベルケイド)-デキサメタゾン-タリドミド、CRP、C反応性蛋白質。B)iMCD-1の5回目の発病の1年前から1年後までのsIL-2Rα(正常<1022pg/mL)およびVEGF-A(正常<86pg/mL)の血清レベル(発症は点線の縦線で示され、期間は斜線の領域で示される)CRPは参考のために含まれている。矢印は、sIL-2RαとVEGF-AがULN以上に上昇した時を示す。
iMCD-2は、17歳で重篤な体質症状、胸水、細胞性胸水、腎機能障害、低アルブミン血症、多中心性リンパ節腫脹を呈し、過血管化を含むiMCDの病理組織学的検査を受けた女性である(表1,補足図1)。iMCDのTAFROサブタイプと診断され、最初にドキソルビシン-ブレオマイシン-ビンブラスチン-ダカルバジン併用化学療法とトシリズマブによる治療を受けたが、臨床効果は得られなかった。トシリズマブは維持療法として継続された。トシリズマブ投与開始から2年半後に、貧血、疲労、関節痛、全身性リンパ節腫脹を伴う再発がみられた。寛解を誘導するための細胞毒性化学療法に代わる治療法が望まれていた。
iMCD-3は61歳の女性で、吐き気、嘔吐、体質症状、リンパ節腫脹、体液貯留、血液透析を必要とする腎不全、機械換気を必要とする肺不全を呈した。リンパ節生検ではiMCDの病理組織学的所見が示され、血管の増加が認められた(表1,補足図1)。彼女の臨床的特徴は、iMCDのTAFROサブタイプと一致していた。リツキシマブとトシリズマブを投与され、臨床効果が得られ、2年間トシリズマブを維持した。その後、トシリズマブ投与中に疲労、アナザルカ、脾腫、リンパ節腫脹が再発した。
iMCDはIL-6が駆動する疾患と考えられているが、IL-6遮断薬はiMCD-1では3回の発作の間に反応を誘導することができず、3人とも再発を防ぐことができなかった。これらの患者および他の患者におけるIL-6遮断薬に対する反応の欠如は、一部の患者では、追加のシグナル伝達経路が疾患の病態形成に重要である可能性を強く示唆している。
候補治療標的の同定
IL-6遮断に抵抗性のiMCDに対する追加の治療標的候補を同定するために、我々は、広範な臨床データおよび生物試料が利用可能なiMCD-1から始めて、一連の分子および細胞免疫学的研究を行った。iMCD-1の5回目のフレアに先立つ数ヶ月間に測定された13種類の血清炎症性マーカーの解析から、T細胞活性化のマーカーである可溶性IL-2受容体α鎖(sIL-2Rα)のレベルがフレア発症の20週間前に正常値の上限(ULN)を超えて上昇し、フレア中にULNの10倍でピークを迎えたことが明らかになった(図2B)。5回目のフレアに先立つ数ヶ月間に測定された13種類の解析結果から、フレア前にULNを超えて上昇した唯一の炎症性マーカーはVEGF-Aであることが明らかになった。VEGF-Aレベルはフレアの8週間前にULNに近づき、フレア中はULNの3倍でピークを迎えた(図2B)。VEGF-Aレベルは、2回前のフレアの間に測定されたときにも、ULNの2~4倍以上であった。この観察は、iMCD-1のVEGF-A関連の臨床病理学的症状-チェリー血管腫症、毛細血管漏出症候群、およびリンパ節の過血管化-と一致している。他の11の臨床的に測定された血清炎症性マーカーは、フレア発症前に一貫した上昇傾向を示しなかった(補足図2)。
次に、血清炎症性マーカーの縦断的な測定結果に基づいて、血清ベースのプロテオミクスを用いて、フレアと寛解の間で発現量に差があるかどうかを調べるために、より多くの分析項目をスクリーニングし、新たな標的候補を特定することを目指した。315の分析物のレベルを定量化するMyriad-RBM DiscoveryMAPプロテオミクスプラットフォームを用いて、sIL-2RαとVEGF-Aは、寛解期のサンプルと比較して、両方のフレアの発症時に最も上昇した血清タンパク質のうちの2つであることが明らかになった。sIL-2Rαは寛解期よりフレアの方が5倍(平均log2 [フレア/寛解]:2.38)高く、15番目に上昇した分析物であった(図3Aおよび補足表1)。VEGF-Aはフレア時に最も高発現したサイトカインであり、6番目に高発現した分析物であった(平均log2 [フレア/寛解]:3.52)(図3Aと補足表1)。病気のフレアに先行する縦方向の変化とフレア中のsIL-2RαとVEGF-Aのアップレギュレーションは、iMCD-1の病気のフレアにおけるT細胞活性化とVEGF-Aの可能性のある病原性の役割を示唆していた。
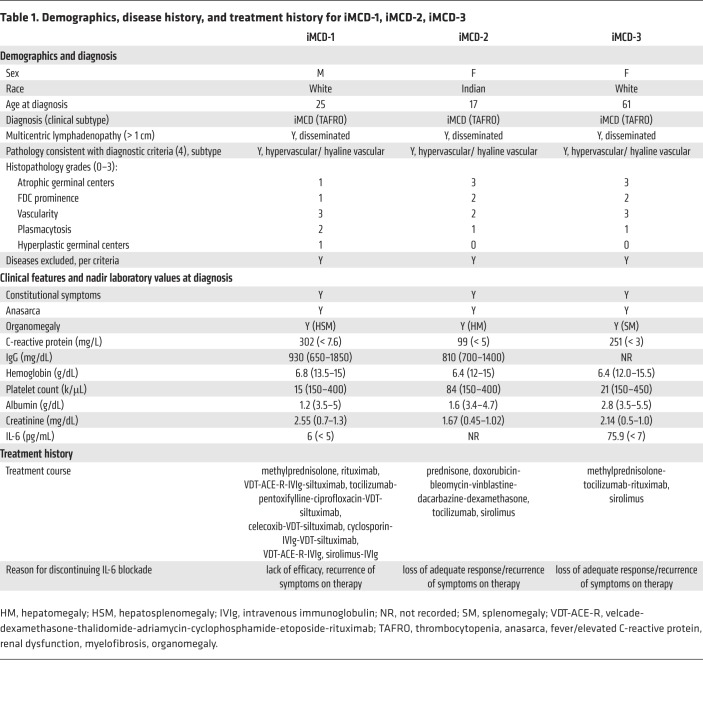
図3 血清プロテオミクスとパスウェイ解析により、VEGF-A、sIL-2Rα、PI3K/Akt/mTORシグナル伝達がiMCD-1の治療標的候補として同定された
(A) 第3回および第5回のiMCD-1のフレアと寛解の間に、同じ方向に少なくとも2倍に増加(青)または減少(オレンジ)した分析物のヒートマップ、Myriad RBM DiscoveryMAP(n = 1)で測定された。分析物は、寛解時と比較した5回目のフレア時のlog2(フレア/寛解)の変化に基づいて、左から右に昇順に表示される。キーは、与えられた倍数変化の色の強さを示している。(B, C) iMCD-1の代謝経路のためのMyriad RBM DiscoveryMAP遺伝子セットのEnrichrを使用したエンリッチメント解析。(B)第3フレア、(C)第5フレアのうち、log2(フレア/寛解)が2以上のタンパク質をKEGG経路の遺伝子セットとして解析したときの上位5つのエンリッチメント遺伝子セット(FDR<0.01,スコアを合わせた順位)の結果
色付きのセルは、フレア時に寛解時と比較して4倍以上(青)または4倍以上(オレンジ)減少していることが確認された特定の経路の遺伝子メンバーを示している。
T細胞の活性化とVEGF-A発現の中心的な標的となる候補経路を同定するために、フレア時のlog2倍以上の変化が2以上の化合物について、DiscoveryMAPデータの富化解析を行った。KEGGデータベースを用いた解析により、iMCD-1の3回目のフレアでは35個、5回目のフレアでは33個の有意な経路(FDR < 0.01)が同定された。PI3K/Aktシグナルは、両フレアの上位5つの最も濃縮されたシグナル経路の中で唯一のシグナル経路であり、sIL-2RαとVEGF-Aの両方を含む唯一のシグナル経路が同定された(図3,B、C、補足表2)。次に、DiscoveryMAPで同定された上昇した分析物の試験管内試験での発現を低下させる薬物クラスを同定することを試みた。Library of Integrated Network-based Cell Signature 1000データベースを用いた濃縮解析により、同様にVEGF-Aの発現を低下させると予測される17種類のユニークな化合物(FDR < 0.01)が同定された(表3補足)。PI3K/Akt/mTORを阻害する化合物が最も多く含まれていた(5化合物)。2つの化合物はMEKを標的としており、残りの化合物はそれぞれ独自の標的を持っていた(表3)。これらの結果から、PI3K/Akt/mTORはT細胞の活性化とVEGF-Aの発現を結びつける標的となりうる経路である可能性が示唆された。追加の候補経路を発見するために、1129種類の分析項目を測定する直交プロテオミクスプラットフォームSomaLogic SOMAscanを用いて、DiscoveryMAPでの解析と同時に得られた血漿サンプルを解析した。また、フレアと寛解の間に少なくとも2倍以上の変化(log2 [フレア/寛解]≧1)を示す分析対象物のIngenuity Pathway Analysisにより、両方のフレアのトップパスウェイとしてPI3K/Akt/mTORシグナルに関連する正則パスウェイが同定された(補足表4,補足表5)。これら3つの別々の解析により、血清プロテオミクスにより同定されたT細胞活性化とVEGF-A発現の増加の中心となる候補経路として、PI3K/Akt/mTORシグナル伝達が三角関係にあることが明らかになった。
治療標的候補の調査と阻害
次に、iMCD-1でプロテオミクス解析から同定された治療標的候補が、3症例(iMCD-1,iMCD-2,iMCD-3)すべてに存在するかどうかを調査した。IL-6遮断薬に抵抗性の3例の患者において、疾患フレア時にT細胞の活性化が増加しているかどうかを調べるために、3例すべての患者の再発時に得られたPBMCと、年齢をマッチさせた3例の健常対照者のPBMCをフローサイトメトリーで解析した。これらの解析の結果、フレア時のCD4+/CD8+ T細胞比率は健常対照と比較して有意に減少し(補足図3)CD38+(活性化)CD8+ T細胞の割合は有意に増加していることが明らかになった(図4,AおよびB)。CD38とHLA-DRを共発現する活性化CD8+ T細胞もまた、フレア中の患者では対照と比較して高い傾向にあった(P = 0.0513)(図4,AおよびC)(16)。フローサイトメトリーで観察された増加したT細胞活性化は、CD4+ T細胞集団では差が観察されなかったので、プロテオミクス所見と一致し、CD8+ T細胞に特異的である(データは示されていない)。
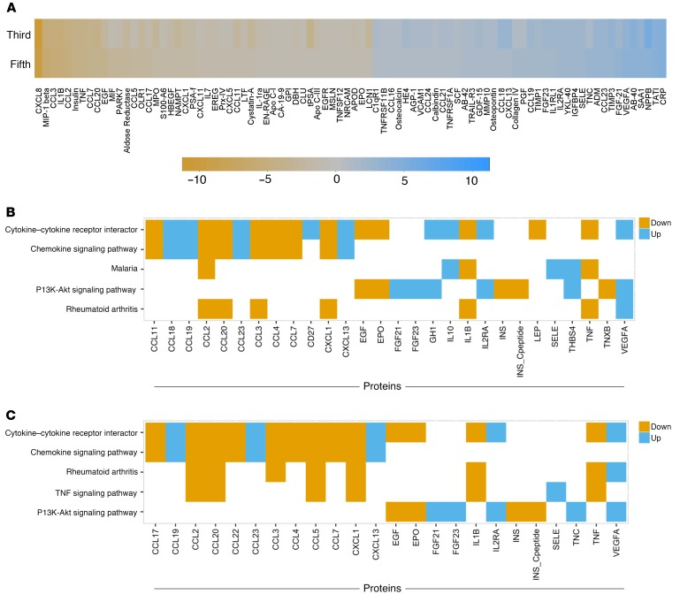
図4 IL-6阻害剤難治性iMCDにおけるCD8+ T細胞活性化、VEGF-Aレベル、およびmTORシグナル伝達の増加
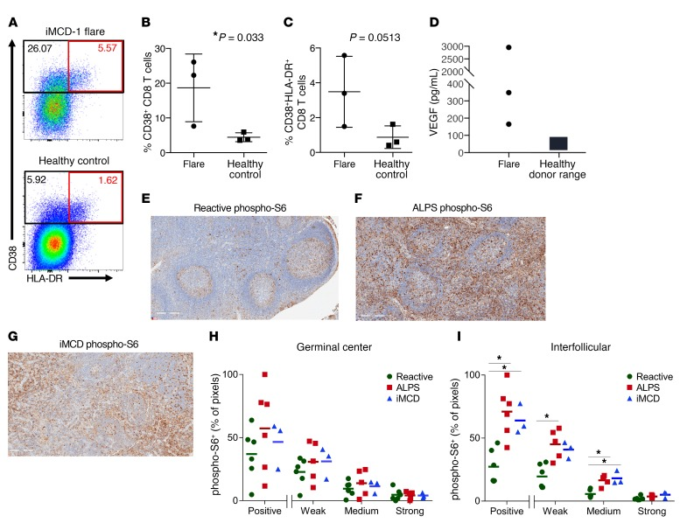
(A-C)生きた非生存CD8+ T細胞のためにゲーティングされたPBMCsのフローサイトメトリー。PBMCsは、フレアの再燃の発症時にiMCD-1,iMCD-2,およびiMCD-3から得た(n = 3,iMCD-1フレアで表される)および年齢をマッチさせた3つの健常対照(ヘルシーコントロール)から得た。ノナティブCD8+ T細胞を、CD38およびHLA-DRの発現のためにゲーティングした。ゲーティングされた領域内の細胞の割合は、それぞれについて提供される(黒の四角:CD38+;赤の四角:CD38+HLA-DR+)。SEMによる平均を示す。3つのiMCDフレアサンプルと3つの年齢をマッチさせた健康なコントロールとの間で、不対1-tailedスチューデントのt検定を行った。CD4+ T細胞集団に異常は観察されなかった(データは示されていない)。(D)循環VEGF-Aレベルは、ルーチンの臨床治療の一部として再発時にiMCD-1およびiMCD-3について測定された;iMCD-2のVEGF-Aは臨床グレードアッセイ(ARUP Laboratories)(n = 3)で測定された。健常対照範囲(9-86 pg/mL)を示す。E-I)リンパ節組織上で免疫組織化学を行い、反応性(Reactive)(E)自己免疫性リンパ増殖症候群(ALPS)(F)およびmTOR活性化のマーカーであるリン酸化リボソームタンパク質S6(phospho-S6)に対する抗体と並行してヘマトキシリン(青)で対染色したIMCD(G)リンパ節の免疫染色(茶色)の代表的な画像を提供する(スケールバーを参照のこと。300μm)。) H)生殖細胞中心染色強度の定量化および(I)毛包間染色強度の定量化は、陽性に染色されたピクセルの割合、および反応性(緑丸、n = 6)ALPS(赤四角、n = 5)およびiMCD(青三角、n = 3)のための弱、中、または強染色の内訳として示されている。平均と共にドットプロットを示す。統計的有意性は、1-尾張 Mann-Whitney U 検定で中央の対数変換された比率を比較することによって検定された。*P < 0.05.
2人の患者(iMCD-1,iMCD-2)では、CD4+とCD8+ T細胞の割合も臨床評価の一環としてフローサイトメトリーによってリンパ節組織で測定した。サンプルサイズが2であるため、これらの症例を正常なリンパ節の割合と比較するための統計的検定は実行できなかった;参考のために、過去の正常な対照群の平均とSDが提供されている(17)。循環の中で見られたことと一致して、CD8+ T細胞の割合は、両方のケース(iMCD-1:29%、iMCD-2:15%)では、歴史的な正常対照群の平均+1 SDよりも高かった。10% ± 3.3% (17). CD4+ T細胞の割合(iMCD-1:32%、iMCD-2:17%)とCD4+/CD8+ T細胞の割合(iMCD-1:1.1,iMCD-2:1.1)は、いずれの症例においても歴史的正常対照群の平均値マイナス1SDよりも低かった。それぞれ48%±12.8%、4.5±1.38%であった(17)。循環およびリンパ節におけるCD4+ T細胞に対するCD8+ T細胞の割合の増加は、活性化されたCD8+ T細胞の母集団の拡大と一致している。
iMCD-2とiMCD-3が再発時にiMCD-1(348pg/mL)と同様の循環VEGF-Aレベルの上昇を持っていたかどうかを決定するために、再発時に両方の患者の血清VEGF-Aレベルを測定した。iMCD-1で観察されたように、iMCD-2及びiMCD-3もまた、過血管化リンパ節(補足図1)及び毛細血管漏出症候群などのVEGF-Aの上昇に関連した臨床病理学的特徴を示した。これら3例の平均リンパ節血管性スコア(平均:2.67/3)は、5つの病理組織学的特徴(萎縮性生殖腺中心、形質細胞症、血管性、過形成性生殖腺中心、濾胞性樹状細胞隆起)の中で最も高いスコアであり、専門家の血液病理学者のパネルによって評価された(表1)。
CD8+ T細胞の活性化とVEGF-Aレベルの上昇という3つの症例に共通する特徴と、iMCD-1のこれらの異常の基礎となる中心的なシグナル伝達経路の候補としてPI3K/Akt/mTORシグナル伝達が同定されたことから、PI3K/Akt/mTORシグナル伝達は患者のリンパ節組織で増加すると仮説を立てた。我々は、疾患フレア時にPI3K/Akt/mTORシグナル伝達が亢進しているかどうかを決定するために、3例すべての患者の診断リンパ節組織において、mTOR活性(18)の読み出しであるリン酸化リボソームタンパク質S6(phospho-S6)のレベルを定量した。非特異的反応性リンパ節と自己免疫性リンパ増殖症候群(ALPS)リンパ節を比較対象とした。反応性リンパ節は非特異的な免疫反応によるリンパ増殖を反映するために選択されたが、ALPSは臨床的およびリンパ節病理組織学的にiMCD(19)と重複しており、病理学的にPI3K/Akt/mTOR活性の上昇を伴い(14)臨床的にmTOR阻害に反応するため、陽性対照として選択された(20)。陽性染色の割合を定量化すると、3つのIL-6遮断薬不応性のiMCD-TAFRO症例のすべての毛包間空間において、反応性結節と比較して、ホスホ-S6が有意かつ特異的に上昇していることが明らかになった(図4,E-I)。さらに、これらのiMCD-TAFRO症例におけるphospho-S6発現レベルは、過剰に活性化したmTORシグナル伝達を伴うことが知られている疾患であるALPS(14)で観察されたものと同様の大きさと分布であり、mTOR阻害が標準治療の対象となっている(20)。これらの知見は、PI3K/Akt/mTOR経路の活性がiMCD-TAFRO症例で増加していることを確認し、PI3K/Akt/mTORシグナリングがIL-6遮断薬難治性のiMCD-TAFROにおける病因機序である可能性を示唆している。
これらの所見と、これらの患者さんが以前の治療法で再発していたことを考慮して、3人の患者さん全員にmTOR阻害薬であるsirolimus(3mg/日)の投与を開始した。投与量は5-10 ng/mLのトラフレベルになるように調節され、ALPS(20)の投与量と一致していた。3人の患者さんでは、シロリムスを投与した前のフレアサンプルと寛解サンプルの間で、活性化CD8+T細胞が有意に減少した(図5,A-C)。シロリムスの開始後、VEGF-AレベルはiMCD-1(図2A)では正常範囲にとどまり、iMCD-2(図5D)ではわずかに下降傾向にあり、iMCD-3ではULNの20倍から正常範囲内に劇的に低下した(図5E)。
図5 IL-6阻害抵抗性iMCDにおけるmTORの治療的阻害後のT細胞活性化とVEGF-Aレベルの低下
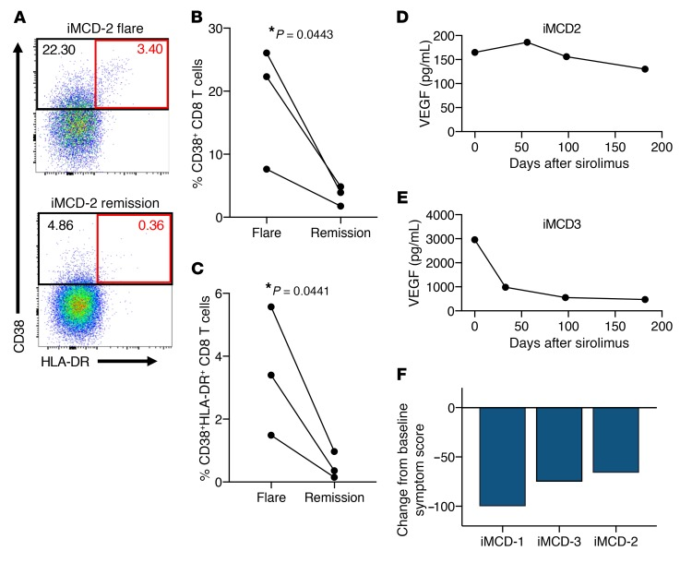
(A-C)ライブ非生CD8+ T細胞のためにゲートされたPBMCsのフローサイトメトリー。図4A-Cに示すように、フレアの再燃の発症時のiMCD-1,iMCD-2,およびiMCD-3からのPBMC(n = 3,iMCD-2フレアで表される)を、3人すべての患者(iMCD-2寛解で表される)について、mTOR阻害により寛解が達成された後のPBMCと比較した。ノナイブCD8+ T細胞を、CD38およびHLA-DRの発現のためにゲーティングした。ゲートされた領域内の細胞の割合は、それぞれについて提供される(黒の四角:CD38+; 赤の四角:CD38+HLA-DR+)。3つのiMCDフレアサンプルと3つの寛解サンプルの間でペアリングされた1-tailedスチューデントのt検定を行った、P < 0.05。D-E)循環VEGF-Aレベルは、iMCD-2(D)については臨床グレードアッセイ(ARUP Laboratories)によって、iMCD-1(データは図2Bに示されている)およびiMCD-3(E)については、再発時およびシロリムスを開始した後の3つの後続の時点で、ルーチンの臨床ケアの一部として測定した。両方のVEGF-Aアッセイの健常対照範囲は9〜86pg/mLであった。F)iMCD-1,iMCD-2,およびiMCD-3(n = 3)のMCD関連総合症状スコアによって決定されるベースライン症状スコアのパーセンテージ変化を表示するプロット。
iMCD-1,iMCD-2,iMCD-3では、MCD関連総合症状スコア(MCD-OSS)が少なくとも50%改善した(10)という耐久性のある症状反応の基準を満たし、プリシロリムスによるMCD-OSSの変化はそれぞれ-100%、-66%、-75%であった(図5F)。2019年7月現在、iMCD-1,iMCD-2,およびiMCD-3では、それぞれ66,19,19ヶ月間、応答が持続的であり、進行中である。リンパ節腫脹が存在し、Cheson基準(22)でリンパ節/腫瘍反応を評価できる患者(iMCD-2およびiMCD-3)はいずれも完全奏効を獲得した。iMCD-1 は、臨床症状が急速に悪化したため、sirolimus を開始する前に、リンパ節/腫瘍反応が完全に反応し、臨床症状が部分的に反応する多剤併用細胞毒性化学療法を受けていたため、sirolimus についてリンパ節/腫瘍反応の基準を評価することができなかった。化学療法後、iMCD-1では、シロリムス開始前のMCD-OSSは6であり、低悪性度の持続性症状を有していた。しかし、リツキシマブ関連低ガンマグロブリン血症に対する継続的なsirolimusと静脈内免疫グロブリン(IVIg)(500mg/kg/月)の免疫補充的投与により、iMCD-1は2019年7月時点で66カ月の完全寛解状態にあり、これは以前の寛解期間の平均(7.6カ月)よりも8倍長いもので、これもまた多剤化学療法によって誘発され、以前はIL-6遮断薬と化学療法によって維持されていたものである。VEGF-AとsIL-2Rαはともに過去66カ月間正常範囲にとどまっていた(データは示されていない)。
表2 iMCD-1,iMCD-2,およびiMCD-3のsirolimus投与前後の臨床的および検査的特徴と臨床的有用性の反応
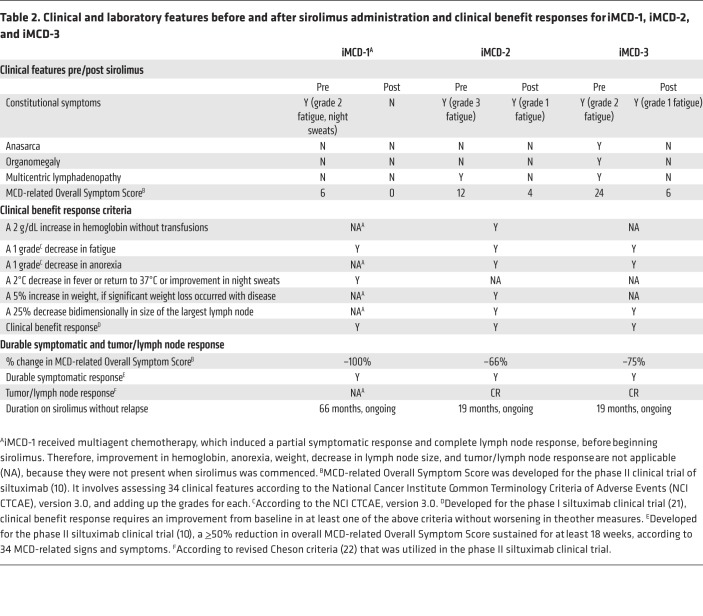
iMCD-2の軽度の疾患活動性再発(MCD-OSS:12)の最中にトシリズマブからシロリムス単剤療法に移行したところ、ヘモグロビン値の改善、疲労感、食欲不振、関節痛の改善、肥大したリンパ節の縮小が認められた。患者は、フルタイムの大学の授業に復帰できるほど元気になった。iMCD-3の中等度の疾患活動性の再発(MCD-OSS:24)の間に、トシリズマブをシロリムス単剤療法に置き換えると、疲労と脾腫、体液の蓄積が減少し、リンパ節のサイズが縮小した。3名の患者さんはいずれもシロリムス投与後の経過は良好で、再発や重大な合併症はなかったと報告されている。iMCD-1は当初、副作用として口腔内潰瘍を経験したが、4ヶ月後には消失した。これらの結果は、PI3K/Akt/mTORが有効な治療標的であることを示しており、シロリムスはIL-6阻害剤難治性のiMCDにおいても寛解を延長し、疾患活動性を低下させることが可能であることを示している。
考察
iMCDは広くIL-6が関与する疾患と考えられている。しかし、iMCDではIL-6が一様に上昇しているわけではなく、IL-6遮断薬が有効な症例はごく一部に限られている。本研究では、臨床的、細胞的、分子的データを総合的に検討した結果、CD8+ T細胞の活性化とVEGF-Aの上昇がiMCDの特徴であり、PI3K/Akt/mTORが治療標的であることを明らかにし、iMCDにおけるT細胞の活性化とVEGF-Aとの関連性を初めて明らかにした。以上の結果から、シロリムスの投与は、IL-6阻害剤難治性のiMCD-TAFROにおいて、疾患寛解の維持と疾患フレアの治療の両方に有効であることが示唆された。
シロリムスは、腎移植片拒絶反応の予防(23)およびリンパ管新生筋腫症の治療(24)のためにFDAの承認を受けており、長期的な安全性プロファイルが確立されている。シロリムスは、既存の化学療法や他の標的治療薬と比較して、安価で、簡便な経口剤形で入手でき、忍容性も良好である。シロリムスが他の疾患で報告されている複数の作用機序が、iMCDで観察された治療効果に寄与している可能性がある(23)。本研究のデータは、mTOR、CD8+ T 細胞活性化、サイトカイン分泌(VEGF-A を含む)細胞増殖(13)の阻害を通じて sirolimus の有効性が主張されるモデルを支持するものである(補足図 4)。いくつかの証拠は、PI3K/Akt/mTOR経路活性がVEGF-A発現(25-29)とT細胞活性化(30-33)に重要であることを示唆しており、mTOR阻害はこれらの機能を阻害する期待される効果を発揮する。シロリムスはT細胞以外の細胞、例えばマクロファージ(34)にも作用している可能性があり、これもVEGF-Aレベルの上昇に寄与している可能性があり、シロリムスはエフェクターT細胞に比べてその機能や増殖を相対的に抑制している調節性T細胞にも作用している可能性がある。ALPSや全身性エリテマトーデスなど、免疫調節障害を伴う他のいくつかの疾患は、PI3K/Akt/mTOR経路の活性化の亢進を伴うことが知られており、シロリムスの恩恵を受けることができる(14, 35)。ALPSでは、シロリムスは、疾患を誘発する二重陰性T細胞とその前駆体の生存と増殖を阻害する(14)。重要なことは、3人のiMCD患者において、phospho-S6がALPS患者と同程度に増加していることを示したことである。シロリムスに反応するループス患者では、シロリムスはエフェクターメモリーCD8+T細胞を有意に減少させ、プロ炎症性T細胞を減少させ、調節性T細胞を増加させる(35)。これらの症例におけるphospho-S6を発現する細胞型の調査は行われなかった。iMCDにおけるこれらの細胞型を同定するためには、免疫蛍光またはフローサイトメトリーを含む将来の研究が必要である。mTORシグナルはiMCDの主要な推進因子であるかもしれないし、そうでないかもしれないが、これらの患者の症状の改善は、iMCDの病因に重要であることを示唆している。
治療マーカーに加えて、sIL-2Rα、VEGF-A、CD38+CD8+ T細胞は、iMCDの病状をモニターするための重要なマーカーであると考えられる。iMCDの症例研究の分析では、sIL-2RαとVEGF-Aの上昇は、それぞれ21例中20例と20例中16例で認められた(3)が、その後の血清プロテオミクス研究(12, 36)で確認された所見である。活性化CD38+CD8+T細胞は、3例のiMCD患者で増加し、シロリムス投与により減少したが、HIV(37)や全身性エリテマトーデスでも増加し、同様に効果的な疾患コントロールにより減少する(38)。これらのマーカーやその他のマーカーの有用性をより大規模なコホートで調査し、それらの潜在的な予測や治療への影響を調べるためには、さらなる研究が必要である。大規模な血清プロテオミクス研究が現在進行中である。
この研究にはいくつかの制限がある。第一に、この研究は3人のiMCD患者のみを含んでいた。サンプルサイズが小さいにもかかわらず、シロリムスの確立された生物学的標的のレベルは、対照群と比較して有意に増加し、また、シロリムス治療後に有意な減少を示し、堅牢な生物学的反応を示唆した。第二に、3人の患者はすべて、iMCDのTAFRO症候群の臨床サブタイプを示しており、無作為に選択されなかった。これらの患者にシロリムスを投与したのは、臨床病理学的特徴とmTOR阻害が有効であることを示唆する細胞・分子所見を共有していたからである。さらに、2名の患者(iMCD-2およびiMCD-3)では、症状が徐々に再発しており、化学療法が適応となる前にシロリムスを投与することが可能であった。したがって、これらの知見は、IL-6 遮断薬に抵抗性のある TAFRO 症候群の iMCD 患者に限定されている可能性があり、iMCD 患者全体の有効性を評価し、奏効のバイオマーカーを同定するためには、より大規模な臨床試験が必要である。我々のデータに基づいて、IL-6遮断薬難治性のiMCDを対象としたシロリムスの臨床試験が2019年8月に登録を開始する予定である(NCT03933904)。第三に、iMCD-1は、sirolimusが投与される前に既に細胞毒性化学療法を受けており、高用量で様々な免疫調節機構を示すことができるIVIgの免疫不応性投与をsirolimusと同時に受けており(39)、この場合のsirolimusの影響を完全に評価する能力が制限されている。しかし、iMCD-1の長期の寛解、iMCD-2とiMCD-3の持続的な症状とリンパ節反応は、より重症化した疾患の中で、シロリムスが有効であることを示唆している。第四に、これらの症例におけるPI3K/Akt/mTORシグナル伝達の増加の原因は不明である。iMCD-1からのPBMCsからのDNAの臨床的全エクソームシークエンシング解析(ベイラー医科大学、テキサス州ダラス)は、患者の表現型に関連する変異またはバリアントを同定するために実施されたが、いずれも発見されなかった。生殖細胞のDNAとリンパ節組織のDNAの遺伝子配列決定は、他の患者でも進行中であるが、これまでのところ明確なゲノムドライバーを特定することはできなかった。11人のiMCD患者のリンパ節組織からの広範なウイルスの発見も、iMCDの病因としての急性ウイルス感染を明らかにすることができなかった(40)。炎症性シグナリングを開始する自己反応性抗体を同定するために、自己抗体スクリーニングが現在進行中である。PI3K/Akt/mTOR活性化の増加の病因は不明であるが、本研究は、病因が不明のままであっても患者の利益につながる治療標的を特定するために、細胞、プロテオミクス、分子アッセイの可能性を実証している。
採用された精密医学的アプローチは、活性化されたCD8+ T細胞、PI3K/Akt/mTORシグナル伝達、VEGF-AがiMCDの発症に関与しており、sirolimusが難治性iMCDの有効な治療法である可能性を示唆している。
方法
臨床および検査データ
すべての臨床検査値、治療、および検体採取日は、患者の医療記録から得た。図2Aの疾患発現日は、低アルブミン血症(< 3.5 g/dL)C反応性蛋白(CRP)上昇(> 10 mg/L)貧血(ヘモグロビン< 13.5 g/dL)腎機能障害(クレアチニン> 1.3 mg/dL)体質症状、および体液の蓄積によって定義された。iMCD-1のsIL-2Rαのデータは、1日に複数の検査が行われた場合に平均化された。VEGF-Aレベルは、iMCD-1とiMCD-3のカルテデータから得た。iMCD-2については臨床試験ではVEGF-Aレベルが定量化されていないため、サンプルをARUP研究所に送って検査を行った。循環VEGF-A正常範囲は、すべてのアッセイにおいて86pg/mL未満であった。患者の臨床評価の一環として実施されたリンパ節組織のフローサイトメトリー(iMCD-1およびiMCD-2)のデータは、患者の医療記録から抽出された。過去の正常対照群(N = 27)からのデータは、参考のためにiMCD-1とiMCD-2からの割合の隣に示されているが、統計的検定は実施されなかった(17)。ACCELERATE自然史登録のために集められたiMCDの専門家のパネルは、それぞれの診断を確認し、主要な病理組織学的特徴を評価し、各ケースの臨床データと病理組織学を検討した。医療記録と画像データは、MCD-OSSと腫瘍/リンパ節反応基準(参考文献10に定義されている)による症状反応と臨床的利益反応(参考文献21に定義されている)を評価するために、治療医によってレビューされた。
フローサイトメトリー
3人の患者(フレアおよび寛解期)と3人の年齢と性別をマッチさせた健常対照者からサンプルを採取し、同じプロトコルに従って処理した。簡潔に言うと、PBMCは、Ficoll-Paque PLUS(GEヘルスケア)を用いた密度勾配遠心によって単離された。細胞をリン酸緩衝生理食塩水(PBS)(Life Technologies)で2回洗浄し、20%ウシ胎児血清(FBS)(Life Technologies)および10%DMSO(Sigma-Aldrich)を含む凍結培地で凍結保存し、長期保存のために液体窒素中で維持した。 iMCD-1のフレアサンプルは、部分的な応答を誘導するVDT-ACE-Rを受ける前に、iMCD-1のCRPが28.5 mg/Lであったときに収集した。iMCD-2のフレアサンプルは、シロリムス単剤療法開始直前にトシリズマブ投与中に症状が再発したときに採取した。寛解サンプルは、sirolimus単剤治療開始6ヶ月後に採取した。iMCD-3のフレアサンプルは、シロリムス単剤治療開始直前にトシリズマブを投与中に症状が再発したときに採取された。寛解サンプルは、シロリムスを開始してから6ヶ月後に採取した。シロリムス投与開始から1ヵ月後と3ヵ月後に採取したサンプルも分析したところ、同様の傾向が示された(データは示されていない)。フローサイトメトリー実験のために、凍結保存した細胞を解凍し、10%FBS(Gemini)1%ペニシリン/ストレプトマイシン(Lonza)および2mM l-グルタミン(Corning)を添加したRPMI培地中で3時間休ませた。次いで、細胞をPBSで洗浄し、生存性色素(LIVE/DEAD Aqua、サーモフィッシャーサイエンティフィック)で室温で10分間染色し、次いで、表面マーカーに対する抗体で20分間染色した。使用した抗体クローンは以下の通りである。抗CD3(UCHT1,BDバイオサイエンス、カタログ565515)抗CD4(SK3,BDバイオサイエンス、カタログ566392)抗CD8(RPA-T8,BDバイオサイエンス、カタログ564805)抗CD19(HIB19,バイオレジェンド、カタログ302239)抗CD14(MφP9,BDバイオサイエンス、カタログ566190)抗CD45RA(HI100.BD Biosciences、カタログ565702)抗CCR7(G043H7,BioLegend、カタログ353213)抗CD27(O323,BioLegend、カタログ302827)抗HLA-DR(G46-6,BD Biosciences、カタログ562844)抗CD38(HIT2,BD Biosciences、カタログ565069)および抗PD1(EH12. 2H7,BioLegend、カタログ562516)を用いた。) 染色後、細胞を1%BSA(Gemini)および0.1%アジ化ナトリウム(Thermo Fisher Scientific)を含むPBSで洗浄し、1%パラホルムアルデヒド(EMS)で固定した。すべてのサンプルを、FACSymphony A5細胞光度計(BD Biosciences)を用いて読み取り、FlowJoソフトウェア(FlowJo, LLC)を用いて分析した。リンパ球は、前方散乱および側方散乱により同定した。リンパ球のゲートをさらに分析して、生きたCD3+CD8+ T細胞をゲートした。ナイーブCD8+ T細胞を表すCD45RA+CCR7+細胞を除外して、ナイーブCD8+ T細胞をゲートした。iMCDフレアサンプルと健常対照との細胞集団の割合を比較するために、対をなした1-tailed Student’s t検定を使用した。対をとった1-tailedのStudent’s t検定を用いて、フレア中に得られたiMCDサンプルと、シロリムス投与中の寛解サンプルの細胞集団の割合を比較した。
プロテオミクス。
iMCD-1の第3回および第5回フレアサンプルは、それぞれ第3回および第5回フレアの発症時に、CRP値がULNの2~3倍の間であったときに採取した。寛解期の血清と血漿サンプルは、iMCD-1のCRPが正常範囲にあるときに採取した。血清および血漿を、標準プロトコルに従ってiMCD-1について単離し、-80℃で保存し、ドライアイス上で一晩出荷して、Myriad RBM(血清)およびSomaLogic, Inc. 血漿)に一晩ドライアイスで輸送した。プロテオミクス定量は、315の分析物のレベルを定量するマルチプレックスイムノアッセイであるMyriad RBM DiscoveryMAP v.3.3(41)および1129の分析物を定量する修飾DNA-アプタマーアプローチであるSomaLogic SOMAscan(42)について、以前に公表された方法に従って実施した。
DiscoveryMAPデータセット
DiscoveryMAPを用いてプロファイリングされた315のタンパク質のうち、236は3つのサンプルすべてで検出可能であり、41は少なくとも1つのサンプルで検出可能であり、38はいずれのサンプルでも検出できなかった。また、データが完全または一部欠落している各タンパク質の平均発現量を最小検出量(LDD)と比較した。少なくとも1つのサンプルで検出可能なすべてのタンパク質は、LDDよりも大きい平均発現を有していた。したがって、欠落した値は、そのタンパク質のLDDで置き換えた。最後に、IL-6は、シルツキシマブ投与後は、IL-6中和シルツキシマブ複合体による干渉のため、現在利用可能な免疫学的ベースのIL-6定量法では正確に測定できないため、分析から除外した(43)。ヒートマップを作成するために、両フレアのすべてのタンパク質について、フレア時のタンパク質濃度を寛解時で割ったlog2比を求めた。絶対log2倍率が2より大きいタンパク質は、ユーザーが遺伝子記号のリストをアップロードできるウェブベースのアプリケーションであるEnrichrを使用して解析し、フィッシャーの厳密検定を使用して、遺伝子リストと任意のデータベースからの遺伝子セットを比較した。KEGG 2016は、有意に濃縮された代謝経路を同定するために使用された。Library of Integrated Network-based Cellular Signatures(LINCS)1000データベース(約1300のFDA承認薬)を、アップレギュレーションされたタンパク質の遺伝子発現を逆転させることができる薬剤を同定するために使用した。多重仮説検定の補正には、Benjamini-Hochberg偽発見率(FDR < 0.01)を用いた。
SOMAscanデータセット
定型的な経路を同定するために、Ingenuity Pathway Analysis (Qiagen) (44) を、フレアと寛解の間で少なくとも 2 倍の変化(例えば、log2 [フレア/寛解] の絶対値≧1)を示した SOMAscan で定量化されたタンパク質に対して実行した。参照データセットは、SOMAscanによって定量された1129個のタンパク質すべてから構成された。以前に発表された方法(4)に従って、観察された制御された遺伝子セットと予測された制御された遺伝子セットの重なりを測定するフィッシャーの厳密検定P値(-log [P値])を、各正則経路について生成した。
免疫組織化学
ホルマリン固定パラフィン包埋組織切片の免疫組織化学(IHC)は、標準的なプロトコルに従ってフィラデルフィア小児病院の病理コアで行われた。簡単に言えば、iMCD-1,iMCD-2,およびiMCD-3,自己免疫性リンパ増殖性症候群の患者5人、および反応性リンパ節を切除した6人の患者について、5μmの厚さでスライドを作成した。エピトープ検索は、E1検索液(ライカバイオシステムズ社)を用いて20分間行った。IHCは、ライカボンドマックス自動染色装置(ライカバイオシステムズ社製)で、ボンドインテンスR染色キット(ライカバイオシステムズ社製DS9263)を用いて行った。抗ホスホ-S6リボソームタンパク質(Ser235/236)(D57.2.2.2E、Cell Signaling Technology、カタログ4851S)を1:125希釈、室温で1時間の延長インキュベーション時間で使用した。アビジンビオチンブロッキングを添加し(Vector Labs SP-2001)ペプチドブロッキングステップを添加した(DAKO X0909)。スライドを、Aperio ScanScope CS-Oスライドスキャナ(Leica Biosystems)上で×20倍の倍率でデジタルスキャンし、Aperio ImageScopeおよびImage Analysis Toolkitソフトウェア(カラーデコンボリューションv9アルゴリズム)を用いてオフラインで解析した。生殖中心染色強度の定量化および毛包間染色強度の定量化は、弱、中、または強と同様に陽性に染色されたピクセルの割合として行った。ヘマトキシリンおよびエオジン(H&E)染色は、病理臨床サービスセンターの解剖病理部門の標準プロトコルを用いて実施した。
統計
使用した統計検定および各図パネルの有意性(P値)に関する詳細な情報は、それぞれの図の凡例に記載されている。実験前の仮説が、ある特定のグループが他のグループに比べて増加したという実験前の仮説である2つのグループ間のフローサイトメトリーデータの比較については、1-tailed Student’s t 検定を実施した。被験者と対照群間のIHC染色面積の比率の比較の統計分析は、異なる染色面積の比率が1に加算され、互いに依存しているため、組成分析を用いて行った。比率データは、セントロメトリック対数比変換を用いて変換した。1-tailedノンパラメトリックMann-Whitney U検定を用いて、症例群と対照群の間で比較した。0.05未満のP値は有意であると考えられた。すべてのIHC組成分析コードは、Rバージョン3.4.4で記述した。プロテオミクスデータは、Rバージョン3.4.4.4を用いて変換し、グラフ化した。フローサイトメトリーデータの解析は、FlowJoとGraphPad Prismを用いて行った。残りの統計解析は、Microsoft Excelを使用して実施した。
研究の承認。
すべての研究は、アーカンソー大学医療科学部の機関審査委員会またはペンシルバニア大学の機関審査委員会によって承認された。患者は、研究に参加する前に書面によるインフォームドコンセントを得ている。
