Contents
Human ApoE Isoforms Differentially Modulate Brain Glucose and Ketone Body Metabolism: Implications for Alzheimer’s Disease Risk Reduction and Early Intervention
www.ncbi.nlm.nih.gov/pmc/articles/PMC6067075/
要旨
ヒトはアポリポ蛋白E(ApoE2,ApoE3,ApoE4)の3つの遺伝的アイソフォームを有しており、これらのアイソフォームがアルツハイマー病の発症リスクを左右することが知られているが、そのメカニズムは十分に理解されていない。
本研究では、ヒトApoEアイソフォームが脳のエネルギー代謝に与える影響を調べた。TaqManカスタムアレイを用いて、ヒトApoE遺伝子標的置換マウスを用いて、アセチル-CoAの生成につながる経路に焦点を当てて、グルコースとケトン体の輸送と代謝に関与する合計43の遺伝子の発現を調べた。
その結果、ApoE2を発現する脳は最も強固なプロファイルを示したのに対し、ApoE4を発現する脳は脳の主要な燃料であるグルコースの取り込みと代謝において最も欠損したプロファイルを示した。具体的には、3つのApoE脳は、グルコースの神経細胞への進入を仲介するグルコーストランスポーターと、グルコース代謝の「ゲートウェイ酵素」として働くヘキソキナーゼに大きな違いがあった。
興味深いことに、脳の二次エネルギー源であるケトン体の取り込みと代謝に関しては、ApoE2とApoE4の脳は同程度の頑健性を示したが、ApoE3の脳は比較的欠損したプロファイルを示した。さらに、創意工夫経路解析により、PPAR-γ/PGC-1αシグナル伝達経路がApoE2脳では活性化され、ApoE4脳では抑制され得ることが示された。特に、PGC-1αの過剰発現は、ApoE4誘発の解糖およびミトコンドリア呼吸の障害を改善した。以上の結果から、ヒトApoEアイソフォームが脳の生体エネルギー代謝を異なる方法で調節していることが明らかとなり、これがアルツハイマー病のリスクに個別に影響を与える可能性があることが示唆された。
我々は、3 種類の ApoE 遺伝子型によって異なる制御を受けるグルコース代謝の鍵となる細胞質ポイントとして、ヘキソキナーゼを明らかにした。その結果、ヘキソキナーゼの発現や活性の違いが、脳のグルコース利用に影響を与え、さらにはアルツハイマー病の発症にも影響を与えている可能性が示唆された。したがって、グルコース代謝中間体、例えばピルビン酸を提供することによって、グルコースの細胞質代謝の欠乏を回避することができる治療アプローチは、アルツハイマー病のリスクが高いApoE4キャリアにとって有益である可能性がある。生体エネルギーの頑健性はシナプス活性の向上につながり、最終的にはアルツハイマー病発症のリスクを軽減し、臨床症状の発症を遅らせることが期待される。
序論
アルツハイマー病は現在、世界で3,500万人が罹患しており、その中には540万人のアメリカ人が含まれている。この数は2050年までに3倍近くに増加し、1380万人になると予測されている(アルツハイマー病協会 2016)。過去20年間に行われた広範な研究努力にもかかわらず、アルツハイマー病の原因は依然としてつかみどころのないものであり、現在のところ効果的な治療法はない。アルツハイマー病症例の増加は、アルツハイマー病治療薬開発の継続的な失敗とともに(Cummings et al 2014年)アルツハイマー病治療の分野での進歩のための緊急の必要性を強調している。そのためには、アルツハイマー病リスクを打ち消すメカニズムをよりよく理解することが、アルツハイマー病予防と早期介入を目的とした新たな戦略につながる可能性がある。
ヒトアポリポ蛋白E(ApoE)の遺伝的多型は、アルツハイマー病症例の大部分を占める晩期のアルツハイマー病に対する感受性に差があることが示されている(Farrer et al 1997)。3つの主要なアイソフォーム、ApoE2,ApoE3,およびApoE4は、19番染色体の長腕にある1つの遺伝子座における3つの対立遺伝子の産物である。最も一般的なアイソフォームであるApoE3は、人口の約75%の人に存在し、リスクニュートラルであると考えられている。ApoE2はまれで、人口の5%に存在し、アルツハイマー病に対する保護を示する。対照的に、ApoE4は人口の20%に存在するが、アルツハイマー病症例の65%近くを占めている(Kim et al 2009; Liu et al 2013)。臨床的には、ApoE4キャリアは、加齢とアルツハイマー病に関連した認知機能の低下の加速した割合を示する(Craft er al)。 分子レベルでは、ApoE4は、アルツハイマー病神経病理の悪化、神経炎症の亢進、脂質代謝の低下、ミトコンドリア機能不全、およびシナプス可塑性の障害と関連している(Nagy et al 1995年;Chang et al 2005;Rapp et al 2006;Klein et al 2010;Rodriguez et al 2014)。
これまでの研究は、主にApoE4によって付与されるアルツハイマー病リスクメカニズムの特定に焦点を当てており、アルツハイマー病との関係でのApoE2の役割を探求した研究は比較的少数であった。ApoE2は、アルツハイマー病の進行を遅らせ、加齢期の認知機能と正の相関があることが明らかにされている(Nagy et al 1995年;Craft et al 1998年;Martins et al 2005;Shinohara et al 2016)。前臨床研究の結果は、臨床所見と一致している。ApoE2の強制発現は、ApoE4によって誘導されるシナプス完全性の進行性の損失を減衰させた(Klein et al 2010)。ApoE2の遺伝子導入は、ADマウスモデルにおいて脳アミロイド病理を著しく減少させた(Zhao et al 2016)。最近、我々の研究室からの非バイアスプロテオミクス研究は、ApoE2脳がシナプス伝達のための最も強固な調節機構を持っていることを明らかにした(Woody et al 2016)。これらの研究をまとめると、ApoE2脳は神経保護メカニズムにさらされていることが示唆されている;その解明は、新しいアルツハイマー病予防とリスク低減戦略につながる可能性がある。
それは、アルツハイマー病に対する保護がアルツハイマー病発症に大きく先行することが提案されている。実際、アルツハイマー病の前臨床発症は、その臨床症状が現れる前に10-20年続く可能性がある。一般的に前臨床のアルツハイマー病脳で起こる主な変化の一つは、脳のエネルギー代謝の乱れである。ApoE4を運ぶものを含むアルツハイマー病のリスクで認知的に正常な個人は、グルコースの減少した脳代謝を示した(Reiman et al 2004,2005)。ケトン体誘発剤を用いた治療は、ApoE3キャリアの認知機能を改善したが、ApoE4キャリアの認知機能は改善しなかった(Reger et al 2004; Henderson et al 2009)ことから、ApoEの遺伝的状態が脳のケトン体利用に影響を与えることが示唆された。さらに、経路に焦点を当てた遺伝子プロファイリング研究により、ApoE2を発現するマウス脳は、インスリン様成長因子1シグナル伝達およびグルコース輸送において最も頑健なプロファイルを示したことが明らかになった(Keeney et al 2015)。これらの知見から、ヒトのApoE遺伝子の状態が脳のエネルギー代謝に影響を与えていることが示唆されているが、その基礎となるメカニズムは不明である。本研究では、ヒト化ApoEマウスおよび細胞モデルを用いて、脳の一次および二次エネルギー源であるグルコースおよびケトン体の輸送および代謝に関与する経路を調べた。
材料と方法
原文参照
結果
原文参照
議論
ヒトの ApoE アイソフォームは、アルツハイマー病 症例全体の 95%を占める晩発型 アルツハイマー病 において、差 異的なリスクをもたらすことが示されている。これまでの研究では、主にアルツハイマー病発症におけるApoE4の役割に焦点が当てられており、アルツハイマー病との関連でApoE2の役割を探求した研究はほとんどない;しかしながら、これらの研究の結果は全体的にApoE2が神経保護作用を持つことを示唆している(Wu and Zhao, 2016)。しかし、ApoE2が神経保護を与える根本的なメカニズムは、まだほとんど解明されていない。本研究の結果は、ヒトApoEアイソフォームが、グルコースとケトン体を含むエネルギー基質の脳内取り込みと細胞質代謝を異なる方法で調節していることを示している(図8)。我々のデータは、ApoE2に関連する神経保護効果とApoE4に関連する有害な効果のための1つの潜在的なメカニズムの理論的根拠を提供する。
図8 我々の作業仮説と結論
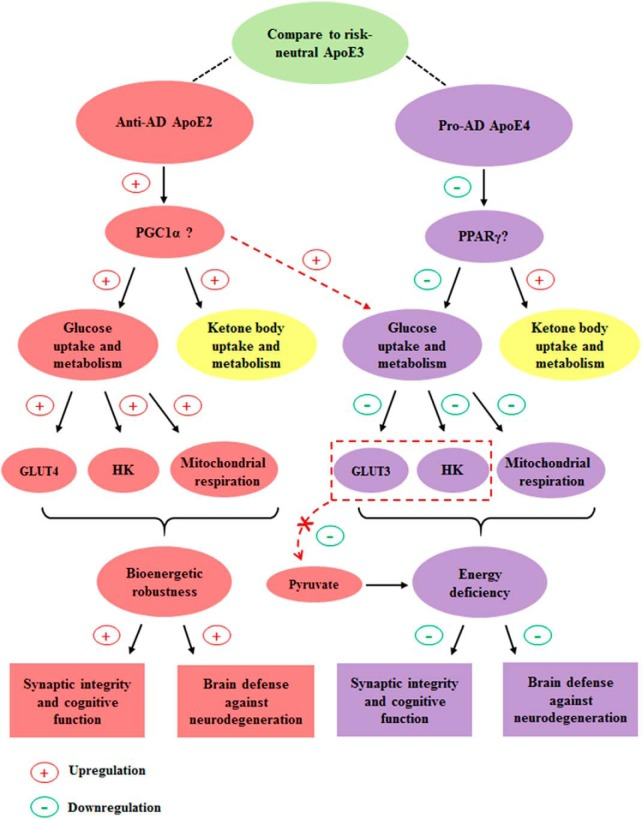
ApoE2脳は最も代謝的に頑健なプロファイルを示すのに対し、ApoE4脳は脳の主要なエネルギー源であるグルコースの取り込みと代謝が最も不足しているプロファイルを示す。特に、これら2つのApoE遺伝子型は、GLUTとヘキソキナーゼの発現に有意な差がある。脳の二次燃料であるケトン体の取り込みと代謝に関しては、ApoE2とApoE4の両脳は、ApoE3の脳よりも頑健なプロファイルを示した。
PGC-1αはApoE2の生体エネルギーの頑健性の上流マスターレギュレーターとして機能している可能性があり、PPARγシグナル伝達経路の阻害はApoE4のエネルギー不足の原因となっている可能性がある。その結果、PGC-1αを過剰に発現させることで、ApoE4による生体エネルギーの低下を抑制することができた。
グルコース代謝中間体、例えば、ピルビン酸を提供することによって、グルコースの取り込みと解糖の欠乏をバイパスすることができる治療アプローチは、ApoE4キャリアにおけるアルツハイマー病リスクを低減するための約束を保持する可能性がある;しかし、ケト原性戦略は、ApoE4キャリアよりもApoE3でより意味のある利益を提供する可能性がある。
正常な生理学的条件の下では、グルコースは、脳内のエネルギー生産のための唯一の基質である。ニューロンは高いエネルギー要求量を持っているので、その機能性はグルコースの利用可能性と利用に大きく依存する(Mosconi, 2013)。
細胞へのグルコースの利用可能性は、促進型グルコーストランスポーター(GLUT)によって支配されている。ここでは、hApoE-TRマウスの脳内の主要なGLUTのmRNAレベルを調べたところ、3つのApoE遺伝子型間でGLUT1の発現に有意な差は認められなかった。しかし、GLUT1のmRNAまたはタンパク質発現を変化させることなく、血液脳関門を越えたグルコース輸送の有意な減少がhApoE4-TRマウスで報告されており、GLUT1の機能には翻訳後修飾が関与している可能性が示唆されている(Alata et al 2015)。
GLUT1とは対照的に、ApoE3脳よりもApoE4脳の方がGLUT3のmRNAレベルが有意に低いことがわかった。GLUT3は、神経細胞集団において優勢なアイソフォームであり(Nagamatsu et al 1992)GLUT3のタンパク質発現は、アルツハイマー病に脆弱な脳領域における脳内グルコース代謝の低下と並行して低下することが示されている(Simpson et al 1994)。したがって、GLUT3発現の低下は、ApoE4脳におけるエネルギー供給の不足と神経細胞機能の摂動につながる可能性がある。さらに、GLUT4のmRNAレベルは、ApoE4脳と比較してApoE2脳で有意に高かったが、これは、我々の以前の知見と一致している(Keeney et al 2015)。ApoEアイソフォームがGLUTs活性に与える影響を決定するためには、さらなる詳細な研究が必要である。
グルコース代謝には、細胞質での解糖、トリカルボン酸サイクル、ミトコンドリアでの酸化的リン酸化が含まれる。この解糖、特にヘキソキナーゼについては、3つのApoE遺伝子型が大きく異なることがわかった。具体的には、ApoE2遺伝子型とApoE4遺伝子型が最も強固な解糖機能と欠損に関連しており、これはヘキソキナーゼ発現への個別の影響に起因していると考えられた。解糖によって生成されたATPは、脳内で使用される総エネルギーのわずかな割合を占めているという事実にもかかわらず、新たな証拠は、解糖がシナプス機能を維持する上で重要な役割を果たしていることを示唆している。
いくつかの解糖酵素は、それらがシナプス小胞への神経伝達物質の濃度を媒介するプロトンポンプであるV型H+-ATPase(V-ATPase)のサブユニットと相互作用する神経末端で発見されており、したがって、シナプス伝達のために重要である(Lu et al 2004)。Chan et al 2016)は、グルコース不足の細胞にグルコースを添加した後、解糖フローがV-ATPaseの再構成を制御していることを報告した。以前、我々は、ApoE2脳が、ApoE3およびApoE4脳の両方と比較して、V-ATPaseのβサブユニット(Atp6v1B2)の有意に高いレベルを発現していることを実証した(Woody et al 2016)。ここで、我々は、ApoE2脳もまた、V-ATPaseのためのATPおよびプロトンの直接の供給源を提供する解糖のための最も頑健な代謝プロファイルを有することを示す。したがって、我々のデータは、ApoEアイソフォームが介在する脳内グルコース代謝の差動調節が、V-ATPaseのようなエネルギー利用に大きく依存する活動を持つシナプスタンパク質を介した神経伝達に大きな影響を与える可能性を示唆している。このような生体エネルギーの頑健性は、ApoE2に関連した認知促進作用や抗アルツハイマー病作用の根底にある重要なメカニズムである可能性がある。
また、グルコースとは別に、エネルギー的に困難な状況下での脳の主な代替燃料であるケトン体の代謝に対するヒトApoEアイソフォームの影響も調べた。臨床研究では、ケトン体誘発剤による治療がアルツハイマー病患者の認知パフォーマンスを改善したことが示されているが、治療上の利点はApoE4非キャリアに限定されているように思われた(Reger et al 2004;Costantini et al 2008;Henderson et al 2009)。このことは、ApoE4脳はケトン体の輸送および/またはケトン体を代謝する主要な酵素が欠乏している可能性を示唆している。興味深いことに、我々の遺伝子アレイデータは、ApoE3脳と比較して、ApoE2とApoE4脳の両方でケトン体の取り込みと代謝のためのより強固な代謝プロファイルを示しており、ApoE2とApoE4脳はケトン体の利用のためにより優れた装備を備えていることを示唆している。この考えを支持するために、ApoE2およびApoE4を発現する細胞は、ApoE3を発現する細胞よりも効率的にケトン体を代謝した。これらの研究からの結果は、ケトーシスはApoE4キャリアよりもApoE3キャリアに利益をもたらすという臨床観察のための代替説明を提供する。
アルツハイマー病のコンテキストでは、ApoE4脳はグルコースの低代謝に関連付けられているので、堅牢なケトン体の代謝は、生体エネルギーの損失を補うための適応応答として機能する可能性がある。我々は、ApoE4脳が代償応答の結果としてケトン体利用の上限を持っているのではないかと推測している。その結果、ApoE4脳はエネルギー生産のために外因的に供給されたケトン体をさらに代謝することができず、認知能力の向上を誘導することはできない。しかし、ケトン体の代謝における頑健な能力は、ApoE2に関連する無傷の認知へのもう一つの重要な貢献であるかもしれない。
脳のエネルギー代謝におけるApoEアイソフォーム特異的な調節のメカニズムは明らかではないが、転写補因子PGC-1αが重要な役割を果たしている可能性がある。PGC-1αのダウンレギュレーションは、いくつかの代謝経路、特に酸化的リン酸化とミトコンドリア電子輸送鎖における広範な変化と関連している(Cui et al 2006; Taherzadeh-Fard et al 2009)。さらに、PGC-1αヌルマウスの脳の遺伝子発現解析により、神経細胞機能に関連する遺伝子の有意なダウンレギュレーションが明らかになった(Lin et al 2004; Ma et al 2010)。これらの結果から、PGC-1αがミトコンドリアの酸化代謝やエネルギーの恒常性を制御し、神経細胞の機能を維持する上で重要な役割を果たしていることが示唆された。本研究では、ApoE2脳ではApoE3脳に比べてPGC-1αのmRNAレベルが有意に高いことを見いだした。一方、PGC-1αの発現はApoE4脳で最も低かった。タンパク質発現の低下に加えて、PGC-1αの活性も低下している可能性がある。Theendakara et al 2013)は、ApoE4の強制発現により、PGC-1αのNAD+依存的脱アセチル化を媒介する酵素であるサーチュイン1(Sirt1)のmRNAおよびタンパク質レベルが低下し、その転写活性が増強されることを報告した(Cantó and Auwerx, 2009)。
したがって、Sirt1の発現低下はPGC-1α活性化の低下をもたらし、それがApoE4に関連する生体エネルギー障害の根底にあるかもしれない。実際、PGC-1αの過剰発現は、ApoE4によって誘発された解糖およびミトコンドリア呼吸の障害を減衰させた。これまでのところ、ApoE2遺伝子型におけるSirt1の発現と転写制御についての報告はない。しかし、ApoE2は同様のメカニズムでPGC-1αの活性を調節している可能性がある。PGC-1αはミトコンドリアの酸化代謝のマスターレギュレーターであることを考えると、PGC-1αの高発現と活性は、ApoE2に関連した生体エネルギーの頑健性に大きく寄与している可能性がある。さらに、糖代謝におけるApoEアイソフォーム依存性の役割に関与する他の上流調節因子や関連するシグナル伝達経路を同定するために、さらなる研究が必要である。
我々の結果はまた、ApoE4キャリアにおけるピルビン酸補給の潜在的な有益性を示唆している。Suh et al 2005)は、ポリ(ADP-リボース)ポリメラーゼ-1(PARP-1)の過剰活性化により、細胞質のNAD+が枯渇し、その後、解糖が阻害され、持続的なエネルギー不全と最終的に細胞死に至ることを報告している。ミトコンドリア代謝の直接基質として、ピルビン酸は、細胞質NAD+の非存在下で酸化され得る;したがって、ピルビン酸は、PARP-1によって課される制限を迂回して、エネルギー不足を回復することができる(Zilberter et al 2015)。この概念と一致するように、ピルビン酸の投与は、インスリン誘発性低血糖症にさらされたラットの脳における神経細胞の生存を有意に改善した(Suh et al 2005)。したがって、ピルビン酸は、グルコース取り込みと解糖の障害による神経細胞のグルコース利用の持続的な障害を回避することで、ApoE4脳にとってより効率的なエネルギー源となる可能性がある(図8)。老化やアルツハイマー病脳、特にApoE4遺伝子型を持つ脳におけるピルビン酸の治療効果を検討するためには、より多くの研究が必要である。
我々は、この研究は技術的な強みと限界の両方を提示したことを指摘する必要がある。一つの主要な懸念事項は、mitotic後のニューロンと比較して代謝表現型を変更した可能性がある神経芽腫細胞株の利用であった。この懸念に対処するために、我々は、より生理学的に関連性の高い神経細胞モデルである分化したN2a細胞を用いて、ヘキソキナーゼと解糖に対するApoEアイソフォームの効果を調べ、確認した。N2a細胞を使用する利点は、トランスフェクトされた細胞が同等のヒトApoEを発現していることであり、これにより3つのApoEアイソフォームを並行して比較することが可能となり、hApoE-TRマウスで報告されているようなApoE発現レベルの違いに起因する複合的な複雑さを排除することができた(Riddell et al 2008; Sullivan et al 2011)。以上のことから、
(a)ヒトApoEアイソフォームが脳の生体エネルギー代謝を異なる方法で調節していること、
(b)3つのアイソフォームを発現する脳におけるApoEタンパク質レベルの違いよりも、ApoEアイソフォームの異なる機能特性がこのような調節を引き起こしていること、
が相補的かつ一貫した証拠となった。最も重要なことは、3つのApoEアイソフォームが異なる影響を与える重要な細胞質ポイントとしてヘキソキナーゼをピンポイントで特定したことであり、これは脳のグルコース利用に異なる影響を与えることに貢献している可能性がある。ApoE2を発現する脳で示された解糖堅牢性は、シナプス活動の強化、そして最終的にはこの遺伝子型に関連した認知を好んだり、抗アルツハイマー病特性を臨床的に証明することにつながる可能性がある。
