2021年3月26日
Maura Boldrini 医学博士1,2; Peter D. Canoll 医学博士3; Robyn S. Klein 医学博士4,5,6
著者所属 論文情報
はじめに
COVID-19は、現在までに1億2000万人以上の症例と260万人の死亡者を出している。呼吸器症状と消化器症状は、短期および長期の神経精神症状(NP)と長期の脳の後遺症を伴う。
患者の中には、無嗅覚、認知・注意障害(ブレイン・フォグ)新たに発症した不安、抑うつ、精神病、発作、さらには自殺行動などを呈する者もいる1,2。これらは呼吸器症状の前、中、後に現れ、呼吸不全とは無関係であることから 1,独立した脳障害が示唆される。ドイツとイギリスで行われた追跡調査では、COVID-19後の神経精神症状が、若年成人であっても20%から70%の患者に見られ、呼吸器症状が消失してから数カ月後に持続していたことから、脳への影響が持続していることが示唆されている1。
SARS-CoV-2は、アンジオテンシン変換酵素2受容体を介して侵入し、2 内皮細胞を損傷して、炎症、血栓、脳障害を引き起こす。さらに、全身の炎症によってモノアミンや栄養因子が減少し、ミクログリアが活性化されることで、グルタミン酸やN-メチル-D-アスパラギン酸(NMDA)3が増加し、興奮毒性が生じる(図参照)。これらの傷害は、既存の神経精神症状の新たな発症または再増悪を誘発する。
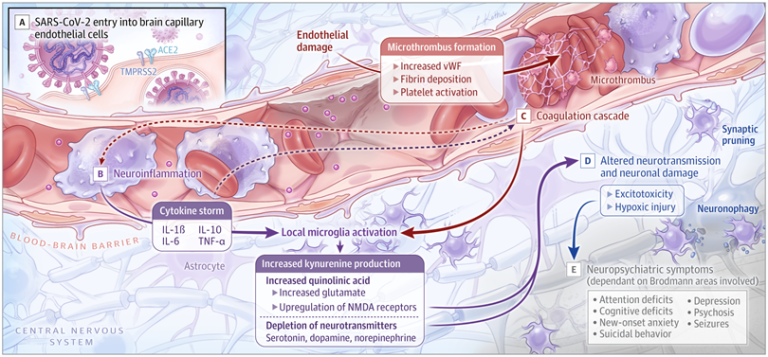
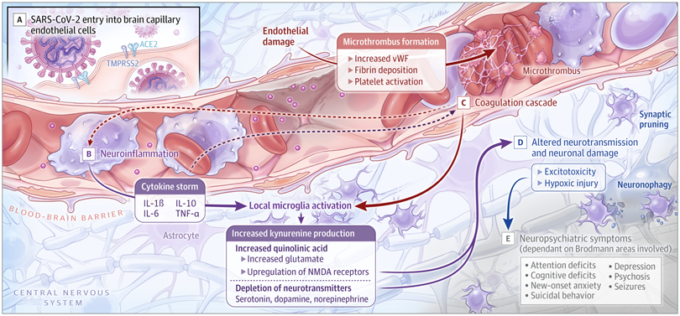
図. 脳血管障害、神経伝達系の機能障害、血栓イベント、神経細胞の損傷、および精神神経症状
脳血管障害、神経伝達系機能障害、血栓イベント、神経細胞損傷、および精神神経症状
A, SARS-CoV-2は、膜貫通型アンジオテンシン変換酵素2(ACE2)受容体を介して、膜貫通型プロテアーゼ、セリン2(TMPRSS2)の働きで内皮細胞に侵入する。B, サイトカインの上昇とミクログリアの活性化により、キヌレニン、キノリン酸、グルタミン酸が増加し、神経伝達物質が枯渇する。C, 凝固カスケードとvon Willebrand factor (vWF)の上昇により、血栓現象が起こる。D. 神経伝達の変化、グルタミン酸の増加による興奮毒性、低酸素傷害により、神経細胞の機能障害と喪失が起こる。E, 精神神経症状は、関与するブロドマン領域によって異なる。ILはインターロイキン、NMDAはN-メチル-d-アスパラギン酸、TNFは腫瘍壊死因子を示す。
ウイルスは脳に侵入するのか?
SARS-CoV-2は、嗅覚粘膜に侵入し、嗅覚障害を引き起こすことが知られている。また、篩板(しばん)から嗅覚路に沿って移動するか2,迷走神経経路や三叉神経経路を通って脳に侵入する可能性もあるが、その決定的な証拠はない。SARS-CoV-2は、炎症性サイトカインがBBBの不安定性を引き起こすことから、血液脳関門(BBB)を通過するか、単球を介して侵入する可能性がある4。また、BBBに発現する接合タンパク質を欠く柵状の毛細血管を介して血液や脳脊髄液の内容をモニタリングする、第三脳室および第四脳室周辺の正中線構造である脳室周囲器官(CVO)を介して脳組織に到達する可能性もある。ウイルスのRNAは、毒素に対する嘔吐反応を制御するCVOである後頭葉に隣接する延髄および小脳2で、逆転写定量リアルタイムポリメラーゼ連鎖反応により検出されたが、in situ hybridizationでは検出されなかった。SARS-CoV-2のタンパク質は、脳の血管内皮に検出されているが、神経細胞やグリアには検出されていない2。したがって、検出されたウイルスRNAは、レプトメニングやヴィルヒョウ・ロービン空間の血管系による汚染であると考えられる。ヒトの全脳の病理組織学的分析では、脳幹にミクログリアの小結節と神経細胞の貪食(神経細胞貪食)が見られ、大脳皮質や辺縁系構造では頻度が低く、まばらなリンパ球浸潤を伴ってたが、同じ脳内での病理組織学的所見とウイルスメッセンジャーRNAのレベルには相関性がなかった5。老化現象、吐き気、嘔吐はCVOや脳幹へのウイルス侵入に関連している可能性があるが、その他の短期的および長期的な神経精神症状は、神経炎症や低酸素傷害に起因する可能性が高いと考えられる。脳幹の侵襲は、持続的な自律神経の異常や不安を説明できるかもしれない。
サイトカインとミクログリアの活性化が神経毒性を引き起こす
重度のCOVID-19感染症患者は、インターロイキン(IL)1,IL-6,IL-10,腫瘍壊死因子(TNF)-αなどの炎症性サイトカインの血清レベルが上昇し、重度のサイトカイン・ストームを起こすことが報告されている。TNF-αは、輸送(サイトカインによる損傷によってBBBの伝染性が高まる)4やCVOによって直接BBBを通過することができる。活性化されたミクログリアは、損傷した細胞を貪食するだけでなく、グルタミン酸、キノリン酸、IL、補体タンパク質、TNF-αなどの炎症性メディエーターを分泌する。興奮毒性と神経細胞の喪失により、領域および神経伝達物質に特異的な神経精神症状が生じる。
炎症と神経精神症状s
炎症の増加は、トリプトファンをセロトニンではなくキヌレニンに代謝するインドールアミンジオキシゲナーゼという酵素を活性化する3。インターフェロンアルファで治療を受けた患者では、神経伝達物質の放出が減少し、ポジトロン断層撮影によるフルオロドーパ18Fの取り込みが増加し、尾状体と後頭葉の回転率が低下したことが示された。同様に、インターフェロンやILベースの免疫療法は、うつ病を誘発する可能性がある。炎症は、モノアミン神経伝達の鈍化、快感消失、否定的な認知・精神運動・神経植物学的症状、うつ病、自殺行動を引き起こし、従来の抗うつ剤にはほとんど反応しない。3 大うつ病性障害を持つ自殺未遂者では、血漿キヌレニンの上昇、血液、脳脊髄液、脳内のIL-1およびIL-6の高濃度、脳内グルタミン酸濃度と相関する血清CRPの上昇が認められた。TNF-αとIL-6のレベルは、精神病のリスクがある人の陰性症状や抑うつ症状を予測する可能性があり、IL-6が高いと海馬の体積が小さくなることと相関している。IL-1βシグナルの上昇は、海馬の神経新生を減少させ、アポトーシスを増加させる。大うつ病の自殺者では、死後の海馬で炎症マーカーの増加と神経新生の低下が見られ8,歯状回の縮小、顆粒ニューロンの減少、神経前駆細胞の減少が見られた9。
炎症と血液凝固の相互作用
ウイルスが脳血管の内皮細胞に侵入すると、好中球、マクロファージ、トロンビン産生、補体経路が活性化され、微小血栓の沈着が促進される2。COVID-19の脳損傷では、剖検時にマクロおよびミクロの低酸素性・虚血性損傷と梗塞が認められる5。したがって、COVID-19の神経精神症状は微小な脳卒中や神経細胞の損傷に起因している可能性があり、その症状は関係する脳領域によって異なることになる。COVID-19の脳損傷のメカニズムは、外傷性脳損傷のメカニズムと類似している可能性がある。外傷性脳損傷では、炎症の促進状態と神経細胞の損失をもたらす微小血管の損傷の組み合わせが、自殺行動の病因に関係しているとされている10。逆に、臨床結果の成功は、Toll受容体が関与する初期免疫反応と、非プライミングまたは低プライミングの遅発性炎症の鈍化によってもたらされるだろう。
COVID-19による脳障害の細胞的・分子的側面を理解することで、長期的な神経精神症状を減らすための介入が可能になる。介入には、以下が含まれる可能性がある3。
- サイトカインの拮抗薬(エタネルセプト、インフリキシマブ)
- NMDA受容体(ケタミン)
- TNF-αおよび抗炎症経路(アスピリン、セレコキシブ)
- キヌレニン経路調節薬(ミノサイクリン)
COVID-19後の長期的な認知、感情、行動の後遺症を軽減することは、疾患の負担を減らすことにつながる。COVID-19の神経病理は、他の脳疾患における神経炎症に関連した神経変性プロセスを解読し、新しい治療戦略を開発するためのモデルとなるかもしれない。