Contents
Host-Directed Antiviral Therapy
cmr.asm.org/content/33/3/e00168-19.long
要旨
抗ウイルス薬は伝統的に必須のウイルス成分を直接標的にして開発されてきた。しかし、この戦略は、薬剤耐性ウイルスの急速な大量発生により、しばしば失敗に終わる。最近では、siRNA(siRNA)やCRISPR(clustered regular interspaced short palin-dromic repeats)を用いたゲノムワイドなアプローチや、細胞内の「キノーム」を標的とした低分子化学的阻害剤を用いたアプローチが、ウイルスの複製をサポートする細胞因子の同定に成功している。
これらの細胞因子の中には、ウイルスの複製には重要であるが、宿主には不要なものもあるため、抗ウイルス薬開発のための新規なターゲットとなる可能性がある。さらに、免疫応答の増強、サイトカインストームの調節、およびウイルス感染時のエピジェネティック変化の調節もまた、感染を制御するための実行可能なアプローチである。
ウイルスは、欠落した細胞機能を置換するために突然変異を起こす可能性が低いため、宿主を標的とした阻害剤アプローチを用いて薬剤耐性変異体を生成する可能性は最小限に抑えられている。しかしながら、ある種の宿主指向性薬剤に対する薬剤耐性は、実際には、ある特定の状況下で発生し得る、例えば、ウイルスが代替の宿主因子を使用するために適応する機会を可能にする、または耐性をもたらす標的に対する親和性を変化させることができる宿主指向性抗ウイルス剤の長期的な選択圧力のような状況下で発生し得る。
このレビューでは、宿主誘導型抗ウイルス剤に焦点を当てた抗ウイルス剤開発のための新しいアプローチと、宿主誘導型抗ウイルス剤に対する抗ウイルス剤耐性の獲得の可能性のあるメカニズムについて述べている。
キーワード
抗ウイルス剤、宿主因子、薬剤耐性、エピジェネティック制御、精密医療
序論
国際ウイルス分類学委員会(ICTV; 2019)の最近の報告書には、14の目、143科、および846属にまたがる4,958種のウイルスがリストアップされている(1)。
最近の技術の進歩により、ほぼ毎日のように新しいウイルスおよび/またはその遺伝的/抗原性変異体が発見されている。現在、世界では新型コロナウイルス疾患(COVID-19)が発生しているが(2-5)幸いなことに、ほとんどの新しいウイルスは臨床疾患とは関連していない。人類の歴史の中で、いくつかの新しいウイルスが大パンデミックの原因となっていた(6-15)が、今日の高度に相互接続された世界は、私たちを過去よりもさらに脆弱にしている。あらゆるウイルス感染を制御するための最も成功したアプローチはワクチンによるものであるが、この戦略は様々な理由から多くの病原体には効果的ではない。ウイルス感染症と闘うためのより効果的な一般的なアプローチは、効果的な抗ウイルス剤を開発することである(16)。このアプローチは、ヘルペスウイルス感染症を制御するために最初に使用され、現在、ヒト免疫不全ウイルス1型(HIV-1)感染症を制御するための主要な手段である(17)。最近では、C型肝炎ウイルス(HCV)を制御するために非常に有効な抗ウイルス剤も開発されており(18-20)世界はCOVID-19に対して活性な抗ウイルス剤を歓迎するであろう。
食品医薬品局(FDA)によって承認されている抗ウイルス薬の大部分は、ウイルスエンコード因子を直接標的にして作用する(21)。しかし、これらの薬剤は、薬剤耐性ウイルス変異体の出現により、ほとんど必ず効力を失う(22-27)。そのため、代替的な抗ウイルス薬の研究が必要とされている。このレビューでは、ウイルスが必要とする宿主因子を標的とするが、宿主細胞の機能には必須ではない抗ウイルス薬の開発について述べる。このような薬剤を宿主指向型抗ウイルス剤と呼ぶ。ゲノム全体のsmall interfering RNA(siRNA)および/またはclustered regular interspaced short palindromic repeats(CRISPR)スクリーンと、細胞の「キノーム」を標的とした低分子化学的阻害剤という2つの主要なアプローチにより、細胞の25,000個のタンパク質をコードする遺伝子のうち、相互作用して感染ウイルスの複製を制御するものが明らかになっている(28, 29)。これらの宿主因子の中には、宿主にとっては不要なものもあるが、そのライフサイクルの様々なステップを完了するためにウイルスによって必要とされるものもある(30-35)。これらの宿主因子は、抗ウイルス薬開発のターゲットとなり得る(図1)。宿主の遺伝的変動性はウイルスに比べて非常に低いため、宿主誘導型抗ウイルス剤はウイルスゲノムの変異によって効果がなくなる可能性が低い(36, 37)が、そのような抗ウイルス剤に対する耐性の例が報告されている(38, 39)。本レビューの主な目的は、宿主誘導型抗ウイルス剤に焦点を当てて、抗ウイルス剤開発の新しいアプローチについて議論することである。また、宿主指向型抗ウイルス剤に対する薬剤耐性の可能性のメカニズムについても議論する。
ホスト指向型抗ウイルス剤
ウイルスは複製中に宿主因子や経路と多数の相互作用を確立する。実際、技術の進歩により、ウイルスの複製には必須であるが、宿主にとっては不要な宿主因子がすでにいくつか同定されている(40-42)。さらに、インターフェロン(IFN)や適応免疫応答のような、ウイルス感染に応答するいくつかの宿主活動は、感染の結果を変更するために操作することができる。
図 1 抗ウイルス薬開発の新しい戦略
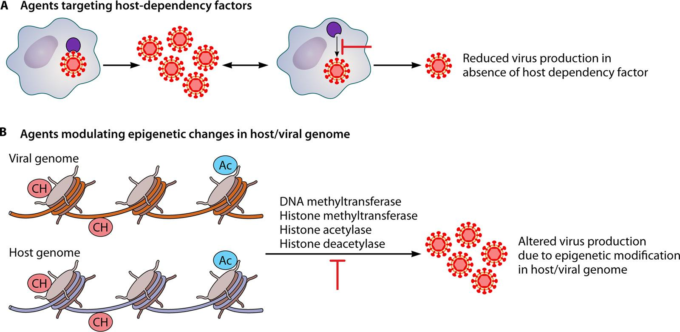
(A) 細胞内で効果的に複製するために、ウイルスは特定の細胞因子に強く依存しており、そのうちのいくつかは細胞には不要なものであるため、抗ウイルス薬開発のターゲットとなり得る。
B)DNAメチル化やヒストンアセチル化などのエピジェネティックな変化もウイルスの複製・転写・翻訳を制御することが示されており、これらのエピジェネティックな変化の原因となる酵素(DNAメチル化酵素、ヒストンメチル化酵素、ヒストンアセチル化酵素、ヒストン脱アセチル化酵素)を標的とした阻害剤が抗ウイルス薬開発の有力なターゲットとなる可能性がある。
過去20年の間に、宿主誘導療法は勢いを増してきた。そのような研究の多くは前臨床段階にあるが、FDAによって承認された化合物はごくわずかである。ここでは、FDA承認薬と前臨床開発中の治療薬を分けて説明する。
FDA承認の宿主媒介型抗ウイルス剤
これまでにFDAによって承認された抗ウイルス薬の大部分のうち、宿主因子を標的としたものはわずかである(表1)(21)。FDAが承認した宿主因子を標的とする抗ウイルス薬のほとんどはIFNに基づいており、HIV-1,ヒトパピローマウイルス(HPV)B型肝炎ウイルス(HBV)C型肝炎ウイルス(HCV)などの慢性感染症に対して開発されている(21)(表1)。IFNにはいくつかの異なるサブタイプがあるが、今のところ臨床的に使用されているのはアルファIFN(IFNs-a)のみである(43)。IFN治療の主なターゲットは、当初、非A型非B型慢性肝炎(現在ではC型肝炎として知られている)の治療であった(44)。その後、IFNはHBV(45)とHPV(46)の感染症の治療にも承認された。その後、IFN療法の持続的なウイルス学的奏効率の向上は、様々な技術的改良とリバビリンの導入によって達成された。この改変には、ポリエチレングリコールと共役してペギル化IFN(PegIFN)を形成することが含まれ、これは酵素分解を防ぎ、IFNの半減期を増加させ、また、副作用を減少させたが、排除したわけではない(47-49)。しかし、このアプローチは患者の無反応性(50)や干渉(抗IFN)抗体の産生(51)など多くの問題を抱えており、他のより安全な薬剤が開発されて以来、米国ではほとんど廃棄されていた。
表1 FDAが承認した宿主指示型抗ウイルス薬a
原文参照
aIFN、インターフェロン;HBV、B型肝炎ウイルス;HCV、C型肝炎ウイルス;HIV-1,ヒト免疫不全ウイルス1型;HPV、ヒトパピローマウイルス;PegIFN-a、ペギル化IFN-a。
現在、慢性HCV感染症の治療には、PegIFN-a-2bとリバビリンの併用療法が推奨されており、50%以上の患者で持続的なウイルスクリアランスが得られている(52)。しかし、HCVに対するIFN{aとリバビリンの正確な作用機序は十分に定義されていない。実際、HCV感染の動物モデルで観察されているように、ウイルス感染自体が非反応者におけるIFN{aの誘導および作用を抑制する可能性がある(53)。さらに、個々の宿主遺伝的因子、自然免疫応答および適応免疫応答、ウイルス遺伝的多様性、および共感染も治療不応の一部を説明する可能性がある(54)。Alfacon-1(組換え合成I型インターフェロン)とリバビリンは、標準的なPegIFN-a/リバビリン療法に反応しなかった一部の患者に有効であることが証明されている(44)。現在、新しい薬剤の組み合わせが開発中である。例えば、テラプレビル(HCV NS3/4プロテアーゼ阻害薬)とPegIFN-a/リバビリンの併用は、従来のPegIFN-a/リバビリン療法に反応しない慢性HCV患者の治療に有効である可能性がある(55)。PegIFN-aおよびリバビリンと併用する他のHCV NS3/4Aプロテアーゼ阻害薬もまた、持続的なウイルス学的奏効率の改善を達成する可能性がある(56-59)。しかし、それらをPegIFN-aおよびリバビリンと併用した場合の毒性は、依然として全体的な有効性を制限している(60,61)。
IFN製剤には、いくつかの追加の問題がある。これらには、疲労、インフルエンザ様症候群、神経障害、自己免疫、虚血、肺炎、貧血、好中球減少症、腎炎、紅斑、血管炎、および壊死が含まれ、これらはすべて使用を制限している(62-67)。さらに、IFN療法に抵抗性のウイルスも観察されている(68,69);これらのウイルスは、構造タンパク質または非構造タンパク質のいずれかの変異の獲得により出現した可能性がある(70,71)。
IFN療法の副作用を克服するためには、IFNを局所部位に標的化するか、またはプロドラッグ製剤を調製することが有効であり得る(72, 73)。このような観点から、肝臓組織に特異的な抗体を用いて肝臓を標的とするIFN-a-2が採用されている(74,75)。さらに、薬物動態を改善し、多関節作用を克服するために、IFN-a-2bは、HCV NS3プロテアーゼ切断部位をリンカーとして融合したトランスフォーミング成長因子b(TGF-b)の潜伏関連タンパク質の保護シェルを提供することによって潜伏状態にするように設計されている(67)。
宿主誘導型抗ウイルス薬もまた、HCV関連イボを治療するために承認されている。これに関連して、HCVおよびHBV感染症の治療にも承認されている薬剤であるイントロンA(IFN-a-2b)は、HPV関連性器イボに対する臨床的有効性を示している(76)。別の薬剤であるポドフィロックス(コンディロックス)は細胞分裂を強力に阻害し、最終的にHPV関連性イボの退縮をもたらす(77)。さらに、イミキモド(アルダラ)は、いくつかの免疫学的活性に作用することにより、プロファウンド抗腫瘍(抗イボ)活性を示す(78)。同様に、シネカテキン(Veregen)は、その作用機序はまだ知られていないが、外性器および肛門周囲イボの治療のために2006年にFDAによって承認された最初の植物性医薬品であった。IFN-a-N3の別の注射製剤は、主要組織適合性複合体クラスI(MHC-I)の発現をアップレギュレートし、ウイルス関連抗原の提示を強化し、それによってイボの退縮を助ける細胞傷害性CD8 T細胞を活性化する(79)。
臨床使用が認可されている唯一のCCR5アンタゴニストであるマラビロックは、C-Cケモカイン受容体5型(CCR5)の陰性アロステリックモジュレーターである。マラビロコは、HIV-1のgp120エンベロープ糖タンパク質がCCR5に結合できなくなるように、CCR5の細胞外ループを変化させることで、HIV-1の侵入を阻害する(80,81)。さらに、マラビロックはまた、試験管内試験でHIV-1の潜伏を逆転させる(82)。しかし、部分的なマラビロク耐性を有するHIV-1株が出現している(83-85)。この耐性株は、代替のコアセプター(CCR5ではなくCXCR4)を使用するか、またはマラビロコ結合型のCCR5と結合する能力を変化させている可能性がある(86-88)。
ウイルス複製に重要な宿主因子および経路の標的化
ウイルス感染は、細胞内シグナル伝達経路を活性化し、細胞増殖(37,89-92)細胞生存(37,93)および/または免疫活性化(93,94)を調節する。ウイルス感染の典型的な経過では、感染した細胞はIFNを分泌し、それは、抗ウイルス活性を含む機能を有する多くのいわゆるIFN刺激遺伝子(ISG)を発現するように近くの細胞を誘導する。ウイルスはまた、感染した細胞内のシグナル伝達経路を利用して、感染した細胞内で自分たちに有利になるように利用することもある(37, 93)。例えば、インフルエンザAウイルス(IAV)感染では、核内因子κB(NF-κB)シグナル伝達経路が活性化されることがある(95)。これは、ウイルスゲノムの最適な合成をもたらし、それはまた、プロ炎症性サイトカインの分泌をもたらし得る(95,96)。したがって、NF-κBのようなシグナル伝達経路は、ウイルス複製およびウイルス誘発性炎症性再スポンソンの両方を調節するために、治療法によって標的とされ得る。
細胞受容体やウイルス複製を制御する他の細胞タンパク質の遮断も治療の標的とされているが、これまでのところ臨床試験に至ったものはほとんどない(21)。大多数の研究では、キナーゼおよび脂質合成酵素が抗ウイルス薬開発の主要な宿主標的となっている(表2)。
キナーゼ阻害剤 2002年にヒトゲノムプロジェクトが完了したことにより、518個のキナーゼが同定され、それらは総称して細胞の「キノーム」として知られている(97)。キナーゼは、細胞の恒常性を維持するための様々な生理的プロセスに関与しており、それらの調節障害は病理学的な結果をもたらす可能性がある。ウイルス感染を含む病原体による感染もまた、「キノーム」の摂動と関連している(98, 99)。ウイルス複製サイクルの各ステップは、複数のキナーゼによって制御され得る(100-102)。細胞キナーゼの中には、宿主細胞の生存には不要なものもあるが、ウイルス感染中には必要とされるかもしれない(102)。このようなキナーゼは、潜在的に価値のある創薬標的となる可能性がある(図1A)。キナーゼの機能は、低分子の化学的阻害剤によって阻害することができ(103)このアプローチは癌の分野で使用されている。このトピックは、広範囲にレビューされている(104-120)。これまでに開発された数百種類のキナーゼ阻害剤のうち、抗がん剤としての使用が認可されたのは38種類のみである。キナーゼ阻害剤ライブラリーは抗ウイルス活性についてもスクリーニングされており、いくつかの有望な候補が、ウイルスのライフサイクルの異なるステップの阻害剤として浮上してきている(37, 38, 121-128)。
ウイルスの複製サイクルは、付着、侵入、ゲノム合成、新たに合成されたウイルス粒子の集合、および出芽を含む多段階のプロセスである。ウイルスのライフサイクルの各ステップには宿主細胞キナーゼが関与し(表2)単一のキナーゼがウイルスのライフサイクルの1つまたは複数のステップを制御している。例えば、マイトジェン活性化プロテインキナーゼ(MAPK)-相互作用キナーゼ1(MNK1)阻害剤CGP57380は、バッファロポックスウイルス(BPXV)のタンパク質合成の開始のみを阻害する(38)。対照的に、IAVに対しては、受容体チロシンキナーゼ(RTK)阻害剤AG879とA9は、ウイルスRNA合成、ウイルスリボ核タンパク(vRNP)の輸出、および出芽を含む複数のステップを阻害することができる(121)。RTKがウイルスRNA合成を制御する正確なメカニズムは知られていないが、vRNP輸出および出芽の制御は、CRM1(染色体維持1)核輸出経路およびファルネシルピロリン酸合成酵素(脂質生合成酵素)を介してそれぞれ媒介される(121)。ウイルスのライフサイクルの複数のステップを制御するシグナル伝達経路を標的とすることが、より効果的な抗ウイルスアプローチになると考えられる(121)。
特定のウイルスファミリーのすべてのメンバーは、通常、同じキナーゼ要件を共有する。例えば、SERCA(サルコ/小胞体カルシウム-ATPアーゼ)阻害剤は、複数のパラミクソウイルス科のメンバーの複製をブロックする(39)。それにもかかわらず、いくつかのキナーゼは、複数のウイルスファミリーに必須であり、それゆえに、広範な抗ウイルス薬を開発するための潜在的な標的となり得る(121,129)。そのような例として、RTK阻害剤AG879は、IAV、アカゲザルロタウイルス、センダイウイルス、コロナウイルス、単純ヘルペスウイルス1(HSV-1)およびピチンデウイルス(アレナウイルス)に対して活性である(121, 129)。
脂質生合成阻害剤。ヌクレオチドおよびアミノ酸の他に、多くのウイルスは、その複製サイクルの間、細胞内脂肪酸の継続的な供給を必要とする(130,131)。これを達成するために、ウイルスは自身の最適な複製を促進するために、脂質合成を含む細胞代謝を再プログラムする必要があるかもしれない(131,132)。脂肪酸の生合成を抑制する化学的阻害剤で細胞を治療すると、ウイルスの産生が減少する(121, 133-136)が、このアプローチはデングウイルス(デングウイルス)、ジカウイルス(ZIKV)、ウェストナイルウイルス(WNV)に対して有望であることが示されている(137)。
表2 前臨床開発中の宿主誘導型抗ウイルス剤
原文参照
略語
AAK1,アダプター関連プロテインキナーゼ1;AdV、アデノウイルス;AstV、アストロウイルス;BDV、ボルナ病ウイルス;BPXV、バッファロポックスウイルス;BHV1,ウシヘルペスウイルス1;BEFV、ウシエフェメラ熱ウイルス;CDK、サイクリン依存性キナーゼ;CVB3,コックスサッキエウイルスB3;cIAP2,アポトーシスタンパク質2の細胞阻害剤。CLK1,Cdc2様キナーゼ1;CMV、サイトメガロウイルス;CoV、コロナウイルス;DGAT1,ジアシルグリセロールアシルトランスフェラーゼ-1;デングウイルス、デングウイルス;DHODH、ジヒドロオロチン酸デヒドロゲナーゼ;EAV、馬動脈炎ウイルス;EBOV、エボラウイルス;EGFR、上皮成長因子受容体。EMCV、脳脊髄炎ウイルス;EV、エンテロウイルス;eIF4E、真核生物翻訳開始因子4E;ERK、細胞外制御キナーゼ;FLV、フラビウイルス;FAS、脂肪酸合成酵素;FMDV、口蹄疫ウイルス;GAK、サイクリンG関連キナーゼ;HBV、B型肝炎ウイルス。HCV、C型肝炎ウイルス;HIV-1,ヒト免疫不全ウイルス1型;HMG-CoA、3-ヒドロキシ-3-メチルグルタリル補酵素A;hnRNPA1,異種核リボ核タンパクA1;hRSV、ヒトルス肉腫ウイルス;hCMV、ヒトサイトメガロウイルス;hAdV、ヒトアデノウイルス。hRhV、ヒトライノウイルス;HSV-1,単純ヘルペスウイルス1;IAV、インフルエンザAウイルス;IBV、インフルエンザBウイルス;IMPDH、IMP脱水素酵素;JEV、日本脳炎ウイルス;JUNV、ジュニンウイルス;MHV、マウス肝炎ウイルス;MNK1,MAPK相互作用キナーゼ1;NDV、ニューカッスル病ウイルス。NGFR、神経成長因子受容体;NPC1L1,ニーマンピックC1様1;NF-κB、核内因子κB;OSBP、オキシステロール結合タンパク質;PDGFR、血小板由来成長因子受容体;PIV、パラインフルエンザウイルス;PEDV、豚伝染性下痢ウイルス。PI4KB、ホスファチジルイノシトール4-キナーゼIIIb;PKC、プロテインキナーゼC;PPRV、peste des petits ruminants virus;PRRSV、ブタ生殖呼吸器症候群ウイルス;PyV、ポリエーマウイルス;RACK1,活性化Cキナーゼ1受容体;RVFV、リフトバレー熱ウイルス;RSV、ルス肉腫ウイルス。RV、ロタウイルス;SERCA、サルコ/小胞体Ca2 -ATPase;SV、センダイウイルス;SINV、シンドビスウイルス;SirT1,サーチュインタイプ1;VSV、小水疱性口内炎ウイルス;VEEV、ベネズエラ馬脳炎ウイルス;WNV、ウエストナイルウイルス;XPO1,exportin 1;ZIKV、ジカウイルス。
アセチルコエンザイムA(アセチル-CoA)カルボキシラーゼ(ACC)ATPクエン酸リアーゼ(ACLY)および脂肪酸合成酵素(FASN)は、真核細胞における脂肪酸生合成を制御することが知られている(138)。化学的阻害剤である5-(テトラデシルオキシ)-2-フロン酸(TOFA)および3,3,14,14-テトラメチルヘキサデカン二酸(MEDICA 16)でACCを標的とすることは、フラビウイルス(WNVおよびウスツウイルス[USUV] )の複製を減少させることが示されている(134)。これらの化合物は、グリセロリン脂質、スフィンゴ脂質、およびコレステロールなどの複数の脂質の細胞レベルを減少させることによって作用する(134)。さらに、脂質生合成阻害剤TOFAおよびセルレニンは、それぞれACCおよびFASNを阻害することにより、ZIKV(Flaviviridae)およびSemliki Forest virus(Togaviridae)に対して幅広い抗ウイルス活性を示している(133)。リピドミクスなどの改良された技術により、ウイルス感染後の脂質代謝のリプログラミングについての洞察が得られるはずである。しかし、抗ウイルス戦略として宿主の脂質代謝を標的とすることは、宿主細胞への毒性によって制限される可能性があるため、注意が必要である(139)。
細胞キナーゼおよび脂肪酸合成酵素を標的とする以外に、他のタンパク質/脂質標的に対する低分子化学的阻害剤も開発されており、それらを表2にまとめた。他のタイプの阻害剤には、ウイルス感染および複製に必要な特定の宿主因子を標的とするために使用できる、比較的新しいクラスの治療用モノクローナル抗体(MAbs)が含まれる。これらについては、以下のセクションで説明する。
宿主誘導型治療用モノクローナル抗体。ウイルスタンパク質に対する抗体の役割を検討するのではなく、このセクションでは、正味の結果が抗ウイルス性である場合の宿主成分に対する抗体の役割を強調することに焦点を当てている。例えば、CD4 T細胞上の受容体結合部位をブロックするUB-421(140)ibalizumab-uiyk(141)およびmaraviroc(80,81)のような抗体は、HIV-1感染症の治療において臨床的な有効性を示している(21)。
クラウディン(142)およびオクルディン(143)などの細胞タイトジャンクションタンパク質は、HCVなどのウイルスの侵入受容体として作用する可能性がある(142-145)。したがって、抗クラウディン1(CLDN1)(146)および抗オクルディン(147)モノクローナル抗体が設計され、最小限の副作用でHCV感染を阻害することが示されている。同様に、ヒトスカベンジャー受容体クラスB、タイプI(SR-BI)はHCVの受容体と推定されており、この分子を標的とすることは有用な治療アプローチとなりうる(148)。しかしながら、SR-BI依存性が低下したHCV変異体は、SR-BIを標的とした治療の使用を制限する可能性があることが以前に報告されている(149-151)。興味深いことに、SR-BI標的分子に対する試験管内試験抵抗性が増加したHCV変異体に感染したヒト化マウスは、生体内試験での抗SR-BI MAb療法に依然として反応性を示しており(152)HCV感染と闘うための効果的な方法であることが示されている(152)。
他の細胞タンパク質(ウイルス受容体以外)に向けられた抗体も開発されている。例えば、抗CD69モノクローナル抗体を用いてCD69(感染時に白血球によって高度に発現する宿主中の膜貫通型C型レクチンタンパク質)をブロックすると、感染時に二次リンパ系器官における白血球数を増加させることができる。これは、ワクシニアウイルス感染のクリアを促進する(153)(図2A)。抗CD69抗体はまた、ガンマ・インターフェロン(IFN-g)および腫瘍壊死因子α(TNF-a)を産生するナチュラルキラー(NK)および適応免疫T細胞の数を増加させるが、これは部分的にはmTORシグナル伝達によって媒介される効果である(154, 155)。他の研究では、ベバシズマブ(血管内皮増殖因子に対する組換えヒト化モノクローナル抗体)がHSV-1誘発角膜新生血管化およびヘルペス性間質性角膜炎における瘢痕化を抑制する可能性があることが報告されている(156,157)。
モノクローナル抗体は、抗ウイルス療法とともに補助的な治療薬として使用されてきた。例えば、経口抗CD3抗体療法は、IFNsとリバビリン療法を追加で受けている慢性HCV患者において、ウイルス負荷の有意な低下および調節性T細胞レベルの上昇を引き起こす可能性がある(158)。
注目すべきは、宿主指示型抗ウイルス療法(例えば、モノクローナル抗体および他のタイプの阻害剤)が、ウイルス指示型介入よりもいくつかの利点を提供することである。遺伝子型に依存した抗ウイルス活性を発揮するウイルス媒介剤と比較して、宿主媒介剤は、広範な汎遺伝子型活性を示す。例えば、SR-BI(159,160)CLDN1(161)およびCD81(162,163)に対するモノクローナル抗体は、複数のHCV遺伝子型に対して広範な抗ウイルス効果を示している。同様に、ITX-5061(164)エルロチニブ(165)エゼチミブ(166)フラボノイド(167,168)レクチン(169)およびホスホロチオエートオリゴヌクレオチド(170)ならびにシリマリン(171,172)などの宿主指向型薬剤は、HCVの複数の遺伝子型に対して抗ウイルス活性を示す。宿主誘導剤はまた、ウイルス脱出変異体の複製を制限する。例えば、すべての主要なHCV遺伝子型の侵入を阻止することに加えて、CLDN1に対して指示されたモノクローナル抗体は、感染性の高いHCVの中和抗体エスケープ変異体の細胞侵入も阻止することができる(161)。その結果、臨床的に有用なモノクローナル抗体および他の宿主指示薬の最近の開発は、抗ウイルス療法の戦略に革命をもたらした。
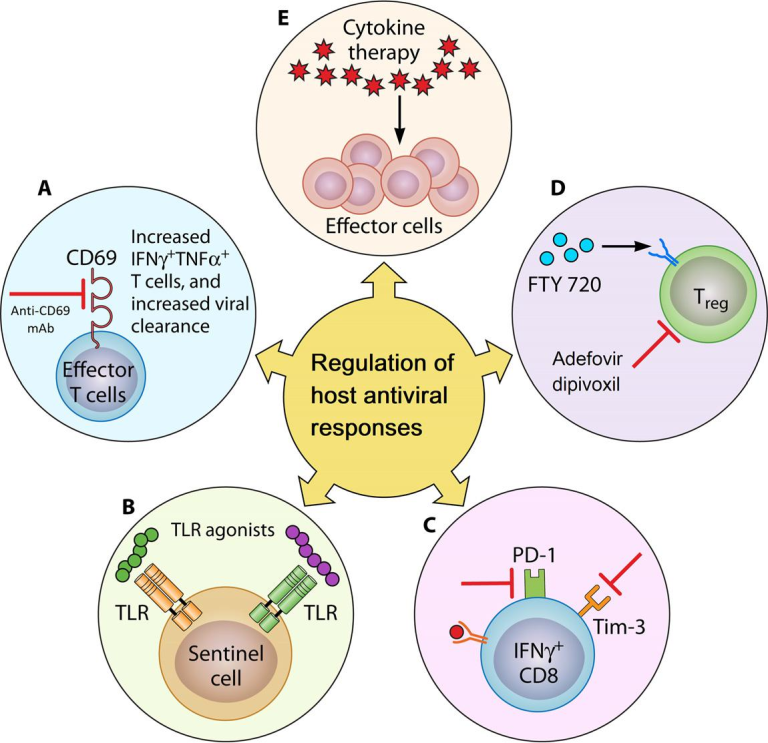
図2 宿主抗ウイルス応答の制御。抗ウイルス免疫応答は、いくつかの可能な手段によって増強することができる
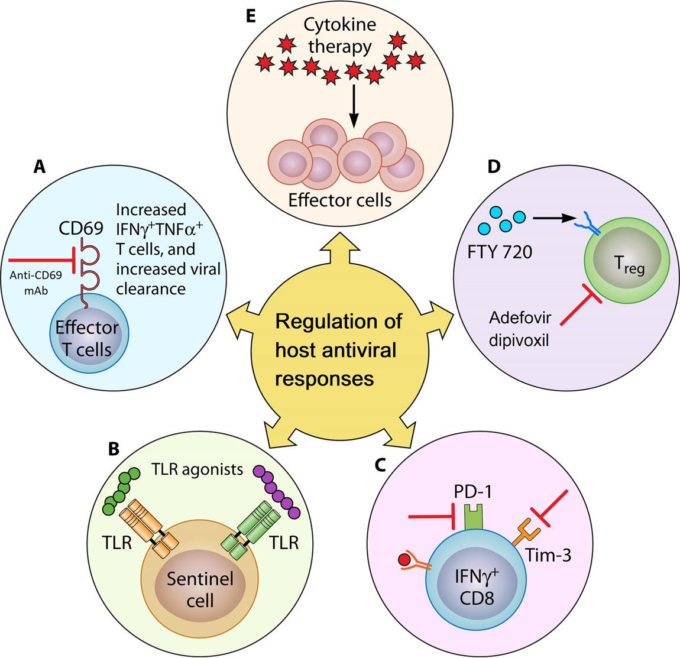
A)モノクローナル抗体。抗CD69モノクローナル抗体を用いてCD69をブロックすることで、感染時に二次リンパ系器官の白血球数を増加させ、ウイルス感染をクリアする能力を向上させる。
B)PRRアゴニスト。PRRを標的とするアゴニストは、強化されたウイルスクリアランスのための自然免疫応答を増強するための別の可能な戦略である。
C) 対炎症性メカニズムの調節。Tim-3/Galectin-9相互作用およびPD-1/PDL-1軸のような対炎症性メカニズムは、過剰な免疫応答によって引き起こされる巻き添え組織の損傷を防ぐ。このように、抗炎症メカニズムをブロックすることにより、抗ウイルス免疫を増強することができる。
D)Treg応答を操作する。Tregは、過剰な免疫応答を制限するために作用する抑制細胞である。FTY720はTregの機能を拡張・増強し、その結果、ウイルス誘発性免疫病理学を改善する。一方、Tregを阻害することにより(アデフォビルジピボキシル)抗ウイルスエフェクター応答が増強される。
E)サイトカイン療法。炎症性サイトカインの投与や、免疫抑制性サイトカインの遮断は、抗ウイルス免疫応答の増強に役立つ可能性がある。
宿主の抗ウイルス応答の調節
感染細胞内での複製に関与するウイルスイベントまたは生理学的プロセスのいずれかを直接標的とする薬剤を使用する代わりに、ウイルス感染によって設定された様々な宿主免疫イベントを標的とすることができる。感染に応答して、ウイルスは、通常、最終的には感染の範囲を制御し、宿主からウイルスを除去するように作用する広範囲の宿主応答を誘発することができる(図2)。このような事象は、宿主主導のウイルス制御を容易にし、感染によって引き起こされる組織損傷の程度を制限するために、一連の治療法の拡大によって変化させることができる。これらの戦略については、以下のセクションで議論する。
表3 宿主の抗ウイルス反応の制御
原文参照
略語
COX-2,シクロオキシゲナーゼ2;DHV、アヒル肝炎ウイルス;EGFR、上皮成長因子受容体;HBV、B型肝炎ウイルス;HCV、C型肝炎ウイルス;HPV、ヒトパピローマウイルス。IAV、インフルエンザAウイルス;JEV、日本肝炎ウイルス;PPAR、ペルオキシソーム増殖因子活性化受容体-g;SINV、シンドビスウイルス;SIP、スフィンゴシン-1-リン酸塩;VSV、小水疱性口内炎ウイルス。
IFN経路の誘導。ウイルス自体は、タンパク質、脂質、または核酸であり得る1つ以上の病原体関連分子パターン(PAMP)を有していてもよい。これらのPAMPは、細胞パターン認識受容体(PRR)と相互作用して、IFN産生などの自然免疫イベントを誘導する(173-178)。細胞は、IFN刺激遺伝子(ISG)としてまとめて知られる多数の細胞タンパク質の発現を変化させることによってIFNに反応する(179, 180)。これらは、応答した細胞をウイルスの複製から保護するために機能し、したがって、感染症の解決に役立つ(181, 182)。ウイルス感染に応答して産生される他のモルキュールは、細胞の炎症反応に関与している可能性があり、これらも抗ウイルス制御を発揮することができるが、過剰に刺激された場合には、多くの慢性ウイルス感染の間に典型的に見られるように、組織の損傷に寄与する可能性がある(183, 184)。
ウイルスPAMPの最もよく研究されている例は、細胞内のToll様受容体(TLR)を引き金とするものである。このような相互作用は、細胞の活性化、サイトカインの産生、およびウイルス感染の結果を調節しうるいくつかの他の活動を含むイベントのカスケードをもたらす(185,186)(表3)。PRRは、合成リガンドによって誘発され得る。例えば、TLR7アゴニストGS-9620の投与は、NK細胞およびHBV特異的T細胞を拡大させ、慢性HBV感染のより良い制御につながる可能性がある。
187)(図2B)。同様に、TLR7/8アゴニストR848は、抗ウイルスタンパク質であるviperinの活性化を介して、ヒト単球におけるZIKVゲノムおよびタンパク質合成をブロックすることができる(188)。同様に、TLR9およびTLR3アゴニストは、それぞれHCVおよびHBVの複製を阻害することができる(189)。
細胞性RNAとは異なり、いくつかのウイルスRNAは、5=三リン酸(5=ppp)末端構造を含む。これは、細胞内シグナル伝達カスケードを活性化して
炎症性サイトカイン反応を活性化する可能性がある(190, 191)。合成5=ppp RNAの投与はまた、RIG-I依存性の抗ウイルス応答を活性化し、RNAおよびDNAウイルスの多様なグループに対して有意な保護を提供し得る(192)。
IFNを刺激する特定の薬剤および生物学的製剤が開発されており、これらはウイルス感染を制御することに貢献してきた。例えば、ウイルスの複製は、I型IFN経路のIFN調節因子3(IRF3)を活性化する低分子化合物のクラスであるヒドロキシキノリンによって超抑制される(193)。
対炎症性経路の阻害による宿主抗ウイルス応答の増強 宿主の対炎症性経路は、ウイルス感染に対して生成された過剰な免疫応答の結果として起こり得る巻き添え組織損傷を抑制するように機能する。一方、宿主の対炎症性機構はまた、急性ウイルス感染に対する効果的な免疫を減衰させる。例えば、IAV感染のマウスモデルでは、TIM-3/ガレクチン-9免疫阻害性相互作用は、損傷を媒介するTIM-3陽性CD8 T細胞のアポトーシスを誘導することにより、巻き添え損傷を制限するように作用することができる(194)。しかしながら、残念ながら、このアプローチは、CD8 T細胞によっても媒介される抗ウイルス制御を損なう可能性がある。したがって、TIM-3融合タンパク質を用いてTIM-3/ガレクチン-9免疫相互作用をブロックすることは、ウイルス特異的な血清IgM、IgG、およびIgA抗体のレベルの上昇(194)と同様に、より強固な急性期ウイルス特異的CD8 T細胞応答を生成することによって、抗ウイルス免疫を増強することができる(図2C)。
他の免疫誘導的アプローチは、コイン抑制性受容体プログラムされた死-1(PD-1)の遮断を含む。これは、PD-1に対する抗体を有するマカクにおける慢性シミアン免疫不全ウイルス(SIV)感染を制御するために使用されてきた。これは、ウイルス特異的CD8 T細胞機能への作用を介して防御を増強する(195)(図2C)。他にも、阻害性受容体を標的とするMAbsを用いてウイルス感染を制御する利点が報告されており、このアプローチは有望な将来性を持っていると思われる(196)。
調節性T細胞(Treg)
ウイルス感染と闘うための別の免疫誘導戦略の可能性は、しばしば過剰な炎症性反応を減少させるように作用する調節性T細胞(Treg)の機能を標的とすることである。Tregはウイルスに対する炎症反応に対して有益な効果を持つが、その欠点は、特に急性感染に対しては防御を制限する可能性があるということである(197)。したがって、Treg活性は、抗ウイルス免疫を増強するために治療的に管理される必要がある(図2D)。例えば、慢性HBV感染症に対して使用されるアデノシンの非環状ヌクレオチドアナログ(198)は、Tregの機能およびその拡張を阻害する(199)が、軽度の腎毒性を有する。同様に、TNF-aはTregの抑制効果を阻害し、その結果、HBV特異的免疫応答が増強された(200)。しかし、最近のレビュー論文に記載されているように、ウイルス{特異的Tregの阻害は、様々な理由から技術的に困難な問題である可能性がある(201)。抗ウイルス応答を直接調節することに加えて、Tregの操作はまた、ウイルス感染によって引き起こされる組織損傷を改善することができる。例えば、スフィンゴシン-1リン酸受容体アゴニストであるFTY720の長期適用は、HSV-1誘発免疫病理学において抗炎症効果をもたらす(202)。FTY720のこれらの効果は、T細胞受容体(TCR)で刺激された非調節性CD4 T細胞が、抑制活性を高めたTregに変換されることによって媒介された。免疫系の多数の抑制経路は、自己耐性を維持し、巻き添え組織の損傷を最小限に抑えるために重要である。また、ウイルスは、特にウイルス抗原特異的なT細胞に対する免疫抵抗性の主要なメカニズムとして、特定の免疫チェックポイント経路をcooptすることもよく理解されている。このように、免疫チェックポイントの調節は、実行可能な新しい治療法として注目されている。しかし、治療法を決定する前には、慎重に検討する必要がある。
サイトカイン療法
サイトカインの投与により、抗ウイルス適応免疫の治療効果を高める試みがなされていた。T細胞免疫応答には、拡張、収縮、記憶の3つの段階がある(203,204)。抗ウイルス免疫応答の収縮期にインターロイキン2(IL-2)を投与すると、ウイルス特異的T細胞の増殖と生存率が向上し、ウイルス力価が大幅に低下する(205)(図2E)。しかし、拡大期の間のIL-2処置は、急速に分裂するエフェクターT細胞の生存に負の影響を与えた(205)。同様に、慢性HBV患者では、特定のサイトカインを刺激する治療法を用いてウイルスを制御することができる。例えば、Peg-IFN-l治療は、IFN産生HBV特異的CD4 T細胞およびCD8 T細胞応答の両方を維持するとともに、高い血清レベルのIL-18(抗ウイルスサイトカイン)を誘導することで、おそらくコントロールを達成することができる(206)。これらの強化された免疫活動は、ウイルスの複製を著しく制限する可能性がある(13)。一方、IL-10などの免疫抑制性サイトカインは抗ウイルス免疫を抑制し、この効果を克服することで、リンパ球性絨毛膜炎ウイルス(LCMV)感染で観察されているように、ウイルスの制御が強化されることがある(207)。
サイトカインストームの制御
「サイトカインストーム」という用語は、サイトカインの異常な産生およびそれらが組織を損傷させる免疫病理学を説明するために使用される。もともと「サイトカインストーム」は、臓器移植に関連した病理学を特徴づけるために造語されたもので、ドナー免疫細胞がレシピエント患者宿主の組織に反応して引き起こされる炎症反応(移植片対宿主病)によって実証されたものである(208)。サイトカインストームはまた、特に急性ウイルス感染症の場合、病気の重症度の増加と相関している(208)。これらには、IAV(209,210)デングウイルス(211,212)およびエボラウイルス(EBOV)(213)の感染が含まれる。150以上のサイトカインがサイトカインストームに関与している可能性がある(211-213)が、主に関与しているのはTNF-a、IL-6,およびIFNである。
細胞シグナル伝達経路の活性化に関与する宿主タンパク質を標的とすることによってサイトカインストームを制御することは、組織損傷を減衰させるための潜在的なアプローチである(214)。例えば、高病原性のH5N1鳥インフルエンザウイルスは、季節性インフルエンザ(H1N1)と比較して頑健なサイトカイン応答を誘導する(215)。さらに、1918-1919年に壊滅的な大パンデミックを引き起こした高病原性の「スペイン風邪」(H1N1 IAV株)もまた、フェレットにおいて高サイトカイン血症を誘発することが示されている(216)。高サイトカイン血症には複数のサイトカインが関与しているため、単一のサイトカインを破壊することは通常、その価値が限定的である(215, 217)。しかしながら、サイトカインの大部分の誘導はNF-kBシグナル伝達経路の活性化を介して媒介されるため、この転写因子を標的とすることは治療的に実行可能なアプローチであるかもしれない。例えば、H5N1感染のノックアウトマウスモデルでは、NF-κB(p50サブユニット)を枯渇させると、NF-κBが制御するサイトカインおよびケモカインの発現が大幅に減少した(高サイトカイン血症の欠如)(215, 218)。
ある高病原性IAV感染症(H5N1)では、サイトカインストームを経験した患者の大多数は高齢者か免疫系が低下していた(219)。実際、関連する問題は、なぜ特定の個人がサイトカインストームに対して相対的に抵抗性であるのに対し、他の個人はより感受性が高いのかということである。細菌産物に対する高応答性および低応答性も患者で確認されているが、これはTLR1タンパク質の構造と機能の違いによって部分的に説明できる(220)。したがって、ウイルス誘発性サイトカインストームに対する宿主の感受性の高さとPRRの遺伝的多型との関連については、より詳細に検討する必要がある。
エピジェネティック修飾の調節
エピジェネティクスとは、生物のゲノム内のヌクレオチドの変化を伴わない表現型の変化の研究である(221)。細胞内で起こる主なエピジェネティックな変化は、ヒストンの修飾(アセチル化とメチル化)ホスホリル化、ユビキチン化、スモイル化によるものである。ヒストンはゲノムDNAと相互作用してクロマチン構造を形成する。クロマチンの圧縮の程度は、主にヒストン蛋白質のメチル化やアセチル化に依存しており(222)、これがゲノムの安定性、遺伝子発現、細胞系列の発達、幹細胞の成熟、有糸分裂を決定している(223)。ヒストン修飾は、ヒストンアセチルトランスフェラーゼ(HAT)ヒストン脱アセチラーゼ(HDAC)ヒストンメチルトランスフェラーゼ(HMT)などのエピジェネティックな調節因子によって行われ、これらの因子は、癌(224)や寄生虫疾患(225)を治療するために標的とされていた。同様に、DNAメチル化を調節するDNAメチルトランスフェラーゼ(DNMTs)は、多くの異なる疾患と関連している(226,227)。最近の報告では、ウイルス複製の調節におけるこれらのエピジェネティック修飾因子の関与も強調されている(228-231)。例えば、エピジェネティック修飾は、ウイルスゲノムの転写および複製を抑制することにより、抗ウイルス防御機構として機能し得る。一方、ウイルスはまた、ウイルス感染時に宿主ゲノムのDNAハイパーメチル化を誘導することにより、宿主機能をエピジェネティックに修飾することがある(232)。したがって、ウイルス感染時の遺伝子発現を制御するエピジェネティックレギュレーター(図1B)の阻害剤の開発が求められている。
ヒストンのアセチル化と脱アセチル化
ヒストンのアセチル化および脱アセチル化は、ヌクレオソームのヒストンコアから突出しているN末端テール内のリジン残基が、遺伝子制御の間にアセチル化および脱アセチル化されるプロセスである(233)。ヒストンのアセチル化はHATおよびHDACによって制御されており、HDACの化学的阻害剤は抗ウイルス効果のために評価されてきた。例えば、選択的HDAC6阻害剤であるツバシンは、日本脳炎ウイルス(JEV)(234)およびHCV(235)の複製を阻害することが示されている。そのメカニズムは、ヒートショックプロテイン90(Hsp90;HDAC6基質)のハイパーアセチル化の誘導に関係しており、Hsp90とJEV NS5の相互作用を阻害してウイルスRNA合成を阻害することが示されている(234)。同様に、HDAC阻害剤SAHA(suberoylanilide hydroxamic acid)は、免疫調節タンパク質であるオステオポンチンのH3アセチル化レベル(236)を増加させることにより、HCV複製を阻害することができる(237)。
潜在的HSV-1感染の試験管内試験モデルでは、静穏感染したPC12細胞(ラット神経芽細胞腫)をトリコスタチンA(TSA)および酪酸ナトリウム(HDAC阻害剤)で治療すると、ウイルス複製が再活性化されることが示された(238)。他のヘルペスウイルスと同様に、エプスタインバーウイルス(EBV)は、潜伏感染したBリンパ球の中で主にエピソーム(共有結合的に閉じた円形DNA[cccDNA]とも呼ばれる)として持続する(239)。潜伏期間中、ウイルスDNAは比較的低レベルのヒストンアセチル化によって維持される。ウイルス性BZLF1タンパク質の発現は、ウイルス性再活性化と関連している(240)。その発現は、YY1(陰陽1)およびZEB(ジンクフィンガーEボックス結合因子)のような細胞抑制因子のリクルートによってブロックされる。これらは、転写活性化因子へのアクセスを妨げ、HDACなどの抑制性補因子の結合を促進する(240)。したがって、HDAC阻害剤は、EBV潜伏の反転を誘導することができる。
これらのHDAC阻害剤は、有望な治療薬として使用する可能性があるが、宿主のゲノム内の他の潜伏感染ウイルスを再活性化する可能性があるため、使用前の慎重な評価が不可欠である(241)。例えば、SAHA/TSAの投与は、コックスサッキーウイルスB3(CVB3)関連心筋炎の重症度を増加させる可能性がある(242)。
大きな問題となっている慢性HBV感染の制御は、慢性感染細胞におけるエピジェネティックイベントを操作することによって達成されるかもしれない。ウイルス粒子中のHBVゲノムは、転写的に不活性な円形の部分的な二本鎖DNAの構造のままである(243)。転写活性になるためには、感染細胞の核内でcccDNA(エピソーム)に変換される(244,245)。一旦感染が起こると、ウイルスは肝細胞の核内でcccDNAとして無期限に持続する。現在、ヌクレオシドアナログをベースとした ap-proved 抗ウイルス療法は、cccDNAに直接影響を与えずに細胞質のHBVゲノム複製を標的としているため、長期的な抗ウイルス療法が必要である(246-250)。慢性HBVの全治は、すべての肝細胞の核からウイルスエピソームが除去された場合にのみ達成されうる。HBVによるcccDNAの形成は、細胞の転写機械(251)によって促進されるが、これにはエピジェネティックな修飾も関与している(251,252)。エピジェネティック阻害剤C646(HAT阻害剤)は、測定可能な毒性を伴わずにcccDNAを転写的にサイレンシングするため、慢性HBV感染症の治療への新しいアプローチとなっている(253)。
ヒストンメチル化
HMTには、ヒストン-リジンN-メチルトランスフェラーゼとヒストン-アルギニンN-メチルトランスフェラーゼの2種類がある。HMT阻害剤は、特定のタイプの癌に対する治療薬としての可能性が証明されており、いくつかのウイルス感染症の調節に有効であるかもしれない。例えば、PRMT5(タンパク質アルギニンメチル化トランスフェラーゼ5)はHBVの複製を制限し、これはウイルスDNA転写のエピジェネティックな抑制(アルギニンが豊富なC末端ドメインのアルギニン残基の脱メチル化)を介して媒介される(254)。したがって、PRMT5アゴニストは、HBVのDNA転写を抑制するために有用である(255)。
HMTのもう一つの潜在的な使用法は、HSVの潜伏を操作することである。転写抑制因子CTCFは、CCCTCDNA結合因子または11-ジンクフィンガータンパク質としても知られており、CTCF遺伝子によってコードされるヒトゲノム中の転写因子である。これは、HSV-1のDNAに結合し、HSV-1のlytic転写を促進することができる。siRNAによるCTCFの枯渇は、HSV-1遺伝子の転写の減少と同時に、抑制性ヒストンマークH3K27me3およびH3K9me3の増加を引き起こし得る(256)。同様に、5=デオキシ-5=メチルチオアデノシン(MTA;タンパク質メチル化阻害剤)による処置は、H3K4me3のレベルを抑制し(メチル化酵素Set1を介して媒介される)これは最終的にHSV-1の転写および複製の減少をもたらす(257)。
ヒストンの脱メチル化
DNAウイルスは、ヒストンを持たずにゲノムをカプセル化するが、感染後に急速にクロマチン構造を獲得する(258,259)。したがって、それらは宿主のエピジェネティック修飾因子による修飾を受け、それを阻害してウイルス複製を調節することができる。例えば、リジン特異的デメチラーゼ1(LSD1;KDM1Aファミリー)の阻害は、DNAウイルスゲノムの転写およびリチン性複製の阻害をもたらす。この結果、ウイルスの脱落が減少し、疾患の重症度が低下する(260-264)。DNAウイルスとは異なり、RNAウイルスゲノムはヒストン結合およびクロマチン構造に依存しない。しかしながら、驚くべきことに、LSD1は、IAVおよび他のいくつかのRNAウイルスの細胞抗ウイルスタンパク質として機能するインターフェロン誘導膜貫通プロテイン3(IFITM3)を脱メチル化し、活性化することにより、IAVの複製を間接的に阻害する(265)。さらに、HIV-1がRNAウイルスであるにもかかわらず、LSD1活性をブロックすることは、潜伏感染T細胞におけるHIV-1転写のプロウイルスDNA活性化を抑制することも示されている。この効果は、ウイルスのアクセサリーであるTatタンパク質の脱メチル化によって媒介される(266)。
DNAメチル化
DNAメチル化は、微生物感染や癌を含む多くの異なる疾患と関連しているエピジェネティックな修飾であることがよく知られている(226,227)。DNAメチル化は、転写開始部位付近のCpG島において最もダイナミックである(222)。CpG島は通常、ゲノムの残りの部分と比較して低メチル化されている。一般に、プロモーターのメチル化は遺伝子の転写を抑制するが、ゲノムの他の領域のメチル化は遺伝子のトランザクティベーションを誘導する(222)。クロマチン構造は、DNAメチル化に続いて(267, 268)、HDAC/DNMTsとの相互作用の間に変化する(269, 270)。DNMTsは、CpGジヌクレオチドのシトシンの炭素5位のメチル基(-CH3)と結合してDNAをメチル化する(271)。ハイパーメチル化されたDNAは、低アセチル化ヒストンと負の相関があり、クロマチンの縮合を引き起こし、その結果、転写抑制につながる(267)。
ウイルスゲノムの転写と複製を抑制することで、DNAメチル化は抗ウイルス防御機構として機能する。内在性レトロウイルスやレトロトランスポゾンは、DNAのハイパーメチル化によって抑制されることがよく知られている(272)。HPV、HSV-1,HBV、EBV、およびアデノウイルスのようなDNAウイルスのゲノムもまた、豊富なメチル化を受け、感染した細胞内でしばしばサイレンス化される(273-277)。沈黙したウイルスゲノムは、エピジェネティックイベントを操作することによって再発現させることができる。例えば、DNMT阻害剤である5-アザシチジン(デシタビン)による処理は、サイレンス化されたEBVゲノムの活性化を誘導した。これは最終的には、免疫を介したEBV関連腫瘍細胞の破壊を促進した(278, 279)。いずれにしても、脱メチル化剤は、レトロウイルスのRNA転写を休眠状態(潜伏状態)から活性化させることができ(280)これは治療上の潜在的な問題である。
ウイルスはまた、DNAのハイパーメチル化を誘導することにより、エピジェネティックに宿主機能を破壊することがある(281,282)。例えば、HCV感染は、DNMT1および3b媒介のDNAハイパーメチル化を誘導する。これは、腫瘍抑制活性を有する一次細胞接着分子であるE-カドヘリンの発現のダウンレギュレーションをもたらす(283)。この効果は、DNMT特異的阻害剤での治療後に反転させることができる(283)。同様に、SOCS1(サイトカインシグナル伝達1のサプレッサー、JAK/STATシグナル伝達の負の調節因子)のメチル化は、HBV誘発性肝細胞癌と負の相関を示した(284)。同様に、腫瘍抑制遺伝子であるGADD45(成長停止・DNA損傷誘導遺伝子45)のプロモーターは、マウスのHCV感染中にハイパーメチル化することが示されている(285)。複数のDNMTを調節することにより、HPVやHBVなどのDNA腫瘍ウイルスは、異常なDNAメチル化を誘導し(286-288)最終的には発がんを引き起こす可能性がある(289)。
光架橋支援m6Aシーケンシング(PA-m6A-seq)m6A架橋免疫沈降(m6A-CLIP)を用いたN6-メチルアデノシンの高分解能マッピング(m6A-CLIP)重亜硫酸塩シーケンシング、5-メチルシトシンRNA免疫沈降(m5C-RIP)などの技術。5-アザシチジンを媒介とするRNA免疫沈降法(Aza-IP)や、メチル化-個別ヌクレオチド分解能クロスリンキング免疫沈降法(miCLIP)は、ウイルスや宿主ゲノムにおけるエピジェネティックな変化をプロファイルするための強力なツールとして登場している(290-294)。これらの技術は、クロマチン免疫沈降法(ChIP)と組み合わせることで、ウイルス感染症のエピジェネティック制御に関連する多タンパク質複合体に関する包括的な情報を提供することができる。さらに、リン酸化やスモイル化などのトランスラプション後修飾の他のモードの役割を解明することで、ウイルスと宿主のダイナミックな相互作用についての洞察を得ることができる(294)。
抗ウイルス剤治療の最新のアプローチと抗ウイルス剤開発のための宿主因子の同定
薬物併用療法
薬物の組み合わせを適切に使用することで、効力が強化され、抗ウイルス活性が拡大し、薬剤耐性の可能性が低くなる可能性がある(295,296)。上述したように、PegIFN-aベースのレジメンにリバビリンを追加することで、慢性HCVコントロールの劇的な改善が得られた(53,297)。しかし、IFN-aとリバビリンがHCVに対して作用するメカニズムは解明されていない。他の組み合わせもHCVに対して有効であることが証明されている。例えば、Xiaoらは、宿主指向型薬剤(エルロチニブ、ダサチニブ)宿主指向型抗体(抗CLDN1,抗CD81,抗SR-BI)およびウイルス指向型薬剤(telaprevir、bocepre-vir、およびsimeprevir、またはDanoprevir、daclatasvir、mericitabine、およびsofosbuvir)の組み合わせがHCVに対して非常に有効であることを示した(298)。
薬物の組み合わせの使用における新たな手段は、ウイルス複製を支持する複数の宿主因子および経路を同時に標的とすることであろう(299,300)。宿主を標的とする薬剤が既にFDAで承認されている場合には、追加の利点がある。このような薬剤は、ウイルス感染症の治療に直ちに使用することができ、これは薬剤の再利用として知られているアプローチである(299, 301-303)。これらの薬剤の標的はすでに十分に特徴づけられ、検証されているため、安全性の問題やリスクはほとんどない。異なる作用機序を利用するためにどの薬剤を適切に組み合わせるかを決定するために、多くの新しいアプローチが試みられており、以下で議論されている。
精密医療時代の抗ウイルス薬開発
個々の人がどのように病気を発症し、どのように治療に対応するかについての理解には大きなギャップがある。従来の医学は「一人一人に合った」アプローチに基づいているが、これでは、各人の遺伝子構成が他の人とは微妙に異なるため、的外れになる可能性がある。精密医療(個別化医療、個別化医療、ゲノム医療などとも呼ばれる)の有望なアイデアは、一人一人の遺伝子構成に合わせた医療を提供することである。しかし、この新しい技術はまだ検証中であり、臨床的に実現可能になるまでには数年かかるかもしれない。いずれにしても、抗ウイルス薬を開発する際には、個人のユニークさを考慮することが重要であり、このユニークさが治療結果に重要な影響を与える可能性があるからである。
抗ウイルス療法の結果における患者間のばらつきは、個人に存在する可変性のあるマイクロバイオームと同様に、異なる遺伝的プロファイルに起因する可能性がある(304, 305)。後者は、宿主の薬物動態や薬力学的プロファイル、薬物の分布に影響を与える可能性がある(306)。ゲノム、トランスクリプトーム、プロテオーム、メタボローム、リピドミッ クスレベルで患者を包括的に特徴付ける方法論の出現と、グローバルなタンパク質-タンパク質相互作用(インタラクトーム)を解析するための計算ツールの利用可能性は、生物学的データベースを大幅に改善した(307)。これらの「オミックス」アプローチを用いて臨床集団をメカニックなサブグループに分類することは、抗ウイルス療法を含む治療法の成功率を高めることにつながると考えられている(306)。
精密医療の潜在的な応用の1つは、異なる個人におけるウイルス感染の転帰を予測することである。例えば、IAV感染は強力な炎症性サイトカイン反応を誘発する可能性があり、一部の患者は重篤な疾患を経験する。このような状況下では、ステロイドはウイルスの複製を促進する可能性があるため、通常は推奨されない(308)。さらに、炎症反応を抑えることを目的とした抗炎症療法は成功しているが、ごく一部の患者でしか成功していない(308)。このような状況下では、「オミックス」データ(バイオマーカー)の利用可能性は、個人差を説明したり、免疫反応をモニターしたり、個々の患者における疾患の重症度を評価したりする上で貴重なものであることが証明されるべきである。
もう一つの応用例として、HIV-1の制御にも応用できるかもしれない。HIV-1では、抗レトロウイルス療法(ART)開始後のCD4 T細胞数の回復が重要である(309)。しかし、すべてのHIV-1患者がCD4 T細胞数の回復を経験するわけではないことが明らかになっており、日和見感染に対して脆弱である(309, 310)。ARTに対する患者の反応のレベルの違いを予測する遺伝的要因を特定することは、最適な治療成績を得るための鍵となる。例えば、個々の患者の末梢血単球(PBMCs)による遺伝子発現パターンは、特定の患者がCD4 T細胞数を回復するかどうかを予測することができる(311)。同様に、患者におけるMDR-1遺伝子の多型は、特定の多型を欠く患者よりもARTへのより強力な反応と関連している(312-315)。薬物輸送体や代謝酵素をコードする遺伝子の多型もまた、血漿中の抗レトロウイルス薬の含有量を決定する重要な因子である(316-320)。宿主遺伝的要因以外にも、個々の患者のマイクロバイオームの変化がウイルス感染やワクチン接種の結果に影響を与える可能性があることは注目に値する(304)。これは他の場所でも議論されている重要なテーマである(304, 321)。
医薬品開発のための宿主因子を特定するためのゲノムワイドスクリーニング
単一または限られた数のタンパク質の役割を研究することによる古典的な還元主義的アプローチでは、ウイルスの複製をサポートするすべての細胞因子の全体像を提供することはできない。現代の医薬品開発は、複数の分子標的の同時評価を可能にするRNAiやCRISPRスクリーンなどのゲノムワイドなハイスループット技術の出現によって促進されてきた。新しいハイスループットアプローチから得られたデータは、新しい仮説の構築や、新しく有用な診断用バイオマーカーの同定に非常に有用であることが証明されている。
siRNAスクリーン。小型干渉RNA(siRNA)は、人為的に合成された、19~23ヌクレオチド長の二本鎖RNA分子で、細胞内のmRNAを特異的に標的にして分解するように設計されている(322)。ゲノムワイドなRNAiスクリーニングアッセイを通じて、何千もの異なる宿主因子が、様々なウイルスの複製を促進または阻害することが示されている(323-350)。しかしながら、これらの細胞因子の大部分が、異なるウイルスのライフサイクルにどのように影響を与えているかについては、あまり理解されていない。例えば、これまでに実施された7つの異なるIAV RNAiスクリーニングにおいて、合計1,362個のウイルス支持性宿主因子が同定されている。重複した遺伝子は、ウイルス複製サイクルの様々なステップを調節することが示された(351-355)。しかしながら、NF-kB(96)Raf/MEK/ERK経路(36)のメンバー、およびRTK(121,129)のような、同定された数千の宿主因子のうち、IAV複製を促進することが知られているものはわずかである。特定された数千のウイルス支持性宿主因子の中で、複数の独立したスクリーンで重複を示すのは比較的少数の因子のみである(例えば、113,14,および6因子は、それぞれ2,3,および4個の個別のスクリーンで共通であることが見出された)。注目すべきは、これまでに実施された7つのIAV RNAiスクリーンすべてにおいて、共通の宿主因子が同定されていないことである。したがって、我々は、RNAiスクリーンがウイルス複製のための宿主依存性因子についての全体的な見解を提供することができると結論付けることができる。しかし、異なるスクリーン間でのデータの再現性(様々な固有または他の制御不能な変動性の問題による)や、ウイルス複製における多くの異なる宿主因子の関与に関する決定的なメカニズム論的洞察の決定は困難である可能性がある(356)。この問題は、レンチウイルスをベースとしたプールドRNAiスクリーンを使用することで克服できるかもしれない。この方法では、まず、細胞を低感染多重度(MOI)(0.1~0.3)でレンティウイルスのプールに感染させ、多様なsiRNAのプールを発現させる。その後、細胞は、細胞病理学的効果を産生するために、関心のある標的ウイルスで挑戦される。生き残った細胞を増殖させ、次世代シークエンシング(NGS)に使用する。これにより、ウイルス誘発細胞死に対する保護を提供するsiRNAターゲット(宿主遺伝子)が同定される(329, 330)。
CRISPR/Cas9スクリーン。上述したように、抗ウイルス薬開発のために利用可能な宿主標的を同定するためのRNAiアプローチは困難であるが、最近開発されたCRISPR/Cas9アプローチは、改良された方法であることが期待されている。RNAiは弱い表現型を産生するが(100%のトランスフェクション効率を達成することができないこともあり)細胞内CRISPR/Cas9機械はその標的タンパク質を完全に破壊し、それによってより強固な表現型を産生することができる(357)。ゲノムワイドCRISPR/Cas9ノックアウト(GeCKO)技術は、ウイルス複製に必要な細胞性因子の同定に成功することができる(358-367)。この手法は、RNAiスクリーンに比べて多くの利点がある。例えば、7つのIAV RNAiスクリーンで同定されたプロウイルス宿主因子の数が90から323であったのに対し、GeCKOスクリーンでは最大453のプロインフルエンザ宿主遺伝子が同定された(359)。さらに、GeCKOスクリーンは、様々なRNAiスクリーンによって同定された2〜16個のプロインフルエンザ宿主遺伝子と比較して、少なくとも33個の共通のプロインフルエンザ宿主遺伝子を同定した(359)。GeCKOスクリーンはまた、以前のRNAiスクリーンでは発見されなかった、IAV複製に必要な400の稀な宿主遺伝子を明らかにした(359)。同様に、フラビウイルス(FLV)を用いた3つの独立したGeCKOスクリーンは、効率的なFLV複製のための鍵となる細胞因子として小胞体(ER)関連タンパク質複合体を同定した。これは、RNAiスクリーンよりも高い再現性を示した(360,362,363)。HIV-1のコアレセプターである溶質キャリアファミリー35メンバーB2(SLC35B2)活性化白血球細胞接着分子(ALCAM)チロシンタンパクスルホトランスフェラーゼ2(TPST2)(336-341)およびノロウイルス(NV)細胞受容体CD300If(367)もGeCKOスクリーンで同定された。
表4 宿主指示型抗ウイルス剤に対する抵抗性の発現に関する観察a
原文参照
a略語
BPXV、バッファロポックスウイルス;CVB3,コックスサッキーウイルスB3;デングウイルス、デングウイルス;EV、エンテロウイルス;HCV、C型肝炎ウイルス;NDV、ニューカッスル病ウイルス;SERCA、サルコ/小胞体カルシウム-ATPase;MNK1,MAPK相互作用キナーゼ1;PI4KB、ホスファチジルイノシトール4-キナーゼIIIb。
機能喪失に基づくGeCKO/RNAiスクリーニングにおいて、宿主制限因子または依存性因子の同定は、ウイルス力価の増加または減少に基づいて行われる。しかしながら、特定の細胞因子は、ウイルス産生の調節に直接寄与するのではなく、細胞死経路を調節する。例えば、Maらは、EMC2,EMC3,SELL1,DERL2,UBE2G2,UBE2J1,およびHRD1を高濃縮遺伝子として同定しており、これらの遺伝子はすべて、WNVのGeCKOスクリーニングにおいてER関連タンパク質分解(ERAD)経路に属するものである。これらの遺伝子はウイルス産生には影響しないが、WNV誘発細胞死と関連している(364)。
RNAiおよびGeCKOスクリーニングで得られたデータを実施し、解釈する際には、いくつかの要因を考慮しなければならない。動物における遺伝的冗長性のレベル、RNAiおよびGeCKOスクリーンの効率の変動レベル、および実験条件の多様性を考慮すると、比較的高い偽陽性率をもたらすオフターゲット効果が時折発生する可能性がある。これは、選択された遺伝子の検証の比較的低い率と相まって、同定された宿主遺伝子が実際にウイルス複製のために協力されていることを確認するための検証の必要性を強調している。
ホスト指示療法の開発における課題
宿主媒介型抗ウイルス剤に対する薬剤耐性
前述したように、ウイルスは変異誘発によって欠落した細胞機能を容易に置換することができないため、ウイルスがウイルス複製に必要な宿主因子を標的とする薬剤に対して薬剤耐性を発現する可能性は低いと考えられている(37)。しかし、新たな証拠は、宿主が指示する抗ウイルス剤に対するウイルスの耐性が実際に起こりうることを示唆している(表4)。細胞培養モデルでは、臨床的に関連性のあるIAV誘導剤は、6継代後(P6)のような短期間で完全な耐性表現型を誘導することがある(129)。しかしながら、この継代レベルでは、細胞培養における宿主指向性薬剤の存在下で選択される薬剤耐性IAV変異体は知られていない(129)。他の試みもまた、P25までの宿主媒介剤に対する薬剤耐性ウイルス変異体の導出に失敗している(129, 368, 369)。しかしながら、細胞培養中の宿主媒介剤の存在下でウイルスをさらに継代すると(P35)多くの場合、部分的ではあるが非常に有意な耐性表現型を持つウイルス亜種が観察されることがある(39)。宿主指示薬の存在下でのウイルスのさらなる増殖(P70まで)は、薬剤耐性の大きさを増加させるようには見えなかった(39)。興味深いことに、薬剤耐性ウイルスは、細胞培養液から阻害剤を除去した後も、その表現型を維持していた(我々の未発表データ)。これらの証拠は、宿主指向薬剤に対する耐性ウイルスの変異体は容易には生成されないが、宿主指向薬剤に長期的に曝露した場合には比較的低いレベルで発生する可能性があることを示している。このセクションでは、宿主が指示した抗ウイルス剤に対する薬剤耐性の出現の背景にある可能性のあるメカニズムについて考察する。
図3 宿主指示型抗ウイルス剤に対する抵抗性の獲得の潜在的なメカニズム
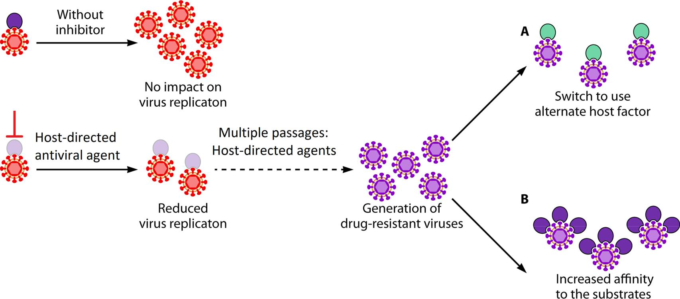
宿主指示型抗ウイルス剤に対する抵抗性の獲得に関連する可能性のある3つのメカニズムが仮説化されている。
(A) 代替の宿主因子の使用への切り替え。重要な細胞因子の長期的な制限された利用可能性は、ウイルスが抵抗性を獲得するために代替の宿主因子を使用するように誘導する可能性がある。
B)基質に対する親和性の増加。ウイルスが特定の宿主因子の制限された利用可能性の存在下で長期培養される場合、ウイルスは、標的とする宿主タンパク質の制限された量の下で最適に複製するための効率を増加させることができる。
代替の宿主因子(複数可)を使用するように切り替える。まだ完全には理解されていないが、宿主指示薬に対する薬剤耐性の獲得の基礎となる可能性のあるメカニズムの一つは、ウイルスが代替の宿主因子(370)を使用するようにスイッチする可能性があるということである(図3A)。例えば、CLDN1ノックアウト細胞におけるHCVの伝播は、代替宿主タンパク質-CLDN6またはCLDN9(370)を使用して細胞内で感染および複製を成功させることができるCLDN1非依存性HCV変異体を生成し得る。
他の例としては、宿主の翻訳装置を調節するための多様な戦略を進化させたウイルスが挙げられる。例えば、多くのRNAウイルスは、細胞タンパク質のキャップ依存性翻訳の開始をシャットダウンするために、細胞のeIF4Fを破壊(不活性化)することができる(37)。しかし、RNAウイルスは、内部リボソームエントリーサイト(IRES)を含むキャップに依存しないプロセスを介して、自身のmRNA翻訳を開始する。ほとんどのDNAウイルスおよび少数のRNAウイルスでは、ウイルスの翻訳にはキャップ依存性のメカニズムが関与しており、これはERK/MNK1/eIF4E経路を介して媒介されている(37)。活性化されたMNK1は、翻訳開始複合体のelF4Gと相互作用し、elF4Eをリン酸化し、最終的にはmRNAの5=キャップに結合して翻訳を開始する(37)。MNK1またはeIF4Eを標的とする化学的阻害剤の存在下でBPXVを細胞培養中で長時間継代すると、MNK1またはeIF4E阻害剤に耐性を持つ突然変異ウイルスが生成された(38)。耐性の正確な分子機構は不明であるが、耐性ウイルスが別の宿主因子を使用するように切り替えたのではないかと示唆したくなる。あるいは、BPXVが別の(キャップに依存しない)翻訳開始経路に切り替えた可能性も考えられる(371)。これらの可能性を調べるためには、さらなる研究が必要である。
もう一つの例として、ニューカッスル病ウイルス(NDV)の侵入、ウイルスタンパク質の合成および細胞内局在化をサポートする重要な細胞因子であるSERCAが挙げられる(39)。SERCA阻害剤(thapsigargin)の存在下で効率的に複製するNDV変異体は、完全な薬剤耐性表現型は観察されていないが、細胞培養においてP40で出現している(39)。変異型ウイルスのFタンパク質における少なくとも1つの薬剤耐性関連変異(E104K)が同定されている。タプシガルギンに対する薬剤耐性の獲得の基礎となる分子機構を正確に解明するためには、F遺伝子および/または他のウイルスタンパク質のいずれかに点状変異を有する組換え型NDVの追加研究が必要である。
選択的圧力下でのウイルス効率の向上 特定の宿主因子の利用可能性が制限された存在下でウイルスを長期培養した場合、ウイルスは、薬剤を標的とする宿主タンパク質の制限された量の下で最適な複製を行うために、その効率を高めることができる(図3B)。例えば、HCV複製に必須のタンパク質である細胞性シクロフィリンの枯渇は、ウイルス複製の減少をもたらす。しかしながら、長期のウイルス通過は、シクロフィリン枯渇細胞内で効率的に複製することができる薬剤耐性HCV変異体を生成する。耐性HCV株は、NS3,NS5A、およびNS5Bタンパク質に後天的な突然変異を持っているようであり、これらのタンパク質はシクロフィリンに対する親和性が高いことを示している。これにより、耐性HCV株は、制限されたシクロフィリン濃度下で最適な複製を行うことができるようになった(372)。
ホスファチジルイノシトール-4キナーゼIII b(PI4Kb)は、エンテロウイルスの薬剤開発の宿主標的となり得る(373)。しかしながら、ポリオウイルス3Aタンパク質におけるウイルス抵抗性変異体(G5318AまたはA70T)は、PI4Kb阻害剤の存在下で培養中のウイルスの効率的な増殖をもたらす。これらのウイルス変異体は、ホスファチジルイノシトール4-リン酸(PI4P)脂質の基底レベルの上昇を誘導し、PI4Pが枯渇した細胞培養物において効率的なウイルス複製を可能にする(374)。興味深いことに、PI4Kb耐性コクサッキーウイルスB3変異体(3A-H57Y)は、PI4Kb阻害剤の存在下で、細胞内の高いPI4Pレベルを回復させることなく複製することができる(375)。これは、コックスサッキーウイルス3Aゲノムにおけるいくつかの変異が、PI4Kb活性化またはPI4P脂質濃度に依存しない抵抗性表現型を付与し得ることを示している。同様に、シクロスポリン(CsA)耐性HCV変異体もまた、CsA阻害剤の存在下での細胞培養において同定されている(376,377)。
抗ウイルス剤治療のパターンとウイルスのライフサイクルの同期化。いくつかのバクテリオファージは、そのライフサイクルの長さが突然変異可能な形質であるように進化してきた(378-383)。同様に、細菌においては、抗生物質耐性(耐性の代わりに)は、高い薬物濃度の下で一時的に生き延びるプロセスである(384)。耐性表現型は突然変異に起因し、遺伝する可能性がある。それは、生物のライフサイクルの様々なステップのタイミングの変化を伴うことがある(385, 386)。
ウイルス媒介療法に対する抗ウイルス剤耐性の最も一般的に理解されているメカニズムは、薬剤を投与可能な部位でウイルスゲノムに突然変異が起こり、それが薬剤の直接的な作用に対するウイルスの感受性を変化させるというものである。しかし 2000年にWahlとNowakは、「クリプティック・レジスタンス」という用語を提案した(387)。これは、薬剤を投与可能な部位で変異を獲得することなく耐性化したウイルス集団を定義するものである。この仮説は、治療は定期的に代謝されながら、一定の間隔で投与されるため、患者の抗ウイルス薬の濃度が治療中に必ずしも一定ではないという事実に基づいている。2回の投与の間に、薬剤の濃度が非抑制的なレベルにまで低下することがある。この「暗号的抵抗性」という表現型は、ウイルスの持続的な複製を可能にするために、薬物濃度が最も低い期間に複製するようにウイルスがそのライフサイクルを適応させる状況を説明している。しかし、この考えは正式に証明されていない。したがって、持続的な(薬剤耐性の)高薬剤濃度でのウイルス増殖能力と一過性の(薬剤耐性の)高薬剤濃度でのウイルス増殖能力を区別するために、「クリプト抵抗性」という用語は、「同期化による薬剤耐性」に修正されている(388)。数理モデルを用いて、Neaguら(388)は、薬物治療に応答してウイルスのライフサイクルが適応することを示したが、これは、彼らが「ウイルスのライフサイクルと抗ウイルス薬物治療のパターンとの同期化」と呼んでいるプロセスであり、ウイルス薬物耐性のメカニズムである。この効果は、薬物投与の時期とウイルスのライフサイクルが密接に一致している場合に実現可能である(388)。しかし、この考えはin silicoの数学的モデリングに基づいているため、実験室や臨床現場での実証的な証拠が必要である。さらに、薬物耐性の現象を調節する可能性のある宿主因子の正確な性質は、まだつかみどころのないままである。さらに、薬物の組み合わせ、複数のウイルス感染(214)季節性などの複雑で動的な環境下での薬物耐性/同期化を評価するために、モデルシステムが必要とされている。
生体内試験への翻訳
争点となるのは、宿主主導の治療法は試験管内試験では人工物であるが、トランスレーショナルな応用はほとんどないということである(389)。例えば、IMPデヒドロゲナーゼ(IMPDH)阻害剤であるVX-497は、試験管内試験ではHCVの複製に障害を与えることができるが、生体内試験では障害を与えない(390-392)。これは、ヌクレオチドの性質および利用可能性が試験管内試験と生体内試験の条件下で異なる可能性があり、それによってIMPDH阻害剤の抗ウイルス効力に影響を与えるために起こる可能性がある(368)。別の例として、スタチン系薬剤が挙げられるが、これは試験管内試験では強力な抗HCV活性を有することがあるが(390,391,393-395)臨床的な有効性はない(396-399)。これは、スタチンの活性がコレステロールとの相互作用により生体内試験で阻害されることによって部分的に説明できるかもしれない。
宿主指示薬は宿主細胞の代謝を阻害するため、細胞毒性のリスクが高くなることが予想される。前述したように、PI4Kb阻害剤はエンテロウイルスに対して強力な抗ウイルス活性を発揮することが知られているが、マウスでは致死的であることが判明し、抗ウイルス薬としてのさらなる開発を妨げる可能性がある(400)。急性ウイルス感染症の治療は、宿主指向薬剤が使用される場合、慢性感染症の治療よりも問題が少ない(401)。これは、多くの宿主指向性化合物が、慢性ウイルス性疾患に対して長期間使用された場合、固有の細胞毒性の問題を有するからである。それは、心血管系および炎症性疾患または癌に対して臨床的に使用されている宿主指向性薬剤の大部分は、副作用が最小限または全くないということである(402)。例えば、非小細胞肺癌に対するFDA承認薬であるエルロチニブ(上皮成長因子受容体[EGFR]阻害薬)は、肺癌患者において安全で忍容性が高い(403)。同様に、臨床的に承認されている宿主誘導型HIV-1侵入阻害薬は、有害反応の報告がない(404)。それにもかかわらず、宿主指示型抗ウイルス薬の潜在的な安全性の問題は依然として大きな懸念であり、批判的に分析する必要がある。
まとめのコメント
ヒトゲノム/キノームに関する完全な情報が入手できなかった時代には、還元主義的なアプローチでは、通常、一度に単一の抗ウイルス宿主ターゲットしか特定できなかった。広範囲のキナーゼ、ホスファターゼ、およびその他の宿主因子に対する低分子化学的阻害剤のライブラリが利用可能になったことで、ウイルスの複製に必要な複数の細胞因子を迅速かつ同時にスクリーニングすることが可能になった。
このレビューでは、ウイルスが欠落した宿主因子の機能を突然変異誘発によって置換することは考えにくいため、これらの宿主因子のいくつかを標的とした薬剤を設計することが重要であるとしている。
しかし、ウイルスが代替の宿主因子を使用するように切り替えるか、または正常な宿主依存因子への親和性を変化させることができる例がある。ウイルスの複製およびウイルスと宿主の相互作用に関する現在の理解は、まだ完全ではない。ウイルス複製を媒介する細胞タンパク質の役割を解明するためには、生化学的アプローチ(細胞抽出物の使用や単一分子技術など)に基づく機能的・機構的研究と、新しいライブセルイメージング技術との組み合わせが不可欠である。また、ウイルスの複製を制御するために操作できる様々なエピジェネティックなプロセスを解析に加える必要がある。
最後に、ウイルスの増殖と高サイトカイン血症の両方を抑制する能力を持つ薬剤を組み合わせることで、ウイルス複製サイクルの複数のステップを阻害することができる抗ウイルス剤を選択することが好ましい戦略であることを提唱する。さらに、ウイルス指向性薬剤と宿主指向性薬剤を組み合わせることは、いくつかの組み合わせが有益な相乗効果をもたらす可能性があるため、有用なアプローチである。しかし、患者のコンプライアンスと薬物投与を向上させるために、細胞毒性が低く忍容性の高い効率的な宿主指向型抗ウイルス剤を開発することは困難な課題であると考えられる。
精密(個別化)医療、特に抗ウイルス治療の分野では、その利用と意味合いを理解することは比較的新しく、導入には時間がかかると思われる。将来的には、医学的な処方や治療がより個別化されていくことが予想されるため、個々の患者の包括的な情報(「オミックス」データ)を提供できる迅速で費用対効果の高い技術が不可欠となるだろう。