Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC6213774/
オンラインで公開2018年9月21日
エドワード・J・カラブレス
要旨
本論文は、ホルミシスが生物学の基本概念として認識され、毒性学、微生物学、医学、公衆衛生、農業など、生物のパフォーマンスを高めることに関連するすべての分野に影響を与えるようになった経緯を説明している。本論文では、ホルミシスがどのようにして正常な加齢に対する回復力を高め、神経変性疾患、心血管疾患、その他の疾患、さらには外傷やその他の健康や幸福に対する脅威から守ることができるかを評価している。また、パーキンソン病やハンチントン病などのいくつかの神経変性疾患へのホルミシスの応用、マクロファージの分極とその系統的な適応保護、幹細胞の機能強化と医療応用におけるホルミシスの役割などについても解説する。
キーワード
ホルミシス、用量反応、適応反応、プレコンディショニング、二相性、回復力、ホルミシス性
1. はじめに
線量反応の概念は、生物学、医学、そして公衆衛生の中心的なものである [1]。線量反応とは、細胞から個体までのあらゆるレベルの生体システムが、内因性物質、代謝プロセス、および外部から課せられたストレス因子/脅威に対して、どのように反応し、適応し、適応できないかを生物学的に統合したものである。線量反応は、毒性の誘発、修復、回復などの動的なプロセスを記述する線量-時間反応として評価すると、このような課題を捉え、生物学的/機械的な洞察を提供することができる [2]。したがって,生物システムは,進化的な適応戦略を持つ動的な存在であり,それは用量反応の性質に反映されている。
2. 歴史的文脈における線量反応
この文脈の中で、Muller [3]によって発見された放射線誘発突然変異に対する線量反応の概念に、放射線遺伝学の研究者がどのようにアプローチしたかを考えてみよう。この発見から3年以内に、Muller [4]は、X線による突然変異の線量反応は、すべての細胞タイプについて単一のイオン化まで線形であるという、いわゆる「比例則」を提案した[5,6]。この考え方は、その後、低線量リスク評価のための線形非閾値(LNT)モデルの作成につながった[7]。比例則は、現代の放射線遺伝学界では信頼できるものとして広く認められており、最終的には米国科学アカデミー(NAS)の原子放射線の生物学的影響(BEAR)遺伝学パネルに受け入れられ[8]、その勧告により、世界中のがんリスク評価にLNTモデルが採用されることになった。比例ルールとその直接的な規制である線量反応モデルであるLNTがんリスクモデルは、誘発される遺伝的損傷はすべて以下の3つの重要な仮定の産物である。1)修復不可能、(2)不可逆的、(3)累積的。このような機能的な仮定を総合して、電離放射線や化学物質による突然変異や発がんについて、線量反応が直線的になると考えたのである。
この線量反応仮説は、ショウジョウバエの成熟した精子における突然変異の研究に基づいてた。この仮説の形成とリスク評価への応用の時点では、DNA修復が存在することはもちろん、精原細胞が成熟精子に移行する際にDNA修復が失われたり、完全に分解されたりすることも知られていなかった。このように、米国NAS遺伝学パネル[8]が規制機関にリスク評価のためのLNTモデルを採用するという画期的な勧告を行ったとき、彼らは、X線や化学的変異原は修復不可能な突然変異を引き起こし、誘発された損傷は累積し、線量反応は線形であるという信念に完全にコミットしていた。放射線遺伝学界ではこのような信念が強固であったため、これらの誤った信念はすぐに公共政策となり、今日でも国の規制リスク評価方針に反映されている。
低線量での線形性に関するこの信念は、現代の著名な放射線遺伝学者であるオークリッジ国立研究所のWilliam Russellが、200万匹以上のマウスを用いたマウス特異的遺伝子座試験を用いて放射線誘発突然変異の反復研究を行ったことで、疑問視されるようになった(詳細なレビューは[9,10]を参照)。この場合、ラッセル[11,12]は生殖細胞の被曝の段階として(成熟精子ではなく)マウスの精原細胞を採用した。ラッセルは線量率という概念を発見した。つまり、突然変異のダメージは累積的なものではなく、放射線を照射する速度の関数であるということである。この発見は、長年にわたって遺伝学者が唱えてきた「不可逆」「累積」「線形」という言葉に真っ向から反していた。ラッセル[13]は、線量率の研究に基づいて、雌のマウスにバックグラウンドの電離放射線の約27,000倍の放射線を照射しても、未照射の対照群の突然変異率を超えない突然変異反応を示すことを報告した。これは、卵母細胞が静止した細胞ではなく、比較的高線量の放射線の影響を完全に防いだり修復したりすることができることを示すものである。これらの観察結果と精母細胞の観察結果から、ラッセルはDNA修復プロセスの存在を示唆している。その後4年間で、このようなDNA修復プロセスが存在し、非常に一般的なものであることが示され、最終的には構成的および誘導的な修復プロセスの発見につながり 2015年にはノーベル賞を受賞することになった。これらの発見は、成熟した精子はそのようなDNA修復を欠いているが、この欠損は生殖過程で卵子が提供する修復能力によって補われているという認識にもつながる。
ラッセルら[12]の線量率の発見は画期的な出来事であり、米国のNAS BEAR Genetics Panel[8]が成熟精子における反応を体細胞を含むすべての細胞に外挿したことに誤りがあったという認識につながった。ラッセルのこれらの発見は、放射線遺伝学者の線形線量反応のマントラがもはや有効ではないことを明らかにした[14,15]。このBEAR遺伝学パネルの誤り[8]は、次の米国NASのBEIR(電離放射線の生物学的影響)委員会でも認識されたが[16]、突然変異やがんのリスク評価における線形線量反応の科学的基盤を誤って提供したという点で、根本的な重要性を持っていた。BEIR委員会(1972年から最新の2006年まで)が認識していなかったのは、1927年に発表した研究で遺伝子の突然変異を起こしたというミュラーの主張も正しくなかったということである。現代のヌクレオチド分析によれば、ミュラーの突然変異は遺伝子の突然変異ではなく、主に小規模から大規模な遺伝子の欠失による染色体レベルの遺伝子変化であった[17]。したがって、LNTモデルは、ミュラーが遺伝子の突然変異を誘発したという誤った仮定に基づいて導き出された。これらの誤り(すなわち、成熟した精子から体細胞への外挿と、遺伝子変異の解釈の誤り)のいずれかがあれば、LNTモデルは無効になる。
また、ラッセルの発見は、1970年代半ばに化学的に誘発された突然変異に対する適応/修復反応の存在を証明した後続の研究の基礎となった [18]、その後、電離放射線に対する適応/修復反応の存在が証明された [19]。これらの適応反応/プリコンディショニングによる保護の発見は、がんの根本的なメカニズムと考えられていた突然変異の発生に影響を与えるという点だけでなく、プリコンディショニングの概念を、ホルミシス戦略によって予防/最小化できる他の膨大な種類の病気や傷害にまで拡大する道を開いたという点でも、重要な意味を持ってた [9,10]。
DNA修復やその他の適応プロセスが広範囲に存在することから、線形線量反応はせいぜい極めて限定的であり、複雑な生物系にはほとんど、あるいは全く適用できないと考えられるようになった[20]。様々なクラスの防御機構が発見されたことにより、新しい線量反応モデルが生まれたり、古い線量反応モデルが見直されたりした。電離放射線被曝の枠組みの中では、Azzamら[21]の劇的な発見があった。非常に低線量の放射線がDNA修復プロセスをアップレギュレートする能力を持ち、その結果、突然変異による損傷の量が正常な対照者よりも有意に少なくなったことから、ホルミシス的-二相性の線量反応の存在が示唆された。さらに、様々な実験モデルの環境から背景放射線を除去すると、健康状態が著しく低下するが、背景放射線を再導入すると元に戻ることが多くの研究で示されている[22,23]。
3. ホルミシスの概念
放射線による遺伝と突然変異の物語の基礎となるこの簡単な歴史的ヴィネットは、この研究コミュニティが、細胞から生物全体に至るまでの生物システムは動的ではなく静的であるという概念を持っていたことを示している。また、進化論に基づく放射線遺伝学者の研究者たちが、遺伝子修復プロセスの選択が進化の過程で起こり、それが突然変異の線量反応に反映されることを想定していなかったことも不思議であった。特に注目すべきは、Russell, Samson and Cairns [18]、Olivieri ら [19]、Azzam ら [21]の研究開発により、低線量域での線量反応は線形ではなく、おそらく閾値でもなく、おそらく二相性であることが示唆されたことである(すなわち、グラフ化する終点によってJ字型や逆U字型になる)。これらの所見は、その後、Luckeyによる代表的な書籍[24,25]で提供された電離放射線の線量反応情報の膨大な要約によって裏付けられた。これらの本は、ホルミシス的な線量反応は科学文献の中で非常に一般的なものであり、ホルミシスは例外や方法論上の誤り、あるいは背景の変動と混同された反応ではなく、進化上の期待であったはずだという前提を支持していた。
放射線遺伝学の分野でホルミシス性線量反応が広く知られるようになったことは、1970年代後半から現在に至るまで、生物学および生物医学の他の分野でも徐々に起こっている。これらの研究者は、化学物質の段階的な低線量を測定するための新しい分析ツールを開発し、1980年代の試験管内試験革命を利用して、幅広い濃度範囲で多数の濃度を試験することが可能になった。これらの進展は、Web of Scienceデータベースにおけるホルミシスまたはホルメティックという用語の年間の引用数に反映されている。1980年代の10年間では、この数は年間10~12件程度であったのに対し 2017年だけで9300件以上と劇的に増加しており、強力なメカニズムのフレームワークを持つホルミシス線量反応の高度に学際的な報告を反映している。
4. 医学、薬理学、毒性学が用量反応を半狂乱にした理由
ホルミシスの概念は、上記のような細胞モデルや評価法の発展により著しく加速されたが、その歴史は約130年であり、酵母の代謝に対する約10種類の消毒剤の影響に関するHugo Schulz [26,27]の知見に始まる。Schulzの研究は,ホメオスタシスの初期崩壊に対する適度な過剰補償反応という枠組みの中で,二相性の用量反応を確立した点で重要であった。この研究は、生物が毒性物質に対して最初に有害な反応を示し、そのように誘発された損傷に対して適度な修復的過補償(すなわち低用量の刺激)で反応する能力を明らかにした。シュルツの研究は、複数のグループによって再現され[28]、広範囲に拡大・一般化されたにもかかわらず[29,30,31,32,33]、シュルツは発見直後に、二相性用量反応をホメオパシーの実践と結びつけ、その説明原理を発見したと主張するという根本的な誤りを犯した[34]。シュルツのこの行動は、強力な伝統医学界からの長期にわたる科学的・職業的・個人的な反発を招き、彼のキャリアを縮小させ、二相性用量反応/ホルミシスの概念の受け入れを大きく阻害した[34,35,36]。
シュルツと彼の二相性線量反応(彼はArndt-Schulz法と呼んだ)は、伝統医学界の指導者たちから激しく、容赦なく異議を唱えられ、嘲笑されたが[37,38,39]、シュルツのプロとしてのキャリア(1880年から 1932)の間に、多くの独立した研究者たちが、様々な生物学的モデル、特に微生物学、植物生物学、昆虫学の分野で、多くの化学物質や電離放射線を用いて、同様の二相性線量反応の知見を報告している[29,30,31,32,33]。しかし、様々な理由により(Calabrese[5,36])二相性線量反応の概念は科学の主流に組み込まれることなく、疎外され続けていた。1970年代に入ると、電離放射線に関するミズーリ大学のLuckey [24]、重金属の海洋毒性を研究した英国プリマス海洋研究所のTony Stebbing [40,41]、薬理学的な二相性用量反応関係を多数報告し、それらを受容体に基づくメカニズムの枠組みに組み込んだリバプール大学のElmer Szabadi [42]らの科学的リーダーシップにより、この状況は変わり始めた。これら3人の独立した研究者は、1985年8月にカリフォルニア州オークランドで開催された第1回ホルミシス会議(1987年に『Health Physics』誌にピアレビューされた議事録が掲載されている)をきっかけに、ホルミシスによる二相性線量反応の変化のための重要な知的基盤を提供した。
その後の数十年間で、ホルミシスによる線量反応が一般的であり、微生物、植物、動物の広範なモデルで発生していることが実質的に証明され、広範な一般性が示唆された[43,44,45]。同様に,ホルミシス応答の発生は,広範囲の薬剤によって誘発され,同様に広範囲のエンドポイントに影響を与える可能性がある[46,47,48]。このような努力の結果,約40の研究に関連する実験および用量反応の特徴に関する情報を含む,継続的に拡張されたホルミシスデータベースが開発された。
ホルミシスの用量反応を示す生物学的モデル,誘発剤,およびエンドポイントはかなり多様であるにもかかわらず,これらには1つの非常に一貫した共通の特徴があり,すなわち,それらの量的特徴は類似している。これは,低用量の刺激が直接的な刺激によって生じた場合でも,初期の毒性反応に対する過剰補償によって生じた場合でも同様であった[49].最大時の刺激反応の大きさは一般的に控えめで、最大範囲は対照群よりも約30~60%大きいものであった。この知見は、ホルミシス研究の数が数百から数千に増えるにつれて再確認され、ホルミシスの最も予測可能な特徴となった。このささやかな刺激的反応は、生物学的モデル、生物学的組織のレベル、エンドポイント、誘発剤に依存しない。また,後にメカニズムにも依存しないことが示された[50].このことは,ホルミシスが生物学的可塑性の一形態を定量的に説明していることをさらに示唆している[51].
このような生物学的に深遠な発展は,膨大な数の用量反応とその定量的な特徴,および機構的な特徴を研究することによってもたらされた。さらに,ホルミシスの用量反応の定量的な特徴も生物学的にモデル化され,膨大な種類の重要な生物学的パラメータを体重や体表面に関連付けるものと同様のアロメトリックなパターンを反映していた[6]。このように、ホルミシスは生物学の基本原理であり、自然淘汰の産物であり、高度に保存されていることを示している。この生物学的原理は,ホメオパシーと伝統医学との長期にわたる対立や,ホルミシスの概念が主流の科学活動から排除されていたこと,比較的低用量での適度な反応を研究する上での固有の課題などのために,何世代にもわたって生物学および生物医学の科学者たちに見過ごされていた[34]。これらの重要な特徴、理解、洞察は、ホルミシスに長期的に一貫して焦点を当てた結果、1990年代半ば以降に追加されたものである。
ホルミシスは,生物学的可塑性の大きさと限界を規定するものであるため,薬剤開発,疾病抵抗性,および,プレコンディショニングやポストコンディショニングなどの手順によって生物学的性能を向上させ,回復力を獲得することを目的としたその他の活動に対して,広くかつ重要な意味を持っている[9,10]。可塑性の制約はホルミシス量反応の定量的な特徴によって定義されるため,この観点からは,生物学的性能が最大で30~60%の範囲に制限されることを製薬・農薬業界に伝えることができ,臨床,実験室,および野外での研究デザインや商業製品の開発に重要な意味を持つ。
ホルミシス刺激反応の最大値の評価は、一種の生物学的最適値を表している。その最適なホルミシス刺激反応が閾値以下のゾーンのどこに存在するかを正確に判断することは、可能性のある治療薬のテストにおいて重要である。ホルミシス・データ・ベース[46]を用いると,ホルミシス刺激反応は,通常,推定閾値の10〜20倍下のゾーンに存在することが多い。ホルミシスのデータベース[46,47]を用いて,閾値以下の用量の数が,最適な用量(すなわち,最大の刺激反応をもたらす用量)を検出する能力に影響を与えるかどうかを評価した。この一連の評価により,閾値以下の1用量では,観察された最大刺激反応は対照反応よりも約20%高いことが明らかになった。しきい値以下の用量が6-7回になると、観察された最大刺激反応は対照値の約60%にまで漸増した。このように、臨床試験では1~2回の投与量を使用する傾向があり、そのような試験では生物学的に可能な値よりも低い最大刺激が得られることが示唆される。このことは、有意な治療効果を検出するためには、より大きなサンプルサイズが必要であること、および/または、ホルミシスゾーン内に治療群を追加する必要があることを示唆している。閾値以下の投与回数が最大ホルミシス刺激にどのように影響するかについてのこの洞察は、この関係が試験が試験管内試験または生体内試験で行われたかどうか、また生物学的モデルやエンドポイントに関係なく発生したことから、あらゆる種類の試験でホルミシス投与反応を評価することに関心のある人々にとって要因となる可能性がある。
5. ホルミシスの応用
ホルミシス量反応は、ハザード評価、発がん性物質のリスク評価、内分泌かく乱作用、生物学的パフォーマンスを向上させる医薬品・天然物、適応メカニズムをアップレギュレートしてレジリエンスを高めるコンディショニング前後の活動などの分野で重要な意味を持つ。
5.1. ハザードアセスメント
ホルミシスは、いくつかの点で危険有害性評価プロセスの指針となる。ホルミシスは、特に背景となる疾患の発生率に関連して、評価対象となる生物学的モデルの選択に科学的根拠を与える。ホルミシスは、線量反応モデルの枠組みを提供し、採用する線量数、線量間隔、及びサンプルサイズの選択を支援する。また、ホルミシスは、代償反応の可能性を評価するための時間をかけた繰り返しのサンプリングに関する決定にも影響を与える。ホルミシスに基づくこれらの知見は有用であり、このような研究の質と実用性を高め、知見の信頼性を高めると同時に、生物統計学的モデルの検証を行うことができる。しかし、これらの要素は、実験の費用と期間を増加させるという問題がある。さらに、しきい値以下の用量を特定するためには、しきい値が発生しやすい場所を知り、適切な研究デザインで低用量のホルミシス刺激領域をより正確に特定する必要がある。そのためには、閾値が発生しそうな線量域をより明確にするための予備的な実験を追加する必要がある。このような実験上の課題により、ホルミシス仮説の評価や低用量反応の再現性のある知見を得ることが難しくなる。これは、対照群が特に変化しやすい場合には厄介なことになる。さらに、対照群の変動に関する情報をきちんと記録しておくことも重要だ。このような要素を考慮に入れないと、観察されたホルミシス様の二相性の用量反応が再現可能な効果なのか、それとも単に背景の変動によるものなのかについての信頼性が低下する可能性がある。
5.2. 発がん性物質のリスク評価
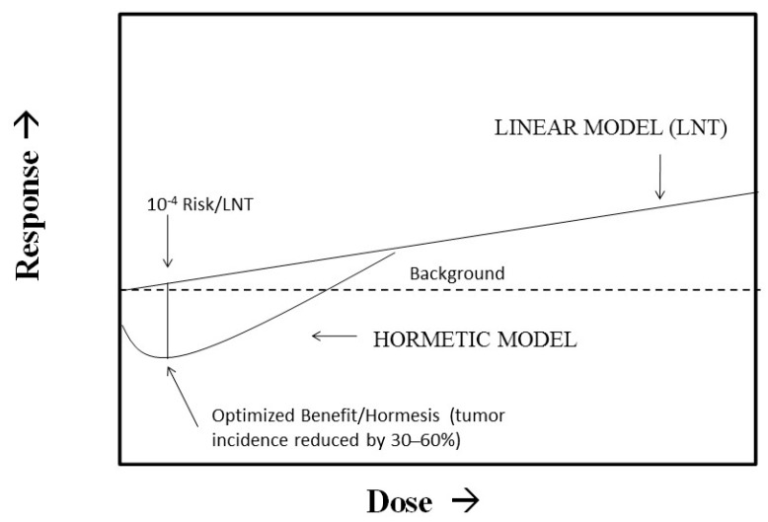
最近、環境保護庁(EPA)のような規制機関が、がんのリスク評価におけるデフォルトモデルとしてLNTを使用することから脱却し、ホルミシスのような非線形線量反応モデルの使用を検討することが提案されている。Calabreseら[52]は、このEPAの提案は、LNTモデル、閾値モデル、ホルミシスモデルの最良の特徴を統合した「モデル最適化」アプローチで実施できると提案している。我々は以前、慢性毒性の閾値リスク評価法に一般的に用いられているベンチマーク用量(BMD)に100倍の不確実性因子を加えた方法を用いると、健康上の利益が最適化されるホルミシス曲線の直下にある同じ用量に密接に近似することを示した[53]。この線量は、LNTリスクが約10-4であることも示している(図1)。したがって、このモデルの不確実性のアプローチにより、ホルミシス曲線の直下で最適化された線量から上下のいずれかに線量が変化したときに集団のリスクが増加するという、一種の規制のスイートスポットが特定された。このアプローチでは、LNTが不確実性の上限であり、ホルミシスモデルが下限であると考えられる。この方法では、最適化された線量においてリスクの解釈が異なっていても、閾値モデルを介してホルミシス学的アプローチの線量収束の検証を行うことができる。ホルメットモデルが正しければ、リスクのある集団には大きな健康上の利益がもたらされる。しかし、ホルミシスモデルが正しくなく、LNTが完全に正しかった場合、その影響は最も強力な疫学研究でさえも検出できないだろう。実際、リスクの増加はバックグラウンドのがんリスクの約1/500にとどまるため、このモデル不確実性アプローチによるがんリスク評価は、公衆衛生の観点から実用的で魅力的なものとなっている。
図1 リスク評価のためのホルミシスとLNT(linear non-threshold)の統合
出典:Calabrese er al)。 [52]).
5.3. ホルミシスの有害な影響
低用量の内分泌かく乱剤は、ホルミシスの用量反応の定量的特徴に非常に近い二相性の用量反応を介して作用するものがある。例えば,いくつかの動物モデルでは,低用量のビスフェノールA(BPA)が前立腺の大きさに二相性の影響を与え,ホルミシス反応領域で最大の増強が見られた[54].数十種類のヒト腫瘍細胞株で試験したところ,多くの抗腫瘍剤で同様のタイプのホルミシス様二相性生物学的反応が見られた[55].同様のホルミシス効果は、広範なスクリーニングアッセイにおいて、多数の抗生物質についても報告されている[56]。この他にも、低用量の刺激が悪影響と考えられる例は数多くある[44]。これらの効果の大きさは、生物学的な可塑性の範囲によって制約される。
5.4. 医薬品
抗不安薬(図2)[54]や抗てんかん薬(図3)[57]をはじめとする様々な医薬品には、ホルミシスの特徴が見られる。前臨床試験では,これらの薬剤は一様にホルミシス的な用量反応を示す。このような動物モデルでの知見に基づいて、最適化された用量が選択され、ヒトを対象とした試験が行われる。このように、製薬業界ではホルミシス学的用量反応に基づいた製品ポートフォリオの分野が充実している。記憶力向上剤の分野も同様に、ホルミシス用量反応を示している[58]。米国FDA(Food and Drug Administration)でヒトへの使用が承認されたアルツハイマー病(AD)治療薬はすべて,前臨床試験結果においてホルミシス量反応を示している[58]。アルツハイマー病患者の脳内にβアミロイド斑が蓄積するのをいかに防ぐかという研究が盛んに行われているが、βアミロイドには本質的な生物学的機能があり、ホルミシス的二相性で作用する[59](図4)。AD研究者の間では強調されてきた知見だが、いまだにほとんど評価されておらず、臨床的にも利用されていない。さらに,ALS(筋萎縮性側索硬化症)の治療薬として最も長く承認されているのはリルゾール[60]であるが,リルゾールの保護機能はホルミシスプロセスの誘導を介している(図5)。
図2 抗不安薬ホールボードテストにおける(dl-THP)処理雌雄ICRマウスのヘッドディップ回数/5分
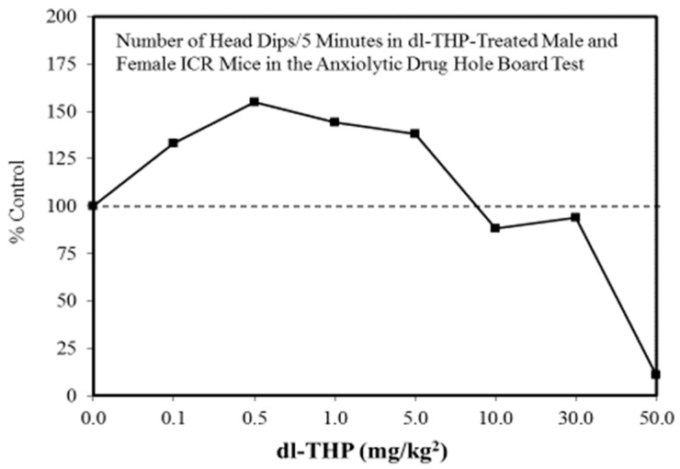
(出典:Leung er al[67])
図3 ペンチレンテトラゾール(PTZ)誘発性発作閾値に対するモルヒネの異なる用量の効果
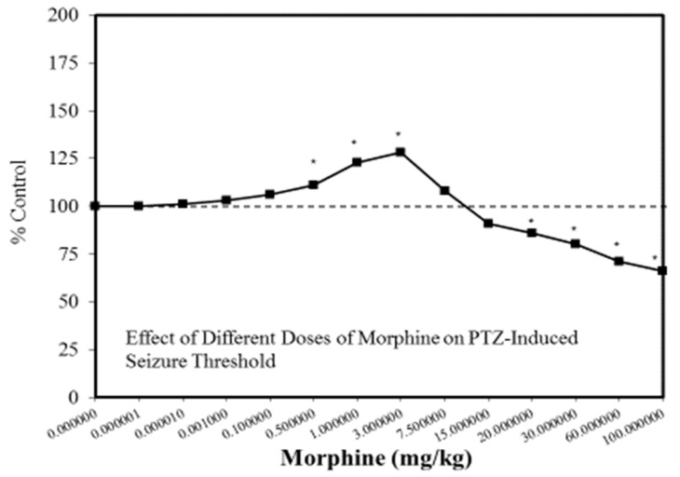
(出典:Honarら[68])
図4 βアミロイドペプチド(Aβ)42は海馬の長期増強にホルミシス作用を及ぼす
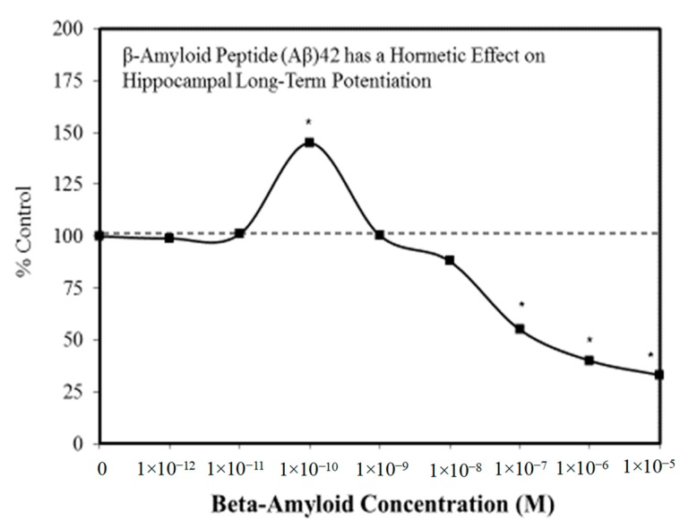
(出典:Puzzoら[59])
図5 ラット脊髄シナプトソームにおけるグルタミン酸取り込みに対するリルゾールの効果
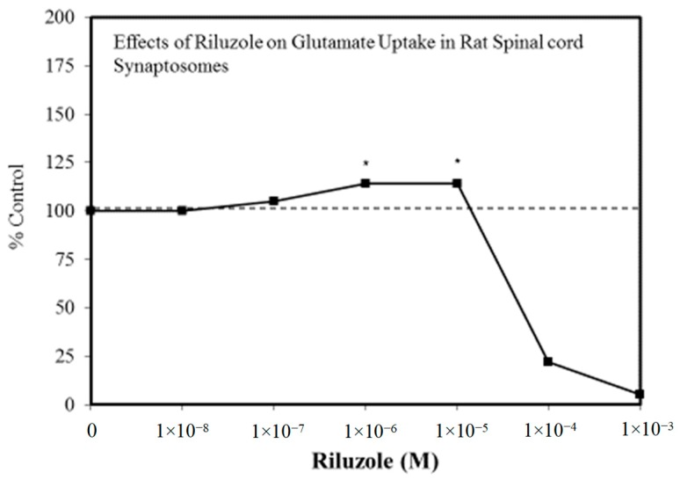
(出典:Frizzoら[60])。
5.5. パーキンソン病とハンチントン病
パーキンソン病やハンチントン病(HD)の有効な治療法の探索には、さまざまな予測実験モデルが用いられている。Calabreseら[61,62]は、パーキンソン病(PD)に対する有望な化学予防剤が広く存在することを報告している。この評価では、約50の薬剤がホルミスティックなプロセスを介して化学的保護に影響を与えることがわかった(図6および図7)[62]。可能性のあるPD治療薬の多数のホルミシス学的な例は,比較的多くの濃度を組み込んだ細胞モデル系を使用することによって強化され,治療領域における用量反応の特徴をより詳細に評価することができるようになった。これは、ホルミシスの枠組みの中で、潜在的な創薬や治療法を探り、評価し、組み立てるという新しい試みである。これは、HDについても同様で、試験管内試験(図8)[63]および生体内試験実験モデル(図9)[64]において、ホルミシスによる二相性の用量反応の例が数多く見られる。PDとHDの両方の場合、実験プロトコルにはホルミシス・プリコンディショニング・プロトコルが多用されている。他の実験プロトコルでも、疾患プロセスの開始時に投与された場合や、ポストコンディショニングの枠組みの中で投与された場合に、ホルミシス作用が示されている。このように様々な疾患を引き起こすプロトコルの中で、薬剤がホルミシスプロセスを活性化する能力を持つことは、ホルミシスが治療だけでなく予防にも利用できることを示す重要な観察結果である。同様の展開は,多発性硬化症など他の神経疾患の予測モデルでも報告されている[65,66]。
図6 投与24時間後のPC12細胞(=パーキンソン病細胞モデル)の細胞生存率に対するベルベリンの効果
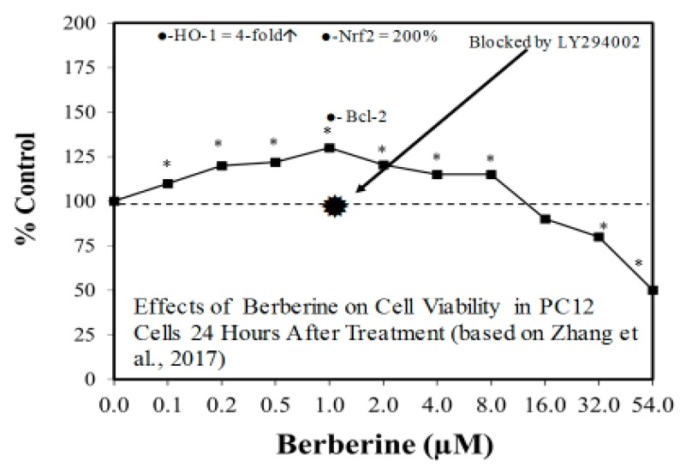
(出典:Zhangら[69])
図7 24時間後の6-ヒドロキシドーパミン(6-OHDA)のプレコンディショニングプロトコル内でチャレンジしたPC12細胞の細胞生存率に対するベルベリンへの事前暴露の効果
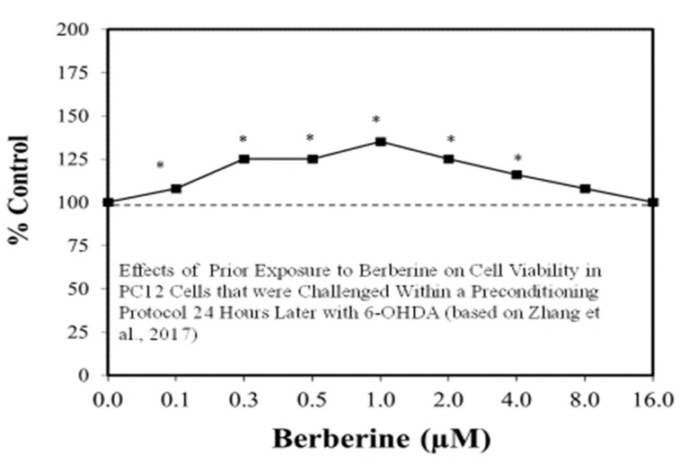
(出典:Zhangら[69])。
図8 試験管内試験のハンチントン病モデルであるST14A細胞に対する化学予防剤の効果
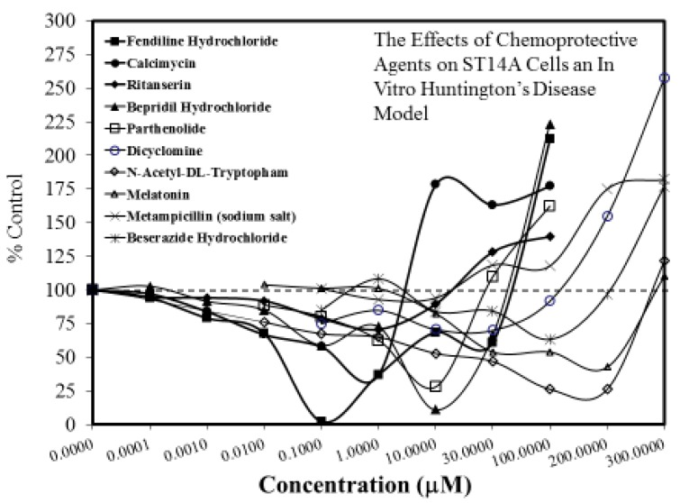
(出典:Wangら[63]-表S1)。100%未満の反応では保護作用が、100%以上の反応では毒性が生じる。
図9 スナネズミの一過性局所脳虚血後の神経学的悪化および梗塞に対する3-ニトロプロピオン酸(3-NP)のプレコンディショニング
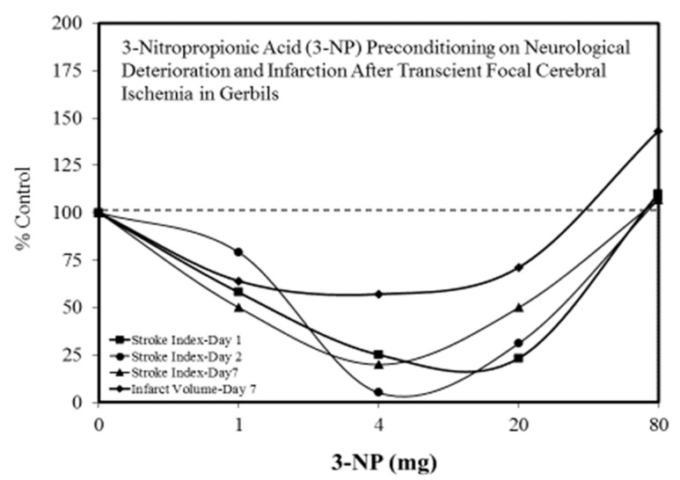
(出典:Kuroiwaら[68])
6. ホルミシスのメカニズム
ホルミシスにおけるメカニズムの役割は、過去10年間で著しく進歩した。ホルミシスの概念が深く掘り下げられ始めた1990年代には、再現性のあるホルミシスの例は数多くあったが、そのような反応のメカニズム的な根拠は非常に限られており、しばしば推測の域を出なかった。しかし、細胞のシグナル伝達経路や、生物学的プロセスを活性化する受容体との関連性に関する研究が大きく進展したことで、この状況は変わった。2013,Calabrese [50]は、400種類のホルミシスの用量反応関係のメカニズムを、受容体と細胞シグナル伝達経路のレベルで文書化した。この評価では,膨大な種類のメカニズムがホルミシス反応を媒介していることが示された。ホルミシスの用量反応の定量的な特徴は、メカニズムとは無関係であった。このことは、ホルミシスの定量的特徴が、なぜ、どのようにして、系統、臓器、細胞型、エンドポイント、近縁のメカニズムを超えて類似しているのかという疑問を提起するものである。CalabreseとMattson[51]は、アロメトリック遺伝子群から出現する可能性のある調節生物学的プロセスを特定した。これらの遺伝子は、体全体の大きさに対する臓器の大きさの関係など、重要な生物学的形質を制御している。ホルミシスの用量反応もアロメトリックモデリングに準拠しており、この生物学的根拠に基づくアロメトリックアーキテクチャー遺伝子群の枠組みで評価することができる。このような形質は、単細胞生物からヒトまでの全体的な形態と機能のパラメータに関する洞察を提供し、近縁のメカニズムとは無関係にホルミシスの最大応答が30-60%増加する仕組みの基礎を示す手がかりとなるかもしれない。
マクロファージの極性化
過去20年間の大きな進展は、マクロファージが酸化促進型(M1マクロファージと呼ばれる)または抗炎症型(M2マクロファージと呼ばれる)に再プログラムできることが認識されたことである。プレコンディショニングの場合、このプロセスはマクロファージをM2形態に偏らせ、防御/回復/抗炎症反応を促進する。我々は最近、M1またはM2マクロファージ形態への分極を伴うマクロファージのリプログラミングは、シグナル伝達物質の濃度勾配を介して行われるのではないかという仮説を立てた。総合的な評価の結果、多くの物質が、ホルミシスの用量反応に適合する濃度勾配に従って、マクロファージの分極を媒介することが明らかになった[70,71]。この濃度勾配を利用した制御戦略は、すべての臓器に影響を与えるほど広範囲にわたっている。この分野を研究しようと思った最初のきっかけは、低線量の放射線が腫瘍細胞を死滅させる一方で、抗炎症表現型を作り出すことで炎症状態を改善するという観察結果に基づいている[72,73]。放射線によって誘発される酸化防止および抗炎症の表現型の発生をよりよく理解しようとすると、上述のように課題が大きく拡大した。ホルミシスの概念をマクロファージの分極に統合すると、炎症過程を制御することで、腫瘍細胞や有害な微生物の排除を促進したり、逆に炎症過程を抑制して濃度勾配プロセスにより治癒を促進したりできることが明らかになった。これらの発見は、生物学的調節プロセスの文脈におけるホルミシス概念の生物医学的/治療的意義と、その生物学的/臨床的応用を拡大するものである。
7. 幹細胞生物学とホルミシス
広範囲の幹細胞において、ホルミシスによる線量反応が起こることについては、かなりの文献が存在する。このような幹細胞のホルミシス反応には、直接的な刺激による線量反応のほか、プレコンディショニングの枠組みの中で誘発されるものもある。幹細胞のホルミシス量反応の定量的な特徴は、他のすべての細胞タイプと同様である[47]。特に、心臓発作や脳卒中のような様々な疾患による損傷後の組織再生という潜在的な治療の枠組みの中で、幹細胞を用いたプレコンディショニング・ホルメティック・プロトコルに注目が集まっている。ホルミシスを利用することで、注入された幹細胞が非常に困難な生物学的微小環境を生き延びる能力を高め、組織修復の可能性を高めることが期待されている[74,75,76,77,78]。ホルミシスデータベースの評価によると、数十種類の薬剤が幹細胞にホルミシスを誘発しており、電離放射線、低酸素、レスベラトロールを用いた研究が最も盛んに行われている。
8. 考察・結論
本論文は、本特集のテーマである「デイブレイク・ホルミシス」に沿って書かれたものである。ホルミシスは科学的には「成人」であるにもかかわらず、最初に報告されたのは1880年代であり、過去1世紀の間に多くの生物学的分野で多くの優れた研究が行われていた[29,30,46,47]。このように、ホルミシスの夜明けがこれほど大幅に遅れたり、生物学の基本的な原理が1世紀以上も科学界に見過ごされたりするはずがないと考えられていたのである。ヒューゴ・シュルツがホルミシスをホメオパシーと結びつけていなければ、また、ホメオパシーが伝統医学と呼ばれるものと経済的にも知的にも大きな戦争をしていなければ、このような奇妙な歴史的状況は起こらなかったであろう[35]。ホメオパシーはこの現実の戦いで大敗したが、伝統医学はその「説明原理」であるホルミシス概念にも敵意を示した。このようにして、アルフレッド・J・クラークのような薬理学界の主要な世界的リーダーのリーダーシップを介して、ホメオパシーは医療行為としてはほぼ解体されてしまい、シュルツは非常に急上昇したキャリアがすぐに失速し、回復することはなかった。実際、アメリカでは1900年には23のホメオパシー医学校があったが、約20年後には3校しかなかった[79,80]。ホメオパシーの運命が強烈な下降線を描いていたように、その「説明原理」も下降線を描いていた。ホルミシスは主要な教科書には掲載されておらず、研究費からも除外され、主要な教育機関の教員には研究を強く勧められていた。つまり、あるアイデアに一種の死刑宣告が下されたのである。これは、学術的にも、世界の規制機関でも同じことが言える。このような不可能に近い状況に加えて、ホルミシスの研究は非常に困難であり、より多くの用量、より多くのサンプルサイズ、より多くの再現性が求められ、さらに閾値ゾーンをより明確にするための予備的な調査が必要であった。これらの問題に加えて、この分野の研究者たちのリーダーシップと組織力が決定的に不足していた。これについてはかなり深く調査されており,1920年代と1930年代にホルミシス研究をリードしていた研究者の多くが組織の主要な管理職に移ったため,この問題を抱えた駆け出しの分野が成長する機会を失っていたことが判明している[36].これは、科学界がホルミシスの意義を研究し、評価し、場合によっては認めることができなかったことを意味する。皮肉なことに、このようにホルミシスの概念が理解されなかったのは、伝統医学がホメオパシーとの戦いに勝利した結果である。つまり、伝統医学は戦争には勝ったが、ホルミシスの概念を否定することで、専門家や一般の人々に損害を与えたのである。この状況をさらに問題にしているのは、ホルミシス線量反応を説明するのに、膨大な数の用語が使われていることである。実際、非常に大規模なホルミシスのデータベース[47]には、入力された研究のうち、ホルミシスやホルメティックがキーワードとして使用された研究の情報は約15%に過ぎない。このように、ホルミシスまたはホルメティックという2つのキーワードを使った文献では、ホルミシス線量反応は簡単には見つからない。
ホルミシスへの過去1世紀の挑戦は、その効果が漸近的な回帰の中で希薄になり、影響力を失っている。ホルミシスに焦点を当てた過去30年間の熱心な研究は、このような歴史的反感と科学的課題の泥沼を乗り越え、ホルミシスの一般性とその潜在的な医療、公衆衛生、農業への影響を確立する大きな進歩を遂げた。
ホルミシスは現在、毒性学、薬理学、および関連する生物医学分野の主要な教科書に掲載されている。ホルミシスは、生物老年学、神経科学/神経変性疾患、運動科学、および公衆衛生に関心のあるその他の分野における優れたリーダーシップから大いに恩恵を受けている。ホルミシスは、研究者が多くの領域で重要な生物学的疑問に答えるのに役立つ中心的な生物学的概念であると考えられるようになっている。このように、130年の歳月をかけて、ホルミシスがついに科学的な転換点を迎えたことを、Hugo Schulz氏は誇りに思っていることであろう。