Contents
Highly Selective Activation of Heat Shock Protein 70 by Allosteric Regulation Provides an Insight into Efficient Neuroinflammation Inhibition
www.ncbi.nlm.nih.gov/pmc/articles/PMC5605382/
Li-Chao Wang,a,b Li-Xi Liao,a Hai-Ning Lv,a Dan Liu,c Wei Dong,d Jian Zhu,d Jin-Feng Chen,a Meng-Ling Shi,a Ge Fu,a Xiao-Min Song,a Yong Jiang,a Ke-Wu Zeng,a,⁎ and Peng-Fei Tua,b,⁎
概要
熱ショックタンパク質70(Hsp70)は、免疫疾患に広く関与していることから、炎症疾患の創薬ターゲットとして注目されている。炎症治療のためにHsp70の発現を非選択的に誘導すると、炎症とは無関係なタンパク質の機能が大きく阻害され、副作用が生じる可能性がある。しかし、特定の機能性アミノ酸残基を標的としたHsp70の直接的な薬理学的活性化は、Hsp70の正確な機能制御への洞察をもたらし、これまであまり注目されていなかった炎症に対するより満足のいく治療効果をもたらす可能性がある。ここでは、天然の低分子ハンデリンを用いて、Hsp70を選択的に活性化するシステイン残基(Cys306)を示している。Cys306を共有結合で修飾することで、Hsp70の活性が著しく上昇し、より満足のいく抗神経炎症効果を示す。また、ハンデリンによるCys306の修飾は、Hsp70のアデノシン三リン酸加水分解能力を促進するアロステリックな制御を誘発し、後続の炎症シグナル経路を効果的に遮断することが機構的に明らかになった。本研究は、機能的なシステイン残基を標的としたHsp70の直接的な薬理学的活性化に関するいくつかの知見を提供するものであり、ヒトの神経炎症の病因を正確に、かつ望ましくない副作用を少なく制御する強力なツールを提供するものである。
キーワード
熱ショックタンパク質70(Hsp70)ハンデリン、ドラッグターゲット、共有結合修飾、神経炎症
図解でわかること
1. はじめに
熱ショックタンパク質(Heat Shock Protein: HSP)は,ストレス条件にさらされているすべての生物種に存在するストレス応答タンパク質のファミリーである(Kityk er al)。 HSPの代表的なメンバーであるHSP70サブファミリーは、さまざまなストレスから生物を守る過程で重要な役割を果たしている(Morimoto, 1998, Jäättelä, 1999, Jian et al 2016, Yu er al)。 HSP70サブファミリーには、小胞体に存在するHsp70(ストレス誘導性Hsp70とも呼ばれる)構成的に発現するヒートショックコグネイト70(Hsc70)ミトコンドリアのグルコース調節タンパク質75(GRP75)GRP78が含まれる(Jäättelä, 1999, Tsan and Gao, 2004)。Hsp70(またはHSPA、ヒトではHSPA1A遺伝子にコードされる)は、細胞のストレス時に高発現し、アデノシン三リン酸(ATP)依存性の分子シャペロンとして機能し、新しく合成されたタンパク質の適切な折りたたみを助ける(Alexander and Vladimir, 1997, Gething and Sambrook, 1992)。そのため、Hsp70は複数の疾患に対する重要な治療ターゲットとなっている。
近年、Hsp70は、細菌感染、大腸炎、自己免疫性関節炎、糖尿病、肥満、神経変性疾患など、さまざまなヒトの炎症性疾患と関連していると言われている(Chung et al 2008,Tanaka et al 2007,Tanaka et al 2014,Van Eden et al 2005,Van Herwijnen et al 2012,Van Noort et al 2008)。そのため、炎症反応の過程におけるHsp70の役割にますます注目が集まっている。現在、Hsp70を標的とした免疫制御戦略は、主に転写および翻訳レベルでのHsp70遺伝子発現のアップレギュレーションに焦点を当てている(Bianchi et al 2014,Wieten et al 2010,Yoo et al 2000)。しかし、Hsp70は重要なシグナル伝達のハブタンパク質として働き、多くの生理学的プロセスに広く関与している。したがって、非特異的なHsp70遺伝子の誘導は、Hsp70に関連する細胞内シグナル伝達経路の広範な障害、あるいは望ましくない薬物有害反応を引き起こす可能性がある。異なるタンパク質部位を標的とする低分子化合物は、異なるタンパク質の機能に影響を与えることがよく知られている。したがって、機能ドメインの特定のアミノ酸残基を標的としてHsp70を直接薬理学的に活性化する研究は、Hsp70の機能をより正確に制御することができ、治療の可能性を高め、副作用を減らすことにつながる。
神経炎症反応におけるHsp70の直接的な薬理学的制御の重要性を考えると、新規の機能制御部位の発見に関する洞察は、神経炎症疾患の治療薬の開発を促進する上で必須のものである。Hsp70は、ATPの加水分解を促進するN末端のヌクレオチド結合ドメイン(NBD)と、基質を結合するC末端の基質結合ドメイン(SBD)からなる共通のドメイン構造を持ち、構造的にも非常に保存されている(Kityk et al 2012, Mayer, 2013)。NBDとSBDのドメイン間の相互作用が、Hsp70の多機能を実現している。これまで、Hsp70の特定のアミノ酸残基を化学的に直接標的とすることで、神経炎症を効果的に治療する方法は報告されていない。
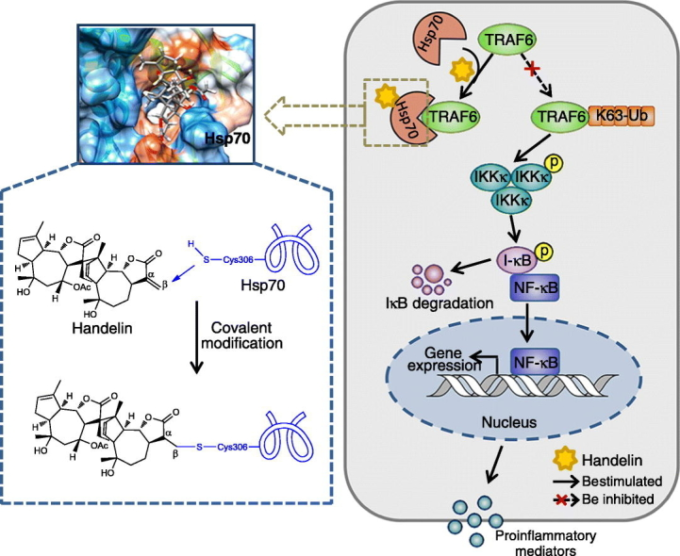
本研究では、天然の低分子化合物handelinを、神経炎症を抑制する選択的なHsp70活性化剤として同定した。ハンデリンは、共有結合によるマイケル付加反応を介してHsp70のシステイン306(Cys306)を特異的に修飾することができ、これまで認識されていなかった神経免疫学の低分子制御メカニズムを示唆している。さらに、Hsp70のCys306にハンデリンを特異的に修飾することで、ATP触媒ポケットにアロステリック効果が生じ、ATPがアデノシン二リン酸(ADP)に加水分解されるサイクルが促進されることが示唆された。さらに、このアロステリック効果は、Hsp70がTNF受容体関連因子6(TRAF6)との相互作用を促進し、TRAF6のリジン63特異的なユビキチン化をさらに阻害することで、核内因子-κB(NF-κB)の炎症シグナル経路の下流を不活性化することにつながる。ハンデリンは、Hsp70遺伝子誘導剤であるゲラニルゲラニルアセトン(GGA)よりも副作用が少ないことも注目された。
今回の研究では、Hsp70を特別に活性化して神経炎症を抑制するために、システイン306が薬効のある残基であることが明らかになった。さらに、Hsp70を選択的に活性化するための天然の分子足場を示している。これらの結果は、特定のアミノ酸残基を標的としたHsp70機能の直接的な薬理学的制御についての知見を提供するとともに、将来の合理的な薬物設計の指針となり、ヒトの神経免疫疾患をより少ない副作用で治療することができると考えられる。
2. 実験手順
2.1. 化学物質と試薬
Handelin (C32H40O8; 分子量552.6552)は、Baoji Herbest Bio-Tech Co. 中国山西省)から入手し,H1NMRおよびMSデータで確認した。純度はHPLC法により98%以上であることが確認された。脂肪酸を含まないウシ血清アルブミン(BSA)は,Equitech-Bio, Inc. (Kerrville, TX, USA)から入手した。パルミチン酸(PA,TCI,上海,中国)は,ストック溶液として絶対エタノールに溶解した後,10%BSAと共役させて,既述のように100μMの濃度にした(Li er al)。 組換えヒトHsp70タンパク質は、Sino Biological Inc. 中国・北京)から入手した。
iNOS(2982)COX2(12282)GAPDH(3683)HSP70(4873)HSC70(8444)K63-Ubi(12930)に対する抗体。K48-Ubi(8081)、p-IKKα/β(2697)、IKKα(11930)、IKKβ(8943)、p-IκB-α(2859)、IκB-α(4814)、p-NF-κB p65(3033)。NF-κB p65(8242)HA-Tag(3724)His-Tag(2366)TRAF6(ab94720)IL-1β(12242)TNF-α(11948)ウサギIgG(7074)およびマウスIgG(7076)は、Cell Signaling Technology(Beverly, MA, USA)から購入した。Iba-1(ab178680)CD11b/c(ab202907)およびCD68(ab31630)に対する抗体は、Abcam Biotechnology(Cambridge, UK)から入手した。
2.2. プラスミドとCys変異体
ヒトのHsp70またはTRAF6を、N末端領域にHisまたはHAタグ配列を含むpcDNA3.1ベクターにクローニングした。鋳型としてHAタグ-Hsp70を用い、QuikChangeサイト指示変異導入キット(Agilent Stratagene, La Jolla, CA, USA)を用いてサイト指示変異導入を行った。
2.3. 細胞培養とトランスフェクション
マウスBV2ミクログリア細胞株,ヒト胚性腎臓細胞株HEK 293T,ヒト神経芽細胞腫SH-SY5Y細胞株は,中国の北京ユニオン医科大学Cell Bankから入手した。すべての細胞株は、高グルコースのダルベッコ変法イーグル培地(DMEM)に、10%の熱不活化ウシ胎児血清(FBS, PAN-Biotech, Aidenbach, Germany)100U/mLのペニシリン、100μg/mLのストレプトマイシンを加え、5%CO2雰囲気下、37℃で日常的に培養した。
siRNAによるノックダウン研究では、BV2細胞またはHEK293T細胞を用いてHsp70 siRNAのトランスフェクションを行った。特異的なHsp70 siRNAは、補足表1に記載されているように、GenePharma社(中国・江蘇省)で設計・合成した。siRNAは、OPTI-medium(Gibco®, Thermo Fisher Scientific, Waltham, MA, USA)中のlipofectamine RNAiMAX(Invitrogen®, Thermo Fisher Scientific, Waltham, MA, USA)と予め混合した後、製造者の指示に従って細胞に適用した。
2.4. 炎症誘発性サイトカインの測定
BV2細胞を、ハンデリン(0.63,1.25,2.5μM)の有無にかかわらず、BSAまたはPAで24時間処理した。培養上清を回収し、一酸化窒素アッセイキット(Jiancheng Bioengineering Institute, Jiangsu, China)を用いてNOの産生量を測定した。上清中の腫瘍壊死因子α(TNF-α)インターロイキン6(IL-6)およびIL-1βのレベルは、市販のELISAキット(ExCell Bio Company, Shanghai, China)を用いて評価した。
2.5. ミクログリアを介した神経毒性の検出
ICRマウスの胚から得られた初代皮質ニューロンを,前述の方法で6日間培養した(Zeng et al 2012)。その後、BV2細胞を神経細胞播種培養ウェルのトランスウェル上に播種し、神経細胞とミクログリアを直接接触させずに同じ培養液を共有させた。ミクログリアとニューロンの共培養は、ハンデリン(0.63,1.25,2.5μM)の存在下でPAで処理するか、または処理しないで48時間行った。その後、ニューロンを固定し、クリスタルバイオレット溶液またはHoechst 33,258溶液で染色した。画像は、蛍光顕微鏡(IX73,オリンパス、東京、日本)で得た。さらに,3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロマイド(MTT)溶液(Sigma-Aldrich,St.Louis,MO,USA)を加えて,神経細胞の生存率を測定した。
2.6. イムノブロッティングおよび共同免疫沈降(Co-IP)分析
細胞ライセートホモジネートを10%SDS-PAGEで分離し、ニトロセルロース膜に転写した。その後、膜を特異的な一次抗体および二次抗体でプローブした。タンパク質のバンドは、強化化学発光(ECL)基質で可視化し、Tanon 5200 Imaging Analysis System(Tanon, Shanghai, China)で分析した。Co-IPアッセイでは、細胞溶解液を、氷上で抗HA-tag抗体結合磁気ビーズと4時間、または抗TRAF6一次抗体(1:100希釈)とそれに続くプロテインA+G-アガロースビーズと4℃で4時間インキュベートした。免疫沈降したタンパク質をSDS-PAGEで分離し、イムノブロッティングで検出した。
2.7. RNA の抽出とリアルタイム PCR 分析
RNAprep pure Cell/Bacteria Kit (TianGen)を用いてトータルRNAを抽出し,TIANscript RT Kit (TianGen)を用いてcDNAに逆転写した。定量的リアルタイムPCR(qRT-PCR)は,Agilent Technologies Stratagene Mx3005Pで行った。各遺伝子のPCRプライマーの配列は,補足表2に記載した。標的遺伝子の相対的な転写レベルは,GAPDHを正規化遺伝子とする2-ΔCT法により算出した(Zeng er al)。
2.8. ハンデリンの標的タンパク質の同定
ハンデリンの標的タンパク質は、若干の修正を加えた既報に従ってプルダウンした(Liu et al 2014)。簡単に言うと、ハンデリンをエポキシ活性化セファロース6Bビーズ(GE Healthcare, Chicago, IL, USA)に結合させた。ビークルビーズとハンデリン結合ビーズを細胞ライセートと混合した後、4℃で一晩インキュベートした。ビーズに捕捉されたタンパク質は、混合物をインキュベートすることによって得られ、10%SDS-PAGEに分離し、銀染色によって可視化し、そして我々の以前の研究で報告されたように、ナノHPタンデムLTQ-Orbitrap Velos pro質量分析計(Thermo Fisher Scientific)を用いたLC-MS/MSによって同定した(Liao er al)。
2.9. 表面プラズモン共鳴(SPR)アッセイ
ハンデリンとHsp70の相互作用は、Biacore T200システム(GE Healthcare)を用いて定量的に解析した。精製したリコンビナントヒトHsp70タンパク質(500μg/mL)を,標準的なアミンカップリング法を用いて,カルボキシメチル化した5センサーチップに固定化した。分析物として、ランニングバッファー中のハンデリン(0.04~50μM)の濃度勾配をつけて注入した。データはBiacore評価用ソフトウェア(T200 Version 2.0)で解析し,1:1のLangmuirモデルに当てはめて結果を得た。Ka, Kd, KDの速度論的パラメータは,1:1 Langmuir結合モデルにフィッティングして得られたものである。
2.10. 細胞熱シフトアッセイ(CETSA)の実施
生細胞CETSA実験(Lomenick et al 2011)では、BV2細胞をハンデリンで2.5μM、2時間処理した後、表示された温度で3分間個別に加熱し、その後、室温で冷却した。細胞を回収し、液体窒素を用いて5回凍結融解した。その後、ライセートをSDS-PAGEで分析し、続いてHsp70のイムノブロッティングを行った。
細胞ライセートのCETSA実験では、BV2細胞を液体窒素で5回凍結融解した。細胞ライセートを2つのアリコートに分け、一方をコントロールとし、もう一方をハンデリン(10μM)と室温で1時間インキュベートした。その後、ライセートを加熱し、同じ方法でHsp70を分析した。
2.11. Drug Affinity Responsive Target Stability (DARTS) Assay
BV2細胞溶解物を異なる濃度のハンデリンと1時間インキュベートし、続いて5μg/mLのプロナーゼを室温でさらに15分間添加した(Molina et al 2013)。SDS-PAGEローディングバッファーを加えて反応を停止し、特異的な抗Hsp70抗体を用いてイムノブロットで分析した。
2.12. NF-κBレポーターアッセイ
NF-κB標的配列連結ルシフェラーゼレポータープラスミドをリポフェクタミン2000トランスフェクション試薬でトランスフェクションすることにより、NF-κB-ルシフェラーゼレポーター遺伝子を安定的に発現させたBV2細胞株(NF-κB-luc-BV2)を作製した。NF-κB-luc-LV2細胞は、ハンデリン(0.63,1.25,2.5μM)の非存在下または存在下でPAで8時間処理した後、蛍光分光光度計(PerkinElmer, Waltham, MA, USA)でルシフェラーゼレポーター遺伝子アッセイキット(Bioassay sys, Hayward, CA, USA)を用いてルシフェラーゼ活性を分析した。
2.13. LC-MSによるGSH-Handelin複合体の同定
グルタチオン(GSH,500μM)をハンデリン(500μM)と37℃で2時間インキュベートした。その後,GSH-ハンデリン複合体をLC-Q-trap-MS(Liquid Chromatography coupled with hybrid triple quadrupole-linear ion trap mass spectrometer)法で分析した。プロトコルは、水(0.1%ギ酸、A)とアセトニトリル(B)からなる移動相を,0.4mL/minの一定流量で送出し,0〜1分で5〜20%B、1〜3分で20〜100%Bのグラジエント溶出を行ったことを除いて、既報(Liao er al)。
2.14. Hsp70のハンデリン結合部位の決定
組換えHsp70タンパク質をハンデリンと4℃で一晩インキュベートした後、限外濾過管を用いて混合物を精製した。Hsp70上のハンデリン結合部位の同定のために、EASY-nLC IIシステムとLTQ-Orbitrap velos pro質量分析計を用いて、我々の以前の研究(Liao er al)。 質量分析データは、SEQUEST検索エンジン(Thermo Fisher Scientific)を搭載したProteome Discoverer(1.4)ソフトウェアを用いて、以下の基準で解析した:分類学、ヒト;酵素、トリプシン;ミス切断部位、2;可変修飾、メチオニン酸化(+15. 995 Da)システインのカルバミドメチル化(+ 57.021 Da)Hsp70とのシステイン結合(+ 552.272 Da)前駆体の質量公差を10 ppm、フラグメントの質量公差を0.6 Da、偽発見率(FDR)を0.01とした。
2.15. In Vitro Hsp70 ATPase Activity Assay(試験管内試験Hsp70 ATPase活性アッセイ)
組換えヒトHsp70タンパク質溶液を様々な濃度のハンデリンと30分間プレインキュベートした後、2.5mM ATPと37℃で3時間インキュベートした。マラカイトグリーンベースの比色アッセイは、リン酸ナトリウム標準曲線から濃度を校正することによって計算された無機リン酸濃度を得るために、以前の報告(Ko er al)。 ADPレベルは、市販のADP colorimetric assay kit II(Sigma-Aldrich社製)を用いて検出した。相対的な無機リン酸またはADPは、コントロールに対する倍数の変化として表した。
2.16. トリプトファン蛍光消光試験
組換えヒトHsp70タンパク質をハンデリン(0.5-50μM)またはビヒクルと石英プレートでインキュベートした。最初のタンパク質のトリプトファン蛍光スペクトルとハンデリン溶液を連続的に添加したときの蛍光スペクトルを記録した。蛍光は,蛍光分光光度計(PerkinElmer社製)を用いて,励起波長を280nm,発光波長を300nmから550nmの間で1nm刻みに設定して検出した。蛍光強度はバッファーの寄与分で補正した。
2.17. 分子動力学法によるシミュレーションと解析
2.17.1. システムの構築
Hsp70 Chaperone BiP (PDB ID code: 5E84, chain A) および E. coli DnaK (PDB ID code: 2KHO, chain A) をテンプレートとしたホモロジーモデリングにより、Human heat shock 70 kDa protein 1A/B protein the open state および closed state の初期モデルをそれぞれ作成した。ハンデリンの有無にかかわらず、低親和性の開放状態で結合するHsp70と、ハンデリンの有無にかかわらず、高親和性の閉鎖状態で結合するHsp70の4系列のシステムを設計した。ジオメトリの最適化と静電ポテンシャルの計算は,Gaussian09スイートのHF/6-31G ⁄ レベルで行った。ハンデリンがHsp70タンパク質のCys306残基に共有結合している場合の力場パラメータは,General AMBER Force Field(GAFF)とRestrained Electrostatic Potential(RESP)を用いて作成した。得られた構造体は、タンパク質表面と溶媒和境界の間に10Åの距離を置いて、明示的なTIP3Pウォーターボックスを用いて溶媒和し、Na+対イオンを加えて中和した。
2.17.2. モデル構築と分子動力学(MD)シミュレーション
AMBER 14 gaff および ff14SB 力場を用いて,Amber14 パッケージを用いて全原子の MD シミュレーションを行った。シミュレーションプロトコルは,エネルギー最小化,NVTアンサンブルでの0から300Kまでの段階的な加熱,NPTアンサンブルでの1気圧での平衡化という標準的なステップを含んでいる.シミュレーションでは,周期的な境界条件を採用し,原子間の相互作用は,ファンデルワールスとクーロンについてはカットオフ半径1.0 nmで切り詰め,長期的な静電処理についてはPME(Particle-Mesh Ewald)を用いた。また,水素原子を含む共有結合はすべてSHAKEアルゴリズムで拘束した。MDシミュレーションは、温度300.0K、圧力1atmの条件で、NPTアンサンブルを用いて、何の制約もなく100ns継続して行われた。生成スナップショットは1psごとに記録した。
2.18. 免疫蛍光コローカリゼーション分析
HEK293T細胞にリポフェクタミン2000トランスフェクション試薬を用いて,Hisタグ付きHsp70プラスミドとHAタグ付きTRAF6プラスミドを一過性に共導入した後,2.5μMハデリンの有無にかかわらず6時間処理した。細胞をHisタグ付きマウス一次抗体とHAタグ付きウサギ一次抗体の混合抗体でインキュベートした後,Alexa Fluor 594標識抗ウサギとAlexa Fluor 488標識抗マウスの混合二次抗体を加えた。DAPIで染色した後、共焦点顕微鏡(Leica TCS SP8 X, Leica Microsystems, Wetzlar, Germany)で細胞を撮像した。
2.19. 動物実験
BALB/cマウス(6-8週齢,18-22g)は,Vital River Company(Beijing, China)から入手した。動物は,25±2℃で12時間の明暗サイクルのもと,水と標準食(SD)を自由に摂取できるようにした。日常の動物飼育と実験の手順は,「医学動物実験管理実施細則」(中国公衆衛生部文書番号1998-55)に準拠して行い,北京大学のInstitutional Animal Care and Use Committeeの承認を得た(ライセンス番号LA2016318)。
高脂肪食(HFD)マウスモデルへの挑戦では、BALB/cマウスに、10%のラード、10%の卵黄、1%のコレステロール,0.2%のコラート、78.8%の標準食を含むHFDを14日間与えた。対照群およびモデル群には0.5%CMC-Na溶液を、治療群にはハンデリン(10または20mg/kg/day)を8日目から強制投与した。8時間絶食した後、マウスを断頭して脳を取り出した。脳内のミクログリアの活性化を検出するため、特異的な抗体を用いてイムノブロッティング法と免疫組織化学法を行った。
BALB/cマウスに0.5%CMC-Na溶液、ハンデリン、GGA(100mg/kg/d)を3日連続で強制投与した。末梢血細胞は、セルタックα MEK-6400自動血球計数装置(日本光電工業、東京)を用いて分析した。血清の総コレステロール(TC)値は、市販のアッセイキット(Jiancheng Bioengineering Institute)を用いて測定した。
2.20. 熱ショックによる傷害
SH-SY5Y細胞を45℃で20分間熱ショックに曝し、37℃で指示時間後に回復させた。細胞の生存率はMTTアッセイで測定した。Hsp70の発現を評価するために、細胞を回収して溶解し、特異的な抗Hsp70抗体を用いてイムノブロッティングにより分析した。
2.21. 線虫の寿命の測定
Escherichia coli OP50 bacterial lawnsを播種したNGM(normal growth medium)寒天平板上で、線虫N2株を培養した。L4幼虫期のワームを、50μMのハンデリンまたはビヒクルを含む新鮮なプレート上で培養した。2日ごとに動物の生存率を調べ、寿命をモニターした。穏やかな突き刺しに反応しなかったワームは死んだものとしてスコアリングした。すべての寿命は、L4をタイムポイント0としてプロットした。
2.22. ゼブラフィッシュ胚の発生実験
野生型チュービンゲンゼブラフィッシュ(Danio rerio)を標準的な条件で飼育した。WTの正常な受精胚を採取し、卵水を入れたシャーレで培養した。24時間後の受精(hpf)の健常胚に、30μMのハンデリンまたはビヒクルを投与した。72 hpf後、統計解析のために生きている胚を数えた。
2.23. 統計解析
すべてのデータは、平均値±SEM(平均値の標準誤差)で表し、nは独立した実験の数を表す。統計解析およびグラフ作成にはGraphPad Prism 6.0を用いた。平均値は、一元配置分散分析(ANOVA)とDunnettのポストホックテストにより比較した。P < 0.05を統計的に有意とした。
3. 結果
3.1. 抗神経炎症用低分子プローブの探索
本研究では、パルミチン酸(PA)誘発ミクログリアを用いた抗神経炎症スクリーニングモデルを確立し、低分子プローブを発見した。その結果、ハンデリン(Fig.1a, Kang et al 1996)が強力な抗神経炎症プローブ候補として同定された。ハンデリンは、濃度依存的にPAによる亜酸化窒素の放出を強力に阻害したが(IC50 0.87μM)毒性はなかった(図1bおよび補足図1a-b)。さらに、TNF-α、IL-6,IL-1βなどの様々な炎症性サイトカインの分泌がハンデリン処理によって有意に抑制され(Fig.1c-e)また、対応する炎症性遺伝子の発現も抑制された(Supplementary Fig.1c)。さらに、ハンデリンの神経炎症抑制効果は、誘導性一酸化窒素合成酵素(iNOS)およびシクロオキシゲナーゼ2(COX2)のタンパク質発現を有意に低下させることで確認された(補足図1d)。
図 1 ハンデリンは抗神経炎および神経保護作用を示す

(a)ハンデリンの化学構造。(b)-(e) BV2細胞を10%BSAまたはPA(100μM)で24時間処理した後、NO(b)、TNF-α(c)、IL-6(d)、IL-1β(e)のレベルをGriessおよびELISAアッセイで検出した。(f)-(g) ミクログリアと神経細胞の共培養物をBSA、PAまたは/およびハンデリンと48時間インキュベートした。その後、神経細胞をMTTアッセイ(f)クリスタルバイオレットおよびHoechst 33,258溶液(g)でそれぞれ染色した。白矢印で示した神経細胞の典型的な形態変化を、神経突起の長さと細胞体の直径の比率に応じて4つのサブタイプ(0〜3+)に分類し、統計的に解析した。典型的なアポトーシスを起こした神経細胞は黄色の矢印で示した。スケールバーは20μm。データは3回の実験の平均±SEMで表した。⁎P < 0.05, ⁎P < 0.01, vs. PA群。##P < 0.01 vs. コントロール群。
ハンデリン依存性の神経炎症抑制が効果的な神経保護につながるかどうかを調べるために、試験管内試験でニューロンとミクログリアの共培養を行った。大脳皮質ニューロン単独の培養では、ハンデリンもPAも細胞毒性作用を示さなかった(補足図1eおよびf)。しかし、ミクログリアとニューロンの共培養では、PAはミクログリアからの神経毒性のある炎症性メディエーターの放出を促進し、ニューロンの生存率を著しく低下させたが、ハンデリンはこれに効果的に拮抗した(図1f)。さらに、形態学的な観察から、ハンデリンはミクログリアによる神経毒性に対して、神経細胞のシナプス結合を保護し、神経細胞のアポトーシスを防ぐことが明らかになった(Fig.1g)。これらの結果から、ハンデリンは、ミクログリアによる神経炎症や神経毒性を抑制する強力な低分子化合物であることが明らかになった。
3.2. ハンデリンはHsp70を直接標的とする
ハンデリンの細胞内直接標的を明らかにするために、以前の報告(Liu er al)。 BV2細胞のライセートをハンデリン結合セファロースビーズとインキュベートして標的タンパク質を捕捉した後、ハンデリン結合セファロースビーズに特異的に結合したタンパク質をSDS-PAGEで分解し、銀で染色した。その結果、70kDa以上のタンパク質バンドが、液体クロマトグラフィーとLTQ-Orbitrap Velos pro質量分析装置を組み合わせたLC-MS/MS分析により、Hsp70と同定された(図2a、補足図2aおよびb)。特に、対照群やハンデリンの競合量が過剰な群では、明らかなタンパク質バンドが見られず、ハンデリンのHsp70への結合が特異的であることが示された(図2a)。次に、Hsp70とHsc70を含む異なるHSP70ファミリーアイソフォーム間のハンデリン結合の選択性を評価してみた。図2bに示すように、ハンデリンを結合させたセファロースビーズでは、リコンビナントおよび細胞内在性のHsp70の両方がプルダウンされたが、これは過剰なハンデリンの競合によって濃度依存的に逆転したことから、ハンデリンがHsp70に特異的に結合していることがわかった。さらに、リコンビナントHsc70タンパク質や細胞ライセートをハンデリン結合セファロースビーズとインキュベートしたが、Hsc70タンパク質の特異的なバンドは検出されず、ハンデリンはHsc70ではなくHsp70と選択的に相互作用していることが確認された(図2b)。さらに、表面プラズモン共鳴(SPR)技術を用いて、ハンデリンとHsp70の相互作用を定量的に調べた。図2cに示すように、ハンデリンは濃度依存的にHsp70に特異的に結合し、解離定数(KD)は18.81μMであり、ハンデリンのHsp70に対する強い結合力が示された。
図 2 ハンデリンの分子標的としてのHsp70の同定

(a) ハンデリンを結合させたセファロースビーズを、過剰なハンデリン(10μM)の存在下または非存在下でBV2細胞溶解液とインキュベートした。70kDaの強いバンドはゲルから切り出され、熱ショックタンパク質70(Hsp70)と同定された。アスタリスクを付けたバンドは、非特異的にビーズに結合したビメンチンとアクチンを示した。(b) ハンデリンを結合させたビーズを、細胞ライセートまたはリコンビナントHsp70(またはHsc70)タンパク質、ハンデリンと示した濃度でインキュベートした後、ビーズに結合したタンパク質をイムノブロッティングと銀染色で検出した。c)表面プラズモン共鳴分光分析の代表的なグラフで、濃度を上げていくハンデリンとヒト組換えHsp70との結合の速度論を示している。Ka、Kd、KDの動態パラメータは、1:1のLangmuir結合モデルに当てはめて導き出した。(d)BV2細胞をハンデリン(10μM)またはビヒクルに曝し、続いて細胞熱シフトアッセイを行った。e)BV2細胞のライセートをプロナーゼ(5μg/mL)の存在下または非存在下でハンデリンとインキュベートした。f)ハンデリンが媒介する亜酸化窒素、TNF-α、IL-6およびNF-κBルシフェラーゼ活性の阻害に対するHsp70遺伝子サイレンスの逆効果。データは、3回の個別実験の平均±SEMで表した。⁎P < 0.05, ⁎P < 0.01 vs. PA群。##P < 0.01 vs. コントロールグループ。N.S., not significant.
次に、セルラー・サーマル・シフト・アッセイ(CETSA)とドラッグ・アフィニティ・レスポンシブ・ターゲット・スタビリティー(DARTS)アッセイを用いて、細胞における薬物標的の関与をモニターすることを目的とした。CETSAの結果、ハンデリンは、BV2細胞のin situおよび細胞ライセートの両方において、Hsp70の安定性をビヒクル群に比べて有意に増加させた(図2dおよび補足図2c)。また、ハンデリンはプロテアーゼによるHsp70の分解を濃度依存的に抑制したことから、ハンデリンとHsp70の直接的な相互作用が示唆された(Fig.2e)。
誘導型Hsp70は、さまざまな疾患から細胞を守ると考えられている主要な熱ショックタンパク質であるが、炎症の活性化に関与していることが広く報告されている。ここでは、Hsp70遺伝子をサイレンシングしたBV2細胞を用いて、ハンデリンを介した神経炎症抑制におけるHsp70の役割を調べた。図2fに示すように、ハンデリン依存性の抗神経炎作用は、Hsp70遺伝子の発現を特異的にノックダウンすることで顕著に逆転した。このことから、Hsp70は、ハンデリンによる抗炎症作用を担う重要な細胞標的として機能していると考えられる。
3.3. ハンデリンによるシステイン306の共有結合による修飾
ハンデリンがHsp70と相互作用する特性を特定するために、まず、ハンデリンがHsp70と共有結合するかどうかを調べた。ハンデリンを結合させたセファロースビーズをBV2細胞ライセートとプレインキュベートした後、競争相手として過剰量のハンデリンで処理した。Fig.3aに示すように、ハンデリンの後処理では、ビーズへのHsp70の結合を防ぐことができなかった。そこで、ハンデリンとHsp70の間に共有結合が形成されているのではないかと推測した。ハンデリンにはα, β-不飽和カルボニル基があり、これがHsp70のシステインのスルフィドリルと共有結合で反応する可能性がある(Nilsson er al)。 そこで、β-メルカプトエタノール(βME)ジチオスレイトール(DTT)グルタチオン(GSH)など、スルフィドリルを含むいくつかの薬剤が、Hsp70とハンデリンを結合したセファロースビーズとの結合に及ぼす影響を調べた。驚いたことに、いずれのスルフィドリル剤もHsp70のビーズへの結合能を完全に消失させた(Fig.3a)。これは、ハンデリンがHsp70のシステインのスルフィドリルに共有結合している可能性を示唆している。ハンデリンとスルフィドリルの詳細な相互作用を明らかにするために、ハンデリンとスルフィドリルを持つ塩基性ペプチドであるGSHをインキュベートし、LC-MS/MS分析により生成物を同定した。その結果、ハンデリンのα, β-不飽和カルボニル基とスルフィドリルとの付加反応(ハンデリン-GSH複合体)を質量分析計で検証することに成功した(補足図3a)。
図3 ハンデリンはCys306残基と共有結合している

(a) ハンデリンビーズは、BV2細胞の溶解液とインキュベートされ、表示されているように、スルフィドリル化合物を含む、または含まない。ビーズに結合したタンパク質をイムノブロッティングで分析した。(b)ハンデリンを添加しない(i)または添加した(ii)インキュベートしたリコンビナントHsp70タンパク質のLC-MS/MS分析。(c)-(d) HEK293T細胞に、野生型またはシステイン変異型のHA-Hsp70プラスミドをトランスフェクトした。細胞を溶解し、ハンデリンを結合させたセファロースビーズでプルダウンするか(c)ハンデリン(10μM)に曝露した後、細胞熱シフトアッセイを行った(d)。(e) ハンデリンとHsp70の共有結合様式の提案。
Hsp70には5つのシステイン残基がある。そこで、ハンデリンによってどのシステイン残基が修飾されたかを確認するために、リコンビナントHsp70タンパク質をハンデリンとインキュベートした後、LC-MS/MS分析を導入した。トリプシン反応生成物のデータを解析した結果、計算上の質量が1810.86 Daのペプチド(FEELCSDLFR)が同定された。この質量は、リコンビナントHsp70の対応するペプチドの計算上の質量1258.58 Daよりも552.28 Da大きかった(図3b)。この552.28 Daという質量差は、ハンデリンの分子量とぴったり一致しており、Hsp70のペプチドFEELCSDLFRがハンデリンによって特異的に修飾されていることが示唆された。さらに、このペプチドのMS/MSスペクトロメトリーでは、b4フラグメントイオンからb5フラグメントイオンに向かって552.28 Daの質量シフトが生じており、このペプチドのシステイン(Hsp70のCys306に相当)がハンデリンによって修飾されていることがわかった。さらに、この観察結果を検証するために、Cys306を含むヒトHsp70由来の合成ペプチド(PeptideC306, FEELCSDLFR)をハンデリンとインキュベートしたところ、LC-MS/MS分析により、ペプチドC306についても同様の質量変化の挙動が確認された(Supplementary Fig.3b)。これらの結果は、Hsp70のCys306残基がハンデリンによって共有結合で修飾されていることを示している。
ハンデリンとの結合におけるCys306の機能的意義をマッピングするために、Hsp70のすべてのシステイン残基をそれぞれアラニンに変異させた。システインを変異させたHsp70を用いてプルダウンアッセイを行ったところ、Cys306の変異だけがハンデリンとの結合能を消失させたことから、ハンデリンはCys306残基の選択的な修飾を介してHsp70と相互作用することがわかった(図3c)。同様に、システインを変異させたリコンビナントHsp70を用いたCETSAアッセイでも、ハンデリンがHsp70のCys306に共有結合するという我々の発見が支持された(図3d)。以上のことから、ハンデリンは、システインのスルフィドリルとα, β-不飽和カルボニルとのマイケル付加反応を介して、Hsp70タンパク質のCys306を直接標的にしていると考えられる(図3e)。
3.4. ハンデリンのアロステリック効果によるHsp70の活性化
Hsp70は、ATPase活性を持つN末端のヌクレオチド結合ドメイン(NBD)と、ポリペプチド基質を認識するC末端の基質結合ドメイン(SBD)という2つの主要なドメインが、柔軟な疎水性リンカーによって結合されている。NBDは、そのATP触媒ポケットによってATPをADPに加水分解するとともに、隣接するSBDの構造変化を引き起こし、基質への親和性を高める(Ko er al)。 ハンデリンは、ATP触媒ポケットに位置するNBDのCys306に共有結合しているため、ハンデリンがATP加水分解やHsp70の構造に影響を与えるかどうかは非常に興味深いところである。私たちはまず、ハンデリンがHsp70の構造制御に果たす役割を調べるため、Hsp70のトリプトファンの蛍光分析を行った。Fig.4aに示すように、ハンデリン-Hsp70複合体の蛍光強度は、ハンデリン濃度が高くなるにつれて減少した。発光スペクトルの最大波長は、ハンデリン50μMで青くシフトした。これらの結果から、ハンデリンがHsp70の構造変化を引き起こすことが明らかになった。
図4 ハンデリンはアロステリック効果によってHsp70を活性化する
原文参照
(a) ハンデリンとHsp70の相互作用を蛍光分光法で解析した結果
様々な濃度のハンデリンで処理した、あるいは処理していないリコンビナントヒトHsp70タンパク質の蛍光を集めた。(b) Amber14を用いた100nsのMDシミュレーションで得られたハンデリン結合Hsp70系のNBD(ADP)の代表的なコンフォメーション。c)Hsp70のADPに対するハンデリンの効果を比色法で測定した結果
(d) マラカイトアッセイを用いて測定したHsp70のATPase活性に対するハンデリンの影響。
次に、分子動力学シミュレーション(MD)を行い、Hsp70のアロステリックなメカニズムを解明した。Hsp70には、低親和性のオープン状態(ATPがNBDに結合している状態)と高親和性のクローズ状態(ADPがNBDに結合している状態)の2つの主要なコンフォメーションがある。閉鎖状態では、ADPは最初、NBDサブドメインのローブIとローブIIの間の深い裂け目に埋め込まれている。ハンデリンがCys306に結合すると、NBDの2つのローブが徐々に離れ、ADPがNBDから移動することで、ATP加水分解の循環が促進される(図4b、補足図4a)。このメカニズムを確認するために、ハンデリンで処理したHsp70の遊離ADP量をATPを基質として測定したところ、ATPaseが触媒する加水分解反応の主要産物であるADPの遊離に対して、ハンデリンの明らかな促進効果が認められた(EC50 0.96 μM)(図4c)。開放状態では、ATPはサブドメインローブIBから解離し、サブドメインローブIAの親水性残基であるスレオニン13(Thr13)およびThr14と水素結合を介して緊密に相互作用している(補足図4bおよびc)。ハンデリンは、ATPを結合したHsp70と比較して、リン酸基の遊離を促進してATPの加水分解を促進するこれらの親水性残基とATPの結合を明らかに制御する効果はなかった(補足図4bおよびc)。興味深いことに、無機リン酸濃度のモニタリングに用いられる比色法であるマラカイトグリーンアッセイでは、ハンデリンは濃度依存的にATPからの一リン酸放出レベルを有意に増加させ、そのEC50は1.03μMであった(図4d)。これらのデータを総合すると、ハンデリンは閉じた状態のHsp70のATPase活性をアロステリックに上昇させることが示唆される。
3.5. Hsp70の活性化はTRAF6のユビキチン化を制御して抗神経炎症作用を発揮する
次に、ハンデリン依存性の神経炎症抑制におけるHsp70の役割を調べた。Hsp70は、TRAF6のユビキチン化を阻害することで、炎症反応に悪影響を及ぼすことが報告されている(Chen et al 2006)。本研究では、ハンデリンがHsp70とTRAF6の相互作用を明らかに増強することをCo-IP法で確認した(図5a、b、補足図5a、b)。さらに、ハンデリンとTRAF6との相互作用をプルダウン実験で調べた。図5cに示すように、TRAF6とHsp70の両方は、Nonidet P40(NP40)を含む洗浄バッファーを用いて、ハンデリンを結合したセファロースビーズによって引きずり降ろされた。しかし、ドデシルスルホン酸ナトリウム(SDS)入りの洗浄液では、TRAF6は引きずり下ろされなかった(図5c)。SDSは強力な洗剤であり、タンパク質間の相互作用を破壊する可能性があることから、ハンデリンはTRAF6を直接標的にしていないのではないかと推測された。このことは、TRAF6タンパク質がハンデリンを結合させたセファロースビーズに結合できないことからも裏付けられた(図5d)。これらの結果から、ハンデリンはTRAF6ではなく、Hsp70を直接標的としてHsp70-TRAF6複合体を制御していることが示唆された。さらに、Hsp70-TRAF6複合体の形成についても、ハンデリンがHsp70-TRAF6の相互作用を直接促進することが明らかになった(図5e)。さらに、HEK293T細胞では、Hsp70とTRAF6のコロケーションが促進されていることが確認された(図5f)。これらの結果から、ハンデリンはHsp70に直接結合し、Hsp70-TRAF6間の相互作用を促進することが明らかになった。
図5 ハンデリン依存性の神経炎症抑制には、HSP70-TRAF6軸が関与していることがわかった
原文参照
(a) HAタグ 付きHsp70ベクターを導入したHEK293T細胞を、2.5μMのハンデリンまたはビヒクルで処理した。抗HA抗体を用いて共免疫沈降(Co-IP)を行い、続いて指示した抗体でイムノブロッティングを行った。(b) HA-TRAF6を過剰発現させたHEK293T細胞を2.5μMのハンデリンまたはビヒクルで処理した後、抗HA抗体によるCO-IPを行い、続いて銀染色を行った。約70kDaのバンドは、MS分析によりHsp70と同定された。アスタリスクを付けたバンドは、非特異的にビーズに結合したアクチンを示した。c)ハンデリン結合ビーズをBV2ライセートおよびハンデリンと示した濃度でインキュベートした。ビーズに結合したタンパク質を1% NP40-またはSDSを含むバッファーで洗浄し、その後Hsp70とTRAF6のイムノブロッティングを行った。(d) ハンデリンを結合させたビーズを、示した濃度のHA-TRAF6タンパク質およびハンデリンとインキュベートした。ビーズに結合したタンパク質は、HAのための免疫ブロッティングによって分析された。e)HA-TRAF6をトランスフェクトしたHEK293T細胞を回収して溶解し、続いて抗HA抗体でIPを行った。その沈殿物を、ハンデリンを含む、あるいは含まない、精製された組換えHsp70-Hisタンパク質とさらにインキュベートした。HisとHAについてはイムノブロッティングを採用した。(f) HAタグ付きTRAF6(赤)とHisタグ付きHsp70(緑)の共局在。スケールバーは25μm。g)BV2細胞をPAおよびハンデリンで処理した。示した抗体を用いてCo-IPとイムノブロッティングを行った。h)HA-TRAF6ベクターとHsp70に特異的なsiRNA二重鎖を共導入したHEK293T細胞を、2.5μMのハンデリンまたはビヒクルで処理した。その後、Co-IPとイムノブロッティングを行った。i)モックまたはTRAF6を導入したBV2細胞におけるPA誘導NO、TNF-α、IL-6産生および細胞生存率に対するハンデリンの効果。データは、3回の個別実験の平均±SEMで表した。*P, $P < 0.05; ##P, **P, $$P < 0.01; N.S., not significant.
付きHsp70ベクターを導入したHEK293T細胞を、2.5μMのハンデリンまたはビヒクルで処理した。抗HA抗体を用いて共免疫沈降(Co-IP)を行い、続いて指示した抗体でイムノブロッティングを行った。(b) HA-TRAF6を過剰発現させたHEK293T細胞を2.5μMのハンデリンまたはビヒクルで処理した後、抗HA抗体によるCO-IPを行い、続いて銀染色を行った。約70kDaのバンドは、MS分析によりHsp70と同定された。アスタリスクを付けたバンドは、非特異的にビーズに結合したアクチンを示した。c)ハンデリン結合ビーズをBV2ライセートおよびハンデリンと示した濃度でインキュベートした。ビーズに結合したタンパク質を1% NP40-またはSDSを含むバッファーで洗浄し、その後Hsp70とTRAF6のイムノブロッティングを行った。(d) ハンデリンを結合させたビーズを、示した濃度のHA-TRAF6タンパク質およびハンデリンとインキュベートした。ビーズに結合したタンパク質は、HAのための免疫ブロッティングによって分析された。e)HA-TRAF6をトランスフェクトしたHEK293T細胞を回収して溶解し、続いて抗HA抗体でIPを行った。その沈殿物を、ハンデリンを含む、あるいは含まない、精製された組換えHsp70-Hisタンパク質とさらにインキュベートした。HisとHAについてはイムノブロッティングを採用した。(f) HAタグ付きTRAF6(赤)とHisタグ付きHsp70(緑)の共局在。スケールバーは25μm。g)BV2細胞をPAおよびハンデリンで処理した。示した抗体を用いてCo-IPとイムノブロッティングを行った。h)HA-TRAF6ベクターとHsp70に特異的なsiRNA二重鎖を共導入したHEK293T細胞を、2.5μMのハンデリンまたはビヒクルで処理した。その後、Co-IPとイムノブロッティングを行った。i)モックまたはTRAF6を導入したBV2細胞におけるPA誘導NO、TNF-α、IL-6産生および細胞生存率に対するハンデリンの効果。データは、3回の個別実験の平均±SEMで表した。*P, $P < 0.05; ##P, **P, $$P < 0.01; N.S., not significant.
TRAF6は、自身のオートポリユビキチン化を触媒するユビキチンE3リガーゼ活性を有しており、中でもリジン48(K48)およびリジン63(K63)結合型ポリユビキチン化が最も豊富なタイプである(Mishima er al)。 K48結合型ポリユビキチン化はプロテアソーム依存的なTRAF6タンパク質の分解に関与し、K63結合型ポリユビキチン化はTRAF6関連の炎症性シグナル伝達経路を活性化する(Mishima et al 2015, Zeng er al)。 そこで、ハンデリンが介在するHsp70-TRAF6間の相互作用が、K48および/またはK63結合型のTRAF6のユビキチン化に影響を与えるかどうかを確認した。その結果、ハンデリンは、TRAF6のK63結合ポリユビキチン鎖形成を無効にするが、K48結合ポリユビキチン鎖形成には影響を与えないことがわかった(図5g)。一方、TRAF6のタンパク質および相対的なmRNAレベルは変化しなかった(補足図5cおよびd)。さらに、ハンデリンがTRAF6のK63ポリユビキチン化を抑制することに、Hsp70が関与しているかどうかを調べた。図5hに示すように、TRAF6上のK63-ポリユビキチンの発現はハンデリンによって有意に減少したが、Hsp70をノックダウンすると、ハンデリンによるTRAF6の脱ユビキチン化効果が顕著に拮抗した。これらの結果は、ハンデリンがHsp70-TRAF6間の相互作用を促進し、TRAF6のK63結合型ポリユビキチン化を抑制することを示している。さらに、TRAF6を過剰発現させると、ハンデリンのHsp70を介した神経炎症抑制作用が顕著に制限された(図5i)。これは、TRAF6がHsp70を標的とした抗炎症作用の軸として機能していることを示している。
TRAF6はNF-κB炎症経路の上流に位置する不可欠なシグナル分子であることから、ハンデリンがNF-κB経路の活性化を制御するかどうかをさらに検証した。イムノブロッティング法によると,PAはIKKα/β,I κB-α,およびNF-κB p65のリン酸化を顕著に促進したが,ハンデリン処理によって濃度依存的に効果的に抑制された(補足図5e)。また,NF-κBの転写活性を評価するために,BV2細胞にNF-κB-ルシフェラーゼレポーター遺伝子を安定的に導入したところ,PAの存在下で明らかに活性化されたNF-κB-ルシフェラーゼレポーター遺伝子が観察されたが,これはハンデリンによって緩和された(補足図5f)。これらの結果から、ハンデリンがTRAF6のポリユビキチン化とそれに続くNF-κBの炎症シグナルを制御することで神経炎症を抑制するためには、Hsp70が必要であることが示唆された。
3.6. ハンデリンは生体内で神経炎症を抑制するが、副作用は少ない
ハンデリンの神経炎症疾患への効果を評価するため、高脂肪食(HFD)誘発神経炎症モデルを生体内試験で構築した(図6a)。イムノブロッティング解析によると、高脂肪食を摂取すると、脳内でCOX-2,TNF-α、IL-βなどの炎症性タンパク質が過剰に発現することがわかった(Fig.6b)。これらの変化は、ハンデリンを経口投与することで効果的に回復した(Fig.6b)。また、HFDマウスの大脳皮質では、活性化したミクログリアが増加しており、イオン化カルシウム結合アダプター分子-1(Iba-1)の特異的な染色によって示された(図6c)。ハンデリンは、Iba-1陽性のミクログリアの数を減少させることで、ミクログリアの活性化を効果的に抑制した(Fig.6c)。さらに、HFDによって誘発されたCD68(cluster of differentiation 68)およびCD11b/c陽性のミクログリアの増加に対しても、ハンデリンは同様の抑制効果を示した(図6dおよび補足図6a)。これらの結果から、ハンデリンはHFDによるミクログリアの活性化を抑制し、その結果、脳内での炎症性メディエーターの産生を抑制することが明らかになった。
図6 ハンデリンはHFD誘発マウスモデルにおける神経炎症を抑制する

(a)HFDモデルのスキーム。(b) 脳内の炎症性タンパク質の発現の違いをイムノブロッティングで測定した。(c-d) 大脳皮質を特異的なミクログリアマーカーIba-1(c)とCD68(d)で染色した代表的な画像。矢印は陽性に染色されたミクログリアを示す。(e) ハンデリンとGGAの投与のスキーム。f)血清総コレステロール(TC)好中球比率(NEUT%)および単球比率(MONO%)に対するハンデリンおよびGGAの効果。データは、3回の実験の平均±SEMで表した。⁎P < 0.05; ⁎P, ##P < 0.01; N.S., not significant.
ハンデリンの副作用を調べるために、BALB/cマウスの血清総コレステロール(TC)および単球、好中球、リンパ球、血小板などの末梢血細胞に対するハンデリンの影響を、Hsp70遺伝子の古典的な薬理学的誘導剤であるゲラニルゲラニルアセトン(GGA)と比較した(Fig.6e)。Fig.6fに示すように、単球比率(MONO%)、好中球比率(NEUT%)および血清TC値については、ハンデリン(100mg/kg/d)とビヒクル投与の間に統計的な有意差は認められなかった。しかし、GGA投与群(100mg/kg/d)では、血清TC値とMONO%が顕著に上昇し、NEUT%が有意に低下した。このことは、GGAの臨床試験でよく見られる副作用と一致する。さらに、ハンデリンとGGAはともに平均血小板容積(MPV)を増加させたが、GGAはハンデリンよりも顕著な増加を示した(補足図6b)。さらに、PAによる神経炎症に対するGGAとハンデリンの効果を亜酸化窒素(NO)アッセイで比較した。その結果、ハンデリンはNOの放出を用量依存的に抑制したが、GGAは同濃度のNOレベルに影響を及ぼさなかった(Supplementary Fig.6c)。これらのデータは、ハンデリンがGGAよりも神経炎症の治療や血中脂肪や末梢の免疫機能の維持に優れている可能性を示唆している。
ハンデリンはHsp70を活性化し、その多機能な生物学的機能のための細胞の救命装置として機能する(Jäättelä er al)。 この意味で、ハンデリンは、細胞の生存と寿命に対してポジティブな作用を有すると考えられる。この可能性を検証するために、まず、激しい熱ストレス刺激による細胞傷害に対するハンデリンの効果を調べた。その結果、ハンデリンは、Hsp70タンパク質の発現に影響を与えることなく、ヒートショックによるSH-SY5Y細胞の死を有意に抑制することがわかった(補足図7aおよびb)。さらに、動物の発生におけるハンデリンの役割を調べてみた。線虫では寿命を、ゼブラフィッシュでは初期胚の生存率を調べた。補足図7cに示すように、ハンデリン50μMを投与した線虫は、対照として大腸菌OP50を投与した線虫に比べて寿命が延びた(ハンデリン16.85日、対照14.35日、平均寿命が約17%延びた)。さらに、ゼブラフィッシュの胚の発生初期において、30μMのハンデリンを72時間処理することで、死亡率が20%から5%にほぼ減少した(補足図7d)。これらの結果から、ハンデリンが細胞保護および寿命延長に有益な効果を持つことが明らかになった。
4. 考察
脳内におけるミクログリアの異常な活性化は、炎症性サイトカインの発現を上昇させることで神経炎症と強く関連し、さらに神経細胞の機能障害や認知障害を引き起こすことを示唆する証拠が蓄積されている(Erion et al 2014,Jeon et al 2012,Meireles et al 2015,Miller and Spencer 2014)。そのため、神経炎症を治療するための新しい治療アプローチを開発する必要がある。ここでは、低分子ハンデリンを化学的プローブとして使用し、高脂肪関連の神経炎症に対する熱ショックタンパク質70(Hsp70)の薬効のあるアミノ酸残基としてシステインを同定した。その結果、ハンデリンは、システイン306(Cys306)を共有結合で直接修飾することで、Hsp70の活性を大きく誘導することがわかった。これにより、Hsp70の触媒ポケットにアロステリック効果が生じ、Hsp70と基質であるTRAF6との結合が促進され、TRAF6依存性の神経炎症シグナル伝達経路がさらに阻害される。したがって、Cys306は、神経炎症やその結果として生じる神経細胞の機能障害を抑制するためのHsp70の有望な薬剤標的部位となりうる。
Hsp70は、様々な神経免疫疾患に大きく関与している。Hsp70(HSPA1A)遺伝子の発現誘導(シクロペンテノンプロスタグランジン剤、ヒートショック、HSP72トランスジーンの過剰発現による)は、炎症関連遺伝子の産物に対する潜在的な抑制効果を示す(Ding et al 2001,Ianaro et al 2003,Liu et al 2012,Tanaka et al 2014,Wang et al 2002)。しかし、低分子を用いたHsp70の直接的な薬理学的活性化は、長い間注目されなかった。ここで我々は、低分子ハンデリンが、肥満に伴う神経炎症の重要なマイルストーンであるパルミック酸誘発ミクログリア活性化を有意に阻害することを発見した。さらに、ハンデリン投与による明確な抗神経炎症効果は、高脂肪食誘発動物モデルにおいても証明された。
生理活性を持つ低分子の標的同定は、その標的分子が薬効を持つ場合、非常に有益である(Van Eden et al 2005)。本研究では、ハンデリンが、これまで知られていなかったシステイン残基(Cys306)を標的としてHsp70に直接結合することを発見した。驚くべきことに、ハンデリンはマイケル付加反応によってCys306を共有結合で修飾し、その結果、抗神経炎効果を発揮することを明らかにした。現在のHsp70依存性の抗炎症療法は、主に遺伝子的アプローチや化学的な誘導剤によって内因性のHsp70遺伝子の発現を促進することに焦点を当てている(Bianchi et al 2014,Ding et al 2001,Ianaro et al 2003)。しかし、この戦略は、遺伝子誘導のための複雑なシグナル伝達経路や、転写のオフターゲット効果に悩まされている。特に、Hsp70は様々な生理機能の鍵となるハブタンパク質として機能しているため、Hsp70遺伝子の発現を誘導すると、いくつかのシグナル伝達経路が乱れ、望ましくない副作用が生じる可能性がある。したがって、特定の機能性アミノ酸残基を標的としてHsp70を直接薬理学的に活性化することは、これらの制限を効果的に克服することができ、周囲の生理学的環境への影響を少なくしながらHsp70の機能をより正確に制御する戦略を提供することができる。
さらに我々は、ハンデリンがナノモルレベルでHsp70を選択的に活性化し、Hsc70を活性化しないことを明らかにした。これは、構成的なHsc70の対応するアミノ酸残基が、反応性の高いチオール基を持たないアスパラギンであるため、ハンデリンとの共有結合効果が失われているのではないかと推測している。このことは、ハンデリンが異なるHSP70サブファミリーメンバーに対して標的選択性を示す構造生物学的な性質を構成しているのかもしれない。ハンデリンは、システイン残基を標的としてHsp70を直接活性化し、神経炎症を抑制する低分子であることは注目すべき事実である。
Hsp70は、ほとんどすべての炎症性疾患に大きく関与していることがわかっており、炎症治療の有望なターゲットとして提案されている(Jian et al 2016,Van Eden 2015,Van Eden et al 2005,Vinokurov et al 2012)。これまでの研究で、低分子がATP加水分解過程を促進し、アロステリック効果を介してHsp70のATPase活性をアップレギュレートする可能性が明らかになっている(Wang er al)。 ハンデリンは、NBDの触媒ポケットのアロステリック制御を誘導することで、Hsp70からのADP放出を促進し、ADPとATPの交換を容易にして、ATP加水分解サイクルを加速する。このように、ハンデリンによるアロステリック効果は、Hsp70のATPase活性を著しく向上させることが、マラカイトグリーンとADPの分析により確認された。我々の知る限り、このような低分子を介したHsp70のアロステリック活性化機構はこれまでに報告されておらず、今後、新規の低分子Hsp70活性化剤のさらなるデザインと開発を可能にした。
TRAF6上でリジン63(K63)結合ポリユビキチン鎖が形成されることは、炎症経路の活性化に重要な細胞イベントである。これまでの報告では、Hsp70がTRAF6に直接結合し、TRAF6のK63結合ポリユビキチン化を阻害することで、下流のNF-κB炎症シグナルを不活性化することが明らかになっている(Chen er al)。 本研究では、ハンデリンがTRAF6のK63結合ポリユビキチン化を有意に抑制した。ハンデリンによるアロステリックな制御は、Hsp70の基質結合面のTRAF6への露出を誘導し、Hsp70とTRAF6の相互作用を促進するものと推測される。さらに、Hsp70とTRAF6の結合は、TRAF6のK63結合ポリユビキチン化を阻害し、その後のNF-κB炎症シグナル伝達経路を不活性化する。この結果は、Hsp70がマクロファージにおけるTRAF6のポリユビキチン化を阻害することで、細菌のリポポリサッカライドによるNF-κBの活性化を抑制するという過去の研究でも支持されている(Chen et al 2006)。
代表的なHsp70遺伝子誘導剤であるGGAは、大腸炎や胃炎などの様々な前臨床炎症モデルに対して有意な抑制効果を示すことが確認されているが(Howden, 2014)GGAを用いた臨床試験の結果によっては、その有効性が疑問視され、胃十二指腸粘膜損傷に対する副作用の可能性が指摘されている(Kunimoto er al)。 これは、本研究で観察されたGGAによる単球の増殖によるアレルギー反応と関連があるのではないかと推測した。しかし、ハンデリンによる特異的なHsp70の活性化は、単球の増殖に対する同様の効果を誘発しないため、抗炎症薬の開発において、より満足のいく利用可能性と適応性が得られると考えられる。もちろん、さらなる調査が必要である。
HSPは、高温を含む様々な有害環境ストレスに関与する酸化還元感受性タンパク質のファミリーである(Jäättelä, 1999, Trovato et al 2016, Vinokurov er al)。 HSPの中でも、Hsp70はビタジーンと呼ばれる細胞保護遺伝子に極めて顕著にコードされ、酸化還元の恒常性と細胞修復を維持している(Calabrese er al)。 この考えは、ハンデリンが熱ストレスによる細胞毒性に対するSH-SY5Y細胞の生存を促進したことからも強く支持され、ハンデリンの細胞内標的がHsp70であることがさらに確認された。Hsp70は、ビタジーンネットワークの主要メンバーとして報告されており、毒性のあるミスフォールディングタンパク質の自発的な凝集を防ぐことで、細胞を保護する効果を発揮し、アンチエイジングや長寿への効果が期待されている(Dattilo er al 2015,Lanneau er al 2008)。本研究では、ハンデリンがHsp70を活性化することで、ミクログリアの活性化を介した神経毒性や熱ストレスによる神経毒性からの神経保護効果を示した。さらに、ハンデリンを継続的に投与することで、C. elegansやゼブラフィッシュの寿命を効果的に延ばすことができることが確認され、ハンデリンの抗加齢・長寿効果が示された。しかし、ハンデリンはHsp70タンパク質の発現には明らかな影響を与えなかった。このことから、ハンデリンは、Hsp70に関連するビタゲンネットワークを制御するのではなく、Hsp70を機能的に活性化することで細胞保護作用を発揮するのではないかと推測された。このような観点から、Hsp70タンパク質をビタゲンに依存せずに薬理学的に活性化することは、酸化還元のホメオスタシスを調節し、細胞の生存を助ける有効な戦略となる。
以上のように、我々はCys306がHsp70を直接薬理学的に活性化するためのドラッグ可能な残基であることを初めて報告した。これにより、望ましくない副作用が少なく、神経炎症を効果的に抑制することができる。さらに、低分子ハンデリンは、特異的なHsp70活性化剤を設計するための化学的テンプレートとなり、ヒトの神経炎症疾患を研究するための強力なツールを開発するための重要な手段となる。
