pubmed.ncbi.nlm.nih.gov/27295409/
2016 年 5 月 20 日に受理
キーワード がん代謝 電解質異常 低張性 低ナトリウム血症 低カリウム血症 低浸透圧 浸透圧ストレス 浸透圧調節

概要
この総説では、電解質バランスの点で「健康な」水は、公衆衛生を促進する上で「純粋な」水と同様に重要であると論じている。飲料水処理における脱塩技術の普及により、ナトリウム、カリウム、マグネシウム、カルシウムの濃度が非常に低い水道水が作られることが多くなっていることを考慮した。
このような水の摂取は、低ナトリウム血症、低カリウム血症、低マグネシウム血症、低カルシウム血症などの電解質異常を引き起こし、これらはがん患者において最も一般的で顕著な特徴の一つである。
脱塩水への曝露と悪性腫瘍の因果関係は十分に理解されていない。この総説では、電解質代謝の異常と発がんおよびがんの特徴の発現を関連づけるエピデメオロジーおよび生体内試験の証拠のいくつかに焦点を当てている。* *
脱塩水の摂取が、血管新生、ゲノム不安定性、プログラム細胞死への抵抗性、持続的な増殖シグナル、細胞の不死化、腫瘍性炎症などのがんの微小環境における重要な経路やプロセスのいくつかを媒介することによって、いかに発がん効果を持ちうるかについて論じている。低浸透圧ストレス応答プロセスが多くの潜在的な癌遺伝子をアップレギュレートするという証拠は、多くの研究によって裏付けされている。
世界のほとんどの地域で脱塩水の生産と消費が増加していることから、電解質異常ががんの発生を促進、拮抗、あるいは可能にする生物学的重要性とタンパク質的役割に関するさらなる研究の必要性が強く指摘されている。多くの人々が海水淡水化された水を消費する湾岸協力会議(GCC)諸国は、この研究を始めるのに論理的な場所であろう。
1. はじめに
エイムズ博士(1979)は、そのブレイクスルー論文の中で、DNAの損傷がほとんどのガンの主要な原因であることを指摘し、人間の食事に含まれる天然化学物質や最近環境に導入された何万種類もの合成化学物質のDNA損傷能力を検査することを提案した。
エイムズ博士は、環境中の変異原と発癌物質を同定するために、迅速な変異原性試験法の使用を提唱し、このブレイクスルー研究は、「発癌物質としての変異原」に科学と規制の重点を移す役割を果たし、「完全」発癌物質(すなわち、それ自体で癌を引き起こす可能性がある物質)であることが示される個々の化学物質と少数の明確な混合物(例えば、ディーゼル排気ガス)の探索を国際的に行うきっかけになったのである。
がん生物学の進歩により、その後、このアプローチの限界が明らかになり、異なる経路で作用する個々の(非発がん性の)化学物質の累積効果、および様々な関連システム、器官、組織および細胞が、腫瘍および最終的には悪性腫瘍を生成するためにもっともらしく共謀することを認識する多段階および「がんの特徴」の枠組みをもたらした (Casey 他, 2015; Hu 他, 2015; Narayanan 他, 2015)。 我々は、脱塩水への曝露による電解質の乱れが、発がん性の結果をもたらす方法でがんの微小環境を媒介することができると仮定している。
このレビューは、がんの発生、維持および進行を可能にする上で、最も認識しやすい特徴の1つであると同時に、がんの最も早く定義された特徴の1つ(Robeyら 2015)である電解質恒常性の調節不全の役割について探求する。
* *
淡水資源が不足するにつれて、世界のさまざまな地域のコミュニティは、海水の脱塩または脱塩から飲料水を「製造」することにますます目を向けている。海水や汽水の脱塩は急速に拡大しており、世界の多くの地域で新たな淡水(脱塩水)の主要な供給源となっている(Greenlee er al 2009; Fried and Serio, 2012; Lattemann er al 2010 )。
2013年現在、150カ国に17,000以上の海水淡水化プラントが設置されている。これらのプラントでは、1日あたり約8000万立方メートル(211億USガロン)以上の水を生産している。世界中の3億人以上の人々が、日常生活の一部または全部を海水淡水化に依存している(IDA, 2015)。
世界的な干ばつの拡大(例:米国カリフォルニア州)と、特にアラビア湾岸地域と中国における水の必要性によって、海水淡水化の割合は、容赦なく増え続けている(GWI, 2015)。海水淡水化が天然水と異なる点は、その組成を制御できることだ。
一方、天然水は、気候、地質、偶然の産物である非常に幅広い物理的、化学的、生物的特性を持ち、地域住民や生態系の健康と結びついている(WHO 2011a;Mecawi er al 2013)。公衆衛生における論理的な疑問は、海水淡水化およびその他の製造された「純」水の最終的な組成が、長期的な消費者の健康に悪影響を及ぼす可能性があるかどうかである(WHO, 2011a; Rygaard er al 2011)。このレビューでは、「証拠の重み付け」アプローチを用いて、脱塩水の慢性的な摂取が健康上の有害な結果をもたらす潜在的なリスク要因であることを示唆した。

脱塩水の慢性的な摂取は、細胞外液および細胞内液のイオンおよび分子組成を変化させ、低ナトリウム血症、低カリウム血症、低マグネシウム血症および低カルシウム血症を引き起こし、これらはがん患者に非常によく見られる併存疾患である。
このような電解質恒常性異常は、構造的および生物化学的な支持を与える細胞外マトリックス、メッセージを送るシグナル伝達分子、腫瘍に栄養を与える血管、およびサイトカインなどの可溶性因子間の相互作用の複合体からなる腫瘍マイクロ環境に影響を与えることによって、腫瘍発生の複数の段階に寄与し得る(ケイシーら 2015;ランギーら 2015)。
さらに、ナトリウム、カリウム、マグネシウムおよびカルシュウムのレベルが低い水の摂取は、体液の強壮および浸透圧、ひいては有効細胞量および血圧に影響を与え、それによって浸透圧ストレスを生じさせる可能性がある。いくつかの哺乳類細胞株に関する研究によると、浸透圧ストレスは、その起源にかかわらず、染色体異常につながるDNA損傷を引き起こす可能性があり、しばしば引き起こされるゲノムの機能不全は、癌の発生の前提条件となる(Langieら 2015年、Thompsonら 2015)。
このレビューは、異なる代謝経路や様々な関連システム、器官、組織、細胞に対する異常な電解質ホームオスタシスの累積効果が、発癌性シネルを生み出す可能性があることを論証するものである。発がん作用を誘発する正確なメカニズムについては、十分に解明される必要がある。このレビューでは、この仮説を検証するための探索的実験の可能な領域を強調している。
* *
子供たちは、脱塩水の誤飲による健康被害に対して特に脆弱である。ほとんどの場合、子供たちは機会があれば飲み、水やソーダ(ミネラル分が少ないことが多い)フルーツジュース(脱ミネラル水で作られている)などの液体を飲み続けることによって、最適な必要水分量を容易にオーバーすることができる。
時間が経つにつれて、最適な水分摂取の慢性的な不足は、後年、エピジェネティックな変化や腫瘍形成を促進する代謝的条件を作り出す可能性がある。子供の飲水による健康への影響の遅れは、何らかの形で懸念されなければならない。
2. 脱塩水摂取による水分・電解質恒常性の乱れ
純粋な脱塩水には、配水システムに影響を与える好ましくない性質があるため、一般的には、石灰や石灰石を使用したり、地下水と混合したりして、その腐食性を安定させ、低減する努力がなされている (WHO, 2005, 2011b; Birnhack er al 2011)。。
後処理工程では、さまざまな化学的特性を持つ製品が製造されることが多く、現在、消費者の蛇口まで届く脱塩水の品質に特化した規制ガイドラインがほとんどないのは注目に値する(WHO, 2005)。このような脱塩水または脱塩水(蛇口から出るかボトルで売られているかにかかわらず)には、ナトリウムが10 mg/L、カルシウムが15 mg/L、マグネシウムが5 mg/L、カリウムが3 mg/L、全硬度が50 mg/L未満という場合が多い(Wheltonら 2007; LahavとBirnhack 2007; WHO 2010; Dieter, 2011; Rygaardら; Al Nouriら 2011,2014)。
これに対し、ヒトの血清中の典型的な濃度は、マグネシウムが15-25 mg/L、カルシウムが45 mg/L、カリウムが137-196 mg/L、ナトリウムが3000 mg/L以上である。
摂取した水分の細胞外・細胞内液への変換は複雑な現象である。しかしながら、脱塩水を摂取すると、視床下部-下垂体-副腎(HPA)軸、アドレナリン神経(ANS)レニン-アンジオテンシン-アルドステロン(RAAS)系における浸透圧調節過程を通じて、これらの成分が尿として失われることを示す証拠がある(Verbalis(2003)による総説)。
調節反応は、多くの癌の一般的な生理的特徴である低カリウム血症、低マグネシウム血症、低ゼレン血症、および低セレン血症を同時に出現させることができる(Weberら 2010;RosnerおよびDalkin 2014)。
腫瘍の病因に対する電解質低代謝の役割は不明であるが、低ナトリウム血症、低カリウム血症および低マグネシウム血症は、患者の腫瘍の転帰の重要な決定要因であるという示唆がある(Onitiloら 2007)。
* *
体内のナトリウム負荷の大部分(約65%または2500mmol)は細胞外液に存在し、細胞内には約8%または300mmolのナトリウムしか存在せず、残りの体内のナトリウム(約25~30%または1000mmol)は骨に貯蔵されている(Giebisch and Windhager 2005)。
血清ナトリウムとそれに付随する陰イオン(主に塩化物と重炭酸塩)は、細胞外液の主要な浸透圧活性物質であり、したがって細胞外および細胞内の容積条件の制御において最も重要な役割を果たす(Giebisch and Windhager, 2005)。
脱塩水を摂取すると、細胞外および細胞内の電解質のバランスが崩れ、大量のナトリウム、カリウム、カルシウム、マグネシウム、その他の微量ミネラルが尿、便、汗に流出することが分かっている(WHO, 2005, 2011a)。
さらに、細胞外液の溶質(オスモライト)濃度の希釈効果により、細胞内液と細胞外液の浸透圧平衡を維持するために水が拡散して、最初に細胞が膨張する低張性が生じるだろう(Verbalis 2003;Miltiadous er al 2008;Popkin er al 2010)。
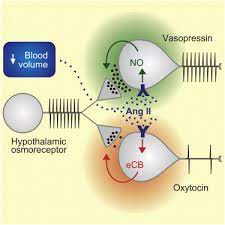
これは、血液量と動脈血圧の変化(増加)(浸透圧ストレス)を引き起こすが、細胞は、喉の渇きを感じることと、体内の電解質(主にナトリウム)量のバランスをとることを組み合わせて、「アフェクター」システムと「エフェクター」システムという二つの主要経路を使って、速やかに回避しなければならない(図1)(Verbalis 2003; Popkin er al 2010)。
情動系(または感知系)は、ナトリウムの量が多すぎるか少なすぎるか、あるいはちょうどよい量かどうかをモニタリングしている。これは、大動脈弓、頸動脈、心房、脳および肝臓にある圧受容器を通して行われる。ナトリウムの含有量が適正でない場合は、レニン-アンジオテンシン-アルドステロン系、カテコラミン系、バソプレシン系のエフェクターシステムが作動し、ナトリウム保持量と血圧を変化させる。(Popkin et al 2010)。
また、心房性ナトリウム利尿ペプチド(ANP)系も腎臓のナトリウム喪失に関与している(Bourqueら 2008;Sternsら 2013)。これらのオスモレギュレーションシステムは、血漿ナトリウム濃度が142mEq/L以上に上昇したり、135mEq/L以下に低下することを防いでる。
血漿ナトリウム濃度がわずか1〜2%変化する(それに伴って血漿浸透圧が変化する)と、細胞容量受容体(「オスモレセプター」)がストレス調節系を活性化して反応する(Verbalis, 2003; Schrierら, 2013; Sternsら, 2013; Rivardら, 2013)。つまり、脱塩水を摂取しても、細胞や血液のナトリウム濃度や張力が大きく変化する必要はなく、複雑な調節系に多くの影響を及ぼすということだ。
水代謝は、水の「制御された」成分と「制御されていない」成分の摂取と排泄のバランスを表しており(図1)その大きさは、生理学的および病態生理学的条件によって変化し得る(Verbalis 2003;Nwosu er al 2013)。
水分摂取の非規制成分は、摂取した食品に含まれる固有の水分量、主においしさや望ましい副次的効果(カフェインなど)の理由による飲料の摂取、あるいは社会的または習慣的理由(アルコール飲料など)によるものである(Verbalis, 2003; Bourque, 2008)。
水分摂取の制御された構成要素は、喉の渇きの知覚に反応して摂取される水分からなる(McKenna and Thompson, 1998)。調節されていない水分の排泄は、様々な原因による感知できない水分損失(発汗による皮膚損失、呼気中の蒸発損失、消化管損失)および体の代謝によって生成された溶質を排除するために腎臓が排泄しなければならない水分量によって起こる(Verbalis 2003)。
一方、調節成分の排泄は、恒常性を許容範囲内に維持するために必要な義務量を超えた自由水を腎臓から排泄することを含む(Rose, 1986; Kültz, 2001; Kacprowicz and Lloyd, 2009)。
基本的に、制御された構成要素は、制御されていない水の損失や獲得によって生じるいかなる摂動も補償することによって、水収支を維持するように作用する。
* *
原理的には、調節された水と調節されていない水に対する刺激は、異なるタイプの反応を引き起こす可能性がある。調節された水の成分が正常値から逸脱した場合の刺激には、喉の渇きというストレス反応が伴い、最終的に恒常性を回復させることを目的とした保護的再対応(飲水)につながる(Thornton, 2010; Chovatiya and Medzhitov, 2014)。
一方、非調節水は、調節された浸透圧の逸脱を引き起こす可能性のある課題(防御反応)だが、それ自体は調節された変数ではない(Chovatiya and Medzhitov, 2014)。
ストレス反応と防御反応は、前者が上述のよく発達した浸透圧調節システムによって感知されるのに対し、後者は味蕾を介し、そのメカニズムはよく分かっていないが、一種の「報酬系」として脳とコミュニケーションしている(Popkin er al 2010)。
さらに、食物(空腹)と水(喉の渇き)の飽和状態は同期していない(消化管が食物と水にさらされるタイミングが異なる)。食事から電解質を摂取することで、脱塩水を飲むことによるホメオスタシスへの悪影響が解消されるという一般的な仮説は、必ずしも有効とは限らない。
* *
癌患者を含む重篤な患者は、喉の機能が低下していることがよくある。健常者の場合、脱水は単純に全身水分量(TBW)の不足と定義されるが、機能的には体内水分量、組成、分布が含まれ、これらはすべて動的であり、一括して測定することは難しい(Mangeら、1997; Cotterら 2014)。
健常者では、この状態は高ナトリウム血症、つまり飲みたい衝動(渇き)と強く関連する血清浸透圧の上昇と関連している(Thornton, 2010)。多くのがん患者は、この生理学的パターン(健常者の表現型)に当てはまらない。それどころか、ほとんどのがん患者は、ナトリウムと血清オスモル-濃度の低下により、高ナトリウム血症ではなく低ナトリウム血症に苦しんでいる (Sarhill et al 2001; Davis et al 2009; Nwosu er al 2013)。
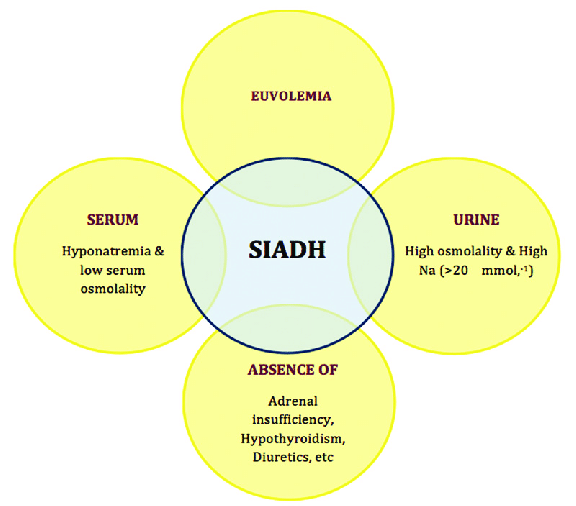
多くの場合、がんは不適切な抗利尿症候群(SIADH)を伴う。我々は初めて、喉の渇き感覚の障害が、腫瘍形成の素因となるような電解質代謝の調節障害に関連することを提案する。脱塩水を摂取すると、喉の渇きを感じるための浸透圧の閾値が下がり、多飲症の症例で報告されているように、低い血漿浸透圧で喉が渇いたと感じるようになる (Robertson et al 1988; Thompson et al 1991; Wall et al 1992)。
このことは、多くの研究で報告されている脱塩水の喉の渇きを癒す特性の低さを説明するものと思われる (WHO, 2011a)。生理的要求を満たすのに必要な量を超える脱塩水の摂取は、一般に、口渇およびAVP分泌の浸透圧および非浸透圧制御の統合において他の異常を引き起こす(Ragavanら、1984;Goldmanら、1988;McKinleyおよびJohnson 2004)。
口渇と不適切な抗利尿のシンドローム(SIADH)の発症との関係については、情報がない。SIADHは、血漿AVPの不適切な上昇と不適切な尿中ナトリウム濃度を伴う低ナトリウム血症によって特徴付けられることを考慮すると、脱塩水による口渇調節障害の共通の結果であると推測される。これは今後の研究の興味深いテーマとなるであろう。
脱塩水(または塩分不足の食事)への暴露は、(i)細胞内容物の濃度を希釈し、(ii)細胞の構造的完全性を危うくする細胞体積および細胞水和の変化を伴う(島本および小宮 2000;Petersら 2007;Popkinら 2010;WHO 2005;Lamerisら 2015)。
細胞の水和の増加は、細胞の分化、移動、メカノトランスダクション、DNA修復および腫瘍形成に影響を与える方法で、分子(クロマチンを含む)の内部構造および配置を変えることができる(Finant and Guilak, 2010; Finan er al)。
細胞量の増加は、細胞膜電位の変化、様々なセカンドメッセンジャーカスケード、多様な標的タンパク質のリン酸化、遺伝子発現の変化など、多くの細胞内シグナル伝達事象を引き起こす可能性がある。
ホルモンでさえ、その効果を発揮するために体積調節機構を利用することが示されている(Lang et al 1998; Kültz, 2001; Hochachka and Somero, 2002)。
要するに、細胞の容積と容積調節機構の変化は、血管新生、ゲノム不安定性、プログラム細胞死への再抵抗、持続的な増殖シグナル、細胞の不死化、腫瘍性炎症など、がんの微小環境における重要な経路とプロセスのいくつかを媒介することができるのである。電解質異常とこれらのがんの特徴との間には明確な関係があるが、これらすべてにおける脱ミネラル水への曝露の役割は不明である。
3. ヒトの研究からの証拠
実験動物や人間のボランティアを使った実験や、脱塩水を飲用する集団、逆浸透膜処理された脱塩水を飲用する集団、脱塩水を使った飲料を飲用する乳児の観察データは、数十年前にさかのぼる(WHO(2005)にレビューあり)。さらに、ミネラルの少ない(軟)水とミネラルの多い水を使用した人々の健康への影響を比較した疫学研究の結果からも、いくつかの知見が得られている(WHO 2005)。
これらの研究のほとんどは、低ミネラル水の摂取が、体内の水分とミネラルのバランス、および一部の水分依存性ホルモンの機能活性にマイナスの影響を与えるという事実を指摘している(WHO, 2005)。
蒸留水や全溶解固形分(TDS)r75 mg/L の水の摂取は、(i)排尿量、細胞外液量の増加、血清中のナトリウム(Na)イオンと塩素(Cl)イオン濃度の低下と体外への排出量の増加をもたらし、全体として負の電解質バランスをもたらすこと、(ii)赤血球とその他一部のヘマトクリットの容量に変化が生じることが、主にラットの動物実験で繰り返し示されている (WHO,2011a) 。
ヒトのボランティアに低ミネラル水を与えた実験の結果は、動物実験で報告された結果と一致しており(WHO, 2005)利尿作用(平均でほぼ20%)と体水分量の増加、ナトリウム、カリウム、塩素、カルシウム、マグネシウムの体外排出の増加などが報告されている。これらの人体実験やボランティア実験のほとんどは、がん以外のエンドポイントを扱い、1960年代と1970年代に実施された。

低ミネラル水がヒトのがんに及ぼす影響については、現地の軟水がカルシウム、マグネシウム、亜鉛の濃度が低いアジアの一部の地域で観察的研究が行われている。台湾の疫学調査では、食道がん、胃がん、直腸がん、結腸がんの過剰リスクと飲料水中の低ミネラル濃度との間に可能な関連が指摘されている。
ある研究(Yang et al 2009a)は、軟水の使用に関連して、食道癌による死亡リスクが42%過剰であると報告した(オッズ比(OR)¼1.42;信頼区間(CI)1.22-1.66)。
別の研究では、飲料水の硬度と胃癌死亡率との間に有意な負の関係が示され、硬水の使用と比較して中程度の硬度の水と軟水にさらされた場合のオッズ比はそれぞれ1.16(CI、1.07-1.26)および1.65(CI、1.52-1.79)だった (Yang et al 1997)。
直腸癌については、硬水の使用と比較して、中程度の硬度の水と軟水にさらされた場合のオッズ比はそれぞれ 1.24 (CI, 1.01-1.55) と 1.38 (CI, 1.10- 1.73) であった (Yang et al 1999b)。
同じグループの研究者は、飲料水の硬度と結腸癌死亡率との間に有意な負の関係があることも示しており、硬水を使用した場合と比較して、中程度の硬度の水と軟水を使用した場合のオッズ比はそれぞれ 1.22 (CI, 1.04-1.43) と 1.46 (1.22-1.75) となっている (Yang and Hung, 1998)。
いくつかの癌におけるトリハロメタン(THM)の役割を媒介する飲料水中の低濃度のミネラルの重要性は、最近のいくつかの出版物で進められている(Chiuら 2010a; Kuoら 2010; 2011; Tsaiら 2013)。
また、マグネシウムの低摂取と結腸がんとの関連や、強力な発がん物質であるN-ニトロソ化合物の生成の増加が報告されていることも興味深い(Chiuら 2010b)。低マグネシウムと結腸新生物のさらなる関連性は、腺腫性および過形成性ポリープとの関連によって強調されており、これらは癌に進行する可能性がある (Schmitz et al 2003; Dai et al 2007)。
1958年から1967年にかけて行われたがん死亡に関する調査では、イングランドとウェールズの80の郡区において、胃、食道、前立腺、男性の膀胱、女性の乳房のがんによる死亡が、飲料水の軟らかさと関連していることが判明した(Stocks, 1973)。
ポーランド南部のオポール県における生態学的研究において、Tukiendorf and Rybak(2004)は、肝臓がんの発生率と飲料水中のマグネシウム濃度との間に逆相関があることを報告している。胃がんによる年間死亡者数は、兵庫県の 98 市町村の井戸水および水道水のマグネシウム濃度とは負の、Mg2 þ/Ca2 þ比とは正の相関があることがわかった(坂本ら、1997)。
フィンランド北部の女性集団において、地下水の硬度と数種類のがん、特に総がん(すべてのがんを合わせたもの)の間に、統計的に有意な強い正の相関関係が報告されている(Piispanen、1991)。
Zemla (1988) による古い研究のレビューでは、飲料水の水質が、特にその水を長期間使用している人々の胃がん発生頻度に何らかの影響を与える可能性があると結論づけている。1994年から2003年の期間にスロバキア共和国の2883の自治体から得た飲料水に関する20,339の化学的データの最近の分析では、がん死亡率とCaおよびMgの濃度の間に、個別および組み合わせで強い逆相関があることがわかった(Rapant er al 2016)。
また、Ca、Mgおよび/または水の軟らかさとがんの罹患率または死亡率との間に有意な関連を見いださなかった他の研究があることに留意すべきである(WHO 2011を参照)。

悪性腫瘍の入院患者において電解質異常が頻繁に発生することを示す文献は、はるかに多く存在する。電解質障害は通常、腫瘍の診断に付随するが、それに先行する場合もあり、また、内科的または外科的治療と再関連付けられることもある(Schrierら 2013;RosnerおよびDalkin 2014)。
がん患者における電解質異常の正確な頻度は不明であり、がんの併存疾患とスチューディにおける電解質異常の因果関係を解明することは困難である(表1)。入院患者の電解質異常は急性かつ重篤であることが多いため、電解質異常はがんの先行因子としてではなく、がん自体によるものか、治療による合併症によるものと一般に考えられている(Miltiadous er al 2008)。
さらに、電解質異常は通常、特定の金属の血清総濃度を測定することによって決定される。しかし、多くの場合、血清濃度はその金属の体内負担のごく一部(Mgの場合は約1%)に過ぎず、大部分は骨、筋肉、軟組織などの他の器官に貯蔵されている。
血清値はいわゆる正常範囲内であっても、体内では特定の電解質が著しく欠乏している場合があり、欠乏による臨床的影響は結果として過小評価される可能性がある。近年、慢性的で軽度の電解質異常が一般集団にも存在することが明らかになり(Liamis er al 2013)このような状態は、おそらく多くの患者においてがんの発症に先行する静かな危険因子である可能性が示唆されている。
* *
本総説では、臨床的に重要な3つの電解質異常、すなわち低ナトリウム血症、低カリウム血症、低マグネシウム血症について主に考察する。これらの疾患は脱塩水の摂取に起因し、さまざまな種類の癌と関連している。それぞれの症状は、水や食品に含まれる特定の金属の摂取量の減少によって引き起こされ、これらの金属はしばしば共通の代謝経路を持つ。
低ナトリウム血症は、水分のバランス障害と密接な関係があり、したがって、通常、抗利尿ホルモンであるバソプレシンの過度の乱れによって引き起こされる。低カリウム血症は、しばしばレニン・アンジオテンシン系の活性の上昇に関係し、消化管カリウム損失を誘発し、また低カルシウム血症の一因となることもある。
低マグネシウム血症は、通常、ナトリウムと水の代謝に関連した腎臓または消化管のマグネシウム喪失の結果である。がん患者の電解質異常に関する研究のほとんどは、低ナトリウム血症に焦点を当てたものであり、悪性腫瘍に併存する低カリウム血症、高カルシウム血症、低マグネシウム血症やこれらの病態の因果関係についてはほとんど研究されていない。

低ナトリウム血症は、がん診療でよく見られる電解質異常である(Onitiloら 2007;Schrierら 2013)。研究により、がん患者における低ナトリウム血症の有病率は約4%から47%と高いことが報告されている(Castilloら 2012;RosnerおよびDalkin 2014)。
低ナトリウム血症の発生率と有病率は、がんの種類、臨床環境、血清ナトリウムのカットオフ点、化学療法剤(特にシスプラチンおよびカルボプラチン)による治療によって大きく異なる(Castilloら 2012)。低ナトリウム血症および一般的に関連する代謝性ナトリウム調節障害は、不適切な抗利尿ホルモン症候群(SIADH)と呼ばれ、脳腫瘍、血液学的悪性腫瘍、胸腔内非肺停止癌、皮膚腫瘍、消化器癌、婦人科癌、乳癌および前立腺癌に関連している(Gillら 2006;Miltiadousら 2008;Waldら 2010;Chawlaら 2011)。
他の研究でも、非ホジキンリンパ腫、腎細胞癌、および胃癌肺癌の患者における低ナトリウム血症と死亡率の間に顕著な関連があることが示されている(Doshiら 2012;RosnerおよびDalkin 2014)。肺がんの高リスク者を特定するためのバイオマーカーとして低ナトリウム血症を使用することが提案されている(Kasi, 2012)。
低ナトリウム血症が併存する癌の原因なのか結果なのかを、現在利用可能な診断手順に基づいて解読することはしばしば不可能であることは強調されるべきである(Hsu er al)。) しかし、1つだけはっきりしていることがある。低ナトリウム血症は腫瘍の病態を複雑にし、転帰の悪化につながる(Onitilo er al 2007)。
* *
低カリウム血症は、がん患者で遭遇する2番目に多い電解質異常である(O’Reganら、1977;Milionisら、1999;Filippatosら 2005)。気管支カルチノイド腫瘍、小細胞肺癌、肺腺癌、胸腺腫瘍、膵臓腫瘍、甲状腺髄質癌など、数多くの悪性腫瘍がカリウム障害と関連している(Isidoriら 2006)。
ほとんどの場合、低カリウム血症の病因は多因子性であり、カリウムの消化管および腎臓の損失(Rosner and Dalkin, 2014)またはコーラソフトドリンクなどのカリウムの少ない液体の大量慢性消費(Tsimihodimos et al, 2009)などが挙げられる。
低カリウム血症はまた、他の電解質障害(低ナトリウム血症、低カルシウム血症、低リン酸血症、低マグネシウム血症および非アニオンギャップ代謝性アシドーシス)と関連してよく見られ(ミリオニスら、1999)鉱物の代謝サイクルの根本的な連関を反映している。高カルシウム血症の患者はまた、カルシウム値上昇によるカリウレシス効果により、低カリウム血症を起こすことがある(AldingerおよびSamaan、1977)。
* *
マグネシウム欠乏症(低マグネシウム血症)は、世界的によくみられる現象である。米国では、成人の不十分なマグネシウム摂取の有病率は、男性で約64%、女性で67%である。71歳以上の高齢者では、その割合は男性で81%、女性で82%に上昇する(Moshfegh er al)。
マグネシウムの摂取量が最適でないことは、他の国でも同様に報告されている(Larssonら 2005;CastiglioniとMaier 2011;Quら 2013)。マグネシウムはゲノムの安定性を維持するのに必須であり、DNA合成と修復に関わるほとんどの酵素系の補酵素である(Hartwig, 2001)。
ヒト集団における多くの前向き研究により、細胞内マグネシウム濃度の低さと大腸(結腸および直腸を含む)がんのリスク増加との間に有意な関連があることが報告されている(Larssonら 2005;FolsomおよびHong 2006)。
45-74 歳の日本人男女を対象とした最近の研究では、マグネシウムの食事摂取量の増加により、大腸がん罹患率が 35%、結腸がん罹患率が 52%減少することが報告されている(Ma er al 2010)。興味深いことに、過体重または 2 型糖尿病患者において、マグネシウムの摂取がインスリン感受性を改善する ことにより大腸がんリスクを予防する可能性が 2 つの研究で示されている (van den Brandt et al 2007)。
低マグネシウム状態は、ヒトにおける炎症性ストレスの増加と関連しており、炎症と癌の関連は確立されたパラダイムである (Colotta et al 2009; Nielsen, 2010)。血清マグネシウム濃度は、治療とは無関係に、固形新生物の患者において頻繁に減少することが分かっており、その減少は悪性腫瘍の病期と相関している(Sartoriら、1992)。

低カルシウム血症が癌のリスクであるという最初の直接的な判断は、CarruthersとSuntzeff(1944)が、過形成マウス表皮におけるCa2 þレベルの低下が前癌状態における重要な特徴であることを示した70年以上前になされたものである。
それ以来、発癌と腫瘍の進行の両方におけるカルシウム代謝の研究は、癌生物学の重要な側面となっている(Marchi and Pinton, 2016)。Ca2 þ恒常性の調節障害は、がん細胞の転移行動やアポトーシスに対する腫瘍抵抗性の付与に重要な因子であり(Mueller er al 2005)チャネル、ポンプ、交換体などの細胞内カルシウムシグナルの調節を担うタンパク質の発現変化が様々ながんで報告されている(Monteith er al 2012;Farfariello er al 2015)。
癌のいくつかの共通の特徴を制御するCa2 þチャネルの重要性は、(i)成長シグナルおよび異常な細胞増殖のリモデリング、(ii)antigrowthシグナルの増強、iii)プログラム細胞死(アポトーシス)の回避、ならびに(iv)組織侵入および転移において重要な役割を果たすと認識されている(Farfariello er al 2015)。
カルシウムの栄養失調は、世界中で何百万人もの人々に影響を与え、特に東南アジアの国々で流行している(Peterlikら 2013年;Rossら 2011)。長年にわたり、多くの観察研究により、カルシウム不足が様々な癌、特に色直腸癌および乳癌の重大な危険因子であることが示されている(Parkら 2009;Peterlikら 2013)。
腎臓がん、胃がん、膵臓がん、卵巣がん、子宮内膜がん、肺がん、および多発性骨髄腫の発症に対するカルシウム摂取量の低下の寄与も報告されているが、エビデンスはまだはっきりしない(Bristow et al 2013)および(Peterlik et al 2013)による総説あり)。
Caサプリメントに関する多くの無作為化プラセボ対照試験で、がんの転帰について報告されている。これらの試験の1つは、Ca単剤療法が総発癌リスクを47%減少させ、ビタミンDの同時投与で60%減少させることを明らかにした(Lappeら 2007)。
対照的に、CaとビタミンDを併用または併用しない他のランダム化プラセボ対照試験では、がんリスクに対する効果の証拠は見つからなかった(Huncharekら 2009;Chlebowskiら 2008;BollandとReid 2008;Avenellら 2012)。
カルシウムサプリメントの効果に関する 5 つのコホート研究のデータをプールした解析では、大腸がんリスク が 24%減少したことが報告されている (Huncharek et al 2009)。26,335 例の大腸がん症例を登録した 60 件の疫学研究のメタ解析では、北米の大腸がんリスクは 55%減少し、すべての国の合計では 23%減少したと報告されている (Huncharek er al 2009)。
これらの研究は、がん患者における低カルシウム血症の発生率が十分に報告されていないことを示唆している (Fokkema et al 2005; Yener et al 2008)。* *
電解質代謝に重要な役割を果たすカリウムチャネルは、様々な健康細胞やがん細胞に広く分布し、細胞増殖や新生物成長、また腫瘍の進行や悪性化に関与しており、多くの種類の腫瘍やがん細胞で発現異常が認められている(Wangら 2002; Kunzelmann 2005; Pardo and Stühmer 2014;Comesら 2015)。
がん細胞は、電解質と水分のバランスを維持する際に、非悪性細胞と同じイオンチャネル、ポンプ、交換体を使用している。細胞シグナル伝達における役割を通じて、チャネルタンパク質とイオンポンプは、成長因子、細胞接着および他のシグナル伝達分子との高分子複合体の形成を仲介することができる。
低電解質負荷への慢性的な曝露がNaþ、Kþ、Mg2 þ、Ca2 þチャネルの発現を変化させることの因果関係はまだ十分に解明されていないが、異常な細胞周期制御と増殖、細胞接着-移動、細胞運動、形と体積の制御、アポトーシスと血管形成に対するそれらの役割は、ますます精査されている(Litan and Langhans 2015)。
異常なチャネルとポンプによるシグナル経路のリモデリングは、細胞が細胞外空間を通り抜ける方法を見つけるために、接着、収縮、剥離の適切なタイミングに必要な細胞骨格の再配列を制御する。この多面性のために、イオンチャネルとポンプは、細胞の運命を制御することができ、多くの種類の腫瘍の発生に関与しており、癌はチャネル異常症と呼ばれるようになった(Litan and Langhans, 2015)。イオンチャネルの操作は、がん治療のターゲットとしてますます支持されている。
4. 電解質の調節異常とがんの特徴
細胞の容積と浸透圧ストレスによって制御されるプロセスのリストは、生命本そのものを読むようで、成長と増殖、膜輸送、エキソサイトーシス、エンドサイトーシス、細胞の形状変化、ホルモンシグナル伝達、代謝、興奮性、神経伝達、細胞移動、栄養供給、廃棄物ろ過、壊死とアポトーシスなどが含まれる (Casey et al 2015; Nahta et al 2015)。
これらは、癌の共通の特徴の一つである(Hana-han and Weinberg, 2011)。電解質異常ががんの発生、進行または転移のプロセスを仲介することができる多数のチェックポイントがあることは明らかである(図2)。
穏やかな低張力条件下では、細胞は膨張し、横方向の張力の増大は、微絨毛やカベオレのような突起や侵入に蓄えられた過剰な膜面積を犠牲にすることによって部分的に補われる(Pietuchら 2013)。低張溶液への曝露は、過剰な表面積の除去および細胞膜を横切る浸透圧の上昇による張力の増加により、細胞のさらなる硬化をもたらす(Pietuchら 2013)。
これらの浸透圧ストレスは、クロマチンの内部構造と配置を変化させ、核膜と孔、さらに細胞内イオンと巨大分子の濃度を変化させる。これらの浸透圧に敏感なプロセスは、遺伝子転写や核・細胞質間輸送に影響を与え、細胞分化、移動、メカノトランスダクション、DNA修復、腫瘍形成に重要な影響を与えることが示されている(Finan and Guilak, 2010; Martins et al, 2012)。
* *
浸透圧ストレスは、複製されたゲノムが染色体対に圧縮される細胞分裂の最終段階(有糸分裂)に強い影響を与えることができる(Burgessら 2014)。低張状態への曝露による有糸分裂細胞の膨潤は、有糸分裂プロセスを停止させることが示されている(Huges, 1952; Burgess er al 2014)。
低張ストレス下では、停止は(高張ストレス下よりも)はるかに安定ではなく、染色体の脱凝縮、キン・トコアおよび紡錘体構造の破壊、および分離していない染色体の周りの核膜の再編成によって特徴付けられる有糸分裂の滑りを細胞が急速に受けることができ(ブリンクリーら、1980;フォードおよびコンゲディ、1987)これらはすべて染色体異常および倍数体を通してゲノム不安定性を促す(ノワック、1987;Burgessら 2014)。
この経路を介して、低張力ストレスへの曝露は、細胞の発癌感受性を高めることができ、この有糸分裂の特徴は、低張力溶液を使用して、癌細胞による化学療法(タキソールなどの白金系治療)の取り込みを高める取り組みにつながった(Stephenら、1990; Katanoら、1997)。
* *
ATPは多くの細胞種で機械的負荷により放出されるが、癌遺伝子の観点から細胞外培地中のATPの生理的機能が理解され始めたところである。Nandigama et al 2006)による研究では、低張力ストレス時に放出されるATPは、前立腺癌細胞の増殖を刺激し、プリン作動性受容体をac-tivated、細胞内カルシウムイオンを増加させ、MAPKs ERK1/2とp38およびホスファチジルイノシトール3キナーゼ(PI3K)に関わる下流のシグナル伝達カスケードを開始させることができたことが明らかにされた。
* *
彼らは、低張ストレスによるMAPKの活性化、カルシウム応答、細胞増殖の誘導が、ATPスカベンジャーであるアピラーゼとのプレインキュベーションによって抑制されることを示し、低張ストレスによるシグナル伝達経路が放出ATPによって誘導されることを示唆した。
彼らはまた、低張ストレスがプロスタグランジンE2(PGE2)合成を増加させ、それが結果的にPI3Kのアンタゴニストによって阻害されたことも報告した(Nandigama er al)。) 関連する研究では、SK-N-ASとSHSY5Y細胞を低細胞外ナトリウムに曝露したところ、40以上の異なる遺伝子が発現し、酸化ストレス(癌発症の危険因子)に対する転写反応を示すHeme oxygenase遺伝子が最も高く発現した(Benvenuti er al 2013)。
* *
細胞の休眠は、原発巣から離れた部位に散在する孤立したがん細胞の増殖を防ぐことにより、メタ静的プロセスの制限ステップとみなすことができる(Townsonら 2003;Townson and Chambers 2006;Chaffer and Weinberg 2011)。
細胞の休眠状態への移行や維持を制御するメカニズムは十分に解明されておらず、細胞が休眠状態を脱するよう誘導する内部または外部の合図についてはあまり知られていない。Havard et al 2011)は、アンドロゲン感受性前立腺癌細胞に関する最近の研究において、培養液の浸透圧が細胞のクローニング効率を調節する重要なパラメータであることを発見した。
彼らは、浸透圧のわずかな変動が、研究対象細胞の休眠状態を誘導するのに十分であることを報告した。前立腺癌細胞のドーマンシーの誘導は、実験の低張性条件から高張性条件まで連続的に増加することがわかり、生理的範囲内のわずかな浸透圧の変化でも生物学的に大きな影響を与えることが示唆された。
興味深いことに、人間の喉の渇きに伴う浸透圧の変化は、正常な血漿浸透圧より10〜20mOsm/リットル高い(Singer and Brenner, 2008)が、数日間維持すれば、前立腺癌細胞のクローン形成性に影響を与えるのに十分であることが判明した(Havard er al)。
この誘導型休眠は、浸透圧以外の追加刺激で元に戻すことができる、分散した細胞に特有の安定した細胞分裂の遮断など、生体内試験のがん細胞の休眠といくつかの点で類似していた。休眠の確立と維持には、smad経路とp53経路が関与していることが示され、生体内の幹細胞やがん細胞の休眠と共通のメカニズムであることが示唆された(Havard er al)。) 浸透圧が、ヒトにおける休眠やメトーストの誘導に直接的な役割を果たすかどうかは、現時点では未解決の問題である。
* *
電解質サイクルの調節障害は、COX-2,NF-jB、STAT3及びiNOSを含むGI細胞における炎症経路を活性化し、その後、細胞サイクルの増加、腫瘍抑制経路の阻害及び癌遺伝子の活性化によって腫瘍形成を促進し得る(Ohshimaら 2005;Berasainら 2009;Wangら、1996;Moorら 2010;Wilson及びGeorgeら 2014)。
さらに、腫瘍が設立されると、正常な恒常性状態の調節障害は、アポトーシスの阻害、細胞増殖および血管新生の促進、細胞接着の調節および転移の促進によって、その進行を媒介することができる(Wilson and George 2014)。
現在までに、食道、胃、胆嚢、膵臓、大腸、肝臓を含む様々な固形腫瘍と電解質不均衡/浸透圧ストレス/炎症の併存が多くの研究で報告されているが(Lu et al 2006; Roa et al 2006; Berasain et al 2009)その因果関係はまだ解明されていない。
* *
アクアポリン(AQP1-13)は、水・塩分の恒常性に重要な役割を果たす膜水チャネルで、ヒトのがんとの関連も指摘されている(Verkman, 2012)。腫瘍形成の正確な生物物理学的メカニズムは現在のところ不明だが、AQPによって促進される細胞移動は、血管新生だけでなく腫瘍の広がりや他の疾患にも関連する一般的な現象のようである (Verkman et al 2012)。
腫瘍細胞におけるAQP1の発現は、血管を越えて外部に侵入する能力を高め、局所的に侵入することが再提示されている(Hu and Verkman, 2006)。AQP3が細胞増殖に関与することは、皮膚や結腸など様々なAQP3発現細胞で報告されている(Verkman er al)。
浸透圧の変化はAQPの形成を促進し、結果としてAQPに関連した血管新生や腫瘍増殖のメディエーターとなる。重要な発見は、AQP3欠損マウスの腫瘍表現型である。このマウスは、野生型マウスでは複数の腫瘍が生じる腫瘍イニシエーター・プロモータープロトコルに応答して、皮膚腫瘍の形成に完全に抵抗性を示す(Hara-Chikuma and Verkman, 2008)。
AQP3の阻害は、腫瘍細胞の移動と増殖の両方を抑えることができるため、例えば「電解質バランス」のとれた飲料水の摂取によるAQP3阻害が、一部の腫瘍の予防や治療のターゲットになる可能性が示唆されている(Verkman er al)。
* *
電解質の不均衡や浸透圧ストレスによるレニン-アンジオテンシン系(RAS)の活性化は、発がんとの関連が指摘されている経路の一つである。RASとがんとの関連は、多くの疫学的研究や介入研究で報告されており、その多くは、RASの活性化ががんの発生および/または進行の予測因子であることを示している(Agerら 2008;Georgeら 2010)。
RASは、血管新生、浸潤、生存シグナル、増殖、炎症など、がんに関連する様々な生理機能を制御することが知られており、多くの試験管内試験、動物、臨床研究において報告されている(Agerら 2008; Georgeら 2010)。
アンジオテンシンII(AngII)は、RASの主要なメディエーターであり、その局所生成は、膀胱、脳、子宮頸、結腸、腎臓、肝臓、肺、膵臓、前立腺、皮膚、胃の癌腫を含む多くのヒト腫瘍で実証されている(Tallant et al 2006)、Ager et al 2008)、Gallagher et al 2011)の総説あり)。
マウスモデルでは、アンジオテンシンIIは、炎症、血管新生、腫瘍細胞の移動および転移を媒介し、抗腫瘍免疫を抑制することによって腫瘍の進行を促進する腫瘍促進性マクロファージの産生を促すことが示されている(Cortez-Re-tamozoら 2013)。
腫瘍形成におけるRASおよびAngIIの媒介的役割の他の可能な説明には、腫瘍成長を促進するためのK-ras細胞癌遺伝子の発現および活性(Kingら 2014)ならびにERK1/2およびNF-kappa B癌遺伝子の活性化(Pageら 2002)が含まれる。
アルギニン・バソプレシン(AVP)の分泌は、浸透圧および非浸透圧因子によって刺激され、血漿浸透圧の変化がAVP放出の主要な刺激となる(Petersら 2007)。前立腺癌、精巣癌、卵巣癌、膵臓癌、結腸癌、鼻咽頭癌、腎臓癌、胃腸癌などの様々な種類の癌において、バソプレシンが細胞成長および増殖機構に関与することを示唆する研究が増えている(North 2000,Bolignanoら 2010,Khegaiら 2014,Northら 2014)。
AVSは、AVSが発現しているほとんどの癌の細胞表面に存在するV2-Rを含む受容体を介して、腫瘍の増殖や代謝に多面的な作用を及ぼすことが示唆されている(North, 2000; Treschan er al 2006)。我々は、バソプレシンの発現は、細胞の生存と成長を最大化するための選択的な変換を目的とした、特殊な発育促進プロセスの一部であると考えている。
STEPS(Selective Tumor gene Expression of Peptides essential for Survival)として知られるこの概念は、ペプチド産生腫瘍がペプチド遺伝子を発現するだけでなく、これらのペプチドが腫瘍成長および移動性に影響を及ぼすことが知られている受容体の遺伝子を発現するという発見によって裏付けられている(North 2000;North et al 2014)。
AVSを発現する腫瘍の患者に非常によく見られる併存症は、抗利尿ホルモンの不適切な分泌症候群(SIADH)である。水と電解質の恒常性の異常が、腫瘍細胞によるAVSとそのアゴニストの発現の引き金となり、AVSと受容体遺伝子の複合発現が、これらの腫瘍のオートクライン増殖ループとみなすことができる重要な役割を果たしていると推定される。
* *
Tonicity-responsive enhancer-binding protein (TonEBP) は、Nuclear factor of activated T cell 5 (NFAT5) としても知られ、転写活性化物質のRelファミリーのメンバーである (Miyakawa et al 1999; Graef et al 2001)。
NFAT5はもともと腎髄質で発見され、アスベタイン-GABAトランスポーター-1(BGT-1)アルドース還元酵素(AR)ナトリウム-ミオイノシトール輸送体(Smit)などの浸透圧調節遺伝子の発現を駆動することがわかった。タウリントランスポーター(TauT)熱ショックタンパク質(HSP)70などの体液調節遺伝子や、アクアポリン2(AQP-2)尿素トランスポーターA(UT-A)などの尿濃縮機構に関わる遺伝子(Kuper er al, 2014)。 肺がん、メラノーマ、乳がん、大腸がん、腎がんを含む様々ながんの病態形成にNFAT5が関与しているという報告が多数ある(Zhongら 2004;Mijatovicら 2006;Levyら 2010;Chenら 2011;Germannら 2012;Kuperら 2014)。
乳がん、結腸がん、および腎臓がん細胞において、NFAT5は、メタスタシン-1(MtS1)としても知られるプロ転移因子S100A4の発現を促進することが示されている(Garrettら 2006;Chenら 2009;2011)。
浸透圧ストレスは、NFATSとS100A4による腫瘍形成の重要な要因である。浸透圧ストレス下では、腎臓がん細胞においてNFAT5が大量に発現し、その結果、S100A4の発現が増強される。NFAT5をノックダウンすると、S100A4の発現が鈍化し、細胞の増殖および移動活性も低下する(Kuperら 2014)。
* *
細胞の体積変化に対する二次的な反応には、遺伝子発現、代謝、ストレス耐性のレベルで広範囲の細胞機能を標的とするシグナル伝達経路のダウンストリーム活性化が含まれる(Zonia and Munnik, 2007)。
哺乳類細胞では、増殖とアポトーシスは、受容体型チルオキシキナーゼ(RTK)によって高度に制御されており、MAPKや細胞生存促進タンパク質キナーゼB(Akt)など、一連の下流シグナル伝達経路を活性化することができる(Marshall, 1994)。
一般に、高浸透圧ストレスと細胞収縮は、p38 MAPKとJNKの活性化、細胞周期進行の抑制とアポトーシスの促進を伴う。一方、低浸透圧ストレスと細胞の膨張は、MEK1/2-ERK1/2およびホスファチジルイノシトール3キナーゼ(PI3K)-Akt経路の活性化に結びつき、アポトーシスを阻害し増殖性の再応答を促す(Xiaら、1995;Chuangら 2000;Gillisら 2001;Hoffmann and Pedersen 2001;Shrodeら、1998)。
したがって、浸透圧ストレスは、キャンセルの特徴である抗がん作用や細胞増殖につながる可能性のあるシグナルカスケードを活性化または不活性化することができる。さらに、細胞容積の変化は、異なるシグナル伝達カスケード間のクロストークに影響を与える可能性がある。
例えば、細胞膜の水に対する伝染性は、水(およびいくつかの小さな中性溶質)の膜を通過する流れを可能にするアクアポリンチャネルによって大きく向上する(Chaumont er al)。) アクアポリンは、動物、植物、菌類、細菌細胞において、浸透圧センサーおよび細胞体積の調節因子として機能することが示唆されており(Hill et al 2004)大きな体積変化を受けた細胞ではアクアポリンが高いレベルで発現し、細胞のプロ増殖が促進されることを示唆している(Tyerman et al 2002)。言い換えれば、電解質の乱れは、代謝プロセス間のクロストークを媒介することができる。
電解質機能不全の細胞効果は、ある意味で、細胞の種類に応じて細胞に対してプロおよびアンチアポトーシス効果の両方を引き出すことができる多くの低用量環境発癌物質への曝露の効果と似ている(Langieら 2015年;Narayananら 2015)。
低用量発癌物質への曝露と同様に、浸透圧ストレスや電解質異常によるDNAの損傷は、2つの結果をもたらす可能性がある。損傷が多数の修復経路のうちの1つに従って修復されるか、あるいは細胞が-
* *
-または、損傷によって誘発されるアポトーシスを受けるかである。したがって、逆説的な方法で、損傷が発癌性突然変異に固定されるのを防ぐ役割を担う同じDNA修復経路が、開始されたものの損傷を受けた細胞の生存を促進することがある(Langieら 2015年;Caseyら 2015)。
多くの金属(鉛、ニッケル、コバルト、メチル水銀など)は、ゲノムの不安定性を促進する能力において発癌促進性であり、同時にアポトーシスを促進する能力において抗発癌性である(Huら 2015; Nahtaら 2015)。
したがって、環境中の多くの低用量汚染物質と同様に、電解質の乱れは、ゲノムの変化、癌遺伝子の発現、シグナル伝達の改変、さらには低酸素など、多種多様なメカニズムによって、癌の特徴に向けた素因影響を行使することができるのである。
4.1. 湾岸地域における海水淡水化とがん発生率
カタール、サウジアラビア王国(KSA)バーレーン、オマーン、クウェート、アラブ首長国連邦(UAE)からなるアラビア湾岸地域では、再生可能な水資源が極めて乏しく、急速な経済成長、ライフスタイルの大きな変化、地域人口の急成長に伴い、海水の消費が最も盛んである。
湾岸協力会議(GCC)諸国は 2013年の世界の海水淡水化生産能力の約70%を占めている(Al Hashemi er al 2014)。UAE、クウェート、バーレーンでは飲料水の60%以上を海水化が占め、サウジアラビアでは都市部で使用する水の70%以上を、カタールでは飲料水供給の99%以上を提供している(Darwish er al 2013)。
海水淡水化プラントへの継続的な投資により、GCC諸国の生産能力は2020年までに日量1億立方メートルを超えると予測されており(Al Hashemi er al 2014)この地域全体の飲料水の90%以上をこの水源が占めることになる。
GCC諸国は、脱塩水の長期消費に関する進行中の実験場と見なすことができ、このような消費に伴う健康リスクはまだ評価されていない。この実験は、世界の他の地域にも急速に拡大しつつある。さらに、イオン交換、ポイントオブユース(POU)ポイントオブエントリー(POE)ろ過システムの普及により、天然淡水が飲料水として利用されている地域でも、低ミネラル水の消費は世界の多くの地域で拡大しつつある。

GCC諸国における電解質異常の有病率に関する情報は非常に限られている。サウジアラビアでは、慢性喘息患者における電解質障害の有病率は一般的で43~68%と推定され、急性重症喘息ではその割合ははるかに高い(98%)(Omar,2001; Mohammad et al,2014)。
サウジアラビアのリヤドにおける糖尿病患者の研究では、87%が低ナトリウム血症であり、低カレミアについては症例と対照の有病率に差はなかった(Al Jameil, 2014)。比較すると、世界各地の53の研究による軽度の低ナトリウム血症のプール推定平均値(PEM)は、老人病棟で22%、その他の病院病棟で17%、老人ホームで19%であった(Mannesse er al)。
GCC地域のがん患者における電解質異常に関する研究はさらに少ない。2008年から2012年の間にカタールのCenter for Cancer Care and Researchの患者2048人を調査したところ、前立腺がん(57.1%)汎膵がん(50%)肝がん(49%)肺がん(40.2%)さらには乳がん(23.5%)で中等度から重度の低ナトリウム血症が非常に高い割合で見られた(Abu-Zeinah er al 2015)。
中等度から重度の低ナトリウム血症(Nao130mmol/L)の患者は、正常・軽度の低ナトリウム血症(NaZ130)の患者に比べて4.28倍死亡しやすく(Po0.05)低ナトリウム血症の重症度が高い院内死亡率と関連する独立因子であることが示された(Abu-Zeinah er al 2015)。カタールや他のGCC諸国では、がんと電解質異常の併存が一般的な現象であると推測される。
* *
GCC地域におけるがんの発生率に関する正確な情報は、スクリーニングプログラム、包括的ながん登録、体系的なデータ収集の取り組みがないため、非常に限られている(Al-Madoujら 2011;Brownら 2012;Al-Othmanら 2015)。
入手可能な限られた情報は、この地域におけるがん罹患率の急激な上昇を指摘している。1998年から2009年の間、GCCにおけるがん罹患の平均年間年齢標準化率(ASR)は10万人当たり82.9人(Al-Othman er al 2015)新規がん患者数は2020年までに50〜70%増加すると予測されている(Folley er al 2012)。
男性では、大腸がん(全体の9.2%)肝臓がん(7.3%)膀胱がん(4.8%)胃がん(4.6%)など消化器系のがんが最も多い。女性では、乳がんが最も多く(がん全体の24.2%)次いで甲状腺(9.2%)大腸(7.6%)となっている(Al-Othman er al 2015)。大腸がんの患者数は、1998年から2009年の間に男性で3.4倍、女性で2.1倍と急速に増加している。

-増加率は世界でもトップクラスであった(Al-Othman er al 2015)。カタールの研究では、1996年から2006年にかけて、腸管系(大腸、食道、直腸、胃、小腸)および泌尿器系(腎臓、膀胱、前立腺)のがんがカタール男性の悪性腫瘍のトップであったと報告されている。
女性では、消化器系トラックガンの発生率は乳がんに次いで高かった(Bener er al 2007)。カタールにおけるASRの増加は、1991年から2006年にかけて57%と推定されている(Bener er al 2007)。
西アジア 9 カ国(バーレーン、イラン、ヨルダン、クウェート、レバノン、オマーン、カタール、サウジアラビア、トルコ)の 2012 年の全国データを調査したところ、肺がん、前立腺がん、膀胱がん、胃がん、大腸がん、食道がんなどのがんが多いことが明らかになった。
男性に多い悪性腫瘍は、肺がん、前立腺がん、膀胱がん、大腸がん、食道・咽頭がんであるのに対し、女性に多いのは、乳がん、大腸がん、甲状腺がん、胃がん、口腔・咽頭・食道がん、肺がんなどであることがわかった(Roshandel er al, 2014)。
これらの割合で注目すべきは、GCC諸国で急激に上昇していることである(図3)。摂取した脱塩水に直接さらされる可能性が高い臓器や、水の代謝輸送や排泄に関与する臓器の発がん率が、GCC諸国における脱塩水供給の増加に連動して上昇しているように見えることは、偶然ではないのかもしれない。
* *
アラビア湾岸地域では、がんの発生率が急速に増加していることが再認識され 2014年10月にリヤドで開催された大規模な医学研究会議のテーマとなった(Al-mutairi, 2015)。これらの国々では 20-30年までにがんの発生率が現在の2倍になると予測されており、他の国のがん発生率の予測をはるかに上回っている。
GCCにおけるがんの特徴は、一般的に北米やヨーロッパなど世界の一部の地域とは異なっている。GCC地域では、前立腺がん、肺がん、子宮頸がんが最も多い先進国とは対照的に、進行性の消化器がん(大腸がん、甲状腺がん、胃がん、膀胱がん、膵臓がん、非ホジキンリンパ腫など)が成人人口で最も多い(Al-Thman er al 2015)。
また、癌の多くが若年で発生することも顕著な特徴で、これはGCC諸国の若年層が生涯にわたって脱塩水を飲んでいることと関係があると考えられる。GCC地域におけるがんの発生と脱塩水の摂取を実際に関連づける証拠は、現在のところほとんど存在しないことは強調しておかなければならない。しかし、ナトリウム、カリウム、マグネシウム、カルシウムの濃度が低い「合成」水に慢性的に接しているこの地域では、この水が悪性腫瘍の危険因子となりうることを、現在得られている情報が示唆している。
もちろん、GCC地域における癌の有病率の増加には、多くの要因がある。衛生状態や医療水準の向上により、寿命が延び、生涯でがんにかかる可能性が高くなった。急速な環境経済成長により、これらの国の人々が多くの発癌性汚染物質にさらされる機会が増えている。
欧米のライフスタイルを取り入れることで、タバコの使用、座りっぱなしの生活、不健康な食事、その他がんと関連するリスク行動が増加した。がんのリスクに関する誤解や認識不足が原因で、患者が早期に治療を受けることができず、がんの転帰を改善する上で大きな障害となることがよくある。
検診プログラムはほとんど存在せず、がんに関する社会的・健康的な信念のために、受診率は低い傾向にある。この論文は、GCC地域におけるがん罹患率の上昇を抑制または予防することを目的とした介入戦略を開発するために、がんのすべての危険因子を完全に説明する必要性に注意を促している。
5. 結論
現在のところ、脱塩水自体が遺伝子変異を誘発するという点で、直接的にがんを引き起こす可能性を示唆する「決定的な」証拠は存在しない。しかし、脱塩水を摂取すると、浸透圧と張力が変化し、浸透圧調節機構(細胞の容積、イオン輸送、有機溶媒濃度、タンパク質構造、細胞のターンオーバー、その他の細胞パラメータを設定範囲内に維持するために設計された一連の保存適応機構)が相殺されてしまう(Kültz 2001)。
最近のエピデメトリー研究によると、ミネラル含有量の非常に少ない脱塩水を長期的に摂取すると、ナトリウム、カリウム、カルシウム、マグネシウム、その他の微量ミネラルが尿、便、汗に流出し、浸透圧の不均衡を引き起こす可能性があることが判明している。
低ナトリウム血症、低カリウム血症、低マグネシウム血症、低カルシウム血症などの電解質異常は、がん患者に最もよく見られる併存疾患であると多くの研究が報告しているが、併存疾患間の因果関係は、主にこれらの併存疾患のスクリーニングに用いられる現在の戦略の限界により解読することが不可能である。
我々は、電解質障害(特に低ナトリウム血症、低カリウム血症、低カルシウム血症、低マグネシウム血症)が、いくつかの重要な腫瘍促進機構といくつかの重要な防御機構の破壊を同時に引き起こすことによって、発がん性の結果をもたらすことを強調してきた。
いくつかの哺乳類細胞株を用いた研究から、体積変化(増加)および浸透圧ストレスは、DNA損傷を促進し、染色体異常につながるDNA修復を阻害し、発がんに関与するいくつかのシグナル伝達経路を活性化させることが示唆されている。さらに、浸透圧調節機構で重要な役割を果たす多くの遺伝子は、発がん性の特性を有している。
抗利尿ホルモン、アルギニン・バソプレシン(AVP)アクアポリン(AQP1-3)アルドステロン、アンジオテンシンIIなどの発現は、電解質バランスを維持するためのチェックポイントの一つで、がんの特徴とも密接に関連している。カタールおよび他のGCC諸国では、男性で最も高い悪性腫瘍率、女性で2番目に高い悪性腫瘍率が、摂取した水の影響にさらされるリスクが最も高い消化管および泌尿器系(腎臓、膀胱、前立腺)で発生している。GCC諸国における最近のいくつかの癌の増加の一因として、脱塩水の長期摂取がミネラルの不均衡を生み出しているかどうかは、今後の研究課題であろう。
* *
この報告書の副次的な目的は、人間の健康を守るために海水淡水化水の適切な後処理目標とみなされるべきものについて、注意を喚起することだ。
* *
この高度に規制された食品システムの時代に、我々の食事がバランスよく、ライフステージに必要な栄養素を適切な量で摂取できるようにするための努力がなされてきたことは皮肉なことだ。実際、ほとんどの人がそうしている。しかし、世界の多くの地域では、飲料水のミネラルバランスが崩れ、食品の栄養価の向上が妨げられ、地域住民の健康が脅かされる事態に直面している。
過去数十年間、バランスの取れた食事は健康のためのマントラであった。この報告書は、バランスの取れた水(電解質)が、バランスの取れた食事と同じくらい、我々の健康を守るために重要であることを示唆している。
