COVID-19における腸-肺軸と生体機能障害
www.ncbi.nlm.nih.gov/pmc/articles/PMC7314510/
要旨
COVID-19は、SARS-CoV-2による新規感染症であり、世界中で数百万人が感染し、高い死亡率を記録している。
SARS-CoV-2は主に肺感染を引き起こすが,COVID-19患者の消化器症状や感染者の糞便からウイルスRNAが検出されたことから,SARS-CoV-2の糞便経口感染経路の可能性が注目されていた.しかし、ウイルス感染にはウイルスRNAだけでなく、感染性ウイルス粒子も必要であり、感染性ウイルス粒子が糞便-口腔感染経路を介して感染することはまだ証明されていない。
腸内細菌叢と肺のクロストークは、免疫系との関連性により、宿主のホメオスタシスや病気の発症を維持していることが明らかになってきている。
この腸と肺の相互作用は、肺外症状を持つ患者におけるCOVID-19の重症度に影響を与える可能性がある。
COVID-19の重症度は、主に高齢者や基礎疾患と関連している。腸内細菌叢の多様性は加齢とともに減少するため、高齢者がCOVID-19による重症化のリスクが高い理由と考えられる。腸内細菌叢は免疫系や肺と双方向の関係にあるため、COVID-19の経過に寄与していると考えられる。
腸内細菌叢の異常は、二次感染や多臓器不全につながる腸の透過性をもたらする。逆に、腸内細菌叢の異常による腸管バリアの完全性の破壊は、肺から循環系およびリンパ系を介して腸管内腔へのSARS-CoV-2の転座につながる可能性がある。
本総説では、敗血症に関与する腸内細菌叢の腸内細菌叢異常がSARS-CoV-2感染症の重症度に及ぼす役割を指摘した。さらに、SARS-CoV-2の糞便-口腔感染の曖昧さを明らかにすることを目的としている。
1. はじめに
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)と呼ばれる新型コロナウイルスが中国で検出され、重症急性呼吸器症候群コロナウイルス(SARS-CoV)と中東呼吸器症候群コロナウイルス(MERS-CoV)を合わせたものよりもはるかに高い死亡率で世界中の数百万人に影響を与えた(Y.C. Wu et al 2020;Zhu et al 2020)。
現在のコロナウイルスによる発熱と乾いた咳の症状を伴う疾患は、SARS-CoV-2が引き起こした世界的な健康危機が続いていることから、WHOによりCOVID-19と命名され、パンデミックと宣言された(世界保健機関、2020;Zhu et al 2020)。
SARS-CoV、MERS-CoV、および現在のコロナウイルスであるSARS-CoV-2を含む、ヒト疾患を引き起こすいくつかのコロナウイルス種が同定されている。ヒトコロナウイルスは、ほとんどが正極性の長い一本鎖RNAを有する(Hilgenfeld and Peiris, 2013)。
SARS-CoV-2ウイルスは、外表面にスパイク(S)タンパク質、エンベロープ(E)タンパク質、膜(M)タンパク質などの様々なタンパク質が埋め込まれた二重層脂質エンベロープ構造を有している(X. Li et al. SARS-CoV-2の完全ゲノム配列の系統解析の結果、この新規ウイルスはコウモリで検出されたSARS様コロナウイルスと89.1%のヌクレオチド配列同一性を共有していることが明らかになった。
SARS-CoV-2は、SARS-CoVと密接に関連しているが、MERSとはより遠い(Elfiky, 2020; A. Wu et al 2020; F. Wu et al 2020)。
抗ウイルス阻害剤の標的として使用されてきたSARS-CoV-2 RNA依存性RNAポリメラーゼは、SARS-CoVと90.1%の配列同一性を共有しているが、MERS-CoVとは56.7%である(Elfiky, 2020)。MERS-CoVがジペプチジルペプチダーゼ4(DPP4)を用いるのに対し、SARS-CoVおよびSARS-CoV-2はアンジオテンシン変換酵素2(ACE2)を用いてヒト細胞に侵入する。
SARS-CoV-2のACE2に対する受容体親和性は、2003年のSARS-CoV株よりも高いことが示されている(Wan et al 2020)。
SARS-CoV-2は、グローバル化の進展により、SARS-CoVやMERS-CoVに比べて急速に感染が拡大しているが、疾患の経過に関しては大きな違いはないようであり、臨床症状にはいくつかの類似点がある(Peeri et al., 2020)。この現在の感染症の発症様式はまだ明らかにされておらず、COVID-19の病態についての包括的な説明はないが、SARS-CoVおよびMERS-CoVのメカニズムは、SARS-CoV-2感染症の病態についてかなり貴重な情報を与えることができる。
COVID-19の死亡率は、年齢の異なる患者で見られているが、高齢者は依然としてより高いリスク群である(Xu et al 2020)。これまでの研究では、ほとんどの場合、疾患の重症度を高齢者および基礎疾患を有する患者と関連づけている。
しかし、リーキーガットが腸内微生物叢の異常菌によるCOVID-19の重症度にどのように寄与しているかは明確には明らかにされていない。
本レビューでは,敗血症に関与する腸内細菌叢の異常が,SARS-CoV-2感染症の重症度に及ぼす役割を指摘した.また,SARS-CoV-2の糞便-口腔感染の曖昧さを明らかにすることを目的としている.
2. COVID-19の消化器症状と提唱された仮説
武漢からのCOVID-19患者の発病時の主な症状は、レトロスペクティブ報告では発熱、咳、疲労と定義され、頭痛、下痢、嘔吐、腹痛などの症状は発生率が低いため、あまり一般的ではない症状として記載されていた(N. Chen et al., 2020; Huang et al., 2020; Zhu et al., 2020)。
しかし、異なる地域から収集されたより多くの情報および大規模な研究に伴って、胃腸(GI)症状を有する患者の発生率が増加している(Holshue et al 2020; Pan et al 2020; D. Wang et al 2020)。SARS-CoV-2に感染した患者の呼吸器疾患を示す共通の症状のため、COVID-19によって影響を受ける主な臓器は肺であるように思われる。
しかし、疾患の経過中に、肝臓や腸などの臓器の機能障害の発現または多臓器不全が報告されている(N. Chen et al 2020;D’Amico et al 2020;Feng et al 2020;Pan et al 2020;D. Wang et al 2020)。
その後、COVID-19患者から採取された糞便サンプルは、SARS-CoV-2核酸陽性であることが判明した(Y. Wu et al 2020)。呼吸器管内のウイルスRNAのクリアランスにもかかわらず、COVID-19患者の糞便サンプルは約11日間陽性のままであった。
したがって、腸内細菌叢および糞便微生物叢移植(FMT)に関する研究を行っているセンターは、SARS-CoV-2についてFMTドナーをスクリーニングすることを示唆し、ウイルスの糞便経口感染の可能性に注意を促した(Y. Chen et al 2020;Holshue et al 2020;T. Zhang et al 2020;Y. Zhang et al 2020)。
このことは、広範な免疫病理学または肺外SARS-CoV-2感染の存在を示唆している可能性がある。以前の研究では、COVID-19に類似した共通の症状を代表するSARS患者(2002)は、16〜73%の下痢を有していたと報告されている(世界保健機関、2003)。
この比率は、COVID-19を有する患者において2%か et al 20%の範囲であった(N. Chen et al 2020;Pan et al 2020;Xiao et al 2020;J. jin Zhang et al 2020)。報告間で比率が異なるが、これはおそらく病院によって下痢の診断基準が異なるためであろうが、呼吸器症状とともに消化器症状を過小評価してはならない(Liang et al., 2020)。
いくつかの研究では、SARS-CoV-2に関連した下痢は呼吸器症状の前にも現れる可能性があることが示唆されている(Lin et al 2020;Song et al 2020)。204人の患者を対象にCOVID-19の臨床的特徴を調査したPanらは、50.5%の患者で下痢、嘔吐、腹痛を含む消化器症状が認められたと報告している(Pan et al 2020)。
中には消化器症状のみを示す患者もいた。さらに、消化器症状を呈した患者では肝酵素値が高いほど重症度が高く、単球数が低いほど重症度が高くなることから、消化器症状の申告が多かったと報告している。
SARS-CoV-2の感染過程において、ウイルスのスパイクタンパク質はACE2受容体を認識し、II型膜貫通型セリンプロテアーゼ(TMPRSS2)を介して宿主細胞に侵入する(H. Zhang et al. ウイルスが宿主細胞に侵入するためには、これら2つのタンパク質が同じ細胞内で共発現している必要がある。
Zhangらは、単一細胞トランスクリプトーム解析を用いて、ACE2とTMPRSS2の発現パターンについて異なる細胞タイプを調べた(H. Zhang et al 2020)。その結果、これら2つのタンパク質は主に肺組織だけでなく、食道の上皮細胞や腺細胞、回腸や大腸の腸球でも共発現していることがわかった。
これまでの糞便中のウイルスRNAの検出データに加え、これらの結果は、SARS-CoV-2の感染が呼吸器系だけに留まらず、消化器系も同様に疾患の経過に寄与していることを示唆している。
しかし、今日までの限られたデータでは、COVID-19患者の腸症状を説明し、SARS-CoV-2が腸内ウイルスのように胃を通過して腸に到達し、腸管細胞に感染すると主張するための糞便-経口感染経路を提案することは困難であった。
Xiaらは、SARS-CoV-2に感染した73人の患者の便、尿、および血清をウイルスRNAのために入院中ずっと調べた(Xiao et al 2020)。さらに、彼らは、組織学的染色により、1人の患者からの消化管組織中のウイルス核カプシドおよびACE2を調べた。その結果、食道、胃、十二指腸、直腸の上皮からACE2、ウイルスRNA、ヌクレオカプシドが検出され、糞便からの経口感染がウイルスの体内拡散経路の一つであることが示唆された。
これらの結果は、SARS-CoV-2の作用機序を理解する上で注目すべきものであるが、患者数が1名と限られていることから、SARS-CoV-2が消化管細胞に感染したとするのは強すぎると考えられる。
また、上述したように、ウイルスが細胞内に侵入するためには、ACE2とTMPRSS2の両方が細胞内で発現している必要があり、ACE2の発現のみを評価してウイルスが細胞内に侵入したと結論づけることは不可能である。
研究では、大抵の場合、ACE2の組織分布およびSARS-CoV-2 RNAの糞便排出に基づいて、糞便-口腔伝搬を介して消化器系におけるSARS-CoV-2感染を推測することが多い(Y. Chen et al 2020;D’Amico et al 2020;Ding and Liang、2020)。
しかし、COVID-19患者の一部の組織および糞便中のウイルスRNA検出は、その領域のウイルスRNA負荷を支持するが、感染粒子を支持しない可能性がある。可能性はあるが、さらなる調査とさらなるデータが必要である。全体的に、腸症状や腸の損傷が、直接のウイルス感染の結果なのか、炎症に関連したものなのか、薬剤誘発性の損傷なのかは明らかになっていない。
3. 腸の異常症
ヒトの消化管は、500~1000種の細菌からなる1014個以上の細胞を宿主としており、これらは腸内細菌叢と呼ばれている(Gill et al., 2006; Ostaff et al., 2013)。
マイクロバイオータと免疫系の間には、バランスのとれた双方向の相互作用が存在する。マイクロバイオータが免疫系の発達と成熟において基本的な役割を果たしている一方で、免疫系はマイクロバイオータの組成と機能を形成している。このバランスの乱れは、ヒトの疾患につながる可能性がある(Gill et al. 2006; Proctor, 2011; Ostaff et al. 2013)。
様々な健康状態の動物およびヒトにおける腸内マイクロバイオータの組成に関する研究は、腸内マイクロバイオータが健康および疾患の主要な決定因子であり、免疫、消化、および病原性に影響を与えることを示唆している。また、腸内細菌叢は、生理学的および恒常性機能に関与する器官としても機能する(Schrezenmeir and de Vrese, 2001; Gill et al 2006; Proctor, 2011; Ostaff et al 2013)。
腸内細菌叢は、したがって、病原体や免疫enescenceを増加させる可能性のある感染症に対する腸上皮の完全性を強化する高齢者や食事の他の機能が高齢者に示唆されているように乱されることが判明している(Salazar et al 2017)。
腸内細菌叢の多様性は、老化とマイクロバイオーム組成物の間に減少し、不均衡な状態に変更された、いわゆるdysbiosisと呼ばれる、免疫機能障害と一般化した炎症につながる(アレマンとバレンツァーノ、2019)。
不健康なマイクロバイオームの指標と考えられているジスバイオシスは、喘息、関節炎、肥満、2型糖尿病などの様々な慢性疾患とリンクしている(Tai et al)。
65歳以上の人は、65歳未満の人よりもCOVID-19による死亡リスクが高いことが判明している(Ioannidis et al 2020)。
COVID-19患者における下痢の発生率および高齢者における死亡率の高さを合わせて考えると、COVID-19における腸-肺軸の関与の可能性を示唆している。これらのことから、腸内細菌叢の直接的な変化は、ヒトの不健康な状態を予防または治療するために利用できる可能性があることが示唆される。
腸内細菌叢は、肥満やインスリン抵抗性などの代謝症候群にも関連している(Bäckhed et al., 2004; Vrieze et al., 2012)。微生物組成の変化は、肝硬変、非アルコール性脂肪性肝疾患、および糖尿病などの代謝性疾患の発症に寄与する可能性がある(Vrieze et al 2012;峯村および清水、2015)。
腸管透過性の変化は、腸および全身の炎症を介して肝疾患の重症度に影響を与え、細菌感染につながる(Bajaj, 2019)。代謝性疾患は、腸上皮の完全性の低下、および内腔から粘膜への細菌の転座の増加と関連しており、全身炎症を誘発する(Burcelin et al., 2012)。
さらに、肺疾患では、腸内細菌叢および腸管バリアが障害されていることがわかっている(Rutten et al 2014;花田 et al 2018)。
消化器症状を有するCOVID-19患者は、消化器症状を有しない患者よりも肝障害を経験する傾向がある(Pan et al 2020)。ディスビオシス、健康な/正常な腸内細菌叢の摂動は、上述のように幅広い疾患または疾患に関与してきた。このことは、腸内細菌叢の抗生物質による不均衡が下痢を引き起こす理由を説明している。
したがって、バランスを保つことは健康に不可欠であり、腸内細菌叢と免疫系との間のこの相互作用は、肺外損傷を伴うCOVID-19重症度を増加させる可能性のある非健康状態において極めて重要な重要性を有している。
4. COVID-19における腸-肺軸
コロナウイルスは、肺にダメージを与え、不均衡で高免疫応答を伴う肺炎を引き起こすと考えられている(X. Li et al 2020)。COVID-19は、免疫応答に関連した有害な転帰を引き起こすことがわかっている。前炎症性サイトカインおよびリンパ球減少症の増加は、重症のSARS-CoV-2感染と関連している(Huang et al 2020;Zheng et al 2020)。
サイトカインおよびケモカイン産生の亢進は、肺の重症急性呼吸器症候群および多臓器不全をもたらす「サイトカインストーム」に寄与する傾向がある(Huang et al 2020;Kalantar-Zadeh et al 2020)。
中国・武漢の患者150人を対象としたCOVID-19の死亡率に関するレトロスペクティブ研究では、COVID-19の死亡率は、ウイルス性に誘導された高炎症、いわゆるサイトカインストームによるものである可能性が示唆されている(Ruan et al 2020)。
彼らは、白血球数、リンパ球数、IL-6レベルなどの血液分析で死亡群と退院群で有意差があり、さらに死亡群の16%に二次感染があったことを報告している。
以前、SARSは致死的な感染症患者ではTh2サイトカインの上昇を伴う過剰な免疫反応が特徴であった(C. K. Li et al 2008)。SARSコロナウイルスは、一次傷害部位として肺上皮に加えて免疫細胞にも感染することがわかっており、過剰反応が免疫障害とウイルスの発症に重要な役割を果たしていることがわかっている(Gu et al., 2005)。
インフルエンザなどの他のウイルス感染によって誘導された免疫応答は、腸内細菌叢の変化を駆動し、その結果、腸内細菌叢の不衛生を引き起こし、腸管透過性を増加させ、二次感染、細菌性肺炎を引き起こす可能性がある(J. Wang et al 2014)。
ウイルス感染による高レベルの循環性炎症性サイトカインは、腸内マイクロバイオータを変化させ、腸の完全性を乱すことができる。
小腸の機能不全は、腸内マイクロバイオータと免疫系との間のバランスのとれた双方向の相互作用のために、腸内マイクロバイオータの変化と炎症をもたらす。腸内の増加した炎症は、細菌の抗原および毒素が全身循環に移動することを可能にする漏れのある腸につながり、COVID-19を持つ患者の敗血症状態をさらに悪化させる。その後、炎症反応が開始され、多臓器不全につながる可能性がある(H. Wang et al. Ma, 2008)。
集中治療室で治療された重篤な患者を対象とした研究では、多臓器不全は腸管透過性の亢進と関連していることが明らかになっている(Doig et al., 1998)。
腸管バリアの完全性の低下は、腸管リンパ管を介して細菌や炎症性産物の遠隔臓器への移動に関与し、敗血症や多臓器不全症候群につながる(Deitch, 2012)。
腸内細菌叢の変化のもう一つの理由は、大量の抗生物質の使用である。中国では、COVID-19治療中に58〜71%の患者が抗生物質治療を受けており(N. Chen et al 2020;Guan et al 2020)、抗生物質治療を受けた患者の数は多い。
抗生物質は、ジスビオシスをもたらし、新しい感染症および炎症性疾患に対する感受性を増加させる。さらに、それらは抗生物質関連下痢(AAD)を引き起こし得る。AADは抗生物質使用の非常に一般的な副作用であり、抗生物質使用による腸内細菌叢の不均衡から生じる。
さらに、入院患者のAADは、Clostridium difficile associated diarrhea(CDAD)を引き起こす可能性があり、逆にCDADはAADを引き起こす可能性がある(Hickson, 2011)。
腸管バリアの完全性の低下に伴う微生物転座は、二次感染に続く。腸から肺への細菌転座は、バリア機能不全の可能性があるため、敗血症や急性呼吸窮迫症候群で報告されている(Dickson et al., 2017)。腸と呼吸器が免疫応答を調節するために関連していることが知られており、腸内微生物叢の異常が呼吸器の疾患発症に寄与していることが知られている(Fanos et al 2020)。
慢性炎症性肺疾患や喘息などの慢性肺疾患は、通常、炎症性腸症候群(IBD)を含む消化管疾患とともに発症し、それらの患者は腸粘膜の構造や機能、透過性が変化していることが示されている(Roussos et al 2003;Rutten et al 2014)。
さらに、成人のIBD患者の約50%は呼吸器疾患の既往がなく肺機能に障害があることが報告されている(Keely et al. その逆に、感染したウイルスは、感染した肺から全身循環を介して遠くの臓器に移動する可能性がある。
Guらは、SARS-CoVに感染した患者と死亡した患者の剖検例を用いて、in situハイブリダイゼーションと電子顕微鏡を用いてSARSの病態を研究している(Gu et al 2005)。その結果、肺の血管内の単球やリンパ球、循環白血球、リンパ節、リンパ組織でウイルス配列が陽性であることがわかった。
さらに、消化管組織に病理学的な変化が見られ、ウイルスに感染した免疫細胞が腸管細胞を循環して侵入し、消化管障害を引き起こすことが示唆された。これらの結果から、コロナウイルスは肺組織の損傷後に全身循環に転座し、循環系やリンパ系を介して腸管細胞に移行する可能性が示唆された。
このようにして、ウイルスは、ウイルスの脂質エンベロープを破壊し、ウイルスの感染性を阻害する可能性のある胃液や腸液で消化管の過酷な環境を回避することができる。これらのことを総合すると、SARS-CoV-2の腸への到達方法は、ウイルス感染体を摂取することを意味する糞便経口感染ではなく、他の方法を考えることができる(Whittier, 2017)。
糞便経口感染による感染が成功するためには、ウイルスは摂取後に胃の酸や腸の胆汁酸塩などの生物学的障壁に対処しなければならない。Darnellらは、SARS-CoVがpH<3である酸性条件下で不活化されることを発見し、酸性環境を緩衝することができる大きな食事と一緒に摂取しない限り、摂取後の胃分泌によってウイルスが不活化されることを示唆している(Darnell et al 2004)。
イヌコロナウイルスを用いたPratelliらは、37℃でpH2.26およびpH4.38の条件下でウイルスを完全に不活化したことを報告している(Pratelli, 2008)。酸性条件下でのSARS-CoV-2の生存についての情報はほとんどない。Sunらは、プレプリントの一つで、湿潤、乾燥、酸性などの様々な環境条件下でのSARS-CoV-2の生存を研究した(Sun et al., 2020)プレプリントである。
ウイルスは湿潤または乾燥条件下で最大3日間生存するが、高濃度の場合に限ってpH2.2で最大1時間生存することができる。胃の欠点以外にも、ウイルスが摂取後に腸細胞に感染するためには、胆汁酸塩を避ける必要がある。
胆汁酸塩は、感染剤の脂質部分に対する抑止作用を持つ宿主防御に用いられる様々なメカニズムの一つである(Bertók, 2004)。ウイルスは、ヌクレオキャプシドを取り囲む脂質エンベロープの有無に基づいてサブグループに分類される。
脂質エンベロープを有するウイルスには胆汁酸が非常に有効であるのに対し、エンベロープを有しないウイルスは胆汁酸に抵抗性である。SARS-CoV-2は外側の脂質含有膜を含み、エンベロープを有するウイルスの一つである(X. Li et al 2020)。
COVID-19患者からの糞便サンプル中にウイルスRNAが検出されているが(Y. Wu et al 2020;Xiao et al 2020)、糞便-口腔経路を介した感染性ウイルスの伝播はまだ実証されていない。
最近、Zangらは、腸球のSARS-CoV-2感染およびSARS-CoV-2に対する胃液および腸液の影響に関する注目すべき研究を発表した(Zang et al 2020)。その結果、ウイルスは腸管細胞に侵入する能力はあるものの、pHの低い胃液や胆汁や消化酵素を含む腸内環境により、消化管内では生き残れないことが明らかになった。
さらに、COVID-19患者の糞便サンプルからは感染性ウイルスは検出されなかった。
以上のことから,SARS-CoV-2の糞便-口腔経路や腸内感染について言及するのは,これまでのデータが限られている中で,かなり早い時期であり,より多くの実験的データが必要であることが示唆された.しかし,腸内細菌叢が免疫系と双方向の関係を持ち,二次感染や多臓器不全を引き起こす原因となりうることから,COVID-19の重症度に対する腸内細菌叢の寄与を過小評価すべきではないと考えられる.
5. 結論
その結果,COVID-19患者の消化器症状を説明するために様々な仮説が提示されたが,COVID-19患者の急激な急増のためにほとんど知られておらず,最終的な結論を出すためには更なる研究が必要である.糞便中のウイルスRNAは検出されても、感染の原因となるウイルス粒子は検出されなかったことは、糞便-口腔間感染の考えを完全に支持するものではない。
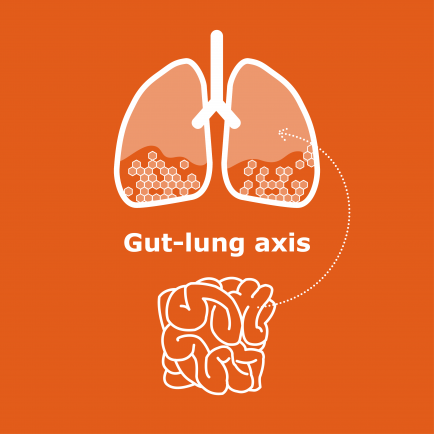
COVID-19の重症度には腸-肺軸が関与していると考えられる(図)。腸管バリアの崩壊は、肺から循環系やリンパ系を介して腸管腔にSARS-CoV-2が移動することにつながる可能性がある。このことは、糞便-口腔感染経路ではなく、糞便中でのウイルス検出を説明することができるかもしれない。
また、加齢に伴い腸内細菌叢の多様性が低下することから、高齢者ではCOVID-19による重症化リスクが高いと考えられる。
これまでのコロナウイルスの研究や腸内細菌叢と免疫系の関係を考えると、腸内細菌叢を正常な状態に戻すことがCOVID-19の症状を緩和し、回復期間を短縮するための代替戦略ではないかと考えられる。
本レビューでは、COVID-19における肺と腸内細菌叢の役割について検討し、COVID-19の重症度における腸-肺軸を完全に理解するための更なる研究の重要性を強調した。
図1

COVID-19の重症度に関与する腸-肺軸を、バイオシスとの関連で模式的に示した。