Contents
鉄の調節不全と微生物の再活性サイクルによる細胞死そしてアルツハイマー病リスク
鉄代謝を中心とする脳腸相関
宿主と微生物の鉄をめぐる争い
鉄は宿主である人間と、宿主に住む微生物の両方にとって非常に重要な金属である。
人間にとっては、主にヘモグロビンなどのタンパク質、酸素を運ぶ機構として、ミトコンドリアの呼吸、中間代謝、生体異物の代謝、細胞の成長や分化など、生命の基本的なプロセスに関与する酵素の普遍的な補因子として働く。
一方で、ボレリアと特定の乳酸菌を除くすべての宿主微生物は成長するために遊離鉄を必要とする。[R] 微生物/ウイルスは、鉄を利用して増殖し、宿主の免疫系に作用し宿主の生命にも影響を与えることがある。
(ボレリアは、マンガンを必要とする酵素に置き換えて、鉄を必要としないように進化する戦略をとった)
人間は微生物の成長を制限するために、体内の遊離鉄の利用可能性を減少させる進化論的な戦略をとってきており、宿主と微生物の間で鉄を奪い合う綱引きを通して、特殊な鉄奪取システムを進化させてきた。
キーワード:感染、鉄、栄養免疫、シデロフォア、鉄過剰、鉄キレート化
pubmed.ncbi.nlm.nih.gov/28730969
シデロフォア(鉄運搬体)
シデロフォアは、細菌から分泌される低分子量の鉄結合複合体の総称。微生物は鉄の少ない場所ではシデロフォアという物質を放出して鉄を手に入れようとする。
シデロフォアは周囲の鉄分を包み込み、微生物の体内に取り込まれる。シデロフォアはサイトカインの発現を誘導するため直接作用する。
デロフォアの3つの主要な構造ファミリーには、カテコレート、ヒドロキサメート、カルボキシレートが含まれる。
2つ以上のシデロフォアファミリの構造要素を含む「混合型」シデロフォアもある。
500以上の異なるシデロフォアが特定されており、一部の病原体は構造的に異なる複数のシデロフォアを分泌する。
さらに、一部の病原体は、ゼノシデロフォア(他の生物によって生成されるシデロフォア)を受け入れることができる。
ja.wikipedia.org/wiki/%E3%82%B7%E3%83%87%E3%83%AD%E3%83%9B%E3%82%A2
シデロカリン(NGAL) Siderocalin
ヒト免疫系によって産生される内因性抗菌タンパク質。Lipocalin-2とも呼ばれる。
シデロカリンの結合によって、多くのカテコール酸シデロフォアに結合し「中和」する。鉄(Fe+3)そのものではなく、シデロフォアによる鉄の病原体への送達を阻むことにより抗菌効果を発揮する。
病原体もこれに対抗すべく、シデロカリンの認識を回避できるシデロフォアを進化させてきた。
動物モデルでは、シデロカリンは炎症および感染時に非常にアップレギュレーションされる。
en.wikipedia.org/wiki/Siderocalin
シデロカリンの抗菌活性は尿中pHと関連しており、より高いpHはより高いシデロカリン活性と相関する。
カテコールの補給は尿中シデロカリン活性を有意に増加させる。尿中のカテコールは、紅茶、コーヒー、ワイン、クランベリーなど、ポリフェノールが豊富な食品の摂取と関連しており、栄養補充戦略が実現可能であることを示唆する。
www.ncbi.nlm.nih.gov/pmc/articles/PMC4481200/
ヒト尿中のシデロカリンリガンド(ピロガロール、カフェ酸、カテコール、メチルカテコール)は、多様で複雑な起源を持っている。それらは植物ベースのポリフェノール前駆体に由来する可能性が高く、腸吸収の前に腸内微生物叢による代謝処理を必要とする可能性がある。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5207064/
腸と鉄の相互影響
鉄欠乏または、吸収不良による腸の鉄過剰は、宿主粘膜の免疫応答を変える可能性がある。腸の消化不良によって引き起こされる腸の炎症は、消化管内の鉄の恒常性に影響を与える可能性がある。
insights.ovid.com/article/00001574-201111000-00007
反対に、免疫の活性化が鉄代謝を調節することができることがこれまでの証拠によって示唆されている。消化管内の鉄の調節異常と腸の異常は、相乗的に増悪させる可能性がある。
消化管出血、または食事成分に由来するヘム(2価の鉄原子とポルフィリンの錯体)は、マウスの腸内細菌叢の共生に寄与する可能性がある。
www.frontiersin.org/articles/10.3389/fmicb.2017.01809/full
鉄調節異常および休眠微生物の仮説の概略図
ストレス、ビタミンD欠乏などによって引き起こされる鉄の調節不全と、それに続く直接的な酸化ストレスに加えて、微生物の再活性化によって引き起こされる全身性炎症。
血液脳関門の透過性の増加と、神経細胞死を促進する神経炎症環境につながる可能性がある。
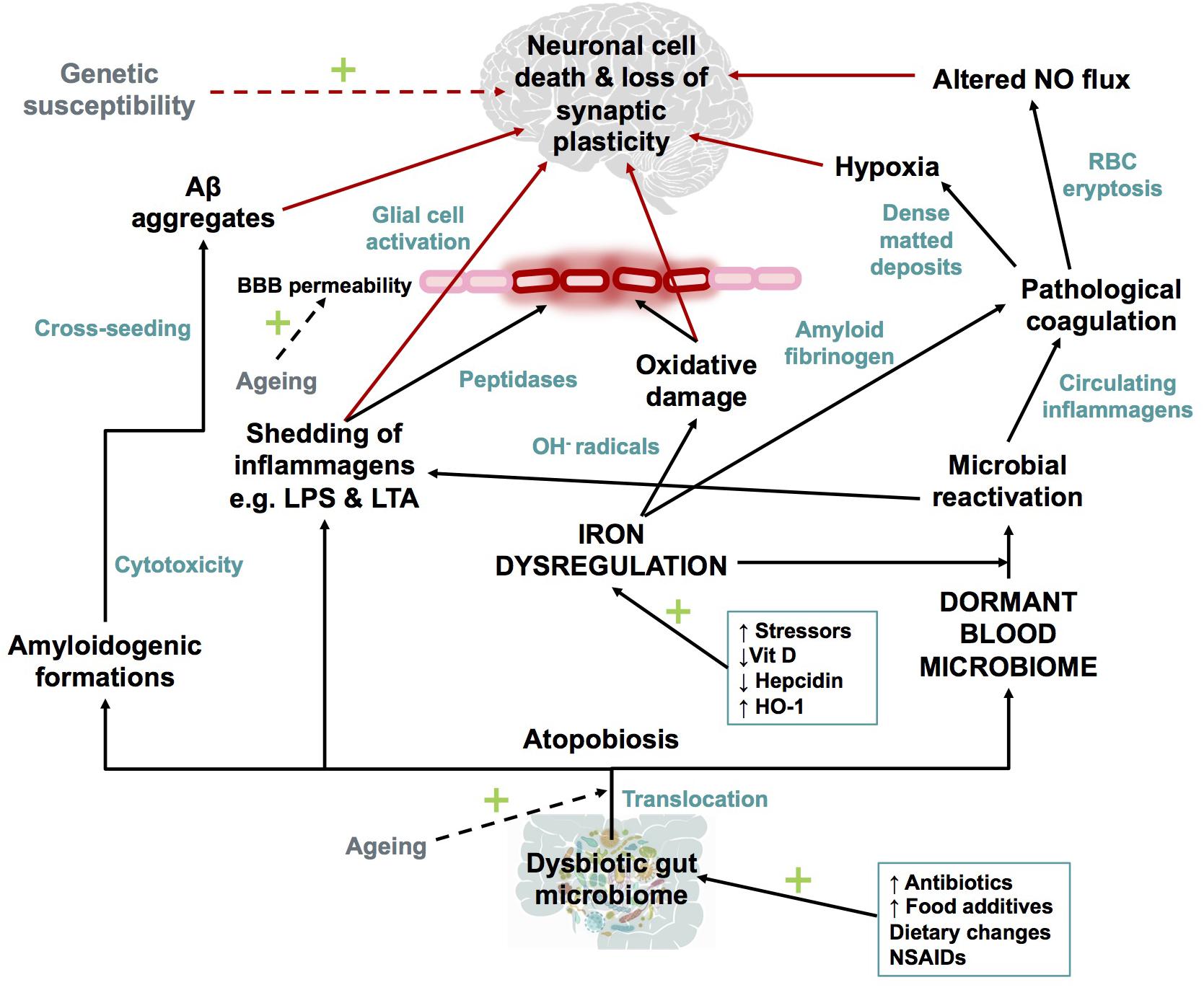
onlinelibrary.wiley.com/doi/full/10.1111/brv.12407#brv12407-fig-0002
www.frontiersin.org/articles/10.3389/fnins.2018.00851/full
赤い矢印は、シナプス喪失と神経細胞死に寄与する可能性のある要因を示している。
破線の矢印は、アルツハイマー型認知症の病因への寄与因子として認識されている。
訳
- Dysbiotic gut microbiome 腸内細菌叢バランスの不均衡
- Atopobiosis アトポバイオーシス(腸内細菌叢の間違った局在)
- IRON DYSREGULATION 鉄調節不全
- DORMANT BLOOD MICRIBIOME 血液中の休眠微生物
- Micorobial reactivation 微生物の再活性化
- Pathological coagulation 病理学的血液凝固
- Hypoxia 低酸素症
- Altered NO flux 一酸化窒素の流動変化
略語
- Aβ アミロイドベータ
- NO 一酸化窒素;
- BBB 血液脳関門
- RBC 赤血球
- OH - ヒドロキシル
- LPS リポ多糖
- LTA リポテイコ酸
- HO-1 ヘムオキシゲナーゼ-1
- NSAID 非ステロイド系抗炎症薬
www.frontiersin.org/articles/10.3389/fnins.2018.00851/full
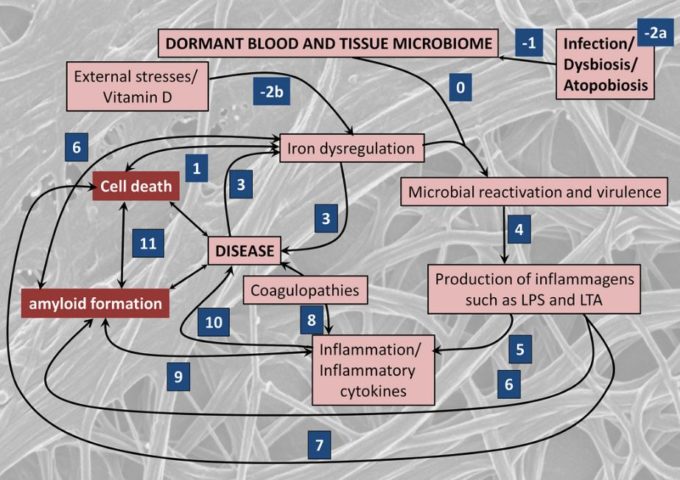
onlinelibrary.wiley.com/doi/full/10.1111/brv.12407
鉄の調節不全要因
ヘプシジン-フェロポーチン軸による鉄恒常性 概略図
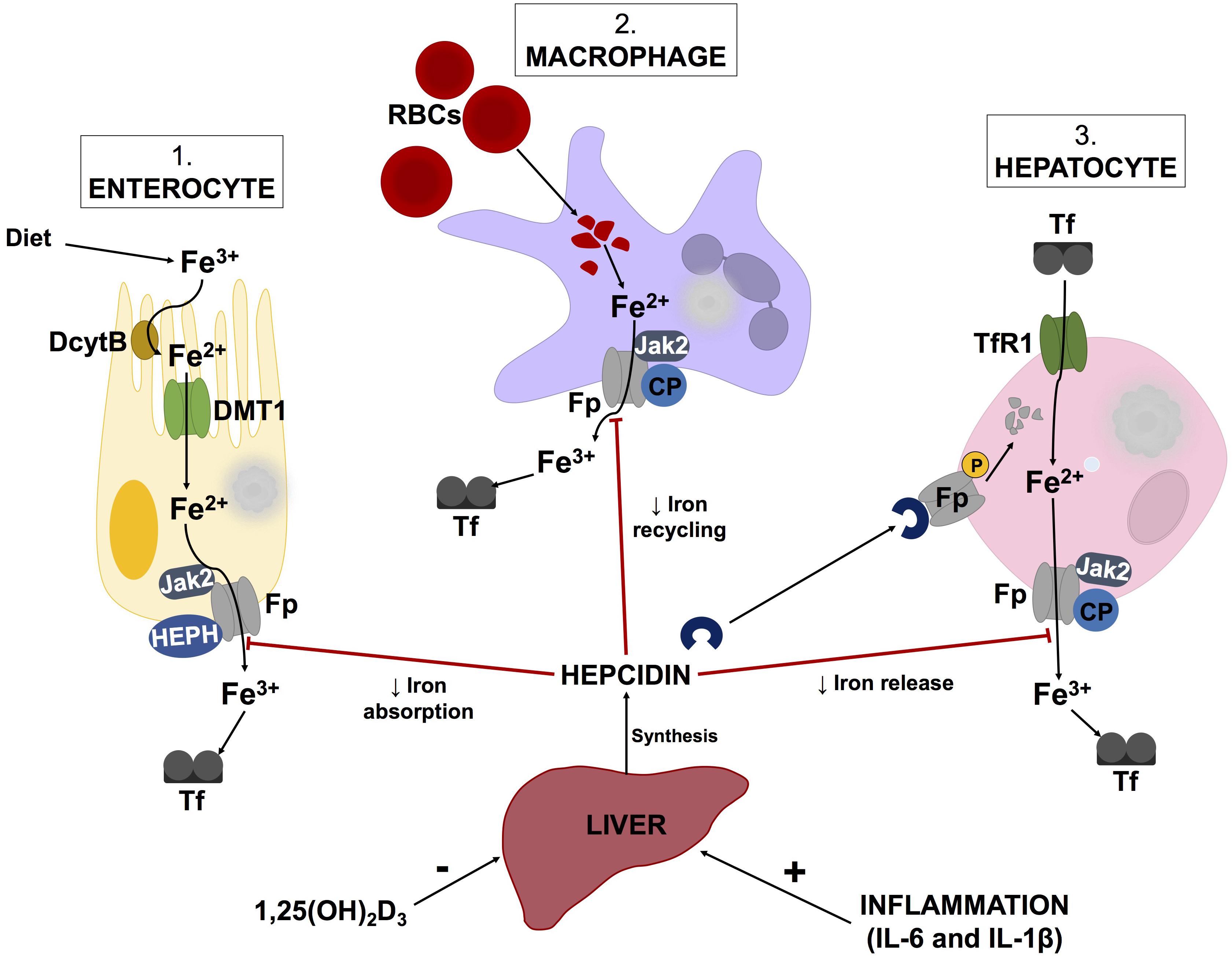
www.frontiersin.org/articles/10.3389/fnins.2018.00851/full
ヘプシジン
ヘプシジンは鉄代謝の重要な調節因子。ヘプシジン合成の欠陥は、組織の鉄過剰につながる可能性がある。
www.karger.com/Article/Abstract/471838
過剰な鉄
onlinelibrary.wiley.com/doi/full/10.1111/brv.12407
食物からの非ヘム鉄の食事摂取は、パーキンソン病のリスクを30%増加させることに関連する。
academic.oup.com/aje/article/168/12/1381/155686
感染
健康な血液には通常遊離鉄はほとんどない(1-10μM)
これは、宿主が侵入した微生物の成長を抑制するための主要な戦略。
休眠中の微生物の鉄による再活性化は、感染リスクを上昇させる。
腸の炎症・消化不良
www.ncbi.nlm.nih.gov/pmc/articles/PMC3734539/
炎症 IL-6、IL-1β
ヘプシジン発現は、LPS、IL-1β、IL-6などの炎症マーカーによって誘導される。
ビタミンD欠乏
ビタミンD(1,25(OH)2 D 3)レベルの増加は、ヘプシジンレベルの減少を引き起こす。
jasn.asnjournals.org/content/25/3/564.short
ヘムオキシゲナーゼ1
遊離鉄の供給源は、ヘムの分解を触媒するヘムオキシゲナーゼ-1(HO-1)の機能によるヘム代謝による。
HO-1活性のアップレギュレーションは赤血球が溶解する全身性炎症性疾患で起こるため、炎症と鉄の調節不全の重要なマーカーでもある。
academic.oup.com/ib/article-abstract/6/5/486/5198252
細胞死が引き起こす鉄の調節不全
細胞死を引き起こす多くの要因によって、鉄の調節不全は開始される可能性がある。細胞死は血流に遊離鉄を放出し、全身に拡散する可能性がある。
pubmed.ncbi.nlm.nih.gov/24549403
血清フェリチンレベルの上昇という形での鉄の調節不全の最も顕著な原因は、細胞死である。
www.sciencedirect.com/science/article/pii/S0891584917312820
細胞死を引き起こす要因には、外傷、栄養ストレス、酸化ストレス、ストレスホルモンの産生などが関与する。
細胞死と遊離鉄の悪循環
細胞死よって遊離した遊離鉄は、フェントン反応、ハーバー・ワイス反応によって、さらに細胞死を引き起こす可能性がある。
物理的損傷
link.springer.com/article/10.1007/s10072-012-1090-1
栄養ストレス(脂肪毒性)
異所性脂質の蓄積が細胞機能不全を引き起こしたり、細胞死を引き起こす。
www.jlr.org/content/57/8/1327.short
薬理学的ストレス
アスピリン、NSAID、利尿薬
www.bmj.com/content/329/7456/15?eaf=
酸化ストレス
www.sciencedirect.com/science/article/pii/S0891584917312820
アトポバイオーシス(Atopobiosis)
細菌、真菌、古細菌、ウイルス、原生動物で構成される腸内微生物の共生は、人間の宿主とも共生しており、栄養素と引き換えに代謝と免疫の恒常性に貢献している。
pubmed.ncbi.nlm.nih.gov/26269668/
腸上皮細胞(IEC)
細胞層のひとつである腸上皮細胞(IEC)は、宿主に害を及ぼさないよう、何兆もの微生物や抗原を分離し消化管外への移動を防ぐ。
GALT(消化管免疫システム)
IECのほかに、GALT(消化管免疫システム)は、有益な微生物に対する免疫原性をブロックし、消化管への封じ込めを確保することにより、腸バリアの完全性に貢献している。
pubmed.ncbi.nlm.nih.gov/23091436
適切な場所で成立する良い腸内微生物叢
腸内微生物は消化管の環境に限定されている限り、局所免疫系として寛容が維持されており宿主と共生を築ける。しかし、腸内微生物とその抗原は、全身性免疫を活性化するため、微生物が腸内から流出すると劇的な変化が起こる。
誤った場所での腸内微生物の出現による異常は、不均衡な腸内微生物叢によって生じる「ディスバイオーシス」の用語と区別をつけるためにを「アトポバイオーシス」と名付けられている。
pubmed.ncbi.nlm.nih.gov/25940667
その他の微生物の血液流入経路
アトポバイオーシスは、主に腸バリアの破壊などによって腸内微生物が血中に流入することによって生じることが想定されているが、その他歯周病や尿路感染によっても生じうる。
歯周病
pubmed.ncbi.nlm.nih.gov/24365095
pubmed.ncbi.nlm.nih.gov/22092606
尿路感染症(UTI)
pubmed.ncbi.nlm.nih.gov/16485005
アトポバイオーシスによるアルツハイマー病リスク
老化は、腸の障壁を破壊し、微生物の体内への流入を可能にする。微生物が中枢神経系に入ると、微生物とその抗原はアミロイドβの過剰生産を誘発する。
微生物は腸管内に閉じ込めておくことがアルツハイマー病を含めた神経変性疾患の予防において重要となる。
www.ncbi.nlm.nih.gov/pmc/articles/PMC6608545/
微生物スカウト仮説・微生物休眠仮説(IDDM)
多くの微生物はストレス条件下では、増殖も死滅もしない「休眠」状態に移行することでストレスに強い耐性をもち、白血球から生き残る事が可能となる。そして特定の刺激、自己触媒的なプロセスによって再活性化または蘇生できる。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5325058/
www.ingentaconnect.com/contentone/ben/cmc/2018/00000025/00000001/art00009
宿主と微生物の共生進化的な議論から、侵入した微生物は宿主と戦うよりも耐え忍ぶことを採用する戦略が有利となる。
pubmed.ncbi.nlm.nih.gov/27259146
鉄による休眠微生物の再活性
金属はフリーラジカルとしてアルツハイマー病の酸化ストレスの生成に関与していることが知られているが、休眠微生物の再活性化プロセスにも関与する。
リポ多糖類(LPS)・リポテイコ酸(LTA)
グラム陰性菌およびグラム陽性菌の細胞壁には、さまざまな環境および生理学的シグナルに応答して分離する可能性のあるLPS、LTAが大量に含まれている。
LPS
LPSは隔離することのできるタンパク質に結合しているが、細胞毒性であるという証拠がでてきている。
pubmed.ncbi.nlm.nih.gov/26345428
pubmed.ncbi.nlm.nih.gov/27939482
リポタイコ酸(LTA)
LTAは細胞壁成分リポタイコ酸(LTA)の略語、グラム陰性菌とは異なるがLPSと同等に炎症反応を同等に引き起こすことができる。LPSが主にtoll様受容体4(TLR4)と相互作用するのと対照的に、LTAは主にtoll-like receptor 2(TLR2)を活性化することにより標的細胞を刺激する。
LTAはLPS種よりも強力な効果をもっている可能性がある。
royalsocietypublishing.org/doi/10.1098/rsif.2017.0941
エンドトキシン
宿主に排出されたLPSはエンドトキシンと呼ばれる。このタイプの炎症性物質の微生物放出の最も極端な例としてヤーリッシュ・ヘルクスハイマー反応が知られている。
アルツハイマー病への寄与
LPSとLTAによるアミロイド形成
アルツハイマー病患者脳の対照脳よりも高いLPS。アミロイドβとLPSの共局在。
pubmed.ncbi.nlm.nih.gov/27784770
pubmed.ncbi.nlm.nih.gov/26462180
pubmed.ncbi.nlm.nih.gov/23666172
ビタミンD欠乏によるLPSからの保護能力低下
低濃度のビタミンD3濃度は、慢性炎症の原因ではなく結果である可能性がある。
ビタミンD(1,25(OH)2 D 3)の増加は、ヘプシジンのプロモーターへのビタミンD受容体結合を介してヘプシジンレベルを低下させ、IL-1β、IL-6レベル減少する。
ビタミンD欠乏によるLPS抑制効果の低減
ビタミンDシグナル伝達の役割のひとつは、ビタミンD受容体の活性化であり、900の遺伝子産物に影響を与える。
pubmed.ncbi.nlm.nih.gov/23178257
この遺伝子の産物にはカテリシジンやベータデフェンシンなどの抗菌ペプチド(AMP)が含まれており、LPSなど病原体を攻撃することが知られている。
pubmed.ncbi.nlm.nih.gov/25101194

