Contents
Glutamine as a Potential Neuroprotectant in Alzheimer’s Disease
略語リスト
GlnまたはQ グルタミン

序論
グルタミン(GlnまたはQ)は、血液中に最も豊富に存在するアミノ酸である。健康なヒトでは、筋肉中のグルタミン濃度は約15~20mMであるが、血漿中の濃度は通常0.5~0.8mMである。細胞内では、グルタミンの機能には次のようなものがある。
(1)窒素トランスポーター
(2)エネルギー源
(3)代謝中間体
(4)必須アミノ酸の細胞内への取り込みの媒介者
(5)細胞の酸化還元状態の維持に関与。
これらの多様な機能のために一部では、ほとんどの細胞タイプではないにしても、多くの場合、他のほとんどのアミノ酸のそれを超える外因性グルタミンの要件を持っている。実際、それはATPの生産、mTORのシグナリング、および高分子合成におけるその重要な役割でグルコースに例えられている。
グルタミンは、グルタミン合成酵素(E 6.3.1.2)の作用を介して生体内で生産され、グルタミン酸とアンモニア(図70.1)からグルタミンの形成を触媒する。グルタミン合成酵素 の機能は脳の発達や神経細胞の生存に不可欠であり、先天性の グルタミン合成酵素 欠損はヒトやマウスの脳奇形や新生児死亡の原因となる。また、グルタミン合成酵素の成熟神経細胞に対する神経保護効果もいくつかの研究で報告されている。神経変性疾患との関連性が高いのは、グルタミン合成酵素の活性が加齢とともに指数関数的に上昇する混合機能酸化に弱いという事実である。酸化されたグルタミン合成酵素は活性が低下し、優先的に分解される。この酸化によるグルタミン合成酵素活性の低下は脳の部位特異的なものであり、後頭葉に比べて前頭葉では2倍の速度で起こる。重要なことは、その減少は年齢をマッチさせた対照群よりもアルツハイマー病患者の前頭前皮質でより顕著であるということである[1]。最近のプロテオミクス研究では、軽度認知障害(MCI)とアルツハイマー病患者の両方において、年齢をマッチさせた対照群と比較してグルタミン合成酵素が有意に酸化されていることが報告されている[2]。このことは、グルタミン合成酵素が早期に障害され、疾患の進行を通してダメージが持続することを示唆している。
医学的な「食品」としてのグルタミンの使用は広範囲に研究されてきた;しかしながら、特に神経変性が起こっている状況下では、脳の健康に対するグルタミン補充の効果についてはあまり知られていない。我々の研究を含む最近の研究は、グルタミン不足と神経変性疾患との間の可能性のリンクを明らかにし始めており、アルツハイマー病の治療におけるグルタミン補給の可能性を示唆している。このレビューでは、我々は現在、この重要なアミノ酸について知っていることを検証し、それがどのように老化脳が特に脆弱である変性変化から守るのに役立つかもしれない方法を説明するためにいくつかの仮説を示唆している。我々は、グルタミンは、アルツハイマー病に対する武器の私たちの武器庫への貴重な追加であるかもしれないことを提案する。
グルタミンは、多機能であり、条件的に不可欠である
通常の生理的状況では、グルタミンは血糖値を適正に維持し、適正なpH範囲を維持する役割を担っている。また、細胞内の水の量と様々な組織の浸透圧を制御するアミノ酸の一つである。細胞は、DNAとタンパク質の合成や、重要な抗酸化物質であるグルタチオンの生成にグルタミンを使用する。
グルタミンはまた、免疫細胞を含む多くの種類の細胞にとって重要なエネルギー源でもある。グルタミン加水分解の副産物であるアンモニアも、オートファジーなどのいくつかの細胞機能を制御するために重要である(図70.2)。グルタミンは通常、体内の細胞内で自発的に合成されるため、非必須アミノ酸とみなされている。しかし、ヒトは、傷害後のグルタミンレベルを維持するために使用することができるグルタミンの24~48時間の予備を持っているだけである。そのため、過酷なストレスがかかると、筋肉や他の組織で生産されるよりも早く血流からグルタミンが枯渇してしまうため、グルタミンは不可欠なものとなる。例えば、激しい運動、手術、感染症、熱傷、またはその他の急性外傷は、グルタミンの枯渇を引き起こし、その結果として免疫機能障害、腸の問題、および筋肉の消耗を引き起こす可能性がある。この複雑さを認識して、グルタミンは現在、特に異化状態やストレス状態では、条件付き必須アミノ酸として一般的に記述されている。グルタミンのサプリメントは、これらの条件のいくつかで有益であることが知られている。
私たちの体のすべての細胞はグルタミンを使用しているが、いくつかの細胞タイプは他のものよりもはるかに多くのグルタミンに依存している。グルタミンは、腸、免疫、筋肉の機能のために不可欠であり、十分なグルタミンなしでは、筋肉が萎縮し始め、腸の細胞が変性変化を受け、免疫機能が破壊される。腸の上皮細胞は、食事由来のグルタミンの多くを消費し、呼吸の燃料として利用している。しかし、食事由来のグルタミンは血漿中の遊離グルタミン全体の10%以下を占めている。遊離グルタミンの主な供給源は骨格筋である。グルタミンは筋タンパク質に比例して含まれているが(全体の約20分の1)その量は筋肉中の遊離アミノ酸の40%を超えている。実際、骨格筋は体内の遊離グルタミンプールの90%を含み、有意な量のグルタミンを放出することができる。脳、肝臓、脂肪組織、腎臓、肺などの他の臓器もグルタミンを産生することができる。
正常な脳の脳脊髄液中のグルタミン濃度は約0.5mMであるが、大脳では0.4~1.5mMの範囲と報告されている。グルタミンは神経系の重要なエネルギー源である。脳に十分なグルコースが供給されていない場合は、グルタミンの代謝を増加させることでエネルギーを補っている。DNA、タンパク質、グルタチオン(グルタミン合成酵素H)の合成のためのビルディングブロックとして使用される以外にも、脳のグルタミンは、必要に応じて神経伝達物質への変換のために生産される(図70.2)。実際、グルタミンは興奮性と抑制性の両方の神経伝達物質(グルタミン酸とγ-アミノ酪酸(GABA))の生成の基質となっている。グルタミン酸およびGABAの合成は、グルタミン-グルタミン酸サイクルおよびグルコースの酸化を含むグリア-ニューロンプロセスによって行われる。
特筆すべきは、グルタミン酸神経伝達は、電気活動電位の他のコンポーネントと一緒に、いくつかの推定で80%以上のグルコース酸化から生成された脳ATPのかなりの部分を消費する。
グルタミン合成酵素は、生体内グルタミン生産のために不可欠な酵素である
グルタミン合成酵素 は、ヒトでグルタミンを合成できる唯一の酵素として知られている。グルタミン合成酵素は進化的に保存されている酵素であり、組織特異的かつ発生制御された方法で発現している。例えば、グルタミン合成酵素は肝臓細胞ではミトコンドリア型であるが、脳細胞では細胞質型である。組織特異的な細胞内局在性の違いは、グルタミン合成酵素タンパク質の弱いミトコンドリアターゲティング配列によって決定される。神経組織では、グルタミン合成酵素の発現は通常、脳内で最も豊富なグリア細胞であるアストロサイトの細胞質に限定される。実際、アストロサイトの成熟は、グルタミン合成酵素活性の増加によって特徴づけられる。グルタミン合成酵素はグルタミン酸神経伝達のグルタミン酸-グルタミンサイクルに関与するコア酵素である(図70.3)。簡単に言えば、アストロサイトはグルタミン合成酵素を介してグルタミン酸からグルタミンを産生し、グルタミンを神経細胞に取り込ませるために間質空間に放出する。ニューロンでは、グルタミンはリン酸で活性化されたグルタミナーゼを介して脱アミド化され、結果として生じたグルタミン酸は、最終的な放出のためにシナプス小胞に包まれる。その放出後、シナプス小胞内のグルタミン酸は、グルタミン酸-グルタミンサイクルを完了するために、周囲のアストロサイトによって再び取り込まれる。注目すべきは、脳内の内因性グルタミンの大部分は、アストロサイトグルタミン合成酵素を介して生成される。脳マクロファージとミクログリア細胞は、グルタミン酸クリアランスと代謝のための追加の局所的な誘導性細胞集団を構成しており、需要に応じて利用可能である。
グルタミン酸からのグルタミンの合成は、生体内でアンモニアを無害化するための重要な経路であるため、機能的なグルタミン合成酵素は生物にとっても重要である。グルタミンの合成は、身体、特に脳をアンモニアの毒性から保護する。生物の生存に不可欠な役割を果たしているため、生きているヒトやマウスではグルタミン合成酵素の完全な欠乏は起こらない。しかし、Haberleらによる2005年の研究[3]では、ヒトの新生児においてグルタミン合成酵素活性の部分的な損失が記録されている。突然変異により先天的にグルタミン合成酵素活性が著しく低下した2人の血縁関係のないヒトの新生児は、脳奇形、多臓器不全、発作、および乳児死亡を示した[3]。興味深いことに、これら2例ではグルタミン合成酵素の発現が増加しており、変異体酵素のグルタミン合成酵素活性の低下を補っている可能性が高い。グルタミン合成酵素欠損の動物モデルでは、グルタミン合成酵素-/-マウス胚はE3.5で死亡しており、マウスの初期胚発生にグルタミン合成酵素が不可欠であることを示唆している。さらに、GFAP陽性アストロサイトに選択的に誘導されたグルタミン合成酵素遺伝子欠損マウスは、生後3日目までしか生存しなかった。最後に、よく知られたグルタミン合成酵素阻害剤であるメチオイニンスルホキシミンによってラット海馬のグルタミン合成酵素活性が抑制されると、発作の再発や脳病理が引き起こされることを明らかにした。
グルタミンは生物の生存に不可欠であるが、すべての細胞が低濃度の外因性グルタミンに敏感であるわけではない。実際には、グルタミン合成酵素は細胞型特異的なグルタミン非依存性の遺伝的決定因子である。グルタミン欠乏は、高レベルのグルタミン合成酵素を発現する細胞(アストロサイトなど)よりも、低レベルのグルタミン合成酵素を発現する細胞(ニューロンなど)の方がはるかに劇的な反応を誘導する;重要なことに、高レベルのグルタミン合成酵素を発現する細胞は、組織内で低レベルのグルタミン合成酵素を発現する細胞をサポートし、共生システムを構築することができる。
細胞内でのグルタミン合成酵素の発現と活性は動的であるが、厳密に制御されている。グルタミン合成酵素のサブユニットあたり16個のヒスチジン残基のうちの1つは酸化的修飾を受けやすい。グルタミン合成酵素の酸化された形態は、生体内では細胞内プロテアーゼによって優先的に分解される。確立された証拠は、グルタミン合成酵素が脳内で最大の速度で機能していないことを示唆している。例えば、ラットの脳では、カロリー制限は海馬のグルタミン合成酵素活性を増加させる [4]。N-メチル-D-アスパラギン酸(NMDA)受容体をブロックすることも、グルタミン合成酵素活性の増加とそれに続く脳内グルタミン含有量の上昇につながる可能性がある。このことは、NMDA受容体の強直活性化がグルタミン合成酵素の一定の阻害を維持していることを示している[5]。さらに、一酸化窒素合成酵素の阻害はグルタミン合成酵素の活性を高め[6]、エストロゲンの添加はC6-グリオーマ細胞のグルタミン合成酵素活性を高める[7]。対照的に、低酸素はアストロサイトからのグルタミン合成酵素の急速な損失をもたらす可能性がある[7]。グルタミン合成酵素活性は、ネズミの脳の虚血/再灌流誘発性傷害時にも低下する[8]。同様に、過酸化水素処理による酸化ストレスは、アストロサイトにおけるグルタミン合成酵素の鉄依存的な不活性化をもたらす可能性がある[9]。これらの結果は、グルタミン合成酵素の活性が、これらのよく知られた神経細胞保護剤やストレス因子の保護/損傷効果の鍵を握っている可能性を示唆している。
上述したように、アストロサイトは神経伝達物質のリサイクルに関与し、脳全体のシナプス機能を調節している。アルツハイマー病を含む様々な中枢神経系の状態において、反応性アストロサイトが障害の病態形成において重要な役割を果たすという証拠が増えてきている。反応性アストロサイトが グルタミン合成酵素 の発現をダウンレギュレートすることに注意してほしい。グルタミンは GABA 産生にも必要なので、このダウンレギュレーションは、シナプスの GABA の急速な枯渇につながる。驚くべきことに、グルタミンの補充はグルタミン合成酵素活性のこの欠損を救済し、正常な抑制性シナプス後電流を回復させることができる[10]。これらのデータは、正常な脳機能における遊離グルタミンの重要な役割を声高に語る。アルツハイマー病脳では、多くのアストロサイトにおけるグルタミン合成酵素の発現は、グルタミン合成酵素が反応性アストロサイトでダウンレギュレートされているという考えに沿って、健康な高齢者の脳よりも低い。予想されるように、de novo グルタミン合成酵素の発現は、アルツハイマー病の脳の錐体ニューロンのサブ集団で検出されている;通常の状況では、ニューロンはグルタミン合成酵素の検出可能なレベルを発現していない[11,12](図70.4)。これらの観察は、特にグルタミンの恒常性に関して、アルツハイマー病脳におけるニューロンとアストロサイト間の代謝相互作用の深刻な障害を示している。
グルタミン合成酵素のニューロンの発現は、グルタミン酸-グルタミンサイクルの障害への適応応答である可能性が高い。実際、十分な量のグルタミン(2mM)で培養したマウスの初代ニューロンでは、グルタミン合成酵素はほとんど発現しないが、培養液からグルタミンを除去すると、ニューロンはグルタミン合成酵素を発現し始める。生理的に低濃度のグルタミン(0.33mM)でも、ニューロンのグルタミン合成酵素の発現は著しく低下し、高濃度のグルタミンではさらに低下する。重要なことは、この抑制はアストロサイトとの直接接触を必要とする経路を介して作用するということである[12,13]。同様に、ニューロンのグルタミン合成酵素発現は、ニューロンをアストロサイトと共培養するか、またはグルタミンを含む筋肉抽出物を添加することで減少させることができる。それにもかかわらず、超生理学的濃度(5mM)であっても、外因性グルタミンは培養ニューロンにおけるグルタミン合成酵素発現を完全に抑制することができず、ニューロンにおけるグルタミン合成酵素発現がグルタミンの供給不足によって完全に引き起こされているわけではないことを示唆していることは注目に値する。また、アンモニアを無害化する必要性も、培養ニューロンにおけるグルタミン合成酵素のde novo発現に寄与している可能性がある。システムの複雑さは、減少したレベルのグルタミン合成酵素を含むアルツハイマー病皮質のアストロサイトの広範な数があるが、ニューロンでのグルタミン合成酵素の発現は比較的まれであるようなものである。このミスマッチは、ニューロンでのグルタミン合成酵素合成の原因が全球的なものではなく、ニューロンごとの局所的なものであることを強く示唆しており、グルタミン酸およびアンモニアの局所環境を無害化するアストロサイトの能力の低下が部分的に原因である可能性がある [13]。
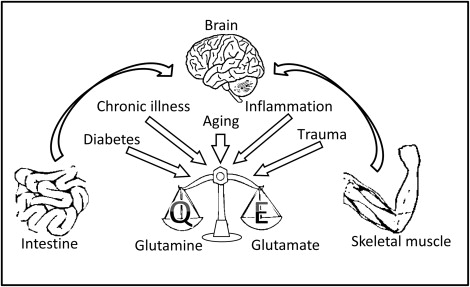
加齢および成人におけるグルタミン代謝異常
グルタミンレベルは、脳のグルタミン酸濃度がそうであるように、我々は加齢とともに減少するように見える [14]。アルツハイマー病におけるさらなる複合グルタミン/グルタミン酸の減少は、いくつかの研究で報告されている[15-18]。グルタミン価の低下は、加齢脳におけるグルタミン合成酵素活性の低下によって部分的に説明できる [19]。神経変性疾患との関連性が高いのは、グルタミン合成酵素の活性が加齢とともに指数関数的に上昇することがよく知られている混合機能酸化に対して脆弱であるという事実である。この酸化によるグルタミン合成酵素の活性低下は、脳の部位特異的なものである。前頭葉では後頭葉の2倍の速度で起こる。重要なことに、減少は年齢をマッチさせた対照群よりもアルツハイマー病患者からの前頭葉皮質でより顕著である[1]。
このゆっくりとはしているが衰退がもたらす広範な影響は、ストレスに反応する細胞の能力への影響を考慮することで理解することができる。私たちの研究室の最近の研究では、低グルタミン条件下では、N2a神経芽腫細胞と一次ニューロンの両方で、重要なストレス応答タンパク質の力価が低下していることが示されている[12]。この減少は、53BP1 や ATM などの DNA 損傷応答タンパク質の間で顕著であったが、他の応答ネットワークにも及んでいた。このような細胞の準備性の低レベルに合わせて、低グルタミン状態の細胞は、DNA損傷、重金属、酸化、アミロイドβペプチド[12]などの外因性ストレスに対してより脆弱であった(図70.5)。Nicolayらは、神経細胞での我々の観察と一致し、RBF1(ハエRb)を欠失したショウジョウバエはグルタミンの異化が変化しており、DNA損傷に対して過敏であることを発見した。RBF1欠損細胞はDNA損傷の存在下でもDNAを複製し続けた。驚くべきことに、グルタミンの補給はRBF1欠損動物の感受性を抑制するのに十分である[20]。経口グルタミンの補充は、このようなリン酸化タウとアルツハイマー病のマウスモデルでの神経細胞周期タンパク質の存在などの病原性マーカーのレベルを低下させることができたように、これは、重要な臨床的意味合いを持っている。これらの同じ動物では、シナプス結合タンパク質のマーカーが増加し、変性が停止しただけでなく、修復が始まっていたことを示唆していた [12]。これらの知見は、培養では、減少したグルタミンレベルは、年齢の効果の多くを模倣する可能性があることを示唆している。同様に、年齢に基づくグルタミン合成酵素活性とグルタミンレベルの低下は、ヒトとマウスの両方の研究において、加齢とともに増加するアルツハイマー病やパーキンソン病などの脳疾患のリスクを定量化できる指標として有用であることが証明されるかもしれない。グルタミンレベルが炎症、オートファジー、βアミロイドへの反応を含む様々な疾患プロセスに重要な影響を及ぼすことが認識されていることから、このような広範囲にわたる効果が文献でも確認されている。
βアミロイドとグルタミンのメタボリズム
グルタミンとアルツハイマー病の変化した脳化学との間の相互作用のための強力な証拠は、アミロイドβへの細胞応答上のグルタミンの効果から来ている。アルツハイマー病における最も初期の神経病理学的変化の一つは、アミロイドβの沈着の部位で反応性アストロサイトの多数の存在である。アルツハイマー病脳から単離されたプラークをラット脳に注入すると、神経細胞の分解が誘導され、グルタミン合成酵素はアミロイドβ(1-42)が注入された基底核で広範囲に酸化される[21]。Matosらは、アミロイドβペプチドを投与すると、培養ラット脳アストロサイトにおけるグルタミン酸の取り込みが減少し、その結果、ニューロンへのグルタミン出力が低下することを試験管内試験で示している[22]。我々は、アミロイドβによって誘発された神経ジストロフィーおよび変性に対するグルタミンの保護的役割を支持する追加のデータを発見した[12]。グルタミンの剥奪は、アミロイドβで処理した培養ニューロンにおいてタウのリン酸化を増幅させ、グルタミンなしで培養したニューロンにおいては、より多くのアミロイドβ誘発性ニューロン細胞死が存在する。さらに 2011年の研究では、Olabarriaらは、アルツハイマー病のトリプルトランスジェニックマウスモデル(3×Tg-アルツハイマー病)では、対照マウスと比較して海馬形成におけるグルタミン合成酵素レベルが低下することを明らかにした。重要なことは、この減少は高齢のマウスでより深刻であるということである。さらに、アミロイドβが沈着している領域では、アミロイドβが沈着していない領域に比べて2倍のグルタミン合成酵素レベルの低下が見られた[23]。これらのデータをまとめると、アミロイドβは脳のグルタミン代謝に強い負の影響を与えうることが示唆される。正常なグルタミン代謝を回復させることを目的とした医薬品または栄養補助食品の介入は、おそらくアルツハイマー病患者に利益をもたらすであろう。
グルタミン代謝および炎症
慢性炎症は、アルツハイマー病の中心的な病因の特徴として浮上している。ミクログリアとアストロサイトの活性化によって証明されるように、炎症はまた、アルツハイマー病患者における酸化ストレスの重要なソースである。前述したように、反応性アストロサイトはグルタミン合成酵素活性を低下させ、その結果、ニューロンの支持を低下させる。グルタミンを外因的に適用することで、グルタミン合成酵素の損失を部分的に逆転させることができるので、このような治療法には治療上の利益があるかもしれない。
グルタミンは、T細胞およびマクロファージを含む免疫系の様々な細胞にとっての主要なエネルギー源である。培養液中では、グルタミンは、他のアミノ酸の10〜100倍の過剰量で存在しなければならず、グルタミン酸またはグルコースで置換することはできない。重要なことに、全身性の炎症は、免疫細胞のグルタミンに対する需要を増加させ、ヒトの脳を含む標的組織からグルタミンの流出を引き起こす可能性がある。実際、Bergらによる2010年の研究では、ヒトボランティアのLPS注射によって誘導された全身性炎症に反応して、脳内のグルタミンプールが枯渇することが明らかにされている[24]。グルタミンの枯渇は免疫細胞を飢えさせ、免疫細胞の数を減少させたり、活動を低下させたりする。一方、LPSまたはTNF-α、インターロイキン-1βなどのプロ炎症性サイトカインは、アストロサイトにおけるグルタミン合成酵素の発現を有意に減少させることができ、その結果、外因性グルタミンが低くなる。幸いなことに、グルタミンの補充は、強い抗炎症効果を有するようである。例えば、外因性グルタミンは、熱ショックタンパク質を誘導し、IL-8産生を調節し、LPS誘発慢性炎症から保護することができる[25,26]。これらの証拠のすべてのラインは、慢性炎症とアルツハイマー病の病因の間の強いリンクを与えられたアルツハイマー病患者にグルタミンの補完が有益である可能性があるという予測に収束する。
グルタミンとオートファジー
オートファジーは、細胞内のタンパク質のリサイクルと分解を行う異化過程であり、栄養飢餓による代謝需要の増加に適応的に反応するように誘導される。オートファゴソームの形成・成熟速度とオートファゴソーム/リソソーム融合の効率は加齢とともに低下し、効率的なオートファジーと細胞の若々しさとの間には直接的な関係があることが示唆されている。実際、オートファジーの増加は老化を遅らせて寿命を延ばすが、オートファジーを阻害すると老化が早まることが明らかになっている。ニューロンのような長寿命のミトコンドリア後細胞では、オートファジーの増加は、有毒なタンパク質の凝集体を減少させ、ミトコンドリアや他の小器官の機能を改善し、生存を促進する。特筆すべきは、オートファジーの増加はまた、自然免疫応答を改善し、炎症性応答を減少させることである。成長している証拠は、オートファジーがアルツハイマー病で規制緩和されていることを示唆している。例えば、ベクリン1の発現の減少は、オートファゴソーム分解の障害[27]のために部分的にアミロイドβが蓄積することを示唆することにつながる、アルツハイマー病脳で検出された。
グルタミンのための神経保護的役割のアイデアと一貫して、我々はグルタミンが培養ニューロンでオートファジーを促進することを発見した[12]。最近の詳細な研究では、van der Vosらは、著名な転写因子であり腫瘍抑制因子であるFOXO3が、グルタミン代謝を調節することでオートファジーを制御することを実証した[28]。実際、グルタミン合成酵素はFOXO3標的遺伝子であり、FOXO依存的なグルタミン合成酵素活性化はオートファゴソーム形成を誘導する。著者らは、グルタミンだけでオートファジーを誘導するのに十分であることを示しているように、この経路はアミノ酸そのものを介して作用する。対照的に 2009年の研究では、Nicklinらは、必須アミノ酸の存在下でのグルタミンの細胞内への取り込みとそれに続く急速な排出がmTORの活性化の律速段階であることを示している。グルタミンのフラックスは、オートファジーを減少させながら、mTORと翻訳を活性化する[29]。グルタミンは細胞タイプに応じて、mTORシグナリング/オートファジーを促進または抑制することができるようである。どちらの反応が観察されるかは、観察されている特定の細胞タイプのグルタミン合成酵素レベルに依存する。内因性グルタミン合成酵素活性を欠くニューロンのような細胞は、オートファジーを含む適切な細胞機能のために外因性グルタミンに依存している。対照的に、より高いレベルのグルタミン合成酵素を発現する細胞は、外因性グルタミンに完全に依存していない。これらの細胞が外因性グルタミンの通常レベルよりも高いレベルを経験すると、正味の効果は実際にグルタミン合成酵素活性を低下させ、間接的にオートファジーの抑制を引き起こすことができる。これらの例は、オートファジーに対するグルタミンの効果がかなり複雑であることを示している。生物全体のために達成する必要がある利益と害の間には微妙なバランスがある。
グルタミンの欠乏はオートファジーに影響を与えるだけでなく、ミトコンドリアを含むオートファジーを介して細胞小器官の幸福にも強い影響を与える。グルタミンの欠乏は、ミトコンドリアの伸長と管状ネットワークの形成につながり、栄養飢餓時のオートファゴソームの分解からミトコンドリアを保護する。ミトコンドリアの伸長は、血清枯渇またはグルコース消去によってオートファジーが誘導された場合には起こらない[30]。多くの細胞タイプにおいてグルタミン欠乏状態ではオートファジーが減少するので、グルタミンを欠乏した細胞でのオートファジーの低下がミトコンドリアのターンオーバーの低下にも寄与している可能性が高いと推論するのは論理的である。また、オートファジーがグルタミン依存性代謝をリセットするのに役立つことにも言及する価値がある。細胞外グルタミンレベルが低い場合、オートファジーは細胞の生存に重要なサブミリモル濃度のグルタミンを細胞に供給することができる。
グルタミンと糖尿病
2型糖尿病は高齢者に多く、65~85歳の約30%の人に影響を与え、血管性認知症とアルツハイマー病の両方の高いリスクと関連している。2型糖尿病とアルツハイマー病の関連性は非常に強く、一部の研究者によってアルツハイマー病は3型糖尿病と呼ばれている。アルツハイマー病では、脳のインスリンとインスリン様成長因子の抵抗性と欠乏が早期に始まり、病気の重症度に応じて悪化する。インスリン経路の規制緩和は、アルツハイマー病の病理に直接寄与する可能性がある。実際、スザンヌ-デ-ラ-モンテの研究室からのデータは、ラットの脳では、インスリン経路が遮断されている場合、ラットのニューロンが悪化し、動物は物理的に混乱になったことを示した。彼らの脳は、アルツハイマー病の兆候の多くを示した[31,32]。
グルタミンは、インスリン分泌に重要なシグナル伝達の役割を果たしており、したがって、体内の血糖値に影響を与える立場にある[33]。臨床研究では、グルタミンサプリメントは、食後血糖値を低減し、2型糖尿病患者におけるグルカゴン様ペプチド-1応答を増強することができることが示されている[34]。予測されるように、グルタミンはインスリンレベルに影響を与えることができるが、インスリンレベルはグルタミン代謝にも影響を与えることができる。Liethらは、糖尿病が網膜のグルタミン合成酵素とグルタミン産生を減少させることを発見した[35]。Mengeらはまた、2型糖尿病患者が循環グルタミン濃度の有意な低下を示すことを明らかにした[36]。さらに、高血糖症を治療すると、大手術後のがん患者の骨格筋グルタミン代謝が改善されることが明らかになった[37]。合わせて、これらのデータは、グルタミンがインスリン感受性の改善に有利である可能性があり、現在知られていない経路を介して、おそらくアルツハイマー病に利益をもたらすことを示唆している。
グルタミンと腸
いくつかの疫学研究では、非ステロイド性抗炎症薬(NSAIDs)の長期使用は、APOE4を有する被験者をアルツハイマー病の発症から保護する可能性があることが示唆されている。しかし、NSAIDsの長期使用は腸管障害を引き起こすことが知られており、高齢者では一般的に消化管の機能が低下しているため、高齢者では悪化する可能性が高い。グルタミンは、腸管内膜の細胞である腸球の主なエネルギー源である。腸管の代謝と健康、特に高齢者にとってグルタミンが不可欠な役割を果たしていることは、多くのエビデンスが示唆している。例えば、高齢になる前に開始したグルタミンの長期投与は、非常に高齢のラットの腸管に強い有益な役割を果たしており、グルタミンを摂取した非常に高齢のラットの腸球は、成人ラットの腸球の代謝能力を回復しているように見える[38,39]。したがって、十分なグルタミンは、NSAIDs使用者の腸管透過性を健康なレベルに維持することで、ダメージを最小限に抑えることができる可能性が高い。グルタミンの抗炎症的役割が知られていることを考えると、グルタミンの補充は、消化管の健康を改善することによってNSAIDsの副作用を打ち消すこと、およびNSAIDsの抗炎症効果を高めることの2つの方法で、長期的なNSAIDs使用者を助けることができるかもしれない。
グルタミンと運動
老化は、アルツハイマー病 の最強の危険因子は、通常強度の低下に関連付けられている筋肉量の漸進的な損失をもたらする。通常、私たちの血流中のグルタミンのほとんどは筋肉によって生成される。高齢者の筋肉量の減少は、グルタミンの利用可能性を制限する。特筆すべきは、グルタミンは筋肉の成長を促進することが知られていることである。実際、グルタミンサプリはボディビルダーに広く利用されている。定期的な運動は、明らかに筋肉の緊張と強度を向上させることができ、重要なことに、それはまた、認知力を高めることができる。2012年に発表されたレビューの中で、Hogervost氏は、身体運動の認知への効果を調査した複数の臨床研究のメタ分析を行った。著者らは、筋力を向上させる運動を用いて行われたすべての研究が認知力を高めることを発見した。興味深いことに、これらのタイプの運動を行っている女性は男性よりも多くの恩恵を受けていた。認知に対する運動の効果は、特に中年女性に顕著であった。さらに著者らは、運動は認知症の予防に役立つかもしれないが、十分な強度の運動は、すでに認知症になっている人でも全体的な認知機能を向上させることができることを示している[40]。加齢や認知に関心のある人の多くは運動の有用性を認識しているが、今回の結果は、すべての運動が同等の効果を持つわけではなく、筋力を向上させる運動の方が明らかに効果的であることを強調している。しかし、この効果の生物学的な根拠を明らかにするのははるかに難しい。Cotmanらは、運動後に脳由来神経栄養因子(BDNF)産生が増強されることを実証している[41]が、身体活動はグルタミン代謝にも強い影響を与える。例えば、運動不足は、タンパク質分解の変化とは無関係に全身のグルタミンのターンオーバーを減少させる [42]。対照的に、中等度のトレーニングは、筋肉合成と末梢クリアランスの間の正のバランスにより、グルタミンの利用可能性の改善につながる。しかし、激しい排泄はグルタミン枯渇と免疫抑制につながる可能性がある[43]。まとめると、グルタミン補給は高齢者、特に筋力の弱い人の認知力向上に役立つかもしれない。
他の脳疾患への応用
アルツハイマー病以外にも、統合失調症、うつ病、自殺行動、てんかんなどの他の脳疾患においても、脳内グルタミン合成酵素の発現、分布、活性が変化していることが示唆されている研究が増えている[44-46]。また、免疫細胞の浸潤、ミエリンやオリゴデンドロサイトの喪失、軸索損傷を特徴とする中枢神経系の炎症性疾患である多発性硬化症(MS)の病変からもグルタミン合成酵素が枯渇していることが明らかになっている。グルタミン合成酵素枯渇に加えて、活動性MS病変では、ジストロフィー性軸索に近接したマクロファージおよびミクログリアにおいて高レベルのグルタミナーゼ発現が認められる [47]。低グルタミンは、6-OHDA誘発性パーキンソン病(PD)ラットの線条体においても記録されている [48]。しかし、初期のヒトの研究では、パーキンソン病患者では酵素グルタミン合成酵素の明確な全身的な調節障害がないことが示された。しかし、ミトコンドリアに対するグルタミンの保護効果を考えると、パーキンソン病患者の医学的栄養素のリストからグルタミンを除外するのは時期尚早であることを示唆している。
また、食事のカロリー制限はラット海馬のグルタミン合成酵素活性を増加させる可能性があり[4]、一方、高脂肪食によって引き起こされる栄養バランスの乱れは海馬のグルタミン合成酵素活性のダウンレギュレーションを誘発することにも注意することが重要である[49]。肥満や高脂肪食は海馬機能に悪影響を及ぼし、ヒトでは可塑性の障害や学習障害につながることが知られている。一方で、食事のカロリー制限は、長寿の延長を含む広範な健康上の利点を有することがよく知られている。それは加齢に関連した病気から中枢神経系を保護し、アルツハイマー病、ハンチントン病(HD)パーキンソン病に関連した症状を予防する。この中枢神経系の保護のメカニズムはまだ十分に理解されていない。しかし、グルタミン酸/グルタミン代謝の障害があることは明らかであり、グルタミンの補充は、これらの中枢神経系疾患の少なくともいくつかを治療するのに有用であるかもしれない(図70.6)。
実務上の問題
多くの末期癌患者と同様に、アルツハイマー病の末期は、原因不明の体重減少と悪液質に関連している。癌では、現在の理解では、腫瘍細胞は、腫瘍に栄養を与えるために、体の他の部分からグルタミンを浸出させている。これは筋肉の消耗と免疫系の低下を引き起こす。グルタミン合成酵素は、がん性悪液質症の間、骨格筋で強くアップレギュレートされ、筋肉の損失中に誘導される萎縮関連遺伝子のリストに属していることに注意されたい。どうやら、グルタミン合成酵素発現のこの増加は、排出速度の増加と一致しないため、筋肉内のグルタミンの枯渇が結果として起こるようである。グルタミンの補給は、身体の衰えを遅らせるための有望なアプローチであるように思われる。しかし、以前の研究では、グルタミンは腫瘍細胞のような分裂の早い細胞にとって必須の食物であることが示されていたため、理学療法士はがん患者にグルタミンのサプリメントを処方することには消極的であった。実際、新しい証拠は、グルタミンがK-RASで制御された代謝経路を通じて膵臓がんの増殖をサポートしていることを示唆している[50]。しかし、これには、すべてのことがそうであるように、トレードオフがある。腫瘍の増殖細胞に対する利点と、グルタミンが我々の免疫細胞にとって不可欠な食物でもあるという事実とのバランスをとる必要がある。たとえグルタミンの摂取量を制限したとしても、筋肉や他の臓器の破壊を誘発することで、がん細胞が必要なグルタミンを「盗む」ことを考える価値がある。グルタミンの “戦争 “に勝つための装備がないため、結果として生じるグルタミンの欠乏は、ひどく私たちの体の正常な細胞にダメージを与える可能性が高い。おそらく、これまでに学んだことを考えると、より良い戦略は、体の機能を維持するのに十分なグルタミンとアミノ酸を供給することではないだろうか。実際、臨床研究と動物実験の両方で、腫瘍の増殖や転移を刺激することなく、乳がん患者にグルタミンを投与できることが示唆されている。したがって、経口グルタミンの利点は、免疫系、特にナチュラルキラー細胞を強化することであり、このようにしてがんを撃退するための身体自身の防御システムを高めることであろう [51-53]。癌やアルツハイマー病などの重篤な疾患に直面している場合、グルタミンの利点は、可能性のある副作用を十分に上回るかもしれない。
サマリーポイント
- グルタミンは条件付きで必須であり、多くの細胞機能にとって重要。
- グルタミン合成酵素活性は厳密に制御されているが、NMDA受容体の活性化、NO産生、低酸素、エストロゲンの欠乏によって影響を受ける可能性がある。
- グルタミン欠乏症は、細胞のストレス応答コンポーネントの安静時レベルを低下させ、細胞が損傷を受けやすくなる。
- グルタミン欠乏は、DNA損傷反応、ミトコンドリアのエネルギー生産、アポトーシス、オートファジーなどの重要な細胞機能を低下させる。
- グルタミン代謝は、糖尿病や慢性炎症などの酸化ストレスや他の アルツハイマー病 危険因子によって引き起こされる可能性が高い アルツハイマー病 患者で妥協している。
- グルタミン合成酵素活性は、アルツハイマー病患者の脳内アストロサイトで減少している;アミロイドβは直接この減少に寄与することができる。
- グルタミンの補給は、複数の領域でアルツハイマー病患者の状態を改善するのに役立つ可能性がある。