Contents
Genome-wide meta-analysis identifies new loci and functional pathways influencing Alzheimer’s disease risk
pubmed.ncbi.nlm.nih.gov/30617256/
アルツハイマー病は非常に遺伝性が高く、最近の研究では20以上の遺伝子座が同定されている。しかし、これらの遺伝子座は遺伝的差異のごく一部を説明するにすぎず、まだ発見されていない遺伝子座が残っていることを示唆している。ここでは、臨床的に診断されたアルツハイマー病とAD-by-proxy(71,880例、383,378例)の大規模なゲノムワイド関連研究を行った。親の診断に基づくAD-by-proxyはアルツハイマー病と強い遺伝的相関を示した(rg = 0.81)。
メタ解析により29のリスク遺伝子座が同定され、215の潜在的な原因遺伝子が示唆された。関連遺伝子は免疫関連組織や細胞型(脾臓、肝臓、ミクログリア)で強く発現している。遺伝子セット解析により、脂質関連プロセスやアミロイド前駆体タンパク質の分解に関与する生物学的メカニズムが明らかになった。また、複数の健康関連アウトカムと強い遺伝的相関を示し、メンデルランダム化の結果から、認知能力がアルツハイマー病リスクを保護する効果があることが示唆された。
これらの結果は、アルツハイマー病リスクに寄与する遺伝的因子の同定に一歩前進し、アルツハイマー病の神経生物学に新たな洞察を加えるものである。
アルツハイマー病は最も頻度の高い神経変性疾患で、約3,500万人が罹患している1。アルツハイマー病は遺伝性が高く、60%から80%と推定されている2。遺伝的には、アルツハイマー病は大きく分けて2つのサブグループに分類される。
1)家族性早期発症例は、多くの場合、強い効果を持つ希少なバリアントによって説明されている3,および
2)低効果の大きさを持つ複数のCOMMONバリアントによって影響を受けている後期発症例4。
分離解析により、APP,PSEN,PSENを含むいくつかの遺伝子が最初のサブグループに関連している。これらの遺伝子の同定は、アルツハイマー病の発症に重要な役割を持つ分子機構、アミロイド原性経路8への貴重な洞察をもたらし、遺伝子の発見が病気の病因の生物学的理解にどのように付加することができるかを例示している。
いくつかのまれな遺伝因子(例えばTREM2やABCA7)の同定に加えて、ゲノムワイド関連研究(GWAS)は、ほとんどの場合、より複雑な後期発症型のアルツハイマー病のための共通のリスクバリアントを発見している。APOEはアルツハイマー病後期発症型の最も強力な遺伝的リスク遺伝子座であり、リスクの3~15倍の増加をもたらしている11。合計19の追加のGWAS遺伝子座については、17,008人のアルツハイマー病症例と37,154人の対照群の発見サンプルを用いて記載されており、その後、8,572人のアルツハイマー病患者と11,312人の対照群での関与遺伝子座の複製が行われている4。現在確認されているアルツハイマー病のリスク遺伝子座は、アルツハイマー病の遺伝率のごく一部を説明しているに過ぎず、サンプルサイズを増加させることは、アルツハイマー病のリスクに関与する生物学的メカニズムの理解を助ける、より一般的なリスクバリアントの検出力を高める可能性がある。
今回の研究では、ヨーロッパ系の45万5,258人(Nsum)を対象に、3つのフェーズに分けてメタ解析を行った(図1)。第1フェーズでは、臨床的に診断された後期発症アルツハイマー病患者24,087人と対照群55,058人を対象とした。フェーズ2では、英国バイオバンク(UKB)に登録されている親のアルツハイマー病状態が利用可能な個人を対象に、AD-by-proxy phe-notypeの解析を行った(プロキシ症例47,793名、プロキシ対照者328,320名)。GWASにおけるバイプロキシ表現型の価値は、最近Liuら12によって12の一般的な疾患について実証され、アルツハイマー病については統計的な力が大幅に向上した。アルツハイマー病の高い遺伝率は、子孫のケースステータスが親のケースステータスから部分的に推測することができ、アルツハイマー病の親の子孫がより高い遺伝的アルツハイマー病リスク負荷を持っている可能性が高いことを示唆している。したがって、我々は、2つの親を持つケースをアップウェイトしながら、アルツハイマー病を持つ1つまたは2つの親を持つ個人を代理ケースとして定義した。同様に、プロキシcon-trolsは、古い認知的に正常な両親が若い親はまだアルツハイマー病を開発する可能性があることの高い可能性を考慮するためにアップウェイトされたアルツハイマー病なしで2つの親を持つ被験者が含まれている(方法を参照してほしい)。代用表現型は一般人のアルツハイマー病状態の純粋な尺度ではなく、アルツハイマー病を発症しない個体を含む可能性があるので、遺伝的効果の大きさはやや過小評価されるだろう。しかし、代理症例対照群は非常に大規模であるため、UKB13を用いた最近の研究でも実証されたように、アルツハイマー病12の遺伝的効果を検出する力が実質的に増加する。最後に、第3相では、第1相と第2相の全個体を一緒にメタ解析し、独立したサンプルでの再現性を検証した。
結果
ゲノムワイドメタアナリシスによるアルツハイマー病症例対照試験 フェーズ1では、3つの独立した共同事業(Psychiatric Genomics Consortium (PGC-ALZ)のアルツハイマー病ワーキンググループ、International Genomics of Alzheimer’s Project (IGAP)、Alzheimer’s Disease Sequencing Project (ADSP))によって収集されたコホートを用いて、臨床的に診断されたアルツハイマー病症例を対象としたゲノムワイドなメタ解析を行った(図)。 有効サンプルサイズNeff=72,500)品質管理に合格した9,862,738種類の遺伝子変異(図1,補足表1)の合計79,145人を対象としている(Nsum、有効サンプルサイズNeff=72,500)。図1および補足表1)。) ADSPのサブセットには、4,343例の症例と3,163例の対照群の全ゲノム配列データが含まれており、残りのデータセットは遺伝子型SNPアレイで構成されていた。PGC-ALZおよびADSPについては、生のジェノタイプデータを標準化された品質管理パイプラインに従った。GWA解析はコホートごとに実行され、その後、要約統計のみが利用可能なIGAPと並んでメタ解析に含まれた(方法を参照)。補足注に詳述されているように、第1相解析では、18の独立した遺伝子座を同定したが、これらはすべて以前のGWASで同定されたものであった(表1,補足図1,補足表2)。
次に(第2相)親のアルツハイマー病状態を年齢で重み付けしたUKBのヨーロッパ系祖先の376,113人を用いてGWASを実施し、AD-by-proxy状態を構築した(図1)。ここでは、13の独立したGWS遺伝子座を同定したが、そのうち8つの遺伝子座が第1相と重複していた(表1,補足注)。その結果、アルツハイマー病ステータスとAD-by-proxyステータスの間には0.81(s.e.m.=0.185)という強い遺伝的相関が認められ、また、補足注に記載されているように、個々のSNP効果にも大きな一致が見られた。
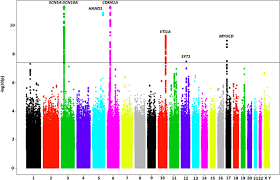
遺伝的重複が高いことから、第3相では、臨床アルツハイマー病 GWASとAD-by-proxy GWASのメタ解析を実施した(図1)。連鎖不平衡(LD)スコア切片14は1.0018(s.e.m.=0.0109)標本サイズ調整値15 λ1,000は1.044であり、遺伝的シグナルのインフレ(λGC =1.0833)の大部分は多遺伝子性によって説明できることが示された(補足図1b)。2,357個のGWSバリアントがあり、そのうちの94個のリードSNPは29の異なる遺伝子座に位置していた(表1,図2,補足図2)。これらには、フェーズ1で検出された18座位のうち15座位、フェーズ2で検出された13座位のすべて、および個別の解析ではサブスレッショルドであったが、メタ解析では有意になった9座位が含まれていた。有意なSNPの大部分(94例中60例)は、19番染色体上の確立されたAPOEリスク遺伝子座に集中していた。この領域は複雑なLD構造を持ち、アルツハイマー病リスクに非常に強い影響を及ぼすことが知られている;したがって、これらのSNPは単一の関連シグナルを表している可能性が高いと考えられる。条件付き解析では、ほとんどの座位が単一の完全に独立したシグナルを表すことが示されたが、TREM2,PTK2B/CLU、およびAPOE座位は複数の可能性のある因果関係シグナルを含んでいた(補足注、補足表3および4)。
29の関連遺伝子座のうち、16の遺伝子座はLambertら4のGWASで同定された20のゲノム領域のうち1つと重複しており、彼らの知見を再現していたが、13の遺伝子座は新規であった。5つの遺伝子座(CR1, ZCWPW1, CLU/PTK2B, MS4A6a, APH1B)の関連シグナルは、一部ADSPのエキソームシーケンスデータに基づいている。ADSPを除いたこれらの遺伝子座の再解析では、同様の関連シグナルが得られた(補足表5)。これは、IGAPとADSPの間の部分的なサンプルオーバーラップを正しく調整したことを示唆している。3つの遺伝子座(HESX1,TREM2,およびCNTNAP2に最も近い遺伝子を持つ)のリードSNPは、UKBコホートでのみ利用可能であったが(表1)質の高いものであった(インputation quality INFO score >0.91,Hardy-Weinberg equilibrium P >0.19,ミッシングネス <0.003)。これらのSNPはすべて稀であり(マイナー対立遺伝子頻度(MAF)<0.003)将来的には別の同様の大規模サンプルで確認する必要があることを意味している。しかし、TREM2のバリアントは、以前の研究ではアルツハイマー病と強固に関連していた9。
13の新規遺伝子座をアルツハイマー病9,12,16-18に関する他の最近の遺伝学的研究と照合して、4つの座(TREM2,ECHDC3,SCIMP、およびABI3)は、Lambertらによって同定された16に加えて、以前に発見されており、この執筆時点では9つの新規遺伝子座(ADAMTS4,HESX1,CLNK、CNTNAP2,ADAM10,APH1B、KAT8,ALPK2,およびAC074212.3)を残している。ADAMTS4とKAT8遺伝子座もまた、部分的に重複するサンプルでの最近の解析で同定されている13。我々のメタ解析結果をLambert er al)。4の全遺伝子座と比較して、関連遺伝子座の違いを決定するために、我々は4つの遺伝子座(MEF2C、NME8,CELF1,およびFERMT2)をGWSレベルで観察することができなかった(観察されたP値は1.6×10-5~0.0011)これは主にUKBデータセットでは低い関連シグナルに起因している(補足表6)。対照的に、Lambertら4は、彼らの研究の第二段階ではDSG2とCD33遺伝子座を再現することができなかった。我々の研究では、DSG2もまた、この遺伝子座の無効性を示唆しているが、CD33遺伝子座(表1のrs3865444)はアルツハイマー病と有意に関連しており(メタ解析P = 6.34 × 10-9; UKB解析P = 4.97 × 10-5)アルツハイマー病リスクとの真の遺伝的関連を示唆していた。
次に、我々は、6,593人のアルツハイマー病症例と174,289人の対照者を含むアイスランドの独立したコホート(deCODE19,20)を用いて、各遺伝子座におけるリードSNPまたはリードSNPのLD-proxy(r2 >0.9)の複製を検定することにより、新規知見のさらなる支持を見つけることを目指した(図1および補足表7)。リードSNP(および高LDのSNP)がアイスランドの参照パネルに存在しないか、十分な品質でインピュートされていなかったため、2つの座位をテストすることができなかった。レプリケーションのためにテストした7つの新規遺伝子座のうち6つについては、deCODEコホートでも同じ方向に効果があることが観察された。さらに、遺伝子座(CLNK、ADAM10,APH1B、およびAC074212.3)は、同一遺伝子座内の同一SNPまたは高LDのSNP(r2 >0.9)に対して、名目上有意な関連結果(P <0.05)を示した(両側二項検定P = 1.9 × 10-4)。1番染色体上の遺伝子座(ADAMTS4)は有意に非常に近く(P = 0.053)非複製よりも複製の証拠が強いことを示唆していた。新規遺伝子座とは別に、我々は、deCODEで利用可能な(27のうち26の)メタアナリシスから、すべての遺伝子座の96.3%のトップ(遺伝子座ごとの)リードSNPについて、符号の一致を観察した(両側二項検定 P = 4.17 × 10-7)。
複製を検定する追加の方法として、2つの独立したサンプル21において、ゲノムワイドなポリジェニックスコア予測を用いた。今回の結果は、症例対照の診断を受けた761人の個人において、1.69×10-5という低いベストフィットP閾値(P =1.80×10-10)で、臨床的アルツハイマー病の分散の7.1%を説明した(P =1.80×10-10)。APOE遺伝子座(chr19: 45020859-45844508)を除くと、この結果は分散の3.9%を3.5×10-5のベストフィットP閾値で説明した(P =1.90×10-6)。我々はまた、R2 = 0.41と0.827の曲線下面積(AUC)(95%信頼区間(95%CI):0.805-0.849,P = 1.90×10-6)のR2 = 0.41と曲線下面積(AUC)で病理学的に確認された1,459例とコントロール22のサンプルでアルツハイマー病状態を予測する。 805-0.849,P =9.71×10-70)のR2 =0.23およびAUC =0.733(95%CI:0.706-0.758,P =1.16×10-45)のGWAS P <0.50のSNPのベストフィットモデルを使用した場合と同様に、APOE SNPのみを使用した場合であった。この検証サンプルには、IGAPとオーバーラップする個体が少数含まれている;このサンプルを用いた以前のシミュレーションでは、このオーバーフィットにより推定値の誤差が約2-3%増加することが示されている22。しかし、このサンプルは、超正常な対照群とは対照的に重度の末期アルツハイマー病症例を代表しているため、多遺伝子予測は典型的な症例対照群または集団サンプルで予想されるよりも高いかもしれない。
遺伝的変異の機能的解釈。関連する遺伝子座におけるすべてのGWS SNP(n = 2,357)の機能的アノテーションを行ったところ、SNPの大部分はイントロニック/インタージェニック領域に位置していたが、クロマチン状態4と5に富む領域にも位置しており、活発な転写への影響を示唆していることがわかった(図3,補足表8)。25個のGWS SNPはエキソニック非同義であった(図3a、補足表9)が、おそらく遺伝子機能に劇的な影響を与えていた。強い関連性(Z >|7|)を示す収束した証拠と劇症的なバリアント効果の高い確率(Combined Annotation Dependent Depletion (CADD)23スコア≥30)が、rs75932628 (TREM2)、rs142412517 (TOMM40)、rs7412 (APOE)に見出された。最初の2つのミスセンス突然変異はまれで(それぞれMAF=0.002および0.001)代替対立遺伝子はアルツハイマー病の高いリスクと関連していた。後者のAPOEミスセンス変異は、確立された保護対立遺伝子Apoε2である。補足表8および9は、関連するゲノム座位におけるバリアントの詳細なアノテーションカタログを示している。また、同定されたGWSバリアントから信頼できる原因となるSNPのセットを同定するために、ファインマッピングモデル24を適用した(補足表8)。例えば、APOE遺伝子座(No.26)では854個中30個のSNPが選択されたのに対し、HLA-DRB1遺伝子座(No.7)では434個中345個のSNPが選択された。因果関係のあるSNPは、エキソニック非同義語などの既知の機能的カテゴリーに限定されておらず、より複雑な因果関係の経路を示しており、これらの統計的および機能的アノテーションによって優先的に決定された一連のバリアントを用いて調査する価値があることが示された。
非常に大きな効果量を持つSNP(すなわちAPOEバリアント)を除外した分割遺伝率解析25では、H3K27acマークに位置するバリアントについてSNP-遺伝率(h2SNP)の濃縮度が示された(濃縮度=3.18,P=9.63×10-5)。 63 × 10-5)や、転写の活性化に関連する複数のエピジェネティックな転写活性マークがクラスターするゲノム領域であるスーパーエンハンサー(濃縮度=3.62,P=2.28 × 10-4)に位置するバリアントについては、SNPヘリタビリティ(h2SNP)が濃縮されていた(図3d、補足表10)。また、遺伝率は17番染色体上のバリアントでも富化し(富化度=3.61,P=1.63×10-4)希少なバリアントよりも共通のバリアントでは遺伝率が富化する傾向が見られた(補足図3,補足表11,12)。遺伝率の大きな割合(23.9%)は19番染色体上のSNPによって説明できるが、この推定値の周りの標準誤差が大きいため、この富化は有意ではなかった(補足表11)。全体的に、これらの結果は、アルツハイマー病リスクに寄与するいくつかの非-シノニム性バリアントにもかかわらず、GWSのSNPの大部分は非コード領域に位置し、転写に活性化効果を持つ領域に富むことを示唆している。
示唆された遺伝子。関連するバリアントを遺伝子に関連付けるために、Functional Mapping and Annotation (FUMA)26で実装されている3つの遺伝子マッピング戦略を適用した(方法を参照)。遺伝子マッピングには、P値が5×10-8以下のすべてのSNPを使用した。位置的遺伝子マッピングでは、既知の遺伝子境界から上流または下流(±10キロベース(kb))の位置によってSNPを99個の遺伝子にアラインメントし、発現定量形質座(eQTL)遺伝子マッピングでは、cis-eQTL SNPを1つ以上の組織で発現レベルに影響を与える168個の遺伝子にマッチさせた。とクロマチン相互作用マッピングは、各SNPのゲノム領域と近傍または遠方の遺伝子との間の三次元的なDNA-DNA相互作用に基づいて、SNPを21の遺伝子に結びつけた(注釈されたエンハンサー領域とプロモーター領域間の相互作用のみに限定した)(補足図4,表13および表14)。4,補足表13,14)。) その結果、192個の遺伝子がマッピングされ、そのうち80個は少なくとも2つのマッピング戦略によって、16個は3つのマッピング戦略によってマッピングされていた(図4e)。
特に注目すべきは、8番染色体上の遺伝子座(CLU/PTK2B)である。Lambertら4によるGWASでは、この遺伝子座は2つの異なる遺伝子座(CLUとPTK2B)として定義されていた。遺伝データに基づく条件付き解析でも、この遺伝子座は少なくとも2つの独立した関連シグナルを持つとされていたが(補足表4)脾臓と肝臓という2つの免疫関連組織におけるクロマチン相互作用データ(補足表14)は、PTK2BとCLU遺伝子座によってインデックスされたゲノム領域が物理的に相互作用している可能性を示唆しており(図3e)したがって、同じ生物学的メカニズムを介してアルツハイマー病発症に影響を与えていると考えられる。組織特異的な遺伝子発現パターンは、CLUとPTK2Bの間では、どちらも脳とリンパ節で比較的高い発現を示しているが、ほとんど異なっている27。したがって、今後の研究では、これら2つの遺伝子が同時にどのようにアルツハイマー病リスクに影響を与えるかの共同効果を検討すべきである。
8つの遺伝子(HLA-DRB5,HLA-DRB1,HLA-DQA、HLA-DQB1,KAT8,PRSS36,ZNF232,CEACAM19)は特に注目すべき遺伝子であり、これらの遺伝子はeQTL関連を介して、アルツハイマー病発症の初期に影響を強く受ける脳領域である海馬-大脳に関与している(補足表13)。16番染色体には長距離eQTL関連遺伝子が含まれており(図3f)背外側前頭前野で観察されたRNF40の発現変化を含め、より遠方の遺伝子C16orf93,RNF40,ITGAXが様々な体組織(例えば、血液や皮膚)で遺伝的因子(rs59735493)によってどのように影響を受けうるかを明確に示している。これらの観察結果は、物理的な位置だけでなく、エピジェネティックな影響も考慮して原因遺伝子や制御要素を検討することの妥当性を強調している。補足注に詳述されているように、リスク遺伝子座にはeQTLが過剰に存在し、関連する脳領域では多くの量的形質座(QTL)関連(eQTL、メチル化量的形質座(mQTL)ヒストンアセチル化量的形質座(haQTL)を含む)が同定され、将来の機能的追跡調査や生物学的解釈のための興味深いターゲットとなった(補足表15-17)。
これらの遺伝子マッピング戦略は、GWAS遺伝子座ごとに複数の原因遺伝子を示唆しているが、いくつかの遺伝子は、機能的または以前にアルツハイマー病との遺伝的関連を持っているため、特に関心のある遺伝子である。補足表13の遺伝子座1については、ADAMTS4は神経可塑性に機能し、アルツハイマー病発症におけるその役割のために広く研究されているADAMTSファミリーのプロテインをコードしている28。19座については、明らかに最も可能性の高い原因遺伝子はADAM10であり、この遺伝子はADAM1029のまれなコデイングバリアントに焦点を当てた研究によってアルツハイマー病と関連している。ここでは、この遺伝子はアルツハイマー病の同門リスク因子として暗示されており、これはLDにおける複数の共通SNPの背外側前頭前野eQTLおよびmQTLデータ(補足表15および16)で観察された因果関係のある分子機構によって支持されている。この遺伝子は、APP30を切断するγセクレターゼ複合体のタンパク質サブユニットをコードするAPH1Bのエクソン1にある非同義変異体である。この遺伝子座のリードSNPがKAT8の3番目のイントロン内に位置しており、この遺伝子座内の複数の有意な変異が海馬を含む複数の脳領域におけるKAT8の発現またはメチル化レベルに影響を与えている(補足表13および16)。クロマチン修飾因子KAT8は、Apoε4の非存在下でアルツハイマー病に関連する遺伝子KANSL1によって制御されている。パーキンソン病を対象とした研究では、GWASと遺伝子発現の差に基づいて、アルツハイマー病とパーキンソン病におけるKAT8の神経変性における共有の役割を示唆し、潜在的な原因遺伝子としてKAT8を報告した31。これまでに報告された遺伝子の機能情報は非常に有用であるが、機能的なフォローアップ実験の指針とするためには、関与しているすべての遺伝子を因果因子とみなすことが望ましい。
次に、Multi-marker Analysis of GenoMic Annotation (MAGMA)32を用いて、ゲノムワイドな遺伝子ベースの関連性解析(GWGAS)を行った。この方法は、既知のタンパク質コード遺伝子にSNPをアノテーションし、遺伝子内のすべてのSNPに基づいて集約的な関連性を推定するものである。FUMAが個々に有意なSNPを遺伝子にマッピングするのに対し、統計的な遺伝子ベースの検定を提供する点でFUMAとは異なる。GWGASでは、アルツハイマー病と有意に関連する97の遺伝子を同定した(補足図5,補足表18)が、そのうち74の遺伝子がFUMAでもマップされていた(図4e)。そのうち、7 遺伝子(HLA-DRA、HLA-DRB1,PTK2B、CLU、MS4A3,SCIMP、RABEP1)は APOE 遺伝子座には存在しないため、今後の研究の必要性が高いと考えられた。
アルツハイマー病およびAD-by-proxyに関与する遺伝子セット。遺伝子ベースのP値を用いて、キュレーションされた生物学的経路と組織/単細胞発現について遺伝子セット解析を行った。4つの遺伝子オントロジー33の遺伝子セットがアルツハイマー病リスクと有意に関連していた。タンパク質脂質複合体(P = 3.93 ×10-10)アミロイド前駆体プロタンパク質異化過程の制御(P = 8.16 ×10-9)高密度リポタンパク質粒子(P = 7.81 ×10-8)タンパク質脂質複合体アセンブリ(P = 7.96 ×10-7)である(図4a、補足表20および21)。APOE遺伝子座に関する条件付き解析では、関連シグナルの一部はAPOEにも起因していたが、これら4つの遺伝子セットのアルツハイマー病との関連はAPOEの影響に依存しないことが示された。高密度リポタンパク質粒子経路の25個の遺伝子は全てタンパク質脂質複合体の一部である;条件分析は、これらの遺伝子セットが独立した関連として解釈できないことを示した(P = 0.18)が、他の3つのセットは独立して有意であることを示した(補足表20)。
遺伝子ベースのP値を組織および細胞型特異的な遺伝子セットにリンクさせると、テストしたすべての遺伝子セット(すなわち、6,994の遺伝子オントロジーカテゴリ、53の組織および39の細胞型)を補正した厳格なボンフェローニ補正には、関連性は認められなかった。しかし、全組織型または細胞型の検査数のみを補正した場合(図4cおよび補足表22)特に全血(P=5.61×10-6)脾臓(P=1.50×10-5)肺(P=4.67×10-4)では、APOE遺伝子座とは独立した免疫関連組織間での関連性が示唆された。脳の単細胞発現遺伝子セット解析では、マウスを用いた発現データセットでミクログリアとの関連が認められた(P = 1.96 × 10-3)が、厳密なボンフェローニ補正には耐えられなかった(図4b、補足表23)。しかし、我々は、ヒトにおける2番目の独立した単細胞発現データセット(P = 2.56 ×10-3)において、ミクログリアについて同様の同化シグナルを観察した(補足図6および補足表24)。予想されるように、両方のミクログリアのシグナルは、大部分が独立しているものの、部分的にはAPOEに依存している(補足表23および補足表24)。
交叉型遺伝的影響。補足注および補足表25,26に記載したように、アルツハイマー病に対する遺伝的影響は、認知能力や教育的達成度を含む多くの他の疾患や心理的形質と重複していることが観察され、先行研究34,35と同様の結果が得られた。これらの知見を拡張するために、我々は一般化された要約統計学に基づくメンデル無作為化36(GSMR)を用いて、アルツハイマー病のリスクに直接影響を及ぼす可能性のある遺伝的に相関した結果の信頼できる因果関係の可能性を検証した。アルツハイマー病は遅発性疾患であるという性質と、他のほとんどの形質の要約統計が若いサンプルから得られているため、我々は潜在的な因果関係の逆方向の検定は報告していない(つまり、遅発性疾患が早発性疾患に及ぼす因果関係の検定は行っていない)。この一連の解析では、遺伝的に相関のある表現型のサマリー統計から得られたSNPを道具変数として使用し、各曝露とのSNPの関連性とアルツハイマー病転帰との関連性の比を比較することにより、これらの「曝露」表現型がアルツハイマー病リスクに及ぼす因果関係を推定した(方法を参照のこと)。相関統計量は標準化されており、報告された効果は、曝露表現型の標準偏差が増加するごとに、アルツハイマー病のオッズ比の予想される差を反映するようにした。我々は、認知能力(オッズ比=0.89,95%CI:0.85-0.92,P=5.07×10-9)学歴(オッズ比=0.88,95%CI:0.81-0.94,P=3.94×10-4)および身長(オッズ比=0.96,95%CI:0.94-0.97,P=1.84×10-8)のアルツハイマー病リスクに対する保護効果を観察した(補足表27および補足図7)。アルツハイマー病とこれらの表現型の間にはプリーオトロピーの実質的な証拠は観察されず、オーバーラップするSNPの1%未満がアウトライアとしてフィルタリングされた(補足表27)。
考察
サンプルサイズを増やすためにアルツハイマー病の代理遺伝子型を含めるという型破りなアプローチを用いることで、9つの新規遺伝子座を同定し、アルツハイマー病の病因に関する新しい生物学的知見を得ることができた。9つの新規遺伝子座のうち、7つの遺伝子座の複製を検定することができたが、そのうち4つの遺伝子座は明らかな複製を示し、1つの遺伝子座はわずかな複製を示し、2つの遺伝子座は現時点では複製されていないことがわかった。標準的な症例対照の状態とUKBのバイプロキシ表現型との間の高い遺伝的相関(rg =0.81)と、独立したdeCODEコホートにおける新規遺伝子座の複製率の高さは、この戦略がロバストであることを示唆している。
in silicoでの機能的追跡解析を通じて、また、先行研究18,37と同様に、免疫関連の体組織(全血、脾臓、肝臓)と脳の主要な免疫細胞(ミクログリア)の変異型濃縮を確立することで、疾患病理の結果としての免疫応答ではなく、免疫系の重要な因果関係を強調している。注目すべきは、肝臓で観察された濃縮は、アルツハイマー病発症における脂質系の遺伝的関与を示唆している可能性があるということである38。
さらに、同定されたゲノムリスク遺伝子座について、免疫関連組織内での情報提供的なeQTL関連とクロマチン相互作用を観察した。我々の研究における脂質代謝に対するアルツハイマー病関連の遺伝的影響と合わせて、これらの生物学的意味合い(これは遺伝的シグナルに基づいており、以前の生物学的信念に左右されない)は、脂質の変化がミクログリアやアストロサイトの免疫応答や脳の血管の健康に害を及ぼす可能性があるため、アルツハイマー病の発症には炎症と脂質の相互作用が関与しているという仮説を強化している39。
以前の臨床研究に従って、我々の研究は、アルツハイマー病上のいくつかの人間の形質の保護効果のための重要な役割を示唆している。認知的予備力は、脳が既存の認知処理戦略を用いて脳損傷を制御しようとする保護機構として提案されている40。本研究で得られた知見は、アルツハイマー病の遺伝的要因の一部が認知的予備力に影響を与えている可能性を示唆しており、アルツハイマー病の病態に関連した損傷過程に関与するのではなく、認知的予備力を介して間接的にアルツハイマー病の発症に影響を与えている可能性を示唆している。さらに、大規模なコミューニティベースの研究では、アルツハイマー病発症率が数十年にわたって低下していることが観察されており、これは最低でも高校卒業資格を持つ人に特有のものであった41。このことは、教育到達度のメンデル無作為化の結果と組み合わせることで、教育到達度のアルツハイマー病に対する保護効果が遺伝の影響を受けていることを示唆している。
同様に、観察された身長の正の効果は、身長と頭蓋内容積42,43の間の遺伝的重複の結果である可能性がある。この間接的な関連性は、身長の高い人のコグニティブ予備能の増加が観察されていることによっても裏付けられている45。あるいは、身長に影響を与える遺伝的変異はまた、インスリン様成長因子をコードし、脳アミロイド46と関連しているIGF1のような、アルツハイマー病の病因に関与する生物学的メカニズムに影響を与えるかもしれない。
本研究の結果は、さらに、機能的追跡実験のための有望な遺伝子の選択や、薬剤開発や層別化アプローチのためのターゲットを特定するための貴重なリソースとして役立つ可能性がある。機能的解釈戦略とフォローアップ実験により、末期アルツハイマー病の病因の理解が深まり、アルツハイマー病治療改善のための強固な基盤となることを期待している。
