Contents
From Reproducibility to Translation in Neurodegenerative Disease
要旨
神経変性疾患に対する莫大な投資と前臨床試験の成功にもかかわらず、患者に対する効果的な疾患改善治療法は未だに確立されていない。この不一致の理由の一つとして、動物実験のデザインと報告に欠陥があることが挙げられている。
この点が広く改善されれば、前臨床試験の再現性は向上するであろう。しかし、一般化可能性を改善する努力を並行して行わなければ、これらの改善は動物実験からより複雑なヒト神経変性疾患に効果的に反映されないかもしれない。
神経変性疾患のメカニズムや表現型の多様性は、ほとんどのモデルでは複雑な現象の個々の側面を調べることしかできない。一つのアプローチは、動物を個々の疾患のモデルとしてではなく、個々の標的のモデルとして考え、予測妥当性の概念を個々のモデルから、標的のトランスラタビリティーを実証する実験体へと移行させることである。
探索的前臨床研究も治療的前臨床研究も、厳密性と再現性を促進する研究デザイン法に依存している。しかし、治療学的研究で有効性を実証するために必要とされるエビデンスは、探索的研究で必要とされるものよりもかなり広い。
個々の実験における厳密さを必要とすることに加えて、治療の可能性を示す説得力のある証拠は、モデルの選択、意図した介入の目的、薬理学的基準、バイオマーカーデータとヒトに臨床的に関連するアウトカム指標の統合との関係を評価しなければならない。
概念実証研究が細胞ベースのシステムに移行し、動物システムはより遠位のトランスレーショナルな目的のために 確保されるようになることが考えられる。そうなれば、「トランスレーショナル」という言葉が真に意味するものは何かを再検討することになるだろう。
神経変性、再現性、厳密性、翻訳
序論
研究の現場には、神経疾患に対する有望な前臨床研究が数多く存在するが、ヒトではその可能性を発揮できなかった(Geerts 2009; Silberberg 2013; Talevi er al)。 2012)。この不一致の理由としてよく挙げられるのは、動物試験のデザインと報告の厳密さが不十分であることである(Landis er al)。 2012; Perrin 2014その結果、再現性がない(Begley and Ioannidis 2015有望な結果が過剰に報告される(Sena er al)。 2010; Tsilidis er al)。 2013)。これを緩和するための努力として、報告とデザインのガイドライン(Kilkenny er al)。 2010)は、多数のジャーナル(Santori 2016)や主要な研究助成機関(Collins and Tabak 2014)によって採用されている。これらの変更が広く実施されれば(Eisen er al)。 2014前臨床試験の厳密性と再現性が向上する可能性が非常に高い。しかし、それらは本当に翻訳を改善するのであろうか?
再現性とは、実験をわずかに異なる条件で繰り返したときに、実験結果を複製できる能力と定義されている(Begley and Ioannidis 2015)。翻訳は、はるかに困難な課題であり、動物実験で得られた知見をどの程度までヒトに一般化できるかを指す。新薬候補の薬物動態学的及び薬力学的特性を動物からヒトに翻訳しなければならず(Danhof er al)。 2008臨床試験を開始する前にヒトへの毒性効果を予測しなければならず、新規候補は長期の臨床開発期間を乗り切らなければならない(Paul er al)。 2010)。薬理学的および毒性学的な問題は新薬の開発中止の重要な原因であるが、特に第Ⅱ相および第Ⅲ相試験では、有効性の失敗がトランスレーショナルな主要な障害となっている(Arrowsmith and Miller 2013; Cook er al)。 2014)。
神経変性疾患に代表されるトランスレーショナルな課題の1つは、問題となっている疾患の生物学的な複雑さである。神経変性疾患は、病因論的にも機構論的にも複雑であり、表現型が変化し、容赦なく進行する。これらの疾患は、解剖学的にアクセスできない器官系に影響を与え、再生能力が比較的低い高度に分化した細胞型で構成されている。さらに問題を複雑にこととして、最も一般的な認知症は、複数の曝露や併存疾患を持つ高齢の患者集団で発生する。この複雑さを克服するために、前臨床研究における一般的な科学的手法は還元主義的アプローチに頼ってきた(Ahn et al 2006)。神経科学研究に対する財政支援は、過去10年間で大幅に増加している(Tracy 2016)。疾患を改善する可能性のある膨大な数の介入を試験する前臨床研究の大部分は有望な結果をもたらしている(Gordon and Meininger 2011; Lohle and Reichmann 2010; Zeiss 2015)アルツハイマー病の分野では、動物モデルを用いた国立衛生研究所(NIH)の資金提供による研究がヒトでの研究を上回っている(Pistollato er al)。 これらの努力にもかかわらず、神経変性疾患に対する疾患改善のための介入は、捉えどころのないままであった。
新たな発見がなされるのは基礎研究を通してであり、その価値は広く揺るぎないものであると考えられている(Collins er al)。 2016)。NIHのOffice of Portfolio Analysis (nexus.od.nih.gov/all/2016/08/03/model・organisms-part-two/)による2016年のアップデートでは、マウスモデルを用いた研究が、NIHの学外ポートフォリオの中でますます重要な役割を果たしていることが明らかになった。現在の傾向が続くならば、ほとんどの介入マウス研究は有望な結果が得られ、ほとんどの研究はヒトの反応を予測することができないだろう。前臨床試験のデザインが十分に厳密でないことから生じる再現性のなさや動物データの過度のバラツキは、トランスレーショナルギャップを確実に悪化させている(Scott er al)。 2008)。動物実験デザインの改善が広く実施されれば、このギャップは縮小されるであろう。しかし、それは必ずしも翻訳の改善を保証するものではない。
複雑性の問題
遺伝子操作されたマウスは、人間のシステムの複雑さによって不明瞭になっているかもしれない力学的現象を解剖するために使用される。このために使用されるアプローチは、主に仮説に基づく方法と還元主義的な方法である(Heng 2008)。方法論的還元主義は、個々の部分に関する情報が全体を説明するのに十分であるという仮定に基づいている(Ahn er al)。 2006)。調査中の独立変数以外のすべての要因を一定に保つために、選択された介入の効果が明確に明らかになるように、潜在的な変動源が制御される。研究内の因果関係の結論が正当化される程度は内部妥当性と呼ばれ(van der Worp er al)。 2010)、実験計画と実施が系統的誤差(バイアスとも呼ばれる; Bailoo er al)。 2014)をいかに最小化するかに決定的に依存する。このアプローチの欠点は、実験システムがあまりにも特異的になり、その結果が他の状況への一般化に失敗する可能性があること、つまり、外部妥当性が限られていること(van der Worp er al)。
内部的妥当性と外部的妥当性の間のこのトレードオフが、動物モデルから得られた結果がヒト集団に一般化されない潜在的な理由の一つである(Perel er al)。 2007; van der Worp er al)。 2010)。疾患が複雑であればあるほど、個々の部分の相互作用によって、その部分の調査だけでは予測できない行動が生じる可能性が高くなる。一般化可能性を可能にする要因は、内部妥当性に影響を与える要因よりも文脈的に定義されており、モデルの選択(Bolker 2012)介入の目的、縦断的または横断的な研究デザイン、バイオマーカーデータと臨床的に関連するアウトカム指標との統合などの変数間の関係に関係している(Buckholtz er al)。 これらの複雑さは還元主義的手法を放棄する理由ではなく、還元主義的手法を改良し、その限界を理解し、戦略的に利用するためのものである。
還元主義、よくできている
再現性を損なう研究デザインや報告の欠陥は、20 年以上前から研究結果の内部妥当性を損なうことが指摘されてきた(Festing 1992)。さらに最近になって、個々の実験結果を信頼できるように研究デザインを改善するための対策を講じなければならないというコンセンサスが広まってきている(Howells er al)。 具体的なデザインと報告に関する推奨事項については、過去の出版物(Bailoo er al)。 2014; Festing 2006; Festing and Altman 2002; Kilkenny er al)。 2010; NRC 2011)で包括的に議論されており、表1に簡単にまとめられている。これらのガイドラインの普及は遅々として進まないが(Baker er al)。 2014; Gulin er al)。 厳密な方法を用いた研究の複製が有意性のためのより高い基準を設定するという証拠がある。例えば、Scottら(2008)は、最適化された試験デザインを用いて、マウスモデルにおいて生存期間を延長することが以前に報告された複数の化合物を再試験し、以前に報告された経路および用量で投与されたいずれの化合物についても生存の有益性がないことを報告した。したがって、厳密な試験デザインの方法は、有望な前臨床試験結果の氾濫を減少させ、ポジティブな結果を信頼できるという確信を与える可能性が高い。これは前臨床試験の信頼性を向上させるための必要かつ基本的なステップであるが、結果をより複雑なシステムに変換するという問題が残っている。
表1. 動物実験における試験デザインと報告のためのショートガイド
スタディデザイン
1. 実験単位の定義
個体、治療群、ケージ、牛群など。各グループ内では、動物は、年齢、体重、遺伝子型、背景株、性別、および他の関連する変数のバランスをとる必要がある。
2. 無作為化
選択の偏りを避けるために、正式なランダム化システムを使用して治療グループに動物を割り当てる。
3. 盲検化
治療状態にマスクされた転帰のオブザーバー、および遺伝子型などの解釈に影響を与える可能性のある他の変数。観察はランダムな順序で行われる。
4. 検出力分析を用いた標本サイズの推定
検出力分析は次の変数を考慮に入れる:結果指標の変動性、意味のある効果の大きさ、有意水準(通常はP = 0.05検出力(通常は80%統計的検定の両側性。標本サイズが固定されている場合、提案された実験の検出力(すなわち、指定された効果が検出される可能性が高い確率)の推定値を検出するために、検出力分析を使用することができる。サンプルサイズの計算を行うためのソフトウェアやオンラインのフリーウェアの例:nQuery (www.statsols.com/nquery-sample-size-calculator)Biomath (www.biomath.info/power/index.htm)G power (www.gpower.hhu.de/en.html)Experimental Design Assistant (eda.nc3rs.org.uk/)。
5. 資源方程式法を用いた標本サイズの推定
分散分析を使用して結果を分析する複数の治療群を含む小規模で複雑な生物学的実験に有用。
6. 階層実験計画
これにより、リソースの大幅な増加を必要とせずに、結果に対する複数の変数(例えば、治療法、系統、性別、食事)の影響を調べることができる。
7. 適切な統計分析
パラメトリック手法(例えば、t検定や分散分析)は、残差(グループ平均からの各オブザベーションの偏差)が正規分布を持ち、変動が各グループでほぼ同じであるという仮定に依存する。小さな標本サイズ(典型的には<6)または歪んだデータの場合、ノンパラメトリック手法(例えば、Mann-WhitneyまたはWilcoxon 検定)が典型的にはより適切である(109)。しかし、サンプルサイズが小さい場合、基礎となる分布が正規分布であり、変動が既知である場合、パラメトリック法が適用されることがある。
報告
1. 動物の特徴を定義する
遺伝的変化、背景にある株、性別、年齢、または転帰に影響を及ぼす可能性のある他の特徴。
2. 飼育と福祉の詳細を提供する
これらには、一般的な詳細(例えば、食事や住居)だけでなく、実験結果に影響を与えるもの(例えば、実験が行われた日の時間)が含まれる。痛みや苦痛を最小限に抑えるための努力を記述する。予期せぬ動物の損失を報告してほしい。
4. 実験計画の詳細を記載する。
無作為化、盲検化、遺伝的特徴、実験単位、介入の詳細、転帰尺度、病理組織学的研究におけるスコアリングの方法とバイアスを回避するための手段、統計解析の方法。
5.データを明確に報告する
変動の尺度を含める(例:標準偏差、信頼区間)。相対値(例えば、相対リスク、オッズ比)と同様に絶対値を提供する。各平均について実験単位数を特定する。
Bailoo er al)。 2014; Festing 2006; Festing and Altman 2002; Holland and Holland 2011; Kilkenny er al)。 2010からの引用。
疾患ではなくメカニズムのモデル化
神経変性疾患におけるトランスレーショナルな失敗は、しばしば「良い」動物モデルがないことに起因しているとされてきた(Chesselet and Richter 2011; Pistollato er al)。 この議論にはメリットがある。これらの疾患は人間特有の性質を持っているため、その特徴を十分に再現した動物モデルが登場しても、トランスレーショナルデバイドが解消される可能性は低い。個々の神経変性疾患のための遺伝子操作されたげっ歯類モデルは、典型的には、家族形態の疾患に関連する新しい原因遺伝子(Chesselet and Richter 2011; Ittner er al)。 2015; Puzzo er al)。 2015; Roberson 2012)のそれぞれの発見に続いてきた。その結果、これらの遺伝子は個々の標的をよくモデル化しているが、ヒトにおける関連する臨床表現型のバリエーションや複雑性の再現性は低い。さらに、神経変性疾患は必ずしも臨床的にも機械論的にも明確に分離できるものではなく(Metzler-Baddeley 2007; von Coelln and Shulman 2016)ある神経変性疾患の突然変異を有する遺伝子が別の疾患に再発現する可能性がある(Guerreiro er al)。 最後に、一般的な神経変性疾患に罹患している患者の大多数は、明らかな基礎となる変異を同定することができない散発的な形態の疾患を発症する(Kalinderi et al 2016;Rosenberg et al 2016)。これらは、家族性の形態での遺伝学的発見によって照らされた離散的な細胞メカニズムの複雑な相互作用によって駆動される可能性が高い。
細胞ベースのシステムは、ヒト組織内の基本的なメカニズムを尋問するための有望な手段ではあるが、まだ主流ではない(Mason and Price 2016)。したがって、それらの限界にもかかわらず、我々は今後しばらくの間、我々が持っている動物モデルを使用し続けるだろう。どのようにして改善された結果を得ることができるのであろうか?一つのアプローチは、動物、特に遺伝的に改変されたマウスを、病気のモデルとしてではなく、分子経路や標的のモデルとして考えることである。このアプローチには、複数のメカニズムが相互に作用してヒトの病気を作り出しているという理解が含まれており、これらのメカニズムの寄与度を様々なモデルやアプローチを用いて調べることで、治療の目標を知ることができる。図1には、いくつかの神経変性疾患について、重要な原因遺伝子、その認知細胞メカニズム、およびそれらの主な臨床表現型の関係が示されている。これらの疾患が直面しているトランスレーショナルな課題について、いくつかのコメントが続く。
図1. 神経変性疾患における研究の進んでいる遺伝子とその細胞間相互作用
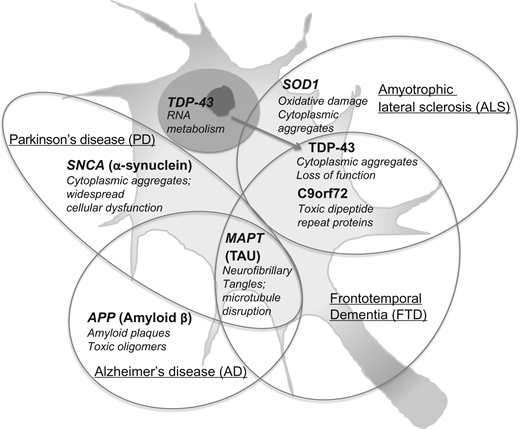
神経変性疾患における研究の進んだ遺伝子とその細胞内相互作用。
主要遺伝子(太字)と特徴的な病態生理過程への関与(斜体)を示す。これらの遺伝子またはそのタンパク質産物と、その発現が重複する可能性のある様々な臨床的実体との関連が、ベン図形式で描かれている。これらの実体に関連する遺伝子の全スペクトルは、Online Mendelian Inheritance in Manのサイト(http://www.omim.org)で見ることができる。認知マウスモデルは、Mouse Genome Informaticsサイト(http://www.informatics.jax.org)に掲載されている。
アミロイドβ
アミロイドβは、膜貫通型タンパク質であるアミロイドβ前駆体タンパク質(APP)に由来し、その正常な機能は不明である。APPのβおよびγセクレターゼによる連続的な切断により、様々なアイソフォームが生成されるが、その中で最も一般的なのはアミロイドβ40とアミロイドβ42である。アミロイドβ42は容易に自己凝集してアミロイド斑(神経細胞外に沈着したアミロイド線維の集合体)を形成する。アミロイドβオリゴマーはアミロイド斑の周囲に蓄積し、TAUの高リン酸化を促進するなどの神経毒性を示す。APPとプレセニリン1と2(PSEN 1,-2)の変異は、家族性アルツハイマー病の攻撃的な形態を引き起こす一方で、アポリポ蛋白E4(APOE4)対立遺伝子のためのホモ接合個体は過剰なアミロイドβを蓄積し、散発性、または遅発性アルツハイマー病になりやすいです(Selkoeとハーディ2016)。
微小管関連タンパク質タウ(MAPTまたはTAU)
TAUタンパク質は、微小管を安定化させることで機能する軸索に優勢に発現している。タウ病(Arendt et al 2016)では、TAUは高リン酸化され、神経細胞内で神経原線維のもつれ(NFT)として蓄積する(ジストロフィー性神経炎としても知られている)。アルツハイマー病では、NFT病理の程度は臨床的疾患の重症度と相関している(Braak er al)。 2006)。
スーパーオキシドジスムターゼ1(SOD1)
SOD1 は、細胞質の銅および亜鉛を含む抗酸化酵素である。病原性SOD1の突然変異は、オリゴマー化および酸化的損傷を介した毒性機能の獲得をもたらす。筋萎縮性側索硬化症(ALS)に典型的な細胞質内包物は、SOD1,ユビキチン、およびTDP-43を含む様々なタンパク質を含む(Saberi et al 2015)。
トランザクティブ応答DNA結合タンパク質(TARDBPまたはTDP-43)
TDP-43は、主に核内に位置するDNAおよびRNA結合タンパク質である。RNAの翻訳、スプライシング、輸送などのRNA代謝に多様な機能を持つ。TDP-43陽性介在物(FTD-TDP)を有するALSおよび前頭側頭葉認知症では、TDP-43はリン酸化され、神経細胞およびグリア細胞質介在物に誤局在化する(Irwin et al 2015)。
染色体9番オープンリーディングフレーム72(C9orf72)
C9orf72ヘキサヌクレオチド反復拡大は、世界的に家族性FTDおよびALSの最も一般的な原因である。C9orf72は機能未知の蛋白質をコードしており、その拡大に起因する神経変性のメカニズムは不明である。後者は、C9orf72タンパク質の損失、または核細胞質輸送を混乱させるジペプチドリピートタンパク質に関連する毒性を介して起こると考えられている(Rohrer et al 2015)。
α-シヌクレイン(SNCA)
α-シヌクレインは、小胞輸送に役割を果たすシナプス前末端に集中している。パーキンソン病(PD)および他のシヌクレイン病におけるα-シヌクレインの凝集は、細胞骨格ダイナミクスの変化、小胞体ストレス、ミトコンドリア毒性、およびシナプス機能の障害を含む、広範囲の潜在的に神経毒性のある影響を誘導する。α-シヌクレインは微小管関連タンパク質タウのフィブリル化を誘導し、シヌクレイン病およびタウ病の臨床的重複を有する(Moussaud er al)。
病因、細胞機構、臨床症候群の種を超えた類似性の高い疾患に対する動物モデルの予測妥当性は良好である。例としては、網膜色素上皮特異的タンパク質65kDa遺伝子の変異によって引き起こされる小児失明の一形態(Leber先天性甘露症;Buch et al 2008)に対する遺伝子治療の開発が挙げられる。病因的に複雑な神経変性疾患におけるこのパラダイムの失敗は、予測の妥当性はモデルの使用方法ではなく、モデルに内在するという仮定にあると思われる。
例えば、パーキンソン病(PD)の対症療法の開発は、比較的高いトランスレーショナルな成功を収めている(Connolly and Lang 2014)。これは、動物およびヒトにおける線条体回路の神経解剖学的特徴付け、および毒素誘発性げっ歯類および非ヒト霊長類モデルの使用に大きく依存している(Jackson-Lewis and Przedborski 2007; Potts er al)。 2014)。運動障害は一時的にコントロールできるが、疾患は進行し、線条体の変性が継続し、レボドパ誘発性ジスキネジアが発現し、最終的には認知症に至る。他の神経変性疾患と同様に、様々な疾患修飾介入を用いた前臨床試験の成功は、臨床への応用には至っていない(AlDakheel er al)。 この原因の一つとして考えられるのは、対症療法の有効性を実証するために使用されたのと全く同じモデル(主に毒性を起源とする)および試験デザインが、神経保護療法の試験に大部分使用されていることである(Zeiss et al 2017)。
アルツハイマー病では、マウスモデルでの広範な成功は、臨床への移行に失敗した(Pistollato et al 2016;Zeiss 2015)。これは2012年に、2つの有望な抗アミロイドβ抗体、バピヌズマブとソランズマブの試験が失敗したことで、アルツハイマー病におけるアミロイド仮説の中心性(Selkoe and Hardy 2016)とそのマウスモデルの価値についての憶測を促したことで、頂点に達した。一見すると、アルツハイマー病治療薬を開発するための努力は、ターゲット駆動型研究方法論の原則に忠実に従っていたのである。最近の報告(Sevigny et al 2016)は、過去の挫折が、アミロイド線維形成の関係、異なる抗アミロイド抗体の薬物動態と薬力学的特性、およびヒトの認知機能低下を正確に反映するアミロイドイメージングモダリティの能力についてのまだ進化していない理解に起因している可能性があることを示している。本研究では、アミロイドβトランスジェニック(Tg2576)マウスの価値は、抗体の結合性(オリゴメラー型およびフィブリル型)と用量依存性の病理組織学的プラーククリアランスを関連付けることであり、その結果、用量依存性のプラーク負担の減少および患者の臨床的衰えの減少に関連する可能性があることを示した。
前頭側頭型認知症(FTD)および筋萎縮性側索硬化症(ALS)は、重複する臨床表現型および遺伝的原因または危険因子によって特徴づけられるスペクトルの一部であると考えられている(Guerreiro et al 2015)。これらの疾患の家族性形態に関連する30以上の遺伝子の変異は、FTD-ALSスペクトルのいずれかの端にある様々な臨床表現型と優先的に分離している。原因となる変異を有する著名な遺伝子には、微小管関連タンパク質タウ(MAPT43 kDaの超活性応答DNA結合タンパク質(TDP-43としても知られている9番染色体オープンリーディングフレーム72(C9orf72およびスーパーオキシドジスムターゼ1(SOD1)などがある。アルツハイマー病およびFTDのモデルにおける病理学的TAUを標的とする試みは(かなり広い範囲のメカニズムを指向した低分子および抗体ベースの治療法を介してヒト試験からの結果はまだ未解決で、前臨床の有望性を示している(Grüninger 2015)。マウスTDP-43モデルでは、広範な神経病理学的および機能的異常が発現している(Roberson 2012);しかしながら、FTLD-ALSに関連する機能的表現型と様々なTDP-43の変化との相関関係は明らかではない。C9orf72に関連したTDP-43病理、神経細胞の喪失、および行動障害は、最近、マウスモデルで実証されたばかりである(Chew er al)。 TDP-43-およびC9orf72関連疾患のマウスモデルが相対的に少ない中で、FTD-ALSスペクトルの前臨床研究は、主にALS関連SOD1変異を有するマウスを利用してきた(Ittner er al)。 2015)。これらの結果は、臨床への移植には成功していない。
還元主義的限界の克服
個々の神経変性疾患に関連する原因遺伝子および感受性遺伝子に加えて、シナプス機能の変化、ミトコンドリア機能不全、酸化ストレス、および炎症などの追加の細胞プロセスが、これらのすべてを複雑にしている(Correia er al)。 2016; Hooten er al)。 2015; Lepeta er al)。 2016)。このようなメカニズムの複雑さを考えると、動物ベースであろうと細胞ベースであろうと、どのような単一のモデルでも、ヒトにおけるこれらの疾患を駆動する相互作用を捉えることができそうにないのは当然のことである。一般化可能性への取り組みを並行して行わなければ、再現性を高めるための研究デザインの改善は、動物実験からより複雑な系への応用は期待できないだろう(van der Worp er al)。 1つのアプローチは、顔、構成要素、および予測妥当性(Chesselet and Richter 2011)の伝統的な理解を、個々のモデルから、ターゲットの潜在的な翻訳可能性を示す実験の本体に移すことである。このようにして、様々なモデル(s)を使用して個々の還元主義的な実験は、一般化可能性を向上させるために組み合わせることができる。
研究デザインは文脈に依存する
動物実験は、治療的介入の手段として特定の細胞メカニズムや標的の可能性を実証するために一般的に用いられている(Shineman er al)。 これらの実験は多くの場合、自然界では探索的または概念実証的なものである傾向がある。トランスレーショナルな観点から見ると、これらの実験の欠点は(統計的デザインに関するよく知られた問題は別として)有効性の説得力のある証拠を提供するために必要とされるヒト疾患の側面の一貫性のないモデル化が含まれている。これらには、介入のタイミング、選択されたアウトカム指標、ターゲットの関与と臨床的に関連性のあるアウトカムの証拠とバイオマーカーの統合が含まれる(Buckholtz et al 2012)。さらに、以前に発表されたアプローチや「よく受け入れられている」モデルは、それ自体が永続する傾向があり、その結果、研究デザインの規範の反響室が形成されている。
研究デザインは実験の目的によって異なる。例えば、ある介入の有効性を実証するには、その介入が対症療法的なものであるか神経保護的なものであるかによって異なるアプローチが必要である。パーキンソン病における対症療法的介入のトランスレーショナルな成功は比較的高い(Connolly and Lang 2014)。この成功の根底にあるのは、ドーパミン作動性細胞の喪失が線条体回路に及ぼす影響を理解していることである。ヒトおよび毒素誘発動物モデルにおける運動徴候は、ドーパミンに支配された間接・直接線条体回路の不平衡と、レボドパによるこれらの事象の悪化に由来する。対症療法的介入はこの調節障害された回路の側面に向けられているため、臨床転帰指標の変化は、介入、標的の関与、および疾患表現型の改善との間の因果関係を実証するのに十分である(Zeiss et al 2017)。さらに、介入が行われる前にパーキンソン表現型を確立すること(NHPsにおける最も一般的なアプローチ;Potts et al 2014)は、患者がすでに有意なドーパミン作動性低下が生じた後に治療されるパーキンソン病の臨床的現実に近似している。
対症的な介入とは対照的に、パーキンソン病に対する疾患修飾的な介入は、効果的な神経保護の追加の重要な側面を評価することが期待され得る。さらに、翻訳的に関連性のある神経保護を説得力をもって実証するためには、ヒトのパーキンソン病に特徴的な比較的後期の介入をモデルとし、メカニズムや神経病理学的データを縦断的な臨床転帰に結びつける研究デザインが望ましい。疾患修飾介入は通常、これらの研究を高等動物に拡大する前にげっ歯類を用いて試験されるが、これは倫理的に適切なアプローチである。しかしながら、若い雄性C57BL/6マウス(その介入が1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン曝露に先行するか、または1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン曝露と一致している;池田 et al 2002)における急性1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジンプロトコル(Anderson et al 2006)を利用した受け入れられたマウスデザインは、トランスレーショナルな成功の最小限の証拠で繰り返し再利用されている。このアプローチは良好な再現性を保証し、疾患過程における所定のメカニズムの関与を実証するのには十分であるかもしれないが、臨床的に関連性のある神経保護の説得力のある証拠を提供するものではない。マウスモデルを用いてヒトの疾患の初期または進行期に対応する段階で介入を試験する傾向は、アルツハイマー病(Zahs and Ashe 2010ALS(Kong et al 2012PD(Zeiss et al 2017)においても指摘されている。
バイオマーカー
バイオマーカーおよび病理組織学的データは、しばしばげっ歯類モデルで収集される。これらのデータが疾患の進行や臨床転帰と相関しない場合(Buckholtz et al 2012年標的の関与と治療効果との間の予測的な関連を作ることはできない。患者におけるアルツハイマー病の進行に特徴的な一連のバイオマーカー異常が提案されているが(Jack er al)。 2010)、治療の文脈におけるこれらのバイオマーカーの予測関係は、ヒトでも動物モデルでも知られていない。アミロイド前駆体タンパク質が駆動するアルツハイマー病の側面については、家族性突然変異のマウスモデルでは、程度の差こそあれ、進行性のプラークともつれの病理、脳脊髄液のバイオマーカーの変化、構造的および機能的な神経画像パターン、認知機能障害が再現されている。このシーケンスの検証はADモデルに対して提案されており(Keene er al 2016)異なる介入の効果を比較するための比較可能なベースラインを提供するであろう。トランスレーショナルな目標を達成するためには、カスタマイズされたアプローチの範囲がまだ必要であろう。この例として、上述のaducanumab試験(Sevigny er al)。 2016)が挙げられる。この試験では、マウスの薬理学的および病理組織学的データがヒトのイメージングデータに重要なリンクを提供したが、臨床的有効性の最終的な実証はヒト試験に委ねられていた。
モデルとメカニズムの多様性
特定の治療メカニズムについては、多面的な細胞プロセスの様々な側面を捉えたモデルで有効性が実証されれば、ヒトへの翻訳の可能性がより高くなる。このパラダイムは、倫理的な理由からヒトでの試験が不可能な場合に製品を承認するためのメカニズムである食品医薬品局動物規則の中心的な役割を果たしている。有効性の証拠は、4つの主な基準を満たす動物試験に依存する(Snoy 2010)。有効性が検証され予測可能な動物モデルがない場合には、ヒトにおける所望の結果に明らかに関連する動物試験の エンドポイントを用いて、複数の動物種にまたがって有効性が証明されなければならない。アルツハイマー病の自発的なげっ歯類および大型動物モデル(Braidy et al 2015)は、ヒトの病気の側面を非常によく再現しているが、これらのモデルでアルツハイマー病をモデル化しようとする試みは、病気の一貫性のない発現、大型種の寿命、および原因と結果の関係を特定するという課題に直面している。マウスモデルの多様性は、疾患のための複数のモデルから得られた洞察は、それぞれの内部妥当性を損なうことなく、ヒトの疾患の複雑さを近似するために組み合わせることができるようなものである。
遺伝的異種化
行動神経科学では、環境と検査手順の異質化は、実験間変動に比べて実験内変動を増加させることで再現性を向上させることが示唆されている(Richter er al)。 概念的に類似したアプローチとして、遺伝子的に異質なヒト個体群を近似させるために外交配されたげっ歯類資源を使用することがある。このアプローチの欠点は、「アウトブリード」と呼ばれる系統は遺伝的多様性が比較的限られていること、種内の異質性は問題の疾患とは無関係である可能性があること、どの遺伝子座が異質な反応に寄与しているかを特定する能力がはるかに困難になることである(Festing, 1999)。ヒトにおける遺伝的異質性を近似するために、8つの創世近交系統からの遺伝的変異のプールを共有するCollaborative Cross and Diversity Outbredマウスを使用して、異種応答の基礎となる遺伝的寄与をマッピングすることができる(Bogue er al)。 2015)。遺伝的異種化はまた、複数の標的遺伝子変化を有するマウスが純粋な背景系統に逆交配されていない研究において、知らず知らずのうちに起こる。アルツハイマー病研究(Yassine et al 2013;Zeiss 2015)で示されているように、不確定な系統背景を持つ集団で行われた介入研究は、マウスにおける介入の有効性を決定するための主要な要素である聴覚、視覚、または認知テストに影響を与えるよく知られた系統関連の突然変異によって混同される。他の例としては、Snca遺伝子の欠失を有するC57Bl/6JOlaHsdマウス(Specht and Schoepfer 2004)や、統合失調症で破壊された変異(Disc1)を有する129由来の系統で見られる(Gómez-Sintes er al)。
合成知識
学術誌に発表された介入研究の大半は、翻訳をサポートするために必要な基準の範囲を探っていない。そのためには、典型的な研究室の範囲を超えたリソースが必要となる(Shineman er al)。 あるいは、複数の動物研究から得られたデータを統合することで、翻訳の可能性を予測できるパターンが明らかになるかもしれない(Ioannidis 2012)。このアプローチは、アニマルルールの基本的な考え方をin silicoで支持するために使用される可能性がある(Snoy 2010)。このアプローチでは有効性が要求されるため、治験薬申請に必要な前臨床データよりも翻訳性の基準が高いと考えられる(Novack 2013)。自動化されたテキストマイニングと統合を容易にするためのいくつかのリソースが存在し(Wei er al 2013,Egan er al 2015)は、アルツハイマー病の動物モデルの介入の転帰を評価するためのオンラインデータベースの開発を記述している。システマティックレビューやメタアナリシスの使用は最近レビューされており(van Luijk er al)。 2014; Vesterinen er al ,2014)ここでは取り上げない。
結論
再生産性の問題は新しい問題ではない。しかし、新しいのは、生物医学研究事業における長年の傾向が経済的に持続不可能であるという認識が広まっていることである(Chalmers er al)。 米国の政府および民間の研究資金は、過去 10 年間で減少している(Moses er al)。 研究資金の増加は切実に必要とされている(Dzau and Fineberg 2015)が、前臨床研究のパターンが定着したままでは、非効率性を永続させるリスクがある。なぜなら、生物医学研究の様々な側面を推進するインセンティブが長年にわたり深く根付いているからである(Begley and Ioannidis 2015)。何ができるか?
動物を用いた研究は、その性質上、探索的研究(概念実証、メカニズム、ターゲットベース)と治療的研究(与えられた治療法の動物からヒトへの翻訳に焦点を当てた研究)がある。どちらも、厳密性と再現性を促進する研究デザイン法に依存する。しかし、治療学的研究で有効性を実証するために必要とされるエビデンスは、探索的研究で必要とされるエビデンスよりもはるかに幅広いものである。個々の実験における厳密さに加えて、治療の可能性を示す説得力のあるエビデンスは、モデルの選択、介入の目的、薬理学的基準、バイオマーカーデータとヒトに臨床的に関連性のある転帰指標との関係を評価しなければならない。これを達成するためには、資金提供機関、規制機関、研究機関、学術誌に情報を提供する優先順位を調整する必要がある。
教育・研究機関は、その性質上、再現不可能性と翻訳の両方に影響を与える要因を認識する文化を醸成するのに最も適している。これにより、臨床医、基礎科学者、応用科学者の知識を統合した学際的研究チームが促進される。実験開始前の統計的支援が重要である。さらに、研究デザインを詳細に評価することは機関の動物管理・利用委員会の権限の範囲内で はないが、動物実験を行う前に、研究者が優れた研究デザインの基本的な概念に精通している ことを示すことを期待するのは不合理ではないだろう。多くの研究機関では、研究者はプロトコルの承認前に、動物の使用や化学物質の安全性に関す るトレーニングを受けている証拠を提出しなければならない。そのためには、研究デザインとトランスレーショナルな問題の理解を促進する教育リソースを広く利用できることが鍵となる。このようなリソースは、Protocol Navigator(http://protocolnavigator.org/)やExperimental Design Assistant(https://eda.nc3rs.org.uk/)のような、実験デザインを支援するために使用できるソフトウェアによって補完されるであろう。
様々な分野の報告ガイドラインや出版チェックリストは増殖しているが(Jarvis and Williams 2016いまだに一貫性がなく適用されていない(Stodden er al)。 この分野での最低基準を確立することは今後も雑誌の領域であり、米国研究評議会の実験動物研究所(NRC 2011)が提案している追加のガイドラインの実施を検討することになるだろう。資金提供機関は、透明性のある報告歴が資金提供者に付随しているかどうか、提案されているトランスレーショナル研究が提案されて いる目標を効果的に達成しているかどうか、動物実験の資金提供の優先順位が概念実証研究か、あるいはより包括的な 治療の可能性を示す研究に向けられるべきかどうかを評価するという、より複雑な課題に直面することになる。助成金や雑誌の査読者は重複する集団を代表しているため、助成機関はこれらの問題について、一般的な基準を超えた視点を求めることが求められている。神経変性研究の分野では、多用され、十分に受け入れられているモデルが広範な前臨床データをもたらしているが、これまでのところ予測的な影響はほとんどないという例がある。なぜこのようなことが起きているのかを理解するには、データに基づいた研究が必要であり、個々の研究分野における一般的なパターンを批判的に評価する必要がある。再現性に影響を与える研究デザインの問題は多くの分野に共通しているが、予測値の向上を支えるモデル使用の特定の側面は分野に特有のものである可能性が高い。公表されたデータを統合して、全体的な治療メカニズムの再現性について偏りのない概観を提供するリソースは、長期的に研究デザインの規範を変更した場合の影響を評価する手段を提供し、資金提供機関や規制機関の意思決定を支援することになるであろう。
プルーフ・オブ・コンセプト研究が細胞ベースのシステムに移行し(Mason and Price 2016動物システムはより遠位のトランスレーショナルな目的のために 用いられることが多くなると考えられる。このような展開は3R(Russell and Burch 1959)に沿ったものであり、前臨床試験での有効性の証拠を説得力を持って立証するために必要な基準を再評価するために、生物医学のすべての主要な面で概念的(そして徐々に)にシフトする必要があるだろう。
