Contents
Feed your gut with caution!
www.ncbi.nlm.nih.gov/pmc/articles/PMC6286027/
要旨
腸管上皮は、腸内細菌やその有害代謝物に対する宿主の防御に重要な役割を果たしている。腸管上皮は、強い生理的ストレスや環境ストレスにさらされても上皮の完全性を維持するために、クリプトの基部に存在する多能性腸管上皮幹細胞によって継続的かつ急速に更新されている。
最近の開高らの研究では、腸管クリプトの構造設計が、腸内細菌叢由来の増殖抑制代謝物から大腸上皮幹・前駆細胞を保護していることが示されている。これらの代謝物の中でも、酪酸は大腸上皮幹・前駆細胞の増殖を最も強力に抑制する代謝物として同定されている。
腸管細胞は酪酸を迅速に代謝することで、さらに代謝バリアを構築し、腸管細胞の再生・修復に必要な幹細胞を保護していることが明らかになった。
キーワード
腸内細菌叢、細菌発酵、酪酸、腸内炎症
序論
哺乳類の腸は、食物由来の抗原、毒素、胆汁酸、消化酵素、そして腸内微生物叢として知られる膨大な数の微生物と接触する最初の細胞タイプとしての役割を果たす上皮の単層で覆われている。環境や生理的ストレス要因への絶え間ない曝露に耐えるために、腸の上皮は特殊な突起や隙間にその構造を組織化している。
「形状は機能に従う」という言葉通り、腸絨毛は消化、栄養吸収、潤滑のためのムチン分泌を促進するために腸球と杯細胞で構成されている。
大腸クリプトは、その反対側の端にある、侵食した形をしていて、その根元には繊細な幹細胞も入っているが、これはおそらく悪条件の腸内環境から隔離するためのものであろう(図1)。しかし、大腸クリプトから遠ざける必要がある正確な化合物、微生物、またはそれらの代謝物は、特性化されたままである。
www.seibutsushi.net/blog/2013/01/1364.html
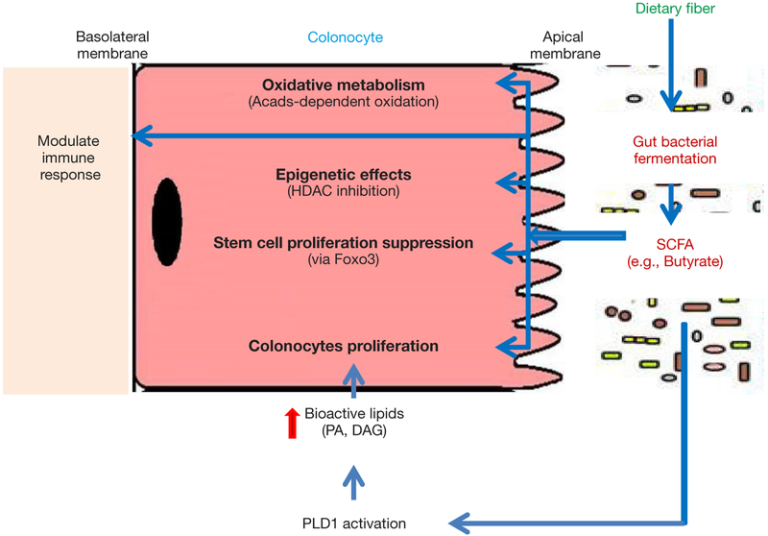
図1 大腸細胞に対する酪酸介在作用のモデル
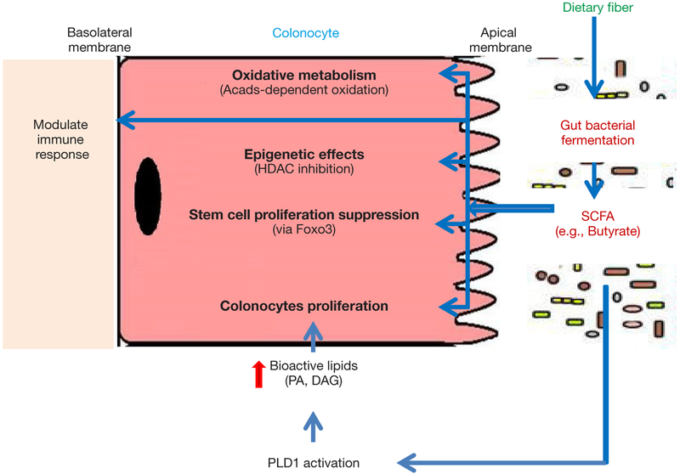
難消化性食物繊維(DF)は、大腸内に存在する微生物群集によって発酵されている。難消化性食物繊維発酵の主要産物である酪酸は、大腸細胞ではAcads依存性の酸化を介して活発に代謝され、エネルギー源として利用されている。また、酪酸塩は、HDAC阻害作用、大腸上皮幹・前駆細胞増殖抑制作用、免疫応答調節作用、PLD1活性化による大腸細胞増殖促進作用、生理活性脂質生成作用などの生物学的作用を示す。
SCFA、短鎖脂肪酸、HDAC、ヒストン脱アセチル化酵素、Acads、アシル-CoA脱水素酵素、Foxo3,フォークヘッドボックスO3,PLD1,ホスホリパーゼD1,PA、ホスファフチン酸、DAG、ジアシルグリセロール。
数字から有害代謝物へ
腸内細菌叢に関する私たちの理解は、ここ数十年の間に、次世代シークエンシングやマルチオミクス技術の出現により、急速に拡大していた。その結果、腸内細菌叢の研究は、「どんな微生物がいるのか」という問いから「微生物は何をしているのか」という問いへと、特に腸の生理機能や宿主全体の代謝に影響を与える微生物の研究へと生産的に移行していた。
Cell誌に発表された研究では、Kaikoら(1)は、腸管幹細胞/前駆細胞の増殖に影響を与える可能性のある微生物代謝物をスクリーニングするための革新的なハイスループットアプローチとして、Cdc25Aプロモーター駆動型ルシフェラーゼレポーターアッセイを採用した。開高らは、スクリーニングした92種類の代謝物のうち、トルイ酸、4-ヒドロキシインドール、インドール3-アセトアミド、チラミン、ピリドキサール、スペルミジン、デオキシコール酸、酪酸の8種類の微生物代謝物候補を同定した。
今回の研究成果は、食物繊維の細菌発酵に由来する酪酸塩が、おそらく最も有害で、クリプト内の幹細胞/前駆細胞の増殖を抑制する力があることを示している。
食物繊維(DF、複合炭水化物)は、主に果物、野菜、穀物から得られる植物食品の難消化性部分である。哺乳類の消化管はDFを代謝することができないが、イヌリンおよびそのオリゴフルクトース誘導体のような可溶性繊維は、腸内微生物によって容易に発酵され、80〜130 mM(2,3)の〜濃度で大量の短鎖脂肪酸(SCFAs; 例えば、酢酸塩、酪酸塩およびプロピオン酸塩)を生成する。
炭素数4のSCFAである酪酸は、細胞の増殖、分化、アポトーシスに対して最も多様で一見矛盾した効果を示しており、これは酪酸パラドックスと呼ばれる現象で、プロまたは抗腫瘍効果を発揮する可能性がある。さらに、その生物学的効果は、曝露部位、曝露レベル、他の代謝基質の利用可能性、細胞内環境などの要因にも影響される可能性がある。
Stappenbeckのグループは、大腸幹細胞に対する酪酸の抑制効果は、このように代謝物への曝露を制限するため、クリプト内の彼らの戦略的な配置によって緩和される可能性があると仮定している。そのメカニズムを解明するために、著者らはゼブラフィッシュを調べた(4)。興味深いことに、ゼブラフィッシュの腸管には酪酸と酪酸産生微生物の両方が存在しないことが明らかになった。開高らは、ゼブラフィッシュに酪酸を投与したところ、ゼブラフィッシュの大腸上皮細胞の増殖が有意に抑制され、著者らの仮説を再確認した。これらの刺激的な知見は、酪酸が幹細胞に到達するのを防ぐクリプトの役割を支持するだけでなく、酪酸産生微生物を保有する動物におけるクリプトの発達の進化的基盤についても新たな絵を描くものである。
場所、場所そして場所
腔内酪酸塩の濃度は、盲腸、DFの最大微生物発酵が発生する「嫌気性バイオリアクター」で最高になる傾向があるが、徐々に離れた場所で減少する。SCFAsは、酪酸産生微生物の不在のために小腸で顕著に最小限に抑えられている。しかし、大腸の風景は完全に微生物とその代謝物の負荷の増加を収容することに加えて、拡張絨毛の欠落している大腸で逆転している。
小腸のクリプトは SCFA の減少したレベルで収容される可能性があるが、どのように大きな腸は酪酸塩からクリプトを保護するのであろうか?興味深いことに、開高らは、“クリプトガード “としての結腸細胞が急速に利用し、酪酸を枯渇させる代謝機械が装備されていることを明らかにし、このように保護の追加の層を提供する。13C標識酪酸の大腸投与を用いて、著者らは、酪酸の大部分が最大限にクリプトの上部にある結腸細胞によって吸収されることを実証した。さらに、アシル-CoAデヒドロゲナーゼ(Acads;酪酸をアセチル-CoAに変換する重要な酵素)の遺伝子欠損により、大腸細胞が酪酸を代謝できなかったマウスでは、クリプト幹細胞の増殖能力が確かに減衰し、酪酸によって阻害されることが確認された。
酪酸に依存する、または依存しないようにするには
主な酪酸生産者は、ほとんどが酪酸-CoAトランスフェラーゼを発現するFirmicutes属(例:Clostridium spp.、Roseburia spp.、Eubacterium spp.、Faecalibacterium prausnitzii)に属する。しかし、ゼブラフィッシュではそれらが存在しないことから、ゼブラフィッシュの腸は高い上皮回転率を示していたにもかかわらず、一般的に酪酸生産者はゼブラフィッシュにとっては使い物にならないことが示唆されている。逆に、酪酸は哺乳類の大腸上皮細胞にとって不可欠で主要な(70%以上を占める)エネルギー源であるという考え方は、十分に受け入れられている(5)。哺乳類の結腸上皮細胞が酪酸に依存せずに多くの大きな臓器を十分に支えることができるのに、微生物産物に依存しなければならないのはむしろ珍しいことである。Kaikoらの研究は、大腸細胞による酪酸の利用が必ずしも単純な栄養要求を反映しているのではなく、むしろ代謝の陥没穴として反映されている可能性があるという見通しを支持している。
酪酸を利用することを選択することによって、大腸細胞は2つの潜在的な利点を得た可能性がある。
- このようにクリプトの洪水からそれを防ぐために酪酸を枯渇させ、
- より貴重なエネルギー商品(すなわち、グルコース)を排出しないようにする。
しかし、これらの仮説は、生殖細胞を持たないマウスを用いてさらに検証する必要があるかもしれない。偶然かデザインかにかかわらず、大腸細胞による酪酸の利用は、宿主と腸内細菌が共存する状態にまで進化したことを示す興味深い例であることは間違いない。
そうであっても、特定の細菌群の減少と病理学的条件を結びつける根拠を再検討することが重要かもしれない。炎症性腸疾患(IBD)患者の腸内の主要な酪酸産生菌が激減していることは、多くの研究で報告されている(6-9)。酪酸生産者の減少は腸内環境異常の特徴であるが、このような変化が腸内環境異常の原因なのか結果なのか、それとも自然現象であり、それ以上の介入を必要としないのかは不明である。多くの人は、このような微生物の変化は有害であると考えており、潜在的な治療法としてプロバイオティクスやプレバイオティクスのアプローチを提唱している。しかし、酪酸生産者の喪失は、腸が腔内酪酸を許容するための最良の状態ではないかもしれない病気の宿主にとって実際に有益であるかもしれないことは、必然的な結論ではない。
酪酸塩で腸に燃料を供給する:有益または炎症性のハザード
開高らは、IBDにおける酪酸の影響を調べるために、マウスにデキストラン硫酸ナトリウム(Dextran Sodium sulfate; 化学的コリトゲン)を投与して大腸潰瘍を誘発し、その結果、幹細胞を腔内酪酸に曝露した。幹細胞の活性の抑制は、大腸炎の間に有害である可能性がある。実際、DSS処理マウスでは幹細胞の増殖が抑制され、潰瘍化の悪化と創傷の修復の遅れを伴う。興味深いことに、酪酸産生細菌(BPB)を選択的に死滅させるメトロニダゾールの投与により、DSSによって誘発された大腸潰瘍は改善されたが、酪酸の外因性投与やBPBを含む糞便移植は大腸炎の表現型を再燃させた。これらの観察結果は、腸の健康に対する酪酸塩の悪影響を示すだけでなく、IBD患者に有害な影響を与える可能性があることを示唆している。
スタッペンベックグループの研究と同様に、Zhangらもまた、黄砂誘発性大腸炎のマウスにおけるBPBの好ましくない効果を検討した(10)。ヒト由来のBPB株Anererostipes hadrusを投与すると、健康なマウスでは腔内酪酸のレベルが上昇することが示されたが、大腸炎マウスでは上昇しなかった。A. hadrusを投与されたDSS処理マウスでは、代わりに大腸炎が悪化したことが示された(10)。この考え方は、水溶性食物繊維イヌリンの補給により、IBDを起こしやすいインターロイキン(IL)-10欠損マウスでは炎症性遺伝子の大腸発現が増加したが、野生型マウスでは増加しなかったという別の研究でも支持されている(11)。酪酸を含む腸内細菌由来の代謝物が大腸の炎症に関与している可能性や、腸内環境異常マウスが発症性大腸炎になりやすい理由を説明する可能性がある(12-14)が、この推測はさらに検討が必要である。
これらの研究は、食物繊維の微生物発酵によって生成される代謝物は、IBDを含むすべての状態において腸の健康に「有益」であるというこれまでの概念を覆すものである。開高らが示したように、健康な大腸細胞は、TCAサイクルや脂質代謝などの代謝酵素を備えており、酸素消費率(酸化的リン酸化の指標)と細胞外酸性化率(解糖の指標)の比率が高いことが知られている。
これにより、大腸細胞は酪酸を急速に酸化し、幹細胞・前駆細胞を保護する代謝バリアを形成する。しかし、大腸細胞数が大幅に減少しているIBDでは、酪酸などの微生物代謝物が上皮の修復や創傷治癒を遅らせることで病態を悪化させる可能性がある。
これらの主張は、過敏性腸症候群患者の食事から発酵性オリゴ糖、二糖類、単糖類およびポリオール(別名FODMAP)を排除する現在の慣行と一致している(15)。したがって、IBD患者の中には、食物繊維を多く含む食事を摂るとIBD発作を起こす人がいることは驚くべきことではない。実際、IBD患者では、健常者の90%以上が耐容性のある量の食物繊維を摂取しても、しばしば腸の副作用が現れることがある(16)。それは、それが正常な腸でよく耐えられているときにSCFAsが有益であるかもしれないが、過剰になったり、機能不全の腸でうまく処理されていないときに有害になったことを考えると、ストレッチの多くはないように思われる。
酪酸パラドックスを解読する
SCFAsとその可溶性繊維前駆体が有益であるか有害であるかの論争は、多くの議論の対象となっている。このような論争は、酪酸がヒストン脱アセチル化酵素(HDAC)の強力な阻害剤であることが確立されて間もない1980年代にまで遡ることができる(17,18)。酪酸のエピジェネティック修飾特性の研究が進むにつれ、大腸細胞の増殖、分化、アポトーシスに関して、酪酸が健康な大腸細胞と癌性大腸細胞に相反する影響を与えることが明らかになった(19)。何十年にもわたって研究が続けられた後も、「酪酸パラドックス」の解決にはほど遠いが、代わりに酪酸、SCFAs、DFの相反する腸内および腸外効果に関する報告により、さらに複雑になっている。注目すべきは、以前の研究では、大腸の炎症(20-24)を抑制する上でSCFAsの有益な特性を実証している、満腹感(25)を改善し、肝性脂肪形成と脂肪率(26-28)を減少させる。まだフリップ側では、より多くの研究は、イヌリン(29)だけでなく、経口酪酸(30)は、結腸上皮の変換を燃料とし、大腸癌(29)を引き起こすことを解明し始めた、SCFAsは、大腸の炎症(10,31)を悪化させ、尿道炎と水腎症(32)を誘導し、肝性リポジェネシス(33)と過嚥下(34)を悪化させることにより、肥満を促進する。
エピジェネティックな効果に加えて、酪酸塩のもう一つの潜在的な生理活性は、細胞増殖を促進することである。酪酸は、腸管上皮におけるホスホリパーゼD1(PLD1)をアップレギュレートすることが知られている(35)。PLD1は細胞膜の主要なリン脂質であるホスファチジルコリン(PC)のホスホジエステル結合を加水分解し、ホスファチジン酸(PA)とコリンを生成し、膜輸送/膜融合に関与する(36)。さらに、PAはジアシルグリセロール(DAG)リゾホスファチジン酸(LPA)環状ホスファチジン酸(CPA)などの生理活性脂質に変換することができる(37)。これらの生理活性脂質は強力なセカンドメッセンジャー/ミトゲンであり、細胞の増殖、遊走、浸潤を促進する。
Kaikoらの研究は、HDAC阻害剤(38)および潜在的に有害なエピジェネティック修飾代謝物としての酪酸の効力についてのもう一つの重要な証拠を提供している。これまでの報告と同様に、著者らは、幹/前駆細胞における核HDACの活性を酪酸が直接阻害し、ヒストンH3K27とH3K9の両方の部位でアセチル化を増加させることを発見した。このメカニズムは、ゼブラフィッシュの上皮増殖を抑制するパン-HDAC阻害剤トリコスタチンAを用いることでさらに確認された。ゲノムワイドクロマチン免疫沈降シーケンシング(Chip-seq)を用いた詳細なメカニズム解析により、酪酸による幹・前駆細胞の増殖抑制は、細胞周期遺伝子を制御する転写因子Foxo3を介して媒介されていることが明らかになった。大腸の幹・前駆細胞において、Foxo3 を薬理学的に阻害し、遺伝子的にアブレーションすると酪酸の効果が逆転することから、Foxo3 は酪酸が媒介する細胞増殖効果のマスター・レギュレーターであることが明らかになった。
興味深いことに、酪酸の抗増殖作用は用量依存的であり、1mMでは可逆的であるが、3-10mMではプロアポトーシスになることがKaikoらによって観察された。このことは、おそらく曝露量と大腸微小環境(例えば、細胞型、クリプト生理学)が酪酸塩の抗またはプロ発がん性および炎症性の効果の不一致の根底にあるかもしれないという新たな仮説をさらに支持している[39でレビューされているように]。実際、マウスの大腸の近位、内側および遠位セグメントの内腔のレベルがそれぞれ3.5,0.8および0.5 mMであるのと比較すると、酪酸のレベルは、大腸のクリプト(50〜800μM)でははるかに低いです(40)。酪酸代謝結腸細胞によって部分的に確立されているクリプトの上部から基部への減少する酪酸勾配は、幹細胞によって許容されるレベルに酪酸曝露の程度を減らすためのメカニズムとして認識することができる。地下室の底部にある酪酸のレベルを測定し、そこにある酪酸のレベルが低下しても幹細胞・前駆細胞の増殖を抑制できるかどうかを調べてみるのも面白いと思う。
酪酸の腸内健康への影響は、HDACの活性を阻害することによってもたらされると考えるのが妥当である。この考え方は、Alenghatら(41)の研究で例証されている。マウスのエピゲノム修飾酵素ヒストンHDAC-3の腸内特異的欠失は、腸管バリア機能の低下、抗菌防御遺伝子の腸内発現の低下をもたらし、最終的には腸の損傷や炎症に対する感受性を増加させたことを示している。同様に、腸内の酪酸塩を慢性的に持続的に曝露すると、結腸細胞のHDAC活性が鈍くなり、IBD発症のリスクを高める可能性があると主張することもできる。
しかし、今後の研究では、酪酸塩の有益な効果と有害な効果を決定づける要因(用量、腸内生理、腸内細菌叢の異常)を評価することで、この分野の研究にさらなる知見を与えることが期待される。今後の研究では、酪酸塩の長期暴露が腸管上皮細胞におけるHDAC活性を低下させるかどうかについても調査すべきである。
プレバイオティクスとプロバイオティクスの再評価:使用するか、使用しないか
健康的な腸機能を改善し、全身疾患を予防するために、食事を通じてヒトの大腸マイクロバイオータを操作することは長期的な目標であり、実際に、食事による複合炭水化物の摂取は、腸内マイクロバイオータの構成とその代謝出力に大きな影響を与えることが示されている。腸の健康と個人の幸福との関連性についての認識の高まりにより、栄養補助食品としてのプレバイオティクスおよびプロバイオティクスの使用は、米国およびヨーロッパ諸国でますます普及してきている。研究者や栄養補助食品業界は、腸内でより多くのSCFAを産生することができるSCFAを豊富に含むプレバイオティクスやプロバイオティクスの開発に熱心に取り組んでいる。今日では、いくつかのプロバイオティクス製剤が商業的に利用可能である;特にそれらは、腸内でのSCFA産生、例えばビフィズス菌を支持する(42)。しかし、それらが腸内で目標を達成するかどうかはまだ不明である。抗生物質を服用している患者にプロバイオティクスを使用することで、腸内微生物群集を大幅に減少させることができ、安定した緩和効果が得られるが、健康な被験者への効果については、網羅的な評価が必要である。
おそらく、「人の肉は人の毒」ということわざは、食物繊維、SCFAs、酪酸にも当てはまるのではないであろうか。健康な宿主であっても有益なプロバイオティクスは、腸の炎症を持つ個人のサブセットで侵入病原体になる可能性があることを警告する増加している報告がある(43)。
例えば、ビフィズス菌と乳酸菌株を含むプロバイオティクス製剤の使用は、重度の急性膵炎が予測される患者コホートにおいて、より高い死亡率と関連している。
さらに、広く受け入れられているプロバイオティクスであるラクトバチルス属菌は、他の日和見菌と同様に、病原体となり、免疫不全患者(44)および腸疾患を有する患者(44,45)において感染症を引き起こす可能性がある。
疾患状態の間のプロバイオティクスの健康効果について利用可能な臨床試験データの数が非常に限られていることを考えると[すなわち、IBD、腸内細菌異常症、小腸細菌過剰増殖(SIBO)]、したがって、それらを処方する前にプレバイオティクスとプロバイオティクスの長期的な健康効果を決定することが重要である。
今後の展望
本研究では、健康な大腸細胞に対する酪酸のポジティブな効果の一部は、その代謝バリアとしての作用に起因していることを示唆している。
ヒトと動物の両方の研究から、酪酸塩の投与が健康な大腸を促進することが示唆されているが、これは必ずしも酪酸塩の有益な健康効果によるものではなく、微生物代謝物の存在に対する体の反応の結果である可能性がある。
宿主の健康に対する腸内微生物の影響の多くは、腸内微生物産物(例えば、リポ多糖類、フラジェリン)や、SCFAs、分岐鎖脂肪酸(BCFAs)乳酸塩、エタノール、コハク酸、α-ケト酸、硫黄化合物などの腸内微生物由来の代謝物を伴っており、これらは腸内および腸外の健康を調節する役割をさらに果たしている。
今後の研究では、「虫から薬へ」というコンセプトを実現するために、これらの代謝物が哺乳類の生理機能に及ぼす影響(特に長期暴露時の影響)を広範囲に調べる必要がある。