Contents
Fasting activates macroautophagy in neurons of Alzheimer’s disease mouse model but is insufficient to degrade amyloid-beta
要旨
我々は、脳内のマクロオートファジーを生体内で観察する新しい手法を開発し、絶食により神経細胞にマクロオートファジーが誘導されるかどうか、またその誘導がADモデルマウスと対照マウスでどのように異なるかを調べた。EGFP-LC3用レンチウイルスを脳内に注入したところ、生きた神経細胞内のオートファゴソームを2光子顕微鏡で可視化することに成功した。タイムラプスイメージングの結果、空腹時には神経細胞内のオートファゴソームの数、大きさ、シグナル強度が増加することが明らかになった。ADモデルマウスでは、オートファゴソームのこれらのパラメータは、飢餓前の基底レベルで高く、ファスティングによってコントロールマウスよりも急速に増加した。しかし、外因性標識アミロイドβの代謝を評価したところ、空腹時に細胞外からの取り込みが亢進して増加した細胞内アミロイドβを分解するには、マクロオートファジーの活性化が不十分であることが示唆された。また、通常の免疫組織化学では、空腹時には内因性アミロイドβの細胞内蓄積が増加し、細胞機能障害を誘発するが、細胞外アミロイドβ蓄積はほとんど減少しないことが明らかになった。さらに、マクロオートファジーの基底レベルの概日リズムを予想外に発見した。これらの結果は、正常/アルツハイマー病状態における神経細胞のオートファジーの新たな側面を明らかにし、我々の手法が生体内でのオートファジー機能を評価する上で有用であることを示している。
オートファジー、特にオートファゴソームを介したマクロオートファジーは、アルツハイマー病を含む様々な神経変性疾患に関与していると考えられている。死後のヒトAD脳の超微細構造解析では、ジストロフィー性神経突起にオートファゴソームが増加していることが明らかになった1。また、マクロオートファジーは、細胞質内でのアミロイドβ(アミロイドβ)の生成経路であることが示唆された2。一方、オートファジー関連遺伝子はアルツハイマー病患者の剖検脳で誘導され3,オートファゴソームはアルツハイマー病のアミロイドβだけでなく、パーキンソン病や前頭側頭葉変性症の剖検脳でもa-シヌクレインやタウ凝集と共局在化しており4,疾患タンパク質のミスフォールディングが一般的にオートファジーを誘導している可能性が示唆された。
神経変性疾患の中には、オートファジーとより直接的な関係を持つものもある5。家族性パーキンソン病の原因タンパク質であるPARK2/ParkinやPARK6/PINK1は、機能的に異常なミトコンドリアの指標として作用し、マイトファジーを誘導する6,7,8,9。遺伝性痙性片麻痺15型は、オートファゴソームの成熟を促進するSPG15遺伝子の変異と関連している10。選択的オートファジーのためのアダプタータンパク質p62の変異は、筋萎縮性側索硬化症(ALS)11と関連している。
水島、大隅らの先駆的な研究では、LC3-GFP トランスジェニックマウスを用いた栄養飢餓後のオートファジーの生体内試験解析が行われている12が、固定化後の脳組織ではマクロオートファジーの誘導は検出されなかった。一方、その後、mTORの阻害によりオートファジーが誘導され、ポリグルタミン病の病態が改善されたことが報告されている13。また、神経細胞のオートファジー応答は条件付きである可能性がある14。誘導性オートファジーとは対照的に、構成性オートファジーはユビキチン化したタンパク質のクリアランスを介して生体内の神経細胞を神経変性から守るために確立されている15,16。この矛盾は、生体内試験の問題を解決するために、生きたニューロンを観察する新しい手法による更なる解析が待たれている。
研究成果
二光子顕微鏡を用いた生きた動物の脳におけるマクロオートファジーの新しい生体内試験イメージング
脳内の生きた神経細胞のオートファジー液胞を可視化するために、EGFP-LC3を発現するレンチウイルスベクターを作製した。5μlのレンチウイルスベクター(力価5.0×106ベクターゲノム/ml)を、後頭蓋異顆粒皮質(RSD)または小脳皮質に注入した。注入から 20日後、マウスを2光子顕微鏡(FV10000MPE2,オリンパス、日本)を用いて、方法に記載されているように薄頭蓋骨法で調べた。両領域において、クラスター化したEGFP陽性小胞と分散した微細なEGFP陽性ドットが観察された(図1a)。特に小脳皮質では、強度の高い小胞が直径10~20μmの狭い領域にクラスター化しており、プルキンエ細胞が単層に並んだ細胞体に対応していることが示唆された(図1a、補足図1)。小脳の再構成画像では、EGFP-LC3小胞もプルキンエ細胞の主樹状突起に整列していた(図1a、補足図1)。
図1 神経細胞におけるマクロオートファジーの生体内試験イメージング
(a)EGFP-LC3レンチウイルスを生後3ヶ月の野生型マウス(C57BL/6 x SJL)の小脳皮質(左パネル)と後頭葉異顆粒皮質(RSD、右パネル)に感染させた。20日後、EGFP-LC3シグナルを2光子顕微鏡で直接観察した。EGFP陽性小胞は、細胞内のオートファゴソームのように集団で分布していた。(b) EGFP-LC3レンチウイルスを注射した野生型マウスの脳組織を抗NeuN抗体とGFAP抗体で免疫染色した。EGFP-LC3小胞はNeuN陽性の神経細胞核を取り囲んでおり(黄色矢印)神経細胞内のオートファゴソームであることが示唆された。このようなEGFP-LC3の分布はGFAP陽性アストロサイトでは見られなかった(白矢印)ことから、ほとんどのEGFP-LC3小胞はニューロンに位置していることが示唆された。EGFP-LC3は、これらの実験では免疫染色を行わずに直接観察された。(c) AAV-EGFPを注入した野生型マウスと5x家族性ADマウスの3ヶ月後のRSD領域の2光子顕微鏡観察。マウスの遺伝子型はいずれも細胞内でEGFPの均一なシグナルを示し、EGFP-LC3シグナルの特異性を裏付けている。(d) 3ヶ月後の5x家族性ADマウスのRSD領域におけるEGFP-LC3小胞の一部とLAMP2Aのコロケーション。
EGFP-LC3小胞のそのようなクラスターが実際にプルキンエ細胞の細胞体に対応していることを確認するために、赤色蛍光タンパク質を発現する二重トランスジェニックマウス(loxP-flanked STOP cassette Td Tomato x Ptf1a-promoter-Cre)を使用した(The Jackson Laboratory、B6. Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J,007914)を小脳のGABA作動性プルキンエ細胞に発現させた17。感染したレンチウイルスベクターは、実際に顆粒細胞の一部であるプルキンエ細胞ではEGFP-LC3タンパク質を発現したが、分子細胞層のTdTomato陽性GABA神経細胞では発現しなかった(補足図2)。大脳皮質ニューロンにおけるEGFP-LC3の発現を確認するために、抗NeuN抗体またはGFAP抗体を用いて免疫組織化学を行い、非染色のネイティブEGFP-LC3と細胞特異的マーカーとの共局在性を調べた(図1b)。その結果、EGFP-LC3小胞/ドットはNeuN陽性ニューロンに分布していることが明らかになった(図1b)。また、GFAP陽性のアストロサイトもEGFP-LC3陽性のドットを持っている可能性があるが、神経細胞のEGFP-LC3小胞と比較するとシグナルは弱い(図1b)。
一方、AAV-EGFPを感染させると、EGFPの細胞内シグナルが拡散的に発生した(図1c)ことから、EGFP-LC3小胞は報告されているようなEGFPの人工的な自己集合体ではないことが示唆された18。さらに、共焦点顕微鏡観察により、脳組織においてEGFP-LC3小胞の一部がリソソームマーカーであるLAMP2Aと共染色されていることを発見し、これらのEGFP-LC3小胞が実際にリソソームと融合していることを示唆した(図1d)。
神経細胞における飢餓依存性マクロオートファジーの誘導と概日リズム
これらの結果から、EGFP-LC3 の 2 光子顕微鏡観察がマクロオートファジーの評価に有用であることが裏付けられたことから、この手法を応用して、生後 3 ヶ月で アミロイドβ沈着を最初に示す最も重篤なマウス アルツハイマー病 モデルの一つである 5x家族性アルツハイマー病 マウスと、バックグラウンドマウスである C57BL/6 x SJL との間で、空腹時処理が神経細胞のマクロオートファジーを誘導するかどうか、オートファジー応答がどのように異なるかという疑問に答えることにした(図 2)。まず、空腹時処理による体重および血糖値への影響を調べたところ、これらのパラメータにおいて、5x家族性ADマウスとバックグラウンドマウスは空腹時処理に対して同様の反応を示すことが確認された(補足図3)。本実験では、EGFP-LC3レンチウイルスを注入してから 20日後に、マウスを絶食させ、水のみを48時間供給した(図2a)。絶食中の0,6,12,24,48時間の時間点で2光子顕微鏡観察を行った(図2a)。血管をマーカーとして、観察位置を厳密に管理した(補足図4)。
図2 ADモデルマウスとコントロールマウスにおけるオートファゴソームの生体内試験イメージング
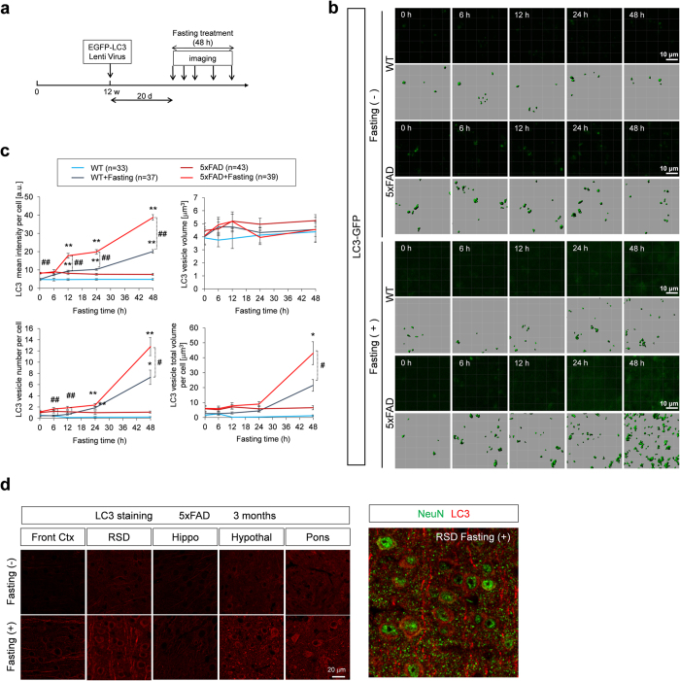
(a) オートファゴソーム形成に対する絶食の効果を試験するための生体内試験タイムラプスイメージングの実験プロトコル。(b) EGFP-LC3小胞のタイムラプスイメージングを、ADモデルマウスとコントロールマウスの同様の領域で、3ヶ月間の絶食の有無にかかわらず実施した。信号強度は、5x家族性ADマウスの方が絶食前のコントロールマウスよりも高かった。絶食は両遺伝子型でシグナル強度の増加を誘導したが、5x家族性ADマウスではその誘導がより顕著であった。c)絶食の有無にかかわらず、EGFP-LC3小胞の経時変化の定量分析。細胞あたりの平均シグナル強度、細胞あたりの平均小胞数、細胞あたりの平均小胞体積では、コントロールマウスよりも5x家族性ADマウスの方が高い値を示した。また、これらの値の中には、コントロールマウスよりも5x家族性ADマウスの方が顕著に増加しているものもあった。小胞の平均体積はそれほど顕著な変化はなかった。平均+/- SEを示す。または###はWT+Fasting群と5x家族性アルツハイマー病+Fasting群の有意差を示す。* または**は、同一遺伝子型での絶食(+)群と絶食(-)群の有意差を示す。#p < 0.05; ##p < 0.01; *p < 0.05; **p < 0.01 二元配置ANOVAに続くポストホックTukeyの検定で。d)様々な脳領域のLC3染色は、絶食治療は一般的にマクロオートファゴソームを増加させたことを明らかにした。
絶食の効果を分析する前に、我々はそれが以前に調査されていなかったので、オートファゴソームの形成が概日リズム(補足図5)を持っているかどうかをテストする必要があった。意外なことに、脳のライブイメージングを行ったところ、EGFP-LC3小胞の細胞あたりの数、体積、シグナル強度が概日リズムのパターンで変化していることがわかった(補足図5)。すべてのパラメータは日中(明)に増加し、夜間(暗)に減少した。しかし、興味深いことに、マウスがあまり食事をしない午後 4 時頃からパラメータが減少し始めたことから(補足図 5)サーカディアンリズム遺伝子が摂食行動とは無関係にオートファゴソーム形成に影響を与えている可能性が示唆された。しかし、サーカディアンリズム遺伝子が摂食行動を介してオートファゴソーム形成に影響を与えているのか、それとも摂食行動を介していないのかは未解決の問題であり、今後の検討が必要である。
そこで、我々は、オートファゴソームの絶食処理に対する応答を評価するために、厳密に同じ時間帯に観察を開始した(図2a,b)。つの光子顕微鏡像(100μm×100μm×100μm体積)を4群のマウスから得た。EGFP-LC3小胞の数、シグナル強度および体積を定量し、それらの平均およびSDを計算した(図2c)。5x家族性アルツハイマー病絶食マウス、5x家族性アルツハイマー病非絶食マウス、Wt絶食マウス、Wt非絶食マウスの各群で5匹以上のマウスを解析した(図2c)。これらのパラメータを取得するための詳細な方法は、方法に記載されていた。タイムラプスライブイメージングにより、EGFP-LC3小胞の基底レベルは、細胞あたりの小胞の数、強度、および総体積では5x家族性ADマウスの方が高かったが、パンククタの平均サイズではなかったことが明らかになった(図2c)。また、これらの値を各マウス群の基準値で補正したところ、増加率も5x家族性ADマウスの方が高かった(図2c)。
また、空腹時処理後の5x家族性ADマウスの死後脳を用いて、内因性LC3小胞を検出する通常の免疫組織学的手法を用いた。この解析では、内在性LC3の検出感度はAAV-EGFP-LC3よりもはるかに低く、マクロオートファゴソームの数を厳密に評価することは困難であった。しかし、LC3シグナルの結果からは、空腹時にマクロオートファゴソームが誘導されていることが示唆され、脳の複数の領域で全般的に観察された(図2d)。
飢餓誘発マクロオートファジーが細胞外および細胞内アミロイドβ蓄積に及ぼす影響
最後に、プレセニリン-1 の アルツハイマー病-asscociated mutation がオートリソソームの酸性化とカテプシンの活性化に障害を与え、オートファジーの進行を阻害することが報告されていたので、オートファゴソームに誘導されたオートファゴソームが本当に アミロイドβの分解に有効かどうかを検証した19。このようなマクロオートファジーの機能不全は、5x家族性ADマウスでも起こる可能性があり、リソソームと融合した後のオートファゴソーム内の基質の分解を阻害する可能性がある。この目的のために、TAMRAで標識したアミロイドβをヒト前楔前野に相当する脳領域である後頭葉異顆粒皮質(RSD)に注入し、注入後24時間から2日間のアミロイドβの動態をタイムラプスイメージングで観察した(図3a)。この実験は、デフォルトモード神経回路網を構成する脳領域の過活動化ニューロンからのアミロイドβの過剰分泌を模倣している可能性がある。
図3 大脳皮質ニューロンによるアミロイドβのエンドサイトーシスとオートファゴソーム依存性分解
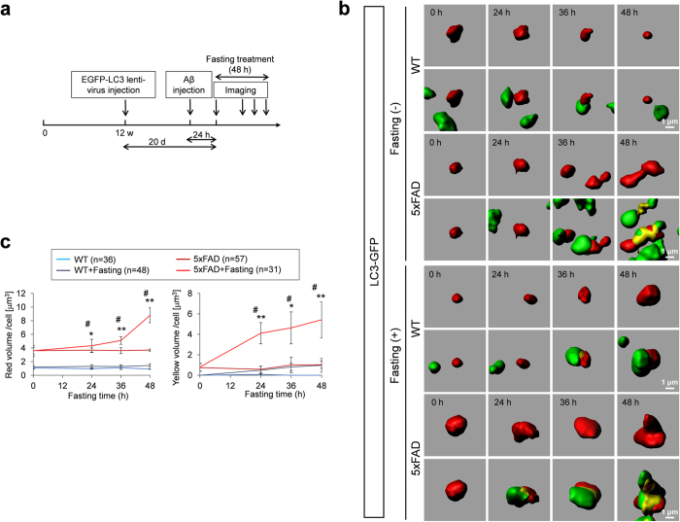
(a) 大脳皮質ニューロンにおけるアミロイドβの取り込みと分解を調べるための時系列生体内試験イメージングの実験プロトコルを示す。(b) TAMRA-β-アミロイド注入後24(0)、48(24)、60(36)、72(48)時間後のTAMRA-β-アミロイド(上段)とTAMRA-β-アミロイド+EGFP-LC3小胞(下段)のタイムラプスイメージング。エンドソーム(赤)とオートファゴソーム(緑)の相互作用が時系列的に観察された。(c) エンドソーム(TAMRA-β-アミロイド陽性小胞、左グラフ)と二次リソソーム(TAMRA-β-アミロイドとEGFP-LC3二重陽性小胞、右グラフ)の経時変化の定量的解析を絶食の有無に関わらず行った。細胞あたりの体積を算出した。または###はWT+ファスティング群と5x家族性アルツハイマー病+ファスティング群の有意差を示す。* または**は、同一遺伝子型での絶食(+)群と絶食(-)群の間に有意差を示す。#p < 0.05; ##p < 0.01; *p < 0.05; **p < 0.01 二元配置ANOVAに続くポストホックTukeyの検定で。(d) 空腹時または空腹時の5x家族性ADマウスの抗LC3抗体で染色すると、脳の様々な領域でオートファジーが増加したことが明らかになった。
まず、注入したアミロイドβが注入後24時間以内に神経細胞に取り込まれることを発見した(図3b)。重要なことは、5x家族性ADマウスでは神経細胞内のアミロイドβ(赤小胞)の量が明らかに多くなっていることである(図3b,c)。細胞内アミロイドβの増加は、エンドサイトーシスによる細胞外アミロイドβの取り込みの増加によって説明できた。また、エンドソームとオートファゴソームの融合小胞である二次リソソームを反映した細胞あたりの黄色小胞量20を解析したところ、空腹時には二次リソソーム量が増加しているのに対し、アミロイドβは未分解のままであることが明らかになった(図3c)。このようなアミロイドβを含む「残存体」20の増加は、野生型マウスでも5x家族性ADマウスでも観察されたが、その程度は5x家族性ADマウスの方が顕著であった(図3c)。
絶食による脳内アミロイドβ蓄積の各部位への影響を比較するために、5x家族性ADマウスの3ヶ月固定後の脳サンプルを病理学的段階を利用した方法を採用した。この場合、外因性アミロイドβ-TAMRAではなく、5x家族性ADマウスの内因性アミロイドβの蓄積に絶食の効果が見られた。抗アミロイドβ抗体を用いたDABおよび蛍光免疫染色により、大部分の脳領域において、5x家族性ADマウスの非絶食群と絶食群との間で細胞外アミロイドβ蓄積に有意な差は認められなかった(図4a,b)。しかし、5x家族性ADマウスの絶食群では、視覚野で細胞外アミロイドβ蓄積量が減少する傾向が見られた(図4c)。
図4 絶食処理は細胞外アミロイドβ蓄積に影響を与えない
(a) 5x家族性ADマウスの3ヶ月間の絶食有無にかかわらず、脳の各部位におけるアミロイドβの画像。抗体反応の可視化にはDABサテンを用いた。すべての脳領域において、空腹時(-)群と空腹時(+)群との間で、細胞内および細胞外のアミロイドβ蓄積に明らかな差は認められなかった。RSD, retrosplenial dysgranular cortex; FC, frontal cortex; LSV, ventral part of lateral septal nucleus; VM, ventromedial thalamic nucleus; PnC, caudal pontine reticular nucleus; OB, olfactory bulb; Sub, subiculum; CA1, hippocampus CA1. CA2, 海馬CA2; CA3, 海馬CA3; DG, 歯状回; Cbm, 小脳 (b) 5x家族性ADマウスの3ヶ月間の空腹時と空腹時の脳の各部位における蛍光二次抗体で可視化したアミロイドβの画像。細胞内および細胞外のアミロイドβ蓄積量は、全脳領域で絶食(-)群と絶食(+)群では明らかな差は認められなかった。(c)矢状切片のDAB染色により、細胞外アミロイドβ蓄積は視覚野で減少していることが明らかになった(矢印)。
細胞内アミロイドβ蓄積は、以前に報告したように脳の異なる領域でも確認されている21。また、細胞内アミロイドβ蓄積は、神経細胞核のDAPIやNeuN染色のぼやけやフェードアウトを伴うことが観察された(図5a,b)。実際、細胞内アミロイドβ凝集体から細胞外アミロイドβ凝集体への進行(図5c)細胞内アミロイドβ陽性細胞での細胞質の奇妙なバルーン化と核のアポトーシス変化を裏付ける様々な画像がしばしば観察された(図5d)。
図5 細胞内アミロイドβ蓄積は空腹時に影響を受けた
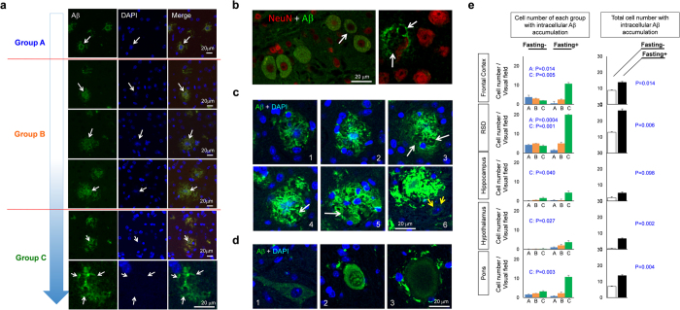
(a) 5x家族性ADマウスの大脳皮質で3ヶ月後に観察された様々な細胞内アミロイドβ蓄積。細胞内アミロイドβの蓄積は核のぼやけやフェードアウトを伴うことが多く、細胞病理の仮説的な進行と一致している。細胞内アミロイドβ陽性で核が無傷のもの、核に異常のあるもの、核がないものをそれぞれA群、B群、C群に分類した。(b) NeuNとアミロイドβの共染色により、細胞内アミロイドβ蓄積を有する細胞が神経細胞であることが明らかになった。(c) 細胞内アミロイドβ蓄積の種から細胞外アミロイドβ凝集体の仮説的な進行を、3ヶ月後の5x家族性ADマウスのRSDにおける代表的な画像で示す。白矢印は死んだニューロンの欠陥を示唆している。黄矢印は核の異常なDAPI染色を伴う核の肥大を示唆している。(d)細胞内アミロイドβ蓄積を伴う細胞の異常なバルーン化は、非定型の細胞死を示唆している。e)絶食および非絶食5x家族性ADマウスにおける脳の各部位におけるA群、B群、C群の細胞数を3ヶ月間で定量的に解析。各群での比較、または絶食と非絶食の間の総細胞数のP値をWelchの検定により算出した。N = 4.
そこで、このような細胞内アミロイドβ蓄積を有する細胞を、DAPI染色で核縁が明瞭なバイタル細胞(グループA)DAPI核がぼやけたり、かすかなDAPI核染色を有する死滅細胞(グループB)DAPI核形状の欠損を有する死滅細胞(グループC)の3つのグループに分類した(図5a)。定量解析の結果、細胞内にアミロイドβが蓄積している神経細胞の総細胞数は、全脳領域で絶食処理により増加していることが明らかになった(図5e)。また、各群を定量したところ、絶食処理により、脳の全領域で全般的にAからCへのシフトが誘導されていることが明らかになった(図5e)。
これらの結果は、細胞内アミロイドβ蓄積が細胞死の引き金となり、プラーク形成が細胞内アミロイドβ蓄積のゴーストによってシード化されるという仮説と一致しており、この仮説は今後、追加の方法を用いてより広範に検討されるべきであると考えられる。
議論
我々の研究では、マクロオートファジーが実際にマウスの神経細胞で飢餓によって誘導されていることを最初に証明した。この知見は、GFP-LC3 トランスジェニックマウスの絶食後の死後解析で得られた結果と一致していた22。GFP-LC3 トランスジェニックマウスを 24 時間または 48 時間飢餓状態にし、灌流して固定した。先行研究の著者らは、マウスを死滅させた後、脳組織をサンプリングし、GFP-LC3 の蛍光を観察した。彼らの方法と比較して、我々の手法は、生きている動物の脳のマクロオートファジーの変化を直接観察できる利点があるが、死んだ動物の脳では観察できなかった。一方、本研究で使用したプロトコルは、脳内の1つまたは複数の限られた領域での観察に限定されていた。しかし、我々が開発したAAVベクターは静脈注射による全身投与も可能であることから、将来的にはこの制限を克服することが可能になるかもしれない。
本研究で得られた空腹時にマクロオートファジーが誘導されるという知見は、化学物質やベクターによるマクロオートファジーの活性化が神経変性疾患の病態を改善することを示すこれまでの結果を裏付けるものである。また、生体内での神経細胞のマクロオートファジーの概日リズムを発見した。この概日リズムは、睡眠中にアミロイドβの分泌が減少するという以前の知見と合わせて考えると、興味深いものとなるかもしれない23。これらの結果は、脳におけるオートファジーの重要性の理解に貢献するものと考えられる。
また、5x家族性ADマウスでは、飢餓下でオートファジーが活性化されたにもかかわらず、細胞内でのアミロイドβの分解は、細胞外からのアミロイドβの取り込みの増加を補うにはまだ不十分であることが示唆された(図3)。この考えは、5x家族性ADマウスの免疫組織化学により、絶食処理により内因性アミロイドβの細胞内蓄積が亢進することが示されたことから、さらに裏付けられた(図5)。さらに、5x家族性ADマウスでは、絶食は内因性アミロイドβの細胞外蓄積に大きな影響を与えなかった(図4a,b)。もしこれがヒトのアルツハイマー病病態に当てはまるとすれば、カロリー制限によるアミロイドβの取り込みの亢進は、細胞内のアミロイドβが異常なシグナル伝達カスケードを誘発することで、神経細胞の機能に悪影響を及ぼす可能性がある。この仮説を裏付けるように、細胞内アミロイドβを持つ神経細胞の数が増加し、絶食後に生存能力を失うことが確認された(図5)。
しかし、生体内での代謝を可視化するために多量・高濃度のアミロイドβを注入したことや、5x家族性ADマウスのアミロイドβ発現量がヒトAD患者よりも極めて高かったことにも注目すべきである。
したがって、細胞外空間のアミロイドβ濃度がそれほど高くない場合には、飢餓状態で活性化されたマクロオートファジーがアミロイドβ病理を改善する可能性がある。その場合、飢餓によるアミロイドβ取り込みの誘導により細胞外アミロイドβが減少し、比較的低いレベルで取り込まれた細胞内アミロイドβが活性化マクロオートファジーにより分解される可能性がある。その結果、細胞外アミロイドβが減少することで、シナプス伝達が回復する可能性がある。この2つの仮説の臨界点については、さらなる検討が必要である。
以上のことから、アミロイドβの分泌、エンドサイトーシス、分解のバランスは、ヒトのアルツハイマー病病態の開始と進行に極めて重要な役割を果たしていると考えられる。したがって、栄養状態やサーカディアンリズムは、生活習慣の影響を受けている可能性があり、アルツハイマー病の興味深い要因であると考えられる。
以上のことから、本研究では、栄養飢餓は神経細胞にマクロオートファジーを誘導するが、その誘導はアルツハイマー病に関連した病態において多量のアミロイドβを分解するには不十分であることが明らかになった。
研究方法
ADモデルマウス
本研究では、5x家族性ADマウスとコントロールマウス(雄、3ヶ月齢)を用いて実験を行った。5x家族性アルツハイマー病トランスジェニックマウスは、トリプル変異を有する変異ヒトAPP770を発現する。スウェーデン(KM670/671NL)フロリダ(I716V)ロンドン(V717I)および二重変異を有する変異ヒトPS1を発現する。マウスThy1プロモーター24の制御下でM146LおよびL285Vを発現させた。バックグラウンドはC57BL/6×SJLであった。マウスは標準的な実験室条件で飼育した。12時間の光と12時間の暗闇、8時00分に光、22±1℃で8時00分にオフにして、水と食べ物は自由摂取で供給された。
レンチウイルスベクターの生成
pEGFP-LC3/pLVSIN-CAGの構築には、pEGFP-LC325から消化したNhel-BamHI断片をpLVSIN-CMVにサブクローニングし、CMVプロモーターをCAGプロモーターにClal-XhoIで置換した。pEGFP-LC3/pLVSIN-CAGをトランスファーベクターにクローニングした。Lenti-XTM Expression Systems(Clontech Laboratories, Inc)を用いて、Lenti-X HTXパッケージングミックス(Lenti-X HTXパッケージングミックスの成分)中のpEGFP-LC3/pLVSIN-CAGの6μgを、製造者の指示に従って、Lipofectamine® 2000(Life Technologies; Cat.11668-019)を用いて、293T細胞(16時間前に4×106細胞でプレーティングした)にトランスフェクションした。トランスフェクションの48時間後、トランスフェクションした細胞の培地を回収し、4℃で5分間8,000gで遠心分離した。上清を48,000gで4oCで2時間超遠心した)。) ペレットをPBSに懸濁し、再び8,000gで4oCで一晩遠心した。ペレットを100回ピペッティングして160μlのPBSで懸濁し、4℃で1時間保持し、100回ピペッティングして4℃で1時間保持し、4℃で8000gで5分間遠心分離し、最終上清を実験前に-80℃で保持した。
ウイルスベクターの滴定
ウイルスゲノムは、qPCRサイクラー(ABI 7500HT、Applied Biosystems社)とLenti-X™ qRT-PCR Titration Kit(Clontech laboratories社)を用いて定量し、適切な濃度に希釈した。PCRサンプルの調製は、レンチウイルスをDNase I(Lenti-X™ qRT-PCR Titration Kitの成分)でインキュベートし、レンチウイルスのゲノムRNAを精製し、逆転写した。ウイルスDNAを適切な濃度に希釈した。
ウイルスベクターおよび蛍光βアミロイドの注入
5x家族性ADマウスとコントロールマウス(C57BL/6×SJL)をイメージングの20日前に注射し、EGFP-LC3レンチウイルス(力価:5.0×106ベクターゲノム/ml、5μl)を後頭葉異顆粒皮質(RSD、前頭葉、-2.0mm、中尾側、ブレグマから0.6mm、深さ1mm)に注射し、小脳皮質(前頭葉、-7.0mm、中尾側、1.2mm、深さ1mm)に注射した。 0mm、ブレグマより内側0.6mm、深さ1mm)およびマウスの小脳皮質(前後側-7.0mm、ブレグマより内側1.2mm、深さ0.5mm)に、1.5%イソフルラン麻酔下で注入した。ヒトカルボキシテトラメチルローダミン(TAMRA)-β-アミロイド1-42,(100μM、A脳脊髄液、DMSO,0.1%で希釈したもの;1μl)を、イメージングの1日前に1.5%イソフルランで麻酔下のマウスのRSDに注入した。ウイルスは、741での熱、150での吸引力、75での速度、1000での遅延、400での圧力の条件の下でキャピラリープーラー(P-1000ピペットプーラー、Sutter Instrument)で作られた先端径20〜50μmのガラスマイクロピペットを介して送達された。5 ulのウイルス溶液を、注入機(FemtoJet®, eppendorf)を用いて、1μl/minの速度でRSDに注入した。
二光子顕微鏡による生体内試験イメージング
オートファジーの二光子イメージングは、正立顕微鏡(BX61WI、オリンパス、日本)水浸対物レンズ(XLPlanN25xW;数値絞り、1.05)パルスレーザー(MaiTaiHP DeepSee、Spectra Physics、米国)を備えたレーザー走査顕微鏡システムFV1000MPE2(オリンパス、日本)を用いて行った。EGFPは890nmで励起し、500-550nmでスキャンした。TAMRA-β-アミロイドは1020nmで励起し、547〜574nmでスキャンした。三次元イメージングに用いた走査領域は、100×100μm(1μmのZステップ、1,024×1,024画素、デジタルズーム×3)であった。大脳皮質層1で検出されたマウスの神経細胞内のLC3標識オートファゴソームを間引き窓で撮像した。オートファジーの機能を決定するために、レンチウイルスEGFP-LC3と同じ領域に1μlのアミロイドβ(TAMRA-β-アミロイド1-42:Cat;PMC-AK13-COS、100μM)を注入した。EGFP-LC3陽性小胞の画像をIMARIS 7.2.2 (Bitplane, スイス)を用いてオートファゴソームの数、大きさ、シグナル強度を解析した。
マウスの絶食処理
撮像中(1日目の午前12時から3日目の午前12時まで)に0〜48時間絶食処理を行った。マウスには自由に水を飲ませた。空腹時処理中、体重および血糖値を体重計(A&D、EK-600i)および血糖モニタリングシステム(PILOT#1000301293)を用いて測定した。
免疫組織化学
マウスをエーテルで深く麻酔し、4%パラホルムアルデヒドの灌流により固定した。脳組織をビブラトーム(HM 650V、サーモ)30μmずつを用いてスライスした。抗体(抗NeuN、ミリポア、MAB377;希釈、1:200,抗GFAP、サンタクルス、SC-6170;1:100,DAPI溶液、同仁堂ラボラトリーズ、340-07971,1:10,000)を用いて免疫組織化学を行った。EGFP-LC3小胞の特徴を同定するために、オートファゴソームマーカー抗体(抗ATG7,Sigma-Aldlich、A2856,1:200,抗ATG12,Cell Signalling 2011,1:100)を用いて免疫組織化学を行った。
アミロイドβ染色のために、切片を10mMクエン酸緩衝液(pH6.0)中で10分間沸騰させることによって前処理し、次いでプロテイナーゼK(100g/ml)を37℃で6分間、または0.5%トリトンX-100を30分間インキュベートした。次に、切片を50mM Tris-HCl、pH7.6,150mM NaCl(TBS)中の10%FBSで30分間ブロッキングした。 5μmの切片を抗アミロイドβ抗体82E1(マウス、1:1000,IBL)で染色し、ビオチン標識二次抗体(1:500,ベクターラボラトリーズ)HRP標識アビジン-ビオチン複合体(ベクターラボラトリーズ)および基質3,3’ジアミノベンジジンでのインキュベーションに続いて行った。スライドをヘマトキシリンで対染色し、顕微鏡(Olympus BX53)および付属カメラ(Olympus DP72)で観察した。免疫蛍光染色のために、切片を抗アミロイドβ82E1(マウス、1:500,IBL)抗LC3(ウサギ、1:500,Sigma-Aldrich)または抗LAMP2a(ウサギ、1.500,アミロイドβcam)で4℃で一晩染色した。 500,アミロイドβcam)を4℃で一晩、次いで、Alexa Fluor 488標識抗マウスI gG(1:1000,Jackson ImmunoResearch)またはCy3標識抗ウサギIgG(1:1000,Molecular Probes)を室温で1時間インキュベートした。画像は共焦点顕微鏡(Olympus FV1200 IX83)により得た。
画像フィールドの位置関係
実体顕微鏡(Qlclick™、74-0083-A0,オリンパス)と血管地図を用いて、RSDにおける撮像領域の同じ位置を追跡した。まず、特定領域を撮影し(Q-Capture Pro7,オリンパス)EGFP-LC3小胞の位置を決定した。詳細は図の凡例(補足図3)に記載した。
統計情報
同時期の複数群の比較には、Tukeyの検定に続く二元配置のANOVAを用いた。実際のp値は補足情報(補足表1)に記載した。
倫理について
すべての実験は、東京医科歯科大学人間倫理・動物実験委員会で承認されたプロトコル(2010-215C6,0150270A,0160328A)に準拠して行った。
