Contents
pubmed.ncbi.nlm.nih.gov/29858957
Extracellular DNA in natural environments: features, relevance and applications
オンライン公開 2018 Jun 1.
要旨
細胞外DNA(exDNA)は、土壌、堆積物、海洋、淡水、メタゾアの細胞間環境など、多くの生息地に豊富に存在する。長い間、その起源は主に溶解した細胞であると考えられていた。現在では、エキソDNAはしばしば活発に分泌され、多くのタスクを実行するために使用されるという証拠が集められ、バイオテクノロジー、医療、環境、一般的な微生物学的応用のための魅力的なターゲットやツールを提供するようになってきている。本総説では、exDNAを扱う主な研究分野を概観し、その固有の起源と機能を説明し、exDNAに基づく既存および新規アプリケーションの可能性を推論する。さらに、既存の抽出方法の概要を説明し、exDNAを扱う際に避けるべき一般的な落とし穴を指摘する。
キーワード 細胞外DNA、環境、バイオフィルム、土壌、植物、微生物活性
はじめに
細胞膜の中にあるDNAである細胞内DNA(iDNA)に対して、細胞外にあるDNAである細胞外DNA(exDNA)。このようなDNAは、あらゆる環境試料から発見される可能性がある。その起源に関する情報を含む最も適切な定義のひとつは、Pietramellaraら(2009)によるもので、exDNAは「能動的または受動的な押し出し機構、あるいは細胞溶解によって細胞内DNAに由来する」と述べている。
環境DNAを扱う場合、類似または異なる項目を参照するためにいくつかの略語が使用される。環境DNAの一般的な略語はeDNAだが、多くの著者が細胞外DNAにもこの略語を使用している。さらに、環境DNAとの混同を防ぐために、細胞外DNAを指す用語としてexDNAまたはcfDNA(無細胞DNA)が導入された。本総説では、頭文字をとってexDNAを優先している。海洋生物学者は、水から抽出できる「可溶性DNA」(sDNA)と「非可溶性DNA」(nsDNA)を区別することが多く、両分画はそれぞれexDNAとiDNAをおおよそ表している(Lever et al.2015)。esDNA、aDNA、cirDNAは、それぞれ細胞外自己DNA、古代DNA、循環DNAを意味し、それぞれ「土壌」「海洋・湖沼生態系」「人体」の章で取り上げることにする。
1950年代初頭に環境中に存在することが知られるようになると、exDNAは水平遺伝子移動(HGT)(Avery et al.1944; Freeman1951)および外来(細胞外プラスミド)DNAによる形質転換によって微生物が抗生物質耐性を獲得する能力(秋葉ら1960; Romanowski et al.1993)の文脈で研究されるようになった。前世紀の80年代から90年代にかけて、exDNAは土壌中での持続性、すなわち様々な土壌成分との結合によるヌクレアーゼ分解からの保護(Ogram et al.1987; Paget et al.1992; Vettori et al.1996)、河口や海洋環境での分解速度(Paul et al.)
Frostegårdら(1999)は、いくつかのプロトコルのDNA抽出効率を評価し、細胞外および細胞内の土壌DNAを同時に抽出する問題に取り組んだ。その頃には、exDNAは遍在していることが判明し、この認識をもとに、さまざまな自然環境に関するさまざまな研究テーマが出現した:
- 土壌中のexDNAの残存性と生態学的関連性(総説:Levy-Booth et al.2007; Pietramellara et al.2009);
- 海洋・水生生態系におけるexDNAの存続、機能、ターンオーバー(Torti et al.2015によるレビュー);
- 人体におけるexDNAの発生、関連性、およびexDNA由来の可能性のある治療法(Aucamp et al.2016; Cooper et al.2013; Thierry et al.2016によるレビュー);
- 病原微生物や環境微生物のバイオフィルム形成におけるexDNAの重要性と機能(Montanaroら2011とWnorowskaら2015(exDNA)、Hobleyら2015(バイオフィルム全般)、Wolskaら2016(遺伝子制御)、PayneとBoles2016(マトリックス相互作用とその結果生じる意味)、Azeredoら2017(方法)によるレビュー)。
細胞外DNAは、枯れ木(Gómez-Brandón et al.2017a)、牛のルーメンと糞尿(Chroňáková et al.2013; Fliegerová et al.2014; Nagler et al.2018)、好気性およびアナモックス顆粒(Cheng et al.2011; Xiong and Liu2012; Dominiak et al.2011)および科学捜査で用いられるヒト上皮細胞(Wang et al.2017)内で調査されている。さらに、exDNAは、哺乳類において感染性生物のトラップとして機能し(Ciesluk et al.2017によるレビュー)、植物の根端成長中(Haws et al.2012、Pietramellara et al.2013)であることが判明した。最後に、exDNAは生命の木の至る所で種特異的な成長抑制因子として働くと想定されている(Mazzoleni et al.2015b; esDNA)。
最近発表された外来生物に関するレビューの多くは、ある特定の環境に焦点を当てたものだが、本レビューでは、これまでに調査されたすべての自然環境における外来生物の主な特徴、機能、関連性を要約することを目的としている(図(図1)1)。また、既存および新規の外来DNAを利用したアプリケーションを紹介することも目的としている。さらに、既存の抽出方法について簡単に説明し、外来DNAを扱う際に避けるべき一般的な落とし穴を示す。
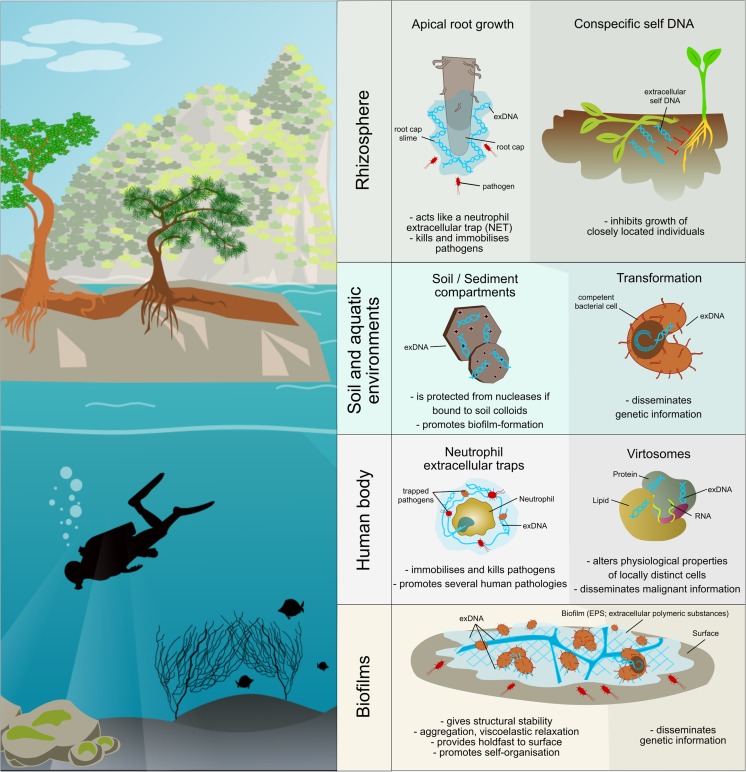
図1 異なる自然環境における細胞外DNA(exDNA)の主な機能。濃い網掛け部分は、細胞外DNAの情報性に由来する機能、薄い網掛け部分は、細胞外DNAの「粘着性」に由来する機能を表す
土壌
土壌では、exDNAは遍在しており、まず砂や粘土などの土壌コロイドへの吸着に関して研究されてきた(図(1) 1)(例:Lorenz and Wackernagel1987; Paget et al.1992; Pedreira-Segade et al.2018).これらの粒子に結合すると、exDNAは一部が分解から物理的に保護され、何年も持続することができる(Agnelli et al.2007; Nielsen et al.2007)。exDNAの実際の持続性は、その組成、メチル化またはコンフォメーション、および一般的な環境条件などの多くの要因に依存する。その中で、急速な乾燥、低温、高塩濃度、低pH、膨張性粘土鉱物の高含有はすべて、exDNAの分解を遅らせることが判明している(Crecchio et al.)放射性炭素年代測定による土壌exDNAの年代推定の試みでは、生存期間は21,000年(14C年代)から90万年(平均滞留時間)の範囲とされているが、化石炭素などによる汚染を完全に排除できないため、これらの結果を慎重に扱うことが示唆されている(Agnelli et al.2007).exDNAは様々な鉱物と結合しているにもかかわらず、土壌中の有能な微生物細胞を変換する能力を依然として保持している(図(図1)1)(Morrissey et al.2015; Romanowski et al.1993; Thomas and Nielsen2005)。土壌中のHGT頻度は低いとする研究がある一方で(Nielsen et al.1998; Pietramellara et al.2007; Pietramellara et al.2006; Thomas and Nielsen2005)、培養不可能な微生物が多いため、実際の形質転換率は過小評価されているという仮説もあった(Pietramellara et al.2009)。しかし、土壌中にDNAが長く存在することで、細胞から細胞へと受け継がれる抗生物質耐性遺伝子の存在感が高まり(Poté et al.2003)、生態学的および進化的な意味合いを持つ。exDNAの品質は、標準的なアガロースゲル電気泳動で示されるように、80から20,000 bp以上の断片サイズである分解状態に依存する(Ascher et al.2009b)。exDNAの大きな断片の完全性は、ほぼ完全な真菌18S遺伝子である1700bpの部分の増幅に成功したことで示された(Ascher et al.2009年b)。土壌中のexDNAの大部分は二本鎖であり、二本鎖DNAに特異的に結合する方法(インターカレーション色素、例えばPicoGreen)で検出できることがわかった(Agnelli et al.2004; Ascher et al.2009b).
能動的または受動的に排泄された後、あるいは溶解した細胞(すなわち、細胞死/壊死またはウイルス攻撃後)から放出されたexDNAは、様々なメカニズムで土壌中に拡散する。垂直方向では、溶出による地下水への移動、または水毛細管への移流による土壌表面への移動が見られ、水平方向では、土壌水の流れに沿って移動する(Agnelli et al.2004; Ascher et al.2009a; Ceccherini et al.2007; Poté et al.2003).どちらの方向でも、外来DNAは栄養分の少ない場所に到達する可能性がある。土壌中の抽出可能なPの10%以上を占め、NやCなどの必須元素を含むexDNAは、特に養分投入量の少ない土壌において、養分およびエネルギー源として機能すると考えられる(Levy-Booth et al.2007; Nielsen et al.2007によるレビュー)。細胞外および細胞関連ヌクレアーゼ(DNase)による分解の後、より小さなexDNA分子は微生物細胞に取り込まれ、そこで新たに合成された核酸の構成要素として機能するか、あるいはさらに分解されて必須栄養素となる(Morrissey et al.2015)。
他の環境と同様に、土壌exDNAはバイオフィルムの形成に重要な役割を果たし、後述するように主に構造的な機能を発揮し、HGTの情報プールとして機能する。同様に、土壌粒子や微細藻類・微生物などの生物は、特に乾燥土壌の表土において生物学的土壌クラストを形成することが知られており、exDNAを含む細胞外高分子物質(EPS)の生産が保水性の向上につながる(例:Adessi et al.2018).このような土壌微生物系は、微生物が活動(呼吸)を通じて酸素供給状態を形成し、一方では酸素供給と高電位活動、他方では低電位活動体制での乾燥や捕食からの保護というシフトを引き起こすという形で自己組織化していると考えられている(Young and Crawford2004)。exDNAは、その構造的特性により、孔や集合体の形成をサポートし、この自己組織化に寄与する可能性がある。
iDNAに関して追加の分類学的および系統学的情報を有するexDNAは、したがって、全土壌DNAプールの両方の画分から得られる微生物群集に関する情報の比較に使用されてきた(Agnelli et al.2004; Ascher et al.2009b; Ceccherini et al.2009; Chroňáková et al.2013; Gómez-Brandón et al.2017b )。これらの研究により、exDNA画分に見られる配列の中には、全DNAプールのiDNA画分には見られないものがあり、それらは古代の、いわゆるレリックDNAであることが示唆された。このようなDNAは、土壌中に長期間存在する可能性があり、調査した環境の歴史的な生物多様性を反映し、過去の気候条件について重要な情報を与えることができる(「アプリケーション」の項を参照)。Cariniら(2016)が行った研究では、実際に、iDNAのみと比較した場合、exDNAは観測された原核生物と真菌の豊かさを最大55%も膨張させることが示された。これらの知見を受けて、exDNAの定量的な存在によって、土壌微生物群集の実際の時間的・空間的変動が過小評価される可能性もあると議論された(Fierer2017)。これは、ほとんどの種がすべての土壌に少なくとも低存在し、環境条件が許せばすぐに繁栄するとする「すべてはどこにでもあるが、環境が選択する」という概念に新しい視点を与えるかもしれない(Baas Becking1931; Fenchel and Finlay2004; Nagler et al.2016)。したがって、多様性と微生物種の存在量に関するいかなる仮定においても、一方では環境DNA(eDNA)とexDNAを、他方では全DNAプールの細胞外(exDNA)と細胞内画分(iDNA)を区別することが不可欠である(Taberlet et al.2012aによるレビュー)(「アプリケーション」セクションを参照)。
リターの自己毒性に関する調査において、細胞外自己DNA(esDNA)の役割が最初に取り上げられ、Mazzoleniら(2015a)は、成長基質にconsific exDNAを添加すると、植物のみならず土壌動物や微生物の成長が抑制されることを発見した(Mazzoleni et al.2015a,b).この効果は非常に特異的で、同種のexDNAにのみ適用され、他の異種のexDNAには適用されないことが判明した。著者らは、この阻害効果が多様性を維持するメカニズムを表していると仮定した。これらの遠大な知見を解釈する試みとして、Veresoglouら(2015)は、土壌中のesDNAは阻害基質ではなく、同種のストレスシグナル分子として機能する可能性があると論じた。同様に、Duran-Flores and Heil(2015)は、esDNAが、被害を受けた植物による抵抗性関連反応の局所的な発現を引き起こす損傷関連分子パターン(DAMP)のグループに属する可能性があると論じている。しかし、これらの知見はすべて、むしろ予備的なものであり、基礎となるメカニズムを適切に解釈し記述するためには、さらなる研究が必要である。
最後に、土壌におけるexDNAの役割は、植物生理学とも関連している。植物の成長培地中にexDNAが存在すると、側根や根毛の成長が促進され、その効果は、根の形態を制御している特定のペプチドホルモン遺伝子の発現変化と関連している(Paungfoo-Lonhienne et al.2010)。その文脈では、exDNAはシグナル伝達化合物の機能を持つ。しかし、根の成長という文脈では、その役割は異なっている。Wenら(2009)は、exDNAが、土壌由来の病原体に対する成長した根皮の抵抗性向上に関与することが知られている根皮スライムの成分であり、exDNAの分解によってそれが失われることを報告した(Wen et al., 2009)。その後、いくつかの研究により、根端から積極的に放出されるexDNAは、ヒト好中球細胞外トラップ(NET)に分泌されるexDNAと同様の機能を持ち、根端に近接した病原微生物を捕捉することが示唆された(レビュー:Haws et al.2011):活発な分泌によって放出されると(Wen et al.2017)、exDNAは病原体だけでなく土壌汚染物質も宿主-微生物特異的に引き寄せて固定化する(Haws et al.2012; Hawes et al.2016; Pietramellara et al.2013)。
厳密には土壌ではないが、それでも密接に関連しているのは、家畜排泄物管理構造において抗菌剤耐性が出現する頻度が高くなる可能性があることである。Zhangら(2013)は、このような環境のexDNAとiDNAプールにいくつかの抗菌薬耐性遺伝子が存在することを発見し、HGTが抗菌薬耐性の拡散の潜在的なメカニズムであることを明らかにした。ルーメンを媒介とする微生物群集を調査したところ、exDNAとiDNAの細菌プロファイルの間にかなりの違いがあることが判明した(Fliegerová et al.)
海洋・水域の生態系
海洋環境では、exDNAは河口域から無酸素状態の深海まで、至る所に存在する。その起源、動態、意味合いについては、Torti et al.(2015)がレビューしている。海洋の全DNAプールの約90%がexDNAとして存在すると推定されており(Dell’Anno and Danovaro2005)、海水最上部10cmに存在するDNAの総量は0.45Gtであり、exDNAの量は堆積物よりも3桁低い(Torti et al.2015).海洋の外来DNAは、自生または同種であり、腐敗、ウイルス攻撃、成長した(微生物)生物から受動的または能動的に放出される。exDNAが水柱に放出された場合、海底に沈むのに十分な重さの粒子と複合化した場合のみ沈降する(Herndl and Reinthaler2013)。しかし、いったん放出されたexDNAの運命は、自然変換、ユビキタスDNaseによる分解とその後の微生物細胞への取り込み、長期保存、生物学的崩壊などがある(図.1)。長期保存に関しては、海洋堆積物におけるexDNAの結合は土壌のそれと似ている。相互作用は静電的で、負に帯電した無機および有機堆積物表面とDNAのリン酸基を結合するために無機カチオンの存在を必要とする(図1)(Lorenz and Wackernagel1987).さらに、深海の無酸素性過塩湖の塩水と接触してもexDNAは保存される(Borin et al.2008)。この場合、浸透圧ストレスにより非適応菌の溶解頻度が高くなり、HGTが起こりやすい環境と考えられる。
水柱や堆積物中のexDNAの次に、Decho and Gutierrez(2017)がレビューしているように、exDNAは海洋バイオフィルムの細胞外高分子物質(EPS)にも存在することがある。EPSは海洋の溶存有機炭素の総プールの主要な構成要素を形成しているが、この特定の環境におけるexDNAの役割はこれまで調査されていない。
湖やその他の淡水環境については、exDNAに関連する研究は非常に少ない。インドネシアの熱帯湖のフェルジナス堆積物について報告した研究では、堆積物に結合したexDNAを用いて微生物コンソーシアムを調査し、湖底から堆積物深度30cmまでexDNAの量が減少し、exDNAとiDNAの分類学的構成に違いがあることを検出した(Vuillemin et al.2016).別の研究では、河川堆積物のexDNAプールにおける抗菌薬耐性遺伝子の持続性に着目し、しばしばプラスミドDNAに組み込まれる耐性遺伝子は、染色体コード化された16S rRNA遺伝子よりも長い持続性を示し、exDNAが抗菌薬耐性情報の主要な貯蔵庫であることを示唆していると報告している(Mao et al.2014).北極海の海氷では、どの海洋環境から報告されたものよりも高い濃度でexDNAが見つかっており、海氷は海洋環境におけるHGTのホットスポットである可能性があると仮定された(Collins and Deming2011)。
バイオフィルム
特に、Staphylococcus属、Streptococcus属、Candida属、Pseudomonas aeruginosa、混合口腔バイオフィルムなど、臨床的に重要な微生物が形成するバイオフィルムが注目されている。環境微生物、植物病原菌(Sena-Velez et al.2016)、または廃水処理中の活性汚泥で形成されるその他のバイオフィルムは、あまり研究されていない(Dominiac et al.2011など)。
EPSにDNAが存在し、当時「スライム」や「マット」と呼ばれていた粘着性に関与していることは、1955年に一部の好塩性細菌(Smithies and Gibbons1955)、数年後にはヒト病原体に焦点を当てたPseudomonas aeruginosa(Murakawa1973)で早くも発見された。1996年以降、活性汚泥のEPSマトリックスやPseudomonas putidaの純粋培養物からexDNAが検出されるようになった(Flemming and Wingender2010によるレビュー)。このDNAの起源は、長い間、溶解した細胞であると考えられていた。その後、このexDNAは、様々な単一種や複数種のバイオフィルムに種特異的に存在し(Steinberger and Holden2005)、格子状の構造や糸状のネットワーク(図(1) 1)を形成して、明確なパターンで組織されていることが明らかになった(Allesen-Holm et al.2006; Böckelmann et al.2006; Flemming et al.2007 )。結果として、exDNAは細胞外マトリックスの構造成分として記述されており、特にバイオフィルム形成時に必須である(Conover et al.2011; Kawarai et al.2016; Martins et al.2010; Novotny et al.2013; Nur et al.2013; Seper et al.2011; Whitchurch et al.2002; Zhao et al.2013)(Flemming et al.2016; Montanaro et al.2011によるレビュー)、したがってバイオフィルム産生微生物によって活発に分泌される(Barnes et al.2012; Kilic et al.2017; Liao et al.2014; Rose and Bermudez2016; Zafra et al.2012)。S. aureusによるバイオフィルム形成時のexDNA放出に関わる遺伝子のゲノムワイドなスクリーニングが最近行われた(DeFrancesco et al.2017)。
粒状活性汚泥などの混合細菌コンソーシアムのバイオフィルムでは、フィンガープリント法を用いてexDNAとiDNAの組成の違いが検出され(Cheng et al.2011)、主に活性分泌に由来する種特異的なDNA放出を示している(Dominiac et al.2011)。さらに、好気性造粒中の微生物の凝集、ひいてはバイオマスの密度や大きさは、exDNA量の増加によって正の影響を受ける(Xiong and Liu2012)。口腔バイオフィルムでは、exDNAは微生物だけでなく宿主DNAからも構成されているが、他のバイオフィルムと同様の機能を発揮する(Jakubovics and Burgess2015; Schlafer et al.2017によるレビュー)。
バイオフィルムにおけるexDNAの役割に着目すると、いくつかの研究(Doroshenko et al.2014; Hathroubi et al.2015; Schilcher et al.2016)では、低濃度の抗生物質に曝露した後にexDNA濃度が上昇し、逆にexDNA量が多いほど抗菌抵抗性が高いことが分かっており(Johnson et al.2013; Lewenza2013)、保護機能を示唆している。exDNAはそのマイナス電荷により、カチオン性抗菌剤のキレーターとして働くが(Mulcahy et al.2008)、アミノグリコシドに対する保護システムとして働くこともできる(Chiang et al.2013)。しかし、抗菌薬や捕食に対する主な保護力は、exDNAがバイオフィルムを構造的に安定化させ、それによって抗菌薬耐性を高める機能に負っている(「応用」のセクションを参照)。exDNAは、さまざまなバイオフィルムの正電荷を持つアミロイドと引き合って結合し、それによってペプチドが蓄積されてマトリックスの重合を起こし、自己免疫力を刺激することも示されている(レビュー: Payne and Boles2016; Randrianjatovo-Gbalou et al.2017; Schwartz et al.2016).多糖類との相互作用は、緑膿菌とS. mutansのバイオフィルムで見られ、両成分は繊維の網を形成し、細菌が付着して成長できる骨格として機能する(Payne and Boles2016; Pedraza et al.2017)。
バイオフィルム内のHGTの文脈における遺伝情報源としてのexDNAの役割は、いくつかの研究(Merod and Wuertz2014; Wang et al.2002など)で取り上げられており、バイオフィルムはホットスポット、すなわち、高い細胞密度、遺伝的能力の向上、exDNAの蓄積などHGTに最適な条件を提供しているので、頻繁に起こることが判明している。バイオフィルムでは、プランクトン型細菌細胞と比較して最大700倍の効率でコンジュゲーションが行われることが示されており(Flemming et al.2016)、バイオフィルムにおける抗菌剤耐性がさらに促進される。さらに、バイオフィルムにおけるexDNAの他のいくつかの機能が説明されている。ほとんどのバイオフィルムにおいて、exDNAはバイオフィルムの発達を通して必要とされるが(Brockson et al.2014)、特に表面への細菌の初期付着と凝集に必要である(Das et al.2010; Das et al.2011; Jermy2010; Tang et al.2013)。しかし、Caulobacter crescentusのバイオフィルムでは、exDNAがスワーマー細胞のホールドファストに結合し、exDNAの存在しない場所への分散を促進し、バイオフィルムの成熟を妨げる(Borne et al.2010; Kirkpatrick and Viollier2010)。さらに、緑膿菌のバイオフィルムが活発に拡大する中で、細胞の自己組織化はexDNAフィラメント上で直接起こるか(Böckelmann et al.2006)、exDNA分子が支える溝のネットワーク構築を通じて起こることが示唆されている(Gloag et al.2013)。バイオフィルムの機械的ストレスの際、exDNAはバイオフィルムの粘弾性緩和を制御する際、際立った役割を示すことが判明した(Peterson et al.)さらに、Sapaarら(2014)は、exDNAがC. albicansバイオフィルムの酵母から菌糸成長への形態変化を誘導する可能性を示唆したが、考えられる基礎的なメカニズムについては何ら説明をしていない。
人体
人体内外のバイオフィルムを形成する臨床関連微生物が分泌するexDNA(バイオフィルムの項を参照)以外に、血液、リンパ液、胆汁、牛乳、尿、唾液、粘液懸濁液、髄液、羊水などの人体の細胞外環境には、主に内因性由来のexDNAが存在することが分かっている。1960年代から、関節リウマチ、膵炎、炎症性腸疾患、肝炎、食道炎など、さまざまな疾患の患者の血漿や血清からexDNAが発見された。1970年代には、二本鎖であること、土壌と同様のサイズ範囲(180から10,000 bp)であることが示された(van der Vaart and Pretorius2008)。より高感度な測定法が開発されたことで、より少ない量ではあるが、健常者にも存在することが判明した(Anker et al.1999)。この種の循環型exDNA(cirDNA、無細胞cfDNAまたは血漿DNA)は、アポトーシスやネクローシスによって、細菌やウイルスによって、また高増殖細胞からの活性放出を経て放出されると提案されている(Thierry et al.2016によるレビュー)。Ankerら(1976)は、ヒトリンパ球がDNAを含む複合体を放出したり、DNAを合成することができる酵素を細胞外に産生することができるという証拠を得た。しかし、このような活発な細胞外放出メカニズムに由来する場合、exDNAはしばしばRNA、脂質、タンパク質などの他の血漿成分と結合し、その場合、ヴィルトソーム(virtosomes )と呼ばれる(図1)。ヴィルトソームの一部として、exDNAは、抗原情報を共有することにより、身体のさまざまな部位に移動し、標的細胞に入り、免疫反応などの生理的特性を変化させる能力を示す(Anker et al.1984; Aucamp et al.2016; Skog et al.2008)。Peters and Pretorius(2012)は、この核酸の活発な放出と取り込みは、すべての生物と細胞タイプの特徴であり、ネオダーウィンのドグマとは対照的に、この循環によって身体や行動の形質が継承されうることを強調した。これは、体細胞だけでなく生殖細胞もexDNAを介して遺伝的・エピジェネティックな修飾を受ける可能性があるという証拠が見つかっているためである(Aucamp et al.2016による集中的なレビューと考察)。このような背景から、ヒト血管内のexDNAは、代謝DNAに由来する可能性が高いと考えられている。代謝DNAは、安定な遺伝DNAとは反対に、RNA生産やその他の細胞機能の制御や実行に関わる特別に合成された低分子量のDNA画分である。このような細胞内のde novo合成に由来するexDNAは(van der Vaart and Pretorius2008)、核内のDNAとは異なり、一本鎖や二本鎖の切断やGCリッチ領域の集積が見られる(Veiko et al.2008)。
人体におけるexDNAに関する研究のもう一つの分野は免疫系であり、好中球はexDNAをアクチン、ヒストン、ペルオキシダーゼ、タンパク質とともに分泌し、それによって好中球細胞外トラップ(NET)、細胞周囲の粘着性マトリックスを形成する(図(図1)1) (Brinkmann et al.2004).これらのNETは、免疫システムの一部であり、防御経路を誘導するシグナルに反応して形成される。病原体はNETによって化学作用的に引き寄せられ、その後トラップの抗菌成分によって固定化され、死滅する可能性がある(Halverson et al.2015; Hawes et al.)Hawesら(2015)は、NETは、DNAホスホジエステル骨格による表面安定化細菌カチオンの除去を通じて、その殺菌特性のほとんどを獲得し、細菌溶解をもたらすと提案した。しかし、最近の研究で、NETの過剰生産とexDNAの蓄積が、ある疾患の発症に寄与していることが明らかになった。乳がん細胞は、感染しなくても好中球を誘導してNETを産生させ(Park et al.2016)、それによって宿主細胞を利用して転移を促進することができる。さらに、NETはその粘着性の特性により、がん細胞の凝集や移植を引き起こす可能性がある(Hawes et al.2015)。このような背景から、García-Olmoら(2012)がレビューし、Thierryら(2016)が論じているように、ヴィルトソームと同様に腫瘍細胞由来のexDNAが健康な細胞に入り込み、転移の形成につながるとするゲノムマスタシス仮説が立てられた。慢性気道疾患では、NETが気道に蓄積することで自然免疫系が活性化し、患者の健康状態が損なわれる(Wright et al.2016)など、さまざまな他の病態が最近exDNAと関連している。同様に、ドライアイに罹患している患者では、exDNAの産生と分解が変化し、exDNAとNETが涙液に蓄積し、炎症を引き起こす(Sonawane et al.2012; Tibrewal et al.2013 )。
一方、人体、特に血管内でのexDNAの機能的役割は、virtosomeの形をした細胞間メッセンジャーとして機能し(Gahan and Stroun2010)、病原体侵入に関する免疫学的情報を広げるだけでなく、発がん、細胞侵入、転移、放射線療法や化学療法に対する抵抗性の発達を引き起こす悪性情報の拡散をサポートする(Aucamp et al.2016 )。一方、exDNAはNETの形をした侵入病原体のトラップとして働き、自然免疫系の一部として感染症に対抗することが示されている。しかし、同じ良性のNETが、上記のように異なるメカニズムを通じて、がん、自己免疫疾患、敗血症、血栓性疾患、炎症反応における病態生理学的効果を引き起こすことがある(Cieslukら2017; Cooperら2013; Parkら2016)。
exDNA抽出の方法論的考察
元DNAを対象とした抽出方法は、環境マトリックスによって異なる。土壌では、exDNAは粘土鉱物や腐植酸などの土壌コロイドと強く結合し、有機および無機土壌化合物の共抽出となり、下流の分析に支障をきたすことがある。これらの問題を克服し、無傷の細胞の溶解を防ぐために、exDNAは土壌粒子から弱アルカリ性溶液またはリン酸緩衝液を介して脱着され、細胞溶解試薬の使用を避け、オプションでDNase阻害剤を含む遠心分離後の上清に含まれる(例:Agnelli et al.2007; Ascher et al.2009b; Ceccherini et al.2009; Ogram et al.1987; Taberlet et al.2012 b)。exDNAを提供する次に、このような逐次抽出を適用することにより、抽出可能な土壌DNAだけでなく、iDNAの総量も増加する(例えば、Ascher et al.2009b; Nagler et al.2018; Wagner et al.2008)。
同様に、海底堆積物の研究では、標準的なDNA抽出の前に、アルカリ性リン酸緩衝液での洗浄と遠心分離を行うことで、sDNAとnsDNAの識別が提案されている(Alawi et al.2014; Lever et al.2015).水試料からexDNAを採取する際には、exDNAを保持するフィルターでろ過する必要があり、exDNAの結合は、フィルターの材質、孔径、pHや総懸濁物質などの水質パラメータによって大きく異なることが判明している(Liang and Keeley2013)。
バイオフィルム研究では、ゲノムDNAを汚染しないようにexDNAを抽出するには、単純な遠心分離よりも酵素処理法の方がより多くのexDNAを得ることができることがわかった(Wu and Xi2009)。がん研究においては、弱く結合したexDNAと強く結合したexDNAを区別し、それに応じて、5mM EDTAを用いて弱く結合したexDNAを除去する第一段階を適用し、トリプシンを用いて細胞表面に強く結合したexDNAを除去する第二段階を提案した(Laktionov et al.2004)。
一般的に、環境マトリックスに関係なく、細胞の溶解を避けるために、抽出手順中に過酷なステップ(物理化学的)を避ける必要がある。
アプリケーション
特定の遺伝情報の供給源としてのexDNA
exDNAの最も直接的な特徴の一つは、iDNAと比較して系統情報が追加されていることである。したがって、exDNAは、例えば、全DNAプールの細胞外および細胞内画分の比較遺伝子フィンガープリント(Agnelli et al.2004; Ascher et al.2009b; Chroňáková et al.2013)または定量PCR(Gómez-Brandón et al.2017a、b)による土壌微生物群集構成の評価精度向上(Pietramellara et al.2009)にも利用することができる。
微生物活動の代理人としてのexDNA(微生物のターンオーバー)
もう一つの特徴は、様々な環境におけるexDNAの起源は、主に溶解した(死んだ)細胞であると予想され(Levy-Booth et al.2007)、一方iDNAは無傷の(生きている、潜在的に生きている)細胞に起因するとされていることである。その結果、両DNA画分の比率(exDNA:iDNA)は、土壌やその他の環境における微生物活性の信頼できる近似指標となるかもしれない(Gómez-Brandón et al.2017a,b; Nagler et al.2018)。驚くべきことに、異なる微生物の活性はexDNA:iDNAの比と完全には相関せず、iDNAと関係なくexDNA量を測定することで最もよく追跡できることが判明した(Nagler et al.2018)。これらの結果は、exDNAが微生物の活動に比例して放出されることを示唆した。同様に、Dlottら(2015)は、個々の微生物の活動を測定する方法を確立しようとしたときに、予想外に低いrRNA:rDNA比を発見し、これらの比は増幅可能なexDNAの量が多いためであった。どちらの結果も、qPCRやその他の下流の分子法に適した品質のexDNA画分は、大部分が活発に放出されたDNAに由来し、したがって微生物の活性を反映している可能性があり、一方、溶解した細胞に由来するexDNAは、これらの方法では得られないことを示唆している。これらの結果は、生存率PCR (Emerson et al.2017; Nocker et al.2006; Wagner et al.2008)やDNase I/proteinase K (Villarreal et al.2013)による処理などの方法を適用する際に考慮する必要がある。これらの方法は、exDNAは主に死んだ細胞に由来するという仮定に基づいている。そのため、iDNAと総DNAは、2つのサンプルのうち1つでexDNAを分解して測定し、生死比を算出する。実際には、exDNAは最近溶解して活性化した細胞に由来するだけでなく、特に土壌コロイドのような無機粒子に結合した場合、数十年、数百年にわたって無傷の細胞膜の外に存在する残存DNAである可能性もある。このように、古くから存在するDNAは、様々な環境において、低いながらも安定した割合で存在していると考えられるため、exDNAを用いた活動追跡は、今後さらに検討される必要がある。
原核生物および真核生物の)生物多様性調査研究のための特定ターゲットマトリックスとしてのexDNA
環境DNA研究の分野(Thomsen and Willerslev2015)では、最近のアプローチとして、環境DNAの細胞外画分に着目し、メタバーコードアプローチを適用して、大規模かつしたがって代表的なサンプル量から大規模(景観スケール;植生図など)で土壌生物多様性を調査することを目的としている(Orwin et al.2018; Taberlet et al.2012 bなど)。しかし、結果は活発に放出された古代のexDNAによって影響を受ける可能性があるため、定量的な結論だけでなく定性的な結論も慎重に解釈する必要がある。
進化研究のためのツールとしてのexDNA
海洋生物学の分野では、化石化した原生生物などの堆積物中の微小な遺体の同定や列挙は、古代のexDNA(aDNA)の研究によってサポートされる。このデータは、無酸素および酸化条件下の堆積物から報告されており、完新世や更新世までさかのぼることができる(Agnelli et al.2007; Lejzerowicz et al.2013 )。このようなデータは、研究対象種の進化史に関する洞察を得るのに有用だが、高山湖畔での人間活動の追跡にも利用されている(Giguet-Covex et al.2014).
バイオフィルム治療のターゲットとしてのexDNA
バイオフィルム制御のための魅力的な標的を表すexDNAは、広範囲に研究され、レビューされている(例えば、Okshevsky and Meyer2015; Okshevsky et al.2015; Penesyan et al.2015; Wnorowska et al.2015).DNaseによる消化の次に(Aung et al.2017; Bhongir et al.2017; Brown et al.2015a; Brown et al.2015b; Rajendran et al.2014; Waryah et al.2017; Ye et al.2017)、また、交差したexDNA鎖の頂点にあるDNA結合タンパク質(DNABII)を標的とする抗体の使用も提案された(Brockson et al.2014; Novotny et al.2016; Rocco et al.2017)、構造的完全性を損傷し、結果としてバイオフィルム構成要素の抗生物質に対する感受性を高めることを目的としている。同様に、exDNAの放出または自己分解に関連するいくつかの遺伝子、ならびにクオラムセンシング阻害剤は、抗バイオフィルム療法の標的となり得る(例えば、Baoら2015;Beltrameら2015;Siら2015;Wolskaら2016によるレビュー)。また、バイオフィルムに対する有望な治療材料として、S. aureusバイオフィルムのexDNAを切断するナノ材料が提案された(Thyagarajan et al.2016)。
exDNAは、バイオフィルムのEPSの主成分であることから、ウランの生体内鉱物化に重要な役割を果たすと考えられている。バイオフィルム内でexDNAを生産する微生物を使用することで、放射性核種で汚染された場所の浄化の際に、標準的な物理化学的処理プロセスの安価な代替となる可能性があると述べられている(Hufton et al.2016)。
医学の分野では、exDNAは、その濃度が癌(Laktionov et al.2004)や自己免疫疾患(Raptis and Menard1980; review by O’Driscoll2007)を含む様々な病態と相関するため、診断だけでなく治療のモニタリングにも役立つツールとなっている。また、DNase Iは細胞の凝集を促進するexDNAを標的とするため、腫瘍細胞の治療に使用する可能性を強調する研究もある(Alekseeva et al.2017; Hawes et al.2015)。妊娠中、胎児の全ゲノムが母体の血液中を循環するため、胎児の遺伝的障害を非侵襲的に検出することができる(Fan et al.2012)。
興味深いことに、exDNAは法医学にも有用であることが分かっている。化学力顕微鏡を用いて、皮膚や唾液との接触による移動後に、ヒト上皮細胞の表面や他の表面上にexDNAを見つけ、定量化することができる。そのようにして、触覚サンプルの法医学的分析における新たなツールを提供する(Wang et al.2017)。
結論として、外来DNAは主に死滅した細胞に由来すると考えられてきたが、様々な環境の外来DNAプールにおいて、活発に放出される外来DNAが定量的に重要な割合を占めていることが明らかになった。活発に放出されることは、ミネラル、脂質、タンパク質などの異なる細胞外コンパートメントへの結合やメチル化によって、DNaseからexDNAをよりよく保護することにもつながる(Böckelmann et al.2006)。このような細胞外DNAを含む複合体は、一旦所望の構造に配置されると、電荷を持つ細胞外DNA分子の粘着性、あるいは細胞外DNAが他の細胞に伝える情報によって、異なる環境下で多くの仕事を行うことができる(図1)。また、DNaseによって断片化されたexDNAは、他の細胞にエネルギーや栄養を供給する役割も果たす。このようなexDNAの特性は、様々な研究分野で開発された、あるいは開発されつつある、非常に多様なアプリケーションの可能性を提供する。
資金調達情報
インスブルック大学およびインスブルック医科大学からオープンアクセスファンドの提供を受けている。
利益相反行為について
著者らは、利益相反がないことを宣言する。