Contents
EXPERT REVIEW REPORT MEDICAL SAFETY OF IVERMECTIN
ジャック・デスコート MD, PharmD, PhD
リヨン クロード・ベルナール大学名誉教授
米国毒性化学アカデミーフェロー
Eurotox登録毒性学者

目次
- I. エグゼクティブサマリー 2
- II. はじめに 5
- III. 非臨床毒性に関する主な知見のまとめ 9
- IV. ヒトでの有害事象とイベルメクチンへの曝露 19
- 臨床試験および医療機関でのイベルメクチンの処方に伴う有害事象 19
- 急性中毒および偶発的な過量摂取 24
- V. 危険因子 26
- 乳児・小児におけるイベルメクチンの臨床的安全性 26
- 妊娠中及び授乳中の女性に対するイベルメクチンの臨床的安全性 26
- 高齢者におけるイベルメクチンの臨床的安全性 27
- 併存疾患 27
- 薬剤関連 29
- VI. 考察 31
- VII. 結論 33
- VIII. 参考文献 34
- IX. 著者の履歴書 45
I. 要旨
イベルメクチンは1987年に初めてヒト用医薬品として承認された。40年にわたる動物用医薬品としての広範な使用に加えて、様々な寄生虫疾患の予防や治療のために、世界中で何億人もの人間に処方されてきた。近年、イベルメクチンの抗SARS-cov-2活性は、多くの実験的研究や臨床試験の焦点となり、その結果や解釈は、イベルメクチンがCOVID-19に対してどれほど有効であるか、あるいは有効であり得るかを確立するための活発な議論を生み出し、現在も継続している。規制当局による医薬品の承認は、リスク・ベネフィット分析に基づいて行われる。ガイドラインを遵守して実施された臨床試験により、有益性が評価される。重篤な副作用は、臨床試験で正確な定量的発生率データを得ることができないほど稀であることが多い。ファーマコビジランス(市販後医薬品モニタリング)は、医薬品の安全性に関するもう一つの重要な情報源である。この専門家によるレビューレポートの目的は、公開されている情報(500以上の論文およびウェブソース)の広範な分析に基づき、執筆時点での既知の限界および不確実性を考慮した上で、イベルメクチンの医療安全性プロファイルの独立した公正な評価を提案することである。
イベルメクチン治療に関連して一時的に報告された有害事象を評価すると、イベルメクチンの有害事象は、かつては頻度が低く(治療を受けた患者の2~5%未満)軽度から中等度であったことがわかる。主な副作用は、めまい、振戦、しびれ、眠気、発熱、疲労、頭痛、吐き気、腹痛、下痢、一過性の頻脈、起立性低血圧、そう痒、発疹などであった。より重篤な神経学的合併症(痙攣、錯乱、脳症など)が発生する可能性があるが、まれである。これらは基本的に感受性の高い人、特にオンコセルカ症やロア・ロア・ミクロフィラリア症などの寄生虫疾患の重症型の患者に発症する。急激な血圧低下、重篤な皮膚反応、肝障害などが初期の安全性評価で言及されている。長年にわたって蓄積された臨床経験から、これらの重篤な有害事象は極めて稀であることが明らかになっている。イベルメクチンが治療を受けた患者を死に至らしめることがあるという、今日でもしばしば繰り返される主張は、1997年に発表されたLancet誌への1ページの寄稿文に基づいている。この主張は、今日まで一度も立証されたことがなく、むしろ、その後の出版物で、この主張が正しくないか、方法論的に不正確であることが繰り返し示されているため、根拠がないと考えられている。
イベルメクチンを服用した後に患者が死亡することは実際にある。しかし、患者の多くは重度の寄生虫症を患っていたことは明らかであり、その死はイベルメクチンの直接的な毒性によるものとは考えにくく、むしろ膨大な寄生虫量に対するイベルメクチンの効果が不十分であったことによるものであると考えられる。記録された有害事象の大部分は、中等度でもなく、急速に自然回復するものでもなく、したがって、対象となる寄生虫に対するイベルメクチンの作用に関連しており、イベルメクチンの直接的な毒性作用ではなく、これらの寄生虫の死、変化、排出に対する曝露された宿主の反応を反映していることが、自殺的または偶発的に人間が曝露された場合の急性中毒の重症度の低さからも明らかである。最後になるが、イベルメクチン治療を受ける前の健康状態の悪さや併存疾患が決定的に寄与していることが認められる。
メルク社がイベルメクチンをヒト用医薬品として初めて承認する前に行った非臨床毒性試験の結果は、治療を受けたヒトにおいて適切な安全レベルが達成される可能性があるという主張を裏付けるものであった。このことは、30年以上にわたってイベルメクチンの治療的使用が急速に拡大したことで確認された。しかしながら、いくつかの初期の非臨床試験では、イベルメクチンはヒト催奇形性があり、乳幼児や高齢者にはより強力な毒性があるとの結論が出されていた。しかし、妊娠中の女性に対するイベルメクチンの臨床経験が蓄積されたことにより、初期の断固とした禁忌から脱却する医学者が増えてきている。乳幼児に対するイベルメクチンの毒性は、ラットやサルを用いた若年者と乳幼児のイベルメクチンの毒性を比較した非臨床試験の結果に基づいて推測されている。しかし,現在得られているヒトでの情報は,これらの動物実験結果を裏付けるものではない。イベルメクチンは、腸や血液脳関門の薬物特異的トランスポーターを妨害することが決定的に示された。これが臨床的に確認されていれば、乳児におけるイベルメクチンの高い毒性を主張する手掛かりになったかもしれない。同様に、血液脳関門の老化によって脳内のイベルメクチン濃度が上昇する可能性が主張されているにもかかわらず、高齢者におけるイベルメクチンの毒性が高くなることは実証されていない。高齢者の疥癬治療にイベルメクチンが世界中で日常的に使用されており、安全性に大きな問題がないことは注目に値する。今のところ、イベルメクチンによる副作用の発生に血液脳関門が関与しているとしても、少なくとも文書化されていないと考えられる。いくつかの国のファーマコビジランスネットワークや国際機関は、寄生虫疾患の治療を受けたヒトを対象にイベルメクチンの安全性を確認する情報や意見を発表している。同様に、COVID-19の予防的または治癒的治療法としてのイベルメクチンの適応外試験や臨床試験に関連して、これまで重篤な有害反応は報告されていないようである。
いずれにしても、イベルメクチンの医学的安全性プロファイルに関する今回の分析の明らかに肯定的な結論は、イベルメクチンをCOVID-19のような非寄生虫性疾患に使用することが推奨される場合には、あらゆる新薬や公式の治療適応の一般的な慣習と同様に、最先端の市販後調査によって蓄積されたデータと対決しなければならない。
II. 序論
イベルメクチンは、東京の北里研究所によって日本の土壌サンプルから分離された放線菌である微生物Streptomyces avermitilisの発酵生成物から得られた抗寄生虫剤の一群である大環状ラクトン類のエバーメクチンファミリーの半合成誘導体である[Omura, 2016]。イベルメクチンの開発は1975年に米国のメルク社で開始され、1981年に動物用医薬品として承認された(商品名:アイボメック®)。1987年にフランス保健省が初めてイベルメクチンをヒト用医薬品として承認した(商品名:Mectizan®)。米国FDAは1996年にイベルメクチンの経口投与を承認した(商品名:ストロメクトール®)。現在では、多くの動物用およびヒト用のジェネリック医薬品が市販されている。2015,イベルメクチンの発見と開発への貢献が認められ、ウィリアム・キャンベル氏(メルク社)大村智氏(北里研究所)Youyou Tu氏(中国伝統医学院)にノーベル医学賞が授与された。
イベルメクチンは,22,23-ジヒドロアベルメクチンB1a(またはH2B1a)が90%以上,22,23-ジヒドロアベルメクチンB1b(またはH2B1b)が10%以下の混合物であり,その分子量はそれぞれ875.10と861.07である[Fisher & Mrozik, 1989](図1)。
図1:イベルメクチンの化学構造
イベルメクチンは、強力な内部および外部寄生虫駆除剤であり、線虫(Ascaris, Trichuris, Ancylostoma)線虫(Taenia)線虫(Fasciola, Schistosoma)に対して幅広いスペクトルを有している。特にオンコセルカ症(河川盲目症とも呼ばれる)とロアイシス(リンパ系フィラリア症)に対して強力な作用を示する[Fox, 2006; Ashour, 2019]。SARS-CoV-2を含む様々な抗ウイルス活性が試験管内試験で報告されているが[Caly et al 2020]、COVID-19を含むウイルス性疾患の予防または治療的治癒のための臨床的妥当性は、現在進行中の議論の問題である[Heidary & Gharebaghi, 2020; Jans & Walstaff, 2020]。
数年前、イベルメクチンは、抑制性のグルタミン酸ゲート塩化物イオンチャネルを選択的に開くポジティブアロステリックモジュレーターとして作用することが示され、その結果、神経細胞または筋肉細胞の過分極を伴う細胞膜の伝染性が増加し、最終的に寄生虫の神経および神経筋の伝達が破壊されることが示された[Campbell, 1989; Martin er al)。 これらのGABA依存性クロライドチャネルのイベルメクチンに対する感度が、脊椎動物に比べて無脊椎動物では高いことが、ヒトだけでなく家畜でもイベルメクチンの安全性が高い理由となっている。その後、特にSARS-CoV-2やその他のウイルスに対するイベルメクチンの主張された活性を立証するために、代替メカニズムが提案された[Krause et al 1998;Chen & Kubo 2018;Changeux et al 2020;Lehrer Rheinstein 2020;Rizzo 2020;Stokes et al 2020]。イベルメクチンの駆虫活性、抗ウイルス活性、抗マラリア活性、抗メタボリック活性、および抗がん活性に関与する分子メカニズムについて、より多くの情報が着実に得られるようになるが、追加のメカニズムが考えられているが、まだ決定的に確立されていない[Laing et al 2017;Martin et al 2021年]。最近の知見で支持されている魅力的な仮説は、SARS-CoV-2を標的とするために、ニコチン受容体とイベルメクチンの間の相互作用の役割を強調している[Krause et al 1998; Changeux et al 2020]。
ヒトにおける抗COVID-19薬と考えられるイベルメクチンの最適な投与量、治療法、関連する血中濃度の選択基準については、それが治療法として提案されているものであれ、予防法として提案されているものであれ、意見が対立している[Camprubí et al 2020; Hellwig & Mai, 2020; Peña-Silva et al 2020; Schmith et al 2020; Martin er al)。] 可能であれば、コンセンサスが得られることが望ましいのであるが、入手可能な情報では、試験された治療レジメンに応じたイベルメクチンの安全性プロファイルの臨床的に関連する違いは指摘されていない。
長年にわたり、イベルメクチンは主に経口経路[Campbell, 1991; Fox, 2006; González et al 2012]または局所経路[Dourmishev et al 2005; Zargari et al 2016]で投与されてきており、現在もそうである。他の投与経路としては、皮下経路[Marty et al 2005;Pakanowski et al 2005;Turner et al 2005;Leung et al 2008;Fuscoら。特に牛では、直腸経路[Tarr et al 2003;Fusco et al 2010;Bogoch et al 2015年]、あるいは獣医学の研究では静脈経路[Van Amstel et al 2008;Gokbulut et al 2010年]を用いることがはるかに少ない。
典型的には、イベルメクチンは、様々な寄生虫疾患の治療のために、150〜200μg/kgの単回用量として投与される。投与は、数日後に1回または2回、あるいは最後の経口投与から3~6カ月後に繰り返し行うことができる。米国疾病対策センター(ジョージア州アトランタ)は、痂皮症の疥癬患者において、1日目、2日目、8日目、9日目、15日目、22日目、29日目に150μg/kgの経口投与を推奨している[CDC 2019]。COVID-19におけるイベルメクチンの予防的または治癒的な活性を評価するために、多くのヒト試験および無作為化臨床試験が実施されているか、進行中である(詳細かつ最新の情報については、https://ivmmeta.com)。ほとんどの例では、試験用量は0.2mg/kg×1日から0.6mg/kg×5日の範囲であった[Kumaraswami et al 1988年、Fox 2006,González et al 2012,Navarro et al 2020,Cepelowicz-Rajter et al 2021、Hill、2021年]。28日間にわたって最大100μg/kgのイベルメクチンを毎日繰り返し経口投与した場合の安全性については、ヒトボランティアを対象とした無作為化比較試験によって評価されている。この試験がほぼ終了した時点で、安全性に関する懸念は現れていない[MedinCell SA、未発表の結果]。
ヒトにおいて、報告されているイベルメクチンの排泄半減期は、かつては12時間から35時間の範囲であった[US FDA、1996;González-Canga et al 2008;JECFA 2016]。イベルメクチンの経口バイオアベイラビリティは、摂食したヒトと摂食していないヒトでは2.6倍も高いこと[Guzzo et al 2002]が、イベルメクチン投与の正式な推奨につながった。しかし、イベルメクチンの薬物動態に対する食物の影響に関する臨床データは少ない。最近のヒトでの研究では、食物の影響があったとしても最小限[Miyajima et al 2016]しか認められていない(Duthaler et al 2020)。
イベルメクチンは限られた生体内変化を受けるため、経口投与量のほとんどが未変化のまま糞便中に排出される(ほとんどの動物種で98%~99.5%)。CYP3A4はイベルメクチンの生体内変化に関与する主要なCYP450アイソフォームであり、次いでCYP2D6およびCYP2E1がわずかに関与する[Zeng et al 1999]。
臨床的に適切な濃度において、CYP450代謝活性に対するイベルメクチンの阻害作用は試験管内試験では明らかにされていない。同定されたイベルメクチンの代謝物の大部分は、水酸化型および脱メチル型の誘導体である。ヒト肝ミクロソームとのインキュベーションにより同定された13種類の代謝物のうち、3種類のイベルメクチン代謝物(M1,M3,M6)が、経口投与後のヒト健常者の血液中に検出された[Tipthara er al)。 ごく最近発表されたこれらの結果を確認し、これらの代謝物がイベルメクチンの活性と安全性に果たす役割があるとすれば、それをさらに調査する必要がある。
人間を含む哺乳類におけるイベルメクチンの体内動態の2つの大きな特徴は、腸内の薬物ABCトランスポーターと血液脳関門の役割である。この2つの特徴とイベルメクチンの安全性分析への関連性については、後述する。
III. 非臨床毒性に関する主な知見のまとめ
イベルメクチンに関する公開された前臨床毒性所見の大半は、Campbell[1989]が編集した複数の著者による書籍に記載されている。メルク・リサーチ・ラボラトリーズが作成したNDA文書[US FDA, 1996]や、最近改訂されたイベルメクチンの動物用医薬品としての食品への残留評価[JECFA, 2016]は、イベルメクチンに関する詳細な非臨床情報の他の情報源である。
急性毒性
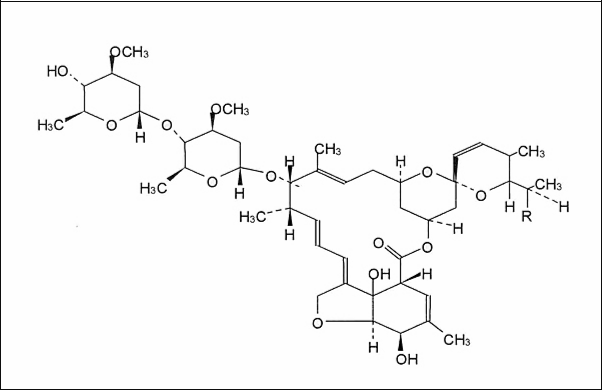
マウス、ラット、ウサギ、イヌ、サルで急性(単回投与)毒性試験が実施されている。報告されている致死量50%(LD50)の値を表Iに示す。
げっ歯類におけるイベルメクチンの急性毒性は、眼瞼下垂、徐脈、運動失調、振戦、右半身反射の消失などで現れた。これらの臨床症状は,イベルメクチンの中枢神経系への直接作用によるものと考えられた。新生児ラットは若年成人よりも重篤な影響を受けることが判明し、これはこの種の血液脳関門が生後に完成したことを反映していると主張された。
ビーグル犬では、散瞳が最も敏感な毒性の指標であった。死に至る前には昏睡状態が見られた。アカゲザルでは、毒性の最も敏感な指標は嘔吐であった。震えや痙攣は起こらなかった。ラットとは対照的に、サルでは急峻な用量反応曲線は認められなかった。
表I. げっ歯類、イヌ、サル、ウサギにおける報告されたLD50値 [Campbell, 1989]。
反復投与毒性
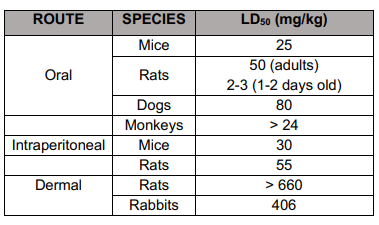
イベルメクチンの反復投与毒性は、マウスでの3カ月間の経口試験、Sprague Dawleyラットでの4週間の経皮試験と3カ月及び6カ月間の経口試験、ビーグル犬での3カ月及び9カ月間の経口試験、ミニブタでの2週間の経皮試験と2週間、3カ月及び6カ月間の経皮試験、最後にアカゲザルでの2週間の経口試験で評価された[Campbell, 1989; JECFA, 2016]。推定NOAELを表IIIに示す。
表II. イベルメクチンの反復投与毒性試験におけるNOAEL値[Campbell, 1989
(*) NOAEL = No Observed Adverse Effect Level(観察されなかった有害影響レベル)。
ラットに1,3,9又は12mg/kg/日のイベルメクチンを13週間経口投与したところ,9mg/kg/日以上の投与量で死亡が認められた。ラットに1,3または12mg/kg/日を27週間経口投与したところ、1日の最高用量を投与した動物にのみ神経毒性症状を伴う死亡が認められた。いずれの場合も、死亡率は主に雌で、投与開始後2週間であった。ラットに20mg/kg/dayのイベルメクチンを4週間皮膚投与した結果、毒性は認められなかった。
ビーグル犬に0.1, 0.25, 0.5, 1.5 mg/kg/dayのイベルメクチンを14週間経口投与したところ、最高用量においてのみ唾液分泌過多と体重減少が認められたが、その他には重大な副作用は認められなかった。また,ビーグル犬に0.5,1または2 mg/kg/dayを14週間経口投与した別の試験では,高用量群の8頭中4頭が神経毒性と体調不良のため安楽死を余儀なくされた。一方,ビーグル犬に0.1,0.5,1.5 mg/kg/dayのイベルメクチンを39週間経口投与したところ,死亡率も顕著な副作用も見られなかった。
アカゲザルにイベルメクチンを2週間連日投与しても,副作用は認められなかった。NOEL(No Observed Effect Level)は試験した最高用量レベル(1.2mg/kg/day)とした。
最後に,マウスおよびミニブタにそれぞれ13および20mg/kg/日までのイベルメクチンを毎日経皮投与したところ,顕著な毒性作用は認められなかった(マウスでは13週間,ミニブタでは39週間まで)。
遺伝毒性
イベルメクチンは,最初の承認に先立って実施された以下のような一連の遺伝毒性試験で陰性とされた[Campbell, 1989]。
- Salmonella typhimurium株TA1535,TA1537,TA98およびTA100を用いた逆細菌突然変異試験(ヒストリカル・エイムズ試験)
- マウスリンパ腫細胞株L5178Yを用いた哺乳類細胞遺伝子突然変異試験
細胞株L5178Y
- ヒト線維芽細胞を用いた予定外のDNA合成アッセイ
- ラット小核試験(生体内試験)
このバッテリーは,現在実施されているガイドライン,特にICH(International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use)[ICH, 2012]のガイダンスS2R1で要求されているすべての試験で構成されていることに注目したい。
念のため、ラテンアメリカの2つの学術機関が、試験管内試験または1 mg/kgのイベルメクチンをラットに単回皮下投与した後のイベルメクチンの遺伝毒性および変異原性の可能性に関して肯定的な結果を発表したことを言及しておかなければならない[Molinari et al 2009; Moreira et al 2014; Cordeiro et al 2018]。これらの結果はいずれも、完全に社内で検証された試験や、Good Laboratory Practiceの規則に厳密に準拠して実施されたアッセイを用いて生成されたものではないことを強調しておくべきであろう。これまでのところ、確認された結果は再現されていないようである。
がん原性
イベルメクチンの発がん性は、従来の2年間のバイオアッセイで試験された[Campbell, 1989]。Wistar系ラットに0,1,3または9mg/kgのイベルメクチンを1日1回経口投与した。最高用量までの雌では薬物関連の腫瘍は認められず,3 mg/kg/day以下の雄では認められなかった。治療に関連した有意な腫瘍所見が認められなかった雄ラットに3 mg/kg/日を経口投与したときのヒト暴露量の倍数は≈600であった。治療に関連した重大な新生物学的所見が認められなかった雌ラットに9mg/kg/日を経口投与したときのヒトへの曝露量の倍数は≒2000であった。
CD-1マウスにイベルメクチンクリームを0,0.1,0.3および1%局所投与した。投与した皮膚およびリンパ系臓器に非腫瘍性の組織学的所見が認められた。これらは車両に関連したものと思われるが、試験品との関連性も否定できなかった。
発育・生殖毒性
イベルメクチンは,マウス,ラット及びウサギにそれぞれヒトの最大推奨投与量の0.2,8.1及び4.5倍の量を反復投与したとき,催奇形性を示すことが示された[Campbell, 1989]。試験した3つの動物種で催奇形性が特徴的であった。これらの非臨床所見に基づき,イベルメクチンは当初,ヒトに対する催奇形性の可能性があるものとして分類された。
後述するように、妊婦へのイベルメクチンの偶発的または意図的な投与により、これまでに蓄積された医学的経験から、多くの規制当局や医学専門家が初期の断固とした禁忌から脱却した。
いくつかの多世代試験が実施されている。ラットでは顕著な親および子への毒性が認められたが、催奇形性は認められなかった[Lankas et al 1989]。ラット仔の未熟な血液脳関門の役割が関与していると仮定された。一方,イヌに毎月600µg/kgを8カ月間投与し,未投与の雌犬と交配させたところ,生殖毒性は全く認められなかった[JECFA,2016]。
一般薬理学および安全性薬理学
1987年にイベルメクチンが初めてヒト用医薬品として承認されたとき、安全性薬理学の前身である一般薬理学は「任意」であり、現在の安全性薬理学のように正式なガイドラインで規制されなかった。そのため、イベルメクチンの安全性を示す情報は限られており、以下に簡単に説明する。
心臓血管系
最大1.5mg/kg/dayのイベルメクチンを39週間経口投与した犬では、心電図の異常は見られなかった。非臨床毒性試験では、イベルメクチンを投与した瀕死の動物にのみ顕著な低血圧が認められた。
リベリア人高齢男性32名にイベルメクチンを投与し,投与前に1日2回,投与後に5回の心電図記録を行った。20名の被験者が治療前に心電図異常を有していた。有意な変化も新たな異常も観察されなかった[Dukuly et al 1990]。
呼吸
呼吸障害はイベルメクチンを投与した瀕死の動物でのみ認められた。呼吸器へのイベルメクチンの直接的な影響は証明されていないし、示唆もされていないようである。
神経系
神経毒性は、すでに述べたように、イベルメクチンの前臨床試験で記録された最も一般的な有害症状であった。
セルビアの研究チームは、ラットにおけるイベルメクチンの中枢および末梢への影響をさらに明らかにするため、薬理学的研究を行った。2.5,5.0または7.5mg/kgの遅い静脈内単回注射では,目に見える中枢神経系の抑制は起こらなかったが,10mg/kgのイベルメクチンを投与した10~40分後には眠気とふらつきが認められ,15mg/kgを投与した動物の半数では死に至るほどの深い中枢神経系の抑制が見られた。イベルメクチンはチオペントンによる睡眠時間を延長し,この効果はベンゾジアゼピン受容体のアンタゴニストであるフルマゼニルで前処理すると拮抗することが示され,イベルメクチンのGABA作動性の特性と一致した[Trailoić & Nedeljkovik, 2011]。さらに、リドカインおよびストリキニーネ誘発性痙攣はイベルメクチンによって拮抗された。リドカイン誘発性痙攣に対するイベルメクチンの抗痙攣ED50は2.44 mg/kgの経口投与であったが、ストリキニーネ誘発性痙攣ではそれよりも高い値(4.25 mg/kg)であった[Trailoić & Varagić, 2007]。いずれの状況でも,抗痙攣用量はイベルメクチンLD50(18.2 mg/kg)の計算値よりも有意に低かった。さらに,フルマゼニルはリドカイン誘発性痙攣に対してのみイベルメクチンの効果に拮抗したことから,イベルメクチンは哺乳動物の中枢神経系においてGABA感受性およびGABA非感受性機構を介して複数の抑制効果をもたらすと考えられた。
局所耐性
1%イベルメクチンクリームは、ウサギの皮膚に刺激性を示したが、眼には刺激性を示さなかった。
免疫毒性および免疫安全性
イベルメクチンは、免疫毒性評価に関する最初のガイドラインがEM(E)A(2000)、米国FDA(2002)及びICH(2005)で発表される何年も前にヒトへの使用が承認された。これまでのところ、最新の方法を用いて、現行の戦略、勧告、規制要件に準拠したイベルメクチンの免疫安全性に関する広範な評価は行われていない。以下に要約するように、いくつかの研究の結果は、その範囲が断片的であったとしても、 イベルメクチンを免疫毒性物質あるいは潜在的に有用な免疫調節物質と見なすには不十分である ところである。
前世紀末に一般的に行われた免疫毒性研究の初期の例として,雄のCD-1マウスに0.2または20 mg/kgのイベルメクチンを1回だけ皮下注射し,T依存性およびT非依存性の抗体反応に対するイベルメクチンの影響を評価したものがある[Blakley & Rousseaux, 1991]。統計的に有意なT依存性抗体反応の増強が認められた。その後、Sajidら[2007]は、さまざまなスケジュールに従って、合計100羽のウサギに200,400,600μg/kgのイベルメクチンを投与した。体液性免疫と細胞性免疫の両方を、数十年前に一般的に使用されていた参照抗原のパネルを用いて生体内試験で試験した。顕著な「免疫増強」が認められた場合は、最高用量のイベルメクチンを投与することが多かった。はるかに従来とは異なるモデルを用いた3つ目の例が、Stankiewiczらによって発表された[1995]。生後6ヶ月の子羊10頭にイベルメクチンを前処理し、その1日後にヒト赤血球とオバルブミンを注射したものを、前処理をしなかった子羊10頭と比較した。処理した子羊の培養リンパ球は、対照の子羊の培養リンパ球と比較して、コンカナバリンAまたはフィトヘマグルチニンに対して同等の造血反応を示した。また、オバルブミンに対する抗体反応も両群で同様に見られた。
寄生虫疾患の動物モデルを用いた実験的研究では、イベルメクチンが免疫反応性に影響を与えるかどうかを評価している。代表的な例として、ダニ(Psoroptes cuniculi)に感染したウサギやシラミ(Polyplax spinulosa)に感染したラットの特異的な免疫反応に対するイベルメクチンの皮下投与の影響が挙げられる。ラットでの結果が否定的であったのとは対照的に、ウサギでの結果はイベルメクチンによる免疫反応の増強を示唆していると考えられる。著者らは、イベルメクチンは免疫反応に直接影響を与えず、シラミに感染したウサギでの所見は、ダニの同期死に伴う抗原の大量放出の結果であると結論づけた[Uhlir & Volf, 1992]。
もう1つの重要な懸案事項は、イベルメクチンが有意な抗炎症作用を発揮するかどうかである。正常なげっ歯類や様々な寄生虫疾患を持つ少数のヒトにおいて、イベルメクチン処理後に炎症性サイトカインのレベルが低下または上昇することが報告されている。これらの結果を詳細に検討することは、本レビューの範囲外である。急性サイトカイン放出症候群(「サイトカインストーム」)におけるイベルメクチンの有意な保護効果は非常に考えにくい。抗炎症作用は、アトピー性皮膚炎のマウスモデルで証明された[Ventre er al)。 実際、イベルメクチンの局所投与は、アレルゲン特異的T細胞の活性化と炎症性サイトカインの産生を抑えることで、アレルギー性皮膚炎を改善した。
イベルメクチンの毒性のメカニズム
前述のように、イベルメクチンの薬理作用のすべてはまだ完全には解明されておらず、いくつかは仮説的なものである。ここでは、専門家でなくても理解できるように、現在の知見を簡単にまとめてみた。
受容体の役割
GABA感受性およびGABA非感受性クロライドチャネル、ニコチン受容体、Cysループ受容体、P2X受容体、フェルネソイドX受容体など、さまざまな受容体が関与していることが示されたり、示唆されたりしている[Bortolato et al 2013; Laing et al 2017,Chen & Kubo 2018,Changeux et al 2020,Martin et al 2021年]。] これらの可能性のあるまたは推定されるメカニズムのそれぞれの関連性は完全には理解されておらず、このことは、抗炎症性、抗ウイルス性、免疫調節性または抗がん性の適応を含む、承認された抗寄生虫の適応を超えてイベルメクチンを再配置しようとするかなり多くの研究および臨床試験によって示されている[Juarez et al 2018;Martin et al 2021]。このことは、特に非寄生虫症の医学的適応を考慮した場合に、「最適な」用量レジメン、イベルメクチンの治療期間、または「治療薬レベル」に関する早急な主張は誤りであることが判明する可能性があるため、避けるべきであることを訴えている。
毒性学的な観点からは、神経毒性が長年にわたる主な安全上の懸念事項であった。今日では、イベルメクチンで治療を受けたヒト患者において、基礎となる寄生虫の侵入や明らかな疾患がない場合には、神経学的合併症は一般的に軽度から中等度であり、頻度は低いことが十分に確立されている[Chandler, 2019; Makenga-Bof et al 2019]。イベルメクチンによる神経毒性は、長い間、GABA依存性クロライドチャネルに関連していた[Campbell, 1998]。それ以降、イベルメクチンの神経毒性の理解に大きな進歩はなかったようである。
薬物トランスポーターの役割
前世紀に入り、薬物の体内動態、薬理効果、毒性を考える上で、薬物輸送体が重要な要素であることが明らかになった。実際、薬物トランスポーターは、細胞内への薬物の取り込みと細胞外への薬物の排出を仲介する。すべてのトランスポーターは、組織内で特定の発現パターンを持っている。小腸、肝臓、腎臓で発現しているものは、薬物の体内動態や薬物間相互作用に非常に重要であると考えられ、一方、血液脳関門や母体・胎児関門で発現しているものは、敏感な組織を毒性化合物から保護することが期待される[Daneman- Prat, 2015; Mahringer & Fricker, 2016; Lund et al 2017; Mayhan & Arrick, 2017]とされている。その一つであるP-glycoprotein(P-gp)は、いわゆるABCスーパーファミリーに属する膜貫通型のタンパク質である。
MDR1遺伝子にコードされているABCスーパーファミリーと呼ばれる膜貫通型タンパク質である。P-gpは、イベルメクチンをはじめとする薬物の細胞外への排出に重要な役割を果たしている。P-gpは、腸細胞、血液脳関門を形成する毛細血管内皮細胞、および胎盤に存在する。P-gpが存在しない場合,イベルメクチンは消化管からの吸収が良くなり,中枢神経系に自由に拡散する可能性がある[Didier & Loor, 1996]。MDR1a-/-マウスのようなP-gp欠損動物[Schinkel et al 1996; Geyer et al 2009]や、コリー、オーストラリアンシェパード、イングリッシュシェパード、ホワイトジャーマンシェパードなどの特定の犬種は、イベルメクチンの神経毒性の可能性に対して非常に敏感である[Mealey et al 2001; 2002]。注目すべきは、ほとんどすべての規制当局による毒性試験に使用されているイヌ、すなわちビーグルがこの欠失を持っていないことである。同様の薬理遺伝学的素因がヒトで検出されたのは今のところ一度だけで、急性神経毒性段階の後に回復した13歳の少年である[Baudou er al)。] 最後になったが、MDR1遺伝子の変異は、CYP3A4を主な生体内変化経路とする薬剤でより頻繁に見られることを、イベルメクチンでは考慮しなければならない。しかし、すでに述べたように、経口投与されたイベルメクチンのうちCYP450系で生体内変換されるのは2%未満であり、約98%が未変化のまま糞便中に排泄されることから、このメカニズムが寄与しているとは言えない。
過去20年間に蓄積された膨大な量の科学的データにもかかわらず、イベルメクチンを投与された被験者に対する臨床的な関連性は不明のままである。生体分子技術の飛躍的な進歩により、構造の詳細や試験管内試験またはin silicoの結果が数多く得られている。しかし、自然発生的な突然変異や化学物質の影響を反映した変化が、臨床的に意義のある有害事象の発生を確実に予測できるかどうかは、今のところ不明である。現在入手可能なヒトのデータでは、イベルメクチンの顕著な影響を示す明確な裏付けがないことが注目されている。
血液-脳関門の役割
薬物トランスポーターは毛細血管内皮細胞に存在し、いわゆる血液脳関門を構成している。前節で述べたことのすべてではないが、ほとんどが血液脳関門に当てはまる。イベルメクチンが属する化学ファミリーであるエバーメクチン農薬の神経毒性[Yung, 2012; El-Saber et al 2020; Gueniche et al 2020]のため、血液脳関門の関与に多くの注意を払うことは論理的であった[Edwards, 2003; Lacher et al 2015; Chedik et al 2017]。未熟なラットやCF-1マウスにおいて重度の神経毒性や死として現れるイベルメクチンの毒性の強さは、脳や空腸におけるP-gpレベルの最小化と説得力を持って関連づけられており[JECFA, 2016]、少なくともその保護的役割が証明されている。実際、ラットとは対照的に[Lankas et al 1989]、イヌやサルにおけるイベルメクチンの反復投与試験(多世代試験を含む)では、顕著な毒性や神経毒性は認められなかった。興味深いことに、生まれたばかりのイヌ、サル、ヒトでは血液脳関門が成熟していることが知られている[JECFA, 2016]。加齢した動物がイベルメクチンに対してより敏感であることを臨床的に適切な条件で実証する実験的研究はこれまでに行われていないようである。後にまとめたように、高齢者はイベルメクチンによって直接引き起こされる神経毒性作用のリスクが高いという主張は、利用可能な臨床データによって立証されていない。
IV. ヒトの有害事象とイベルメクチンへの曝露
1980年代以降、イベルメクチンは寄生虫疾患の治療のために世界中で使用されており、最初は動物で、次にヒトで使用されている。正確な推定値はおそらく達成できないが、数億人の人間がすでに予防的または治療的にイベルメクチンを投与されているというのがコンセンサスである[Thylefors, 2008]。過去30年間に投与された総数は、現在の世界人口の3分の1に匹敵するとさえ言われている[Chaccour, 2020]。
イベルメクチンの臨床試験および医療機関での処方に伴う有害事象
過去30年間に、イベルメクチンの臨床試験中や医療機関での処方後に発生した有害事象を記載した臨床報告やレビュー論文が数多く発表されている。
一般的に、イベルメクチンの軽度から中等度の有害事象は、下痢、吐き気、腹痛、ヒリヒリ感、灼熱感、発熱、疲労、頭痛、眠気などからなる[Addiss et al 1991;Aziz et al 1982;De Sole et al 1989;Whitworth et al 1991;Burham et al 1993;Kamgno et al 2004;Kircik et al 2016;Budge et al 2018;Shouman et al 2020年]。それらはほとんどの場合、頻度が低い(通常、予防的または治療的にイベルメクチンで治療したヒトの5%未満で記録される)。一般的に、イベルメクチンの投与を中止したり、ボランティアを臨床試験から退出させる必要はない。
死亡例
1997年、BarkwellとShieldは、長期療養施設の疥癬患者47人のうち15人が、殺虫剤のクロタミトンとリンデンを局所投与した後、3ヵ月後にイベルメクチン150~200μg/kgを単回経口投与して死亡したことを報告した。同じ施設でイベルメクチンを投与していない複数のグループと比較したところ、統計的に非常に有意な差が認められたとしている。死亡に至った具体的な経緯は記述されなかったが、著者はイベルメクチンが原因物質であると結論づけている。
この1枚の手紙がきっかけとなって、長期にわたる議論が始まった。その直後、DiazgranadosとCosta(1997)は、コロンブスの疥癬患者のコホートにおいて、イベルメクチンを数ヶ月、あるいは数年にわたって繰り返し投与したにもかかわらず、過剰な死亡率は認められなかったという自らの経験を報告した。その後、パプアニューギニアの疥癬患者において、ジエチルカルバマジンとイベルメクチンを併用した患者とそうでない患者を比較しても、統計的に有意な死亡率の増加は認められなかった[Alexander et al 1998]。
驚くべきことに、Barkwell and Shield (1997)は、その時点で入手可能な関連情報を参照していない。西アフリカでイベルメクチンの治療を受けた50 929人のうち、治療後72時間の間に死亡した者はいなかったと報告されている[De Sole et al 1989]。健康状態の悪い38歳の女性患者1名がイベルメクチン投与後10日目に死亡したが、既往の寄生虫の併発が関与していると考えられた。イベルメクチンは、リベリアのゴム農園で働く14,000人の労働者に対して、150μg/kgの単回経口投与を1年おきに2回行った。治療へのコンプライアンスは97%であった。死亡例や重度の副作用は報告されず、治療を受けたヒト被験者の0.5%が中等度の副作用を発症した[Pacqué et al 1990]。
さらに最近では、カメルーンで実施された3年間の無作為化比較試験において、オンコセルカ症の患者でイベルメクチン治療に起因する死亡例は記録されなかった。合計で7237回の治療が行われ、その内訳は、プラセボが2808回、イベルメクチンが150μg/kgで2226回、400μg/kgで475回、800μg/kgで1728回であった[Gardon et al 2002]。最後に、(Kinyanjui et al 2018)は、疥癬の新しいフレームワークモデルとベイズ法を用いてBarkwellとShieldの結果を再検討した。彼らは、死亡数の超過を示す統計的証拠はないと結論づけた。
以上に示したすべてのデータに基づき、本報告書の著者は、イベルメクチンが治療を受けたヒト被験者のグループに過剰な死亡を直接誘発しなかったと言うのが妥当であると考えている。したがって、過去または現在において、イベルメクチンが患者を死亡させる可能性があるという記述は、過去数十年間に蓄積されたすべての医学的情報を考慮に入れていないため、誤解を招く恐れがあると考えられる。
影響を受ける主な臓器または器官別に記載された有害事象
神経系有害事象
イベルメクチン投与中の中枢および末梢の神経学的症状は、最も頻度の高い有害事象である。しびれ、頭痛、めまい、眠気、振戦がイベルメクチン投与に伴う最も一般的な軽度から中等度の有害事象である。
イベルメクチン投与に伴う重篤な神経症状の中には、痙攣が報告されている。実際に、イベルメクチンはいくつかの動物モデルで抗痙攣作用を示すことが分かっている。さらに重要なことは、オンコセルカ症に罹患した集団において、イベルメクチン治療を開始した後、痙攣の発生率が徐々に減少したことが報告されている[Kipp et al 1992; Fodjo et al 2018]。
本格的な脳症は、イベルメクチン治療の最も重篤な神経学的合併症である。その重篤さゆえに、イベルメクチンの安全性に関する多くの懸念を集めた。そのメカニズムは完全には解明されていないが、イベルメクチン治療に伴う脳症はオンコセルカ症やロア糸状虫フィラリア症の患者に多く見られるため、これらの病態を持たない患者がイベルメクチンに直接関連して重篤な脳症を起こすリスクは非常に小さいと考えられることが今日では広く認められている[Dukuly et al, 1990; Boussinesq et al 1998; Gardon et al 2003; Twum-Danso, 2003a; 2003b; Kamgno et al 2008; Chandler, 2018; Chesnais et al 2020]である。しかし、非常に小さいとはいえ、このリスクは、後述するように、推奨される治療レジメンの後に、あるいは事故や自殺による過量摂取に関連して、イベルメクチンが脳症を引き起こす可能性を排除することはできない[Massi et al 2017]。
消化器系の有害事象
下痢、吐き気、腹痛は、イベルメクチンの投与に関連する最も頻度の高い消化器系有害事象である。上述のとおり、これらは通常、軽度から中等度であり、治療を受けた被験者の数パーセントに見られる。
消化器系に影響を及ぼす重篤な有害事象で、イベルメクチンが原因とされるものはないようである。
皮膚系の有害事象
イベルメクチンの摂取後、発疹や斑状丘疹が速やかに消失することがある。しかし、中毒性表皮壊死症(TEN)スティーブンス・ジョンソン症候群(SJS)水疱性類天疱瘡様発疹、好酸球増加および全身症状を伴う薬物反応(DRESS)薬剤性固定発疹などの重篤な皮膚合併症が、イベルメクチンを投与されたごく少数の患者で報告されている[Mara et al: Nakamura et al 2006; Fujimoto et al 2014; Aroke et al 2017; Kerneuzet et al 2018; Ngwasiri et al 2018]がある。
(Oshikoya et al 2020)は 2004年から 2017年までにNigerian Pharmacovigilance Centerで記録された24015件の薬物有害反応を報告した。そのうち、284件は重度のそう痒性毒性皮であった。抗HIV薬が主な原因であった。イベルメクチンが関与していると疑われたのは1例であった。これまで、イベルメクチンで予防的に治療を受けた患者のそう痒性毒性皮は報告されていないようである。
マゾッティー反応は、発熱、悪寒、リンパ節の腫脹と圧痛(リンパ節炎)頭痛、筋肉痛、関節痛、頻脈、低血圧および/またはショック、眼症状、皮膚症状など、皮膚科的、循環器系的および全身的な様々な症状を特徴とする中等度から重度の有害事象である。皮膚症状には、そう痒、丘疹、浮腫、膨疹、小水疱、膿疱に加え、鱗屑、排泄物、びらん、潰瘍、痂皮などがある。オンコセルカ症の治療のためにジエチルカーバメートやイベルメクチンを初めて投与した後の患者に主に記述されている[Awadzi & Gilles, 1992; Ito, 2013]。利用可能なデータでは、補体媒介性過敏症または即時型過敏症のいずれかを支持するものはほとんどない。好酸球の脱顆粒とそれに続く組織や末梢血への炎症性メディエーターの放出が仮定されている[Ottesen, 1987]。ジエチルカーバメートやイベルメクチンの直接的な毒性はなく、ミクロフィラリアの急性破壊が関与していると考えられている。
Mazzotti反応は重篤な場合がある。純粋に臨床的な観察に基づいて診断すると、誤って薬剤によるアナフィラキシー反応や偽アレルギー反応、あるいはイベルメクチンの初回投与直後の心血管虚脱を疑ってしまうかもしれない。Mazzotti反応は、COVID-19の患者のように、基礎疾患であるオンコセルカ症が疑われないイベルメクチン治療を受けた患者では報告されていないようなので、イベルメクチンの直接的な原因となる可能性は低いであろう。
心血管系の有害事象
イベルメクチンを投与した被験者における心血管系の有害事象の報告はほとんどない。イベルメクチンのヒトにおける心血管系の安全性については、限られた情報しかない。リベリアの高齢男性32名にイベルメクチンを投与し、治療前に1日2回、治療後に5回、心電図(EKG)を実施した。20名の被験者に治療前の心電図異常が認められたが、イベルメクチン投与後には有意な変化はなく、新たな異常も認められなかった。
前述のとおり、オンコセルカ症患者におけるイベルメクチン投与のごく初期に、残虐な低血圧が起こることがある[De Sole et al 1989]。
肝有害事象
イベルメクチンは肝毒性があると疑われていた。実際には、いくつかの出版物で再現されたこの主張は、イベルメクチン治療との因果関係が説得力を持って確立されていないいくつかの個別の症例報告[Sparsa, 2006; Veit er al)。 薬剤による肝毒性のデータベースであるLiverToxの最終更新版[2018]では、イベルメクチンは既知の肝毒性物質として分類されておらず、この結論は米国国立衛生研究所[NIH, 2021]によって最近確認された。
過敏症・アレルギー
薬物アレルギーは、複雑で理解されていない分野である。不確実性は残っているものの、イベルメクチンに対する過敏反応(アレルギーよりもはるかに良い言葉である)は、治療を受けた患者では非常にまれであると判断できる。実際、皮疹、Quincke浮腫、アナフィラキシーショック、アレルギー性接触皮膚炎は、イベルメクチンを投与された被験者で記録されたとしても、非常に稀である。
リベリアのオンコセルカ症患者50名を対象に,0,100,150,200μg/kgのイベルメクチンを1回または6ヶ月、12ヶ月の間隔で経口投与した4群において、過敏症は認められなかった。オンコセルカ症に関連した軽度から中等度の全身性反応のみが認められた[Greene et al 1991]。オンコセルカ症の抗原にあらかじめ感作された患者において、イベルメクチンによる寄生虫破壊の結果としてアナフィラキシー反応が起こる可能性が示唆されている。したがって、COVID-19に対するイベルメクチンの予防的投与を受ける被験者のように、寄生虫疾患が進行していない被験者では、このような全身性反応は起こらないと考えられる。
発熱、悪寒、関節痛、吐き気、発疹などのインフルエンザ様反応は、イベルメクチン摂取後すぐに報告されていた。これらの反応は通常、軽度から中等度であった。これらの臨床所見と、イベルメクチンがIL-1およびIL-6レベルを低下させるというデータとを調和させるために、これらのインフルエンザ様反応は、イベルメクチンによるオンコセルカのミクロフィラリアの殺傷による炎症反応を反映しているのではないかと考えられている。
呼吸器系の副作用
呼吸器系に対するイベルメクチンの直接的な影響はこれまでに報告されていないようである。
血液及びリンパ系への副作用
軽度から中等度のリンパ節腫脹が報告されているが、オンコセルカ症の患者に限定されているようである(Mazzotti反応)。
一貫性のある軽度から中等度の、自然に再発する血液学的パラメータ及び凝固の変化が報告されており、特に出血を伴わないプロトロンビン時間の延長が報告されている[Homeida et al 1988年、Pacqué et al 1989年、Richards et al 1989年、Hay & Arnott、1990年、Whitworth et al 1992年]。
これまでにイベルメクチンに関連する重篤な血液学的副作用は報告されていないようである。2名の男性患者が150μg/kgのイベルメクチンを単回投与した4週間後に血腫を発症したが、数日で自然に回復した[Homeida et al 1988]。
耳毒性の副作用
LittleとCosetti[2021]は、COVID-19の潜在的な薬物治療の耳毒性についての最近のレビューで、イベルメクチンの摂取に関連した耳鳴りとめまいの発生を確認した。しかし,これらの副作用は一般的に軽度から中等度であり,速やかに消失した。また、イベルメクチンに関連した直接的かつ長期的な毒性は報告されていないようである。
急性中毒および偶発的な過量摂取
重度のLoa-Lao糸状虫症の19歳の女性がイベルメクチンを自殺目的で摂取したことが報告されている。彼女は推奨治療量の100倍の量(3mgのイベルメクチン錠剤を400錠)を摂取した可能性があり、吐き気と嘔吐、運動失調、反応性散瞳、反射亢進などの中等度の神経学的症状を呈した。彼女は従来の支持療法を受け、摂取後4日目に退院することができた[Djeunga er al 2019]。
イベルメクチンが動物用医薬品およびヒト用医薬品として広く利用されているにもかかわらず、ヒトの偶発的な過量摂取の事例はごくわずかしか報告されていない[Hall et al 1985;Graeme et al 2000;Deraemecker et al 2014;Goossens et al 2014]。通常、中程度の神経毒性症状が見られ、特異的な支持手段を講じないと急速に回復することが多い。乳児や幼児を含む偶発的な過剰摂取で、致命的な結果になったものはなかった。
獣医療の現場から得られた2つのイベルメクチンのデータは、特に注目に値する。まず、急性中毒(しばしば「イベルメクチン中毒症」と呼ばれる)は、古くから犬や猫で報告されている[Merola & Eubig, 2018]。これらは、イベルメクチンに対する犬や猫の過敏性が関与している可能性があるにもかかわらず、動物の飼い主が不用意に過剰量を投与したことが原因であることが多いと考えられている。このような過敏な感受性は、コリーやいくつかの近縁の犬種でよく記録されている[Hopper et al 2002]。多剤耐性遺伝子(MDR1)は、血液脳関門に不可欠な大きな膜貫通タンパク質であるP-グリコプロテイン(P-gp)をコードしている。MDR1遺伝子の欠失変異は、イベルメクチン感受性と関連することが示された。この突然変異をホモ接合で持つ動物は、イベルメクチン感受性の表現型を示す。コリーの1/3から 1/2がイベルメクチン感受性の表現型を持つことがわかった[Mealey et al 2001; 2002]。同様の変異が少数の猫で確認された[Mealey & Burk, 2015]。
これらの知見をバランスよく解釈するために、ビンクリスチン[Lind et al 2013]、アポモルフィン[Campbell et al 2017]、ロペラミド[Sartor et al 2004]、アセプロマジン[Deshpande et al 2016]などのいくつかの認可された動物用医薬品を通常安全な用量で投与されたコリーにおいて、重篤な副作用が繰り返し記述されていることに言及しておくことは注目に値する。獣医療の現場から得られたもう1つの興味深い情報は、イヌのイベルメクチン中毒症の治療における乳剤内投与の有効性が実証されたことである[Fernandez et al 2011]これは、様々な原因による重度のヒト中毒の管理において、ますます推奨されている支援策である。
殺虫剤として使用されるエバーメクチンおよびアバメクチンなどの関連化合物のヒトに対する急性毒性はよく知られている。エバーメクチンによる急性中毒は、まれではあるが、致死的になる可能性がある[Chung et al 1999年、Soyuncu et al 2007,Sung et al 2009,Bansod et al 2013,El-Saber et al 2020年]。エバーメクチン農薬と、承認された抗寄生虫薬であるイベルメクチンとでは、曝露の方法が大きく異なるため、後者の安全性プロファイルが優れていると主張することができる。
V. リスク・ファクター
乳幼児および小児におけるイベルメクチンの臨床的安全性
イベルメクチンは、若年成人よりも乳児ラットの方が顕著に毒性が高いことが分かっている。新生児ラットでは血液脳関門が数週間未熟であることから、イベルメクチンの脳内への移行が促進されることがこの毒性の増加の原因ではないかという仮説が立てられた[Lankas et al, 1988]。この仮説は、ある種の科学的証拠と考えられるほど繰り返し唱えられてきたが、ヒトの乳幼児のイベルメクチンに対する感受性が臨床的に証明された例は一貫して報告されていない。
世界保健機関が発表した必須医薬品のモデルリストの最終改訂版には、小児用のイベルメクチンの経口投与が含まれている[WHO, 2019]。しかし、イベルメクチンは、15kg未満の小児に対する治療的使用が非常に矛盾した形で承認されている。いくつかのオフラベル研究の結果から、イベルメクチンは乳幼児に有効であるだけでなく、安全である可能性が高いことが示された。
疥癬の治療のためにイベルメクチンを単回投与した18人の子供たちには、副作用は見られなかった[Del Mar Sáez de Ocariz, 2002]。Chosidow and Gendrel [2015]は、200mg/kgのイベルメクチンを1週間間隔で2回経口投与したところ、体重15kg未満のほとんどの乳児に有効であり、まれにしか起こらない副作用が誘発されたと報告した。彼らの結果は、Becourtら[2013]の15人の小児における初期の所見を裏付けるものであった。Levyら[2020]は、平均投与量223μg/kg(89%の症例で2回目の投与)で疥癬の治療を受けた1~64カ月の小児170人(体重:4~14.5kg)に関する医療データを収集した。有害事象(いずれも重篤なものではなかった)は7名の小児に報告された。非常に類似した知見が繰り返し報告されている[Wilkins et al 2018,Wimmersberger et al 2018,Colebunders et al 2019,Morris-Jones 2020,Ständer et al 2020年]。
最後になるが、イベルメクチンの推定抗がん作用について、人道的な理由から、手の施しようのない急性骨髄性白血病の3人の子どもを対象に、11歳と13歳の子ども2人には1日量1mg/kgを15日間、5歳の別の子どもには6カ月間、持続的に注入して試験を行った。著者らは,イベルメクチンが重篤な副作用を引き起こさないと結論付けた[Galvao de Castro,2020]。
妊娠中および授乳中の女性におけるイベルメクチンの臨床的安全性
初期の前臨床知見にもかかわらず、妊婦のイベルメクチン曝露に関連した一時的な奇形は記録されていないし、疑われてもいないようである。同様に、妊娠中の母親を介してイベルメクチンに曝露された乳幼児や子供に対する直接的または長期的な悪影響も記録されていないし、疑われてもいない[Gyapong et al 2003,Pacqué et al 1990年、Nicolas et al 2020,Westlake & Aronoff 2020年]。
医薬品の奇形性や世代的なリスクは、一般の人々にネガティブな印象を与えることが長い間示されていた。この否定的な認識が、正しく、あるいは誤って疑われた結果に関連した、重大なレベルの薬事法上の懸念を説明している。このような問題に疑問の余地なく取り組み、議論の余地のない(というよりも議論の余地のある)答えを提供することは非常に困難である。最近、米国食品医薬品局(FDA 2019)は、どちらかというと保守的な規制決定を見直すのに役立つ新しい方法論的アプローチを提案した。
イベルメクチンで治療した授乳中の女性に関するデータは乏しいだけである。
測定された乳汁中のイベルメクチン濃度は非常に低いことが判明した[Ogbuokiri et al 1993;Rodari et al 2020]。
高齢者におけるイベルメクチンの臨床的安全性
高齢者は、イベルメクチンによる神経毒性のリスクが高いと繰り返し主張されていた。しかし、このような主張は理論的な考察に基づいており、これまでのところ、様々な臨床的知見によって正しいことが説得力を持って証明されていない[Raffi er al 2019]。
血液脳関門がある種のグローバルな存在として、加齢に伴って障害を受ける可能性があることは、ほとんど議論の余地がない。血液脳関門が多くの構成要素からなる複雑な存在であり、その正確な役割やそれぞれの相互作用は、臨床的に重要な観点から完全には確立されていないことも、議論の余地はない。
併存疾患
寄生虫疾患
オンコセルカ症またはLoa Loaフィラリア症の患者では、イベルメクチン関連の有害反応がより頻繁でより重篤であるという多くの証拠がある[Dukuly et al 1990;Boussinesq et al 1998;Gardon et al 2003;Twum-Danso 2003b;Chandler 2018;Chesnais et al 2020]。メカニズムは完全には解明されていないが、イベルメクチンの薬理作用の結果として対象となる寄生虫が死滅、放出、および/または排出されることに対する曝露された宿主の反応が関与しているとほとんどの著者が考えている。
可能性としては、局所的な炎症を伴う塞栓性血管病変、血液脳関門MDR1/ABCb1遺伝子の遺伝的異常、過剰な炎症反応に対する遺伝的素因などが寄与していると考えられるが[MacKenzie et al 2003]、今のところ決定的な証拠はない。
免疫抑制
イベルメクチンは、免疫抑制状態にあるヒトの患者において、感染性合併症の発症を促進するほど強力な免疫反応性への影響を及ぼすことは決定的に示されていない。
COVID-19
本稿執筆時点で、イベルメクチンは、COVID-19の予防および/または治療薬として、限られた国で承認されている。例えば、ベリーズ、ボリビア、コロンビア、モルダビア、ジンバブエなどである。頻繁に改訂されるリストは、https://ivmmeta.com。
入手可能なすべての結果を説明することは、このレビューの範囲を超えている。世界的に見て、1万人以上の被験者が調査研究や臨床試験に登録されていると言えるであろう。治療法、投与量、追跡期間、治療の種類(治癒または予防)は様々であるが、大部分の資料はイベルメクチンの医学的安全性を評価するのに適したものである。軽度から中等度の有害事象の発生率は研究によって異なる可能性があるが、イベルメクチンによる重度の有害事象の発生率は一貫して非常に低いことが報告されている。
注目すべきは、イベルメクチンに起因する死亡例や重度の有害事象が報告されていないことである。最近の報告では、Alamら[2020]が例示している。
薬物関連
イベルメクチンは、P糖タンパク質の強力な阻害剤として作用することが示されている[Bartley et al 2009;Didier & Loor、1995,1996;Lespine et al 2006;2007;2009;Jani et al 2011;Ballent et al 2016;Merola et al 2018]。また、CYPA4を阻害し[Zeng et al 1998;Kellerova et al 2019]、血漿タンパク質に広範囲に結合する[Klotz et al 1990]。3つのメカニズムはすべて、潜在的には(または理論的には)臨床的に重要な薬物相互作用につながる可能性がある。実際には、イベルメクチンとの重大な薬物相互作用の臨床報告はほとんどないため、ほとんどの場合、ヒトまたは動物における特定の薬物相互作用の薬物動態学的評価から推測することしかできない[Guéniche er al 2020]。
抗凝血剤
イベルメクチンとワルファリンの相互作用の可能性はしばしば言及されるが、臨床的に重要な相互作用の症例報告はこれまでに1件しか発表されていない[Gilbert & Slechta, 2018]。前述のように、イベルメクチンが凝固に悪影響を及ぼす可能性があるという初期の知見は、最近になって否定された。このような相互作用の有意なリスクは示されていない。
COVID-19治療の文脈の中でイベルメクチンとヘパリンの間の薬物相互作用のリスクを調査する臨床研究は今のところ発表されていない[Horowitz & Freeman, 2020]。
抗菌薬
動物を用いた主に薬物動態学的研究の多くで、エリスロマイシン[Bohlen et al 1995]、アジスロマイシン[El-Tahtawy et al 2008]、セチリジン[Olsen et al 2007]との相互作用の可能性が評価されている。2007]、ドキシサイクリン[Agbedanu et al 2015;Atram et al 2020]、ケトコナゾール[Alvinerie et al 1998:Hugnet et al 2007]、イトラコナゾール[Bellent et al 2007]、およびリファンピシン[Ballent et al 2010]。動物でもヒトでも、臨床的に重要な相互作用は報告されていない。
抗寄生虫薬
アルベンダゾールとイベルメクチン[Awadzi et al 2003]またはレバミゾールとイベルメクチン[Awadzi et al 2004]で治療を受けたヒト被験者において、薬物動態学的な相互作用は認められなかった。
中枢神経系薬
同様に、以下の研究では、イベルメクチンとフェノバルビタール[Ballent et al 2010年]、トラマドール[Ferreira da Cruz et al 2020年]、抗てんかん薬[Grewal et al 2017年]、ロペラミド[Lifschiyz et al 2004年]、トリフルオロパラジン[Marques-Sanros et al 1999年]との間の臨床的に関連する相互作用を証明できなかった。
その他
イベルメクチンとデキサメタゾンとの間の推定される相互作用を扱った結果[Areskoga et al 2008年]、シクロスポリン[Marques-Sanros et al 1999年]、ベラパミル[Molento et al 2004年]、フェキソフェナジン[Olsen et al 2006年]にも同じ結論が当てはまる。
イベルメクチンとの臨床的に重要な薬物相互作用のリスクを確認することができる臨床データが明らかに不足している。したがって、CYP3A4で代謝され、P糖蛋白質を誘導または阻害する可能性のある薬剤とイベルメクチンを併用することが、合理的および/または公正であるかどうかは議論の対象となる。
VI. 論点整理
今回、治療目的または予防目的でのイベルメクチン投与に関連して報告された有害事象を徹底的に調査したが、重大な懸念材料はなかった。実際、オンコセルカ症やLoa-Loa microfiliarisなどの寄生虫疾患の患者を除いて、イベルメクチンに一時的に関連する重篤な有害事象は非常にまれであった。実際、有害事象は主に軽度から中等度であり、頻度も低かった。このことは、疥癬患者や進行中の寄生虫疾患のないヒトで報告された結果からも確認できる。
公表されたデータの分析に取り組む際の大きな困難は、イベルメクチンの投与に一時的に関連しているが、他の原因、特に進行中の寄生虫疾患に関連していると思われる有害事象と、イベルメクチンによって誘発されたと思われる有害事象とを決定的に区別することである。多くの場合、このような区別はできない。
この分析のもう一つの難しさは、イベルメクチン関連の有害事象に関する膨大な文献の中で、因果関係の評価方法が役立った例がほとんどないことである(Agbabiaka et al 2008年にレビュー)。これはイベルメクチンに限ったことではないが、ハードルの高さや不確実性の要因となっていることは間違いない。著者は正直に、しかし誤ってイベルメクチン治療の因果関係を肯定的にも否定的にも結論づけるかもしれないことを心に留めておくことが重要だ。結論を再検討することは必要であり、今回の報告書にもいくつかの例が見られる。
最後に、臨床試験の結果とその統計的有意性に議論の余地がないことを保証するためには、方法論的ガイドラインを厳密に遵守することが絶対に必要であるが、有害事象に関する場合は状況が異なる。臨床試験は、その発生率を正確に定量化するのに役立つが、一般的に重篤である稀な有害事象については、これを達成することはできない。因果関係を医学的に厳密に評価した上で、ケースバイケースのアプローチしかできない。したがって、無作為化比較試験ではない調査的なヒト試験の結果は、有用な安全性情報を提供することができるので、これを捨ててはならない。
VII. 結論
過去30年間に、世界中で何億人もの被験者が治療目的または予防目的でイベルメクチンを投与されてきた。本報告書の参考文献リストは、イベルメクチンの医学的安全性の詳細な分析を可能にする、大量のデータが利用可能であることを示している。確かに、イベルメクチンの薬理作用や作用機序には不確実性が残っているが、それを取り除いても、本報告書の主要な結論は広範で一貫性のある医学論文群に依拠しているため、大きな変化はないと考えられる。
以上のことを検討して、今回、利用可能な医学的データを分析した著者は、イベルメクチンの安全性プロファイルは、これまでのところ、大多数の治療を受けたヒトの患者において優れており、イベルメクチンのヒトへの毒性は重大な懸念要因であると主張することはできないと結論づけた。

