Evaluation of the effectiveness and safety of adding ivermectin to treatment in severe COVID-19 patients
bmcinfectdis.biomedcentral.com/articles/10.1186/s12879-021-06104-9
公開日: 2021年05月04日
Nurullah Okumuş, Neşe Demirtürk, Rıza Aytaç Çetinkaya, Rahmet Güner, İsmail Yaşar Avcı, Semiha Orhan, Petek Konya, Bengü Şaylan, Ayşegül Karalezli, Levent Yamanel, Bircan Kayaaslan, Gülden Yılmaz, Ümit Savaşçı, Fatma Eser & Gürhan Taşkun
概要
背景と目的
COVID-19パンデミックの原因となり、その影響が日々大きくなっているSARS-CoV2に対して、有効な治療法はまだない。イベルメクチンは、その治療効果が検討されている薬剤の一つである。本研究では;重症COVID-19肺炎患者において、イベルメクチンの代謝を変化させ、毒性作用を引き起こす遺伝子変異の有無を調査し、変異のない患者の治療におけるイベルメクチン使用の有効性と安全性を評価することを目的とした。
材料と方法
重症COVID19肺炎患者を対象とし、前向き、無作為化、対照、単盲検の第3相試験として計画された。試験には、試験群と対照群の2群が参加した。イベルメクチン200mcg/kg/dayを5日間、経腸投与用に調製した溶液の形で、試験群に含まれる患者の基準治療プロトコル-ヒドロキシクロロキン+ファビピラビル+アジスロマイシン-に加えた。対照群の患者には、イベルメクチンを使用せず、他の3種類の薬剤による基準治療のみを行った。変異の有無は、無作為化に従って試験群に組み入れられた患者を対象に、サンガー法によるmdr1/abcab1遺伝子の配列解析を行って調べた。変異のあった患者は試験から除外され、イベルメクチンの治療は継続されなかった。患者は治療後5日間の追跡調査を行った。治療とフォローアップ期間の終了時に、臨床効果と検査項目の変化を評価した。
結果
研究グループ36名、対照グループ30名、合計66名の患者が研究に参加した。研究グループの6名(16.7%)の患者の遺伝子検査でイベルメクチンの代謝に影響を及ぼす変異が検出されたため,研究から除外した。5日間の追跡期間終了時に、臨床症状の改善率は、研究グループで73.3%(22/30)対照グループで53.3%(16/30)であった(p=0.10)。試験終了時に死亡率が上昇したのは、試験群では6人(20%)対照群では9人(30%)であった(p=0.37)。追跡期間終了時の末梢毛細血管酸素飽和度(SpO2)の平均値は、試験群が93.5%、対照群が93.0%であることが判明した。また、酸素分圧(PaO2)/FiO2比は、試験群で236.3±85.7,対照群で220.8±127.3となった。血中リンパ球数は対照群に比べて研究群で高かったが(それぞれ1698±1438,1256±710)血清CRP、フェリチン、Dダイマーの減少は研究群でより顕著であった(それぞれp=0.02,p=0.005,p=0.03)。
おわりに
得られた知見によれば,イベルメクチンは重症のCOVID-19患者に使用しても,臨床的回復率の向上,予後の検査項目の改善,死亡率の低下をもたらすことができる。したがって,イベルメクチンはCOVID-19感染症の治療に使用できる代替薬として,あるいは既存のプロトコルに対する追加オプションとして考慮されるべきである。
はじめに
2019年12月に中国の武漢で最初の症例が報告されて以来、全世界を猛烈な勢いで包囲した重症急性呼吸器症候群新型コロナウイルス(SARS CoV-2)誘発性COVID-19のアウトブレイクは、パンデミックとして未だにその影響を及ぼし続けている。現在のデータによると、全世界で6600万人以上がこのパンデミックの影響を受け、150万人以上が新型コロナウイルス感染症(COVID-19)により死亡している[1, 2]。
現在、COVID-19の治療に使用されている抗ウイルス作用、抗炎症作用、免疫調整作用を有する多くの薬剤は、残念ながら完全な治癒をもたらすことはできない[3]。COVID-19の治療において有効性が検討されている薬剤の一つに、22,23ジヒドロアベルメクチンB1の構造で半合成的に生成されるアベルメクチン系の薬剤であるイベルメクチンがある。イベルメクチンは,ヒトの寄生虫症であるアカリ病,皮膚幼虫症,ストロンギロイド症,オンコセルカ症,疥癬などの治療に有効に用いられており,米国食品医薬品局(FDA)でもその経口使用が認められている[4]。抗寄生虫活性に加えて、ヒト免疫不全ウイルス(HIV-1)デングウイルス、ウエストナイルウイルス(WNV)などの多くのウイルスに対する抗ウイルス活性もあることが試験管内試験の研究で示されている[5]。
オーストラリアで発表された最近の試験管内試験研究では,SARS CoV-2に対するイベルメクチンの有効性が評価されている。試験管内試験でSARS CoV-2を感染させたVero/hSLAM細胞にイベルメクチンを作用させたところ,48時間後のウイルス量が99.8%減少したと報告されている[6]。
イベルメクチンは、ウイルスタンパク質を宿主細胞の核内に伝達する役割を担うインポリン(IMP)a/b1受容体を阻害することで、抗ウイルス作用を発揮するのではないかと報告されている[6]。これらのデータに基づき、イベルメクチンはIMP a/b1の阻害を通じてSARS-CoV-2の複製にも影響を与える可能性が示唆されている[7]。これらのデータをすべて評価したところ、COVID-19患者にもイベルメクチンが有効であると考えられた。
イベルメクチンの使用における大きな制限の1つは、中枢神経系(CNS)に対する薬剤の副作用の可能性である。イベルメクチン治療中の最も一般的な副作用は、発熱、頭痛、めまい、そう痒、発疹と報告されているが、オンコセルカ症の治療に使用する際には、脳症、錯乱、昏睡などの神経系の副作用も報告されている。これらのイベルメクチン投与後の重篤な神経系有害事象は、CYP3A4遺伝子の阻害やMDR-1/ABCB1遺伝子の多型が関与している可能性があるとされている[8]。
MDR-1/ABCB1遺伝子産物は、一部の動物や寄生虫において、イベルメクチンの消化器系や中枢神経系のバリアー細胞への侵入を制御し、キャリアー分子として作用することが文献で知られている。同様に,キャリアー分子をコードするCYP3A4遺伝子のハプロタイプや変異が,イベルメクチンの代謝速度を変化させることで,毒性作用や薬量不足を引き起こすことも報告されている[9]。
本研究では,重症COVID-19肺炎患者の治療にイベルメクチンを追加することの有効性を検討することを主な目的とした。また、本研究では、イベルメクチンの代謝を変化させて中毒症状を引き起こす遺伝子の有無を調査し、変異のある患者とない患者におけるイベルメクチンの安全性を調査することも目的とした。
材料と方法
この前向き、無作為化、対照、単盲検の第3相多施設共同臨床試験(2020年5月~9月に実施)では、変異のない患者の治療におけるイベルメクチン使用の有効性と安全性を評価した。事前に重症肺炎*と診断されて入院し、その後COVID-19の診断が呼吸器サンプルのポリメラーゼ連鎖反応(PCR)陽性で微生物学的にも確認された患者を本試験に組み入れた(https://COVID-19bilgi.saglik.gov.tr/depo/rehberler/COVID-19_Rehberi.pdf)。
*以下の基準のうち、少なくとも1つを満たす患者を重症肺炎患者とみなし、研究群と対照群にそれぞれ無作為に割り付けた。
a.頻呼吸30分以上、末梢毛細血管酸素飽和度(SpO2)90%未満、酸素吸入患者の酸素分圧(PaO2)/FiO2 300未満。
b.肺断層撮影でCOVID-19に特異的な放射線学的所見があること(両側の小葉状、末梢に位置する、びまん性の斑状地肌の不透明感)。
c.機械的換気が必要
d.急性臓器障害の所見;SOFA(sepsis-related organ failure assessment)スコアが2以上の患者
除外基準は以下の通りである。18歳未満の小児、妊娠中、授乳中、自己免疫疾患の併発、慢性肝疾患または慢性腎疾患、免疫抑制、MDR-1/ABCB1遺伝子のSNP変異および/またはCYP3A4遺伝子のハプロタイプと変異。
遺伝学的検査
無作為化により試験群に組み入れられた患者において、MDR-1/ABCB1遺伝子およびCYP3A4遺伝子の配列解析をSanger法で行うことにより、機能低下の原因となるハプロタイプおよび変異を調べた。変異のスクリーニングは、研究用医薬品であるイベルメクチンの初回投与時に行い、遺伝子検査の結果、変異が検出された患者ではイベルメクチンの投与を継続せず、これらの患者は研究から除外した。
試験デザイン
本研究は 2020年5月から 2020年9月にかけて、トルコの4つの異なる三次紹介研究教育病院で実施された。本研究は、Clinical Trials(Clinicaltrials.gov NCT04646109, 27/11/2020)に提出され、ヘルシンキ宣言と関連するガイドラインおよび規制に基づいて実施された。本研究の開始前に倫理委員会の承認(Afyonkarahisar Health Science University, Local Ethical Commitee 03.04.2020/139)を得た。対象基準を満たした患者において、試験群と対照群の区別は、一重盲検無作為化法で行われた。研究に参加した最初の患者から順に、奇数番号の患者を研究群、偶数番号の患者を対照群とした。
すべての参加者は、研究登録前にインフォームド・コンセントを得て、インフォームド・コンセント後、適格な患者は標準化された症状質問票と身体検査を受けた。さらに、全血球数検査、生化学的血液検査、初回のSARS CoV-2 PCRの結果、胸部断層撮影の所見を記録した。
トルコ保健省が作成した「COVID-19(SARS CoV-2感染症)ガイド」(https://COVID-19bilgi.saglik.gov.tr/depo/rehberler/COVID-19_Rehberi.pdf)で推奨されている、ヒドロキシクロロキン(2x400mg負荷量、2x200mg、po、5日間)ファビピラビル(2x1600mg負荷量、2x600mg維持量、po、計5日間)アジスロマイシン(初日負荷量500mg、その後250mg/日、po、計5日間)(HFA)からなる基準治療を、対照群および研究群のすべての患者に適用した。
また、対照群の患者には、基準治療に加えて、イベルメクチンを200マイクログラム/kg/日(36~50kgでは9mg、51~65kgでは12mg、66~79kgでは15mg、80kg超では200マイクログラム/kg)で5日間経腸投与した(イベルメクチン5mg/5ml溶液は、NEUTEC™ Pharmaceutical Company-Turkeyが「GMP(Good Manufacturing Practices)」認証条件で製造したもの)。
試験期間中、治療開始1日目、3日目、5日目および治療後1日目、3日目、5日目に患者の呼吸器所見および臨床検査値を記録し、追跡調査を行った。全患者の治療中に観察された副作用を記録した。
本試験における有効性および安全性評価のための主要評価項目および副次評価項目は以下のように決定された。
主要評価項目
イベルメクチン投与終了時の5日目に得られた患者の臨床効果および薬物副作用を評価した。機械的に人工呼吸を行っている患者の抜管、呼吸数26未満、室内空気中のSpO2値90%以上、酸素吸入を行っている患者のPaO2 / FiO2値300以上、SOFA(Sequential Organ Failure Assessment)スコアの2点以上の低下基準の存在を「臨床反応」として評価した。
副次評価項目
イベルメクチン投与終了後5日目(最終的には10日目)に得られた臨床効果及び薬物副作用を評価した。臨床的奏効については、以下の基準のうち少なくとも2つの基準が存在することを求めた。呼吸数が22~24,室内空気中のSpO2レベルが95%以上、酸素を必要としない、集中治療の必要性がない。
患者の治療効果を評価するために、血中リンパ球数、C反応性タンパク質(CRP)フェリチンおよびDダイマー値、多形核白血球/リンパ球(PNL/L)比の変化、SpO2値およびPaO2/FiO2比の変化を測定し、一次および二次エンドポイントにおいて両群間で比較した。また、フォローアップ期間終了時のPCR陰性率と死亡率を両群で評価した。
統計的評価
α誤差0.05,検出力0.95,標準化されたサイズ効果による中程度の効果量0.26のサンプルサイズで、IVM群30名、対照群30名の1:1の無作為化を行い、反復測定のうち鼻咽頭スワブ中の平均ウイルス量の変化における独立した2群間の差を検出するための計算を行った。検出力の解析は,Windows用コンピュータプログラムGpower version 3.1を用いて行った。値が繰り返し測定される量的変数については,グループ内比較にはFriedman検定を,対照群と研究群の比較にはMann-Whitney U検定を,カテゴリー変数にはカイ二乗検定を用いた。統計的有意性については,p=0.05を考慮し,SPSS 20.0のパッケージプログラムで解析を行った。
結果
本研究では、研究グループ36名、対照グループ30名、合計66名の患者が対象となった。研究グループの6名(16.7%)の患者は、遺伝子検査でイベルメクチンの代謝に影響を及ぼす変異が検出されたため、イベルメクチンの初回投与後に基準治療のみを継続し、研究から除外された。患者の人口統計学的データおよび治療前の臨床・検査所見を比較したところ、いずれのパラメータにおいても研究グループと対照グループの間に有意な差は認められなかった。両群の人口統計学的データおよび治療前の臨床・放射線学的所見を表1に示す。
表1 ベースラインにおける人口統計学的および臨床的特徴
| 患者の特徴 | 研究グループ、n = 30 | 対照群、n = 30 | P |
|---|---|---|---|
| 性別(男性)、n(%) | 21(70) | 19(63.3) | 0.58 |
| 年齢(年)(平均) | 58.17±11.52 | 66.23±13.31 | 0.15 |
| 併存疾患、n(%) | |||
| 糖尿病 | 9(30) | 10(33.3) | 0.78 |
| 高血圧 | 15(50) | 12(40) | 0.43 |
| 冠動脈疾患 | 5(16.7) | 8(26.7) | 0.34 |
| 心不全 | – | 1(3.3) | 0.31 |
| 慢性閉塞性肺疾患 | 6(20) | 3(10) | 0.27 |
| 悪性腫瘍 | – | 1(3.3) | 0.36 |
| 免疫不全 | – | 1(3.3) | 0.31 |
| 症状、n(%) | |||
| 熱 | 15(59) | 13(43.3) | 0.60 |
| 咳 | 16(53.3) | 14(46.7) | 0.60 |
| 喉の痛み | 3(10) | 1(3.3) | 0.30 |
| 呼吸困難 | 23(76.7) | 19(63.3) | 0.26 |
| 頭痛 | 5(16.7) | 2(6.7) | 0.22 |
| 弱点 | 13(43.3) | 11(3.7) | 0.59 |
| 筋肉痛 | 9(30) | 7(23.3) | 0.55 |
| 下痢 | 1(3.3) | – | 0.31 |
| 吐き気または嘔吐 | 1(3.3) | – | 0.31 |
| 記号(平均) | |||
| 体温(0 ℃) | 36.9±0.7 | 36.8±0.8 | 0.15 |
| 心拍数(1分あたり) | 88±12 | 92±18 | 0.47 |
| 呼吸数(1分あたり) | 24±5 | 24.7±0.7 | 0.92 |
| 収縮期血圧(mmHg) | 124.39±15.60 | 124.61±15.37 | 0.85 |
| 拡張期血圧(mmHg) | 75.64±9.79 | 73.43±8.47 | 0.07 |
| 吸気ラル、n(%) | 11(36.7) | 19(63.3) | 0.03 |
| SOFAスコア(平均) | 3.12±1.9 | 2.83±2.1 | 0.36 |
| 機械的換気要件、n(%) | 1(3.3) | 1(3.3) | 0.98 |
| 典型的な放射線所見、n(%) | 29(96.7) | 27(90) | 0.30 |
臨床的改善と死亡率
5日間の治療期間終了時(主要評価項目)の臨床的改善率は、研究グループで46.7%(14/30)対照グループで36.7%(11/30)であった。同様に、5日間のフォローアップ期間終了時(二次エンドポイント)には、臨床的改善率は、研究グループで73.3%(22/30)対照グループで53.3%(16/30)であったが、その差は統計的には有意ではなかった(それぞれp=0.43,p=0.10)(補足表1)。
両群で死亡した患者は、研究が終了するまで(平均3カ月)記録され、死亡率は研究群で6人(20%)対照群で9人(30%)に発症した(p=0.37)。治療前と追跡期間終了時のSOFAスコアの平均値を比較したところ、研究グループでは有意な減少(p=0.009)が認められ、対照グループでは増加(p=0.88)が認められた。フォローアップ期間終了時に両群のSOFAスコアを比較したところ、両群間に有意な差は認められなかった(p=0.50)。
追跡期間終了時に、研究群では16名(57.1%)対照群では8名(26.7%)の患者がSARSCoV-2のPCR検査を受けた。これらの患者のうち、研究グループの14人(87.5%)と対照グループの3人(37.5%)が陰性化し、その差は研究グループが対照グループよりも有意に高かった(p=0.01)。
酸素化の変化
両群とも、治療期間終了時のSpO2値(試験群で89.9±6.5から93.5±4.4%、対照群で89.7±5.1から93.0±3.3%)は、ベースライン時と比較して統計的に有意(試験群でp=0.005,対照群でp=0.003)に高くなっていることがわかった。SpO2レベルは、両グループともフォローアップ期間中に増加し続けた。しかし、フォローアップ期間終了時(研究群95.4±2.7%、対照群93.0±3.9%)には、研究群のSpO2の上昇は対照群よりも統計的に有意に高かった(p = 0.032)(図1)。
図1 SpO2値とPaO2/FiO2比の変化をグラフ化したもの
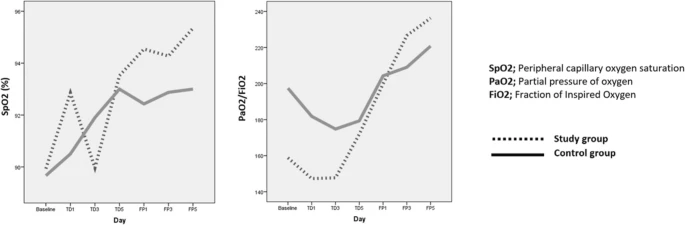
治療期間の開始時には、両群ともにPaO2/FiO2比の低下が観察され、その後、PaO2/FiO2比が上昇に転じることが観察された。にもかかわらず、治療期間終了時には対照群の増加は十分ではなく、ベースライン値よりもわずかに低い値にとどまっていることが観察された(197.4±102.3から 180.1±95.4へ)。一方、研究群のPaO2/FiO2比は初期値と比較して有意な増加が観察された(158.8±88.2から 178.9±98.2へ、p=0.00)。PaO2/FiO2比の増加は追跡期間中も両群で継続し、追跡期間終了時には、研究群と対照群で236.3±85.7と220.8±127.3となり、研究群では初期値に応じた増加が再び統計的に有意であることがわかった(p = 0.01)。フォローアップ期間終了時には、研究グループのPaO2 / FiO2比は対照グループよりも高かったものの、その差は有意ではなかった(p = 0.39)(図1)。
臨床検査値の変化
血液中のリンパ球数(細胞/mm3)
治療期間の終了時に、血液リンパ球数は研究グループで増加し、対照グループではわずかに減少した。研究グループでの増加は、統計的に有意であった(p = 0.010)。フォローアップ期間終了時には、ベースライン値と比較して両群ともに増加し、両群の増加は統計的に有意であった(p=0.008およびp=0.05)。両群を比較したところ、差は見られなかった(p=0.24)(図2)。
図2 検査項目の変化をグラフ化したもの
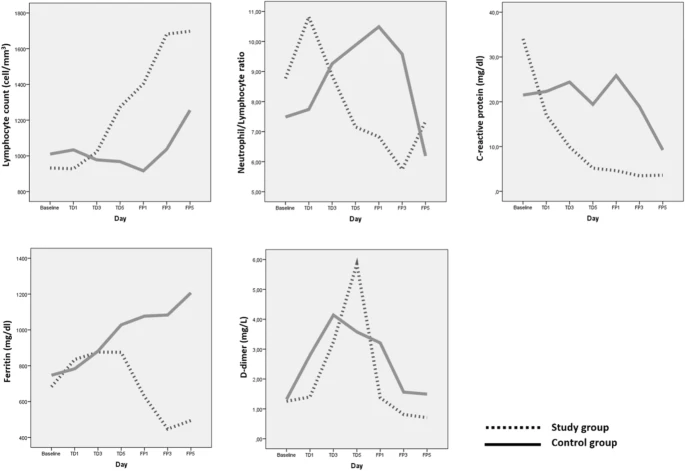
多形核白血球/リンパ球比(PNL/L)の推移
治療期間中、PNL/L比は研究群で減少し、対照群で増加した(両群ともp>0.05)。フォローアップ期間中、両群ともにPNL/L比は減少し、ベースライン値を下回った。しかし、この低下は両群で見られ(2群でp>0.05)追跡期間終了時の両群間の差は有意ではなかった(p=0.56)(図2)。
血清C反応性タンパク質(CRP)値(mg/dl)
血清CRP値は、治療期間中および追跡期間中、両群ともベースライン値に比べて徐々に減少し、研究群の減少(p=0.03)は対照群の減少(p=0.05)よりも有意であることがわかった。さらに、追跡期間終了時には、研究グループのCRP値は対照グループよりも有意に低いことが判明した(p=0.01)(図2)。
血清フェリチン値(mg/dl)
血清フェリチン値は、治療期間中、両群ともにベースライン値に比べて増加した(研究群、対照群ともにp=0.06,p=0.04)。しかし、試験群では追跡期間中に血清フェリチン値が減少し始め、追跡期間終了時にはベースライン値と比較して有意な減少(p=0.04)を示したが、対照群ではベースライン値と比較して増加し続けていることがわかった(p=0.01)。また、追跡期間終了時に両群のフェリチン値を比較したところ、対照群で有意に高い値を示した(p=0.005)(図2)。
血清Dダイマー値(mg/L)
治療期間中、血清Dダイマー値は初期値に比べて両群ともに有意に上昇した(研究群、対照群ともにp=0.003,p=0.02)。一方、経過観察期間では、両群ともにD-ダイマー値は減少に転じ、経過観察期間終了時には、研究群ではベースライン値よりも有意に低い値に達したが(p=0.04)対照群では十分な減少が認められず(p=0.11)ベースライン値よりも高い値となった。追跡期間終了時には、両群のD-ダイマー値の差は有意であった(p=0.03)(図2)。
遺伝子検査の結果と副作用
我々の研究では、イベルメクチンの初回投与時に血液サンプルを採取し、研究グループ全体でMDR-1/ABCB1遺伝子とCYP3A4遺伝子のハプロタイプ解析を行った。文献データに照らして、酵素活性を低下させ、機能を喪失させることが報告されている変異を有する症例(計6例)については、合併症を発症するリスク群であると予測して研究から除外し、これらの症例についてはイベルメクチンの投与を中止した。
試験から除外された6例すべてにおいて、ABCB1 (NM_000927.4)1236 T > C/2677 T > G/3435 T > C CGT, CTC, TTC対立遺伝子のいずれかが検出された。CGC/CGT, CGC/CTC, CGC/TTC, TTT/CGT遺伝子型は、合併症のある人にのみ認められた。CGCおよびTTT対立遺伝子は、合併症を発症していない患者でも最も頻繁に観察される対立遺伝子であるため、合併症の発症はCGT、CTC、TTC対立遺伝子に関連していると考えられた。
この6名の患者のうち1名では、ABCB1遺伝子にS400I(c.1199G > A)CM068130,rs2229109が追加で検出された。S400Iの変化は膜輸送を低下させるため、薬剤耐性を引き起こす可能性があるというデータ(PMID:16917872)があるが、この患者さんにはイベルメクチンが原因と考えられる合併症は認められなかった。
また、6名の患者のうち3名に興奮症状が見られたが、1~2日で自然に消失した。この3名のうち2名では、ABCB1(NM_001348945.1):c.210G > A(p.Gly70=)の遺伝子型が追加で検出された。また、6名の患者のうち、残りの2名に、せん妄様行動、興奮、攻撃的態度、意識変容などの重篤な副作用が認められた。このうち1名は、ハロペリドールで副作用を抑え、1週間以内に症状が消失した。もう1人の患者は、副作用が2週間続いたが、レミフェンタニルとデクスメデトミジンでコントロールし、1ヶ月間の入院で経過観察した後、完全に回復して退院した。また、最も症状が重く長引いたこの患者さんでは、CYP3A4遺伝子にもc.1191C>T(p.T363M)の変化が追加で検出された。
なお、遺伝子所見により副作用の危険性があるため、初回投与時にイベルメクチンの投与を中止し、試験から除外した患者以外には、イベルメクチンに関する副作用や合併症は認められなかった。
また、イベルメクチン以外の薬剤の副作用を患者で評価したところ、対照群の2名に悪心・嘔吐、対照群の1名にALT(アラニントランスアミナーゼ)の2倍の上昇が認められた。これらの副作用はいずれも、患者の治療を中止しなければならないほど重篤なものではなかった。
考察
SARS CoV-2によるCOVID-19感染症は、7~14.8%の割合で重症のウイルス性肺炎を引き起こし、特にリスク群の一部の患者ではその症状が顕著である。その死亡率は2〜4%と報告されている。残念ながら、COVID-19患者に対する治療法は証明されていないが、現在COVID-19の治療に使用されている抗ウイルス作用、抗炎症作用、免疫調整作用を持つ薬剤がある[3, 10, 11, 12, 13, 14]。
高齢(65歳以上)高血圧(HT)または冠動脈疾患の存在、糖尿病(DM)および男性の性別は、厳しい予後と関連することが示されている危険因子である[12, 14, 15]。この文献に従って、我々の研究では、重度のCOVID-19患者に最もよく見られる3つの併存疾患は、高血圧、DM、冠動脈疾患であることが確認された(表1)。我々の研究では、高血圧は対照群よりも研究群の方が多かったものの、他の併存疾患は対照群の方が多かった。しかし、この差は統計的に有意ではなかったため、研究結果に悪影響を及ぼすとは考えられなかった。我々の研究は、重度のCOVID-19患者の治療におけるイベルメクチンの有効性を調査した初めての前向き無作為化比較試験である。
文献上では、COVID-19患者の治療選択肢の一つであるヒドロキシクロロキン、ロピナビル・リトナビル、レムデシビル、ファビピラビルの各薬剤の有効性を評価したプロスペクティブ・ランダム化比較試験がいくつか存在する[16,17,18,19]。これらの研究を調べると、レムデシビルはプラセボと比較して回復時間を短縮し、ファビピラビルはウイルスクリアランスを増加させることが報告されている[18,19]。
今回の研究では、HFA併用療法にイベルメクチンを追加した患者(研究群)は、HFA併用療法のみを受けた患者(対照群)に比べて、臨床的に改善する割合が高いことがわかった。同様に、追跡期間終了時の死亡率も、HFA併用療法のみを受けていた対照群に比べて、研究群では低いことが判明した。試験群と対照群の間の臨床的改善と死亡率の差は統計的に有意ではなかったが、これらの差は、より大規模な患者シリーズを含む新たな研究でより明確に示される可能性がある。
本研究の対象となった患者が重症のCOVID-19であることを考慮すると、これまでに研究された抗ウイルス剤よりもイベルメクチン治療でより良い臨床効果が得られたと考えることができる。フロリダで行われたレトロスペクティブコホート分析では、COVID-19患者にイベルメクチンを単回投与することで死亡率が低下したことが報告されており、今回の結果を裏付けている[20]。しかし、我々の結果は、COVID-19感染症の治療において、イベルメクチンが標準的な治療プロトコルの代替または追加の選択肢となる可能性を示唆している。
SpO2 は、COVID-19 肺炎を発症したほとんどの患者と、重篤な予後の患者のすべてにおいて、生理的レベルを下回っている。また、重篤な予後の患者では、酸素吸入やその他の支持療法を行っても、SpO2値はほとんどの場合、正常限界に達しない。患者の治療に伴うSpO2レベルの上昇は、治療に対する臨床反応の重要な指標となる[21, 22]。我々の研究では、SpO2レベルは、治療期間中および追跡期間中に両群ともベースラインレベルと比較して上昇したが、追跡期間終了時には研究群で所望のレベルに達し(95.4%)対照群よりも有意に高いことがわかった。したがって、イベルメクチンを治療に加えることで、現行の治療プロトコルよりもコービッド-19肺炎の治療にプラスの効果があると言えるであろう。
実際のところ、軽度から中等度の重症COVID-19患者を対象に、イベルメクチン+ドキシサイクリン単回投与併用療法とアジスロマイシン+ヒドロキシクロロキン併用療法の有効性を比較した研究では、イベルメクチンを含む併用療法の方が、より短期間で症状の改善が得られることが報告されている[23]。
血液中の酸素濃度の最も良い指標はPaO2/FiO2比である。その正常範囲は300〜500mmHgであり、200mmHg未満であれば重度の低酸素血症であることを示している。この比率が上昇すると、重度のCOVID-19患者の臨床的改善を示する[24]。私たちは、死亡リスクの高い重症のCOVID-19患者を研究対象とした。研究群の患者の初期のPaO2/FiO2比は対照群よりも低く、治療期間の初めにはわずかな減少が見られたが、治療終了時および追跡期間にはベースラインレベルおよび対照群と比較して高い値に達したことは、治療にイベルメクチンを加えることの有効性の指標として評価できる。また、PaO2/FiO2比での十分な効果が試験後期に得られたことから、重症肺炎が発症する前の早い時期にイベルメクチン治療を開始することで、より良好な結果が得られることが示唆された。軽度または中等度のCOVID-19肺炎の患者にイベルメクチンを使用できるという示唆は、さらなる研究によって裏付けられるべきである。
COVID-19感染症では,血清フェリチン,CRPおよびD-ダイマー値,血中リンパ球数,PNL/L比などが予後との関連性が示されている検査項目である。特に、治療を行ってもリンパ球数が変化せず、フェリチンやDダイマーの値が高いままの患者さんでは、予後が悪いことが報告されている。そのため、これらのパラメータの変化は、治療を受けている患者さんの臨床反応の実質的な指標と考えられている[25,26,27,28]。
我々の研究では、治療にイベルメクチンを追加することで、対照群と比較して研究群の患者でより顕著かつ早期にリンパ球数が増加したことが観察された。また、予後の指標の一つであるPNL/L比は、研究群では治療期間の早い段階で低下し始めたのに対し、対照群では上昇した。研究グループでは、この低下が追跡期間においても有意に続いた。一方、対照群では、PNL/L比の低下は追跡期間の中盤になってから認められた。この結果は、COVID-19感染症の治療において、イベルメクチンが既存のプロトコルに比べて早期に治療効果をもたらすことを示している。
文献的には,50歳以上でPNL/Lが3.13以上の患者の予後は悪く,集中的なフォローアップが必要であると報告されている[27]。したがって,イベルメクチンによるPNL/L比の早期低下は,COVID-19感染症における集中治療期間の短縮と予後の改善に寄与すると考えられる。観察期間終了時には,両群ともにPNL/L比はベースライン値と比較して低下しており,研究群の低下は対照群よりも顕著であったが,両群間に有意な差はなかった。PNL/L比の低下は、追跡期間中の3日目までは研究群で有意に続いたが、5日目にはわずかに上昇した。この理由として、患者から検出された二次的な細菌感染(不特定多数のデータ)による白血球増加が考えられる。
血清CRP値とD-ダイマー値が試験群で有意に早く減少したこと、血清フェリチン値が試験群で有意に減少した一方、対照群では増加し続けたことは、イベルメクチンを追加することで重症のCOVID-19感染症への治療の効果が高まることを示す指標と考えることができる。
本疾患の予後をフォローする上で貴重なこれら5つの検査項目(血中リンパ球数、血清フェリチン、CRP、Dダイマー値、PNL/L比)の結果を評価したところ、イベルメクチンがCOVID-19の治療に有効であることが判明した。これは、より早い治療効果をもたらすと思われ、COVID-19の治療においてイベルメクチンまたは現在の治療プロトコルにイベルメクチンを追加することが選択肢の一つになるという考えを支持している。
本研究では、イベルメクチンを投与された患者には、標準治療を受けた患者と比較して異なる副作用は認められなかった。しかし、MDR-1/ABCB1またはCYP3A4遺伝子変異を有する患者6名のうち、イベルメクチンの初回投与を受けた3名に軽度の副作用(焦燥感)が、2名に重度の副作用(焦燥感、せん妄様行動、攻撃的行動、意識変化)が認められた。
ABCB1 (NM_000927.4)1236 T > C/2677 T > G/3435 T > Cの遺伝子型の判定は、薬物使用時の副作用のリスクを判断する上で重要だ。ABCB1 (NM_000927.4)1236 T > C/2677 T > G/3435 T > Cの遺伝子型は、試験から除外された6名の患者全員から検出された。そこで、ヘテロ接合の場合も含めて、このハプロタイプを合併症発症の主要なハプロタイプと考え、研究終了時には、この予測がほぼ正しかったと判断した。
この6名の患者のうち1名では、ABCB1遺伝子に加えて、S400I(c.1199G > A)CM068130,rs2229109の遺伝子型が見つかった。S400I変化は膜輸送を変化させ、薬剤耐性を引き起こす可能性があると文献に記載されているが(PMID:16917872)、この患者さんではイベルメクチンに関連する副作用は発症しなかった。
ABCB1 (NM_001348945.1): c.210G > A(p.Gly70 =) の遺伝子型は、軽度の副作用を呈した3名の患者さんのうち2名にも認められた。一方、副作用のない31名の患者のうち2名に同じ遺伝子型が検出されたことから、この遺伝子型の変化はイベルメクチンの代謝に影響を及ぼさないと考えられる。
イベルメクチンに関連して最も重篤で長期間持続する副作用を発症した我々の患者では、ABCB1遺伝子変異に加えて、CYP3A4遺伝子の変化がc.1191C > T(p.T363M)であることが判明した。CYP3A4遺伝子に検出されたT363Mの変化は、酵素の機能を低下させることが文献で報告されている。そのため、文献上では薬剤の投与量を減らすことが推奨されている(HGMD:CM015322)。イベルメクチンの初回投与後、興奮、せん妄様症状、攻撃性、意識変化が認められ、鎮静のためにレミフェンタニルとデクスメデトミジンが投与され、試験から除外された患者である。また、ミダゾラムの投与も必要で、この患者では症状が消失するまでに約2週間を要した。この患者の臨床症状が他の薬剤の副作用を持つ患者と比較して長く、重篤であった理由は、ABCB1とCYP3A4の両方の変化が共存していたためと考えられた。この知見は、CYP3A4遺伝子がイベルメクチンの代謝にも有効かつ重要であることを示唆している。
本研究では,イベルメクチンにより副作用が発現した患者において,重度の副作用を呈した2名は2週間以内,軽度の副作用を呈した3名は1~2日で症状が完全に消失した。これらの結果から、イベルメクチンの代謝に影響を与えるような変異を持たない患者さんであれば、本剤を安全に使用できることが示唆された。コミュニティレベルや大規模な集団での使用を決定した場合,実際には時間的な制約から配列解析ができないため,中枢神経系に影響を及ぼす脳症様の症状について患者を注意深くフォローする必要があり,これらの患者では適切な治療とフォローアップによって症状をコントロールすることができると考えられる。
我々の研究は、COVID-19患者を対象に、イベルメクチン投与量の変化を引き起こす可能性のあるMDR-1/ABCB1およびCYP3A4遺伝子変異を調査した、文献上初めての無作為化比較前向き研究である。COVID-19の治療薬として期待されているイベルメクチンの毒性作用の可能性については、Calyらの研究のように文献上で警告されており、FDAもこの問題に特に注意を払っている[7, 29]。しかし、今回の結果は、この点に関する懸念に光を当てている。
本研究の限界として、使用した薬剤の相互作用が評価されていないことが挙げられる。しかし,患者の臨床状態では説明できないような検査値の変化がなかったことから,薬物の有害な相互作用はないと考えている[30]。
結論
本研究では、イベルメクチンがCOVID-19感染症の治療に使用できる代替薬、または現在の治療プロトコルへの追加オプションとなる可能性が示唆された。重症のCOVID-19患者に使用した場合でも、臨床的回復の増加、予後の検査項目の改善、死亡率の減少をもたらすことができる。MDR-1/ABCB1および/またはCYP3A4遺伝子変異のない患者では、イベルメクチンは重篤な副作用を引き起こすことなく安全に使用でき、出現した副作用は適切な治療により除去できることが予測される。これらの結果は、イベルメクチンがCOVID-19感染症の治療に期待できることを示唆しており、我々の研究で得られたこれらの結果は、さらなる研究、特に早期のCOVID-19患者を含むより多くの症例で裏付けられるべきである。
