Contents
頭頂葉の前頭連合体優位の変性は、軽度アルツハイマー病におけるてんかんのリスクとなる
pubmed.ncbi.nlm.nih.gov/31507508/
2019 Aug 22
はじめに
アルツハイマー病(AD)は、認知機能低下の主要な原因である。てんかんはADに頻繁に併存する疾患である。これまでの研究では、ADに関連するてんかん発作の危険因子を分析しているが、軽度のAD症例におけるてんかんのバイオマーカーはまだ不足している。目的:本研究の目的は、てんかん発作を併発している軽度アルツハイマー患者における神経心理学、皮質の厚さ、脳容積測定値の相関関係を分析することである。
材料と方法
我々のデータベースから軽度のAD患者を選び、構造的磁気共鳴画像、24時間脳波計、および詳細な神経心理学で調べた。神経生理学を含むてんかん学的データに基づいててんかんの診断を行った。共分散加重一般線形モデルを用いて、明らかな臨床発作のある軽度AD患者とない軽度AD患者の神経心理学的パターン、臨床的および疫学的特徴、皮質の厚さ、体積値をレトロスペクティブに分析した。
結果
軽度AD患者の26%にてんかん発作が認められた。発作のある患者はない患者に比べて視空間得点が悪かった(p = 0.003)。発作のある患者は頭頂部の厚さが小さく(p=0.018)、左前庭(p=0.007)および右前庭(p=0.005)の厚さの減少と関連していた。視空間パフォーマンスは、頭頂葉の厚さ(r = 0.67; p = 0.002)および楔前部の体積(r = 0.612; p = 0.005)と正の強い相関関係があった。結論 軽度のADであっても、てんかん発作はよく起こる。視空間能力の顕著な低下は、ADの初期段階におけるてんかん発作のレッドフラッグであり、神経変性過程における頭頂葉の早期関与を示すことがわかった。
今回の結果は、頭頂葉の変性が軽度のADに伴うてんかん発作の敏感なマーカーであることを示唆しているため、臨床医は構造的MRIで示される萎縮のパターンに特別な注意を払う必要があります。今回の結果は、てんかん発作が、皮質後部の早期変性を伴うより進行の早いタイプのADに関連している可能性を示唆するこれまでのデータを裏付けるものである。
アルツハイマー病における発作は再発性が高く、疾患経過の悪さと関連する
pubmed.ncbi.nlm.nih.gov/32488295/
2020 Oct;26
背景
アルツハイマー型認知症(AD)では、発作が重要な合併症の一つとされている。アルツハイマー病の発作に関連する臨床パラメータについては、これまでに矛盾した結果が報告されている。また,治療方針を決定する上で重要な発作再発リスクに関するデータも不足している。
方法
National Alzheimer’s Coordinating Centerのデータを解析した。アルツハイマー病における発作の有病率と罹病期間との関連を調べた。発作とAD発症年齢、認知機能、機能的パフォーマンス、発作再発リスクとの関連を調べた。
結果
20,745人が調査対象となった。AD認知症では、7.5ヶ月以内の発作再発リスクは70.4%であった。発作歴は、認知症状の発症年齢の早さ(発作ありvs.なし:64.7歳vs.70.4歳;p<0.0001)と、認知機能パフォーマンスの低下(平均MMSEスコア:16.6 vs.19.6;平均CDR-sum of boxesスコア:9.3 vs.6.8;p<0.0001;罹病期間と年齢で調整)と関連していた。発作の有病率は、ADの認知症期間が長くなるにつれて増加し(標準化されたOR = 1.55, 95% CI = 1.39-1.73, p < 0.0001)認知症期間4.8年での1.51%から11年での5.43%まで上昇した。認知症患者の発作の頻度は、健常者に比べて高かった(活動性発作。1.51% vs. 0.35%, p < 0.0001, OR = 4.34, 95% CI = 3.01-6.27; 痙攣履歴。3.14% vs. 1.57%, p < 0.0001, OR = 2.03, 95% CI = 1.67-2.46)。)
結論
ADの認知症における発作は、例外的に高い再発リスクを特徴とし、認知症状の経過が悪いことと関連している。認知症患者は、特に後期の病期において発作のリスクが高い。今回の知見は、ADにおける発作歴の評価の必要性を強調するとともに、個々の治療方針の決定に役立ち、AD関連のてんかんの体系的な治療研究の必要性を強調するものである。
アルツハイマー病が共有するてんかんのメカニズム 遺伝性てんかんというユニークなレンズで見ると
pubmed.ncbi.nlm.nih.gov/34281185/
2021 Jul 1
遺伝性てんかんの研究から、遺伝性てんかんとアルツハイマー病などの神経変性疾患との間に共通のメカニズムがあることがわかっていた。両疾患は、一見すると無関係な疾患であり、年齢的にも正反対の時期に発症するが、共通のメカニズムが存在する可能性があり、てんかんの研究はADの病因に対するユニークな洞察を提供すると考えられる。神経変性疾患は典型的な晩発性疾患であるが、臨床症状が現れるずっと前から基礎的な病理が発生している可能性がある。これらの疾患の初期段階における病態生理は十分に解明されていないが、メカニズムに基づいた治療法を開発するためには重要である。ADでは、認知機能の低下よりもはるかに早い段階で、興奮性/抑制性(E/I)バランスの乱れによる発作感受性の上昇と無症候性てんかん状活動が確認されている。てんかん状活動の増加は、認知機能の低下に直接寄与する初期段階の主要な病理であると考えられる。従来のADモデルマウスでは、慢性的な疾患経過のため、病態の初期段階をモデル化することは非常に困難であり、ましてや潜在的な非痙攣性てんかん状活動、ADの病態、認知障害が複雑に絡み合っている。
我々は、GABAA受容体やGABAトランスポーター1の変異など、GABA経路に影響を与える遺伝子変異を中心に、GEを幅広く研究していた。GEを研究するために開発されたいくつかのマウスモデルとGEから得られた知見は、ADを理解するためのユニークな機会を提供できると考えている。
GEの研究のために開発されたいくつかのマウスモデルとGEから得られた知見は、ADの初期段階の病理、小胞体ストレス、E/Iの不均衡、さらには認知機能障害への寄与など、ユニークな機会を提供すると考えられる。この総説では、GABAA受容体やGABAトランスポーター1に影響を与える突然変異から得られる知見を中心に、GEとADの間のオーバーラップするメカニズムを紹介する。また、GEとADの両方において、E/Iの不均衡と有害なてんかん状の発生のメカニズム、小胞体ストレス、膜タンパク質の輸送障害、シナプスの生理機能の複雑な相互作用についても詳しく述べる。
疾患の移行期における時間的表現型:てんかんとアルツハイマー病への応用
www.ncbi.nlm.nih.gov/pmc/articles/PMC7374015/
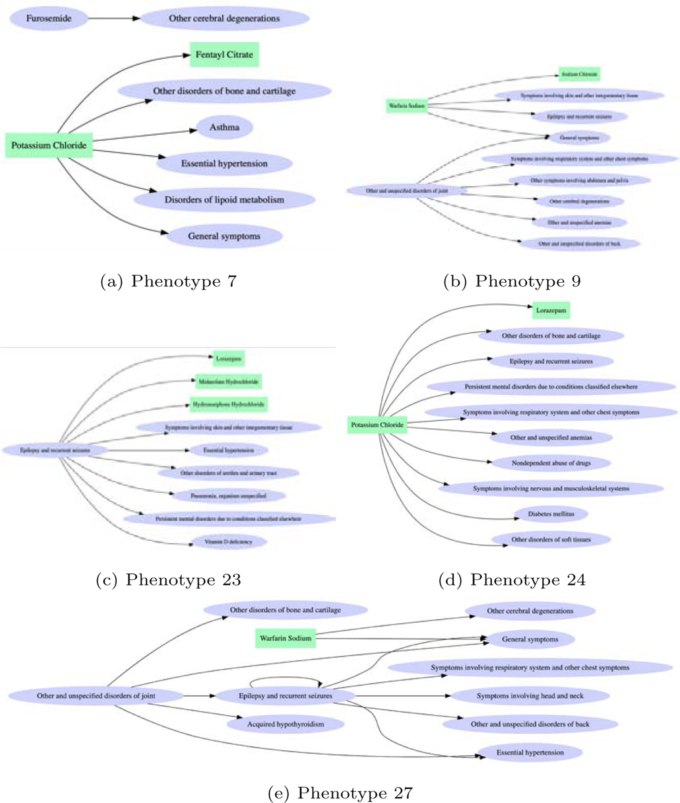
3.3. 発見された表現型
(1) 表現型7では塩化カリウムがハブとなっているが、これはこれらの患者が低カリウム血症に罹患していたか、または低カリウム血症の設定があったことを示している。低カリウム血症は、てんかん発作に関与している可能性があり[25, 26]、また、ADにおいてルビジウムとカリウムの濃度が変化することが新たに示された[27]。カリウムの欠乏は、脂質代謝の著しい低下につながり[28]、ADとの関連性を強めている[29]。カリウムと高血圧からADへの同様の関連性があるようである。興味深い縦断的研究では、カリウムを節約する利尿剤の使用がADのリスクを有意に減少させることがわかった[30]。
(2)表現型9は、ワーファリンを服用している患者と関節障害に関連しており、次いで腰痛やその他の脳変性障害の診断を受けている。表現型9の多くのエッジは表現型27と類似しているが、後者の方が構造が深く、背中の障害に加えて頭や首の症状が加わっている。これは、てんかんの重症度を示していると思われ(転倒事故との関連性が高いと思われる)AD発症のリスクを示す指標になるかもしれない。
(3)表現型23は、てんかんと診断されて発作を繰り返し、すぐに尿道・尿路の問題、肺炎、ビタミンD欠乏、精神障害などの問題を抱える、少し変わった患者のグループのようである。肺炎や精神障害はADの末期患者で診断されることが多いので、この表現型グループには何か特別なものがあるのかもしれない。つまり、患者はすでにAD(あるいは軽度認知障害)を発症していたが、診断が遅れたのかもしれない。
(4)表現型24は、ピペラシリンナトリウム(抗菌薬)の投薬に関連している。ピペラシリンナトリウムは、主に肺炎や皮膚疾患の治療に使用され、その後、骨や軟骨のその他の障害、軟部組織のその他の障害などの診断が続く。ピペラシリンナトリウムはペニシリン系抗生物質に属し、しばしば痙攣やミオクローヌスを引き起こすことがわかっている[31]。このことは、ピペラシリンが発作を悪化させ、ADのリスクを高めることを示しているのかもしれない。
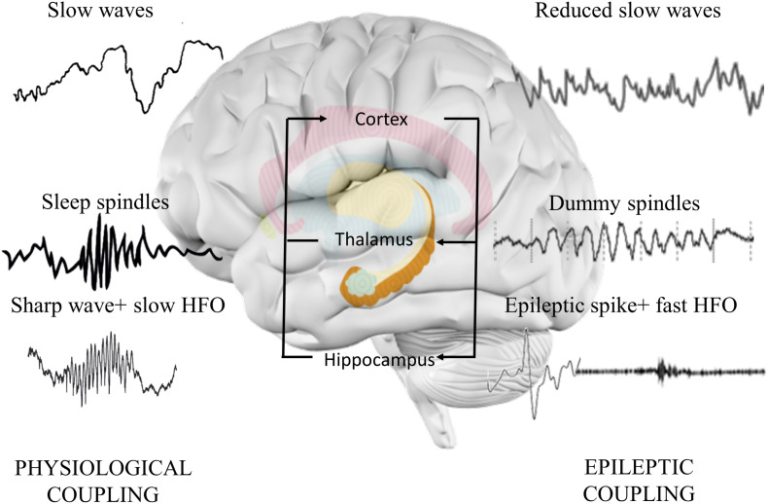
アルツハイマー型認知症におけるてんかん発作の縦断的研究
www.ncbi.nlm.nih.gov/pmc/articles/PMC6904279/
認知機能
てんかん発作が疑われるAD患者は、臨床的にてんかんが疑われないAD患者と比較して、認知機能の低下が加速される。このことは、NCEE群ではACE-IIIスコアの平均値が74.02から72.11(1.91ポイント)に、COMB群では73.48から65.30(8.19ポイント)に低下したことからも明らかである。NCEE群はメモリークリニックの初診時およびPrESIDeのベースライン評価時にACE-IIIスコアが高かったが、COMB群とのスコアの差が有意になったのは12ヵ月後の追跡評価時であった。
ACE-IIIスコアを領域別に分析した結果、すべての領域でパフォーマンスが低下していることがわかった。てんかん群で最大の低下が見られたのは、テストの注意力、流暢性、記憶の各項目であった。てんかん群と非てんかん群の低下の差は、テストの注意力と流暢性の要素で最も大きかった。すべての認知症患者は、時間の経過とともに認知機能が低下するが、てんかん患者の認知機能の低下は、より大きく、より多くの領域に及んでおり、ACE-III総合スコアでの有意差につながっている。このことは、てんかん発作を経験したアルツハイマー病患者は、発作を経験していない患者に比べて、より大きな、より多くの領域に関わる認知機能の低下を示すという見解を支持するものである。一方、NCEE群では、記憶領域の低下が最も大きく、言語領域と視空間領域は比較的安定しており、流暢性と注意領域の低下は小さいことが示された。
これらの結果は、てんかんがこれらの患者のより重篤な病状のマーカーであるのか、あるいはてんかんがこのより急速な変化の原動力であるのかという疑問を提起している。ADの臨床症状の進行は、アミロイドβ(Aβ)プラークとリン酸化タウ(p-tau)神経原線維のもつれが脳内のさまざまな領域に広がることと関連している(21、22)。てんかん発作を経験した人は、すべての領域でより急速な低下を示している。その理由は明らかではないが、神経細胞の興奮性亢進とタウの拡散との関連性を調べた研究がいくつかあり(23-25)、発作が神経細胞を介して(24, 26, 27)、シナプスを介して(28-30)タウの拡散に寄与していることが示唆されている。さらに、タウPETを用いた研究では、認知症患者におけるタウの分布と認知機能障害の間に直接的な相関関係があることが示されている(31、32)。てんかん発作を持つ患者では、認知機能がより急速に低下することは、てんかん発作の結果としてタウの伝播が加速されることに関連している可能性がある(33、34)。逆に、AD患者の中には、この疾患のより積極的な形態を経験している人もおり、この表現型の異質性が、これらの患者のてんかん発作を引き起こしている可能性もある。
抗てんかん薬治療
抗てんかん薬による治療を受けた患者と受けていない患者との間で、認知機能の低下に有意な差は認められなかった。有意差が認められなかったのは、これらの群の規模が小さかったこと、あるいは追跡調査の期間が限られていたことに起因する可能性がある。認知症患者や認知症の動物モデルにおける抗てんかん薬の役割を検討した他の研究では、矛盾した結果が報告されている(35-38)。これらは、患者の選択、治療期間、薬剤の投与量の違いによって説明できるかもしれない。認知症に伴うてんかんの治療ガイドラインを定めるには、さらなる研究が必要である。
結論
アルツハイマー病患者ではてんかんのリスクが高まり、この集団ではてんかん発作の疑いがあると認知機能の低下速度が加速するとされる。この認知機能の低下は、ACE-III検査で測定されたすべての認知機能の領域で起こる。この低下の大きさの違いは、この検査の注意力と流暢性の領域で最も大きく、この集団では実行機能が特に影響を受けることが示唆された。
AD患者のてんかん発作に関する従来の考え方では、てんかんは末期症状として発症するため、てんかん発作を治療しても疾患の進行に影響を与えたり、患者の機能を改善したりすることはできないと考えられてた。しかし、本研究で得られた知見は、他の最近の報告(18、44)と同様に、てんかん発作がADの早期臨床段階にある患者で発生し、認知機能低下の促進と関連していることを示唆している。この知見は、記憶障害の発症後にてんかん発作を経験した可能性のある患者を特定し、禁忌でない場合には抗てんかん薬の投与を検討するよう、臨床医に促すものである。
アルツハイマー病患者様のてんかん治療について
www.ncbi.nlm.nih.gov/pmc/articles/PMC6464746/
主な結果のまとめ
レベチラセタム(LEV)群、フェノバルビタール(PB)群、ラモトリギン(LTG)群の間で、発作の自由度、発作頻度の50%以上の減少、有害事象に有意な差はなかった。その結果、LEVは認知機能を改善し、LTGは抑うつ状態を緩和する可能性があり、PBとLTGは認知機能を悪化させ、LEVとPBは気分を悪化させる可能性があると考えられた。