Contents
Environmental insults: critical triggers for amyotrophic lateral sclerosis
www.ncbi.nlm.nih.gov/pmc/articles/PMC5472994/
要旨
背景
筋萎縮性側索硬化症(ALS)は、下・上運動ニューロンの急速な喪失を特徴とする致死的な神経変性疾患である。複雑な疾患であるため、大部分の症例では加齢と遺伝子環境の複雑な相互作用が関与している。
主な内容
大規模な並列シークエンシング技術を用いてALSの遺伝的感受性を解明することには大きな進歩があったが、一方で環境汚染は依然として疑われているが、ほとんど解明されていないリスク源である。メンデル無作為化を用いたいくつかの研究では、環境負荷とALSの関連性が強化されてきたが、今のところ決定的な結果は得られていない。我々は、遺伝的要因、加齢、環境的要因をリンクさせた新しいALSモデルを提案している。このモデルはALSがどのようにして発症するかのメカニズムを提供し、環境負荷が重要な役割を果たしていることを示している。
結論
これまでに得られた証拠から、遺伝的な欠陥がミトコンドリア機能障害を引き起こす可能性が示唆されており、それがALSの一次的な感受性を確立すると考えられている。その基礎となるメカニズムをさらに研究することで、ALSの病態に光を当てることができるかもしれない。環境破壊はALSの重要な誘因であり、特に他の毒物感受性遺伝子を持つ高齢者では、環境破壊はALSの重要な誘因となる。ALSの誘因を特定することは、そのリスクを持つ人々の予防戦略につながる可能性がある。
キーワード
筋萎縮性側索硬化症、環境危険因子、メンデルランダム化、ミトコンドリア機能不全、引き金、発症、拡散
背景
筋萎縮性側索硬化症(ALS)は、急速に進行し、普遍的に致命的な運動系の神経変性疾患である。筋萎縮性側索硬化症は、上側(前頭部運動野)と下側(脊髄と脳幹)の運動ニューロンの変性によって特徴づけられ、進行性の麻痺と死に至り、通常は呼吸不全が原因となる。発症のピークは60歳代半ば頃で、ほとんどの患者は症状が出てから2~5年以内に発症する[1, 2]。ALSは家族性と散発性に分類される(表1),1)が、これら2つの病型は一般的に臨床的にも病理学的にも区別がつかない[1,3]。散発性ALSの原因は未だ研究課題となっている[4]。最近の超並列シークエンシング技術により、疾患遺伝子の発見が容易になり、現在では50以上の遺伝子の中から、散発性ALSとの関連性が確認されている[5, 6]。
表1 家族性および散発性ALSの遺伝的特徴
| 家族性ALS | 散発性ALS | |
|---|---|---|
| 割合 | 10% | 90% |
| 病気のカテゴリー | 単一遺伝子 | 繁雑 |
| 継承 | 常染色体優性(最も一般的)劣性 X連鎖 |
遺伝子-環境相互作用 遺伝子-遺伝子相互作用 常染色体劣性変異体 Denovo変異体 |
| 一般的な遺伝子(%変異) | C9orf72リピート拡張(24%) SOD1(20%) TARDBP(1–5%) FUS(1–5%) その他の遺伝子(まれまたは不明) |
C9orf72リピート拡張(5–10%) SOD1(1–3%) その他の遺伝子(まれまたは不明) |
略語
C9orf72 染色体 9 オープンリーディングフレーム 72 遺伝子、SOD1 スーパーオキシドジスムターゼ 1 遺伝子、TARDBP TAR DNA 結合タンパク質遺伝子または TDP-43,FUS fused in sarcoma 遺伝子
特に散発性のALSは複雑な疾患であると考えられている(表1).1)。遺伝子-時間-環境モデルが提案されており、環境リスクと加齢が既存の遺伝的負荷と相互作用し、その後に自己減退して死に至るという未知のメカニズムを持つとされている[1]。散発性ALSのリスクの約60%は遺伝的に決定され、残りの40%は環境因子によるものである [4, 7]。ALSの危険因子として確立されているのは、高齢と男性の性別の2つだけである。多くの環境因子が散発性ALSの原因とされていたが(包括的なレビューは参考文献[1,8]を参照)決定的に証明されたものはなかった。また、散発性ALSはどのようにして発症するのか、どのようにして広がるのか、なぜ運動ニューロンを中心に発症するのかなど、いくつかの重要な問題が未だに解明されていない。本論文では、メンデルランダム化解析から得られた、ALSに関連したいくつかの一般的に考えられている環境障害に焦点を当てる。また、遺伝子と環境の相互作用がALSに与える影響や、ALSにおける環境因子の役割をさらに調査する方法についても検討する。遺伝的要因や年齢の上昇と環境要因の役割をリンクさせたALSの発症モデルが提案されている(図11)。
図1
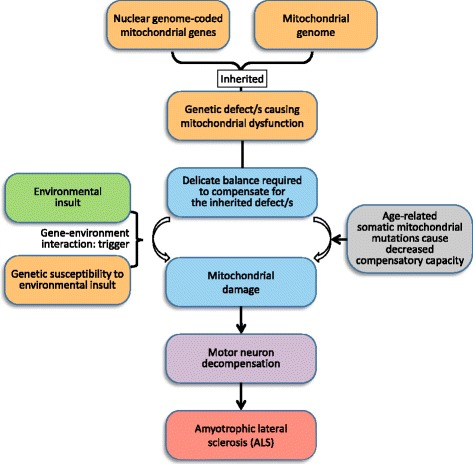
ALSの発症モデル。第一の欠陥は、核ゲノムにコードされた遺伝子またはミトコンドリア遺伝子のいずれかに由来する遺伝的なミトコンドリアの異常である。突然変異キャリアのミトコンドリアは、このような欠陥を補うための闘争と微妙なバランスをとることになる。
補償能力は、加齢とそれに続く体性ミトコンドリア突然変異の蓄積に伴って減少する。特に毒性物質に対する遺伝的感受性がある場合には、環境の影響を受けると、ミトコンドリアはさらに損傷を受け、運動ニューロンでの補償能力低下の引き金となる。
生き残ったニューロンで興奮性伝達を介して補償しようとすると、ニューロン自身の代謝負荷が増大し、この微妙なバランスに悪影響を及ぼすことになる。このような効果的でない補償の試みは、ミトコンドリアの危機と神経細胞のアポトーシスの連鎖反応を引き起こし、ALSを引き起こす。
運動ニューロン系の特徴
運動ニューロン
運動ニューロンは、細胞体、軸索、樹状突起、telodendriaから構成され、随意運動を調整し、体のさまざまな筋肉に信号を伝達する。軸索は、信号の振幅を低下させることなく、神経インパルスを長距離にわたって伝達する長い過程である。例えば、ヒトの坐骨神経の運動ニューロン軸索は、腰椎の脊髄から始まり、下肢を通って足に達する。デンドライトは、1つまたは多くの他のニューロンとシナプスを形成する拡張部を形成し、テロデンドリアは神経筋接合部で筋肉と接触する。
アストロサイト
アストロサイトは、哺乳類の脳の総細胞数の20~40%を占めている[9]。これらのグリア細胞は、細胞体から放射される多数のプロセスによって、ニューロン、樹状突起、軸索間のネットワークを形成し、機能的なユニットを形成している[10]。グリア細胞は運動ニューロンの活動的なパートナーであり、ニューロンシナプスとの接触を通じて、収束した情報を統合したり、修正したりする。
ミトコンドリア
ミトコンドリアは、カルシウムの恒常性維持、エネルギー供給、代謝合成、アポトーシスにおいて複数の役割を果たしている[11]。神経筋接合部を含む運動ニューロンでは、ミトコンドリアが高密度に存在する。中枢神経系は他のどの人間の臓器よりも多くのエネルギーを消費し、身体の総使用量の最大20%を占めている[12]。大脳ATPの生産の約90%は、酸化的リン酸化[13,14]を介してミトコンドリアで発生する。ATPの利用は、主にリン脂質代謝、タンパク質合成、神経伝達物質のサイクリング、および細胞膜を介してイオンの輸送を含む様々な細胞機能をサポートする軸索で発生する。ナトリウム、カルシウム、カリウムイオンは、神経細胞が発火に向けて再充電できるように、ATP消費を犠牲にして細胞の膜を連続的かつ積極的に通過する[13,14]。
ミトコンドリアゲノムは核ゲノムの約15倍の突然変異率を持っている[11]。これは、ミトコンドリアの高濃度の活性酸素種、保護ヒストンの欠如、DNA修復機能の制限と関連している可能性がある。ミトコンドリアの機能に関して重要なことは、核内ゲノムにコードされているミトコンドリア標的タンパク質が1158個予測されていることである[15]。ミトコンドリアは、老化および神経変性に寄与する細胞プロセスの複雑なバランスにおいて中心的な役割を果たしている[11,16](図1)。興味深いことに、アストロサイトは、機能的なミトコンドリアを供給することで、ニューロンの充電ステーションとして機能する[17]。
ALSにおける環境負荷
ALSに関連する遺伝子の変異がALSにつながることが明らかになりつつある。しかし、これらの突然変異のどれもが、病気がどのようにして始まり、どのように広がっていくのかを説明するものではない。その理由の一つは、病気のメカニズムに関する知識が不足しているため、どのような環境障害に焦点を当てるべきかを決定することが困難であるからである。
感染症
ウイルス感染や細菌感染は、いくつかの疫学研究や臨床研究でALSの危険因子として示唆されている[18-20]。エンテロウイルスの核酸は、対照群よりも散発性ALS患者の脊髄に多く存在することが確認されている [21-23]。エンテロウイルスファミリーの一種であるポリオウイルスは、選択的に運動ニューロンに影響を与え [20] 、小児期にポリオ髄炎に罹患した人は、40年後までに進行性の運動ニューロン障害を発症する可能性があり、ポストポリオ症候群と呼ばれている [24]。試験管内試験での研究では、ヒトの運動ニューロンまたはグリア細胞の腸管ウイルス感染が持続する可能性があることが示唆されている [25,26]。これは、運動ニューロンに大きな影響を与え、アストロサイトのグルタミン酸輸送の変化、ミトコンドリア活性の低下、および酸化ストレスに対する抵抗力の低下をもたらす可能性がある[27,28](図1.ほとんどの症例の神経組織に炎症性変化がないことから、運動ニューロンに対する急性ウイルス攻撃は考えにくい。しかしながら、ニューロンにおける持続的なウイルスの存在は、ALSにおいて役割を果たす可能性のある非定型的な障害をもたらす可能性がある。
ポリオウイルス受容体は霊長類に特異的な核内エンコード遺伝子であり、ポリオウイルス複製の第一段階でポリオウイルスの細胞受容体として機能している。その産物は、免疫グロブリンスーパーファミリーに属する膜貫通型糖タンパク質である。ポリオウイルス受容体は、胚発生期の運動ニューロンの分化に関与している可能性がある。ヒトポリオウイルス受容体の変異体は、ポリオウイルス感染の結果に影響を与え、後にALSにつながる持続感染を引き起こす可能性がある[29, 30]。
最近、散発性ALS患者の死後脳組織において、潜在的なヒト内因性レトロウイルス群K(HERV-K)の神経発現が検出された[31]。HERV-Kゲノムまたはそのenv遺伝子を単独で培養ヒト神経細胞に試験管内試験でトランスフェクションすると、神経細胞の退縮と神経細胞死を引き起こす可能性がある。HERV-K env遺伝子を発現するトランスジェニックマウスでは、内在性の皮質興奮性の異常と運動機能の障害が認められ、生後10ヶ月までに50%が死亡する[31]。
有機リン酸塩
有機リン酸塩は運動ニューロンを損傷する能力があるため、ALSの発症の危険因子として疑われている[32-34]。有機リン酸塩を含む化学物質は、肥料、除草剤、殺菌剤、殺虫剤などに含まれており、農業や家庭で広く使用されている[2, 35]。有機リン酸塩の毒性は、神経伝達物質であるアセチルコリンの活性を停止させる酵素であるアセチルコリンエステラーゼの急性阻害に関係している。有機リン酸塩への慢性的な暴露は、アセチルコリンエステラーゼを不可逆的に阻害することにより、進行性の脳障害を誘発し、結果としてコリン作動性受容体の過剰なシミュレーションと興奮毒性を引き起こす可能性がある[36]。様々な有機リン化合物の代謝物 [37] もまた、神経細胞の損傷を誘発し、遅発性の神経毒性を誘発する可能性がある。有機リン酸塩の解毒を阻害する遺伝的感受性が、後述するように、農薬とALSの関連性が報告されている原因となっている可能性がある。
民間パイロット、航海士、客室乗務員においてALS発症率の増加が報告されている[33, 38]。航空機の機内にはエンジン空気が無濾過で供給されているため、有機リン酸塩への曝露がこのグループの関連として提案されている。この空気には、オイルシールやベアリングの漏れ、流体ラインの破裂、不適切なメンテナンス、またはその他の故障により、熱分解したエンジン潤滑油や油圧作動油が含まれている可能性がある。エンジン潤滑油には約4%のリン酸トリクレシルが含まれており[39]、作動油にはリン酸ブチル[40]などの他の有機リン酸塩が含まれている。
重金属
鉛、水銀、カドミウム、セレンを含む重金属は、ALSの発症に関与していることが示唆されている [32, 35, 41, 42]。このレビューでは、個々の金属をすべて網羅することはできないが、水銀と鉛については興味がある。水銀は、元素、有機、無機の様々な物理的状態で存在する。水生環境では、元素水銀は細菌や藻類によってバイオメチル化される。得られたメチル水銀やエチル水銀などの有機化合物は、魚類や甲殻類に蓄積され、食物連鎖を経てヒトに至る。中枢神経系における水銀中毒は、細胞の代謝を混乱させ、いくつかの細胞成分を分解し、最終的には細胞死と臨床疾患に至る。水銀毒性の生化学的メカニズムと臨床像は、個人の遺伝的感受性、金属の化学形態、曝露の長さと濃度に依存している。
ALSと鉛への職業的曝露との関連が提案されている [43, 44]。人間の活動からの鉛には、化石燃料の燃焼、鉱業および製造業が含まれる。溶接またははんだ付け材料に曝露された労働者は、ALSを発症する危険性があるようである [45]。神経系に対する鉛の毒性効果には、鉛脳症(主に小児)および運動神経障害(主に成人)がある。鉛の半減期は、血中では1ヶ月、海綿骨(膝蓋骨など)では約4年、コンパクトな骨では約20年である。骨格筋もまた、鉛の貯蔵場所となりうる[46]。近年、ガソリン、塗料やセラミック製品、コーキング、パイプのはんだなどからの鉛の供給源は減少している[47]ので、欧米諸国のアルツハイマー病で最近示されたように、将来的にALSの発生率が減少するかどうかは興味深いところである。
身体活動
運動能力と激しい身体活動はALSにおいて重要であると考えられてきた。イタリアのプロサッカー選手ではALSが6倍に増加することが報告されており、プレー時間とALSリスクの間には用量反応関係がある[48]。過度の身体活動、繰り返しの頭部損傷、農薬や栄養補助食品、違法物質への暴露などが、これらのサッカー選手のリスクの背景にある可能性がある。身体的ストレスは活性酸素種の産生を促進する可能性があり、運動は神経筋接合部を介してヒトの運動ニューロンへの毒性物質の取り込みを増加させる可能性があることがさらに示唆されている[42]。激しい身体活動は農作業に特徴的であり、有機リン酸塩への曝露とALSの共因子である可能性がある[34]。
その他の環境因子
有機塩素系殺虫剤、ピレスロイド、燻蒸剤、喫煙、電磁場、電撃、シアノトキシン、兵役など、他にも多くの環境因子がALSとの関連で研究されている[8, 49]。殺虫剤、溶剤、工業化学物質の過去の使用に由来する難分解性有機汚染物質もまた、ALSの危険因子となり得る。しかし、利用可能なデータはしばしば矛盾している。例えば、いくつかのパーキンソン病研究では、有機塩素は神経変性と関連しているが[50,51]、ALSにおけるその役割については議論の余地がある。アルドリン、ジエルドリン、DDT(ジクロロジフェニルトリクロロエタン)およびタキサフェンへの曝露はALSのオッズ比を増加させる傾向があるが、年齢の上昇によって交絡が生じる可能性がある[49]。喫煙はALSの危険因子として報告されているが[52, 53]、結果は相反するものであり、明確な用量反応関係が欠如している[1, 54]。これまでのALS疫学研究の限界については、で議論する。
兵役は、複合因子の集合体であるため、危険因子の異なるカテゴリーを表している。兵士はしばしば神経ガスや害虫から身を守るためにコリン作動性阻害剤の予防的治療を受けていた [55]。派兵は通常、集中的な身体活動、感情的ストレス、身体的または心理的外傷に加えて、タバコの喫煙や飲酒などの有害な生活様式因子を伴う。軍人はまた、環境ウイルス、重金属、有機リン酸塩、鼻咽頭ラジウム、ヒーターや発電機からの排気、高強度レーダー波、汚染された食物、現場での爆発にさらされる可能性がある[55,56]。最後に、軍で広く使用されているディーゼル燃料への曝露が、軍人のALSのリスク増加の背景にある可能性が示唆されている[56]。
ALS疫学の課題
ALSは様々なユニークな環境で発生する可能性がある。
ALSの環境的危険因子は長年にわたって研究されてきたが、明確な結論は出ていない。散発性ALSはおそらくヒト特有のものであり、神経変性はホモ・サピエンスの進化の結果、大脳新皮質領域とその相互接続に影響を与えるからである。霊長類では、ALSの影響を最も受けやすい上下の運動ニューロンが直接つながっているのは、高等霊長類だけである。並外れて長い運動軸索とその複雑な活動は、高いエネルギー消費を必要とする。人間が直面する複雑な自然環境、構築された環境、社会環境は、人間の種に特有のものである。例えば、重金属は、空気中の粒子状物質を吸い込んだり、パイプから鉛が浸出した水を飲んだり、魚介類のチェーンを介して蓄積された水銀を食べたりすることで、人間の体内に侵入することがある。ALSの動物モデルは人間とは寿命が異なり、人間は80年以上生きるのが一般的であるが、マウスは3年しか生きられない。したがって、ミトコンドリアDNAの1日のターンオーバーはマウスとヒトでは同じであるため、高齢のヒトは高齢のマウスよりもミトコンドリアDNAの複製サイクルがはるかに多いことになる[16]。したがって、動物モデルの使用は、複雑なヒトの障害、特に環境リスク因子との関係ではあまり実りがないことが証明されているのは驚くに値しない。
ALSにおける環境リスク調査の限界
環境因子はALSの発症に関与していると広く考えられている。しかし、知られている環境危険因子はどれも結論的に決定されていない[1]。疫学的研究のデザインや選択バイアスについての批判がなされてきた。ALSに対する環境影響に関するこれまでの研究の多くは、サンプル数や効果量が少なく、母集団のコントロールがなく、レトロスペクティブな研究である。データ収集の多くはアンケートや調査による自己申告に頼っており、リコールバイアスが発生しやすい。例えば、調査データと血液中の汚染物質の測定値との間に一致性がないことなどは、曝露の誤分類が原因となっている可能性がある [33]。公表されている研究のほとんどは、毒性物質曝露の頻度と強度に関するデータを欠いている[57]。さらに、参加者のALS感受性などのゲノム情報がない場合、環境リスク因子の有意性の解釈は困難である。
観察研究では、環境負荷がALSの発症や進行にどのような影響を与えているかを評価することは困難である。仮に環境負荷と結果が関連していたとしても、ALS自体が環境負荷の強さを不明瞭にしてしまうことがあるため、因果関係の方向性を特定することは困難である。例えば、ALSでは鉛レベルが高くなることがあるが、ALS自体が骨粗鬆症や筋肉の消耗の際に骨および/または筋肉に蓄積された鉛が放出されることにより、鉛レベルに逆の影響を与えることがある[46]。これらの限界を克服するための戦略が提案されている。集団対照を用いたプロスペクティブ研究は理想的であるが、詳細な面接、環境負荷のモニタリング、および発生率が低いALS患者の十分な数をリクルートするための長期間の投資を必要とするため、実施するのは困難である。
環境負荷の遺伝的プロキシ
メンデル無作為化の応用は、環境曝露を評価するための変数として遺伝的プロキシ(例えば、一塩基変種、SNV)を使用するため、因果関係に光を当てることができる(図(図2)2)[58, 59]。メンデルのランダム化の原理は、メンデルの第二法則である独立アソート、すなわち、配偶体形成と受胎の間に起こる親から子孫への遺伝子のランダムなアソートに基づいている。このことは、SNVが集団レベルでの従来の観察研究を歪める可能性のある交絡因子と関連していないことを意味し、また、遺伝子型は受胎時に決定されるため、そのような変異体が逆因果関係の影響を受ける可能性は低いことを示唆している。SNVが有効な手段変数であるためには、それが曝露と確実に関連していなければならず、関心のある曝露を介してのみ転帰と関連していなければならない(図2)。そのようなバリアントは、アウトカムに影響を与える他の要因とは独立していなければならない[60-62]。この戦略は、2つの関連する目的を持ってALS研究に使用することができる。
(1)因果関係の存在を証明する証拠を提供すること、
(2)環境障害に生涯曝露された場合の影響の大きさを正確に推定することである。もし環境因子が本当にALS発症の原因となる危険因子であるならば、その環境因子の影響を受けやすい遺伝的プロキシがALSのリスクを増加させると予想される。
この戦略の3つの例を以下に示す。
1.ウイルス
ポリオウイルスは溶連性ウイルスであるが、他のエンテロウイルスのように持続感染を確立することもできる[25, 30]。ヒトポリオウイルス受容体遺伝子のSNVは、感染の結果に影響を与えうる。例えば、野生型ヒト神経芽腫細胞の56%はポリオウイルス感染後28時間生存したが、特定のSNV(rs1058402)を有する細胞では生存率が79%に上昇した[29]。散発性ALS患者110人と進行性筋萎縮症(PMA、ALSの下位運動変種)30人を対照280人と比較したところ、SNV rs1058402の頻度はPMA患者で20%、ALS患者で12%で、対照群の7%よりも有意に高かった[63]。これらの結果は、ALSにおけるエンテロウイルスの病原性の役割を支持するものであり、感染した神経細胞はポリオウイルスの初期の細胞溶解作用を生き延び、持続的な感染を確立する可能性がある。ポリオウイルス受容体の発現は脊髄運動ニューロンでは弱く、筋運動端板では強いことから、神経筋接合部が下部運動ニューロンへのウイルス侵入経路として機能していることが示唆されている[64]。老化に伴って脊髄運動ニューロンにゆっくりと蓄積する細胞病理学的効果は、ALSの引き金となる可能性がある(図11および図2)。図11および図2)2)。持続的なエンテロウイルス感染は抗ウイルス剤で治療できるので、この危険因子は治療の対象となりうる[65]。
2.有機リン酸塩
有機リン酸塩は、チトクロームP450系によって反応性オキソンに活性化され、これらのオキソンはPON1によってコードされるパラオキソナーゼによって加水分解される。PON1は加水分解酵素活性のレベルが異なり、そのような変異は遺伝的に決定される[66]。パラオキソナーゼ活性の低下をもたらすまれなPON 1の変異体またはハプロタイプはALSと関連している [67, 68]。したがって、有機リン酸塩を解毒する能力を低下させる遺伝子変異は、ALSの発症に有利である可能性がある。しかし、PON 1とALSとの関連は大規模なメタ解析では再現されていない[69]。
3.重金属
メタロチオネイン(MT)は、水銀などの重金属の解毒に関与する金属結合タンパク質である。MTの欠乏は重金属毒性を増加させるが(図2)過剰発現は保護的である[70]。金属転写因子-1(MTF1)は、重金属に応答してMTの発現およびアップレギュレーターとして機能し[71]、MTF1のいかなる変化もMTのアップレギュレーションを混乱させ、運動ニューロンを重金属損傷に対して脆弱な状態にしてしまう可能性がある(図(図2)2)。186人の散発性ALS症例と186人の対照者を対象に、MT遺伝子ファミリーとMTF1の関連遺伝子変異を調べたところ、症例と対照者の間でMT解毒とMTF1遺伝子のいくつかのSNVの分布に有意な差が認められた[72]。したがって、金属解毒の効率の低下はALSの危険因子である可能性がある。
図2
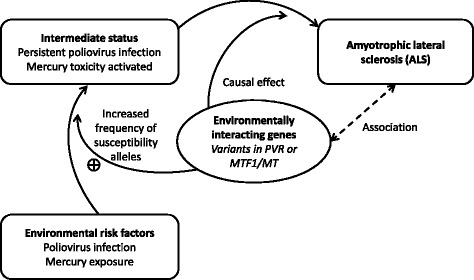
ポリオウイルス感染と水銀曝露の例を用いた環境要因の遺伝的プロキシ。これは、ALSにおける環境因子の因果関係を推論するためのメンデルランダム化アプローチを示している。ALSは中間的な状態と環境相互作用遺伝子(破線)を介して環境因子と関連している。しかし、相互作用遺伝子の効果は方向性があり、中間状態の確立を促進する。このような効果は、環境障害の存在下でのみ発生する。すべての遺伝子型は受胎時に決定されるので、相互作用遺伝子の感受性対立遺伝子がALSの結果に逆の影響を与えることはない。
ALSにおけるミトコンドリアの役割
ALSはどのようにして発症するのか?
多くの証拠がALSのミトコンドリア機能不全を示唆している。細胞内のミトコンドリアの形状と位置は生体エネルギーに重要な役割を果たしている[11]。脊髄前角のALSのミトコンドリアで観察された形態学的変化には、サイズの縮小、クレストの破壊、浮腫、結晶化、空胞化などがあり、代謝障害を示している[73]。これらの変化は、年齢をマッチさせた15の対照試料とは有意に異なっていたので、加齢や死後の過程によるものではないと考えられる。興味深いことに、肝臓や筋肉細胞でも同様の変化が見られ[74, 75]、ミトコンドリアの欠損はミトコンドリアゲノムまたは核ゲノムのいずれかから遺伝するという概念を裏付けるものである[74, 75](図11)。
ミトコンドリアの突然変異は、母性的に遺伝するか、体細胞の変化から生じる。これらの突然変異は、神経クローナルの拡大を介して、加齢とともに進行的に増加することがある[76](図1)。高い代謝率およびATP消費は、ヒトの運動系をエネルギー欠乏に対して特に脆弱にする。筋萎縮性側索硬化症オンライン遺伝学データベース(v6)の126個のALS遺伝子に含まれるのは、ALS遺伝子をミトカルタとクロスオーバーさせたときに見出される、1個のミトコンドリア遺伝子(MT-ND2)および10個の核ゲノムコードされたミトコンドリア遺伝子(ATXN2,CHCHD10,GARS、MAOB、OGG1,OMA1,PARK7,SOD1 SOD2およびSPG7)である[5,15]。他のミトコンドリアバリアント、特に核ゲノムにコードされたバリアントは、その集団頻度や明確な機能性が乏しいために、意味不明のバリアントと誤解釈される可能性がある。44人のALS患者の両親トリオを対象とした研究では、ALSはホモ接合体または複合ヘテロ接合体の変化によって常染色体劣性の方法で感染する可能性があることが明らかになった[6](表(表1).1)。したがって、ALSに関連する劣性対立遺伝子の頻度は予想以上に高く、全エクソーム研究や全ゲノム研究で使用されたカットオフ値によって悪影響を受けてフィルタリングされる可能性がある。
ミトコンドリアがアストロサイトからニューロンに移行するという知見は、ニューロンにおけるミトコンドリアの重要な役割と、ALSの発症にアストロサイトが関与している可能性を裏付けるものである[17, 77]。ALSの発症に長年疑われてきた水銀は、血管周囲のアストロサイトによって取り込まれて最初に中枢神経系に入り、ミトコンドリア内に優勢に存在することから、この点は興味深い。さらに、加齢に伴うミトコンドリア含量の減少や、分裂後のニューロンにおける体細胞の変化は、ミトコンドリア機能の低下につながる可能性がある[79]。
ALS感受性のミトコンドリア変異体は、成人期の半ばから後半まで「スイッチが切れた」ままである可能性は低いが、初期の段階ではあからさまなミトコンドリア疾患を引き起こすには十分ではないかもしれない。これらの個体の運動ニューロンシステムは、そのような欠陥または欠陥を補償するために一定の闘争をしながら、微妙なバランスを保っている可能性がある(図1)。補償能力は加齢とともに低下し、妥協したミトコンドリア機能は最終的に崩壊する可能性がある。環境の障害は、ミトコンドリアにさらに影響を与え、特に相互作用遺伝子の感受性対立遺伝子の存在下では、ALS感受性個体における分解プロセスの引き金となり得る(図11,図12,図13,図14)。図11および2)2)。また、ミトコンドリアの欠陥を持つアストロサイトが、いくつかの環境負荷(水銀など、上記参照)の有害作用の標的細胞である可能性があり、一方で、神経細胞の死は、運動ニューロンと密接に関係するアストロサイトへの最初の負荷に続く二次的なイベントである可能性がある[10, 77]。
持続的なウイルス感染、有機リン酸塩、重金属、および激しい運動は、欠陥のあるミトコンドリアに代謝負荷をかけ、あらゆる代償能力を枯渇させる可能性がある(図1)。興奮毒素、酸化ストレス、またはカルシウムホメオスタシスの変化を含む他のメカニズムが細胞損傷に関与している可能性がある[77]。疾患の誘因はALSの根本原因として偽装される可能性があり、環境研究では相反する結果を生み出す可能性がある。環境負荷は、同じような強度と暴露時間であっても、ALSに罹患していない人に同じような影響を与える可能性は低いと考えられる。
ALSの広がり
運動ニューロンの喪失は、同じ筋肉を支配する生き残った運動ニューロンに余分なストレスを与え、その喪失を補うための代謝ニーズを増大させる。この段階のアストロサイトは、分解したニューロンを救出しようとして資源を流用してしまうため、軸索やニューロン細胞体の正常な維持管理を行うことができなくなる可能性がある。その結果、より多くのニューロンが分解過程に入ることになる。SOD1変異キャリアでは、症状の発症前に運動単位数の減少と皮質興奮性の増加が認められる [80, 81]。このような興奮性の補填は有用ではなく、代わりにミトコンドリアの危機と神経細胞のアポトーシスの連鎖反応を開始させる可能性がある。興奮毒性は、ニューロンへのカルシウムの流入を増加させ、酸化ストレスを開始させ、ニューロンの死をもたらす可能性がある。ミトコンドリア危機はまた、プロテアソームまたはオートファジーによるタンパク質分解に影響を与え、細胞ストレスを増幅させる可能性がある。筋消耗時に放出される筋蓄積重金属などの環境リスク因子[46]は、劣化をさらに加速させる可能性がある。特に、最近の研究では、通常は運動ニューロンを抑制するヒトの脊髄介在ニューロンが、加齢に伴って重金属を摂取することが示されている。
この提案されたモデルは、ALSの臨床的・病理学的パターンとしてよく知られている、ある中枢神経系の領域から始まり、他の隣接する領域に「拡散」するというパターンを説明することができる。この広がりは、分解するニューロンのカスケードによるものである可能性がある。このモデルでは、環境物質がシナプスや細胞外小胞、膜接触を介して、あるニューロンから別のニューロンに移動するという推定を避けることができる。提案されたモデルは、ALSの進行を加速させるための拡散と「毒性の強さの獲得」のための分解プロセスを含むユニークなメカニズムを提供している。
提案モデルと既知のALSの特徴との関連性
ALSの発症には6つの段階があると考えられている[84]。これらのステップをさらに特定することで、新たな予防法や治療法の開発につながる可能性がある。我々が提案するモデルは、遺伝子-時間-環境仮説[1]と一致しており、複数のステップを含んでいる(図1)。このモデルは、環境的な障害がALS発症の引き金になるという、ALS発症の単一の根源となりうる可能性を提示している。
これまでに得られた証拠から、一次的な遺伝的欠陥がミトコンドリアの機能不全を引き起こし、運動ニューロンのALS発症の引き金となる可能性が示唆されている(図1)。
環境の障害は、その後、ミトコンドリア機能の微妙なバランスを崩し、効果的でない補償プロセスのために伝播と加速が続く。
金属の恒常性は、多くの細胞タイプにおいて酸化ストレス応答と密接に結びついている[71]。ALS運動ニューロンにおける微小管とニューロフィラメントの枯渇は、遺伝的素因に起因する可能性がある。その結果、通常の輸送が障害され、十分な栄養素が不足しているためにミトコンドリアの機能に影響を与えることになるであろう。
環境障害もまた、アストロサイトやミクログリアの活性化を含む神経炎症などの有害反応を誘発し、運動ニューロンへの直接的な毒性を引き起こす可能性がある。
持続的なウイルス感染は、分解過程の一つの環境的引き金となりうる。中枢神経系の組織や筋肉のマイクロバイオーム研究は興味深いが、関連するウイルスが単離されたり、血清学的反応が十分に生成されたりする可能性は低い。このモデルは、ウイルスがあるニューロンから別のニューロンに拡散するという概念のパラドックスを説明している。むしろ、あるニューロンの細胞ストレスは、envタンパク質の発現を介して、隣接するニューロンの内因性レトロウイルスを活性化するために拡散する可能性がある[31]。
メンデル無作為化分析によって示唆されたように、ALS患者の中には重金属を解毒する能力が低下しており、これは運動ニューロンが持続的な生存能力の限界を超えてしまうのに十分であり、結果として運動ニューロンの喪失と分解過程が開始されることになる。興味深いことに、運動能力の低下や筋肉への神経刺激は、骨粗鬆症や筋肉のかさ高の低下によって鉛などの重金属がより多く放出されるため、分解プロセスを加速させる可能性がある[46]。
提案されたモデルは、複数のステップを含む遺伝子と環境の相互作用を強調している。いくつかの重要な環境障害は発生初期に発生している可能性があり、それを特定することは困難である。例えば、不顕性エンテロウイルスやポリオウイルス感染、重金属への曝露は、人生の早い段階で発生し、後の人生では病気の開始や加速段階でのみ役割を果たすことがある。異なる感受性を持つ個体は、ミトコンドリア機能に異なる影響を与える異なる遺伝的欠陥を受け継ぐ可能性があり、異なる環境誘因の強度を必要とする。ミトコンドリア関連遺伝子の大規模な欠陥を受け継いだ場合には、偶発的または軽度の引き金しか必要としないかもしれないが、他の遺伝的変異体は、ALSの発症を誘発するためには、軍事配備などの環境負荷の組み合わせを必要とするかもしれない。
結論
これまでに得られた証拠から、遺伝的な欠陥がミトコンドリア機能障害を引き起こし、それがALSの一次的な感受性を確立することが示唆されている。その基礎となるメカニズムをさらに研究することで、ALSの病態に光を当てることができるかもしれない。環境破壊はALSの重要な誘因であり、特に他の毒物感受性遺伝子を持つ高齢者では、環境破壊はALSの重要な誘因となる。ALSの引き金を特定することは、リスクのある人たちの予防戦略につながる可能性がある。
