Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7139347/
Int J Mol Sci.2020 Mar;21(6):1915.
2020年3月11日オンライン公開doi:10.3390/ijms21061915
pmcid: pmc7139347
Dominique Belpomme1,2,3,*、Philippe Irigaray1,2
概要
2009年より、電磁波過敏症(EHS)および化学物質過敏症(MCS)の自己申告症例2000例以上を対象としたデータベースを構築してきた。このデータベースでは、EHSの30%がMCSを合併しており、EHS/MCS合併例の37%ではMCSがEHSの発生に先行していることが示されている。
EHSとMCSは、臨床的には類似した症状を示し、生物学的には、低悪性度の炎症とO-ミエリンに対する自己抗体を含む自己免疫反応を特徴とすることができる。
さらに、EHS患者の80%は、末梢血中に1つ、2つ、または3つの酸化ストレスバイオマーカーが検出されることから、これらの患者は、全体として、真の客観的体性障害を呈していることになる。
さらに、超音波脳血流計と経頭蓋超音波ドプラ法を用いて、中大脳動脈の血行動態に異常があることを示し、側頭葉の被殻視床部に組織脈波指標の欠損を局在させ、辺縁系と視床の関与を示唆した。
これらのデータは、EHSが診断、治療、予防が可能な神経病理学的疾患であることを強く示唆するものである。EHSは、何百万人もの人々を巻き込む新たな世界的疫病となりつつあるので、私たちは世界保健機関(WHO)にEHSを神経系疾患として国際疾病分類に加えるよう要請している。
キーワード 電磁波過敏症、多剤耐性、神経疾患、酸化ストレス、メラトニン、O-ミエリン、炎症、ヒスタミン、高周波、極低周波、電磁場
1.はじめに
電磁波過敏症または電磁波過敏症(EHS)という用語は、1991年にWilliam Reaによって、電磁波に曝露している間に健康被害を報告する患者の臨床状態を特定するために初めて提案された[1]。その後、1997年に欧州の専門家グループが欧州委員会に提供した報告書において、この用語は、EMF曝露を示唆するこの異常な病理を臨床的に記述するために使用された[2]。
2002年には、フランスのSantiniらが、デジタル携帯電話の使用者や無線通信基地局周辺住民に同様の不耐症状があることを報告している[3,4]。2004年、世界的にEHSが増加していると思われたため、世界保健機関(WHO)は、EHSの定義と特徴を明らかにするための国際科学ワークショップをプラハで開催した。プラハの作業部会では、EHSが電磁波曝露によって引き起こされるとは認めなかったものの、EHSを「電場、磁場、または電磁場を放射する機器を使用したり、その近くにいる間に個人が健康に悪影響を与える現象」と明確に定義した[5]。その後、WHOはEHSを有害な健康状態として認めている[6]。しかし、1996年にベルリンで開催された国際化学物質安全プログラム(IPCS)主催の多重化学物質感受性(MCS)会議[7]では、こうした未知の新しい病態を「特発性環境不耐性(IEI)」という言葉で修飾することが推奨された。このように、プラハのワークショップでは、EHSと電磁波曝露の因果関係が証明されておらず、電磁波曝露と臨床症状を結びつける生理学的メカニズムも証明されていないことから、EHSという用語を使用せず、「電磁波による特発性環境不耐性(IEI-EMF)」という用語でこの特定の病態を表すことが提案された。
これは確かにWHOが2005年のファクトシート296[6]で公式に述べたことで、「EHSは、化学物質への低レベル環境暴露に関連する別の障害であるMCSに似ている…」と示し、「非特異的症状」と「明確な診断基準がない」ために、この「障害をもたらす状態」は医学的に診断できないとしている。また、WHOは2002年に極低周波(ELF)、2013年に高周波(RF)をそれぞれ発がん性あり(グループIIB)と分類し、電磁波ががんを引き起こす可能性があるとしている。このような過去の科学的な進化を表1にまとめた。
表1 電磁波過敏症(EHS)/多重化学物質過敏症(MCS)と癌世界保健機関(WHO)の、またはWHOを代表するものを含む声明
COST-電磁場の生物学的影響に関する科学技術研究分野での協力のための欧州行動、EMF-電磁場、IARC-国際がん研究機関。
| 1996 | ベルリンWHO主催のワークショップで、MCSは特発性環境不耐性(IEI)に分類された。 |
| 1997 | ストックホルム電磁波暴露の健康への影響の可能性;欧州委員会のために欧州の専門家グループが作成した報告書 |
| 1998 | オーストリアEHSに関するCOST 244 bis国際ワークショップ |
| 1998 | アトランタ(米国)。MCS1999コンセンサスミーティング |
| 2002 | IARC:極低周波(ELF)電磁波は発がん性の可能性がある(Group IIB)と分類されている。 |
| 2004 | プラハWHOワークショップ:電磁波に起因する特発性環境不耐性の特定 |
| 2005 | WHOEHSの定義に関するWHOファクトシートn°292 |
| 2013 | IARC:発がん性の可能性があると分類された無線周波(RF)電磁波(グループIIB) |
| 2015 | ブリュッセル第4回パリ・アピール・コロキアム:電磁界とEHSを中心に |
しかし 2005年のWHOのEHSに関する声明と、より最近の2014年のWHOの携帯電話曝露と公衆衛生に関する報告書[8]以来、2015年5月にブリュッセルのベルギー王立医学アカデミーで私たちが主催したEHSとMCSに関する国際科学コンセンサス会議でまとめられたように、EHSの特定と特徴づけにおいて臨床的にも生物学的にも多くの進歩があった[9]。
EHSの有病率が世界的に増加していることが疑われたため 2009年から、フランス人保護委員会(CPP)の登録番号2017-A02706-47、および欧州臨床試験*データベース(*EudraCT*)の登録番号2018-001056-36で登録されたデータベースを構成・維持している。このデータベースには、現在2000例以上のEHSおよび/またはMCSが含まれている。このシリーズに含まれるすべての患者は、臨床的および生物学的研究調査についてインフォームドコンセントを行った。さらに、これらすべての患者は匿名でデータベースに登録された。
このデータベースを検索することにより、EHSはMCSと頻繁に関連していること[10]、EHSとMCSは共通の類似した臨床像を特徴とし、末梢血や尿中の類似したバイオマーカーの検出により[10,11]、また脳内の類似したパルス測定異常により客観的に識別できることが初めて示された[10,12]。したがって、EHSとMCSは、実際には、ユニークな病理学的障害の2つの病因である可能性があることが明らかになった[10]。ここで、私たちのオリジナルデータを概観し、EHSがMCSと同様に包括的な生理学的病理学的メカニズムから生じる真の病的神経学的障害の一部である可能性について論じたい。EHSは、その原因が何であれ、世界的な疫病になりつつあると結論づけた。このように、EHSは診断、治療、予防が可能であることを示したので、国際疾病分類(ICD)に含めるようWHOに要望する。
2.人口統計学
私たちは、データベースの一部を構成する多数の患者を対象とした系統的な対面質問票による問診と臨床身体検査を含む前向き研究において、EHSが臨床生物学的に明確に定義された疾患であることを報告した[10]。
表2は、データベースに含まれる最初の連続した726症例の連続分析から得られた人口統計学的データを示している。小児は含まれていない。年齢の中央値および平均値は、EHS群では48歳、MCS群ではそれぞれ48歳と47歳、EHSおよびMCS関連群では46歳であった。性比では明らかに女性が多く、EHS群とMCS群では3分の2に達しており、両疾患を呈する患者群では4分の3であった。このことは、女性が男性よりも遺伝的に電磁波や化学物質に起因する環境不耐性に対して感受性が高いことを強く示唆している。
表2 参考文献[10]による、EHSおよび/またはMCSの自己申告患者における年齢と性別の比率
| 人口統計データ | EHS | メソッド | EHS/MCS |
|---|---|---|---|
| n(%) | 521(71.7%) | 52(7.1%) | 154(21.2%) |
| 年齢(平均±SD) | 48.2±12.9 | 48.5±10.3 | 46.7±11.2 |
| 年齢(中央値(範囲)) | 48(16-83) | 47(31-70) | 46(22-76) |
| 性比(女性/男性) | 344/177 | 34/18 | 117/37 |
| 女性(%) | 66 | 65 | 76 |
3.臨床的説明
表3は、(1)EHS患者、(2)MCS患者、(3)両障害患者について、対面式面接と臨床検査で得られた詳細な症状像である。EHS患者の症状は、EHSおよび/またはMCSの臨床的証拠を示さない一連の健康な対照被験者の症状と比較された。表に示すように、EHSは、頭痛、耳鳴り、過敏症、めまい、平衡障害、表在感覚異常、線維筋痛症、植物性神経機能障害、即時記憶喪失、注意集中力欠如、最終的にはテンポ空間混乱などの認知能力低下などの神経学的症状の発生によって特徴づけられる。これらの症状は、慢性的な不眠、疲労、抑うつ傾向に加えて、情緒不安定、時には過敏性などを伴っていた。主要な観察は、症状が、たとえ弱い強度であっても、推定される電磁波源にさらされたことを報告するたびに起こり、これらの推定される発生源から離れた後は、症状が後退するか、あるいは消失することが、患者によって繰り返し報告されることである。対照群に同程度の頻度で観察された関節痛と情動を除いて、EHS患者に発生するすべての臨床症状は、一見正常な対照群に見られる症状よりも有意にはるかに頻度が高いことが明らかになった。
表3 EHS自己申告患者の臨床症状を正常対照群と比較し、MCSおよびEHS/MCS自己申告患者の臨床症状と比較*、参考文献[11]による
| 臨床症状 | EHS(%) | 正常対照群(%) | p** | MCS(%) | p*** | EHS/MCS(%) | p**** |
|---|---|---|---|---|---|---|---|
| 頭痛 | 88 | 0 | <0.0001 | 80 | 0.122 | 96 | 0.065 |
| 感覚異常 | 82 | 0 | <0.0001 | 67 | 0.0149 | 96 | 0.002 |
| 筋肉痛 | 48 | 6 | <0.0001 | 48 | 1 | 76 | <0.0001 |
| 関節痛 | 30 | 18 | 0.067 | 24 | 0.611 | 56 | <0.001 |
| 耳熱・耳痛 | 70 | 0 | <0.0001 | 16 | <0.0001 | 90 | <0.001 |
| 耳鳴り | 60 | 6 | <0.0001 | 35 | <0.001 | 88 | <0.0001 |
| ハイパーアクシス | 40 | 6 | <0.0001 | 20 | <0.001 | 52 | 0.118 |
| めまい | 70 | 0 | <0.0001 | 52 | 0.0137 | 68 | 0.878 |
| バランス障害 | 42 | 0 | <0.0001 | 40 | 0.885 | 52 | 0.202 |
| 集中力・注意力不足 | 76 | 0 | <0.0001 | 67 | 0.210 | 88 | 0.041 |
| 即時記憶の喪失 | 70 | 6 | <0.0001 | 56 | 0.040 | 84 | 0.028 |
| 混乱 | 8 | 0 | 0.007 | 0 | 0.0038 | 20 | 0.023 |
| 疲労度 | 88 | 12 | <0.0001 | 72 | 0.0047 | 94 | 0.216 |
| 不眠症 | 74 | 6 | <0.0001 | 47 | <0.0001 | 92 | 0.001 |
| うつ病の傾向 | 60 | 0 | <0.0001 | 29 | <0.0001 | 76 | 0.022 |
| 自殺願望 | 20 | 0 | <0.0001 | 9 | 0.027 | 40 | 0.003 |
| 一過性の心血管系異常 | 50 | 0 | <0.0001 | 36 | 0.046 | 56 | 0.479 |
| 眼球欠損 | 48 | 0 | <0.0001 | 43 | 0.478 | 56 | 0.322 |
| 不安・パニック | 38 | 0 | <0.0001 | 19 | 0.003 | 28 | 0.176 |
| エモーティビティー | 20 | 12 | 0.176 | 16 | 0.461 | 20 | 1 |
| イラつき | 24 | 6 | <0.001 | 14 | 0.071 | 24 | 1 |
| 皮膚病変 | 16 | 0 | <0.0001 | 14 | 0.692 | 45 | <0.0001 |
| グローバルボディジステック | 14 | 0 | <0.0001 | 6 | 0.236 | 8 | 0.258 |
*これらのデータは、生物学的マーカーを調査した既報のEHSおよび/またはMCS患者シリーズ[10]を含むデータベースから得られた連続した150の臨床評価可能な症例の臨床分析から得られたものである。EHS患者の自己申告による症状は、対照として使用された50人の見かけ上正常な被験者のシリーズから得られた症状と比較された。これらの症状は、MCSおよびEHS/MCS患者の自己申告による症状とも比較された。症状を有する患者の割合は、カイ二乗独立検定を使用して比較された。**EHS患者自己申告と正常対照との間の統計的差異。***EHS患者自己申告とMCS患者自己申告の間の統計的な差。****EHS自己申告患者とEHS/MCS自己申告患者との間の統計的な差。
EHS患者の臨床症状を報告した研究[2,5,6,13]とは異なり、これらの症状はすべて自覚的なものでなかった。多くの場合、それらは家族によって確認された。さらに、私たちは、身体検査において、5%の症例でロンベルグ徴候(客観的姿勢検査)を検出することができ、16%で皮膚病変の存在を確認することができた。これらの症状の多くは文献上では非特異的なものとされているが、これらの症状の関連性と頻度から得られる一般的な臨床像は、MCSおよびMCS関連EHSの場合と同様に、EHSが実際には典型的な神経疾患として認識・識別されることを強く示唆している。
表3より、EHSとMCSでは、頭痛、筋肉痛・関節痛、平衡障害、集中力・注意力欠如、感情・過敏性、皮膚病、全身性ジステルマシーでは臨床症状の種類と頻度に統計的有意差がないことが明らかになった。皮膚病変、全身性ジステルマシーなどでは統計的に有意な差がなかったが、感覚異常、耳熱・耳痛、耳鳴り、聴覚過敏、めまい、即時記憶喪失、不眠、疲労、うつ傾向、自殺念慮はMCSよりもEHSで統計的に頻度が高いようであった。さらに、MCSを伴うEHSの場合、頭痛、知覚異常、筋肉痛や関節痛、耳鳴り、そして何よりも即時記憶喪失、集中・注意力欠如、テンポ・空間混乱などの認知能力といった症状のほとんどが、EHS単独の場合よりも有意に高い頻度で認められることから、電磁波曝露に起因する不耐性に加えて、化学物質の不耐性の要素が追加されると、より深刻な病態と結びつくと考えられている。特に、皮膚病変は45%に、肉体的・精神的苦痛や自殺願望を伴う抑うつ傾向は40%に認められた。
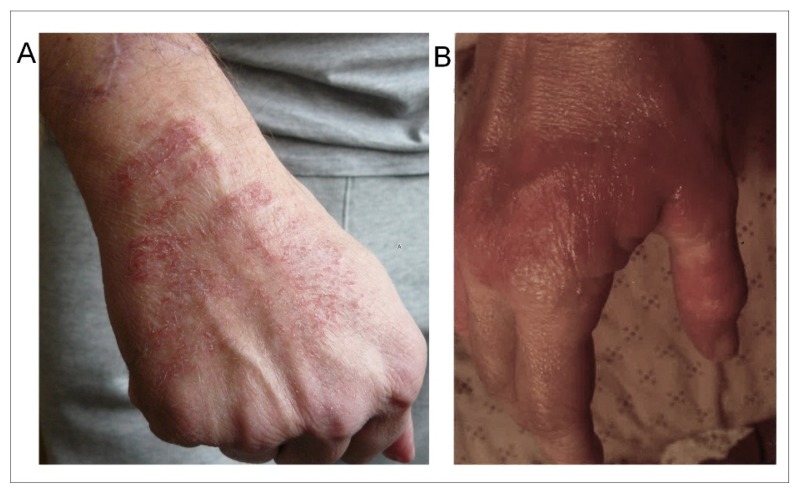
皮膚病変は、患者の下半身よりも上半身に多く、手、特に携帯電話を持つ手に多く見られた(図1A参照)。また、EHSとMCSを合併した患者群では、EHSのみの患者群(16%)よりも皮膚病変の頻度が高い(45%)だけでなく、EHSのみの患者群よりも両者を合併した患者群でより広範囲かつ持続的な皮膚病変が認められた(図1B)。
図1 EHS患者(A)とEHS/MCS患者(B)の手指に観察された皮膚病変の例。(写真はデータベースより発行)。
これらの臨床観察は、EHSおよびEHS/MCSが客観的な身体障害であり、何らかの心理学的または精神医学的関連状態に由来するとも、ノセボ効果に由来するとも言えないことを強く示唆している[11](さらに参照)。
4.バイオマーカーの同定
既報の実験データに基づいて、EHSおよびMCS患者の末梢血と尿中のバイオマーカーをいくつか選択・同定した。このバイオマーカーにより、医師は、EHSおよびMCSが心身症またはノセボ関連のプロセスによって引き起こされるという仮説を否定し、真の身体病理疾患として客観的に特徴づけることができる[10]。表4に示すように、EHS、MCS、または両関連疾患の患者の末梢血における低悪性度炎症関連バイオマーカーの平均レベル値には、同様の増加が認められる。また、頻度としては、過敏性C反応性タンパク質(hs-CRP)が12〜15%、ヒスタミンが30〜40%、免疫グロブリンE(IgE)が20〜25%、熱ショックタンパク質27(Hsp27)およびHsp70が12〜30%で増加することがわかった。これらのマーカーのうち、IgEとヒスタミンはアレルギーが証明されていない患者でも増加していた。したがって、アレルギーが認められない場合、ヒスタミンはMCSと同様にEHSで最も頻繁に関与するバイオマーカーと思われ、これら2つの疾患の発生には低レベルの炎症過程が関与していることが示唆された。したがって、炎症メディエーターであるヒスタミンは、この2つの疾患の発生を説明する生理病理学的メカニズムにおいて重要な役割を果たすと考えられている[11,14](後述)。また、MCS群で増加が少なかったHsp70を除いて、調査した3群のすべてのバイオマーカーについて、正常値を超える患者の割合や正常値に対する増加値の平均値に有意差がなかったことから、EHS、MCS、および両疾患の関連は、共通の低レベル炎症関連の生理学的発生メカニズムである可能性があると考えられる。
表4 参考文献[9,10]による、EHSおよび/またはMCS患者の末梢血における低悪性度炎症関連バイオマーカー平均血中濃度値の増加
SE-標準誤差;hs-CRP-過敏性C反応性タンパク質;IgE-免疫グロブリンE;Hsp-熱ショックタンパク質。
| 患者団体 | ||||||||
|---|---|---|---|---|---|---|---|---|
| マーカ正常値 | EHS平均値±SE | 正常値以上(%) | MCS平均値±SE | 正常値以上(%) | p* | EHS/MCS平均値±SE | 正常値以上(%) | p** |
| hs-CRP<3mg/L | 10.3±1.9 | 15 | 5.3±1.7 | 12 | 0.50 | 6.9±1.7 | 14.3 | 0.36 |
| ヒスタミン<10 nmol/L | 13.6±0.2 | 37 | 23.5±4.5 | 33 | 0.91 | 13.6±0.4 | 41.5 | 0.52 |
| IgE<100 UI/mL | 329.5±43.9 | 22 | 150.9±18.3 | 20 | 0.23 | 385±70 | 24.7 | 0.53 |
| Hsp 70<5 ng/mL | 8.2±0.2 | 18.7 | 5.9±0.5 | 12 | 0.03 | 8±0.3 | 25.4 | 0.72 |
| Hsp 27<5 ng/mL | 7.3±0.2 | 25.8 | 6.8±0.1 | 6*** | 0.59 | 7.2±0.3 | 31.8 | 0.56 |
*マーカー平均レベル値に関するEHS患者群とMCS患者群の比較は、両側t検定を用いて行われた。Hsp70を除いて、分析した異なるバイオマーカーの平均レベル値の増加について、EHS患者とMCS患者の間に統計的に有意な差はなく、EHSとMCSは共通の生理病理学的な発生メカニズムを共有していることが示唆された。**両側t検定によるEHS患者群とEHS/MCS患者群との比較。EHS患者とEHS/MCS患者の間で、分析した異なるバイオマーカーの平均レベル値の増加について、統計的に有意な差は見られなかった。***Hsp27の頻度割合が統計的に有意に低いMCSを除いて、他のすべての調査対象パラメータの頻度割合は、カイ二乗独立検定に基づくと、EHSとEHS/MCSで有意差はなかった。
さらに、表5に示すように、末梢血では、EHSおよび/または MCS群で、S100Bタンパク質の増加が15~20%、ニトロストレスに関連するニトロチロシン(NTT)の増加が8~30%認められることを示すことができた。S100Bタンパク質[15,16]とニトロチロシン[17,18,19,20]はBBBの開口と関連するマーカーであることが示されているため、どの患者群であろうと、これらのバイオマーカーはこれらの患者における血液脳関門(BBB)の開口を反映しているかもしれないということが示唆された。さらに、EHS、MCS、またはその両方にかかわらず、全症例の約20%でO-ミエリンに対する自己抗体が検出された。これは、神経系の白質に対する自己免疫反応が患者において起こることを意味し、実際には酸化的/硝酸的ストレスの発生の結果である可能性がある所見である(10,21)。
表5 参考文献[10,11]によると、EHSおよび/またはMCS患者における末梢血S100B蛋白、ニトロチロシン(NTT)、O-ミエリン自己抗体の血中平均値の増加
| 患者団体 | ||||||||
|---|---|---|---|---|---|---|---|---|
| マーカー正常値 | EHS平均値±SE | 正常値以上(%) | MCS平均値±SE | 正常値以上(%) | p* | EHS/MCS平均値±SE | 正常値以上(%) | p** |
| S100B<0.105µg/L | 0.20±0.03 | 14.7 | 0.25±0.05 | 21.15 | 0.56 | 0.17±0.03 | 19.7 | 0.69 |
| NTT*>0.9µg/ml | 1.36±0.12 | 29.7 | 1.26±0.13 | 8 | 0.85 | 1.40±0.12 | 28.9 | 0.86 |
| O-ミエリン(定性試験) | ポジティブ | 22.8 | ポジティブ | 13.6 | _ | ポジティブ | 23.6 | _ |
*両側t検定によるEHS患者群とMCS患者群との比較。EHS患者群とMCS患者群の間では、分析した2種類のバイオマーカーの平均値の増加について統計的に有意な差は認められず、EHSとMCSは共通の生理病理学的な発生メカニズムを共有していることが示唆された。**両側t検定によるEHS患者群とEHS/MCS患者群との比較。EHS患者とEHS/MCS患者の間では、分析した異なるバイオマーカーの平均値の増加について統計的に有意な差はなく、ここでもEHSとMCSが共通の病因となる生理病理学的メカニズムを持つことが示唆されている。
さらに最近、私たちは、EHS患者の末梢血中のチオバルビツール酸反応物質(TBARS)、酸化グルタチオン(GSSG)、NTTなど、さまざまな酸化・ニトロソ化ストレス関連のバイオマーカーを測定した。図2に示すように、EHS患者の約80%で酸化ストレス/ニトロソ反応関連バイオマーカーが増加していることがわかった。より正確には、これら3つのバイオマーカーのうち1つだけが43%、2つが21%、3つすべてが15%に認められた[22]。このことは、低悪性度の炎症と抗白質自己免疫反応に加えて、酸化的/ニトロソ的ストレスの存在によってEHSを診断できることを明確に示している。
図2 末梢血中のチオバルビツール酸反応物質(TBARS)、酸化グルタチオン(GSSG)、NTT酸化ストレスバイオマーカーが陽性であったEHS自己申告患者の割合(文献[22]による)。NTT、TBARS、GSSG、すなわち3つのバイオマーカーすべてが測定された患者32名中14名が該当。TBARSとGSSGは、対象となった32人の患者すべてで分析されたものである。「陽性」バイオマーカーは、レベルが正常上限を超える1つ、2つ、または3つのマーカーを有する患者に対応し、「合計」は、少なくとも1つの陽性バイオマーカーを有する患者、すなわち1つ、2つ、または場合によっては3つの陽性バイオマーカーを有する患者に対応する。
また、24時間尿中の6-ヒドロキシメラトニン(6-OHMS)/クレアチニン比は、正常値と比較して、88%の症例で正常または有意に減少し、12%では未だ解明されていないプロセスにより、どの患者群でも有意に増加することがわかった。6-OHMSは、メラトニンの代謝物である。長時間のEMF曝露の結果としてメラトニン産生が減少することは、動物とヒトの両方で実験的に証明された[23,24]。しかし、EMFへの曝露はメラトニンの合成と分泌を変化させないことも報告されているので[25]、別のもっともらしい説明として、6-OHMSの尿中排泄量の減少は、メラトニンの摂取量の増加とフリーラジカルスカベンジャーとしての利用により、メラトニン代謝のバイオアベイラビリティが低下するためかもしれない[26,27]。上記のように、EHS患者の多くは酸化/ニトロソ化ストレスを呈しているため、24時間尿の6-OHMS/クレアチニン比レベルが低下している患者では、確かにこのようなことが言えるかもしれない。したがって、尿中の6-OHMSの減少は、松果体における合成の低下というよりも、むしろこのホルモンの抗酸化ストレス作用の結果である可能性がある。その結果、このようなバイオアベイラビリティの低下は、これらの患者の臨床的な睡眠障害だけでなく、宿主防御機構の低下にも寄与し、おそらくこれらの患者を神経変性疾患や癌のリスクにさらすかもしれない[28,29]。
さらに、酸化的/硝酸性ストレスに関連した自己免疫反応の発生は、シャペロンタンパク質Hsp 70およびHsp 27が有するとされる健康保護効果を弱める一因にもなっている可能性がある[30]。12%の症例において、24時間尿中6-OHMS/クレアチニン比が正常または有意に減少する代わりに、この比が正常対照値と比較して有意に増加した理由については、現在のところ明確な説明がない。表6に示すように、セロトニンはメラトニンの前駆体神経伝達物質であるため、場合によっては脳内セロトニン産生が増加したことに起因する可能性がある。
表6 EHS患者42名の尿中の神経伝達物質およびその代謝物の測定に基づく、未発表の予備データ
3-4 DOPAC-3,4-Dihydroxyphenylacetic acid(ジヒドロキシフェニル酢酸)。
| 神経伝達物質 | 患者 | % |
|---|---|---|
| ドーパミンの増加 | 17/42 | 31 |
| 3-4 DOPACの減少 | 18/42 | 43 |
| ノルアドレナリン増加 | 11/42 | 26 |
| アドレナリン増加 | 8/42 | 19 |
| アドレナリン減少 | 12/42 | 22 |
| セロトニン増加 | 4/42 | 9.5 |
| セロトニン減少 | 5/42 | 12 |
表6に示すように、神経伝達物質レベルの変化から、EHSは異なる神経伝達物質プロファイルの異常と関連していることが明らかになり、EHSが確立された新しい脳関連神経疾患であることが確認された。
5.脳神経・血管異常の放射線学的同定法
脳CTスキャン、脳MRI、脳血管撮影などの古典的な脳画像検査は、EHSやMCS、EHS/MCSでは通常正常であり、これらの検査が正常であることは、これらの病的疾患の診断に対する反論にはならないことを意味している。幸いなことに、私たちは、EHSとMCSが機能異常を示した場合、他の画像診断技術を開発し使用することが、客観的な特徴を示す能力を高めるために大いに役立つ可能性があることを示している。実際、表7に示すように、EHS患者において経頭蓋ドップラー超音波(TDU)を用いると、中大脳動脈の一方または両方で平均脈動指数が低下することがわかった。すなわち、右動脈と左動脈でそれぞれ25%と31%、両動脈で50%の症例で低下することが示された。さらに、EHS/MCSのdual群では、片方の動脈で20%、両方の動脈で50%であった。また、血流抵抗(BBF)に関しては、EHS患者では片方の動脈で6.25%、両方の動脈で18.75%、EHS/MCS患者では片方の動脈で5~10%、両方の動脈で25%BBF抵抗が増加していることが分かった。また、平均血流速度は、EHSとEHS/MCSのグループによって、9.75%から40%の症例で正常値を下回り、5%から18.75%で正常値を上回った(表7を参照)。このことは、EHSおよび/またはMCSでは、これらの脳動脈の一方または両方においてBBFが低下している可能性を示唆している。
表7 EHS32例、EHS/MCS20例の経頭蓋ドップラー超音波検査による左右中大脳動脈の抵抗指数、脈動指数、平均流速の正常値との比較結果(未発表データ)
| EHSn=32 | |||||||||
| 正常値 | 平均値±SE | 正常値以下(%) | 正常値以上(%) | ||||||
| 右と左 | 右 | 左 | 右のみ | 左のみ | 両方 | 右のみ | 左のみ | 両方 | |
| 抵抗指数 | <0.75 | 0.62±0.03 | 0.65±0.04 | _ | _ | _ | 6.25 | 6.25 | 18.75 |
| パルサティリティ指数 | >0.60 | 0.55±0.02 | 0.55±0.03 | 25 | 31.25 | 50 | _ | _ | _ |
| 平均流速 | 62±12 | 59.56±5.98 | 61.35±5.27 | 9.75 | 9.75 | 31.25 | 3.12 | 9.25 | 18.75 |
| EHS/MCSn=20 | |||||||||
| 正常値 | 平均値±SE | 正常値以下(%) | 正常値以上(%) | ||||||
| 右と左 | 右 | 左 | 右のみ | 左のみ | 両方 | 右のみ | 左のみ | 両方 | |
| 抵抗指数 | <0.75 | 0.79±0.09 | 0.64±0.04 | _ | _ | _ | 5 | 10 | 25 |
| パルサティリティ指数 | >0.60 | 0.48±0.03 | 0.61±0.02 | 20 | 0 | 65 | _ | _ | _ |
| 平均流速 | 62±12 | 53.03±9.09 | 51.77±7.63 | 20 | 20 | 40 | 10 | 10 | 5 |
さらに、側頭葉に適用した超音波大脳断層撮影法(UCTS)を用いて、これらの葉の中大脳動脈依存性組織領域、特に辺縁系と視床に相当する被殻-視床領域で、平均脈拍指数が著しく減少していることを示した[12]。図3に示すように、この組織低脈動は、主にこれらの葉の被殻-視床領域で検出され、EHSやMCSがこれらの2つの脳構造における毛細血管BBFの減少と関連していることを示唆し、したがって、これらは何らかの血管や神経細胞の機能障害と関連しているかもしれないという仮説が導かれる[10,11,12]。これらの異常は、アルツハイマー病や他の神経変性疾患で見られるものと類似している可能性があるため、特異的ではないが、私たちは最近、UCTSがEHSやMCSの診断や客観的な治療患者の追跡に使用できる最も正確なイメージング技術の1つであることを確認した[12]。
図3 参考文献[11,12]に従い、健常者(A)とEHS自己申告患者(B)の両側頭葉のグローバルな遠心超音波組織脈動性を探る、超音波大脳断層撮影法(UCTS)を用いてデータベースから得られた図の一例。測定値は脈波指数(PI)として表される。なお、AとBでは、各探索領域のPIの平均値は、大脳皮質から各側頭葉の内部まで(すなわち、右葉は左から右へ、左葉は右から左へ)記録されたものであることに注意。また、A(健常者)では、すべての値が正常なPI値の中央値を超えているのに対し、B(EHS自己申告者)では、いわゆる被殻視床領域(右側頭葉は第5列、左側頭葉は第2列)の値が正常値の中央値を著しく下回っており、この患者に代表されるように、EHSには各側頭葉における辺縁系や視床が関係している可能性を示唆していることに注目したい。
しかし、これらの脳の異常は大脳辺縁系や視床に限られたものではないようで、上記のようにTDUを用いて、EHSやMCS患者では、中大脳動脈のBBFが異常である可能性を示したのである。さらに、極低周波(ELF)に慢性的に曝されたEHS患者の機能的MRI(fMRI)を用いて、HeuserとHeuserによっても、主に前頭葉で、デフォルトモードネットワーク(DMN)の異常(特にこのDMNのハイパー結合性として)として、脳BBFの低下と関連して、これまで個別に断片的にハイパー結合した2成分で代謝過程が起こっていると報告されている[31]。例えば、図4では、異常なDMNは、前部成分と後部成分の断片的な過接続で表され、これは、両前頭葉のBBFおよび/または代謝の減少につながる可能性がある。
図4 参考文献[31]によると、電磁波への長期曝露後にEHSを訴える患者における機能的MRI脳スキャンの異常。
6.診断基準
上記の臨床的、生物学的、および放射線学的調査に基づいて、EHSを明確に定義された新しい神経学的病理学的疾患として客観的に特徴づけ、同定するための十分な包括的かつ関連するデータが現在存在していると思われる。そのため、EHSに罹患していると自己申告した患者については、上記の血液や尿のバイオマーカー、画像診断技術など、現在利用可能な客観的検査を用いて調査する必要がある。
臨床レベルでは、頭痛、耳鳴り、めまい、認知障害などの孤立した症状は、電磁波や化学物質への曝露が原因であると患者が言及することはあっても、他の病態を反映している可能性があり、診断を下すには十分とはいえない。とはいえ、EHSの臨床的論拠としては、以下のようなものが考えられる。(1)観察された臨床症状を説明する既知の病態がないこと、(2)私たちが同定したような症状の特徴的な関連性、特に頭痛、耳鳴り、聴覚過敏、めまい、即時記憶喪失、注意・集中力欠如の関連性は最も特徴的で再現性が高い、(3)電磁波の影響による症状の再現性、(4)EMF避けの場合の症状の後退・消失、(5)最後に、最も重要だがMCSと関連性が高いこと。私たちは、30%の症例でMCSがEHSと関連していることを示したが、1999年の国際コンセンサス会議[32]でMCSが明確に定義されたように、この後者の関連性は、実際、EHSの診断に最適な臨床基準となる可能性がある。
しかし、これらの臨床基準の多くは主観的なものであるため、客観的に疾患を証明し、ひいては診断を確定するには十分ではない。生物学的マーカーのうち、血中ヒスタミンは、現在、アレルギーを伴わない場合に最も有効なマーカーであり、医療現場において最も日常的に測定しやすいマーカーである。また、血中の蛋白質S100Bの増加や、GSSG、NTTなどの酸化・硝酸ストレス関連のバイオマーカーの検出も、客観的に診断に寄与するものと思われる。ただし、30%の症例では、血中バイオマーカーが検出されなかった。したがって、臨床的な基準に加えて、TDU、fMRI、可能であればUCTSなどの画像診断技術を用いることで、EHSの診断が可能であると思われる。全体として、この方法を用いることで、EHSの自己申告者の約90%においてEHSを客観的に診断することができた。
7.治療と予後の進展
現在のところ、EHSの標準的な治療法は確立されていない。しかし、生物学的な調査に基づいて、適応となる治療法がいくつかある。例えば、私たちは、EHS患者がビタミンおよび微量元素、特にビタミンDおよび亜鉛の重大な欠乏を頻繁に呈することを示し、これを改善する必要がある[10,11,22]。血中ヒスタミンが増加している場合には、抗ヒスタミン薬も使用する必要がある。さらに、酸化的/硝酸的ストレスがある場合には、グルタチオンなどの抗酸化剤、より具体的には抗硝酸薬も使用する必要がある。さらに、図5に例示したように、発酵パパイヤ製剤(FPP)やイチョウ葉などの天然物が側頭葉の中大脳動脈依存性組織各領域の脳脈動を回復し、脳血流動態を改善し、ひいては脳酸素化を改善することを明らかにした[33]。FPPは、いくつかの抗酸化、抗炎症、免疫調整特性を有することが示されたので[34,35,36]、私たちはこの広く入手可能な天然物の使用をお勧めする。
図5 参考文献[33]によると、EHS被験者の包含時(Ti)と発酵パパイヤ製剤(FPP)補給後(1日9g、2回に分けて摂取)3カ月後(T3)の両側頭葉におけるグローバルなセンチメートル単位の超音波脈動についてUCTSを用いてデータベースから取得した図の例。
EHSは、電磁波や化学物質などの環境ストレスに対して無治療・無保護の場合、神経変性疾患や精神疾患へと発展し、一見アルツハイマー病と関連する状態も含まれる可能性がある。しかし、早期の治療と保護に努めた結果、データベースに含まれるどの患者にも真のアルツハイマー病の発生は見られなかった。一方、不耐症状が治療・保護後に退縮し、消失することもある。しかし、私たちの経験や知識では、電磁波過敏症やMCS関連化学物質過敏症は決して消失しない。つまり、症状としての不耐性とは異なり、EHSやMCSは何らかの不可逆的な神経学的病理状態に関連しており、強力かつ持続的な予防が必要なようである。したがって、最近の一部の主張とは異なり、これらの障害を単に機能障害に還元することはできないと考えている。
8.提案された生理的病理学的メカニズム
WHOは2005年に発表したEHSに関する公式声明の中で、「EHSの症状を電磁波曝露と関連づける科学的根拠はない」、つまり環境要因と疾病を関連づける生理学的メカニズムが認められていないことを指摘した。これは、もはや事実ではない。EHS患者[10,11,22]において私たちが示した基本的な低レベルの炎症と酸化的/ニトロソ化ストレス関連の状態は、(1)ELFやRF EMFを含む様々な環境ストレス要因にさらされた動物[37,38,39]とヒト[11]において実験的に証明された非熱または弱い熱非電離放射線、(2)複数の人工環境化学物質[40,41,42]、特に脳への有害な健康影響を裏付けるものである点、注目に値す[43,44](2011).
図6は、私たちのデータを含め、現在公表されているデータから構築することができたモデルの各段階をまとめたものである。このモデルは、EHSおよび/またはMCS患者において明らかになった炎症および酸化/ニトロソ化ストレス過程に基づき、脳内で生理的病理作用が起こるメカニズム、ひいてはEHSやMCSの発生がどのように起こるかを説明するものである。
図6 参考文献[10]によると、低悪性度神経炎症と酸化的/硝酸性ストレスによる血液脳関門の破壊に基づくEHS/MCS生理病理学モデル。
第一段階として、環境ストレス要因が何であれ、それに対する初期の局所的な炎症反応がある可能性がある。常在するミクログリア細胞、アストロサイト、マスト細胞は、ヒスタミンなどの炎症メディエーターを放出し、脳の局所的な炎症プロセスに関与する最初の細胞になる可能性がある。私たちのデータ[10,11,12,22,33]に基づくと、ヒスタミンは酸化的/硝酸的ストレス,ひいては脳低灌流を誘導し、局所脳低酸素を引き起こす主要メディエーターであると推察された。
第二段階として、酸化的/硝酸性ストレスに関連したBBBの破壊を含む炎症の増幅が起こり、血液から脳への循環炎症細胞の移動が可能になるであろう。最終的には、脳内で神経炎症が起こり、主に側頭葉の視蓋部、すなわち大脳辺縁系と視床が侵されることになるだろう。
大脳辺縁系の関与が感情および認知の病理学的変化(特に記憶喪失)を説明し、視床の関与が表層および深層の感性関連異常を説明することができるため、この包括的な生理学的病理モデルの大きな興味は、EHSおよび/またはMCS患者に生じる主な臨床症状を説明できることである。当然ながら、神経炎症が前頭葉や視床下部にも及んでいる可能性があり[45]、その他の関連する臨床症状を説明することができる。
9.病因と予防
EHSの発生原因については、現在も議論が続いており、EHSの発生が電磁波曝露と因果関係があることを証明するものはないというのが、現在の制度的なメッセージである。しかし、EHS患者の臨床症状発現の原因、すなわちEHS発症後と、EHSそのものの環境的因果関係を明確に区別していないのが現状であり、この問題に対する現在の科学文献には大きな混乱がある。実際、表8で報告したように、EHS患者およびEHS/MCS患者における電磁波および化学物質への過去の曝露をデータベースから検索し、レトロスペクティブに分析したところ、電磁波曝露、さらには化学物質がEHSを引き起こす、あるいは引き起こす一因となることを強く示唆するいくつかの直接的および間接的議論が現在存在していることが分かった。
表8 電磁波知覚過敏の発生に先立つ自己申告による過度の推定電磁波および化学物質への曝露の臨床的分析(未発表データ)
DECT-デジタル強化コードレス通信、RF-無線周波数、ELF-極低周波。
| 情報源 | EHS(%) | 周波数帯域 |
|---|---|---|
| 携帯電話 | 37 | ラジオアイソトープ |
| 携帯電話/DECT | 8 | |
| ディレクト | 7 | |
| 陰極線管 | 9 | |
| WiFi | 16 | |
| 中継用アンテナタワー | 3 | |
| 省エネランプ/携帯電話 | 1.4 | RFおよびELF |
| 高圧送電線 | 2.7 | エルフ |
| 電源トランス | 1.7 | |
| 鉄道 | 0.8 | |
| 化学物質 | 11 | |
| 特発性***。 | 2.4 |
*低周波(LF)と高周波(RF)の両方について、過度の放射線被曝が懸念される。
さらに、不耐性という一般的な用語は、特定の環境状況で生じる臨床症状や生物学的異常を指すものであり、過敏症という用語は、実際には、患者が低用量のストレス要因に対して不耐性になるほどの臨界点まで環境耐性閾値が低下することによって特徴づけられる特定の内因性生理学的状態として定義されるべきものである、という区別をする必要がある。このような区別は、例えばアレルギー患者におけるアトピーの個別化など、医学の世界ではすでに行われている。
したがって、不忍容性の概念とEHSの概念の区別に同意するのであれば、EHSは、患者が低線量強度の電磁波曝露に不忍容性を示すようになる不忍容性の閾値の特定の減少として定義され、一方MCS(1999年にアトランタで開かれたMCSコンセンサスミーティングの報告書ですでに示されている)は、患者が低線量の複数の化学物質に不忍容性になる同様の生理学的状態として定義されていたはずである[32]。この区別は、EHSの自己申告患者において電磁波曝露下で起こりうる臨床症状を再現することを目的とした誘発試験を用いた研究の多くが否定的な結果を報告している理由を説明するものであろう。実際、これらの否定的な結果は、実際には、異なる受け入れがたい科学的欠陥に起因している可能性がある。(1)いわゆるEHS自己申告患者におけるEHSの定義に客観的なバイオマーカーが用いられていないため、客観的な対象基準がないこと、(2)EHS患者は特定の周波数に敏感で、他の周波数には必ずしも敏感ではないこと、(3)曝露期間が一般に短すぎ、評価が早すぎること、(4)MCSとの関連が考慮されていないこと、。(5)上記のように、EHS患者は認知能力に欠陥があるため、電磁波暴露と偽被曝の区別を誤る可能性がある。(6)そして何よりも、環境耐性閾値の低下や、過去の苦悩の歴史による心理的条件付けにより、患者が偽被曝の場合に肯定的に反応する可能性がある。
したがって、この根拠と、動物[37,38,39,43,44]やヒト[11,14,23,24]の研究によって得られた実験結果から、電磁波が健康に与える有害な影響を否定する十分な科学的データは、現在のところ存在しないものと考える。
したがって、EHSの因果関係の起源は、別の科学的アプローチで確立されるべきものである。RFとELFは、動物[46,47]だけでなく、植物[48,49]や微生物[50]にも生物学的な悪影響を持続的に与えることが分かっている。ここでも、このような観察は、EHSの最初の原因としてノセボ効果を仮定することを確実に否定する。実際、私たちがEHS患者で示した炎症および酸化・硝酸態は、これら2種類の非電離周波数(37,38,39)、特に脳で被曝した動物で実験的に得られたデータを裏付けるものであり、注目に値す[43,44]。さらに、私たちが示したこれらの患者の特徴である大脳辺縁系に関連する視蓋の異常[12,33]は、ラットにおける電磁波曝露によって引き起こされた海馬ニューロンの変化に対応している可能性がある[51,52,53]。
したがって、私たちは、EHS患者で観察された生物学的影響は、地上の無極性で連続的に放出される自然のEMFとは対照的に、電気または無線技術によって放出される人工EMFのパルスと極性の両方の特性によるものと考えている[54,55,56]。
また、表9に示すように、EHS症例の30%では、EHSがMCSと関連しており、このEHS/MCS関連症例の37%では、MCSがEHSの発症に先行していた。つまり、この患者群では、63%でEHSがMCSに向かって発展していたことになる。表8で報告したように、約11%の症例では、人工環境化学物質もEHSの発症に因果関係があるものと推測される。
表9 MCS患者が後にEHSに罹患した割合、およびその逆の割合
| EHS/MCS患者総数 | EHS患者総数EHS/MCS患者を含む*。 | |
|---|---|---|
| MCS患者のうち、後にEHSに罹患した人の割合 | 37 | 11 |
| EHS患者のうち、後にMCSに罹患した人の割合 | 63 | 19 |
*EHS/MCS患者は全体の30%を占める。
EHSやMCS患者がリスクを回避するためには、これらのことを知ることが予防策につながるからだ。このような対策には、可能な限り電磁波や化学物質を避けること、電磁波防止服の使用、アースによる電荷の無害化などが含まれる。さらに、最も脆弱な人々、特に妊婦、乳幼児、子供、青少年に対しては、これらの条件下での無線技術の使用を制限するか、あるいは完全に避けることによって、公的な予防措置を講じる必要がある。また、ペースメーカーを使用している心臓病患者、聴覚障害者、神経変性疾患患者などの弱者に対しても、このような保護対策を講じ、実行する必要がある。
10.世界的な健康問題
新しい無線技術や環境中に導入された人工化学物質の役割を否定するもう一つの論拠[57,58]は、表10に示すように、EHSの有病率の増加は一国に限られたものではなく、これらの産業技術が普及すると同時に始まった、現在世界的に発生しているペストであることである。EHS発生の有病率は0.7%から13.3%と推定され、主に多くの国で人口の約3%から5%が影響を受けている(表10)。つまり、実際には世界中で数百万人がEHSの影響を受けている可能性がある。
表10 世界各国における自己申告によるEHS患者の推定有病率
USA-アメリカ合衆国。
| 国名 | 日付 | サンプル数 | 人貢献率(%) | EHSを持つ人の推定割合 | 参考文献 |
|---|---|---|---|---|---|
| スウェーデン | 1997 | 15,000(19-80)* | 73 | 1.5 | Hillertら2002年[59]。 |
| スウェーデン | 2010 | 3406 | 40 | 2.7 | Palmquistら、2014年[60]。 |
| スイス | 2004 | 2048(>14)* | 55.1 | 5 | Schreier et al.,2006[61]. |
| スイス | 2008 | 1122 (30-60)* |
37 | 8.6 | Roosli et al.,2010[62]. |
| スイス | 2009 | 1122 (30-60)* |
37 | 7.7 | Roosli et al.,2010[62]. |
| ドイツ | 2004 | 30,047 | 58.6 | 10.3 | Blettner et al.,2009[63]. |
| ドイツ | 2004 | 30,047 | 58.4 | 8.7 | Kowall et al.,2012[64]. |
| ドイツ | 2006 | 30,047 | 58.4 | 7.2 | Kowall et al.,2012[64]. |
| アメリカ(カリフォルニア州) | 1998 | 2072 | 58.3 | 3.2 | Levallois et al,2002[65]. |
| フィンランド | 2002 | 6121 | 40.8 | 0.7 | Korpinen et al.,2009[66]. |
| グレートブリテン | 2007年以前 | 3633 | 18.2 | 4 | Eltiti et al.,2007[67]. |
| 台湾 | 2007 | 1251 | 11.5 | 13.3 | Tseng et al.,2011[68]. |
| オーストリア | 2008年以前 | 460 | 88 | 3.5 | Schröttner and Leitgeb,2008[69]. |
| 日本 | 2009年以前 | 2472 | 62.3 | 1.2 | 古林ほか,2009[70]. |
| オランダ | 2011 | 5789 | 39.6 | 3.5 | Batiatsasら、2014年[71]。 |
| オランダ | 2013年以前 | 1009 | 60 | 7 | Vabn Dongenら、2014年[72]。 |
*正確には、含まれる患者の年齢間隔を括弧内に示した。
また、これらのEHSの普及率はあくまで推定値であり、EHSを明確に定義する客観的な基準がないため、批判的な評価はなされていないが、図7で推測されるように、無線技術や工業化学物質の製造が発展するにつれて、EHSの普及率が今後も上昇する可能性がある。
図7 参考文献[73]によると、世界中で自分が電磁波過敏症であると考える人の推定有病率(%)を、正規分布グラフに経時的にプロットしたものである。
11.結論
以上のように、EHSは、現在、臨床的、生物学的、放射線学的に十分なデータがあり、病的な神経疾患として明確に定義され、客観的に同定され、特徴づけられるものであることが示された。その結果、EHSを患っていると自己申告する患者は、末梢血や尿のバイオマーカーの検出、fMRI、TDU、可能であればUCTSなどの画像技術の使用など、現在利用できる生物学的検査に基づいて診断および治療を受ける必要がある。さらに、EHSがMCSと頻繁に関連していること、また、両臨床生物学的疾患が共通の生理病理学的メカニズムと関連している可能性を初めて示したことから、その原因が何であれ、これらは固有の神経学的病理症候群として同定できることが明らかになった。さらに、MCSの発症は有害化学物質への曝露に、EHSの発症は過度の電磁波や化学物質への曝露に起因することが示されたため、これら2つの環境ストレス因子に対する防御策を講じる必要がある。
EHSは、その原因や作用機序が何であれ、今後、新たな神経学的病理学的疾患として認識されるべきものである。EHSは、すでに世界中で何百万人もの人々を巻き込む可能性のある、現実の健康上の疫病であるため、WHOに認められ、WHO ICDに含まれるべきなのである。2015年にブリュッセルで開催されたEHSとMCSに関する国際科学コンセンサス会議で述べたように、科学者たちは満場一致で、EHSとMCSをICDの別コードとして分類し、その責任を早急に果たすようWHOに要請した。そうすれば、医療界と一般市民の間でこれら二つの病的実体に関する科学的認識が高まり、EHSとMCS-は、実際にはユニークかつ明確に定義され、同定できる新しい神経疾患であり、効率的に診断・治療・予防する研究を育成し医療関係者の訓練ができるのである。