Contents
Efficacy and Effectiveness Too Trials: Clinical Trial Designs to Generate Evidence on Efficacy and on Effectiveness in Wide Practice
www.ncbi.nlm.nih.gov/pmc/articles/PMC6422692/
オンラインで2019年2月12日公開
要旨
薬事承認を得るために行われる有効性試験は,最適に選択された患者を対象に,有利な条件で比較的短期間に薬剤を評価するものである。有効性試験は、通常の診療における使用を評価することを目的としており、より典型的な患者を対象に、より長い追跡期間で実際の環境下で治療を評価する。E2E(efficacy-to-effectiveness)試験では、最初の有効性試験の要素が肯定的であれば、試験はシームレスに有効性試験の要素に移行し、両タイプのエビデンスを効率的に得ることができる。さらに、EfficacyとEffectivenessを同時に扱う「EfficacyとEffectivenessも(EE2)試験」では、より多くの時間を節約することができる。さらに、E2EとEE2の2つのアプローチをハイブリッドにして、2つの要素の重なり具合を変えることで、特定の医薬品開発のニーズに柔軟に対応することができる。EE2試験を計画する際には、各ステークホルダーの現在および将来のニーズ、インセンティブ、展望を考慮する必要がある。困難ではあるが、利害関係者、医療システム、国民にとっての最終的な利益は、この努力を正当化するものである。
臨床試験は、医薬品の市場承認と使用のための基礎的な証拠を提供するものである。しかし、市場承認を得るための規制要件を満たすために実施された臨床試験は、患者、臨床医、支払者、一般市民などの他の利害関係者が必要とするエビデンスを提供するとは限らない。また、実際の臨床現場での新薬の有効性を示す一般化可能な証拠も得られない。すべてのステークホルダーに有用なエビデンスを最小限のコストと時間で提供できる試験デザインが求められている。理想的には、このような試験デザインにより、実世界での使用を代表するような幅広い患者と環境で、新しい治療法を評価することができる。
すべての関係者にとって有用なエビデンスが不足している主な要因は、薬事承認を目的とした臨床試験の被験者および治験責任医師と、市販承認後に治療薬が使用される患者および臨床現場との違いにある。規制当局の承認を得るためには、一般的に、帰無仮説を棄却する可能性を最大限に高め、薬剤に起因する偽の安全性シグナルのリスクを最小限に抑えるために選択された、比較的均質な特徴を持つ患者群において、薬剤の有効性と安全性が実証される。この初期評価が、最終的な実世界での使用を代表する広範な患者および環境で行われれば、非常に有益である。これらの研究における患者の基準が広くなることのリスクは、有効性と安全性の証明をより困難にする交絡因子が発生する可能性があり、それによって市場承認を得る確率が低下することである。
この2つのアプローチは、広い意味でそれぞれ「有効性試験」と「エフェクティブネス・トライアル」と呼ばれている。理想的には、最適に選択された患者や病態で比較的短期間に新薬を評価する有効性試験に加えて、最終的にその薬剤が使用される患者や病態の範囲を含むエフェクティブネス・トライアルを行うべきである1, 2, 3。しかし、有効性試験のフォローアップは頻繁に行われておらず、臨床試験に基づく、より広範な患者や環境での使用による相対的なベネフィットとリスクのより完全な理解はほとんど得られていない。
E2E試験では、最初の「有効性」試験(事前に設定された分析やデータ安全性モニタリング委員会による評価など)で認められたポジティブな効果は、規制当局の決定が保留されている間でも、有効性試験にシームレスに移行することができる。有効性試験のインフラと運営を解体するのではなく、有効性試験部分では、より通常の医療における有効性を評価するために、最初の試験をベースにする。例えば、試験の登録基準を広げたり、より多くの実際の試験会場を追加したり、治療期間や追跡期間を長くする計画を立てることができる。このようにして、有効性試験を滞りなく進め、薬事承認を得て販売を開始する頃には、有効性試験が完了していることを目指す。
E2Eアプローチでは、治療効果をより完全に理解することができるだけでなく、より多くの潜在的な患者グループや治療環境における治療効果の不均一性をよりよく理解するためのデータを収集する。この異質性を多変量予測モデルで把握することで、最も効果が期待できる患者への治療の最適化を図ることができる5, 6, 7, 8, 9, 10。
シームレスで連続したE2Eデザインは、大幅に改善されたと言えるが、基本的には2つの臨床試験の時間、物流、コストが必要となる。さらなる効率化として、多くの場合、エビデンスの生成を損なうことなく、2つの試験の必要性を排除できると考えている。このような試験は、1つの試験に統合された状態で、規制要件のための有効性エビデンスと、より広範な関係者のための一般化可能な有効性エビデンスの両方を提供することができる。
EfficacyとEffectivenessの証拠を同時に提供するように設計された臨床試験の例として、急性冠症候群に対するブドウ糖-インスリン-カリウム静注療法のIMMEDIATE(Immediate Myocardial Metabolic Enhancement During Initial Assessment and Treatment in Emergency Care)試験が挙げられる12, 13。この試験は、有効性を示すために必要とされる高い基準で実施されたが、多様な環境にいる幅広い地域の患者集団を対象としている。この試験では、EfficacyとEffectivenessの分析を分けることなく、すべての分析が広範な参加者を対象に行われ、グループ全体で肯定的な反応が示された。しかし、ほとんどのスポンサーは、有効性解析に、有効性コホート全体に含まれる患者や医療環境の不均一性を含めることを望まないと思われるため、このような研究デザインと解析は、おそらく頻繁には行えないであろう。したがって、EfficacyとEffectivenessの同時試験の効率性を示しているが、前述の理由により、これは本稿で提案するEE2試験のモデルではない。我々が提案するEE2試験モデルは、2つのカテゴリーの分析を行う。(i)有効性、(ii)有効性。この違いは、IMMEDIATE試験では、有効性の項目と同様に、一般化可能な地域ベースの有効性登録基準を使用しているが、分析グループは1つだけで、全コホートが有効性について分析された。このように、IMMEDIATE試験は、科学的にも効率的にも優れた特殊なEE2試験と見ることができるが、ここで紹介するフレームワークの焦点は、2つの分析アプローチにある。
2コホートアプローチは、伝統的な有効性試験を重視し、ポジティブな結果の確率を最大化するために、より狭い範囲での試験サンプルや充実した試験サンプルを好むスポンサーのニーズに応えることができると思われる。E2E/EE2デザインは、有効性試験デザインに対するスポンサーや規制当局のニーズに応えると同時に、実際の臨床現場で予想される集団のデータを生成する代替手段となる。
EE2試験デザイン
登録基準
概念的には、EE2試験における有効性コホートと有効性コホートは、図11のように描かれる。有効性試験の参加者は、有効性試験と有効性試験のそれぞれの組み入れ/排除基準によって決定される、有効性コホート全体のサブセットである。有効性コホートの範囲は、本試験の目的によって異なる。基準の拡大は、幅広い一般化を目的とし、実際の治療環境を反映した特別な集団(すなわち、従来の有効性に関する臨床試験では十分な結果が得られないことが多い少数民族)を代表する十分な数の患者を含むこともある。このような集団には、併存疾患を有する患者、疾患に対する最初の治療を受けていない患者、特定の年齢、臨床的、社会経済的、およびその他の特徴を有する患者などが含まれる。
図1 有効性・有効性に関する試験における有効性・有効性コホートの描写。
EfficacyとEffectivenessの構成要素のタイミング
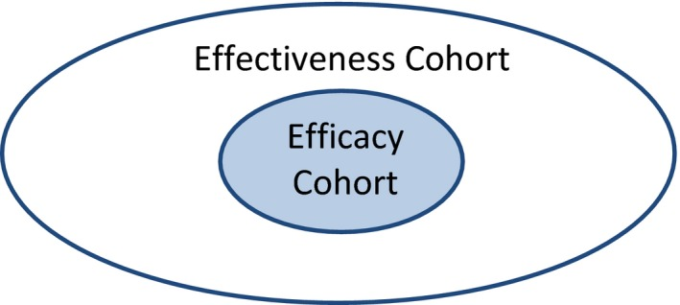
EE2試験のモデルは、EfficacyとEffectivenessの要素を同時に持つことである。これは、前述のE2Eモデルでは、有効性と効果のコンポーネントが順番に行われるのとは対照的である。どちらのデザインも、両方のエビデンスを得るための効率性と確実性を高める必要がある。より一般的には、EE2デザインには、2つの成分のタイミングが、完全に同時のものから完全に連続したもの(すなわちE2E)まで、様々なものが含まれると考えられる。このような柔軟性があれば、効率性を高めつつ、医薬品開発のニーズに最適なモデルを選択することができる。以下に、有効性/有効性試験を組み合わせた3つのモデルを示する。これらのモデルでは、図示されていないタイミングやその他のバリエーションが特定の状況下で必要となる場合がある。さらに、有効性の要素は有効性の要素よりも長くなる可能性があることにも留意する必要がある。これは、治療期間の延長や、現実の診療で考慮すべき長期的なアウトカム指標を反映している可能性があるからである。広範な組み入れ基準により、より容易でタイムリーな募集が可能になるかもしれないが、これは研究に特有のものであろう。また、有効性成分の募集を制限しないことで、有効性成分の登録基準を制限したことによる遅延を緩和できる可能性もあるが、これも試験によって異なる。
以下の図(図2)2)に示すように、完全に連続したE2E試験では、有効性のあるコンポーネントから始まり、有効性のある試験の登録が完了した時点で有効性のあるコンポーネントに移行するという選択肢がある。有効性試験の進行中に、薬事承認のための第一段階の結果の評価を開始することができる。場合によっては、E2E試験の終了および/または承認の完了前であっても、例えば適応または加速承認の経路でマーケティングを開始することができる。
図2 有効性から有効性への連続した試験で、有効性試験の登録後に有効性試験に移行する。
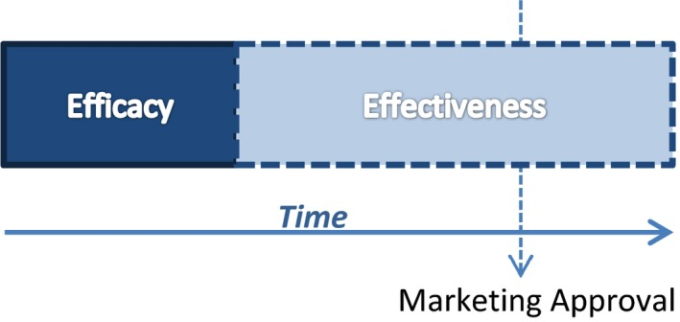
第二の選択肢(図3)3)は、逆に、EfficacyとEffectivenessの構成要素を完全に同時に実施することであり、EfficacyとEffectivenessの両方のコホートが試験の最初から登録される。この方法は、有効性が実証される前に有効性の部分に先行投資するという形で、製薬会社にリスクをもたらす可能性があるが、運営上の試験実施の観点からは、より効率的であると考えられる。このアプローチのインセンティブは、支払者などの他の利害関係者を早期に満足させることができる可能性にある。
図3 EfficacyとEffectivenessのコンポーネントを同時に実施し、両方のコホートが試験開始時から登録される
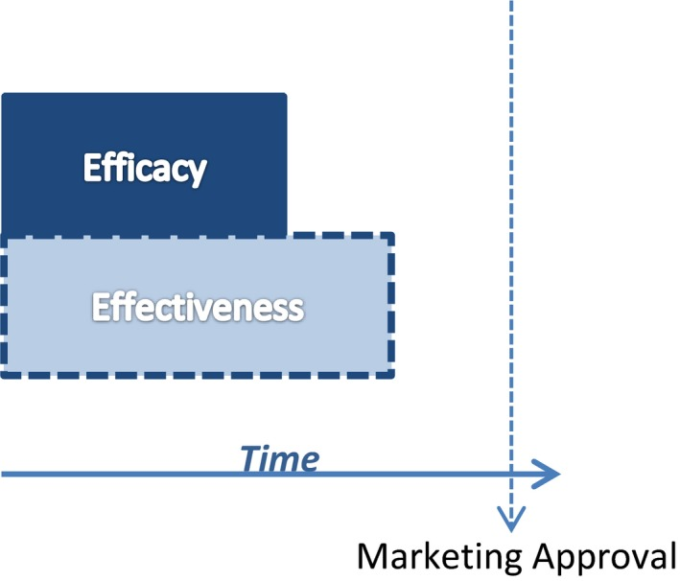
第3の選択肢(図4)4)は、時差式のEE2試験である。この試験では、有効性の項目のみで開始し、事前に指定した時点で、結果の中間評価を行う。中間解析に対応するためには、試験の検出力を高める必要があり、その決定にはαペナルティが伴う。中間評価でポジティブなシグナルが観察された場合、有効性の評価を開始する。この設計により、製薬会社は試験を拡大する前に成功をある程度保証することができ、また、有効性の証拠を早期に得ることで時間を効率化することができる。EE2デザインの本質的な要件ではないが、これは、試験全体の効率をさらに高める可能性のある、拡張時の適応的な試験機能を含んでいると考えられる。
図4 EfficacyとEffectivenessをあまりにもずらした試験;有効性コホートが完全な有効性コホートの前に開始される
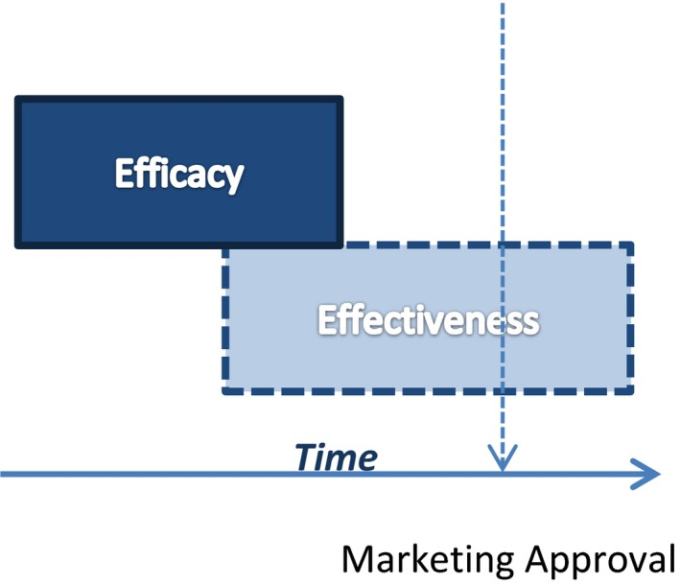
以上のように、IMMEDIATE試験は、EE2試験の特殊なケースである。薬事承認のための有効性解析は、有効性コホートに対して行われた。この記事の焦点ではないが、上記のデザインとの対比のために、図55に示されている。
図5 EfficacyとEffectivenessの両方の基準を満たす単一の登録で、有効性コホート全体を対象とした有効性分析を行う
分析の枠組み
図6は、有効性コホートと有効性コホートの関係を示している。まず、図11の大きな円で示されているように、患者が幅広い有効性の除外基準を満たしているかどうかを判断することから始まる。患者さんがそのような条件を満たしている場合、さらに、有効性の除外基準を満たしているかどうかを判断する。満たされていれば、その患者さんは中央の円の中に入り、有効性と効果の両方のコホートに含まれることになる。有効性の基準が満たされていない場合、そのような患者は中央の円に含まれない大きな円の領域に入ることになる。
図6 効能・効果も試験のフローチャート
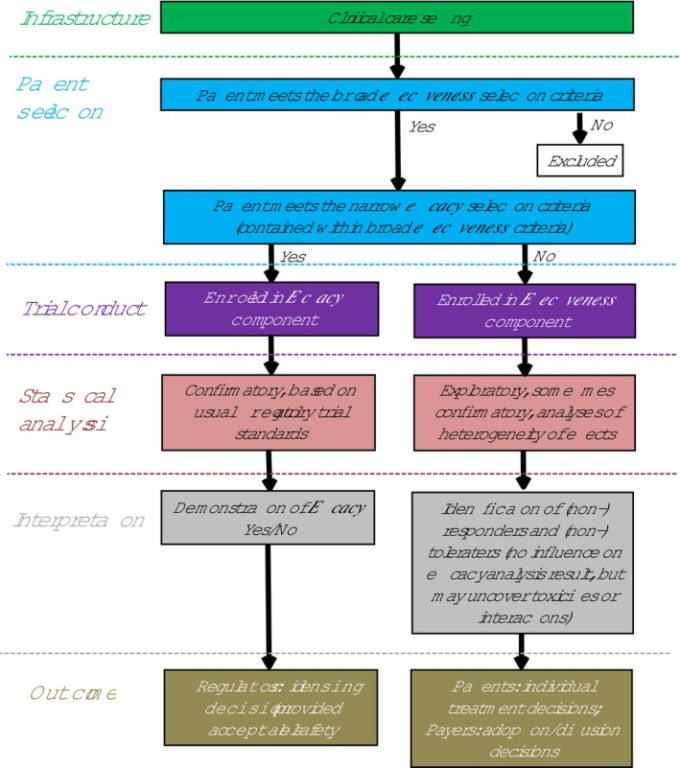
図6に描かれているように、この2つのコホートは別々の統計解析を行う。有効性コホートでは、規制当局に認められた典型的な分析手順により、予定された統計的検出力を持つ、事前に指定された臨床エンドポイントがある。有効性コホートでは、あらかじめ統計的検出力のあるエンドポイントが設定されている場合と、仮説検証のための検出力がない探索的な場合があるが、治療効果の異質性の検出とモデル化を目的とした分析も行われる。有効性コホートは、特に追跡期間が長くなる可能性が高いため、おそらく安全性シグナルについても分析されることになるであろう。IMMEDIATE試験では、有効性コホート全体を対象に有効性解析を行ってたが、このような2レーンでの解析は、IMMEDIATE試験の1レーンでの解析とは異なる。
データ解析には様々な方法が考えられるが、有効性コホートがより広範なエフェクティブネスコホートのサブセットであっても、主要な有効性仮説が最初に試験され、事前に規定された計画に従って行われると考えられる。有効性の仮説は、二次的な仮説として考えられ、場合によっては、統計的有意性を検出するために事前にパワーを与えることができる。また、探索的な分析などの場合には、これらの副次的仮説は有意性のための検出力を持たないこともある。そのため、主要な有効性の分析では肯定的な結果が得られ、規制目的に適しているが、副次的な有効性の分析では、幅広い関係者に情報を提供するにもかかわらず、有意差が得られない可能性がある。あるいは、主要な有効性分析が肯定的でない場合、市場承認には至らないものの、広範なデータと分析が今後の取り組みに役立つと考えられる。
EE2試験をデザインする際には、様々な要因に基づく異なる患者集団における治療法のリスクとベネフィットを考慮して、EfficacyとEffectivenessのコホート、2つのコホートの登録の重複度、適応策の使用などについて最適なデザインを決定する。これらの要因には、スポンサーの臨床開発およびマーケティング計画、既に得られている有効性および有効性のエビデンスの強さ、およびその他のビジネス上および運営上の考慮事項が含まれる。最適なデザインを決定するためには、シミュレーションを行う必要があると思われる。統計学的な観点から、これは必ずしもEE2アプローチに固有のものではないが、E2E/EE2構成要素の重なりのスペクトルに関連する分析は、適応設計と考えることができる14。これはおそらく、完全同時のEE2試験、完全逐次のE2E試験、およびずらしたEE2試験で分析的に類似しており、中間検査では必要に応じてα値を適切に調整する。
考察
デザインに関する考察
EE2試験では、薬事承認のための薬効評価と実使用のための有効性評価を1つの試験で同時に行う。そのため、全体のコホートには、有効性の分析を行うための明確な登録基準を持つコホートと、その治療法が実社会で使用される可能性のある幅広い患者が含まれる。さらに、EE2の有効性の部分は、有効性の部分よりも長期間にわたって実施される可能性がある。これは、長期的なアウトカムが、臨床現場での治療の慢性的な使用をよりよく反映するためである。したがって、理想的には、1つの試験で両方のタイプの目的が達成されることになる。
以前に発表したE2E試験デザイン4では、有効性試験への継続は、最初の有効性試験がエンドポイントを有意に達成することが前提となっている。有効性試験が、有効性試験の結果を受けて直ちにシームレスに行われることで、有効性に関するエビデンスをより確実に、より早く得ることができる。しかし、EE2デザインでは、有効性試験と有効性試験を同時に実施することで、総試験期間をさらに短縮できると考えている。(この文脈では、完全に連続したE2Eデザインは、EE2試験の特定のタイプとみなされる)。
さらに、特定の試験では、2つの成分が完全に連続しているものから完全に同時に行われるものまで、様々なデザインが考えられる。実際、開始時期をずらした部分的に重なる試験では、有効性試験が進行中に、有効性試験の開始に合わせて適応的な調整が行われる可能性がある。治療法開発プログラムの期間とコストを削減するための最近の取り組みは、アンブレラとプラットフォームの適応設計に焦点を当てている15。これらのタイプの試験デザインの革新は、EE2デザインの考慮事項と組み合わせることができ、患者と医師のための追加情報の費用対効果を段階的に改善することができる。
EE2アプローチの基本的な前提は、有効性試験とエフェクティブネス試験の両方が必要であるということである。有効性試験は規制当局の承認を得るために必要であり、新薬を市場に投入するための基盤となる。有効性試験は、これまではある程度自由裁量で行われてきたが、実社会での適用可能性や、広く通常の診療で見られる患者の範囲を示す証拠として、患者や支払者からますます求められるようになっている。また、国民に対する責任を負う規制当局も、有効性試験から得られる情報に関心を持つようになっている。
このようなメリットを得るために、EE2試験にはいくつかの重要な特徴がある。
- 有効性試験のデザインとエンドポイントは、試験が成功した場合に規制当局の承認を得るのに十分なものでなければならず、これは試験前に規制当局がプロトコルを承認することで証明される。
- 有効性の項目では、年齢、合併症、多様性などの理由で有効性試験の対象とならないことが多い参加者を含め、最終的に治療が意図されている患者や環境で治療法を試験する必要がある。さらに、治療期間は実世界での使用に近いものにすべきである。
- 参加基準を広げることに加えて、有効性の項目では、特定のサブグループを強化して、特別な効果や治療効果の異質性を対象とした分析を可能にすることができる。
- EE2試験への登録は、通常の臨床治療と互換性のある方法で行い、適格な患者の登録率を報告するための分母を正確に評価するメカニズムを持つべきであり、これにより、広範な対象集団と比較した試験サンプルの理解が容易になる。
- 有効性の要素は、承認を遅らせたり、統計的に有意でない場合に承認を妨げるものであってはならない。
このような特徴から、有効性試験とエフェクティブネス・トライアルを同時に実施することには大きなメリットがあるはずである。試験の準備や実施にかかる作業効率が向上するため、2つの試験を実施するために必要な時間、労力、コストを削減することができる。また、患者さん、医療費支払者、医療従事者のそれぞれの関心事に沿った指標を取り入れることができるため、患者さん、医療費支払者、医療従事者に広く受け入れられる可能性がある。しかし、分析計画は、様々な薬剤や状況下でのピボタル試験に適したものでなければならない。有効性コホートの対象基準と臨床設定は、より広範な有効性コホートの対象基準と設定のサブセットであるため、解析計画では、規制要件に沿って有効性コホートを試験する能力を維持し、その後、より広範な有効性コホートで事前に設定した仮説を検証できるようにする必要がある。完全同時のEE2試験、時差をつけたEE2試験、完全に連続したE2E試験での仮説検証に対応するためには、解析上の調整が必要となる。いずれの場合も、分析手法は、まず規制当局の承認を得るための有効性データを検証し、その後、患者、支払者、その他の利害関係者にとって重要となる広範な使用における効果を検証する必要がある。
EE2アプローチにとって難しいと思われる状況は、がん試験で多く見られるような、特定の生物学的または遺伝子的マーカーを用いて治療法を示す試験かもしれない。おそらく、分子マーカーを持つ人以外の人を含めることはできないであろう。しかし、より広い有効性の観点から、併存疾患や腫瘍の既往歴など、実際にこの治療を受ける患者の典型的な特徴を持つ患者の登録を認めることができる。実際に、しばしば高価なこのような治療法の普及に伴い、すべての利害関係者は、このような治療法の最適な使用法と限界に関する証拠を得ることに関心を持っている。
治療法の種類によっては、EE2試験に適しているものと適していないものがある。経験を積むことで、アプローチやプロセスが変化し、それぞれのケースの詳細が明らかになる。この初期段階では、これらの検討においていくつかの一般的な特徴が役割を果たしていると考えているが、このような問題の理解と対処によって発展していくであろう。潜在的に困難な分野の例を以下に示する。
最初のEE2試験に適していないシナリオは、新しい分子化合物で、理想的にはプラセボ群と比較したときの安全性プロファイルを理解するのに十分なデータがまだない場合である。そのような初期段階では、合併症を最小限に抑えながら、重大な交絡因子なしに安全性プロファイルを知ることが重要となる。
EE2試験が機能する例としては、第2相の有効性試験に成功した卒業生であり、優れた潜在的利益を示した薬剤の場合が挙げられる。この場合、異種集団を対象とした第III相確認試験は、市場への受け入れと普及に役立つであろう。
また、脂質低下作用のあるスタチン系薬剤やアンジオテンシン受容体拮抗作用のある降圧剤などの「me too」の新薬も適している可能性がある。このような薬剤は、そのクラスのリスクとベネフィットが一般的に知られており、幅広い集団において幅広い有効性と差別化された利点を示すことが重要となる。
また、ベネフィット・リスク・プロファイルが確立されている市販薬で、新たな治療適応が望まれているものも適していると思われる。例えば、数年前から関節リウマチの治療薬として販売されている腫瘍壊死因子(TNF)阻害剤について、スポンサーが脊椎関節症の一つへの適応を求めているような場合である。また、糖尿病治療薬であるナトリウム-グルコース共輸送体2型阻害剤とメトホルミン、閉塞性肺疾患治療薬である吸入β2アドレナリン系気管支拡張剤、ステロイド、抗コリン系気管支拡張剤などの配合剤は、安全性と有効性のプロファイルが充実しているものの、併用に関するデータが不足しているため、EE2試験を実施することが有効な薬剤の一例である。また、ある種の癌を対象とした分子標的薬で、スポンサーが同じ分子標的を持つ別の癌の承認を求めている場合も、このような試験の論理的な候補となる。
EE2試験に適した別のケースとしては、以前のEE2試験で明らかになった効果の不均一性の分析で特定された、明確な集団で薬剤を試験する場合が考えられる。そのような特徴とは、特定の臨床的・生理的特徴や薬剤に対する反応、バイオマーカー、遺伝的特徴などが考えられる。別のアプローチとしては、冠動脈疾患を反映する遺伝子マーカーを用いて、抗コレステロール剤であるスタチン治療が最も効果的な集団にターゲットを絞る方法が提案されている16, 17。このアプローチは、異なる病態生理学的プロセスを持ち、それゆえに異なる治療から恩恵を受ける特定のサブグループについて十分な知識がないまま、現在治療を行っている症候群にも適用できる。例えば、「2型糖尿病」のような複雑な慢性疾患は非常に異質であることが理解されており、インクレチン経路阻害剤やナトリウム-グルコース共輸送体2型阻害剤などに反応する可能性が高い患者を層別化することは、より生産的であると考えられる18。このアプローチにより、複雑な慢性疾患や症候群の現在のやや粗い診断を、おそらく遺伝子ベースの診断ツールによってより精緻化し、より良い層別化と標的治療を可能にすることができるであろう。EE2試験では、このような指標で定義された全体的な対象集団を対象とすることができるが、それでもEfficacyとEffectivenessの要素が重要となるであろう。後者は、年齢、併存疾患、環境、その他の特徴を考慮した上で治療効果を検討することができ、それがより広い範囲の診療に役立つであろう。
ステークホルダーのニーズと関心のバランス
患者や医療費支払者は、実際の診療に関連するEE2の結果を高く評価するであろうが、製薬会社は有効性の項目に懸念を抱くかもしれない。製薬会社は、医薬品開発や臨床試験への多額の投資が、雑音と信号の比率の増加によって損なわれることを懸念しているかもしれない。試験参加者の異質性により、より選択的な試験サンプルで検出されたはずの有効性のシグナルが希釈されたり、圧倒されたりする可能性がある。さらに、有効性試験の要素が肯定的であったとしても、その結果は、効果のある人一人当たりの治療必要数の増加を意味し、使用や償還に悪影響を及ぼす可能性がある。
有効性コホートの主要な分析として事前に指定する以外にも、特定の患者グループの治療決定に情報を提供したり、治療から利益を得る患者を特定するための多変量モデルを作成するために使用することができる、対象となる集団の事前指定された分析および/または有効性データの探索的分析が、対抗的な側面として考えられる。さらに、より広範な有効性コホートを対象としたこれらの追加解析は、たとえ全体的な効果が少ない、あるいは全くないことを示したとしても、患者さん、臨床医、支払者にとっては興味深いものとなるであろう。実際、より広範な登録基準が用いられなければ、患者、臨床医、支払者は、主要な臨床試験で有効性が示された患者よりもはるかに広い範囲の患者に新しい治療法が使用されることに懸念を抱くであろう。そうでなければ、その治療法が効かないかもしれない、毒性があるかもしれない、新たなコストが発生するかもしれない、といった疑問が残り、新薬の販売能力に影響を与える可能性がある。このように、EfficacyとEffectivenessの両方の結果を使用するための明確な計画を持つことは、すべての利害関係者にとって有益であると考えられる。
このようなEE2計画を作成する際には、理想的には、各利害関係者のニーズ、インセンティブ、および展望が明確に示され、対処されることになる。医薬品メーカー、患者、支払者、規制当局などの主要な利害関係者が研究のデザインに関与することで、除外基準や分析計画の詳細を決めることができる。これは容易なことではない。研究課題や仮説の階層化には合意が必要であり、研究サンプルや臨床使用を最終的な対象者や幅広い診療に適合させる必要がある。妥協とトレードオフが必要となるであろう。しかし、私たちは、すべての利害関係者、医療システムや国民にとっての利益は、この作業を正当化するものであると信じている。さらに、このような対話の経験が増えるにつれ、このアプローチを成功させるためのインセンティブや妥協点のタイプが明らかになってくるはずである。表11は、様々なステークホルダーがEE2試験に関して抱くであろうベネフィットとリスクに関する懸念の一部を示している。
表1 効能・エフェクティブネス試験に関するステークホルダーのベネフィットとリスクに関する懸念
| 利点 | リスク | |
|---|---|---|
| 患者と臨床医 | 個々の治療法の選択を通知するためのデータ。これにより、より良い結果が得られ、治療上の不幸を回避できます。 共有された患者と医師の意思決定に情報を提供する証拠。 |
誤解を招く/不完全な情報。 解釈が難しい情報。 情報過多。 |
| 医療グループのリーダーとしての臨床医 | 個人および集団の健康管理に情報を提供するデータ。 財務スチュワードシップ。 |
誤解を招く/不完全な情報。 解釈が難しい情報。 情報過多。 |
| ガイドライン開発者 | ガイドラインに情報を提供するための追加の詳細データ(費用対効果を含む)。 | 誤解を招く/不完全な情報。 解釈が難しい情報。 情報過多。 |
| 支払人/医療技術評価 | どの患者の特徴が結果に違いをもたらすか、実際の使用と影響を含む、現在使用されているエージェントを置き換える新しいエージェントの結果を含む、採用(処方集に追加)と拡散(カバレッジ)の決定を通知するためのエビデンスとデータ。 | 有効であることが示されている医薬品の適用範囲の拡大による追加費用。 |
| スポンサー | 支払者による早期かつ広範囲の補償。 安全信号の以前の、より詳細な検出。 市場浸透のより良い理解。 売上の増加。 |
追加の初期費用。 有効性メッセージの希釈。 売上の減少。 承認の遅れ。 |
| 規制当局 | 以前の/追加の安全情報。 堅牢な有効性データへのアクセスを維持します。 異質性のより良い理解。 |
追加の複雑な分析。 タイムラインへの悪影響。 |
| 公的/社会的費用と利益 | グループと集団の治療法の選択を通知するデータ。これにより、健康とコストの結果が改善される可能性があります。 医療提供とリソース割り当てについての対話を通知します。 |
誤解を招く/不完全な情報。 解釈が難しい情報。 情報過多。 |
この成功には、経験、Win-Winのソリューションへの配慮、そして優れた政策立案が鍵となるが、助けとなる特定の戦略があるかもしれない。例えば、上記で示唆されているように、EE2試験の分析は、まず有効性の効果を検討し、次に有効性の効果を検討するという2段階で行うことができる。これは、有効性コホートの組み入れ基準と設定が、より広範な有効性試験の組み入れ基準と設定のサブセットであり、主要エンドポイントが有効性コホートであるという事実に基づいている。階層的な分析を行い、まず有効性の高いサンプルから始め、その結果が有意であれば、有効性の高いサンプルで同じ仮説を検証し、その他の事前に計画された分析も行うことになるであろう。両方の解析で主要評価項目に統計的有意性が認められれば、その薬剤が標的集団において有効であり、より広範な実世界の集団においても有効であることを示す最良のケースとなる。
しかし、ある薬剤が、有効性の対象となる集団では有意な効果を示しても、より広範なエフェクティブネスの対象となる集団では統計的に有意な結果が得られない場合がある。このような場合でも、より異質な有効性サンプルを用いることで、期待される効果を軽減する要因についての有益な探索的分析が可能となり、その薬剤をより広く使用するための情報を得たり、追加の研究を提案したりすることができると考えられる。このような場合、有効性の結果に対して規制当局が承認を与えることで、メーカーが恩恵を受ける人々に治療を提供することを妨げないが、フォローアップ調査が必要であるという議論がなされ、適応承認19や類似の軌道などのアプローチが検討されるかもしれない。また、有効性の分析では統計的有意性が得られなかったが、エフェクティブネス試験では統計的有意性が得られたというように、逆のことが起こる可能性もある。これは、後続の研究を進める上で有用であり、具体的な内容によっては、アダプティブ・ライセンシングの検討につながる可能性もある。
規制上の問題
規制面では、有効性試験の結果が良好で、毒性プロファイルが良好であれば、その製品はライセンスされる可能性がある。しかし、ライセンスが発行されると同時にエフェクティブネスの結果が出てきて、それが統計的有意性に達していないという事態が発生する可能性がある。スポンサーとの合意では、有効性の結果は規制当局の意思決定プロセスに影響を与えないことになっているので、規制当局は承認を進めるであろう。しかし、現実に使用される可能性の高い治療法では効果がないように見えることがすでに知られているため、規制当局にとっては課題となる。このような状況を回避する方法として、今日では、承認時には有効性の結果のみが入手可能であり、規制当局は、エフェクティブネスの欠如について対処する必要がない。社会的な観点から見ると、このようなデータが入手でき、薬の最適な使用法をめぐる実行可能な計画があることは魅力的に思える。さらに、後になって有効性の項目で重要な効果、相互作用、毒性が明らかになった場合、国民を保護するために何らかの規制措置が必要となる可能性がある。
医薬品開発プログラムの一環としての有効性成分の別の観点では、全体的に肯定的な結果は必ずしも期待できない。目的は、有効性の部分のように、対照群と実験群の全体的な効果について、通常の統計的検定を行うことではない。目標は、治療効果のバリエーションと限界を探るために、より多くの患者を含めることである。いずれにしても、安全性データベースが拡大され、対象となるサブグループが強化され、反応を弱めたり強めたりする他の交絡因子が発見される可能性がある。
規制面では、現在の法律では、新しい治療法の承認に有効性の部分を要求することはできない。しかし、有効性の部分が、市販後に求められる可能性の高い規制に対応できるように設計されていれば、規制当局が重要視する残留不確実性に関する知識を提供することができ、その情報を迅速に提供できる可能性があり、スポンサーに商業的に望ましい表示の補足を提供できる可能性がある。このスキームを実行に移すためには、製品が承認された場合の市販後の潜在的なコミットメントについて、スポンサーと規制当局の間である程度具体的な話し合いが事前に行われる必要がある。EE2試験への圧力の多くは、市場や患者代表から来るものと思われるが、規制当局は、そのような試験の実施によって規制目標が損なわれないようにすることが重要だ。
業界の視点
製薬会社のスポンサーにとって、(EE2試験の有効性の要素に基づく)第一の目標は、法令に記載されている通り、有効性を実証することである。第二の目標は、患者、医師、支払者に関連する情報を早期に収集し、償還までの時間を短縮することである。有効性の部分が否定的であっても、製品が承認されるという保証がないスポンサーは、EE2試験の実施に同意しないであろう。しかし、有効性に関するエビデンスがあれば、話を進めることができる。場合によっては、スポンサーは、規制上の考慮事項とは別に、治療による公衆衛生上の影響の可能性の大きさや、臨床試験で十分な結果が得られなかった患者集団の代表性に応じて、このようなデータを使用するインセンティブを持つかもしれない。
より具体的には、EE2データは、市場、特に支払者(保険会社や政府を含む)が新薬を受け入れる際に重要な役割を果たす可能性がある。特に医療技術評価(HTA)機関のある国では、EE2試験を行うことによる追加コストの懸念を払拭するために、早期に償還を受けることができるというメリットがあるかもしれない。歴史的にHTA市場が成熟していたのは欧州、オーストラリア、カナダであったが、最近では、米国では独立したHTA機関としてICER(Institute for Clinical and Economic Review)が設立され、日本でもHTAシステムの構築が議論されている。この傾向は、ほとんどの主要な医薬品市場において、HTAシステムが導入されているか、あるいは間もなく導入されることを意味している。これにより、これらの製品の臨床的・経済的価値が評価され、評価委員会による適用・償還の決定に反映される。多くの場合、これらの評価を用いた評価委員会は、比較効果の臨床データや対象となる集団が不確実であることから、その製品の価値は低いまたは中間的であると結論づけている21。このような要求を予測して、メーカーは現在、このようなデータをタイムリーに提供する方法を模索している。このような要求を予測して、製薬企業は現在、タイムリーにデータを提供する方法を模索している。製薬企業は、自社の薬剤を販売したいと考えている幅広い患者に有効であることを示す証拠を提供し、支払者のフォーミュラリーに3次または4次以外の順位で掲載されることを望んでおり、圧力は高まっている。後述するEE2試験の例の中で、プロタンパク質変換酵素サブチリシン/ケキシン9型(PCSK9)阻害剤の例では、EE2試験のように、より多くの人々を対象に試験を行っていれば、これらの薬剤へのより広いアクセスが認められていたかもしれないと述べている。また、PCSK9阻害剤の場合、現在の経済分析や市場の反応からもこのことが示唆されている22,23。これは、規制当局からの圧力がなくても、市場の力や支払者(政府支払者を含む)がEE2試験の実施にインセンティブを与える例かもしれない。実際、規制当局からではなく、市場からの圧力が、より多くの有効性試験を行うための重要な動機になると考えており、EE2試験はそのための最も効率的な方法であると思われる。
もう一つの重要な要素は、安全性に関するサブグループ特有の問題について、より早い段階でエビデンスを得ることで、医薬品の市場からの全面的な撤退ではなく、部分的な撤退を可能にすることである。スポンサーにとって悪い結果となるのは、特定のサブグループに対する償還が制限されることである。
薬剤に悪影響を及ぼす部分集団を特定するための十分な情報がなかったために、薬剤が取り下げられた例がある。また、治療を受けてはいけない人について規制当局が理解していたために、薬が回避されたケースもある。規制当局は、特に毒性に関する詳細な情報を持っていればいるほど、販売を許可する可能性が高くなる(少なくとも、許可した後に撤回しなければならないという心配はない)。
EE2試験の可能性の例
EE2試験の基本的な特徴と、有効性・効果のエビデンスを効率的に作成するために想定される利点については、上述の通りである。EE2試験の利用可能な例は、治療法の理解と適用性を拡大する上で、広範な登録者を加えることによるより具体的な利点を示している。
併存疾患がある場合の薬剤の作用を理解することは、EE2試験の明確な目的である。しかし、併存疾患のある患者を含めることで、より多くのことが明らかになる可能性がある。その一例が、RAに対するmethotrexateの使用のケースである。
RAを含む自己免疫疾患や慢性炎症性疾患に有効であることは古くから知られており、メトトレキサートは症状、QOL、疾患の進行を改善することが実証されている24。メトトレキサートの心臓保護作用は、全身の炎症を抑制し、動脈硬化につながる細胞メカニズムに影響を与えることによるものと考えられる25, 26。このように、RAの試験コホートには共存症が存在するため、RA患者の全体的な心血管疾患(心血管疾患)の負担を軽減することが判別されている。これに基づいて、この観察から数年後の現在、RAではない心血管疾患を有する一般の患者を対象とした低用量メトトレキサートの臨床試験が完了しつつある。
RAに対するメトトレキサートの初期の臨床試験において、一般的な合併症を有する患者を含めるという明確な目的があったならば、この心臓保護効果はもっと早くに認められていた可能性がある。さらに、現在RA以外の患者でも検討されているように、EE2試験から得られた探索的な分析により、RA以外の心筋保護のためのメトトレキサートの使用について、さらなる検討がなされていたかもしれない。メトトレキサートは、他の自己免疫性リウマチ疾患や一部の悪性腫瘍にも使用されていることから、心血管疾患を発症している、またはその傾向がある患者、つまり、主要な対象疾患に対する有効性評価試験では避けられていた患者に対しても、同様の有益な効果が認められる可能性が考えられる。
抗炎症作用がRAと心臓保護の両方におけるメトトレキサートの有益性の共通の特徴であるかもしれないという事実は、がんにおける「バスケット・トライアル」の概念的モデルを提起している。これは、異なる器官またはタイプのがんで発見された共通の分子標的を利用して、その標的に対する特異的な作用のために一見多様ながんに薬剤を使用するというものである27。しかし、他のいくつかの例は、バスケット・トライアルのコンセプト・モデルに近いかもしれない。28, 29, 30, 31, 32 これらの疾患の生物学的な共通性を考慮すると、スポンサーは、適切な配慮のもと、tofacitinibの有効性をRAで確認しつつ、乾癬性関節炎および/または潰瘍性大腸炎の集団にもコホートを拡大して、これらの集団における潜在的な有用性を評価する試験(すなわち、シグナルファインディングコホート)を実施することができたはずである。シグナルファインディングコホート)を実施し、追加適応のための有効性確認試験の準備を進めている。既存の臨床試験インフラを活用することで得られる時間とコストのメリットは、全体的なコストやその他のリスクとのバランスを考慮する必要がある。TNF阻害剤の場合、歴史的に1つの適応症(例:クローン病)で試験を行い、その後、RA、乾癬、乾癬性関節炎で追加試験を行っていた。例えば、ホスホジエステラーゼ4を選択的に阻害し、ヒトリウマチ滑膜細胞からのTNF-αの自発的産生を阻害するアプレミラストは、乾癬を適応症として開始され、現在はベーチェット病を適応症として試験が行われている33。したがって、バスケット試験の明確な目的は、リウマチ疾患の重複や共存を理解するためのクロスコンディション試験を可能にすることであるが、EE2試験で可能な幅広い登録者数は、バスケット試験のような試験を実施する前であっても、より幅広い応用につながるシグナルを生成するのに役立つと考えられている。
34, 35, 36, 37 もし、初期の臨床試験で、家族性高コレステロール血症のみを対象とした主要な有効性解析が行われていたとしても、より一般的な原因の高コレステロール血症の患者、特にスタチン系薬剤の副作用を持つ患者にも、より早く効果が現れていたかもしれない。米国の成人の3分の1,7,100万人が低密度リポ蛋白(LDL)の濃度が高く、約1,100万人がLDLの減少目標に到達していない。これは、遺伝的な要因によるものもあるが、スタチン系薬剤の副作用に耐えられないことが原因の場合もある。家族性高コレステロール血症および既往症のある患者を対象とした戦略の一部は、これらの薬剤のコストを考慮して、これらの高LDL、高リスク群で明確な効果を示すことに成功する必要があったためであると理解されているが、EE2試験では、実用的な臨床および規制当局によるスタチン不耐性の定義が確立されていれば、恩恵を受ける患者を拡大する機会を示すことも可能であったと考えられる。
結論
EE2試験は、規制当局の承認を得るために有効性を厳密に示すと同時に、実臨床に適用できる治療効果を評価することを目的としている。EE2試験の具体的なデザインは、スポンサー、規制当局、患者、臨床医、支払者など、すべての利害関係者の関心事によって決まる。全体的なデザインでは、EfficacyとEffectivenessの構成要素の時間的な重複の度合いを変えたり、移行時に適応性のある試験機能を使用したりすることなどが考えられる。また、対象とする集団や環境、分析方法の詳細については、関係者のニーズを満たすものでなければならない。最終的な目的は、重要な医薬品を、実際の使用方法に関する貴重なエビデンスに基づいて市場に投入することである。
このアプローチを提案するにあたり、我々は、両方の要素を持ちながら通常の厳格な基準を満たさない、2種類の試験の妥協点を提案しているのではない。むしろ、この組み合わせは、両方の利点を得ることを目的としている。EE2試験の有効性の部分は、厳格な規制と科学的基準に基づいて実施されなければならず、有効性の部分は、通常の医療環境での使用を真正に示すものでなければならない。言い換えれば、エフィカシーからエフェクティブネスへの試験手順と実施のスペクトルを考慮すると、EE2デザインは、スペクトルの両極端、すなわち有効性の証拠を得るための充実した厳しい選択基準と、現実の世界で広く行われているような集団のデータを維持するモデルと考えることができる。
EE2試験を計画・実施する際には、各関係者の現在および将来のニーズ、動機付け、展望を考慮し、対処する必要がある。最終的には、科学や政策が進化する中で、共通の目的は、個々の患者や集団にとって重要な成果をもたらし、患者や国民の健康に与えるポジティブな影響を最大化することである。これは困難なことではあるが、すべてのステークホルダー、医療システム、そして国民にとってのメリットは、この努力を正当化するものであるはずである。
