Effects of N-acetylcysteine, oral glutathione (GSH) and a novel sublingual form of GSH on oxidative stress markers: A comparative crossover study.
www.ncbi.nlm.nih.gov/pmc/articles/PMC4536296/
要旨
グルタチオン(GSH)は、酸化ストレスとの戦いに不可欠である。その非常に低いバイオアベイラビリティーは、サプリメントの関心を制限する。本研究の目的は、バイオアベイラビリティ、酸化ストレスマーカーへの効果、および新しい舌下型GSHの安全性を、一般的に使用されている2つの栄養補助食品、N-アセチルシステイン(NAC)および経口GSHと比較することであった。本試験は3週間の無作為化クロスオーバー試験であった。メタボリックシンドロームを有する20名のボランティアが登録された。GSHレベルといくつかの酸化ストレスマーカーが、21日ごとに異なる時間帯に測定された。舌下投与群では、経口投与群と比較して、血漿中の総GSH値および還元GSH値の上昇が認められ、GSH/GSSG比が高くなった(p=0.003)。また、投与3週間後には、ビタミンEの血漿中濃度の有意な上昇が舌下GSH群のみで認められた(0.83μmol/g; p=0.04)。これらの結果は、経口GSH製剤やNACと比較して、新規の舌下GSH製剤がGSH補給の面で優れていることを示している。
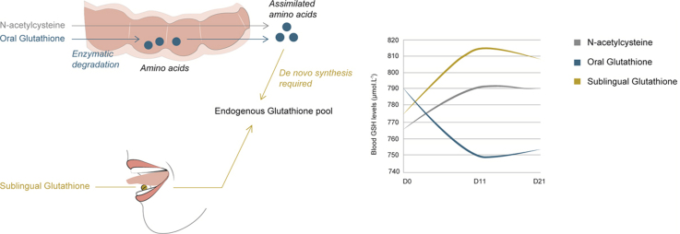
1. はじめに
グルタチオン(GSH)は、多くの組織や細胞にミリモル濃度で存在するユビキタス水溶性分子である。グルタチオンは、チオール基を含む最も豊富な細胞内低分子ペプチドである。このチオール基の機能はGSHの生物学的活性に重要である[1]。
GSHはグリシン、システイン、グルタミン酸の3つのアミノ酸から作られている。このトリペプチドは還元型(GSH)と酸化型(GSSG)がある。各形態の相対的な量は、細胞の酸化還元状態(GSH/GSSG比)を決定し、細胞の抗酸化能力の指標としてよく使用されている[2]。
GSHは多様な生理的役割を果たす。GSH は、強力なフリーラジカルや活性酸素消去剤である [3]。GSH は様々な分子(代謝物、外来物質)と反応して共役体を形成する [4]。GSHは、多くの細胞性タンパク質(メタロチオネイン、チオレドキシン)のチオール緩衝剤として機能する。GSHは多くの酵素にとって不可欠な補酵素であり、いくつかの代謝経路やシグナル伝達経路に関与している[5]。GSHはまた、トコフェロールやアスコルビン酸などの他の抗酸化物質の再生にも重要である[6]。
GSHホメオスタシスの機能不全がいくつかの疾患の病因に関与していることを示す証拠が増えてきている。GSH 枯渇に関連する最もよく知られた疾患には、神経変性疾患 [7,8]、肺疾患 [9]、肝臓疾患 [10]、免疫疾患 [11]、心血管疾患 [12,13]、老化プロセスそのもの [14] などがある。
いくつかの研究では、血漿中のGSHレベルが加齢とともに低下することが示されている。GSHの恒常性の低下は、他の生理的イベントとともに、老化過程や加齢に伴う疾患の出現に関与している可能性がある[15]。
このように、酸化ストレスの負の影響に対抗することで、これらの疾患を予防する可能性のある方法として、抗酸化物質の栄養補給が広く研究されてきた。
研究者らは、GSHを分解する腸内酵素であるγ-グルタミルトランスペプチダーゼ(GGT)の作用により、GSHは経口摂取では吸収されにくいことを示唆している[16]。動物への GSH 補給は、免疫機能の強化[17]、発がん抑制[18]、有害化学物質の排泄改善[19]などの効果があることがいくつかの研究で示されている。
しかし、ヒトではGSHの経口摂取の有効性については非常に議論のあるところである。多くの研究が行われているが、GSHの静脈内投与やネブライザーを用いた研究が行われている。経口GSHを用いて行われた研究の結果は混合している[20,21]。経口 GSH のヒトとラット/マウスとの吸収の違いは、腸内 GGT 酵素の量と活性の違いによって説明できると考えられている[21]。
経口GSHはGSHを摂取する最も便利で安全な方法であるように思われるが、有効性の欠如が、この形態が臨床試験で頻繁に使用されていない理由を説明している。
GSH産生を増強するもう一つの方法は、システイン前駆体であるN-アセチルシステイン(NAC)の使用に依存している。実際、アミノ酸のシステインはGSHの合成を制限する主な因子である。いくつかの研究では、NACは腸でよく吸収され、NACの補充はGSHレベルを増加させるのに有効であることが示されている[22]。しかし、NACの補給は、利用可能な原材料からグルタチオンを合成する体の能力に依存しており、この能力は年齢とともに、また特定の疾患、特に肝臓の機能障害の存在下では低下する。
活性還元型の全GSH分子を直接投与することにより、安全で簡便かつ迅速にGSHレベルを改善する方法を見つけることは、医学的に説得力のあるものとなるだろう。
経口GSHは腸内で酵素的に分解されるため、一つの解決策として、GSHのための舌下送達システムを使用することが考えられる。その送達ルートのための議論は、GSHトリペプチドが粘膜を介して非常によく吸収されることである。また、舌下送達ルートは、肝臓での一次代謝の影響を回避できることが知られている。この仮説に対処するために、食品グレードの舌下投与剤形を設計した。
この研究の目的は、GSHレベルを上昇させ、GSH/GSSG比に作用するためのそれぞれの興味を決定するために、2つの一般的に使用されている栄養補助食品、NACおよび経口GSHと、この新しい舌下投与形態のGSHの使用を比較することであった。
2. 実験部門
この無作為化クロスオーバー試験では、ベースラインとして摂取した前駆体(NAC)の効果と比較して、GSHの舌下投与形態と従来の経口投与形態の効率性に焦点を当てた。評価は、両タイプのGSHのバイオアベイラビリティ、酸化ストレスマーカーに対するそれぞれの効果、および忍容性に焦点を当てた。
2.1. 参加者
試験計画書は倫理委員会(CPP Ouest)およびAgence Nationale de la Sécurité du Médicament(ANSM)によって審査され、承認された。本研究の承認コードはAEC/B120599-40である。すべての臨床活動は、ヘルシンキ宣言、生物医学的研究に関するフランス公衆衛生法、およびClinical Best Practiceの規則に従って、Centre Hospitalier Bretagne Sud(フランス、ロリアン)で実施された。
合計20名の任意被験者(男性5名、女性15名)が登録された。被験者のベースライン特性を以下の表1に示す。
表 1 試験参加者のベースライン特性(平均±SD)
| 女性(n = 15)
|
男性(n = 5)
|
|||||
|---|---|---|---|---|---|---|
| 平均 | マックス | 最小 | 平均 | マックス | 最小 | |
| 年齢(年) | 59.73±8.4 | 67 | 38 | 53.6±4.67 | 59 | 47 |
| 体重(kg) | 75.97±10.17 | 87.5 | 52 | 88.44±5.18 | 95 | 84 |
| 高さ(cm) | 152.30±5.34 | 168 | 150 | 175.20±5.54 | 182 | 169 |
| BMI(kg / m 2) | 28.58±2.81 | 32.42 | 22.51 | 28.80±0.75 | 30 | 28 |
| SBP(mm Hg) | 135±15.3 | 160 | 110 | 129.2±11.6 | 150 | 130 |
| DBP(mm Hg) | 77.8±11.2 | 100 | 60 | 80.0±8.4 | 90 | 65 |
| トリグリセリド(g / l) | 1.27±0.63 | 2.61 | 0.44 | 1.74±0.70 | 2.68 | 0.60 |
| LDL-C(g / l) | 1.48±0.29 | 1.97 | 0.87 | 1.30±0.41 | 1.74 | 0.60 |
| HDL-C(g / l) | 0.68±0.28 | 1.38 | 0.41 | 0.65±0.37 | 1.39 | 0.36 |
| グリセミア(g / l) | 0.95±0.11 | 1.19 | 0.81 | 1.07±0.11 | 1.27 | 0.96 |
BMI:ボディマス指数; SBP:収縮期血圧; DBP:拡張期血圧
除外基準については、すべての被験者は、National Cholesterol Education Program ATP III[23]のガイドラインで定義されているメタボリックシンドロームに対応する低悪性度炎症状態の危険因子を有していた。 10~1.27 g/l(≧6および<7 mmol/l)血圧上昇(SBP>130 mmHgおよび/またはDBP>85 mmHg)高トリグリセリド血症>1.45 g/l(≧1.65 mmol)LDL-C>1.6~2.2 g/l(4.13~5.68 mmol/l)HDL-C>0.40 g/l(1 mmol/l)(男性)および0.50 g/l(1.3 mmol/l)(女性)の間のLDL-C値が1.6~2.2 g/lの間であった。また,たばこの消費量が少なく(5本/日以下),かつ座る生活習慣があることを条件とした。
除外基準については、抗炎症薬や非ステロイド性抗炎症薬を服用していなかった。心血管疾患や症候性慢性炎症性疾患の既往歴がなかった。抗酸化サプリメントやコレステロール低下剤を摂取していなかった。彼らは家族の習慣を尊重した自由な規則的な食事をしていたが、限定的でもなく広範でもなかった(平均エネルギー:2500kcal/日)アルコール使用障害識別テストの基準によると、中程度のアルコール摂取量(<20 g/日)であった。GGTは35IU/l、炭水化物欠乏トランスフェリン(CDT)は3%と劣っていた。
20名の参加者が試験を終了し、全てのデータを解析した。
2.2. 試験した製品
2.2.1. 舌下型グルタチオンの組成
この新しい特許取得済みのGSH(Sublinthion®)の舌下錠は、Laboratoires Le Stum(フランス、Larmor-Plage)から提供された。舌下錠1錠には150mgの還元型GSHが含まれている。投与量は、1日3回(朝、昼、夕)1錠を舌下で溶かすように投与した。これは、1日に450mgのGSHを摂取することに相当する。
2.2.2. グルタチオンの経口剤の組成
還元GSHの経口剤形は、l-Glutathione Reduce®(Laboratoire Equi-Nutri、ベルギー)であった。1カプセルに150mgのGSHが含まれている。本試験で使用された投与量は、1 日 3 回 1 カプセルで、合計 450 mg の GSH を摂取することができる。
2.2.3. 経口摂取された前駆体NACの組成
本試験に使用したNAC製剤は、Fluimucil®(Laboratoires Zambon、フランス)の商品名で販売されていた。1サシェには200mgのNACが含まれている。投与量は1日1サシェであった。
システインはGSH合成の制限因子であり、GSH分子の33.6%を占めている[24]。システイン(市販の投与量)の200 mgを提供することは、理論的にGSHの600 mgまでのde novoを合成するために体のために十分であろう。
2.3. 試験デザイン
各製品は、それぞれ21日間の3つの期間(P1,P2,P3)で連続して投与した。各製品の間には14日間のウォッシュアウト期間を設けた。投与方法は6種類の組み合わせが可能であった。NAC-PO-SL]、[NAC-SL-PO]、[PO-SL-NAC]、[PO-NAC-SL]、[SL-PO-NAC]、[SL-NAC-PO](POはGSHの経口形態、SLは舌下形態)の6つの組み合わせが可能であった。各組み合わせは、組み合わせごとに3つの被験者の最小値を尊重することによって、包含時にボランティアに無作為に割り当てられた。各期間は3回の訪問を含んでいた。V1;V2(V1+10±2日)およびV3(V2+10±2日)であった。合計で、各ボランティアは、2回の予備訪問(包含前訪問および包含前訪問)を受け、プロトコル中に9回の訪問を受けた。
除外前訪問では、除外/除外基準が被験者に説明され、これらの基準に従って初期スクリーニングが行われ、各被験者のインフォームドコンセントが収集された。
除外前訪問では、各被験者から完全な病歴を取得した。また、対象者の消化器、心血管、肺の状態を確認するために健康診断を実施した。
研究は以下の計画に従って実施した(図1)。
図1 試験のデザイン
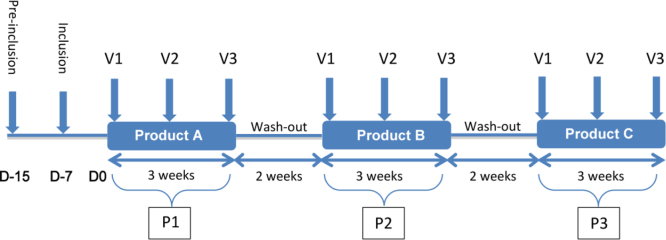
試験中、参加者の食習慣やライフスタイル(食事、身体活動、喫煙など)に変化はなかった。前の製品の服用による次の製品への残留効果の潜在的なバイアスを避けるために、各患者は彼自身のコントロールであった。表2は、本研究に組み入れた時点での各群の平均的な特徴を示している。
表2 組入時のボランティアグループの特徴(平均±SD)
| グループa | 年齢(年) | 高さ(m) | 重量(kg) | BMI(kg / m 2) | 収縮期血圧(mm Hg) | 拡張期血圧(mm Hg) | |
|---|---|---|---|---|---|---|---|
| 1 | NAC-PO-SL | 55±15 | 1.61±0.06 | 70.9±5.1 | 27.4±0.8 | 132±19 | 77±6 |
| (n = 3) | |||||||
| 2 | NAC-SL-PO | 54±10 | 1.65±0.06 | 77.9±7.3 | 28.6±1.9 | 138±18 | 80±9 |
| (n = 4) | |||||||
| 3 | PO-SL-NAC | 63±5 | 1.61±0.04 | 75.1±7.4 | 28.9±2.0 | 135±14 | 82±4 |
| (n = 4) | |||||||
| 4 | PO-NAC-SL | 59±8 | 1.54±0.06 | 71.4±17.0 | 30.0±5.4 | 137±12 | 83±15 |
| (n = 3) | |||||||
| 5 | SL-PO-NAC | 52±5 | 1.69±0.09 | 85.1±10.6 | 29.6±1.7 | 138±17 | 84±13 |
| (n = 3) | |||||||
| 6 | SL-NAC-PO | 61±7 | 1.63±0.15 | 76.6±14.3 | 28.6±2.0 | 125±9 | 77±6 |
| (n = 3) | |||||||
| 比較グループb | p = 0.26 | p = 0.23 | p = 0.28 | p = 0.59 | p = 0.80 | p = 0.72 |
2.4. 測定されたマーカーとパラメータ
血液検査は、すべてのボランティアについて、各期間の開始時(第1回目、治療を受ける前)中間時(第2回目)終了時(第3回目)に実施された。各訪問時に、以下のパラメータを測定した。
2.4.1. 総GSH;GSH(還元);GSSG(酸化);比率GSH/GSSG
内因性グルタチオンは、以下の分析プロトコルに従って測定した。簡単に言えば、動脈血サンプルを、抗凝固剤としてのリチウムヘパリンバキュテーナー中に採取した。全血400μlをメタリン酸3.6mlに採取し、全血、還元型(GSH)および酸化型(GSSG)グルタチオンの定量を行った。遠心分離(4000g、10分、4℃)後、総および還元GSHを酸性タンパク質フリー上清中で酵素的に決定した。GSSG の測定は、脱蛋白化抽出液に 2-ビニルピリジンを添加して GSH をマスキングした後、酵素的に測定した[25]。
2.4.2. 還元チオール
残りの全血を遠心分離(4000 g、10 分、4℃)して血漿を分離し、血漿をエペンドルフ社の滅菌チューブに採取し、-80 ℃で保存した。チオール基の測定は、Ellman’s reagent[26,27]を用いて行った。簡単に言えば,0.2Mリン酸緩衝液、pH8.0中の5,5′-ジチオビス(2-ニトロ安息香酸)2.5mMを試料500μlと50mMリン酸緩衝液50mM pH8.0中の750μlとを混合し、412nmでベースライン吸光度を記録した。その後、調製したばかりのEllmanの試薬250μlを添加し、暗所で室温で15分間反応を進め、最終的な吸光度を測定した。チオール値は、チオール5,5′-ジチオビス(2-ニトロ安息香酸)錯体のモル吸光係数13,600 l mol-1 cm-1を用いて、μmol/gタンパク質で表した。検量線は、1 mMのN-アセチルシステイン原液を順次希釈して行った。
2.4.3. ビタミンE:α-トコフェロール及びγ-トコフェロール
トコフェロールの血清中濃度を高速液体クロマトグラフィーで測定した。
2.4.4. 脂質状態:総コレステロール(TC)LDL-C、HDL-C、トリグリセリド(TG
総コレステロール、HDL、およびTGは、ルーチン化学システム(Vitros Fusion 5.1,Ortho Clinical Diagnostics、米国)で分光光度法により測定した。血清LDL-コレステロールは、以下のFriedewald式[29]を用いて計算した。
LDL-C] = [TC] ・[HDL-C] ・0, 20⁎[TG] (g/lで表される)
2.5. 統計解析
個体特性(年齢,性別)および D0 におけるすべてのパラメータを平均と標準偏差に関して記述する.正規性の条件はShapiro-Wilk検定で事前に検証し、グループの比較可能性はStudentのt検定で行う。以前のパイロット研究(内部資料)に基づいて推定されたσの値から 20人のボランティアが含まれているサンプルサイズを使用した。キャリーオーバー効果(前の期間の製品の次の期間への残留効果)を探索するために、3 つの治療期間(P1-V3; P2-V3; P3-V3)の終了時に得られた測定値を、3 つの治療法ごとに混合線形回帰モデルを用いて比較した。
統計分析は、SASソフトウェアバージョン9.3(SAS Institute Inc. P≦0.05を、すべての処置についての統計的有意性のレベルとした。
2.6. アウトカム
本研究の目的は、各製品のバイオアベイラビリティ、酸化ストレスのマーカーに対するグルタチオンの異なる形態の効果、および各製品の安全性を比較することであった。
2.6.1. バイオアベイラビリティの評価
各製品のバイオアベイラビリティは、それぞれの総グルタチオン(GSHt)還元型グルタチオン(GSH)および酸化型グルタチオン(GSSG)の指標を比較することにより測定した。測定は、初回と2回目の訪問(V2-V1)と初回と最後の訪問(V3-V1)の間でこれらのマーカーを比較することによって行われた。
2.6.2. 抗酸化作用の評価
主要アウトカムは、GSH/GSSGで表される還元型グルタチオンと酸化型グルタチオンの比であった。
混合線形回帰モデルを用いて、各期間の終了時にGSH/GSSG比を比較した。式は次のようなものである。
一次アウトカム(GSH/GSSG)=(a0+ai)+a1*治療+a2*期間+a3*(1回目の訪問時のGSH/GSSG比
上記の式において、ai(a 指標 i)は個人の変動を表し、そこに標準切片(a0)が加えられている。各治療の効果を評価するために、モデルは各治療期間(P1-V1; P2-V1; P3-V1)の開始時の主要アウトカムの値に調整される。モデルはまた、治療期間(3つの治療法の連続摂取に対応する各被験者の3つの期間)にも調整される。この調整により、主要アウトカムに対する時間の潜在的な影響を考慮に入れることができる[30]。
考慮された期間と製品がどのようなものであっても、「キャリーオーバー」効果がないことから、研究したすべてのパラメータに上記の式を適用することができた。
副次的転帰として、血漿中の還元チオール、ビタミンE、総コレステロール、HDL-C、LDL-C、血漿中トリグリセリドが測定された。
2.6.3. 治療法の耐性
各治療法の耐性は、各治療法の初回来院時(V1)から最終来院時(V3)までの間の血漿中CRPus(超感受性C反応性蛋白)および肝機能検査(アラニンアミノトランスフェラーゼ(ALAT)アスパラギン酸アミノトランスフェラーゼ(ASAT)アルカリホスファターゼ(AP)およびGGTの血漿中濃度の変化を評価することにより解析した。値は、正常範囲(N)の上限を超えなくてもよいとした。ALAT(N:30〜50IU/l);ASAT(N:15〜41IU/l);AP(N:40〜150IU/l);GGT(N:5〜50IU/l)。これらの生物学的データの増加率を、符号付きランクのWilcoxon検定を用いて分析した。
安全性の評価は、バイタルサイン(心拍数、血圧、呼吸回数、体温)だけでなく、臨床的有害事象のモニタリングも行った。一般的な外観は、訪問のたびに各被験者の身体検査で確認した(V1,V2,V3)。
3. 結果
3.1. バイオアベイラビリティー
経口GSHと舌下剤との間のバイオアベイラビリティの比較分析を表3および4にまとめた。
表3 総グルタチオン、GSHおよびGSSGレベル(μmol/l)(平均±SD)
| 製品 | 投与量 | V1 | V2 | V3 | ΔV2–V1 | ΔV3–V2 | ΔV3–V1 |
|---|---|---|---|---|---|---|---|
| NAC(n = 20) | 総GSH | 800.24±94.87 | 825.53±127.62 | 821.0±124.88 | 30.35±74.73 | 4.31±47.6 | 27.0±77.75 |
| GSSG | 17.32±5.24 | 17.87±4.38 | 15.60±4.83 | 0.55±4.03 | -1.66±2.91 | −7.33±11.0 | |
| GSH | 765.59±91.94 | 789.79±122.83 | 789.80±119.40 | 24.21±63.64 | 11.14±45.80 | 30.95±71.84 | |
| PO(n = 20) | 総GSH | 823.29±90.51 | 782.69±96.89 | 789.88±133.55 | -37.44±72.41 | 3.19±103.63 | -33.41±84.01 |
| GSSG | 16.32±3,48 | 16.08±4.10 | 18.60±5.29 | −0.06±3.34 | 2.33±6.32 | 2.28±4.62 | |
| GSH | 790.66±87.99 | 750.54±96.90 | 752.68±129.53 | −37.58±67,78 | -1.46±99.74 | −37.98±80.58 | |
| SL(n = 20) | 総GSH | 811.12±99.77 | 846.0±127.88 | 838.76±97.69 | 34.88±61.52 | −7.24±50.57 | 27.65±57.71 |
| GSSG | 17.61±4.03 | 16.54±4.70 | 15.62±3.62 | −1.07±4.17 | −0.92±4.38 | −2.01±4.26 | |
| GSH | 774.71±99.45 | 812.92±122.90 | 807.53±96.15 | 38.73±57.96 | −5.39±48.25 | 32.41±57.54 |
表4 総GSH、GSHおよびGSSGの進化:経口対舌下GSH(µmol / l)
| 投与量 | ΔV2–V1 | ΔV3–V2 | ΔV3–V1 | ||
|---|---|---|---|---|---|
| 比較 | 総GSH | PO | −37.44 | 3.19 | −33.41 |
| PO vs SL | SL | 34.88 | −7.24 | 27.65 | |
| (n = 20) | p | 0.02 | 0.37 | 0.05 | |
| GSSG | PO | −0.06 | 2.33 | 2.28 | |
| SL | −1.07 | −0.92 | −2.01 | ||
| p | 0.23 | 0.12 | 0.04 | ||
| GSH | PO | −37.58 | -1.46 | −37.98 | |
| SL | 38.73 | −5.39 | 32.41 | ||
| p | 0.01 | 0.41 | 0.03 |
経口投与群と比較して、舌下投与群では血漿中の総GSH値の上昇とGSSG値の低下が認められた。また,舌下GSHの補給によりGSSG値も減少した。これらの2群間の差は、どのようなパラメータを考慮しても、統計的に有意であった(p≦0.05)。
クロスオーバーデザインにおける潜在的な問題は、キャリーオーバー効果が治療の直接的な効果を偏らせる可能性があることである。期間と治療法にかかわらず、有意なキャリーオーバー効果は観察されなかった(p>0.75)。したがって、結果を分析するために、与えられた治療法(SL、PO)についてデータをプールした(各治療法についてn=20)。
3.2. 治療法の効果
3.2.1. 一次アウトカム(GSH/GSSG
各治療法のGSH/GSSG比に対する効果の比較は、キャリーオーバー効果がなかったため、結果をプールした後に行った。
3群(NAC、経口GSHまたは舌下GSH)のGSH/GSSG比の推移を表5に報告する。
表5 GSH/GSSG比とその進化(平均±SD)
| 製品 | V1 | V2 | V3 | ΔV2–V1 | ΔV3–V2 | ΔV3–V1 |
|---|---|---|---|---|---|---|
| NAC(n = 20) | 50.03±14.02 | 46.25±7.17 | 56.44±13.74 | −3.79±11.39 | 9.71±10.81 | 7.38±11.12 |
| 経口GSH(n = 20) | 51.68±11.04 | 51.54±14.28 | 44.76±14.23 | −0.91±9.35 | −6.31±17.41 | −6.92±15.90 |
| 舌下(n = 20) | 47.55±12.50 | 53.69±13.84 | 56.97±16.22 | 6.15±10.41 | 3.27±14.75 | 9.42±14.62 |
| 比較NAC / PO | p = 0.28 | p = 0.20 | p = 0.03 | p = 0.29 | p = 0.06 | p = 0.01 |
| 比較NAC / SL | p = 0.22 | p = 0.03 | p = 0.37 | p = 0.02 | p = 0.22 | p = 0.20 |
| PO / SLの比較 | p = 0.11 | p = 0.20 | p = 0.02 | p = 0.03 | p = 0.07 | p = 0.002 |
比較分析は、第一にNACを参考にして(比較NAC対経口GSH、NAC対舌下GSH)第二に経口GSHと舌下GSHの形態を比較して行った。
経口GSH群では、NAC群と比較して、各時点でGSH/GSSG比が低く、V3で有意差が認められた(p=0.03)。
舌下型GSH群では、この比率は毎回高い傾向にあり、V2ではNAC群と比較して統計的に有意であった(p=0.03)。
舌下投与群では、経口投与群と比較して、特にV3で高いGSH/GSSG比を示した(p=0.02)。
3.2.2. 副次的転帰
3.2.2.1. 還元チオール
結果を表6に詳述する。還元チオールレベルは、アルブミングラムベースで表される。
表6 各処理における還元チオール(μmol/g)の進化(平均±SD)
| V1 | V2 | V3 | グループ内進化
|
|||
|---|---|---|---|---|---|---|
| ΔV2–V1 | ΔV3–V1 | ΔV3–V2 | ||||
| NAC(n = 20) | 6.24±0.32 | 6.36±0.32 | 6.29±0.44 | 0.12、p = 0.04 | 0.05、p = 0.29 | −0.07、p = 0.17 |
| 経口GSH(n = 20) | 6.15±0.28 | 6.29±0.28 | 6.28±0.38 | 0.14、p = 0.004 | 0.13、p = 0.001 | −0.01、p = 0.5 |
| 舌下GSH(n = 20) | 6.14±0.29 | 6.28±0.36 | 6.14±0.33 | 0.14、p = 0.01 | 0.00、p = 0.46 | −0.14、p = 0.07 |
| 比較NAC / PO | p = 0.40 | p = 0.40 | p = 0.39 | |||
| 比較NAC / SL | p = 0.21 | p = 0.20 | p = 0.15 | |||
グループ内分析を行ったところ、NAC群ではV2時にベースラインと比較して有意な増加が認められた(0.12μmol/g、p=0.04)。経口GSH群では、V2とV3でベースラインと比較して有意に増加した(それぞれ0.14μmol/g、p=0.004,0.13μmol/g、p=0.001)。舌下GSHについては、第1期のみ上昇した(0.14μmol/g、p=0.01)。3群間では有意差は認められなかった。
3.2.2.2. ビタミンE
また、血漿中のビタミンE濃度に対する3種の治療法の効果を調べた(表7)。
表7 ビタミンE量(μmol/g)とその推移(平均±SD)
| 製品 | V1 | V2 | V3 | ΔV2–V1 | ΔV3–V1 | ΔV3–V2 |
|---|---|---|---|---|---|---|
| NAC(n = 20) | 26.63±6.02 | 25.88±6.39 | 27.16±5.56 | −0.75、p = 0.10 | 0.53、p = 0.18 | 1.28、p = 0.10 |
| 経口GSH(n = 20) | 26.70±4.94 | 26.41±5.52 | 26.23±5.64 | −0.29、p = 0.24 | −0.47、p = 0.15 | −0.18、p = 0.31 |
| 舌下GSH(n = 20) | 26.59±5.76 | 26.71±5.92 | 27.42±6.32 | 0.12、p = 0.44 | 0.83、p = 0.04 | 0.71、p = 0.25 |
| 比較NAC / PO | p = 0.32 | p = 0.31 | p = 0.17 | |||
| 比較NAC / SL | p = 0.49 | p = 0.25 | p = 0.45 |
投与3週間後の血漿中ビタミンE濃度は、舌下GSH群のみで有意な上昇が認められた(0.83μmol/g; p=0.04)。3 群間及び経口 GSH 及び NAC 投与群では有意差は認められなかった。
3.2.2.3. 脂質状態
結果を表8に詳述する。
表8 脂質バイオマーカー値(g/l)とその推移(平均±SD)
| 製品 | 投与量 | V1 | V2 | V3 |
|---|---|---|---|---|
| NAC(n = 20) | TG | 1.52±0.59 | 1.49±0.67 | 1.59±0.63 |
| TC | 2.29±0.39 | 2.28±0.45 | 2.28±0.41 | |
| HDL-C | 0.52±0.11 | 0.51±0.1 | 0.52±0.1 | |
| LDL-C | 1.48±0.34 | 1.47±0.4 | 1.45±0.39 | |
| 経口GSH(n = 20) | TG | 1.52±0.58 | 1.62±0.92 | 1.54±0.72 |
| TC | 2.32±0.38 | 2.29±0.41 | 2.23±0.36 | |
| HDL-C | 0.52±0.1 | 0.52±0.12 | 0.51±0.1 | |
| LDL-C | 1.49±0.33 | 1.46±0.35 | 1.41±0.33 | |
| 舌下GSH(n = 20) | TG | 1.7±0.74 | 1.4±0.61 | 1.55±0.63 |
| TC | 2.3±0.4 | 2.29±0.39 | 2.25±0.43 | |
| HDL-C | 0.51±0.12 | 0.53±0.12 | 0.54±0.13 | |
| LDL-C | 1.45±0.38 | 1.49±0.35 | 1.41±0.4 |
群内分析を行ったところ、モニターした脂質バイオマーカー(総コレステロール、HDL-C、LDL-C、TG)が何であれ、どの時点でも、どちらの群でも変化は認められなかった。
NAC群の脂質値をベースラインとした場合、総コレステロール、LDL-Cは経口群、舌下GSH群ともにV3時にわずかに低下した。しかし、統計的には有意ではなかった。
一方、HDL-C値は経口GSH群で低下し、舌下GSH群で上昇したが、これらの差は有意ではなかった。しかし、経口GSH群と比較して、舌下GSH群ではHDL-Cレベルの有意な上昇が認められた(0.039±0.013,p=0.0043)。
3.2.3. 副作用
各治療群の各訪問時のCRPusおよび肝機能マーカーの血漿中濃度の値を表9に報告した。
表9 処置の生物学的耐性(平均±SD)
表9
治療の生物学的耐性(平均±SD)。
| V1 | V2 | V3 | ||
|---|---|---|---|---|
| NAC(n = 20) | CRPus(IU / l) | 5.2±0.6 | 6.4±4.3 | 5.4±1.2 |
| ASAT(IU / l) | 19.32±6.87 | 18±5.02 | 18.08±5.83 | |
| ALAT(IU / l) | 24.52±10.26 | 22.84±10.12 | 23.64±11.3 | |
| AP(IU / l) | 60.04±15.44 | 60.76±15.12 | 61.76±14.41 | |
| GGT(IU / l) | 36±24.3 | 33.88±21.35 | 35.36±21.85 | |
| 経口GSH(n = 20) | CRPus(IU / l) | 5.2±0.6 | 5.4±1.5 | 5.3±0.9 |
| ASAT(IU / l) | 19.16±6.82 | 18.29±6.6 | 20.48±6.63 | |
| ALAT(IU / l) | 25.16±14.24 | 23.38±11.34 | 27.44±12.59 | |
| AP(IU / l) | 59.16±13.98 | 61.92±15.18 | 61.64±14.53 | |
| GGT(IU / l) | 34.72±22.89 | 35.42±21.23 | 38.88±29.21 | |
| 舌下GSH(n = 20) | CRPus(IU / l) | 7±8.4 | 5.8±2.3 | 8.8±17.5 |
| ASAT(IU / l) | 19.52±8.1 | 20±9.23 | 20±7.44 | |
| ALAT(IU / l) | 24.6±13.6 | 27.2±18.69 | 25.75±12.49 | |
| AP(IU / l) | 58.6±11.59 | 61.6±15.03 | 62.54±14.61 | |
| GGT(IU / l) | 38.28±29.6 | 39.64±29.68 | 36.83±24.73 |
マーカー(肝状態または超高感度CRP)にかかわらず、有意な変化は報告されなかった。モニタリングしたすべてのマーカーについて、値は常に正常範囲内であった。
すべての剤形は非常に忍容性が高く、どのような治療法を用いたとしても、参加者から有害事象は報告されなかった。
4. 議論
サプリメント製品(GSH)もまた、体内で内因性に生成されるため、このような研究を実施することは常に困難である。さらに、他のほとんどの抗酸化物質と同様に、GSHは厳重に管理されている。
どのような治療法を検討しても、結果は時に高い標準偏差を示すことがある。これは、研究された集団の不均一性によって説明できる。実際、主な包含基準は、メタボリックシンドロームの存在でした。メタボリックシンドロームは厳密に定義された疾患実体ではなく、少なくとも3つの危険因子の収束である。各患者は、メタボリックシンドロームの厳密な定義を満たしているにもかかわらず、異なる危険因子の数および/または組み合わせを有している可能性があるため、この不均一性は予想された。そうでなければ、標準的な集団で一般的に遭遇する残りの多様性に対応する。したがって、ボランティアの募集における偏りは、本研究では除外することができる。
GSHの経口投与は、その非常に悪いバイオアベイラビリティと急速な酸化のために最適とは考えられていない。この問題を回避するために、他の間接的な手段が開発されてきた。その一つは、システインの供給源としてのNACの経口投与である。実際、その腸管吸収の後、NACは、それがシステインに脱アセチル化されている肝臓で一次代謝を受ける。その後、肝機能障害がない限り、肝組織はこのシステインからde novo GSHを合成する。このGSHは血漿中に放出される前に肝内のストックを補充する[22,31]。したがって、本研究では NAC を参考治療とした。
経口 GSH のバイオアベイラビリティに関しては、我々のデータは、経口 GSH 補給(1 g/日、4 週間)を行った以前の研究の結果と一致しており、総 GSH 指数および減少した GSH 指数の有意でない減少を示している [20]。この結果、GSH/GSSG比が全体的に低下した。GSSGの高レベルは、酸化ストレスの期間を示している。GSH/GSSG比は酸化還元状態の重要なマーカーである。正常な酸化還元平衡の回復は、GSH/GSSG比の増加につながる。我々の研究では、NACと舌下GSH群のGSH/GSSG比は経口GSH群に比べて有意に高い値を示した。このバランスを改善するためには、経口投与よりも舌下投与の方が有用であると考えられる。
これらの結果の一つの可能な説明は、経口GSHは消化過程で部分的な加水分解と酸化を受けることである。したがって、肝臓は前駆体からde novo GSHを合成しなければならない。
舌下投与では、GSHは頬粘膜を介して直接同化され、肝臓のファーストパス効果を回避することができた。その結果、舌下GSHは経口GSHよりも優れたバイオアベイラビリティーを示すことが示唆された。
このようなGSH/GSSG比の増加は、舌下GSH摂取による酸化ストレスの減少を示唆していると考えられる。そこで、舌下GSHのバイオアベイラビリティーの向上が酸化ストレスマーカーへの影響をもたらすかどうかを検討した。アウトカム指標は、減少したチオールとビタミンEにまで拡張された。
いくつかのエビデンスは、GSHがビタミンC [32,33]のような抗酸化物質のリサイクルに重要であり、その結果、脂質過酸化の重要な阻害剤であるビタミンE [34]のような抗酸化物質のリサイクルに重要であることを示唆している。我々の知見は、これらの以前の観察と一致している。我々は、舌下GSHを補充した後、血漿中ビタミンEレベルに有意な増加があることを発見した。
舌下GSHは被験者に生理的な用量で投与されたことを考慮すると、主要エンドポイントまたはいくつかの副次的エンドポイントにおいて、これら2つの用量の間にこのような有意差が得られたことは、経口GSHよりも舌下GSHの正当性を強化するものである。
GSHの欠乏や酸化ストレスの高い集団(喫煙者、2型糖尿病患者、HIV陽性者)を対象とした同様の試験を実施することは興味深いことであろう。GSH/GSSG比やその他のマーカーについて、2種類のGSHの間に大きな差があると予想される。
NACと舌下GSHの間で観察された結果を考えると、文献[35]に記載されているNACと同じ適応症に対して、この新しい舌下GSHを推奨することは有用であると思われる。本剤の推奨は、高価で可変性のある血液検査に基づくものではなく、臨床観察とリスク因子の棚卸しに基づくものが優先されるべきである。
抗酸化効果を得るために必要な治療期間については、21日間の治療で十分であり、ほとんどがNACおよび舌下GSH形態で有意な結果を得ることができた。この3週間の間、副作用は報告されなかった。しかし、全体的な治療期間は、リスク因子の重要性と多重性を考慮しなければならない。
5. 結論
本研究の目的は、メタボリックシンドロームのリスクを持つ集団を対象に、抗酸化防御の基礎となるグルタチオンの2つの投与量のバイオアベイラビリティ、バイオマーカーへの影響、および短期安全性を評価することである。
全体的に、我々の結果は、バイオアベイラビリティと酸化ストレスに対するポジティブな効果の両方の点で、経口剤よりも新しいGSHの舌下剤の方が有意に優れていることを示している。また、NACと比較して、舌下型GSHの優れた効果も観察された。
メタボリックシンドロームは心血管疾患や糖尿病の発症リスクを高める。メタボリックシンドロームの促進や発症には活性酸素(ROS)の悪影響が影響しているため、予防戦略を立てて酸化ストレスと戦うことが重要である。通常の食事療法に加えて、関心の高い製品を関係者に提案することは合理的である。
この新しいGSHの舌下製剤は、この要件を満たすものである。一次予防および二次予防戦略の中で、その位置を見出すべきである。
