Effectiveness of Ivermectin-Based Multidrug Therapy in Severe Hypoxic Ambulatory COVID-19 Patients
www.medrxiv.org/content/10.1101/2021.07.06.21259924v1
ランニングヘッド イベルメクチンの多剤併用療法でCOVID-19患者を治療
著者 Sabine Hazan1, MD*; Sonya Dave2, PhD; Anoja W. Gunaratne3, PhD; Sibasish Dolai3, PhD; Robert L Clancy3, MD, PhD; Peter A. マカロー, MD4, MPH, Thomas J. Borody3, MD,
PhD, DSc
1. ProgenaBiome, LLC, 1845 Knoll Dr., Ventura, CA, USA, 93003
2. Microbiome Research社、1845 Knoll Dr., Ventura, CA, USA, 93003
3. Centre for Digestive Diseases, 229 Great North Road, Five Dock, NSW, Australia, 2046.
4. Texas A & M College of Medicine, Baylor Dallas Campus, Dallas TX, USA 75226
* Corresponding Author
著者の貢献 SHは、アイデア出し、臨床治療、研究デザイン、Covidexのデザイン、分析、執筆など、本研究のすべての側面に貢献し、主導した。S Daveはデータ解析、Covidexのデザインと検証、コントロールを行い、執筆にも貢献した。AWG、RLC、PAMは執筆に貢献した。S Dolaiは執筆と試験デザインに貢献した。TJBはアイデア出し、試験デザイン、執筆など、すべての面で主導した。
謝意を表する。技術支援をいただいたMargaux Alvaran氏に感謝いたする。
資金調達について 本研究は、ProgenaBiome, LLCから資金提供を受けた。
著者らは,適切な機関審査委員会の承認を得ており,すべてのヒト実験調査についてヘルシンキ宣言の原則に従っていることを表明する。参加者からはインフォームド・コンセントを得ている。
データの共有。本研究で使用されたデータおよび分析されたデータは,相応の要求があれば共著者から入手可能である。
注:このプレプリントは、ピアレビューで認証されていない新しい研究を報告するものであり、臨床診療の指針として使用すべきではない。
概要
イベルメクチンは、安全かつ安価で有効なCOVID-19早期治療薬であり、20以上のRCTで検証されている。Helicobacter pyloriの併用療法を開発した我々は、様々なCOVID-19の組み合わせをテストし、最も効果的であることを説明した。リスクが高く、低酸素状態で、平均9日間の中等度の症状が未治療のCOVID-19被験者24名を対象に、イベルメクチン、ドキシサイクリン、亜鉛、ビタミンDおよびCからなる新規の併用療法を試行したところ、高い効果が得られた。すべての被験者が平均11日で症状を改善し、24時間後には酸素飽和度が改善した(87.4%→93.1%、p=0.001)。入院と死亡は、CDCデータベースの背景を一致させた対照群に比べて有意に少なかった(それぞれp<0.002,0.05)。3剤併用療法は,外来で治療を受けた中等度から重度の低酸素症患者においても,安全かつ有効であることが示された。
試験登録。該当なし、方法を参照。
キーワード
SARS-CoV-2, COVID, コロナウイルス, イベルメクチン, ドキシサイクリン, 亜鉛
略語の一覧
2 検定(カイ二乗検定);CDC(Center for Disease Control);CI(Confidence Interval);COVID-
19(コロナウイルス、SARS-COV-2);Hrs. 時間);HAZDpaC(Hydroxychloroquine,Azithromycin,Vit D,Zinc pack);H. pylori(Helicobacter
pylori);ICT(Ivermectin Combination Therapy);PMH(Past Medical History);pt(ポイント);pts(ポイント);SEM(Standard Error of Mean);SOB(Shortness of breath);SpO2(Percent Saturation Peripheral Oxygen);temp(0Fの体温)。
掲載の同意 すべての著者は、この出版物の最終的な提出内容を読み、同意した。
刊行物
データおよび材料の入手可能性。本研究で使用したデータおよび分析したデータセットは
本研究で使用されたデータおよび分析されたデータは,相応の要求があれば共著者から入手可能である。
資金調達
本研究はProgenaBiome, LLCから資金提供を受けた。
謝辞
Margaux Alvaranの技術支援に感謝する。
はじめに
現在、COVID-19 を発症した早期または外来患者に対する有効な治療法はない。検査で陽性となった患者は隔離のために帰宅させられ、一般的に、この段階では特定の治療法は処方されない。しかし、安全性に優れた再利用可能な薬剤を早期に投与することで、転帰を大幅に改善し、免疫調整剤、抗血小板・抗血栓療法、酸素投与の必要性を回避または遅延させることができるという証拠が増えてきている[1]。
そのようなCOVID-19治療薬の中でも最も幅広く研究されているのがイベルメクチン(IVM)であり、1987年以来、世界中で37億回の投与が行われ、安全に使用されていた[2-4]。最近、IVMの発見で2015年のノーベル賞共同受賞者である大村智博士らは、COVID-19に対するIVMの活性に関するこれまでの研究を包括的にレビューし、そのような有効性を示す証拠が圧倒的に多いと結論づけた[2]。IVMは、COVID-19の治療を目的とした20以上のランダム化比較試験(RCT)で試験されており、これらのほぼすべてにおいて統計的に非常に有意な臨床効果が認められ、治療群と対照群のプールされた死亡率は78%減少した[5]。最近、一流の医学雑誌に掲載されたCOVID-19のIVM治療に関する5つの研究では、いずれもIVMが対照群に対して複数の臨床効果を示し、そのほとんどがp<0.002のオーダーで高い統計的有意性を示している[6-10]。IVMは、標準的な単回投与量である200μg/kgをはるかに超える量でも忍容性が高く[11,12]、COVID-19治療のRCTでは、1,500μg/kg[13]、1,600μg/kg[14]、3,000μg/kg[15]を4日または5日間にわたって累積投与したが、軽度で一過性の副作用は認められなかった。驚くことではないが、IVMは特に非西洋諸国において、COVID-19の予防や早期の疾病管理に広く使用されている。
COVID-19においてIVM療法が臨床的に有用であるという強力な証拠があるにもかかわらず、特に広域抗生物質と亜鉛の添加に関して治療レジメンにばらつきがあるため、急性感染症をどのように管理するのが最善かという点で混乱が生じている。実際、初期の外来多剤併用療法では、869人のハイリスク患者を対象に、入院率と死亡率をそれぞれ87%と75%(いずれもP値0.001)削減したという最も素晴らしい結果が出ているが、IVMとヒドロキシクロロキン( ヒドロキシクロロキン)を併用していたため、最適な管理戦略は不明のままであった[16]。最良のデータに基づいて策定された、効果的で安全かつ実用的な併用療法が早急に求められている。
細胞レベルでは、IVMは細胞質と核の間のコミュニケーションを調整し、ウイルスの集合体にとって敵対的な環境を作り出すと同時に、サイトカインを介した炎症を抑える。さらにIVMは、ウイルスの「スパイク」タンパク質とACE2受容体との結合を特異的に阻害することにより、COVID-19ウイルスの感染後の病態を抑制した。最後に,IVMは細胞性自然免疫の好ましい変化と関連している[17]。
我々のグループは、COVID-19に対する抗ウイルス薬の組み合わせを開発していたが、IVMは、COVID-19の早期に使用することで、症状の消失までの期間を短縮し、入院を防ぐための併用療法として特に有効であることがわかった。IVMを単独で使用した場合、時として部分的な効果しかなく、治癒には至らないが[6,1,19]、高用量のIVMとアジスロマイシンおよび亜鉛を併用することで、対照群と比較して92%の死亡率低下を達成している[14]。そこで我々は、他の適応症でも承認されている、安全で広く入手可能な薬剤で、薬物間の相互作用やQT延長がなく、細胞内のウイルス複製を阻害し、若干の抗炎症作用を有する組み合わせを選択した。
細胞内細菌感染症に対する併用療法は新しいものではなく、結核、ヘリコバクター・ピロリ感染症、ハンセン病、B型・C型肝炎などの細胞内ウイルス感染症の治療に成功しているが、これらの併用療法では単一の成分で治癒することはほとんどない。HIVなどのウイルス感染症では、複数の抗ウイルス剤を併用しても完全には治癒しないが、ウイルス量を永続的に抑制することができる。IVMは、寄生虫感染症に対する広範な有効性、高い治癒率、併用時の薬剤耐性の低さで最もよく知られている[20]。有用ではあるが、IVMの単独使用は「魔法の弾丸」ではない。併用することで、個々の投与量を減らし、副作用を軽減することができる。すべての年齢層の要求を満たすために、有効成分としてドキシサイクリンと亜鉛、そして高齢者の一般的な臨床的欠乏を補うために与えられる「賦形剤」としてビタミンDとCを組み合わせたIVMを開発した。
本研究では、酸素飽和度(SpO2)が73%と低かった連続した外来患者、複雑な患者、時には重度の低酸素症患者に上記の併用療法を使用したことを報告する。参加者は、ベンチュラ・クリニカル・トライアルズ社の経験豊富な臨床試験チームによって治療された。
方法
被験者
被験者は、カリフォルニア州ロサンゼルス、ベンチュラ郡、および米国の他の州で、医師から紹介された患者、または口コミで紹介された患者から特定された。これらの患者は、clinicaltrials.gov ID NCT04482686(二重盲検無作為化対照試験)の臨床試験に参加するように紹介された。しかし、一部の患者は酸素飽和度が90%以下であったため、この試験に参加する資格がなく、プラセボ対照試験に参加するには重症であると判断された。彼らは病院に行くことを拒否して除外されたため 2020年8月から 2021年2月の間、遠隔医療を通じて適応外の治療を受けた。被験者には、綿棒によるRT-qPCR検査で診断が下された時点で、IRBの監督下でこのオープンラベル試験に参加する機会が与えられた。参加基準は以下の通りである。 1)COVID-19のPCR陽性、2)インフォームド・コンセント、3)年齢18歳以上、4)妊娠の可能性がある場合、効果の高い2つの避妊法を実践することに同意。除外基準は以下の通りである。
- 併用療法の成分に対するアレルギーまたは薬物相互作用
- 痙攣リスクを含む併存疾患
- 妊娠
治療
治療:治療は、患者がベンチュラ社の臨床試験に来院してから72時間以内に、できるだけ早く開始した。審査を受けた被験者はすべて組み入れ基準を満たし、連続して登録された。治療は「IVM併用療法」(ICT)と定義され、ドキシサイクリン(100mg、1日2回)IVM(12mg、1日目、4日目、8日目)亜鉛(25mg、1日2回)ビタミンD3(1500IU、1日2回)ビタミンC(1500mg、1日2回)を10日間にわたって経口投与した。ICTは10日間のみ毎日投与した。
2人の患者(#10と#23)は、SpO2が特に低かったり、臨床上の必要性が予想されたため、初日に(12mgではなく)36mgのIVMの初期治療を受けた。
モニタリング
被験者は最初の10日間、日誌(補足1)に症状を自己記録した。心電図(EKG)血圧、体温(0F)SpO2は、提供された医療機器を用いて自宅で収集された。1日目,5日目,10日目,30日目には,SARS-CoV-2検査用綿棒を自己採取し,検査のために病理学教室に送った。必要に応じて妊娠検査も実施した。
エンドポイント
エンドポイントは,1)発症してからSARS-CoV-2 PCRが陰性になるまでの時間,2)発症してから症状が消失するまでの時間,3)入院に至るまでの経過,4)患者の生存率とした。
外部対照試験(ECT)群
COVID-19では、ハイリスクの重症低酸素症患者を未治療の対照群を持つ非盲検試験に登録するという課題があるため、我々の治療群の生存率を一般集団における対照群の生存率と比較した。合成対照群とも呼ばれるこのECTは、COVID-19被験者のCDCの公開データベースから算出した[21]。利用可能な情報には、年齢層、あらゆる慢性疾患の有無(COVID-19-脆弱性など、条件が特定されていない)感染日、COVID-19診断が実験室で確認されたかどうかが含まれる。以下の基準を満たしたすべての被験者の情報を使用した。1)年齢が50歳以上、2)COVID-19の診断が実験室で確認されている、3)死亡/生存、人種、性別の状況が入手可能で判明している、4)2021年3月以前に感染している、5)被験者に併存疾患がある。この合成対照群の開発は、我々の臨床データが得られた後に行われたため、選択基準は、我々の研究の対象者に近い対照群を選んだが、全員が何らかの基礎疾患を持ち、大多数が50歳以上であった。CDCデータベースの解析には、CSViewer vs. 1.3(EasyMorph Inc, Toronto, ON, CA, easymorph.com)を使用した。
Covidexの計算と統計
CovidexおよびCovidex-Fは、我々が本研究で開発・検証した外来患者のSARS-CoV-2感染症の重症度指標である。これらは特にSpO2を重視して重み付けされており、Covidex-Fには体温の変数が含まれている。
Covidexスコア=1pt. (睡眠時無呼吸症候群の既往歴がある場合) + 1pt. (COPD の既往歴がある場合) + 1 pt. (心血管疾患の既往歴がある場合) + 1pt. 喘息の既往歴がある場合)+1pt(過去に血栓、虚血、脳卒中の既往歴がある場合)+1pt(肥満の場合、すなわち30kg/m2<BMI<40kg/m2の場合)+2pt(重度の肥満の場合、すなわちBMI>40の場合 – 1pt(年齢が60歳以上の場合)+[95-(SpO2 as a percentage)]pt. 例えば、喘息の既往があり、病的な肥満で治療前のSpO2が85%の仮想患者の場合、Covidexスコアは、1(喘息の場合)+2(肥満の場合)+10(SpO285%の場合)=12ptとなる。
Covidex-Fスコア=Covidexスコア+1pt. (提示時の体温が99.50F~100.40Fの場合) + 2pt. 発表時の体温が99.50F~100.40Fの場合)+2点(発表時の体温が100.40F~103.50Fの場合)+3点。発表時の体温が103.50F以上の場合)。
Covidexスコアと治療から症状が解消するまでの時間との相関を評価するため、ベストフィットラインを作成した。回帰は、Prism version 8(GraphPad Prism software for Windows, San Diego, California USA, www.graphpad.com)で、重み付けや外れ値の特別な処理を行わずに、最小二乗回帰を用いて行った。グラフはすべてGraphPad Prism version 8を用いて作成し、統計解析を行った。エラーバーは平均の標準誤差(SEM)を示す。
結果
表1は、調査対象となった全被験者(うち2名はICT治療に同意しなかった(被験者番号10および26))と、それに関連する人種、性別、症状、発熱、その他の臨床上の注意事項を示したものである。すべての被験者にCOVID-19関連の症状が見られ、症状の範囲は広く、息切れ(SOB)を示す被験者もいた。また、24人中21人(87.50%)が発熱しており、24人の平均体温は101.2 + 0.32 0Fであった。具体的には、24人中1人(4.17%)が微熱(99.5~100.4)24人中18人(75.00%)が中熱(100.5~103.4)24人中2人(8.33%)が高熱(>103.4)であった(0F)。
表2は、治療に同意した被験者の人口統計および過去の病歴(PMH)をまとめたものである(合計n=24,治療を辞退した2名を除く)。注目すべきは、患者の年齢が高く(COVID-19の脆弱性として知られている)平均年齢は66 + 2.75歳、範囲は43~94歳であった(表2A)。治療に同意した24名の被験者(被験者#10と#26を除く、表1)の母集団は、男性が63%であった。治療を受けていない被験者#10と#26の死亡は、他の図の下流の分析を除外した。
表2Bは、CDCのガイドライン[22]に基づいて、COVID-19の脆弱性に関連する併存疾患を持つ患者数を示している。これらの併存疾患は、慢性腎臓病、慢性閉塞性肺疾患(COPD)ダウン症、心血管疾患、HIVを含む免疫不全状態、肥満(体格指数[BMI]が30kg/m2以上40kg/m2未満)重度の肥満(BMI≧40kg/m2)妊娠、鎌状赤血球症、喫煙、2型糖尿病である。なお、がん、ダウン症、鎌状赤血球症の被験者はおらず、妊娠中や喫煙者もいなかった。
多くの被験者は、表2Bに示すように、COVID-19の脆弱性に関連する複数の併存疾患を抱えてた。合計で11/24名(45.83%)の被験者がCOVID-19の脆弱性を持つ併存疾患を有しており、そのうち3名(12.50%)は2つの独立した併存疾患を持ち、2名(8.33%)は3つの併存疾患を持っていた。
少数の被験者(n=7)は、ICT投与前および/またはICT投与中に他のCOVID-19治療を受けていた。すなわち、レムデシビル(n=1人)HAZDpaCのプラセボ対照試験への参加(n=4人、clinicaltrials.gov NCT04334512試験、治療またはプラセボを受けた可能性あり)ヒドロキシクロロキン( ヒドロキシクロロキン、n=3人)であった。
図1は、すべての被験者がCOVID-19から、通常1~2週間以内に回復したことを示している。図1Aは,各被験者の様々な期間と平均値を示している(1つの異常値を除く)。症状が出てから治療を開始するまでの期間は1列目に示し、平均9.2+2.1日である。治療開始から症状が治まるまでの期間は11.6+1.4日。最初のPCR陽性から最初のPCR陰性までの期間は16.9+1.6日で、3週間未満であった。治療開始から最初のPCR陰性化までの期間は11.5+1.6日であり、これも3週間未満である。
図1Bは、被験者の100%が入院や人工呼吸器の使用を必要とせず、COVID-19を生き延びたことを示している。表2に示したように、これらの被験者の多くは高齢で、合併症を抱えていた。CDCデータベースから得られた合成対照群(「方法」および以下を参照)と比較すると、2検定で評価された生存率(p=0.044)および入院率(p=0.0011)が有意に増加した。注目すべきは、このCDCのデータベースに登録されている患者は、未知の治療を受けた可能性が高いということである。したがって、この合成対照の生存率は、米国における「典型的な」生存率を反映したものであり、ICTで観察された100%の生存率よりも有意に低いものである。
ICTで観察された100%の生存率を、COVID-19被験者のCDCデータベースによる生存率と比較した。方法」の項で説明した資格基準に基づき、356,424人の対照被験者を得た。これらの基準は、基礎疾患を持つ、今回の研究対象者と同様の高齢者(50歳以上)に焦点を当てた。このデータベースに掲載されている基礎疾患の基準情報は、COVID-19-脆弱性を誘発するか否かにかかわらず、あらゆる種類の慢性疾患を指すことに注意してほしい。この定義では、対照群とICT群の100%が何らかの基礎疾患を持っていることになる。
図2の重要な発見(表2も参照)は、23/24人の患者がSpO2<90%の低酸素状態であったことである。治療に同意した被験者の中には、来院時のSpO2が73%、77%、84%、85%と低かった人もった。全体として、図2Aに示すように、被験者のSpO2は、治癒の定義点である95%よりも有意に低かった(平均SpO2の95%CI=85.5〜89.4,平均=87.4+0.93%)。被験者のSpO2は、治療後24時間以内に増加した。治療前の平均SpO2は86.5% + 1.3で、治療24時間後には93.1% + 0.63となり、非常に有意で急激な上昇が見られた(p <0.001)。SpO2はその後も上昇し続けた。治療は10日間続けられ、SpO2が95%以上になった時点で治療成功または治癒となった。治療成功はすべての被験者で達成された。つまり、SpO2の回復率は100%であった。治療を受け入れた患者で入院を必要とした者はいなかった。
2人の被験者(#10と#26)は治療を拒否した。これらの被験者はSpO2が回復せず、COVID-19の感染により死亡した。また、1名の被験者からめまいの有害事象が報告されたが、それ以外は順調に治療を継続した。
図3 は、我々が開発した Covidex および Covidex-F スコアの検証結果を示している(我々の方法で定義)。これらのスコアは、過去の病歴、治療直前の酸素濃度、来院時の発熱グレードに基づいて、COVID-19による重症度予測の指標となる。Covidexスコアの平均値は10.34 + 1.08,Covidex-Fスコアの平均値は11.63 + 1.13で、スコアポイントの87%と85%は、それぞれSpO2項の寄与によるものであった。つまり、このスコアの約80〜90%はSpO2に重み付けされている。また、このスコアに寄与するPMHの側面は、呼吸器系、心血管系、肥満の履歴を重視しており、CDCが定義したCOVID-19-脆弱性とは異なることにも留意する必要がある。
CovidexとCovidex-Fの両方とも、治療から症状がなくなるまでの時間をプロットしている。どちらも統計的に有意な相関を示し(Covidex:p=0.0096,r2=0.2078,Covidex-F:p=0.0288,r2=0.2790)CovidexまたはCovidex-Fのいずれかが症状消失までの時間と関連し、それを予測する可能性があることを示している。
考察
我々は、外来患者として管理されているCOVID-19の「中等度から重度」の低酸素症患者を対象に、100%の生存率と治癒をもたらした効果の高いICTを初めて報告した。H. pyloriに対する併用療法を開発した経験から、外来のCOVID-19患者を対象にIVMをベースとした様々な併用療法を試行し、治癒を目指した結果、上記の併用療法がCOVID-19の「基礎療法」として最適であることがわかった。3剤併用療法に耐性のあるH.pyloriが4剤併用療法を必要とするように、個別のアプローチでは ヒドロキシクロロキンや他の成分の追加が必要となる患者もいることを理解している。低酸素は、COVID-19の死亡率の予測因子として実証されている[23]。例えば、これらの患者の何人かは、来院時にオキシメトリーで測定した結果、73%、77%、84%、85%という重度の低酸素症であった。症状が出てから治療までの期間が9.2日であったにもかかわらず、我々の治療は急速な改善をもたらした。咳の消失、発熱、疲労感などの症状も同様に改善した。また、治療開始から最初のPCR陰性化までの期間は、平均11.5+1.6日であった。一般的には、このような病気の患者は入院することになるが、ICTで治療した患者は全員が入院を免れ、死亡者もいなかった。
ECTの「合成対照群」に目を向けると、報告された患者数が少ないにもかかわらず、ICTが対照群よりも統計的に優れていることが明らかになった。報告されている研究とこの治療群から得られた非常に低い副作用は、臨床症状とCOVID-19進行の危険因子が存在する場合、PCRの結果が保留されている症例であっても、ICTを使用することを支持している。ECT群は、特に対照群や「標準治療」群が致命的な結果をもたらす可能性がある場合に、現在ますます使用されている[24]。
抗ウイルス剤の併用療法を行う理由は、細菌やウイルスなどの細胞内感染症は、単一の薬剤では確実に治癒できないという理解が深まっていることにある。また、IVM耐性が一般的であるという知識にも基づいている。したがって、COVID-19に対する唯一の「銀の弾丸」は存在せず、IVMを単独で無差別に使用すれば、薬剤耐性菌が発生してCOVID-19耐性を誘発する可能性がある。IVMに対する耐性は、疥癬、線虫、ストロンギロイド症、ミクロフィラリア症、オンコセルカ、ボルブルスで単独使用した場合に見られた[19,25-31]。現在では、ピロリ菌に対して2種類の抗生物質を使用した併用療法でも耐性が発生している。このことから、COVID-19のIVMは併用療法でのみ使用することが推奨されている。特に、変異株がワクチンによる画期的な感染症を引き起こすという報告が増えているためである[32]。したがって、提案された併用療法は、より迅速に治癒を誘導し、耐性を予防し、変異株の出現を克服するために開発された(「複製なくして変異なし」)。
併用療法の開発戦略については、細胞内コロナウイルスの複製には、ウイルスの複製を阻害するための複数の活性薬剤が必要である。IVM、ドキシサイクリン、亜鉛はそれぞれ個別にコロナウイルスの複製を阻害し、他にも候補があるが、有効性、成分の安全性プロファイル、安価であること、薬物間の相互作用がないことなどから、上記の組み合わせを提案した。また、IVMとドキシサイクリンの組み合わせは、COVID-19に対して相乗効果を発揮することが実証されている[33]。また、この組み合わせは、Calyらが指摘したIVMを単独で使用した場合の高用量投与の必要性を克服しているようである[34]。さらに、亜鉛が抗ウイルス活性において重要な役割を果たしていることから[34536]、イオノフォア(IVMおよびドキシサイクリン)とうまく結合して細胞内濃度を高め、ウイルスのクリアランスを促進すると考えられる[37]。また、薬物間相互作用を評価したところ、亜鉛とIVMおよびドキシサイクリンとの併用では、相互作用の報告はなかった。さらに、これらの薬剤はいずれも副作用が少なく、アジスロマイシンで報告されたQT延長もない。
現在の文献を総合すると、IVM、ドキシサイクリン、亜鉛の10日間の併用療法は、症状を改善するだけでなく [6,7]、COVID-19からの回復を早めることができる。我々は、寄生虫に対して承認されている安全なIVM投与量である36mgを10日間で選択したが、この投与量はCOVID-19治療において有効かつ安全であることが示されている[38]。血漿中での薬剤の半減期(最大66時間)[39]を考慮して,10日間の時間差投与を提案した。提案されている投与期間では、亜鉛の細胞内への取り込みを促進するのに十分な血漿レベルのIVMを常に利用することができる。したがって、上記の理論的根拠は、IVM単独ではCOVID-19を治癒するのに十分ではなく[6,18,19]、多剤併用療法がより効果的である可能性が高いことをいくつかの論文がすでに示している理由を説明している[40]。
本研究では、アンダーパワーではあるものの、連続した被験者を研究に登録し、異なる時点での被験者の選択に偏りはなかった。登録された被験者の多くは重症であり、主観的な評価により入院や挿管を余儀なくされた可能性がある。しかし、ICTの抗ウイルス作用により、SpO2が急速に回復し、免疫力の向上だけでは説明できない他の症状も回復したと考えられる。
この研究の弱点は、同時に登録された対照群がないことである。しかし、テス・ローリーらは、治療を断念した2人の被験者と同様に、「対照群の多くの重篤な患者が死亡するため、対照群の使用を承認することはもはや倫理的ではない」と指摘している[41]。したがって、我々の研究では、ECTまたは「合成」対照群を使用することで、年齢や併存疾患を一致させて比較することができた。機関内審査委員会は、ローリー[41]が発表したように、利用可能な合成対照群を含める規定を盛り込み、COVID-19試験に対照群を含む試験を拒否すべきである。
本研究では、広範な文献に基づいて、耐性を予防することを目的とした、安価で安全、容易に入手可能で効果の高い実用的な3剤併用療法を提供し、外来患者のCOVID-19に対するルーチン治療として自信を持って使用することができる。
図と表の説明
表1: 被験者とCOVIDに関連する症状が現れた時のリストとその他の特徴。O2% Sat = 治療開始直前の SpO2。O2% Sat post 24 hrs. = 治療開始から 24時間後のSpO2。Rx開始日=ICT投与の1日目。SOB = Shortness of Breath(息切れ)。
表2 A. 被験者の年齢と人口統計。B. COVIDの影響を受けやすい併存疾患の有病率。C. 被験者の併存疾患の数。
図1:1~3週間ですべての患者に完全な回復が見られた
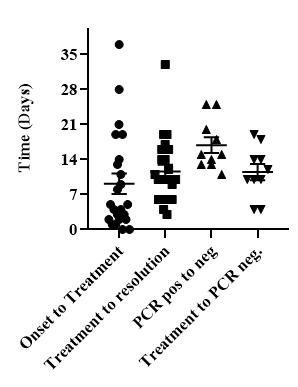
A. 症状が出てから消失するまでの期間(日数)。
ほぼすべての被験者が3週間以内に症状を消失し,PCRが陰性化した Col 1:症状発現から治療開始まで(n = 23,平均 = 9.17 + 2.05)
Col 2:治療開始から症状の消失まで。n = 23, 平均 = 11.61 + 1.38)
Col 3:最初のPCR陽性から最初のPCR陰性(n = 10, 平均 = 16.90 + 1.58)
大腸菌4:治療開始から最初のPCR陰性まで(n=10,平均=11.50+1.60
B. 上段、患者の生存率は100%で、COVID脆弱性が同等以下のCDCデータベースの合成対照と比べて有意に高い(2検定でp = 0.044)。下:入院を必要とした患者は0%で、データベースからの合成対照よりも有意に少ない(2検定でp = 0.0011)。
図2 A. 治療前の酸素飽和度は,すべての被験者が治療に成功したと定義される95%よりも有意に(p < 0.05)低かった。B. 治療から 24時間後、被験者のO2飽和度が有意に上昇した(ペアt検定、p<0.001,治療前後のデータがある被験者のみを対象)。O2飽和度は上昇を続け、O2飽和度95%以上という定義された治癒まで続いた。
図3:COVIDスコア、CovidexおよびCovidex-F(定義については方法を参照、Covidex-Fは発熱対策を含む)と治療開始から症状が解消するまでの時間との比較。Covidexスコア(Covidex, p = 0.0288; Covidex-F, p = 0.0096)と治療完了までの時間には有意な関係があった。
補足図1:被験者が使用した症状記録シートの例。
