Contents
Effect of Ivermectin on Time to Resolution of Symptoms Among Adults With Mild COVID-19
jamanetwork.com/journals/jama/fullarticle/2777389
2021年3月 4日

キーポイント
質問
軽度の COVID-19 を有する成人患者における症状の持続時間に対するイベルメクチンの効果は?
所見
476人の患者を含むこの無作為化臨床試験において、イベルメクチンの5日間の経過を受けた患者では、プラセボと比較して症状の持続期間に有意な差は認められなかった(症状の消失までの期間の中央値、10日対12日;症状消失のハザード比、1.07)。
意味
軽度の COVID-19 の治療にイベルメクチンを使用することを支持するものではないが、他の臨床的に関連するアウトカムへの影響を理解するためには、より大規模な試験が必要かもしれない。
要旨
重要性
イベルメクチンは、その臨床的有用性に関する不確実性にもかかわらず、COVID-19の潜在的な治療薬として広く処方されている。
目的
軽度のCOVID-19に対するイベルメクチンの有効な治療法であるかどうかを明らかにする。
デザイン、設定、および参加者
コロンビアのカリの単一施設で実施された二重盲検無作為化試験。試験参加候補者は、試験期間中に症状があり、臨床検査でCOVID-19が確認された患者の州保健局の電子データベースから単純な無作為抽出によって同定された。7日以内の軽度の疾患と症状を有する成人患者(在宅または入院)合計476人が 2020年7月15日から 11月30日までの間に登録され 2020年12月21日まで追跡調査された。
介入
患者は、イベルメクチンを1日300μg/kgの体重で5日間投与する群(n=200)またはプラセボを投与する群(n=200)に無作為に割り付けられた。
主要評価項目
主要評価項目は、21 日間の追跡期間内に症状が消失するまでの時間であった。依頼有害事象および重篤な有害事象も収集した。
結果
一次解析対象集団に無作為に割り付けられた400人の患者(年齢中央値37歳[四分位間範囲{IQR}、29~48]、女性231人[58%])のうち、398人(99.5%)が試験を終了した。症状消失までの期間の中央値は,イベルメクチン群で10日(IQR,9~13)であったのに対し,プラセボ群では12日(IQR,9~13)であった(症状消失のハザード比,1.07[95%CI,0.87~1.32];log-rank検定によるP = 0.53).21 日目までに、イベルメクチン群では 82%、プラセボ群では 79%が症状が消失していた。最も一般的に報告された有害事象は頭痛で、イベルメクチン投与群104例(52%)とプラセボ投与群111例(56%)から報告された。最も多かった重篤な有害事象は多臓器不全であり、4例(各群2例)に報告された。
結論と関連性
軽度のCOVID-19を有する成人において、イベルメクチンを5日間投与しても、プラセボと比較して症状の消失までの期間は有意に改善しなかった。この結果は軽度COVID-19の治療にイベルメクチンを使用することを支持するものではないが、他の臨床的に関連する転帰に対するイベルメクチンの効果を理解するためには、より大規模な試験が必要であろう。
試験登録 ClinicalTrials.gov Identifier. NCT04405843
序論
COVID-19患者の転帰を改善するためには、治療的アプローチが必要である。イベルメクチンは、良好な安全性プロファイルを有する薬剤として広く使用されている1)。10 いくつかの国では、治療ガイドラインにイベルメクチンが含まれており、11-13,一般人口による薬の需要が急増し、動物用製剤の流通が疑われるほどである14。
4 この無作為化試験(EPIC試験[Estudio Para Evaluar la Ivermectina en COVID-19])の仮説は、イベルメクチンをCOVID-19患者に感染初期に投与すると、COVID-19患者の回復が促進されるというものであった。
方法
試験デザインと患者
この研究は、コロンビア規制庁(INVIMA No. PI-CEP-1390)Corporación Científica Pediátricaの独立倫理委員会、およびコロンビアのカリにある協力病院によって承認され、ヘルシンキ宣言および臨床試験ガイドラインに基づいて実施された。すべての患者から書面によるインフォームドコンセントを得た。試験の詳細については、プロトコル(補足1)に記載されている。
このイベルメクチン対プラセボの二重盲検無作為化試験は 2020年7月15日から 12月21日まで、カリ州のCentro de Estudios en Infectología Pediátricaによって実施された。試験参加候補者は、カリ市のコロンビア国立衛生研究所公認の検査機関のいずれかで実施されたSARS-CoV-2逆転写酵素ポリメラーゼ連鎖反応または抗原検査で陽性の結果が得られたすべての患者の州保健局の電子データベースから同定された。
潜在的な研究参加者は、州のデータベースから単純な無作為抽出によって同定され、選択された。成人男性および非妊娠または授乳中の女性は、症状が過去7日以内に始まっており、在宅または入院しているが高流量鼻腔酸素または機械的換気(侵襲的または非侵襲的)を受けていない軽症であると定義された場合に参加資格があった。
- 患者が無症状であった場合、
- 重度の肺炎を有していた場合、
- 過去 5 日以内にイベルメクチンの投与を受けていた場合、
- または肝機能障害または肝機能検査の結果が正常値の 1.5 倍以上であった場合
は除外された。選考基準の詳細は、プロトコル(補足1)に記載されている。人種/民族による健康格差はCOVID-19感染症で報告されている16,17 。従って、この変数に関する情報は、研究参加者が選択した固定カテゴリーに基づいて研究担当者が収集した。
無作為化
資格のある患者を 1:1 の割合で無作為に割り付け、イベルメクチンの経口投与またはプラセボの溶液投与を 5 日間行った。患者は、非盲検の薬剤師がMicrosoft Excel 19.0を用いて作成した無作為化シーケンスで4つのブロックに分割され、イベルメクチンまたはプラセボのマスクを在宅または病院の患者訪問のために現場の看護師に提供した。割り付けは、研究者や患者には知られていなかった。
介入
試験患者には、イベルメクチンを1日300μg/kg体重で経口投与した溶液または同量のプラセボを5日間投与した。イベルメクチンはTecnoquímicas社から0.6%溶液の経口投与用ボトルで提供された。患者には、スクリーニングと無作為化手続きを経て治験薬を投与する最初の試験日を除き、空腹時に服用してもらった。
2020年8月26日までは、生理食塩水に5%のブドウ糖と蒸留水に5%のブドウ糖を混合した溶液をプラセボとし、その後はメーカーから提供されたイベルメクチンに類似した有機刺激性を有する溶液をプラセボとした。イベルメクチンと生理食塩水/ブドウ糖プラセボの味や匂いが異なるため、盲検化が危ぶまれる可能性があるため、メーカーのプラセボが入手可能になるまでは、1 世帯あたり 1 人の患者のみをこの試験に参加させた。二重盲検化を保証するために、イベルメクチンとプラセボのボトルは試験期間中ずっと同じものを使用した。
試験の手順
試験担当医師が試験参加者候補者に電話で連絡を取り、適格性の選択基準を確認し、インフォームドコンセントを得た。患者はその後、試験看護師によって自宅または病院を訪問され、肝酵素評価のために採血を行い、尿中妊娠検査を実施した。資格のある患者は看護師によって再診され、登録、ベースラインの人口統計学的および臨床情報の文書化、治験薬の調剤が行われた。治験薬は2日目から5日目まで患者に預けられ、自己投与された。その後、患者は2日目から5日目、8日目、11日目、15日目、21日目に試験スタッフから電話で連絡を受け、構造化された面接を受けた。試験担当医師が入院患者の医療記録を確認し、プロトコルで必要とされる情報を入手した。試験終了後(21日目)アドヒアランスを証明するために、未使用または空の治験薬ボトルを回収した。データは電子データベースに入力され、施設の品質管理部門によって検証された。
アウトカム測定
主要アウトカムは、無作為化されてから 21日間の追跡期間内に症状が完全に消失するまでの時間であった。この試験で使用された8項目の順序尺度は、COVID-19の異なる治療試験18-20で使用されており、世界保健機関(WHO)のR&Dブループリント21で推奨されている。0 = 感染症の臨床的証拠がない;1 = 入院しておらず活動制限がない;2 = 入院しておらず活動制限がある、在宅酸素が必要、またはその両方がある;3 = 入院しているが酸素補給を必要としない;4 = 入院しているが酸素補給を必要とする;5 = 入院しているが経鼻高流量酸素、非侵襲的機械換気、またはその両方が必要;6 = 入院しているが体外膜酸素療法、侵襲的機械換気、またはその両方が必要;そして7 = 死亡である。回復までの時間は、患者がスコア0を報告した21日間の追跡期間中の最初の日と定義した。
副次的転帰として、無作為化後に2ポイント(8項目の順序スケールのベースラインスコアから)悪化した患者と定義された臨床的悪化を示した患者の割合が含まれていた。追加の副次的転帰は、2日目、5日目、8日目、11日目、15日目、21日目の8項目順序尺度で評価された臨床状態であったが、2日目と15日目のデータはここでは報告していない。発熱した患者の割合、無作為化後の発熱期間、死亡した患者の割合も報告された。新規発症時に一般病棟または集中治療室に入院した患者、または新規発症時に24時間以上の補助酸素が必要となった患者の割合は、ケアのエスカレーションと呼ばれる単一のアウトカムにまとめられた。両治療群におけるエスカレーションの発生頻度とその期間を報告した。有害事象(AE)の評価には,誘引AE,治療中止に至るAE,重篤なAEが含まれた。有害事象は、米国国立がん研究所の Common Terminology Criteria for Adverse Events version 5.0.22 に基づいて分類した。
ポストホック分析
無作為化時にエスカレーションの必要性が切迫していた患者がいたことを考慮し、無作為化後12時間以上経過してからエスカレーションが発生した症例の頻度と21日目までの期間を両治療群で報告した。また、救急部(ED)または遠隔医療相談を必要とした患者の割合の比較も行った。
統計解析
主要評価項目は、当初、無作為化から8項目の序列尺度で2ポイント悪化するまでの時間と定義されていた。文献によれば、このようなアウトカムが得られると予想された患者は約 18%であった23 。しかし、中間解析を行う前に、プールされた 2 ポイント増悪のイベント率が当初の予想 18%を大幅に下回っていることが明らかになり、サンプルサイズが達成できないことが必要となった。そこで 2020年8月31日、治験責任医師はデータおよび安全性モニタリング委員会に、主要エンドポイントを無作為化から 21日間の追跡期間内に症状が完全に消失するまでの時間に変更することを提案した。これは2020年9月2日に承認された。新しい一次エンドポイントのログランク検定に基づく当初のサンプルサイズ400は維持され、イベルメクチンとプラセボの割り付け比を1:1とした。これにより、21日目の時点で75%の患者が目的のアウトカムを有すると仮定した場合、290件の目的のイベント(症状の消失)を検出することが可能となる24。これは、イベルメクチンとプラセボを比較したハザード比(HR)が1.4の場合、イベルメクチンを投与された患者では症状が3日早く消失することに対応し、症状消失までの期間がプラセボの場合は12日と仮定した場合24,2辺のタイプI誤差5%の下で80%の検出力が得られることになる。
2020年10月20日、主任薬剤師は 2020年9月29日から 10月15日までの間に表示エラーが発生したことを確認し、その結果、この期間中にすべての患者がイベルメクチンを投与され、プラセボを投与された患者はいなかったことを確認した。このエラーのため、試験の盲検者はマスクを解除されなかった。データおよび安全性モニタリング委員会は、これらの患者を一次解析から除外するが、感度解析のために保持することを推奨した。プロトコルは、元々計算されていた研究力を維持するために、これらの患者を置き換えるように修正された。一次解析対象集団には、無作為化群に従って解析された患者が含まれていたが 2020年9月29日から 10月15日の間に募集された患者、および無作為化されたが後に選択基準に違反していることが判明した患者は除外された。患者は、治療を受けたままの集団で受けた治療に従って解析した(感度解析)。
主要エンドポイントである無作為化からイベルメクチンとプラセボの症状が完全に消失するまでの時間をKaplan-Meierプロットで評価し、対数順位検定と比較した。両治療群における症状消失の累積発生率のHRおよび95%CIは、Cox比例ハザードモデルを用いて推定した。比例ハザードの仮定は、log-logプロットと非ゼロ勾配の検定を用いてグラフィカルに検定された。比例の仮定を否定する証拠はなかった。
症状が完全に消失するまでの時間は、すべての患者が21日目に到達した後に評価された。21日目までに死亡した患者または21日目までに症状が消失した患者のデータは、それぞれ死亡時または21日目に右打ち切りされた。8ポイントの順序尺度を用いた各試験訪問における治療の効果の評価は、比例オッズ比(OR)とそれぞれの95%CIを用いて順序ロジスティック回帰を用いて推定した。比例オッズの仮定はBrant検定に従って満たした。8点の序数スケールは,0が死亡、7が症状のない患者に対応するスコアで反転させた。
感度解析では、一次エンドポイントと二次エンドポイントを治療後の集団で比較した。
クラスター化された標準誤差は、同一世帯の複数の患者間の相関を調整するために推定された。統計的有意性はP < 0.05とし、すべての検定は2-tailedとした。多重比較によるタイプIエラーの可能性があるため、二次エンドポイントの解析に関する所見は探索的なものとして解釈すべきである。統計解析はStataバージョン16.0(StataCorp)を用いて行われた。中央値の差のブートストラップ95%CIは、R統計パッケージバージョン3.6.3(The R Foundation)を使用して計算した。
結果
患者
無作為化を受けた患者476人のうち、238人がイベルメクチン投与群に、238人がプラセボ投与群に割り付けられた(図1)。75人の患者は 2020年9月29日から 10月15日の間に無作為化され、一次解析集団からは除外されたが、無治療集団に残った。3人の患者は、無作為化後に不適格と判断されたため、すべての解析から除外された(無症候性の患者1人と、登録前5日以内にイベルメクチンを投与された2人)。一次解析集団には398人の患者が含まれた(200人がイベルメクチン群、198人がプラセボ群に割り付けられた)。
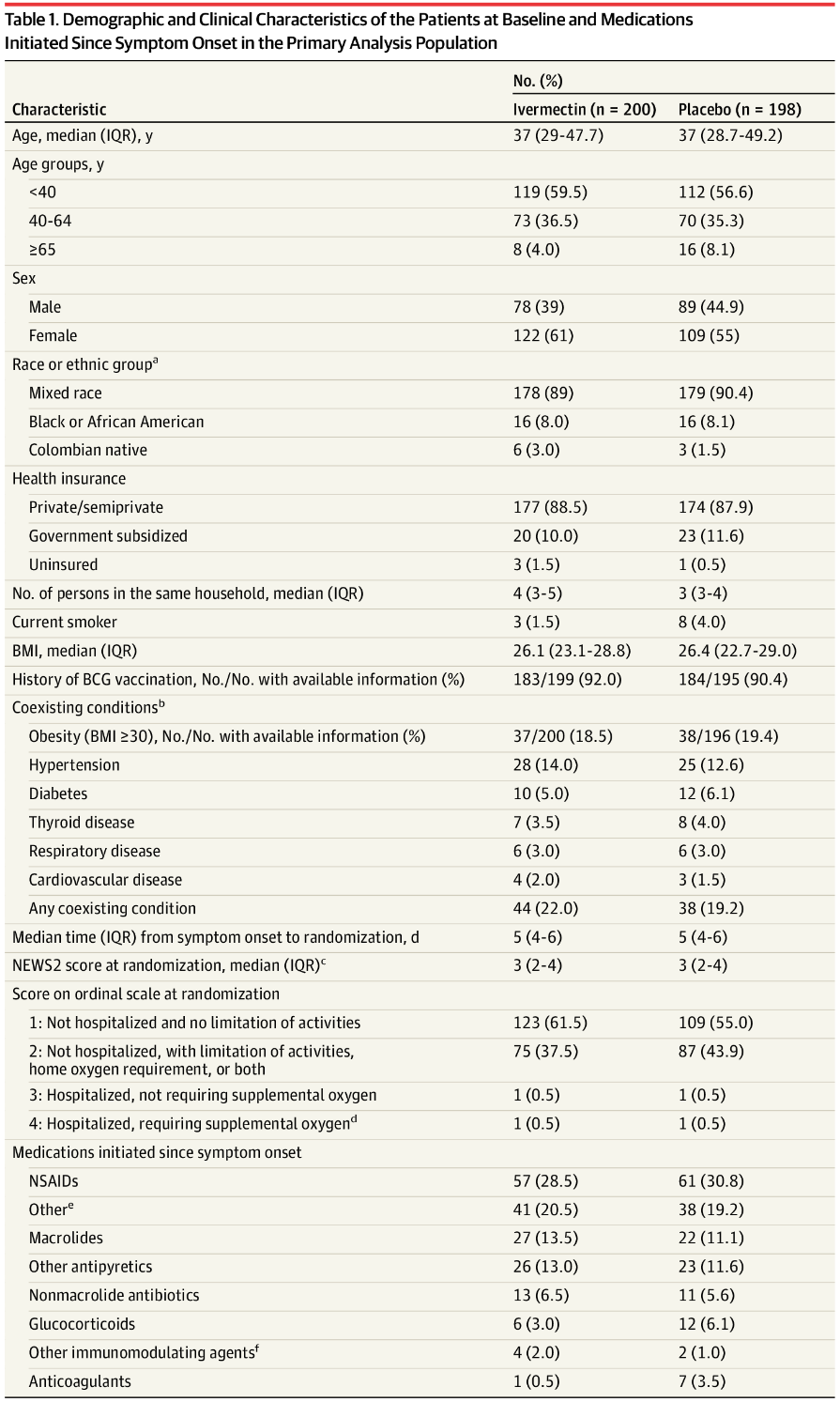
両群の患者は、ベースライン時の人口統計学的特徴と疾患特性のバランスが取れていた(表1;2のe表1)。一次解析集団の患者の年齢中央値は37歳(四分位間値範囲[IQR]、29~48)231人(58%)は女性、316人(79%)はベースライン時に既知の併存疾患を有していなかった。無作為化時の全国早期警戒スコア2の中央値は3(IQR、2-4)であり、ほとんどの患者(n = 232,58.3%)は自宅にいて日常的な活動を行うことができた。最も多かった症状は、筋肉痛(310人、77.9%)と頭痛(305人、76.6%)で、次いで嗅覚・味覚障害(それぞれ223人[56%]、199人[50%])咳(211人、53%)で、最も多かったのは乾性(181人、45.5%)であった(補足2のe表2)。
イベルメクチンを投与されたが一次解析から除外された75人の患者のベースライン特性は、コホートに残った398人の患者と有意差はなかった(補足2のe表1および3)。
表1
一次アウトカム
イベルメクチン投与群とプラセボ投与群の症状消失までの期間に有意差はなかった(中央値、10日 vs. 12日、差、-2日 [IQR、-4~2]、症状消失のHR、1.07 [95% CI,0.87~1.32]、P = 0.53)。図2および表2)。イベルメクチン群とプラセボ群では、21日目までにそれぞれ82%、79%の患者で症状が消失した(表2)。
患者が受けたプラセボの種類は結果に影響を与えなかった(イベルメクチン対生理食塩水中ブドウ糖のHR:1.14 [95%CI,0.83~1.55]、イベルメクチン対メーカー製プラセボのHR:1.07 [95%CI,0.85~1.34])(補足2のe図1)。
同様の結果は、無治療群でも観察された(補足2のe図2およびe表4)。
二次アウトカム
序列8点スケールで2点以上の臨床的悪化を示した患者はほとんどおらず、2つの治療群間に有意差はなかった(イベルメクチン群で2%、プラセボ群で3.5%;絶対差、-1.53[95%CI、-4.75~1.69])。イベルメクチン群とプラセボ群の悪化のORは0.56(95%CI,0.16~1.93)であった(表2)。
順序尺度のスコアが改善するオッズは、比例オッズモデルによって決定され、両治療群間で有意差はなかった(補足2のe図3およびe表5)。
2つの治療群でケアのエスカレーションを必要とした患者の割合には有意差はなかった(イベルメクチン投与群2%、プラセボ投与群5%、絶対差、-3.05 [95% CI, -6.67~0.56]、OR, 0.38 [95% CI, 0.12~1.24])。イベルメクチン群とプラセボ群では、患者がエスカレーションケアを必要とした期間に有意な差はなかった(差の中央値、7日[IQR、-5.0~16.5])。試験期間中に発熱した患者の割合は、2群間で有意差はなかった(イベルメクチン対プラセボの絶対差、-2.61[95%CI、-8.31~3.09];OR,0.73[95%CI,0.37~1.45])発熱期間(イベルメクチン対プラセボの絶対差、-0.5日[95%CI、-1.0~2.0])。(表2)であった。プラセボ群の患者1人が試験期間中に死亡した。主要転帰および副次的転帰についてはデータの欠落はなかった。治療後の集団での結果については、2のe表4および6を参照のこと。
ポストホックエンドポイントと解析
無作為化後12時間以内に入院を必要とした患者4例(中央値、3.25時間[IQR、2~6])を除いた後、エスカレーションを必要とした患者はイベルメクチン群で4例(2%)プラセボ群で6例(3%)であった(絶対差、-1.0[95%CI、-4.11~2.05];OR,0.65[95%CI,0.18~2.36])。表2)であった。
治療(EDまたは遠隔医療相談)を希望した患者の割合は2群間で有意差はなかった(イベルメクチン群8.0%、プラセボ群6.6%;差の絶対値1.43[95%CI、-3.67~6.54];OR、1.24[95%CI,0.56~2.74])。(表2)。治療後の集団での結果については、補足2のe表4を参照のこと。
有害事象
イベルメクチン群154例(77%),プラセボ群161例(81.3%)が無作為化から 21日目までの間にAEを報告した。イベルメクチン投与群では15例(7.5%)プラセボ投与群では5例(2.5%)がAEにより治療を中止した。重篤なAEは4例(各群2例)に発現したが、いずれも治験薬との関連性は認められなかった(表3,2のe表7)。
考察
この軽度の COVID-19 症状を有する成人を対象とした二重盲検無作為化試験では、感染が確認されてから最初の 7 日間にイベルメクチンとプラセボを 5 日間投与したところ、症状が消失するまでの時間を有意に改善することができなかった。
COVID-19治療におけるイベルメクチンへの関心は、SARS-CoV-2に感染したVero-hSLAM細胞を5μMのイベルメクチンで浸漬すると、ウイルスRNAが約5000倍に減少することを明らかにした試験管内試験から始まりました8。しかしながら、薬物動態モデルは、試験管内試験で使用された濃度がヒトの肺や血漿中で達成することが困難であることを示しており25 、イベルメクチンの阻害濃度が臨床的に安全な用量でヒトで達成される可能性は低いことを示している26。これにもかかわらず、ロジスティック回帰と傾向スコアマッチングを用いたレトロスペクティブ研究では、200μg/kgのイベルメクチンの単回投与(8%の患者が2回目の投与を受けた)と重症COVID-19で入院した患者の生存期間の改善との間に関連性があることが示された27。我々の知る限りでは、COVID-19の治療としてイベルメクチンを用いた他のランダム化試験の予備的報告で、良好な結果が得られたものは、まだ査読付きジャーナルに発表されていない。
33,34 さらに、米国食品医薬品局(FDA)が承認した蠕虫症治療用の用量(200 μg/kg)は、観察研究で臨床的有用性が示されており、27,より高用量の投与が臨床的に関連する可能性があるという仮説を支持している。
この研究では、COVID-19の治療に対する臨床的有用性の他の評価指標に対するイベルメクチンの有意な効果は認められなかった。イベルメクチン治療を受けた患者のうち、エスカレーションを必要とした患者の割合は数値的には少なかったが(イベルメクチン投与群では2.0%、プラセボ投与群では5.0%)その差は統計的に有意ではなく、無作為化後の中央値3.25時間に入院した4人の患者を除外したポストホック解析ではさらに減衰していた。さらに、イベルメクチンは ED や電話相談を減少させなかったため、これらのアウトカムに対する有効性の欠如をさらに裏付ける結果となった。しかし、比較的若く健康な研究集団では合併症を発症することはほとんどなかったため、この研究ではそのような効果を検出する力が不足していた。したがって、軽度の COVID-19 からより重度の段階への進行を予防するイベルメクチンの能力については、より大規模な試験で評価する必要があるだろう。
この研究では、症状が顕在化した直後の患者では症状の早期解決を検出するのに十分なパワーがあり、有意差は認められなかった。しかし、研究対象者は比較的若く、併存疾患が少なく、肝酵素値が正常値の1.5倍未満であったため、本知見はそのような集団にのみ一般化可能であるかもしれない。
これらの知見を総合すると、イベルメクチンは初期の COVID-19 の経過に有意な影響を与えないことが示唆され、血漿中の総量および未結合イベルメクチン濃度は、承認用量の 10 倍以上の用量レベルであっても、ウイルスの 50%の阻害をもたらす濃度には達しないことを示す薬物動態モデルと一致している32。
限界
この研究にはいくつかの制限がある。第一に,この試験は当初の計画通りに実施・完了しておらず,また,イベルメクチンの臨床増悪防止能力を検出するという当初の主要アウトカムが試験開始 6 週間後に変更されていることである.この試験集団では、臨床的悪化の発生率が 3%未満であったため、当初予定していた解析は無意味なものとなった。最終的に、主要評価項目および副次評価項目の所見は、イベルメクチン群とプラセボ群で有意差は認められなかった。
第二に、本試験ではイベルメクチンとプラセボの症状消失のHRは1.4と十分な検出力を有していたが、一次エンドポイントではより小さいながらも臨床的に有意な減少を検出するには検出力が不足していた可能性がある。
第三に、ウイルス学的評価は含まれていないが、測定された臨床的特徴は間接的にウイルス活性を反映しており、パンデミック時には関心の高いものである。
第四に、最初の 65 人の患者に使用されたプラセボは、味と匂いがイベルメクチンと異なっていた。しかし、同一世帯の患者は、同じ有機嗅覚特性を有するプラセボが入手可能になるまでは含まれておらず、イベルメクチンの一次転帰に対する効果の欠如は、プラセボのいずれかの製剤と比較した場合にも同様であった。
第5に、2つの副次的転帰は、初期段階では患者の自己報告を必要とするため、主観性を導入することができる8項目の順序尺度を使用している。
第六に、イベルメクチン血漿中濃度のデータは収集されなかった。
第7に、すでに述べたように、研究集団が比較的若く、高齢者集団では結果が異なる可能性がある。
結論
軽度のCOVID-19の成人において、イベルメクチンを5日間投与しても、プラセボと比較して症状の消失までの期間は有意に改善しなかった。この結果は、軽度COVID-19の治療にイベルメクチンを使用することを支持するものではないが、他の臨床的に関連する転帰に対するイベルメクチンの効果を理解するためには、より大規模な試験が必要かもしれない。
共著者。エドゥアルドLópez-Medina、MD、MSC、Centro de Estudios en Infectología Pediátrica、カリ5 B 5号37 BIS-28,カリ、コロンビア(eduardo.lopez@ceiponline.org)。
出版のために受理された。2021年2月18日。
オンライン公開:2021年3月4日。doi:10.1001/jama.2021.3071.
著者の貢献。López-Medina博士とRamirez博士は、研究のすべてのデータに完全にアクセスし、データの完全性とデータ解析の正確性に責任を負う。
概念とデザイン。ロペス-メディーナ、ロペス、Hurtado、Dávalos、ラミレス、Martínez、Díazgranados、Oñate、Chavarriaga。
データ、分析、または解釈。ロペス-メディーナ、Hurtado、ラミレス、マルティネス、オニャーテ、Chavarriaga、エレーラ、パラ、Libreros、ハラミーリョ、Avendaño、トロ、トレス、レスメス、リオス、カイセド。
原稿の起草。ロペス-メディーナ、Hurtado、Dávalos、Chavarriaga、Caicedo。
重要な知的コンテンツのための原稿の批判的な改訂。全執筆者。
統計分析。ロペス-メディナ、ラミレス。
資金提供を得ました。López-Medina、López。
管理、技術、または材料のサポート。Hurtado、Dávalos、Martínez、Díazgranados、Chavarriaga、Herrera、Parra、Libreros、Jaramillo、Avendaño、Toro、Torres、Lesmes、Rios、Caicedo。
監督 ロペス-メディーナ、ロペス、オニャーテ、リオス、カイセド。
利益相反の開示
López-Medina博士は、研究の実施中にSanofi Pasteur、GlaxoSmithKline、およびJanssenからの助成金とSanofi Pasteurからの個人的な手数料を受けていることを報告した。López博士は、研究実施中にSanofi Pasteur、GlaxoSmithKline、Janssenからの助成金とSanofi Pasteurからの個人的な費用を受けていると報告した。Oñate博士は、提出された研究以外で、Janssenからの助成金とMerck Sharp & DohmeおよびGileadからの個人的な費用を受け取っていると報告した。Torres 博士は、本研究の実施中に Tecnoquímicas から本プロジェクトとは無関係の非金融支援を受けていると報告している。その他の開示は報告されていない。
資金/支援
この研究はCentro de Estudios en Infectología Pediátrica(ScDi823)から無制限の助成金を受けた。
資金提供者/スポンサーの役割。
研究のデザインと実施、データの収集、管理、分析、解釈、原稿の作成、レビュー、承認、および出版のための原稿提出の決定には、資金提供者は何の役割も果たしていない。
JAMAという雑誌にコロンビアのダブルブラインドのプラセボ試験結果が載りました。イベルメクチンには効果がないとの結果です。しかし、一般的な錠剤を用いず、わざわざ水剤として服用させてます。イベルメクチンは脂溶性なので溶けません。懸濁液です。一方でプラセボはデキストリンで透明です。
— 花木秀明 (@hanakihideaki) March 5, 2021
イベルメクチン懸濁液は独特の匂いがあります。プラセボにはありません。投与方法を変えた時は、きちんと吸収されてるか否かを判断する為に血中濃度を測定します。至極当たり前の事ですが、測定されていません。吸収されなければ効果は出ません。この基礎的な確認さえ行われていない事に愕然とします。 t.co/iWpUSs2cTq
— 花木秀明 (@hanakihideaki) March 5, 2021
イベルメクチンの原末を企業(名前が分かりません)からもらっていますが、原末は原末であって薬ではありません。吸収させるために様々な工夫が必要です。一介の病院で製薬メーカー並みの製剤検討ができるのでしょうか?
最も大きな問題は臨床試験がプロトコールに則ってなされていない事です。 t.co/bV1dbEa2GY— 花木秀明 (@hanakihideaki) March 5, 2021
プロトコール違反で出された結果を論文化するなど常識では考えられません。
また、普通の生活ができる在宅の若者が対象、在宅なので服用してるか否かの確認が取れない、3%しか悪化しないので有意差がとれない、ウイルスの減少は測定していない、300μg/Kgの5日間連投で胃腸障害もない。不思議です。 t.co/z4CA6ysxGQ— 花木秀明 (@hanakihideaki) March 5, 2021
イベルメクチンが効かない証拠として取り上げた最新のコロンビア治験について、FLCCCのEric Osgood医師によれば、結果はIVMが効かないよりも、偽薬組の回復状況が一般的な患者を大幅に上回り、対照で統計上は有意義にならなかった。さらに治験内容についても疑問がある。t.co/s7sLkR5Nl2
— shiroro (@shiroro75961128) March 5, 2021
FLCCCのEric Osgood医師がコロンビアのイベルメクチン治験に対するコメントと質問はJAMAサイトに掲示された。t.co/iUTbExhues
— shiroro (@shiroro75961128) March 5, 2021
