Contents
EDTA Chelation Therapy for the Treatment of Neurotoxicity
www.ncbi.nlm.nih.gov/pmc/articles/PMC6429616/
要旨
神経毒性は多くの直接的要因によって引き起こされるが、その中でも、有害金属、有機リン系農薬、大気汚染、放射線および電磁場、神経毒、化学療法薬および麻酔薬、病原体が最も重要である。神経毒性の他の間接的な原因としては、サイトカインおよび/または活性酸素種の産生および養子免疫療法が挙げられる。神経変性疾患の発生は、神経毒性と関連している。神経毒性を予防または除去するのに有用な武器はどれか。
キレート剤であるエチレンジアミン四酢酸カルシウム二ナトリウム(EDTA)は、以前から心血管疾患の治療に使用されてきたが、神経変性疾患の治療に有用であることが知られている。本稿では、EDTAが神経変性疾患の治療薬としてどのように機能するのかを解説する。また、我々の知見を確認するために、いくつかの症例研究を報告する。
キーワード:神経毒性、神経疾患、心血管疾患、EDTA
1. はじめに
有害物質によって誘発される神経細胞への損傷を「神経毒性」と定義し、その原因の多くが本レビューで報告されている。ある種の有害物質はニューロンを「直接」損傷させることができ、具体的には、有害金属、大気汚染、有機リン系殺虫剤、神経毒、化学療法、他の薬剤(麻酔を含む)病原体感染症などである。考慮され得る神経毒性の間接的なメカニズムとしては、サイトカイン(インターロイキン-1またはIL-1,腫瘍壊死αまたはTNF-α、およびインターフェロンγまたはINFγ)としてのプロ炎症性刺激因子、活性酸素種(ROS)およびC19 T細胞を用いた養子免疫療法が挙げられる。
本レビューでは、神経毒性の直接的および間接的なメカニズムを考慮に入れている。また、本レビューでは、神経毒性に関連する多くの損傷を除去するためのエチレンジアミン四酢酸(EDTA)キレーション療法の関連性についても記述しているが、この療法によって得られた重要な結果についても報告している。
2. 直接」神経毒性の主な原因と関連メカニズム
2.1. 有害金属
21種類の金属が有毒とされている。それらは以下の通りである。
アルミニウム(Al)アンチモン(Sb)ヒ素(As)バリウム(Ba)ベリリウム(Be)ビスマス(Bi)カドミウム(Cd)セシウム(Cs)ガドリニウム(Gd)鉛(Pb)水銀(Hg)。ニッケル(Ni)パラジウム(Pd)白金(Pt)テルル(Te)タリウム(Tl)トリウム(Th)スズ(Sn)チタン(Ti)タングステン(W)ウラン(U)。
これらのうち、神経毒性を誘発することが最も知られているものは、
Pb, Cd, Hg, Ni, Alである。
酸化的損傷は鉛による神経毒性と関連しており、慢性的な鉛への暴露は認知機能障害を引き起こす可能性がある。生涯にわたる鉛への曝露がラットに神経変性損傷(神経細胞密度と脳体積の低下)を引き起こすことが示されており、それは乳児期に起こり始め、成人期に緩和された後、老年期に強まることが示されている[1]。
鉛の神経毒性の分子機構は、ヒト神経芽細胞腫細胞株SH-SY5Yにおいて、シェロフェルニア-1遺伝子の活性阻害を介して同定されている[2]。PC-12細胞では、Cd曝露により、いくつかの分子(脂質、アミノ酸、ビタミン、有機酸、アシルカルニチン)に重大な変化が生じる可能性がある。これらの変化は、エネルギー代謝(解糖、トリカルボン酸サイクル、脂肪酸β酸化)細胞シグナル伝達、細胞膜組成、抗酸化系や細胞解毒系と同様に調節することができる[3]。
無機Hgへの慢性的な低用量曝露は、ラットの海馬機能障害を引き起こす。実際、海馬では、短期・長期記憶の損傷、細胞毒性、アストロサイトやニューロンのアポトーシスによる細胞死が認められている[4]。ゼブラフィッシュモデルなどのいくつかの実験モデルは、重金属(Pb、Cd、Hg)の神経毒性を解明し、神経系の機能を研究するために使用されてきた[5]。
もう一つの有害金属であるNiは、嗅覚経路を通過するか否かに関わらず、脳内に蓄積される。それはミトコンドリアの損傷、例えばミトコンドリア膜電位の変化(これはミトコンドリア機能を評価するための重要なパラメータである)とATPとmtDNA濃度の低下を誘発する[6]。
Alは、神経細胞、神経膠細胞、新生ラットの共培養神経細胞において細胞死を誘導することが示されている[7]。また、多発性硬化症(MS)患者の脳組織においても、細胞レベル、細胞外レベルの両方で確認されている[8]。
我々は、多発性硬化症(MS)筋萎縮性側索硬化症(ALS)パーキンソン病(PD)アルツハイマー病などの神経変性疾患(ND)の発症と有害金属の負担との関係について既に述べている[10]。
また、エピジェネティックな修飾を介してND患者の遺伝的感受性を有利にする有害金属の役割もすでに示されている。アルツハイマー病の開始と進行におけるAlの役割は、DNAメチル化、ヒストン修飾、ノンコーディングRNAによるエピジェネティックな状態変化と関連している[11]。DNA修復機構におけるCdの干渉も示唆されている[12]。無機Hgは、ヒトのアストロサイト、オリゴデンドロサイト、コルチコ運動ニューロンなどでDNAの損傷を引き起こすことが示唆されており、MS、ALS、アルツハイマー病の発症に関与していることが示唆されている[13]。
特にGd神経毒性については、臨床での使用が増加していることから、関連性が高いと考えられる。
2.2. ガドリニウム神経毒性
ガドリニウム(Gd)系造影剤(GBCA)を用いた磁気共鳴イメージング(MRI)は臨床診断に広く用いられている。ガドリニウムはランタノイド科に属する重金属であり、遊離Gdの存在を避けるためにキレート化した状態でヒトに投与する必要があり、その毒性が軽減されている。
ガドリニウムの神経毒性は試験管内試験で実証されており、実際、Gdに曝露されたラットの皮質ニューロンでは、酸化的傷害を介して小胞体ストレスが発生することが示されている[14]。さらに、Gdは細胞外Ca2+の流入を増加させることで、初代培養ラット皮質アストロサイトにおいてアンフォールドタンパク応答を誘発する [15]。GBCA投与後の脳内Gd沈着は、神田らによって報告されている[16,17]。
Murataらは、脳だけでなく骨や皮膚へのGd沈着も報告している[18]。脳構造物へのGd沈着経路の理解が進んでいる[19]。最初に、関連する沈着性疾患と同様に、一連の副作用と毒性のスペクトルが、腎性全身性線維症として記述された[20]。
これらの知見を踏まえ 2017年に発表された欧州医学庁(EMA)のガイドラインでは、複数の大環状GBCAの臨床使用からの撤退が推奨されている[21,22];
日本では最近、線状GBCAの使用制限が採択された[23]。
大環状GBCAの使用は、小児において歯状核および淡蒼球において信号強度の増加を誘導しているが[24]、少数の患者を除き、MSにおいては結果は確認されていない[25]。最後に、遺伝性腫瘍症候群の患者では、定期的に造影MRIスクリーニングを行った結果、脳内へのGd蓄積が認められている[26]。
これらの結果は、有害金属負荷と神経毒性との関連性を示しており、NDの発症予防に有用な対策を講じるという観点からも、さらなる検討が必要である。
2.3. 大気汚染
大気汚染の構成要素には、有害金属も含まれるが、その他の構成要素としては、粒子状物質(PM)超微粒子PM、ガス、有機化合物などがある。PM、特にディーゼル排気粒子(DE)は、交通関連の大気汚染によって発生する。DEに急性暴露されたマウスは、ミクログリアの活性化、脂質過酸化の増加、脳の様々な部位(海馬や嗅球など)での神経炎症を示している[27]。交通関連の大気汚染への暴露と自閉症スペクトラム障害との間に関連があるかもしれないと示唆されている[28]。
最近の研究では、DE はヒト神経芽腫細胞において神経炎症、酸化ストレス、神経変性関連タウタンパク質の過剰発現とオートファジーによる制御を誘導することが示されている[29]。さらに、動物および細胞培養モデルを用いた研究では、アミロイドβ処理、抗酸化防御、および炎症が、アルツハイマー病の病因に関与している可能性のある汚染された空気中の成分への暴露後に変化することが示されている[30]。環境大気粒子への曝露は海馬のグルココルチコイド受容体の発現を低下させ、グルココルチコイドの分泌を増加させ、気分に関連した行動障害を活性化させる[31]。
そう遠くない将来に直面しなければならないかもしれない別の問題がまだある。マイクロおよびナノサイズの粒子は、吸入中に神経系に到達し、血液脳関門を避け、シナプス神経伝達に影響を与えることができる。人工粒子や遊星粒子に加えて、環境粒子の神経安全性を予測することは困難である。
それは、その組成、大きさ、形状、表面特性、生物や環境における安定性、神経毒性物質の吸収、凝集、粉塵の形成、異なる生体分子との相互作用の能力に依存する[32]。
2.4. 放射線と電磁場
放射線の神経毒性効果も、電磁場の効果と同様に考慮する必要がある。試験管内で照射されたヒト初代アストロサイトは、老化を進行させ、神経炎症および神経毒性を媒介することが知られている[33]。電離放射線に職業的に曝露されている医療従事者は、さまざまながん、特に脳がんを発症するリスクが高くなっているが、これは活性酸素の産生、酸化的DNA損傷、およびインターロイキン-6,IL-1α、マクロファージ炎症性タンパク質-1αのレベルの著しい上昇に関連していると考えられる[34]。
Smartは、放射線照射後の患者における中枢神経系(中枢神経系)機能障害の病因は多因子性であり、年齢、併存疾患、基礎となる悪性腫瘍に典型的な心理的および遺伝的素因、手術および/または薬物治療による付加的な損傷によって影響を受けると説明している[35]。放射線は、処理速度、注意力、学習および記憶、検索、実行機能、および微細運動協調に悪影響を及ぼすことが知られている [35]。放射線治療は、疲労、短期記憶および集中力における認知機能の変化、下垂体機能障害、まれに認知症などの副作用を誘発することがある。放射線治療(RT)は脳の白質を損傷する可能性がある;RT後に最も顕著な線量依存性の変化を示すのは、冠状脳梁、帯状体束、前庭である[36]。原発性中枢神経系リンパ腫を治療するための全脳RTの役割は現在議論されているところである;化学療法に耐えられない患者、または化学療法が失敗して放射線療法を受けた患者に限定されるかもしれない。高周波放射線への曝露は、初代培養ニューロンにおいてミトコンドリアDNAに酸化的損傷を引き起こし、脳における神経毒性を説明している[38]。さらに、極低周波電磁場への曝露は、ミトコンドリアのアポトーシス経路を活性化することで、初代培養海馬ニューロンの神経毒性を誘導する[39]。特に、電磁場は、ヒトリンパ球におけるGdの細胞毒性および遺伝毒性効果を高めることができる[40]。
2.5. 有機リン系農薬
有機リン系農薬(OP)は、ヒトに4つの主要な神経毒性障害を引き起こす。コリン作動性症候群、中間症候群、有機リン誘発性遅発性多発神経障害、慢性有機リン誘発性精神神経障害である。さらに、OPとアルツハイマー病、OPと注意欠陥多動性障害、OPとパーキンソン病との関連が示唆されている[41]。
極めて神経毒性の高いOP化合物であるパラオクソンは、急性胃内投与後のラットにおける濃度依存性ドーパミン放出を増加させる[42]。別のOP化合物であるモノクロトホスは、心嚢水腫、心臓の発育の変化、脊髄や脊椎の異常など、いくつかの発育異常を濃度依存的に誘導することで、ゼブラフィッシュ胚の発育に影響を与える[43]。
2.6. 神経毒
Ciguatoxin と brevetoxin は、主に渦鞭毛藻の gambierdiscus toxicus と Karenia brevis が産生する植物性毒素であり、ヒトではそれぞれ胃腸症候群と感覚障害、例えば麻痺、疼痛、そう痒症、寒冷感覚障害を誘発する。
これらの作用は、感覚系および運動末梢神経系の電圧-ゲートナトリウムチャネルの活性化によるものであり、免疫系にも影響を及ぼす[44]。ボツリヌス神経毒は、以下のような方法で毒性効果を発揮する。
(1)神経特異性、(2)基質分子を1つずつ不活性化できるN末端ドメインの酵素的性質、(3)タンパク質分解基質の本質的な役割、すなわち、末梢神経末端での神経伝達物質放出の基本的な生理学的機能を媒介する可溶性N-エチルマレイミド感受性因子付着タンパク質受容体(SNARE)タンパク質 [45]。運動ニューロン内で逆行性に特異的に輸送される破傷風神経毒とは異なり、ボツリヌス神経毒は治療用の毒素としても広く使用されている[46]。
2.7. 化学療法およびその他の薬物治療
抗がん療法の開発と並行して、化学療法関連の毒性が指摘されている。例えば、白金製剤、各種抗ツブリン剤、免疫調節剤、プロテアソーム阻害剤などの化合物の投与により、末梢神経系の損傷が認められている[47]。オキサリプラチン誘発性末梢神経毒性に対する感受性が様々なマウス系統で指摘されているとしても、その発症リスクの高い被験者の信頼できる予測因子の同定が困難であること、および末梢神経系構成要素に対する薬物誘発性毒性作用の基本的なメカニズムに関する知識がほとんど不完全であることは、非常に重要である[48]。
当初は精神科治療に使用されていたリゼルグ酸ジエチルアミド(LSD)の神経毒性の可能性は、デンマークの患者で指摘されている[49]。
また、抗腫瘍放射線療法の潜在的な神経毒性も忘れてはならない[50]。
麻酔薬も神経毒性に関与しているようである。周術期の神経損傷は、局所麻酔薬による神経毒性に起因している。特定されている可能性のある細胞メカニズムには、内在性カスパーゼ経路、PI3K(phosphoinositide 3 kinase)経路、およびMAPK(mitogen-activated protein kinase)経路が含まれる[51]。新生児マウスモデルにおける揮発性麻酔薬の影響に関する研究では、神経毒性の3つのメカニズムのうちの1つが示唆されている。活性酸素種(ROS)媒介されたストレスとシグナル、成長/栄養シグナル、および直接的なニューロン調節 [52]。
2.8. 病原体
神経感染症の中には、細菌(髄膜炎球菌症)やウイルス(西ナイル感染症、HIV関連認知症)によって引き起こされるものもある[53]。最近では、プリオンを介した神経変性疾患が記載されている;プリオンは、核酸が存在しない状態で生物学的情報をある生物から別の生物に伝達する特異な病原体である[54,55]。特に単純ヘルペスウイルス、エプスタインバーウイルス、サイトメガロウイルスについては、ウイルス感染と神経変性疾患との関連が報告されている[56,57,58]。
さらに、MS患者では、疾患の発症や増悪に関連する病原体の役割として、クラミジア肺炎菌や黄色ブドウ球菌が産生する腸管毒素がスーパーアントゲンとして機能する細菌や、ヘルペスウイルス科のウイルス(エプスタインバーウイルスやヒトヘルペスウイルス6)などが報告されている[59]。
別の研究では、ポーランド北東部のMS患者は、健康な人よりもエプスタインバーウイルスとヒトヘルペスウイルス6の血清陽性の可能性が高いことが示された[60]。最後に、MSの病態におけるウイルスリスク因子と環境リスク因子の相互作用が報告されている[61]。
3. 神経毒性の間接的機序
既知のデータと新興のの両方を報告する。
3.1. サイトカイン/ROSの生産
刺激を受けたグリア細胞または内皮細胞(IL-1,TNF-α、INFγなど)によるプロ炎症性サイトカインの産生は、ニューロン損傷を誘発する可能性がある [62]。著者らは、ピルビン酸エチルまたはアロプリノールを用いてミクログリアの活性化をブロックすると、軸索損傷および脱髄が有意に減少することを見出した。
TNF-αをブロックすることは、脱髄を有意に減少させたが、軸索損傷を防ぐことはできなかった。酸化ストレス、例えば活性酸素の産生は、パーキンソン病の病因におけるドーパミン作動性ニューロンの変性に寄与する中心的なイベントである[63]。
活性酸素生成におけるニコチンアミド・アデニン・ジヌクレオチド・ホスフェート(NADPH)オキシダーゼの役割、およびNDにおいてそれらを標的とする機会が強調されている[64]。
3.2. CD19 T細胞を用いた養子縁組免疫療法
リンパ減少化学療法に続いてCD19を標的としたキメラ抗原受容体修飾T(CAR-T)細胞を注入することは、難治性B細胞悪性腫瘍患者における神経学的な副作用と関連している可能性がある。重度の神経毒性は、INFγを含むサイトカインの放出・産生を促進する内皮活性化(播種性血管内凝固、毛細血管漏出、血液脳関門透過性の増加)と関連している。内皮活性化のバイオマーカーは、神経毒性の発現前の方が高い[65,66]。
神経毒性の直接的および間接的な原因のいくつかは、同時にヒトにダメージを与えることに寄与し得る。例として、活性酸素の産生は、毒性金属の負担によっても誘発される。
4. ヒトの神経毒性を検出するために使用できる方法は?
試験管内試験」細胞培養における神経細胞やグリア細胞への損傷は、様々な潜在的毒性物質を試験することで評価できるが、ヒトにおける神経毒性の検出は困難であり、疫学的データに基づいている。しかし、有毒金属を結合除去できるキレート剤を用いて、ヒトにおける有毒金属の負荷を明らかにする「キレート試験」を採用することができる。
PM、OP、化学療法剤などの有毒化合物には有毒金属が含まれていることが多く、金属以外の化合物による被害を評価する際に有用な方法である。ヒトの有毒金属負担の発生源や症状、多数のヒト疾患におけるキレート剤の投与量や投与経路、キレート剤であるエチレンジアミン四酢酸カルシウム二ナトリウム(EDTA)の使用根拠などについては、すでに広く報告されている[67]。
5. 有害金属検出とEDTAキレーション療法
「EDTAによるキレート試験」は以前に報告されており[67]、以下に簡単に報告する。EDTA(2g)を約500mLの生理食塩水(NaCl 0.9%)で希釈したものを、最初のEDTA静脈内投与の前後に尿サンプルを採取してもらう被験者にゆっくりと(2時間かけて)静脈内投与する。キレート処理後の採尿は12時間続く。尿サンプルは滅菌バイアルに正確に封入され、分析のために毒性学研究所(ドクターズデータ社、セントチャールズ、イリノイ州、米国)に送られる。サンプルは、認証された金属を含まない酸で酸消化され(消化は密閉容器のマイクロ波消化システムで行われる)超純水で希釈され、イオン分子化学と結合した衝突/反応セル法を使用して干渉を低減するための信頼性の高い新しい方法である誘導結合プラズマ質量分析法(ICP-MS)を介して検査される。品質管理とデータバリデーションには、認証を受けたものと自社製の両方の尿標準を使用している。体液の摂取量やサンプル量に起因する大きな誤差を避けるため、結果はクレアチニン1gあたりのマイクログラム(μg)で報告される。最初の「キレーション検査」で毒性金属負担が示された場合、患者は週1回のキレーション療法を開始する。これは、週に1回、2gのEDTAを450mLの生理食塩水で希釈したものをゆっくりと静脈内に注入するものである。治療期間は、ほぼ10回の治療後の有害金属負担の評価を経て決定される。
最も一般的な毒性金属負担は、すでに合計1147人の患者(NDの影響を受けた671人、線維筋痛症などの非NDの影響を受けた138人、健康な対照者338人)で評価されている[10]。これらの患者の毒性金属負担を1年以上にわたって定期的にモニターした。その結果、疾患による被毒患者は健常者よりも多いことが明らかになった。さらに、Asを除いて、ND患者では有害金属の存在量が有意に高くなっていた。この結果は、いくつかの有害金属の慢性的な体内負担とNDとの間に重要な関係があることを強調している。最後に、EDTAキレート療法を繰り返すことで、有害な影響を受けることなくすべての有害金属を除去することができた。
6. 有害金属負担のある患者におけるEDTAキレーション療法の有益な効果
Hgを含む薬物に起因する神経症状は、1人の患者でEDTA治療後に消失した[68]。関節リウマチと重金属中毒に罹患した患者の症状と酸化状態は、EDTA治療後に改善した[69]。標準的な治療に反応しなかったMS患者は、キレート検査でAl、Pb、Hgの負担が高かったため、EDTA治療を受けた。時間の経過とともに、患者は有害金属レベルの低下を示し、症状が改善したため、可能性のある MS の寛解を示した [70]。
NDの病因におけるAlの関与が実証されている;Al中毒は、長期的な治療[72]だけでなく、短期的なEDTA治療[71]によっても有意に減少させることができる。EDTAキレート療法を受けているND患者に投与される抗酸化化合物Cellfoodは、酸化状態とホモシステイン代謝を改善することができる[73]。
ビタミンCを添加しないEDTAキレーション療法は、酸化的DNA損傷および脂質過酸化を減少させることが示されている[74]。既知の疾患と金属曝露との間のもう一つの重要な関連性が最近明らかになった。実際、慢性的な毒性金属暴露は心血管疾患(心血管疾患)と関連しており、これらの疾患の治療におけるキレーション療法の役割を示している[75]。
心血管疾患を治療するためのキレーション治療は長年にわたって行われてきたが、慢性的な有害金属曝露と心血管疾患の罹患率および死亡率との関連性を示す疫学的証拠が最近になって明らかになった。特に、EDTAを用いたキレーション療法は、糖尿病に関連した心血管イベントの予防に役立つ可能性がある[76]。
7. 神経毒性に対するEDTAキレーション療法の有効性を支える主なメカニズム
7.1. 有害金属のキレート化
すでに上述したように、有毒金属は神経毒性のより頻繁な原因の一つであることが知られている。それらは空気中、食品中、薬物中に存在し、吸入、摂取、または経皮吸収の後、中枢神経系を含む重要な人間の臓器に到達し、損傷を与える可能性がある[67]。EDTAは有害金属と結合し、試験管内試験でPb++、Cd++、およびHg++と安定した錯体を生成することができる[68]。複合体は尿を介して生体内で除去され、EDTAチャレンジ試験後の有害金属尿レベルの評価で示されている。
7.2. 抗酸化活性
有害金属は細胞の酸化的損傷にも関与しており、活性酸素の産生を促進している[77]。EDTAはそれ自体が抗酸化剤であり、Cellfoodで治療したND患者の血液サンプルでは、活性酸素の減少と総抗酸化能の増加を引き起こす[73]。キレーション療法を10回行うと、血漿過酸化物レベルとDNA損傷が有意に減少することがすでに示されている[74]。
7.3. 内皮保護
虚血後の再灌流により誘発される急性腎不全モデルラットを用いて,EDTA投与の効果を検討した。EDTA投与は虚血誘発の30分前に行った。機能および組織学的パラメータはEDTA処理により保存された。実際、血清クレアチニン値は有意に上昇せず、一酸化窒素(NO)レベルおよび内皮NO合成酵素腎発現は改善し、接着分子Mac1発現は減少し、TNF-α誘発血管漏出は予防された[78]。TNF-αによって誘導されたヒト臍帯静脈内皮細胞(HUVEC)活性化の調節におけるEDTAの試験管内試験効果についても検討した。TNF-αによって生成されたF-アクチンストレス線維は、正常なチューブリン分布によって強調されるように減少し、十分に広がった静穏な内皮表現型を維持していた [79]。EDTA内皮活性化の回避に関して得られた結果は、心血管疾患に罹患した患者における生体内でのEDTAの有益な効果と一致している[76,80,81]。
7.4. 潜在的な抗菌薬
EDTAは、牛乳房炎の原因とされるストレプトコッカス菌分離株に対して有効な抗菌薬である可能性があることが示されている[82]。EDTA四ナトリウムは、創傷治療に使用するための抗菌剤および抗菌フィルム剤として提案されている。実際、低濃度のt-EDTA(4%)溶液は、24時間の接触時間後に試験管内試験バイオフィルム内の黄色ブドウ球菌、メチシリン耐性黄色ブドウ球菌、黄色ブドウ球菌エピダーミディス、緑膿菌、およびEnterococcus faecalisを死滅させることができた[83]。
提案されているEDTAの作用機序を図1に示し、NDおよび心血管疾患におけるEDTAキレーション療法の有効性を説明している。
図1 神経毒性に対するエチレンジアミン四酢酸(EDTA)
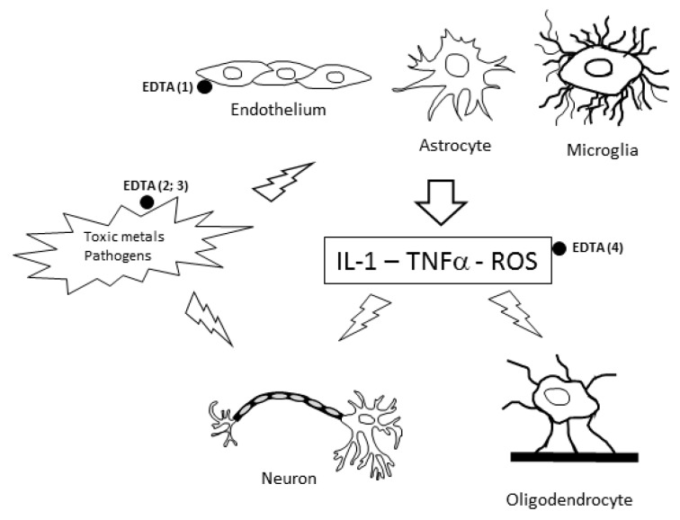
キレーション療法の有効性の根底にあるメカニズムが提案されている。有害物質(有害金属、有機リン系殺虫剤(OP)病原体、大気汚染、一部の薬物)は、神経細胞および/またはグリア細胞および内皮細胞を直接損傷する可能性がある(-)。活性化したグリア細胞や内皮細胞は活性酸素種(ROS)やプロ炎症性サイトカイン(IL-1,TNF-α)を産生し、神経細胞をさらに損傷させる。EDTA(●)による治療には、以下のような効果がある。(1)内皮活性化に対する保護、(2)有害金属の除去、(3)考えられる抗炎症機能(病原体の感染およびサイトカイン産生の制限)(4)抗酸化活性(活性酸素レベルの低下)である。
ここでは、有害金属のキレート化におけるEDTAの有用性を確認するために有用ないくつかの特別なケーススタディを報告する。これらは他の報告されている症例研究[67,68,69,70,71,72,73]と同様の手順で行われた新しい症例である。
8. 症例研究
ペルーのリマ近郊の農村部に住む65歳の女性が、原因不明の様々な臨床症状でペルーとイタリアで受診した。2018年2月に当院の外来医療センターに来院した。アナムネティックデータと症状は以下の通りであった。食欲不振、その後食欲不振と重要な体重減少(約22kg)吐き気、嘔吐、便秘、腹痛、頭痛、物忘れ、高血圧、倦怠感、知覚過敏。患者は不安定で、完全な体力の欠如を明らかにした。
彼女は長年にわたり有機リン系殺虫剤MONOFOSに曝露されており、同じ地域で働いていた若い男性の不可解な死の原因となっていた可能性がある。この患者は直ちにキレーション試験を受け、MONOFOSに含まれるカドミウム、鉛、水銀(図2)による中毒症状が確認された。
キレーション治療を行った。症状は3回の投与で改善したが、10回の投与で症状が改善した。しかし、10回のキレーション治療を行った後も有害金属濃度は高値を維持しており、慢性中毒の存在を示唆していたため、キレーション治療は継続された。キレーション療法を20回行った後、キレーション検査後の尿中のHg濃度は4 µg/g/クレアチニン未満であり、患者は現在回復している。症状は治まり、体重も回復している。
図2
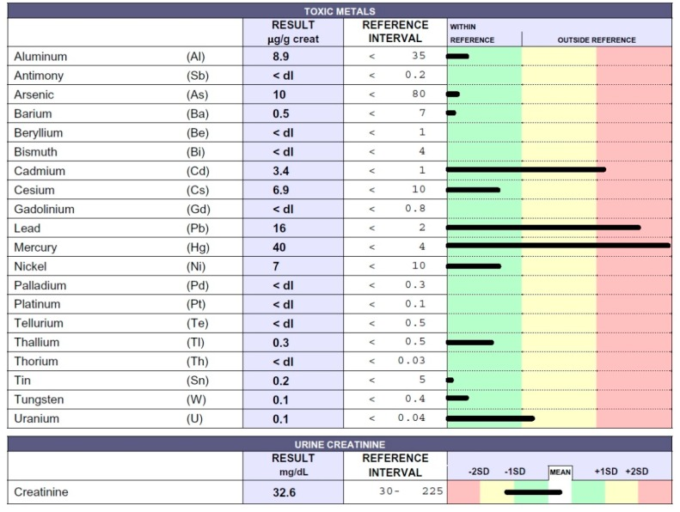
EDTA「チャレンジ」(キレーション試験)後12時間の間に採取した患者の尿中の毒性金属濃度を誘導結合プラズマ質量分析法(ICP-MS)で測定し、クレアチニン1gあたりマイクログラム(μg)で報告した。65歳女性患者はOP中毒の影響を受けていた。
9. Gd神経毒性を示唆する2つの症例
9.1. ケース1
34 歳の男性が 13 年前に多発性硬化症(MS)と診断された。当初はステロイド静注療法を行い、その後以下の薬物療法を行った。インターフェロンβ1a(2年)酢酸グラチマー(1年)ナタリズマブ(3年)フィンゴリモド(2年)オクレリズマブ(1)。この患者はまた、2回に分けて幹細胞注入を受けた。同期間に患者は10回のMRI検査を受け、造影剤としてGdを使用した。MRIでは多数の過緊張面が認められた(データは示されていない)。最近、患者は自発的に治療を中断し、EDTAキレート試験を受けることにした。患者は歩行が困難なため、入浴用の椅子に座って来院し、会話も困難であった。尿サンプル中の有害金属レベルに関する結果は、図3に示すとおりである。
図3 尿サンプルの有害金属濃度の結果
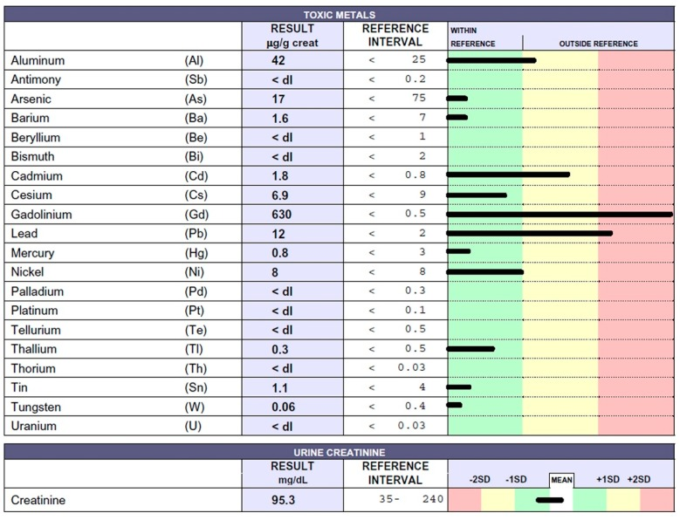
図3 EDTAキレート試験後12時間の間に採取した患者の尿中の有害金属濃度をICP-MS法で測定し、クレアチニン1gあたりマイクログラム(μg)で報告した。34歳の男性は多発性硬化症(MS)を患っていた。
注目すべきことに、Gdの値は、人間にとって許容できないと考えられるレベルであることが判明した。
有毒金属のAl、Cd、Pbも低値であった。この患者はどのようにしてそんなに多くのGdを蓄積したのであろうか?彼はそれを除去することができなかったのであろうか?
一部の被験者は、グルタチオンや活性酸素の除去を助ける酵素の低レベルのために自分自身を解毒することができないことを明らかにしている。患者の脳内に蓄積したGdが症状の悪化の原因だったのか?
Gd投与に伴う免疫抑制剤治療が、若い患者の症状を急速に悪化させた原因だったのだろうか?
この重要な結果は、亜急性Gd毒性の臨床的判断材料としてMRIを受ける患者の腎機能のみならず、腎機能の評価を示唆していると考えられる。
9.2. 症例2
ある女性は39歳のときにMSと診断された。ステロイド静注療法とインターフェロンβ1a療法を1年間行った。患者は不耐症のために免疫抑制剤治療を中断することにした。キレート検査を受けたところ,図4に示すように,Gd,Cd,Pbの中毒が認められた。図4に示すように、キレート検査ではGd、Cd、Pbの中毒が認められ、著しい疲労感、手の運動機能障害、足の感覚低下が認められた。
図4
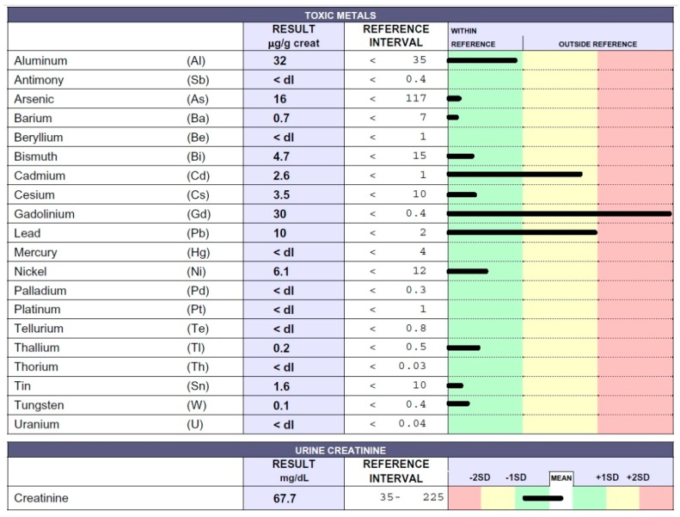
EDTAキレート試験後12時間の間に採取した患者の尿中の有害金属濃度をICP-MS法で測定し、クレアチニン1gあたりマイクログラム(μg)で報告した。39歳の女性はMSの影響を受けていた。
患者は以前に2回のMRI検査でGdの診断を受けたことがあったが、この有害金属が最も多く検出された。患者はキレーション療法を受けることにしたが、その有益な効果はMSの症状が消失したことから明らかでした。キレーション療法は当初、週1回のペースで行われていたが、12ヶ月後に月2回のペースに変更された。しかし、EDTAキレート療法の1年後の尿サンプル中の有害金属レベルを強調した図5に示すように、Gdレベルは非常にゆっくりと減少した。
図5
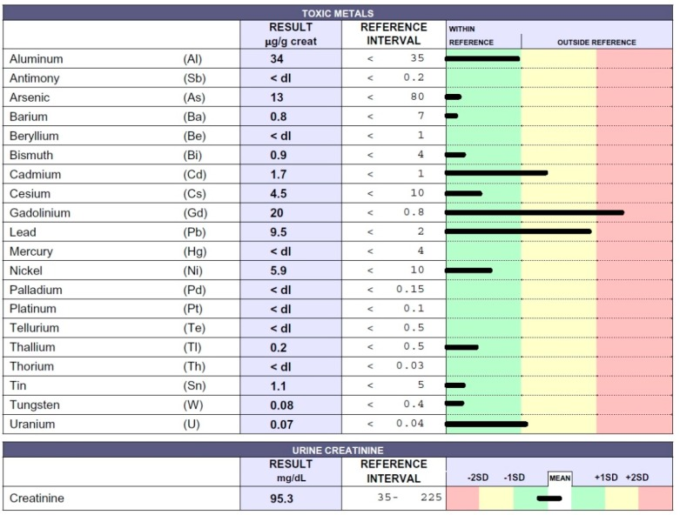
EDTAキレート試験後12時間以内に採取した患者の尿中の有害金属濃度をICP-MS法で測定し、クレアチニン1gあたりマイクログラム(μg)で報告した。この患者は1年間EDTAキレート療法を受けており、MSの影響を受けていた。
ガドリニウムレベルは、図6に示すように、キレーション治療をさらに2年間続けた後にのみ低下した。
図6
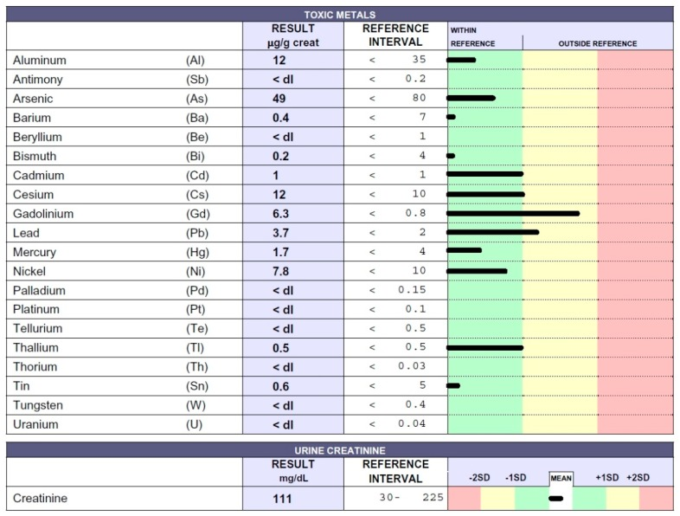
EDTAキレート試験後12時間の間に採取した患者の尿中の有害金属濃度をICP-MS法で測定し、クレアチニン1gあたりマイクログラム(μg)で報告した。この患者は3年間EDTAキレート療法を受けており、MSに罹患していた。
治療期間中、MSの症状は徐々に消失し、患者さんの全身状態は良好であった(キレーション治療開始前のEDSS=4,3年後のEDSS=0)。グルコースを避けた正しい食生活を守り、グルタチオンを毎日(250mg、Oximix 7+ Driatec、イタリア)抗酸化物質であるデットロスルファザイムを1日3回15滴(Cellfood、Eurodream、La Spezia、イタリア)摂取していた。現在は快方に向かい、年2回のキレーション治療を受けている。
10. 結論
多くの有害物質や一部の病原体が神経毒性に特異的に関与している。人間の中毒は、正しい生活習慣、タバコなどの有害物質との接触を避け、汚染された食品の摂取を避けることで防ぐことができる。
健康的な食事と運動が推奨される。特筆すべきは、我々の患者は全員禁煙したことである。しかし、慢性金属中毒の影響を受けてNDおよび/または心血管疾患を発症した患者では、EDTAを用いたキレーション療法の使用は症状を改善するための優れた選択肢である[84]。
金属中毒とNDの関係は、先行研究と本論文で新たに報告された症例によって強調されている。EDTA治療は、患者の完全な無害化まで何年にもわたって副作用なく週1回の治療を行うことができる。NDの影響を受けた患者の症状を改善するためのEDTA治療の有用性は、私たちの意見では、科学者の間でより多くの注目を集めるに値すると考えている。
略語
アルツハイマー病アルツハイマー病
アルミニウム
ALS 筋萎縮性側索硬化症
ヒ素として
バリウム
ベリリウムであること
ビスマス
カドミウム
中枢神経系 中枢神経系
Cs セシウム
心血管疾患 心血管疾患
DE ディーゼル排気粒子
EDTA エチレンジアミン四酢酸二ナトリウムカルシウム
Gdガドリニウム
Hg 水銀
HUVEC ヒト臍帯静脈内皮細胞
ICP-MS 誘導結合プラズマ質量分析法
IL-1 インターロイキン-1
INF γインターフェロンγ
MAPK ミトゲン活性化プロテインキナーゼ
MS 多発性硬化症
NADPH ニコチンアミド・アデニン・ジヌクレオチド
ND 神経変性疾患
ニッケル
NO 一酸化窒素
OP 有機リン系農薬
鉛鉛
パラジウム
PDパーキンソン病
PI3K ホスホイノシチド3キナーゼ
PM 粒子状物質
白金
RT 放射線治療
活性酸素
Sbアンチモン
スズ
SNARE 可溶性N-エチルマレイミド感受性因子付着タンパク質受容体
テ・テルル
トリウム
チタン
Tl T ハリウム
TNF α 腫瘍壊死因子α
ウラン
W タングステン
