Contents
- Early-versus Late-Onset Alzheimer Disease: Long-Term Functional Outcomes, Nursing Home Placement, and Risk Factors for Rate of Progression
- 要旨
- 背景
- 方法
- 結果
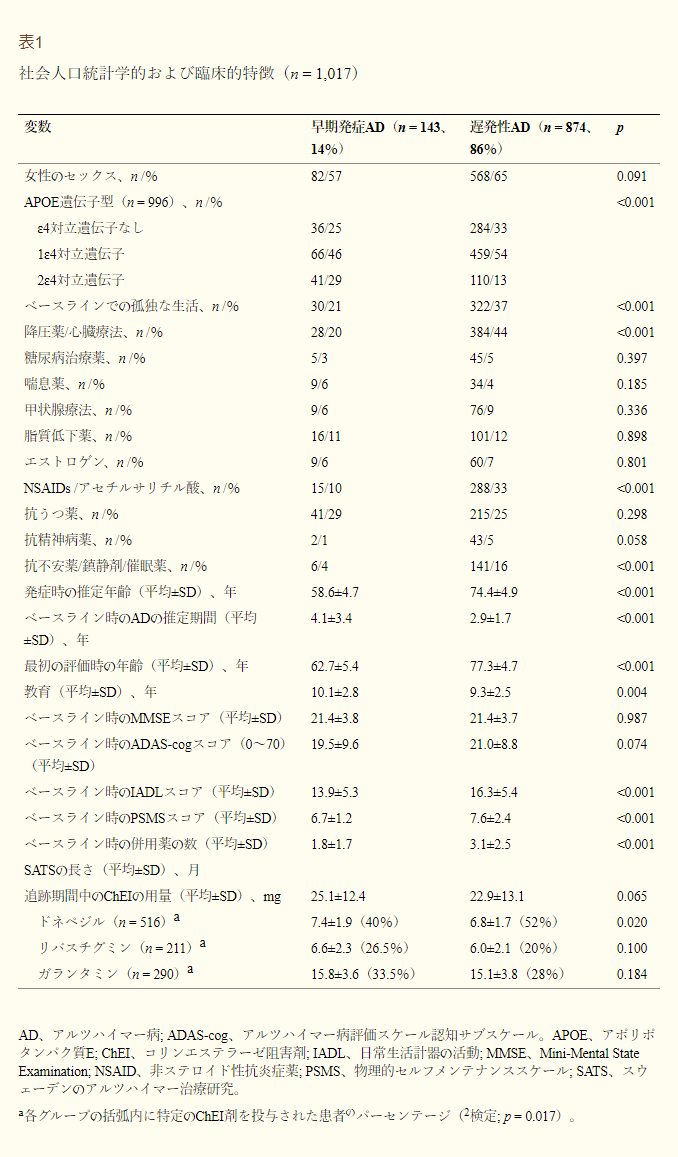
- 表1 SATS参加者の社会・人口統計学的および臨床的特徴(n = 1017
- 若年性アルツハイマー病と高齢発症型アルツハイマー病の縦断的転帰の比較
- 図1 発症群別のIADLおよび基本的IADL課題の遂行に援助を必要としたSATS患者の割合
- それぞれの発症年齢群における疾患進行の予測因子
- 表2 コリンエステラーゼ阻害薬の投与量と3年間の治療期間中の認知機能およびグローバルパフォーマンスの変化:発症年齢群別
- 表3 ミニ精神状態検査のスコアを従属変数とした長期転帰に影響を及ぼす因子、発症時年齢群別
- 若年性アルツハイマー病対高齢発症型アルツハイマー病のエンドポイント
- 図2 コリンエステラーゼ阻害薬(ChEI)治療の3年間のグローバル転帰
- 表4 アルツハイマー病評価尺度-認知サブスケールを従属変数とした長期転帰に影響を及ぼす因子、発症年齢群別
- 議論
- 結論
Early-versus Late-Onset Alzheimer Disease: Long-Term Functional Outcomes, Nursing Home Placement, and Risk Factors for Rate of Progression
要旨
背景
発症時の年齢がアルツハイマー病の進行やコリンエステラーゼ阻害剤(ChEI)治療の有効性に影響を与えるかどうかは明らかではない。本研究では、若年性アルツハイマー病(若年性アルツハイマー病)と後期発症アルツハイマー病(高齢発症型アルツハイマー病)を対象とした臨床試験において、ChEI療法を受けた患者の認知機能と全体的な転帰を比較することを目的とした。
方法
この3年間のプロスペクティブ、観察的、多施設共同研究には、軽度から中等度のアルツハイマー病患者1017人が含まれている。ベースラインと半年ごとに、患者は認知、グローバル、日常生活活動(IADL)スケールを用いて評価され、ChEIの投与量が記録された。認知機能低下の潜在的な予測因子を混合効果モデルを用いて分析した。
結果
ChEI療法の6ヵ月間の効果と認知機能および全人的パフォーマンスの長期予後は、発症年齢群間で類似していた。しかし,3年間のアルツハイマー病評価尺度(ADAS-Cog)を用いた場合、若年性アルツハイマー病の方が高齢発症型アルツハイマー病の方よりも悪化が有意に早かった;したがって、ADAS-Cogの平均値の予測モデルを示した。若いコホートでは高齢者に比べてホモ接合体アポリポ蛋白E(APOE)ε4対立遺伝子キャリアの割合が高かった;しかしながら、APOE遺伝子型は多変量モデルでは認知機能障害の有意な予測因子ではなかった。認知機能の進行速度の遅さは、両群ともアルツハイマー病の早期段階でのChEIの開始、ChEI用量の増加、教育年数の減少と関連していた。高齢発症型アルツハイマー病では、男性の性、より優れた器楽的IADL能力、抗精神病薬の使用なしは、追加の保護特性であった。高齢者は研究期間のほとんどの間、若年者よりも低いChEI用量を受けていた。
結論
若年性アルツハイマー病の参加者は、高齢発症型のアルツハイマー病参加者よりもADAS-Cogの低下が速く、診断前のアルツハイマー病の期間が長く,2つのAPOE ε4対立遺伝子の頻度が高かったが、ChEI治療に対する認知的および全体的な反応と3年後の経時的転帰は、発症時年齢のグループ間で類似していた。ChEIの平均投与量の増加と治療開始時の認知状態の改善は両群とも独立した保護因子であり、すべてのアルツハイマー病患者に対する適切な投与量での早期治療の重要性が強調された。
キーワード 認知、コリンエステラーゼ阻害薬、若年性アルツハイマー病、後期発症アルツハイマー病、予測因子、縦断的研究、混合効果モデル
背景
65歳以前にアルツハイマー病の臨床発症がある人は、若年性アルツハイマー病(若年性アルツハイマー病)と診断される。若年性アルツハイマー病患者の有病率は低いが、研究では6%から16%とばらつきがある[1-3]。若年性アルツハイマー病は遅発性アルツハイマー病(高齢発症型アルツハイマー病)とは別の、より重篤な病態である可能性が示唆されている。
神経病理学的研究では、若年のアルツハイマー病患者は高齢者に比べて神経斑や神経原線維絡みの負担が高く、シナプスの喪失が大きいことが報告されている[4]。
さらに、80歳前に死亡したアルツハイマー病患者は、高齢で死亡した患者と比較して、他の神経伝達物質(ノルアドレナリンなど)の異常を伴うコリン作動性欠損がより広範囲で重度のものであった[5]。
認知に関しては、若年性アルツハイマー病患者では言語と集中力の障害がみられたのに対し、高齢発症型アルツハイマー病コホートでは記憶と方向感覚の障害がみられた[6]。アルツハイマー病の臨床診断は、非定型的な症状や無痛性でない症状のため、早期発症者では見落とされることが多い [7]。
若年者は高齢者に比べて教育を受けていることが多く、認知予備能が高いことも診断の遅れにつながる可能性がある[8]。
そのため、抗認知症治療は疾患の後期に開始される可能性があり、若年性アルツハイマー病における治療効果が損なわれる可能性がある。
現在、軽度から中等度のアルツハイマー病に対する主な治療法はコリンエステラーゼ阻害薬(ChEI)である。プラセボと比較して肯定的な認知効果と全世界的な症状の効果は、主に6ヶ月間の無作為化臨床試験で報告されている[9]。これらの試験はすべて、長期的な延長試験[10, 11]とアルツハイマー病におけるChEI治療の観察研究[12, 13]と同様に、発症時の年齢に関係なく参加者が登録されている。
しかし、短期的な治療反応のレベルと長期的転帰は、アルツハイマー病発症時の年齢によって異なる可能性がある。
軽度から中等度のスウェーデンアルツハイマー治療研究(SATS)コホート全体を調査することにより、我々のグループは、ChEIに対する認知反応と3年後の予後の両方が、若年者よりも高齢のアルツハイマー病患者の方が良好であることを発見した。
さらに、男性性、アポリポ蛋白E(APOE)ε4対立遺伝子の欠如、非ステロイド性抗炎症薬(NSAIDs)/アセチルサリチル酸の使用、および薬剤の種類にかかわらず、ChEIの高用量投与は、認知機能の低下の遅さに関連する独立した予測因子であることを示した[13]。
年齢と認知パフォーマンスの間の前述の関連は、別の研究では観察されなかった[14]。逆に、ドネペジルを3ヵ月間投与した研究では、66歳未満の参加者は高齢者よりも大きな改善を示した[15]。これまでに、若年性アルツハイマー病のみのコホートにおける認知的軌跡に影響を与える可能性のある社会統計学的、臨床的特徴、またはChEI療法の側面(例えば、薬剤や用量)を報告した長期の研究はなかった。
若年のアルツハイマー病患者の認知機能の進行速度が早いことがいくつかの研究で示されている[16, 17]が、他の研究では年齢群間で同様の低下が示されている[18, 19]が、高齢の参加者ではより急速な障害が示されている[20]。これらの混合した相反する観察結果は、サンプルサイズや追跡期間の違い、さらにはAPOE遺伝子型、教育レベル、日常生活動作(IADL)能力、および若年性アルツハイマー病対高齢発症型アルツハイマー病に関するほとんどの先行研究では考慮されていなかった併存疾患などの交絡因子に依存する可能性がある[21]。SATSには、先行研究では同時に評価されていない複数の変数(例えば、上述の共変量)が含まれている。SATSコホートを発症年齢に応じてサブセットに分け、高度な多変量統計的アプローチ(混合効果モデル)でこれらのグループを個別に分析することで、アルツハイマー病の経過と若年者と高齢者のアルツハイマー病の潜在的な予測特性のより良い理解が期待できるかもしれない。
本研究の目的は、(1)臨床現場における若年性アルツハイマー病と高齢発症型アルツハイマー病のChEI治療を受けた患者間の認知的およびグローバルな経時的転帰を記述し、比較すること、(2)それぞれのグループの認知能力に影響を与える可能性のある社会・人口統計学的および臨床的要因(例えば、性別、APOE遺伝子型、教育年数、併用薬)とChEI治療の側面(薬剤、用量)を特定することであった。
認知能力に影響を与える可能性があると考えられるChEI治療の側面(薬剤、用量)を明らかにした。
方法
研究と参加者
SATSは、臨床におけるChEI療法(ドネペジル、リバスチグミン、ガランタミン)の長期有効性を調査するために開始された3年間の前向き、非盲検、無作為化、多施設共同試験である。SATSからの異なる知見は、いくつかの出版物で発表されている(例えば、[12, 13, 22-24])。スウェーデン全土の異なる地理的地域にある14の記憶クリニックから、合計で1258人のアルツハイマー病患者が募集された。ベースラインのMini Mental State Examination(MMSE)[25]スコアが10~26の範囲で、アルツハイマー病発症時の年齢(4人の参加者はデータが欠損していた)を示す1021人の患者全員が本研究に含まれた。このうち,143人が若年性アルツハイマー病(アルツハイマー病発症年齢<65歳),874人が高齢発症型アルツハイマー病(アルツハイマー病発症年齢≧65歳)と定義された;したがって,1017人が登録された。
SATSの対象としたのは、精神障害の診断・統計マニュアル第4版[26]に定義されている認知症の臨床診断基準を満たした40歳以上の外来患者であり、国立神経・コミュニケーション障害・脳卒中研究所およびアルツハイマー病関連障害協会[27]の基準では、アルツハイマー病の可能性があるか、またはその可能性が高いとされていた。すべての患者は、認知症疾患を専門とする医師によって診断された。認知症の専門家は、介護者(通常は配偶者や成人の子供)とのインタビューに基づいて、アルツハイマー病の初期症状の観察に基づいて発症年齢を推定した。さらに、対象者はアルツハイマー病診断時に自宅で生活しており、責任ある介護者がおり、ChEI治療開始時(ベースライン)にMMSEで評価可能であることが条件とされた。除外基準は、アルツハイマー病の診断基準を満たしていないこと、すでに積極的なChEI療法を受けていること、またはChEIの禁忌薬を持っていることであった。
研究への組み入れとベースラインの評価の後、参加者はスウェーデンの通常の医療制度の一部として、承認された製品表示に従ってChEI治療を処方された。すべての患者は、通常の臨床診療と同様にドネペジル5mg、リバスチグミン3mg、またはガランタミン8mgの投与を開始した。SATSは観察研究であり、薬剤の種類の選択や投与量の決定はすべて認知症専門医の裁量と専門的判断に委ねられている。ほとんどの人は4-8週間の治療後に増量を受け、選択したChEI薬に応じてさらに増量することを目指した。しかし、一部の参加者では副作用のために投与量を減らした。ChEIの投与量は、治療開始2ヶ月後に記録し、その後はベースライン後6ヶ月ごとに記録した。ChEI以外の薬物はベースライン時に記録され、メマンチンを除いて研究中に許可された。患者がChEIの服用を中止した場合、またはメマンチンが開始された場合は、その時点でSATSを中止した。SATSを中止した日付とその理由が記録された。
アウトカム指標
SATS患者は、研究者がChEI治療開始時,2ヶ月後(MMSEとグローバル評価のみ)と3年以上にわたって半年ごとに認知、グローバルおよびIADLのパフォーマンスを評価したよく構造化されたフォローアッププログラムで調査された。認知状態はMMSEを用いて評価され、スコアは0~30(より低い方が認知障害が大きいことを示すアルツハイマー病評価尺度-認知サブスケール(ADAS-Cog)[28]を用いて評価された。ChEI療法開始からの変化」のグローバル評価として、Clinician Interview-Based Impression of Change(CIBIC) [29] を用いた。評価は,1(非常に改善した)から7(著しく悪化した)までの7点満点の尺度を用いて、すべての間隔で行われた。1-3は改善,4は変化なし,5-7は悪化とした。個々の評価を定義するためのガイドラインや記述子は提供されなかった。最小限改善したか非常に改善したかの分類は、認知症専門医の臨床的判断に委ねられている。
IADL (Instrumental Activities of Daily Living)尺度 [30] は、電話の使用能力、買い物、食事の準備、家事、洗濯、移動手段、自分の薬に対する責任、金銭管理能力の8つの項目で構成されている。各項目は1(障害なし)から3~5(重度障害)までの点数で評価され、合計8~31点の範囲で評価された。身体的自己維持尺度 [30] は、トイレ、摂食、着替え、グルーミング、身体的な歩行、および入浴の6つの異なる項目で構成されている。各項目は1(障害なし)から5(重度の障害)までの点数をつけ、合計6~30点の範囲で評価した。訓練を受けた認知症看護師が、介護者との面接に基づいてIADLのパフォーマンスを評価した。MMSEとADAS-Cogスコアの比較を容易にするために、スコアの変化を改善を示す正の値に、悪化を示す負の値に換算した。
統計的分析
統計分析の実施には、IBM SPSS Statistics for Windows version 22.0 ソフトウェア(IBM Corporation, Armonk, NY, USA)を使用した。有意水準は、特に指定がなければp < 0.05と定義され、すべての検定は両側遮蔽であった。観察症例分析は、進行性の病状が悪化している疾患の縦断的研究において、より高い以前のアウトカムスコアを入力することにより、治療効果の過大評価を避けるために使用された。サンプルサイズが大きく、連続的な潜在的予測因子がほぼ正規分布しているため、パラメトリック検定が使用された。独立標本のt検定は、若年性アルツハイマー病と高齢発症型アルツハイマー病のような2つのグループについて得られた平均の差を比較するために使用され、χ2検定はカテゴリー変数を分析するために使用された。
参加者を階層変数として用いた(すなわち、個人内相関を可能にするために)混合、線形および非線形の固定およびランダム係数回帰モデルが実行された。混合効果モデル法は、長期研究で見られる一般的な統計的限界である、各患者に利用可能な評価の数の変化とフォローアップ訪問間の不均等な時間間隔も考慮に入れている [31]。非参加者は参加期間中に情報を提供した;したがって、我々はすべてのSATS患者の軌跡を考慮した。
従属変数は、各個人の2回目以降の来院時の認知スコアである;つまり、混合効果モデルはChEI療法開始時のスコアを予測することを意図していない。以下の記述された独立変数がモデルに含まれている。最初に、各参加者の初期認知スコア(ベースラインの差を調整するためおよびそれらの研究期間中の線形項および二次項との相互作用(モデルの非線形変化率を可能にするため)が固定効果として含まれた;すなわち、月単位の時間(および月単位の時間2)×MMSE(またはADAS-Cog)ベースラインスコアである。時間は、ChEI治療開始から各訪問までの正確な月数として定義され、したがって、実際の時間間隔ですべてのデータポイントを使用した。第二に、いくつかの可能性のある社会・人口統計学的および臨床的予測因子がモデルに固定効果として含まれた、例えば性;ChEI治療開始時の年齢;臨床家によるアルツハイマー病の推定期間;教育年数;APOE ε4対立遺伝子の存在(なし/あり);一人暮らし(なし/あり);IADLおよび基本的IADL能力。ベースライン時の薬物の数;および降圧/心臓療法、抗糖尿病薬、喘息薬、甲状腺療法、脂質低下剤、エストロゲン、NSAIDs/アセチルサリチル酸、抗うつ薬、抗精神病薬、抗精神病薬および抗不安薬/鎮静剤/催眠薬を含む特定の併用薬(各群ともになし/あり)。第三に、異なるChEI剤の効果を、薬剤の種類(ダミー変数の集合としてコード化されている)と投与量を用いて分析した。ChEI剤×投与量」および「年齢×ChEI投与量」という用語もモデルに含まれていた。ChEIの投与量は、個々の患者の治療期間中および患者間で変動する可能性がある;したがって、フォローアップ期間全体で使用された平均投与量を各参加者について計算した。脱落した場合には、SATSに参加していた期間の平均線量を算出した。3つのChEIそれぞれの最大投与量のパーセンテージについても同様の指標を得るために、平均投与量を各薬剤の最大推奨投与量(ドネペジル10mg、リバスチグミン(経口投与)12mg、ガランタミン24mg)で割って算出した。最後に、ベースライン時または研究期間中の認知重症度との潜在的な相互作用(性、年齢または学歴)をモデルに含めた。ランダム項は切片と月単位の時間で、分散成分共分散行列を用いた。重要でない変数(p > 0.05)は、後方ステップワイズ的に除去した。階層原理が混合効果モデルに適用された;有意な相互作用に現れる変数は、除去のために考慮されなかった。
若年性アルツハイマー病および高齢発症型アルツハイマー病患者の試験期間中のNHPを予測するために、後方尤度比法を用いた二元ロジスティック回帰分析を行った。Hosmer-Lemeshowの適合度検定の結果はp > 0.05であり、データに対するモデルの適合性が良好であることを示した。前述の潜在的な特性を、アルツハイマー病AS-cog、IADL、PSMSの1ヵ月あたりの平均悪化率とともに独立変数として使用した。
結果
アルツハイマー病発症年齢に応じた社会・人口統計学的特徴と臨床的特徴
SATS参加者1,017人をアルツハイマー病発症年齢により2つのグループに分けた。若年性アルツハイマー病(65歳未満:n=143、14%)と高齢発症型アルツハイマー病(65歳以上:n=874、86%)である。両群の社会統計学的および臨床的特徴を表1.1に示した。ChEI治療開始時(ベースライン)では、若年者では一人暮らしの割合が少なかった(χ2(1)=13.66;p<0.001)。さらに、抗高血圧薬/心臓療法(χ2(1)=30.25;p<0.001)、非ステロイド性抗炎症薬/アセチルサリチル酸(χ2(1)=29.64;p<0.001)、抗不安薬/鎮静剤/催眠剤(χ2(1)=14.16;p<0.001)の割合が若年性アルツハイマー病コホート対高齢発症型アルツハイマー病コホートでは低かった。若い患者はまた、高齢者よりも平均アルツハイマー病期間が長く(t1,015 = 4.36; p < 0.001)、教育年数が多かった(t1,015 = 2.93; p = 0.004)。ベースラインでは、若年性アルツハイマー病患者は、IADLスコア(t993 = -4.92; p < 0.001)とPSMSスコア(t994 = -7.14; p < 0.001)によると機能障害が少なく、高齢発症型アルツハイマー病群と比較して併用薬の服用量が少なかった(t1,015 = -8.20; p < 0.001)。
表1 SATS参加者の社会・人口統計学的および臨床的特徴(n = 1017
若年性アルツハイマー病と高齢発症型アルツハイマー病の縦断的転帰の比較
IADLスコアについては、若年性アルツハイマー病患者の51%、高齢発症型アルツハイマー病患者の48%が、ChEI投与6ヵ月後に改善/変化なし(0点以下の変化)であった(χ2(1)=0.26、p=0.611)。6ヵ月後のPSMSスコアの改善/変化なしは、SATSでは若年者79%、高齢者73%で観察された(χ2(1)=1.52; p=0.217)。
一貫して、IADL尺度またはPSMS尺度を用いた場合、発症群間の経時的な疾患進行に有意差は認められなかった。ChEI療法3年後、ベースラインからの平均低下(95%信頼区間[CI])は若年性アルツハイマー病コホートと高齢発症型アルツハイマー病コホートの間で差がなかった。IADLスコア、6.0点(4.6-7.4)対6.6点(6.0-7.2)(t353=0.83;p=0.406)、PSMSスコア、2.6点(1.8-3.5)対2.9点(2.5-3.3)(t354=0.53;p=0.598)。若年性アルツハイマー病と高齢発症型アルツハイマー病を有する患者をさらにAPOE遺伝子型に分けた。これらのグループ間では、ChEI治療3年後のIADLまたは基本IADL能力の変化に有意差は認められなかった。
IADL能力はChEI治療開始時にすでに著しく障害されており、若年性アルツハイマー病患者の40~65%、高齢発症型アルツハイマー病患者の55~75%がこれらの活動を行うために介助に依存していた(IADLスコア、2~5)。個々のIADL項目に障害がある参加者の割合は、若年性アルツハイマー病コホートではベースライン時に有意に低かったが、「財政処理能力」を除いては発症群間で差がなかった。3年後には、IADLのパフォーマンスはさらに低下し、両群に残った患者の70-90%がこれらのタスクを自立して実行することができなくなっていた。若年者では、”電話の使用能力”、”買い物”、”食事の準備”、”家事 “の低下が早かった。しかし、高齢発症型アルツハイマー病の参加者は、”洗濯”、”移動手段”、”自己服薬の責任 “では、依然として有意に悪化していた(図1a1a)。

図1 発症群別のIADLおよび基本的IADL課題の遂行に援助を必要としたSATS患者の割合
a ChEI療法開始時(ベースライン、括弧内はIADLスコア2~5)および3年後にIADL課題の遂行に援助を必要とした若年性アルツハイマー病および高齢発症型アルツハイマー病患者の割合(※ 0.01≦p<0.05)。 01 ≤ p < 0.05, ** 0.001 ≤ p < 0.01, *** p < 0.001)。 b 発症群に応じて、ベースライン(括弧内)および3年後に基本的なIADL課題(PSMSスコア、2-5)を遂行するために援助を必要とした患者の割合(* 0.01 ≤ p < 0.05, ** 0.001 ≤ p < 0.01, *** p < 0.001)。
IADL, activities of daily living; ChEI, cholinesterase inhibitor; 若年性アルツハイマー病, early-onset Alzheimer disease; IADL, Instrumental Activities of Daily Living scale; 高齢発症型アルツハイマー病, late-onset Alzheimer disease; PSMS, Physical Self-Maintenance Scale; SATS, Swedish Alzheimer Treatment Study.
基本的なIADLに関しては、身体的な歩行を除いて、ベースライン時には大多数の患者が自立して自己管理ができていた。高齢発症型アルツハイマー病を有する患者の50%以上が何らかの介助を必要としていた
(PSMSスコア、2-5)。高齢者コホートでは、IADL項目の「トイレ」、「身体的な歩行」、「入浴」に障害があった割合が有意に高かった。
3年後、SATSの残りの参加者の35-55%は、基本的なIADL課題である「着替え」、「身繕い」、「入浴」の実行に介助を必要としたが、若年性アルツハイマー病患者の60%、高齢発症型アルツハイマー病患者の75%は「身体的な歩行」に介助を必要とした(p = 0.030)。若年者では、「トイレ」と「入浴」でより急速な悪化を示した(図1b1b)。
それぞれの発症年齢群における疾患進行の予測因子
機能的変化の非線形率(若年性アルツハイマー病、n = 120、84%、高齢発症型アルツハイマー病、n = 665、76%)の解析を可能にするために、3回以上の評価を受けた参加者のみが混合効果モデルに含まれた。このモデルは、SATS患者の縦断的な軌跡に影響を与える社会統計学的および臨床的要因を同定するために実施された(若年性アルツハイマー病、524データポイント、高齢発症型アルツハイマー病、2,836データポイント)。すべての固定予測因子に関する従属変数を占める分散の割合は、若年性アルツハイマー病群ではIADLが65.3%、PSMSが16.8%であり、高齢発症型アルツハイマー病群ではIADLが63.3%、PSMSが43.0%であった。これは、モデルの適合性が良好から非常に良好であることを示している(すべてのモデルでp<0.001);しかしながら、若年性アルツハイマー病群ではPSMSモデルの方が説明の度合いが低かった。混合効果モデル、有意な予測因子、および95%信頼区間を持つ標準化されていないβ係数を表22および33に示す。
表2 コリンエステラーゼ阻害薬の投与量と3年間の治療期間中の認知機能およびグローバルパフォーマンスの変化:発症年齢群別
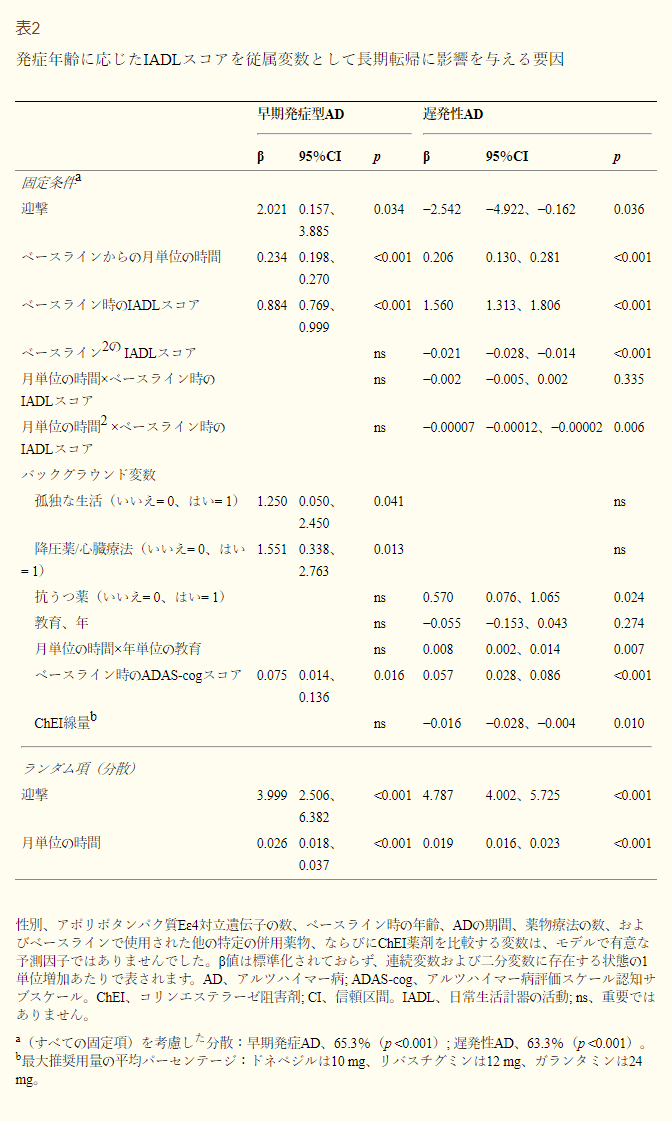
表3 ミニ精神状態検査のスコアを従属変数とした長期転帰に影響を及ぼす因子、発症時年齢群別
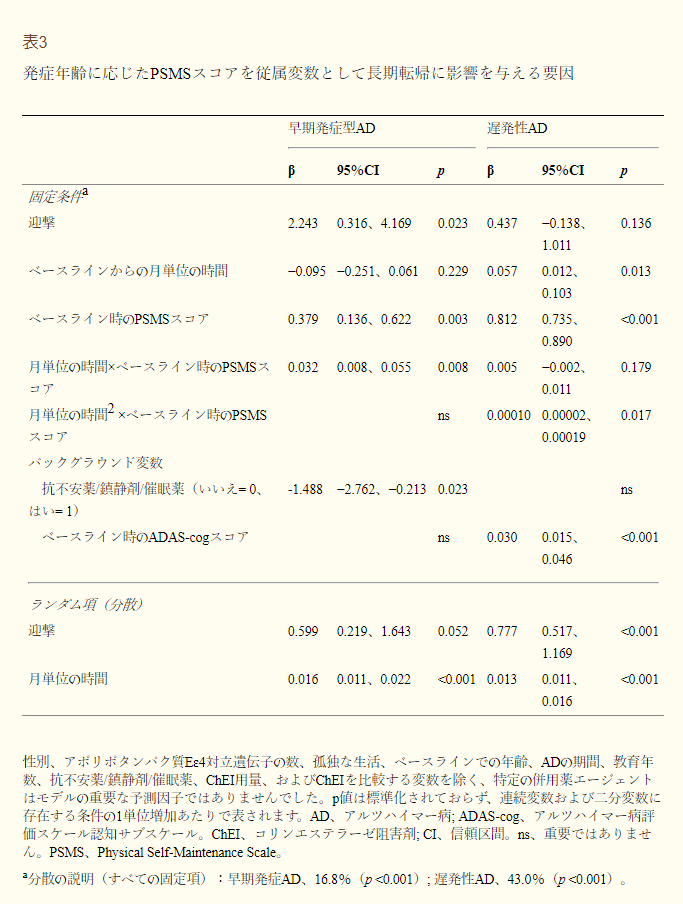
両群ともChEI治療開始時の認知状態が良好な患者では、IADL低下がより良好な長期予後を示した。
若年性アルツハイマー病患者では、IADL低下の早さに関連する危険因子は、孤独な生活と抗高血圧薬・心臓療法の使用であったが、教育年数の増加は有意な傾向を示した(p=0.061)。
高齢発症型アルツハイマー病患者では、抗うつ薬の使用、高学歴、ChEIの低用量は独立してIADLパフォーマンスの悪化を予測した。さらに、学歴年数と研究期間との間には相互作用効果があり、学歴年数が長いほどIADL障害が時間とともに増加することが示唆された。
基本的なIADLに関しては、若年性アルツハイマー病コホートでは抗不安薬/鎮静薬/催眠薬の使用は機能の進行が遅いことを示唆していた;しかしながら、若年者ではこの薬を使用している患者は少なかった(n = 6)。ベースラインでの認知能力の低さは、高齢発症型アルツハイマー病患者では基本的なIADLの悪化が早いことを予測していた。
若年性アルツハイマー病対高齢発症型アルツハイマー病のエンドポイント
全体では、若年性アルツハイマー病患者86人(60%)、高齢発症型アルツハイマー病患者556人(64%)が3年間のSATSを完了しなかった(χ2(1)=0.64;p=0.425)。脱落の理由は、老人ホームへの入所(n=131、13%)、メマンチン併用療法の開始(n=81、8%)、副作用(n=80、8%)、インフォームドコンセントの撤回(n=55、5%)であった。効果・悪化(n = 54, 5%)、コンプライアンス上の問題(n = 49, 5%)、アルツハイマー病とは無関係と考えられる体性疾患(n = 30, 3%)、他のChEI薬への切り替え(n = 21, 2%)、その他の理由(n = 60, 6%)であった。前述の理由による発症年齢群間の差は認められなかった。若年者と高齢者では、他の試験への切り替えがより一般的であった(13[9%]対21[2%]、χ2(1)=17.01;p<0.001)が、脱落理由としての死亡は頻度が低かった(1[1%]対46[5%]、χ2(1)=5.81;p=0.016)。
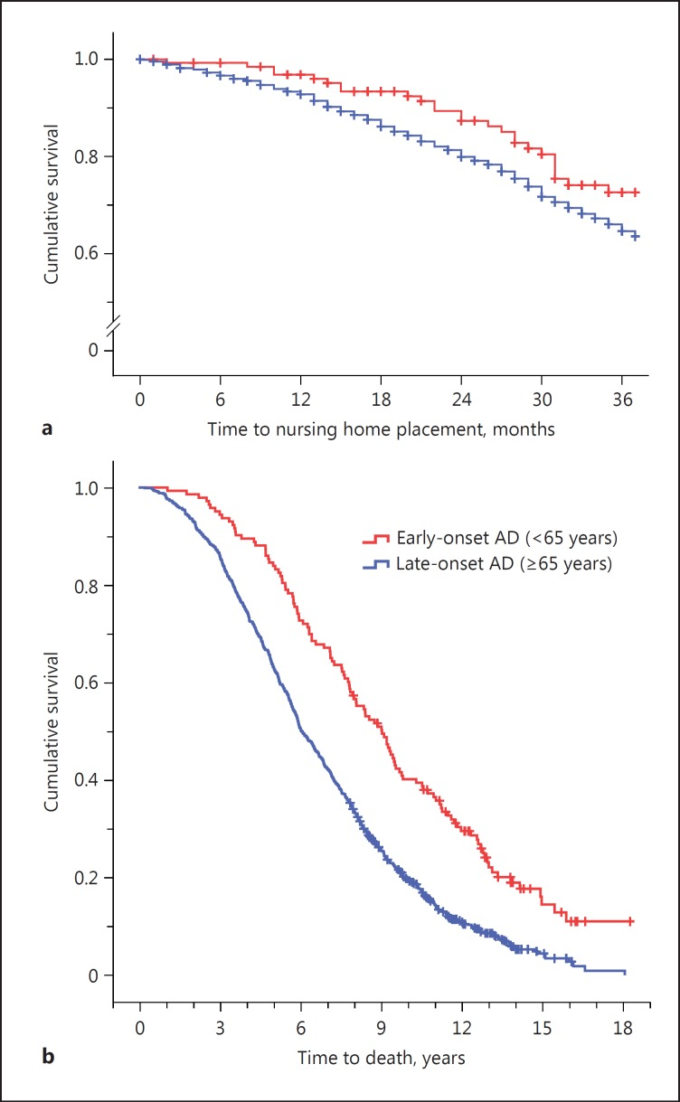
SATS期間中、若年性アルツハイマー病患者26人(18%)、高齢発症型アルツハイマー病患者205人(23%)が老人ホームに入院した(χ2(1)=1.66;p=0.196)。図2a2aは、2群のベースラインからNHPまでの時間分布のKaplan-Meierグラフを示す(対数順位検定、p = 0.064)。若いコホートと古いコホートのそれぞれの平均時間(95%CI)は、推定アルツハイマー病発症からNHPまでの期間が8.4年(6.6-10.2)対4.6年(4.3-4.9)であった(t229 = 7.58; p < 0.001)。しかし、若年性アルツハイマー病および高齢発症型アルツハイマー病の参加者におけるChEI治療開始から施設入所までの期間(22.3[18.7~25.8]対19.3[18.0~20.7]月;t229=1.42;p=0.156)および介護施設での平均生存期間(5.1[3.8~6.5]対4.1[3.7~4.5]年;t221=1.65;p=0.100)は、両発症群間で類似していた。すべての個人において、NHPの危険因子は、孤独な生活、ベースライン時のIADL能力の悪化、および研究期間中のIADL低下速度の速さであった。若年性アルツハイマー病コホートでは、より多くの教育年数と抗高血圧薬/心臓療法の使用が施設化リスクの低い予測因子であった(表44)。
図2 コリンエステラーゼ阻害薬(ChEI)治療の3年間のグローバル転帰
若年性アルツハイマー病(若年性アルツハイマー病)と後期発症アルツハイマー病(高齢発症型アルツハイマー病)の3年間のChEI治療開始からのグローバル成績(Clinician Interview-Based Impression of Change(CIBIC))の治療反応の差に応じた患者の割合を示す。治療開始24ヵ月後(p=0.005)を除いて、両群間でグローバルな奏効に有意差は認められなかった。CIBICスコア1~3を改善,4を変化なし,5~7を悪化とした。
表4 アルツハイマー病評価尺度-認知サブスケールを従属変数とした長期転帰に影響を及ぼす因子、発症年齢群別
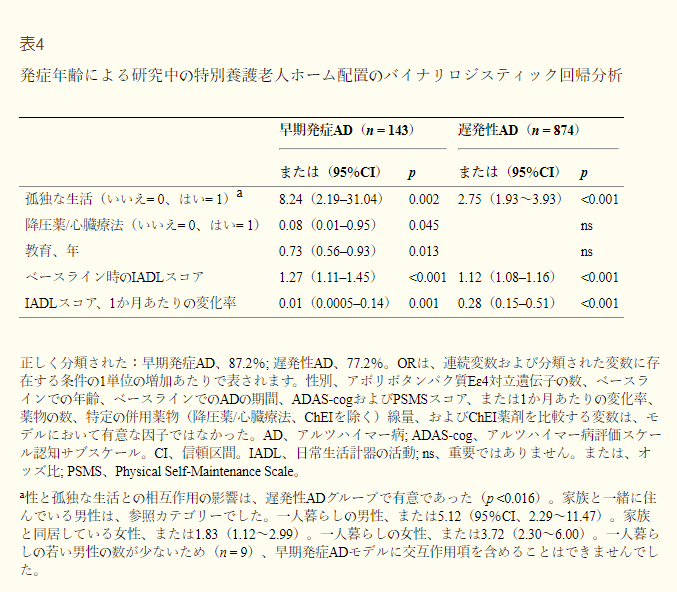
3年間のSATS終了時に若年性アルツハイマー病患者8名(6%)、高齢発症型アルツハイマー病患者127名(15%)が死亡した(χ2(1)=8.53;p=0.002);最長18年間の追跡調査では、115名(80%)、797名(91%)が死亡した(χ2(1)=15.40;p<0.001)。
図2b2bは、若年性アルツハイマー病および高齢発症型アルツハイマー病を有する患者について、ChEI治療開始から死亡までの時間分布のKaplan-Meierグラフを示す(対数順位検定、p<0.001)。ベースラインからの平均生存期間(95%CI)は8.0年(7.4~8.6)対6.2年(6.0~6.4)(t910=5.72、p<0.001)、死亡時年齢は若年性アルツハイマー病および高齢発症型アルツハイマー病患者でそれぞれ71.1年(70.0~72.1)対83.6年(83.3~84.0)(t910=-24.07、p<0.001)であった。
抗高血圧薬/心臓療法の使用者は、ベースラインからの平均寿命が非使用者よりも短かった(5.8[5.5-6.1]対6.8[6.6-7.1]年;t910=4.92;p<0.001)。死亡率の差は、一人暮らしまたは教育レベルという変数については検出されなかった。
議論
日常臨床で実施された本研究では、ChEI療法に対する6ヵ月間の認知反応および全人的反応、および3年後の経時的転帰は、発症年齢群間で類似していたが、アルツハイマー病AS-Cog尺度を用いた場合、若年性アルツハイマー病群では、ある時点でやや早い低下が認められた。ホモ接合体APOE ε4キャリアは若い患者でより頻繁に見られたが、多変量モデルではAPOE遺伝子型は疾患の進行に有意な影響を与えなかった。若年性アルツハイマー病コホートは高齢発症型アルツハイマー病群よりも高いChEI投与量を試験期間中に受けていた。平均ChEI量が高いこと、治療開始時の認知状態が良好であること、教育レベルが低いことは、両群の長期的な認知能力をより良好にする独立した保護因子であった。高齢発症型アルツハイマー病群の予後悪化の危険因子は、女性の性、若年性、IADL能力の低下、抗精神病薬の使用であった。
我々は若年性アルツハイマー病を65歳前のアルツハイマー病発症と定義したが、これは先行研究[21]で最もよく用いられている定義である。典型的には、アルツハイマー病は陰湿で緩やかな発症であり、病気の初期の加齢に伴う悪化と区別するのが問題になることがある;したがって、症状の発症時の個人の年齢を正確に推定するのは難しいかもしれない[32]。65歳未満という年齢のカットオフは恣意的であり、生物学的差異に基づくものではない;その代わりに、社会的要因、すなわち多くの国では伝統的な定年退職年齢が境界線として用いられている [21, 33]。しかし、いくつかの研究では、発症年齢<60歳[7]、発症年齢≦66歳[33]、アルツハイマー病診断時年齢<65歳[2,6]、アルツハイマー病診断時年齢≦65歳[34]、死亡時年齢<79歳[5]など、若年性アルツハイマー病の他のカットオフを使用している。このようなコンセンサスの欠如は、研究間の比較を困難にしている。
本研究では,3年間の認知アウトカムは発症群間で類似していたが、より複雑で感度の高いスケールを使用した場合,12,18,30ヶ月評価では若年性アルツハイマー病の悪化がやや急速に見られた。相反しないことに,10のアルツハイマー病研究を含むメタデータベースから派生した最近の出版物では、Schneiderら[35]は若い参加者で12-24ヶ月間のADAS-CogとMMSEスケールの両方でより大きな悪化を観察したが、それ以前の研究では、Kramer-Ginsbergら[36]は,2年までの間のADAS-Cog + アルツハイマー病AS-Noncogスコアの変化において若年性アルツハイマー病と高齢発症型アルツハイマー病の間に差はないと報告した。MMSEスケールに関する我々の知見と一致して、発症時の年齢に関係なく同様の悪化が記述されている[19, 37]が、他のアルツハイマー病研究では若年者対高齢者のMMSEスコアのより顕著な低下が示唆されているが[16, 34]。より小さなサンプルの研究(n = 42)[37]では、若年性アルツハイマー病と高齢発症型アルツハイマー病の抗認知症薬治療を受けた患者の平均MMSE変化/年は、それぞれ0.82と1.0ポイントであったが、ベースライン時のやや認知障害のあるSATSコホートの対応する進行率は,1.1と1.4MMSEポイント/年とわずかに速かった。これらの観察結果が混在していることから、使用した尺度がこれらの様々な結果の唯一の説明とはならず、若年性アルツハイマー病群が高齢発症型アルツハイマー病群とは異なる認知的軌跡をたどっているかどうかを結論づけることは不可能であることがわかる。若年者の方が疾患経過が早い可能性があり、臨床試験に参加したコホート間の年齢分布が不均等であることが、これらの研究の結果に影響を与えている可能性がある。
本研究では、高齢発症型アルツハイマー病の男性は女性よりも縦断的な認知能力が高いことが示された。男性の性は、いくつかの多変量研究[38, 39]では進行率の低下と関連しているが、すべての研究ではない[40]。しかし、これらの報告では、ChEI療法の潜在的な影響は取り上げられていない。男性のChEIに対する短期的な認知反応は、我々のグループ[13]やタクリンとガランタミンの3ヵ月間の研究[41]で示されている。これらの性差の一つの説明は、アルツハイマー病における性ホルモンの役割かもしれない[42]。もう一つの説は、体格をコントロールした後でも、男性の方が女性よりも大脳半球が大きいということである[43]。また、アルツハイマー病の病態と認知症との関連は、男性よりも女性の方が顕著であると報告されている[44]。これらの所見は、男性がアルツハイマー病の病理学への耐性が高く、女性の脳がより脆弱であることを示している可能性があり、これは、時間の経過とともにより好ましい認知転帰と男性の間で示されたChEIへの反応の良さを説明しているかもしれない。しかしながら、アルツハイマー病の予後とChEI治療の有効性の違いに関する性の影響の可能性は、さらなる調査が必要である。
この研究の若いコホートは、有意に高い教育レベル、アルツハイマー病の期間が長く、より良い機能的パフォーマンスを示したが、ベースラインでの認知状態は同じようなものであった。これらの特徴は若年性アルツハイマー病に関する他の報告[33]で記述されている。より多くの教育年数は、我々の発症時年齢群の両方で認知能力のより速い悪化に関連していた。この観察は、より高学歴の人々はアルツハイマー病診断時により進行した疾患を持つことが予想されるという認知予備能仮説を支持している[45]。さらに、神経病理学的研究では、高齢者よりも若年者の方がアルツハイマー病病理の負担が大きく、シナプスの損失が大きいことが検出されている[4]。本研究では、ADAS-Cogによって測定された若年性アルツハイマー病を持つ個人のやや急速な低下は、彼らの高学歴とより顕著な認知予備軍を反映している可能性がある。従来の認知評価尺度を用いたアルツハイマー病の中等度から重度の段階では、疾患の進行速度が増加することが示唆されている[40]。さらに、本研究では、高齢発症型アルツハイマー病の年齢が高いほど長期的な認知転帰が良好であることと関連していた。最高齢の参加者における認知予備能の低下は、疾患の早期発見、アルツハイマー病の診断、および早期の段階でのChEIの開始につながる可能性があり、その結果、有効性が改善される可能性がある。我々の若年性アルツハイマー病コホートでは、アルツハイマー病診断前のより長い罹患期間が示されたという我々の発見もまた、この説明を支持するものである。これらを総合すると、ベースラインでより大きなアルツハイマー病病理学を有するより進行した疾患、したがってより遅い段階でのChEI療法の開始は、若いSATS群で起こるかもしれない。
本研究では、若年性アルツハイマー病コホートではホモ接合体APOEε4キャリアの頻度が高いことが観察されたが、SATS群の若年者、高齢者のいずれの患者においても多変量モデルにおいてAPOE遺伝子型は認知的軌跡に影響を与えなかった。アルツハイマー病の進行率とε4対立遺伝子の関係に関するこれまでの研究は一貫性がなかった [46, 47]。ある研究では、若年性アルツハイマー病を有するAPOE非ε4キャリアは、高齢発症型アルツハイマー病を有する非ε4キャリアよりも認知機能の悪化が早かったことが示されたが、両群の教育レベルについては言及されていなかった[34]。以前、我々は、ε4キャリアは非ε4キャリアよりもChEI治療開始時の年齢が若く、教育年数が多いことを報告した[13]。若い個体は、より遺伝性で攻撃的な形態のアルツハイマー病を有する可能性がある[48]。教育レベルや認知予備能のような研究間での異なる患者特性、および発症年齢のグループ間での遺伝的素因は、様々な転帰を導くかもしれない。
抗精神病薬の使用とIADLのパフォーマンスの低下は、本研究では高齢発症型アルツハイマー病を有する参加者の認知機能低下をより顕著にする危険因子であった。認知症高齢者の聴覚障害と視覚障害は、それぞれ妄想と幻覚の増加につながる可能性がある [49]。
アルツハイマー病における精神病のレビューでは、発症年齢と精神病症状との関連は研究間で一貫性がないことが示された。しかし、この問題を調査したすべての研究において、精神病はより迅速な認知機能の悪化をもたらした[50]。さらに、アルツハイマー病における抗精神病薬治療は、プラセボと比較して、時間の経過とともに有意な認知機能の悪化に関連していた[51]。
これらの知見は、精神病症状を持つ患者は、アルツハイマー病のより侵攻的な経過と予後の悪化を伴うサブセットであることを示唆している。高齢発症型アルツハイマー病コホートでは、本研究では若年性アルツハイマー病群よりも機能障害が多かった。我々のグループや他のグループは、急速にIADLが悪化したアルツハイマー病患者は、初期評価時に有意に低い認知状態を示すことを報告している[22, 52]。
さらに、認知と機能の間には中等度の直線的な関連がアルツハイマー病で実証されている[53]が、これは、ある能力の変化が別の能力の変化に影響を与える可能性があるため、多変量モデルではこれらの側面を同時に解釈すべきであることを示唆している。この相互作用効果は、新しいアルツハイマー病治療薬の臨床試験で報告された結果に意味を持つかもしれない。
現在の観察的、縦断的研究は、若年性アルツハイマー病と高齢発症型アルツハイマー病を別々に持つ参加者の間でのChEI治療の潜在的な影響を示す最初のものである。ChEIの臨床的価値は、医師の間ではまだ論争の的となっている。スウェーデンの認知症レジストリからの最近の出版物の著者は、若年性アルツハイマー病群では高齢発症型アルツハイマー病コホートよりもChEI治療の有病率が有意に高かったと述べている(88%対75%);つまり、アルツハイマー病と診断された高齢者の4人に1人はChEIを受けていないということである[2]。我々の研究では,3つの薬剤間で効果の差は観察されなかった。ChEIの高用量投与は、両方の発症年齢のグループにおいて、よりポジティブな認知的転帰に関連していた;しかしながら、高齢発症型アルツハイマー病患者は若年性アルツハイマー病患者よりも低用量を経時的に投与されていた。この所見が、高齢者の実際の耐容性の低さに依存しているのか、あるいは高齢者が高用量のChEIに耐えられないかもしれないという医師の意見に依存しているのかは不明である。高用量のChEIと疾患の進行の遅さとの関連は、軽度から中等度のアルツハイマー病患者のSATS参加者の総数[13]と無作為化試験のメタアナリシス[54]で報告されている。
SATSの強みは、スウェーデン全土の記憶クリニックからの併存疾患と併用薬を持つアルツハイマー病患者を継続的に治療した一般的な患者の大規模コホートにおいて、ChEIの開始後3年以上にわたって6ヶ月ごとに、プロスペクティブでよく構成された評価を行っていることである。若年性アルツハイマー病参加者と高齢発症型アルツハイマー病参加者の3年完了率は、それぞれ臨床現場から得られた40%と36%で、他のアルツハイマー病延長研究や自然主義的研究(20~39%)と比較しても高かった[23]。
すべての長期アルツハイマー病研究における大きな脱落率は、残りの患者がChEI療法の恩恵をより受けると仮定すると、より好ましい転帰に寄与している可能性がある。我々の結果は、両方の発症年齢のグループの終了者が研究期間中、より高い平均投与量のChEIを受けていたことを示しており、治療のより良い耐性があることを示唆している。混合効果モデルでは、脱落者の転帰も参加期間中に含まれていた。
高齢発症型アルツハイマー病を有する非中途退学者で観察されたベースラインでの認知能力および全人的能力の低下は、SATSに参加している高齢者の方が時間の経過とともによりポジティブな軌跡をたどることに寄与している可能性がある。高齢発症型アルツハイマー病と精神病症状を有する患者は、研究を中止するリスクが高かった。しかし、その他の特徴については、中途退学者は研究終了者と同様であった。1つの制限は、SATSが倫理的な懸念のためにプラセボ対照ではなかったこと、または他の縦断的な観察的アルツハイマー病研究と同様に、ChEIの薬剤に関して無作為化されていなかったことである。
認知症障害の専門家が、日常的な臨床現場で使用される基準と一致して、各参加者のChEIの種類と用量を決定した。この研究のもう一つの欠点は、発症年齢に関する先行研究[55]と同様に、医師によるアルツハイマー病症状の発症の推定が、情報と介護者とその注意のレトロスペクティブな観察に依存していたことである。
若年性アルツハイマー病と高齢発症型アルツハイマー病、APOE遺伝子型、教育レベル、併用薬との関係を分析した長期研究はほとんどない。さらに、初期の所見は、例えば発症時年齢やAPOE ε4キャリアの状態が疾患の予後に及ぼす影響については一貫性がなく、追加の研究が必要である。ChEIに対する短期的な反応および異なる年齢層における長期的な効果、および転帰を変化させる可能性のある予測因子については、これまで調査されなかった。
結論
この観察研究では、若年性アルツハイマー病と高齢発症型アルツハイマー病の間の疾患進行の様々な側面を比較した。その結果,3年後の認知機能の低下率と全体的な低下率は、発症年齢群間で同程度であったが、より感度の高いADAS-Cog尺度の方が、この期間に若年者の方がより早く悪化する傾向があった。
この情報は、臨床試験の結果を解釈して、様々な年齢のアルツハイマー病コホートを対象とした新たな疾患修飾の可能性のある治療法(ChEIのアドオンとして)の有効性を評価し、現実的な期待を提供するために必要である。さらに、男性の性、より良いIADLパフォーマンス、高齢発症型アルツハイマー病群での抗精神病薬の使用なし、および両群の教育年数の低さは、より肯定的な縦断的認知転帰の保護因子であった。
若年性アルツハイマー病患者は2つのAPOE ε4対立遺伝子のキャリアの割合が高かったが、この観察は多変量モデルを用いても進行率に影響を与えなかった。研究対象となっているアルツハイマー病コホートの社会・人口統計学的および臨床的構成が、多くの報告で示されている結果の不均一性の1つの説明であるかもしれない。
ChEIの平均投与量が多いほど(薬剤に関係なく両方の発症群で認知機能の低下が遅かったが、高齢者の参加者は3年間の研究期間のほとんどの間、低用量を受けていた。この知見は、治療効果を向上させるために、発症時の個人の年齢に関係なく、アルツハイマー病におけるChEIの用量を最適化する臨床家にとっての重要性を強調している。要約すると、我々の結果は、若年性アルツハイマー病と高齢発症型アルツハイマー病は別個の存在ではないことを示唆している。
若い患者のアルツハイマー病診断までの時間の長さ、教育レベルの高さ、したがって認知予備能は、グループ間で検出された違いのほとんどを説明することができるかもしれない。
