Early use of nitazoxanide in mild COVID-19 disease: randomised, placebo-controlled trial
www.ncbi.nlm.nih.gov/pmc/articles/PMC7758778/
オンラインで2021年7月8日に公開された
Patricia R.M. Rocco,1,14 Pedro L. Silva,1,14 Fernanda F. Cruz,1,14 Marco Antonio C. Melo-Junior,2 Paulo F.G.M.M. Tierno,3 Marcos A. Moura,4 Luís Frederico G. De Oliveira,5 Cristiano C. Lima,6 Ezequiel A. Dos Santos,7 Walter F. Junior,8 Ana Paula S.M. Fernandes,9 Kleber G. Franchini,10 Erick Magri,2 Nara F. de Moraes,3 José Mário J. Gonçalves,4 Melanie N. Carbonieri,5 Ivonise S. Dos Santos,6 Natália F. Paes,7 Paula V.M. Maciel,8 Raissa P. Rocha,9 Alex F. de Carvalho,9 Pedro Augusto Alves,11 José Luiz Proença-Módena,12 Artur T. Cordeiro,10 Daniela B.B. Trivella,10 Rafael E. Marques,10 Ronir R. Luiz,1 Paolo Pelosi,13 and Jose Roberto Lapa e Silva1, on behalf of the SARITA-2 investigators

概要
背景
ニタゾキサニドは広く市販されており,試験管内試験では広範な抗ウイルス活性を示している。しかし,重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)感染症に対する影響については,まだ明らかにされていない。
方法
多施設共同無作為化二重盲検プラセボ対照試験において,新型コロナウイルス019年疾患(COVID-19)の症状(乾いた咳,発熱および/または疲労)が発現してから3日以内に来院した成人患者を登録した。鼻咽頭ぬぐい液で逆転写酵素PCR法を用いてSARS-CoV-2感染を確認した後、患者をニタゾキサニド(500mg)またはプラセボを1日3回、5日間投与する群に1対1で無作為に割り付けた。主要評価項目は、症状の完全な消失であった。副次評価項目は、ウイルス量、臨床検査値、血清炎症バイオマーカー、入院率であった。有害事象についても評価した。
試験結果
2020年6月8日から8月20日までに、1575人の患者をスクリーニングした。そのうち、392名(プラセボ198名、ニタゾキサニド194名)が解析された。症状の発現から試験薬の初回投与までの期間の中央値(四分位範囲)は5(4~5)日であった。5日後の診察では,症状の消失はニタゾキサニド群とプラセボ群で差がなかった。綿棒で採取したSARS-CoV-2は、ニタゾキサニド群では29.9%、プラセボ群では18.2%が陰性であった(p=0.009)。ウイルス負荷量は、ニタゾキサニド投与後、プラセボ投与後に比べて減少した(p=0.006)。治療開始から終了までのウイルス量の減少率は、ニタゾキサニド(55%)がプラセボ(45%)よりも高かった(p=0.013)。その他の副次評価項目については、有意差はなかった。重篤な有害事象は認められなかった。
結論
軽度のCOVID-19患者では、治療開始5日後の症状の消失はニタゾキサニド群とプラセボ群で差がなかった。しかし,早期のニタゾキサニド療法は安全であり,ウイルス量を有意に減少させた。
要約
本研究は、軽度のCOVID-19における早期ニタゾキサニド療法の効果を評価した初めての研究である。ニタゾキサニドは、5日間の治療では症状の消失を促進しなかったが、重篤な有害事象はなく、ウイルス量を有意に減少させた。https://bit.ly/37i75pr
はじめに
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)に感染した患者の大半は、軽度のコロナウイルス感染症2019(COVID-19)の症状を呈し、支持療法で回復するが、特定の宿主では、軽度の疾患であっても、臨床的に悪化したり、経過が長期化したりすることがある[1]。現在までに、軽症のCOVID-19に有効な治療介入はない。
COVID-19の治療法を模索する上で、薬剤の再利用は、開発コストや開発期間の短縮につながるため、重要な手段であると認識されている[2]。ニタゾキサニドは、臨床的に承認され市販されている抗寄生虫薬であるが、コロナウイルス、インフルエンザウイルス、B型およびC型肝炎ウイルスを含む広範囲の抗ウイルス活性を有することがわかっている[3]。さらに,Vero CCL81細胞において,マイクロモルの低濃度でSARS-CoV-2の複製を阻害することが示されている[4]。さらに、ニタゾキサニドは経口投与が可能であり、忍容性も高いことから、生体内での有効性が証明されれば、COVID-19の治療薬として有望な選択肢となる[3]。早期治療(症状が出てからすぐに開始し、ウイルス量を減らして病気の進行を防ぐ)に有効であることは、公衆衛生の観点からも特に魅力的である。しかし、軽度のCOVID-19患者に対する治療法として、その安全性や有効性を示す証拠はない。
このような背景から、多施設共同無作為化プラセボ対照試験を実施し、早期のニタゾキサニド療法が症状の解消を促進するのに有効であるかどうかを評価した。次に、ウイルス量、炎症のマーカー、入院率、プラセボと比較したニタゾキサニドの安全性を評価した。
方法
試験デザイン
二重盲検法によるプラセボ対照試験を、ブラジル国内の5つの独立型緊急医療センターと2つの病院で実施した(補足表S1)。本試験は,実行委員会によって企画され,ブラジル国立研究倫理委員会(CAAE:32258920.0.1001.5257)および参加施設の各倫理委員会によって承認された。本試験は,ブラジル科学技術革新省から,国家科学技術開発委員会を通じて資金提供を受けた。NitazoxanideはEurofarma社から無償で提供されたが、Eurofarma社は本試験のデザインおよび実施には関与していない。実行委員会は,データの正確性と,ブラジル臨床試験登録機関(REBEC;番号RBR-4nr86m)およびClinicalTrials.gov(識別子NCT04552483)に登録されたプロトコルに対する試験の忠実性を保証する。臨床試験および感染症の専門家で構成された独立データ・安全性モニタリング委員会は、参加者の25%、50%、75%が14日間の追跡調査を完了し、四分位ごとに有害事象と有効性の結果に関する情報を入手した後に招集された。
本試験は、ヘルシンキ宣言の原則および国際調和医療評議会の臨床試験実施基準(E6R2)に準拠して実施された。オンラインでの臨床モニタリングおよび品質管理は,開発業務受託機関(ATCGen, Campinas, Brazil)に委託した。本報告書は,Consolidated Standards of Reporting Trialsガイドライン[5]に従った。最終的な試験計画書,試験計画書の修正・変更,および最終的な統計解析計画については,補足的な方法で詳述した。
対象患者
3日以内にCOVID-19の臨床症状(本試験では、乾いた咳、発熱および/または疲労と定義)を呈した成人患者(18歳以上)を連続して登録した。除外基準は、鼻咽頭スワブ検体でのSARS-CoV-2の逆転写酵素定量的リアルタイムPCR(RT-PCR)検査が陰性であること、嚥下ができないこと。重度の腎疾患、心疾患、呼吸器疾患、肝疾患、自己免疫疾患、過去5年間の癌、ニタゾキサニドに対する既知のアレルギーや過敏症、投与前30日間のニタゾキサニドによる治療、細菌性肺炎や結核が臨床的に疑われるなど、試験手順を安全に実施することができない既往症があること。
無作為化とマスキング
患者は,コンピュータで作成した乱数表を用いて,プラセボまたはニタゾキサニド(500 mg内用液,20 mg-mL-1(25 mL),1日3回,5日間)のいずれかに無作為に割り付けられ,各試験施設の薬局で調剤された。プラセボとニタゾキサニドの色は一致させ、評価者がすべての時点でグループ分けを意識しないようにした。
試験方法
0日目(ベースライン)に、患者の適格性を評価した。患者からインフォームド・コンセントを得た。患者が同意できない場合は、医療従事者の代理人からも同意を得た。その後、RT-PCR検査のために鼻咽頭ぬぐい液を採取した。バイアスを軽減するため、すべてのRT-PCR分析はCT-Vacinas(Federal University of Minas Gerais, Belo Horizonte, Brazil)で集中的に行われ、検体は採取当日に宅配便で送られた。SARS-CoV-2が陽性と判定された患者(RT-PCRの1~2日後に結果が出た)(図1)には、電話で連絡を取り、最初に来院した医療機関に戻るように求めた。その後、施設の調査員が総合的な身体検査を行い、体温、心拍数、呼吸数、血圧、末梢の酸素飽和度を測定した。民族、現在服用している薬、症状が出た日などは、患者が自己申告した。その後、採血を行い、全血球数、C反応性タンパク質(CRP)および血清中の炎症バイオマーカー(インターロイキン(IL)-6,IL-8,IL-1β、腫瘍壊死因子-α、インターフェロン-γ)を測定した(RT-PCR検査およびバイオマーカー評価の詳細については補足方法を参照)。
図1 試験デザインの時系列

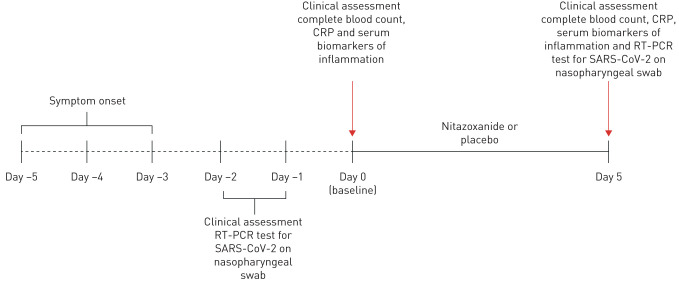
RT-PCR:リアルタイム逆転写酵素PCR、SARS-CoV-2:重症急性呼吸器症候群新型コロナウイルス,CRP:C-反応性タンパク質。
すべての患者は、日常的な症状、新たな症状、各症状の解消日などの情報を収集するための症状日誌を持ち帰った(補足表S2)。試験データは、各試験実施施設の担当者が電子データベースに直接入力し、さらにATCGen社の外部試験モニタリングスタッフが検証した。
治療終了1日後、患者は症状日誌を返却し、RT-PCRのための新たな鼻咽頭サンプルと、全血球数、CRPおよび血清バイオマーカーのための血液サンプルを提出するために、試験実施施設に戻った。データの検証は、必要に応じてATCGen社のスタッフの支援を受けながら、指定された試験地のマネージャーのみが行った。
主要評価項目
主要評価項目は、治療開始5日後に対象となる3つの症状(空咳、発熱、疲労)が完全に消失したこと。
副次評価項目
副次評価項目は、鼻咽頭ぬぐい液検体のウイルスRNA量の減少(ベースラインから治療完了の翌日まで)臨床検査項目の改善(炎症の血清バイオマーカーを含む)治療完了後の入院の発生率とした。治療を受けるために、または治療終了後に試験会場に戻ってこなかった患者には、非遵守の理由を理解するために電話で連絡を取り、その後、per-protocol分析から除外した(補足方法)。有害事象は、グレードにかかわらず、登録から14日目までの電子カルテのレビュー、身体検査、バイタルサイン、および臨床検査により、試験期間中モニターされた。分類にはMedDRA(Medical Dictionary for Regulatory Activities,バージョン23.0)を使用した。
統計解析
392例(各群196例、割付比1:1)のサンプルサイズで、プラセボと比較してニタゾキサニド投与開始後の無症状日数が11%増加したことを検出する検出力は、両面有意水準α=0.05で85%と推定した。人口統計、臨床検査、臨床データについては記述統計を用いた。質的変数については、フィッシャーの正確検定を行った。グループ間およびグループ内の比較には,それぞれMann-Whitney U-testおよびWilcoxon testを用いた。統計解析はSPSS version 27の環境下(IBM, Armonk, NY, USA)で行い、両側のp値<0.05を有意とした(補足)。
結果
2020年6月8日から8月20日の間に、1575人の患者が試験実施施設で適格性を評価された。このうち、475人がRT-PCRによりSARS-CoV-2感染の陽性と判定され、無作為化を行った。図2は、試験参加者の登録と追跡調査の概要を示したものである。無作為化前の除外理由は,0日目に採取したRT-PCRが陰性、および/またはCOVID-19症状がないこと(n=1062)参加を拒否したこと(n=27)治療の初回投与前に入院したこと(n=5)その他の理由(n=6)であった。無作為化後(n=475)介入の中止(n=41)中等度の有害事象(n=7)入院(n=10)により患者を除外した。ニタゾキサニド群の6名とプラセボ群の1名は、最初の2日間で中等度の下痢と嘔吐のために治療を中止したが、両者ともCOVID-19の症状はすでに改善していた。10名の患者(各群5名)が臨床症状の悪化により入院したが、5日間の治療経過を完了した患者はいなかった。2名の患者(いずれもニタゾキサニド群)が集中治療室への入院を必要とした(補足表S3)。解析中、プロトコルの逸脱、主要アウトカムのデータ欠落、評価不能などの理由により、ニタゾキサニド群から12名、プラセボ群から15名が除外され、結果として研究対象者は392名(ニタゾキサニド群194名、プラセボ群198名)となった。
図2 登録,無作為化,追跡調査,治療

1575名の患者が試験実施施設で適格性を評価された。このうち475名が逆転写酵素(RT)PCR法により重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)感染の陽性と判定され,無作為化が行われた。無作為化前の除外理由は,0日目(ベースライン)に採取したRT-PCRが陰性であったこと、および/またはコロナウイルス感染症2019(COVID-19)の症状がなかったこと(n=1062)参加を拒否したこと(n=27)治療の初回投与前に入院したこと(n=5)その他の理由(n=6)であった。無作為化後(n=475)介入の中止(n=39)中等度の有害事象(n=7)(いずれも胃腸の不調)入院(n=10)により患者が除外された(各群のn=5人の患者で、いずれも治療を完了しなかった)。解析中、プロトコルの逸脱、主要評価項目のデータ欠落、評価不能などの理由により、ニタゾキサニド群から12名、プラセボ群から15名が除外され、研究対象者は392名(ニタゾキサニド群194名、プラセボ群198名)となった。
ベースライン特性
ベースライン時の患者の特徴を表1に示した。人口統計学的特性と臨床的特性は両群でバランスがとれていた。年齢は18~77歳であった。半分強(53%)が女性で、69%が白人だった。治療開始のタイミングについては、症状が出てから1日目に登録された患者が8%、2日目に登録された患者が25%、3日目に登録された患者が67%であった。症状発現からニタゾキサニドまたはプラセボの初回投与までの期間(中央値(IQR))は5(4~5)日であった。発熱、乾いた咳、疲労感が登録時に最も頻繁に認められた臨床症状であった。ベースライン時の鼻咽頭ぬぐい液中のウイルス量の全体の中央値(IQR)は、両群間で有意な差はなかった。ベースライン時の試験集団のその他の特徴は、補足表S4に示した。
表1 ベースライン時に逆転写酵素(RT)PCR法で重症急性呼吸器症候群新型コロナウイルスが陽性であった被験者の特徴
| ニタゾキサニド | プラセボ | p値 | |
| 参加者 | 194 | 198 | |
| 年齢範囲年 | 0.891 | ||
| 18〜39 | 115(59) | 113(57) | |
| 40〜59 | 68(35) | 74(37) | |
| 60〜77 | 11(6) | 11(6) | |
| セックス | 0.054 | ||
| 男 | 101(52) | 83(42) | |
| 女性 | 93(48) | 115(58) | |
| 民族性 | 0.644 | ||
| 白い | 131(68) | 138(70) | |
| アジア人 | 5(3) | 2(1) | |
| 先住民族のブラジル人 | 0(0) | 1(0.5) | |
| 黒 | 31(16) | 32(16) | |
| 混合 | 27(14) | 24(12) | |
| BMIkg・m -2 | 1.000 | ||
| <29.9 | 134(69) | 136(69) | |
| ≥30.0 | 60(31) | 62(31) | |
| 併存症 | 0.091 | ||
| 番号 | 171(88) | 162(82) | |
| はい# | 23(12) | 36(18) | |
| 症状の発現から登録日までの時間 | 0.241 | ||
| 1 | 14(7) | 18(9) | |
| 2 | 42(22) | 55(28) | |
| 3 | 138(71) | 125(63) | |
| 症状の発症からニタゾキサニドまたはプラセボの初回投与までの時間、日数 | 5(4–5) | 5(4–5) | 0.124 |
| 併用薬 | |||
| なし | 154(80) | 158(80) | 1.000 |
| アンジオテンシンII受容体拮抗薬 | 6(3) | 12(6) | 0.227 |
| アンジオテンシン変換酵素阻害剤 | 1(1) | 1(0.5) | 0.833 |
| メトホルミン | 1(0.5) | 4(2) | 0.372 |
| スタチン | 0(0) | 4(2) | 0.123 |
| ベースラインでの症状 | |||
| 選択基準 | |||
| 乾いた咳 | 141(73) | 148(75) | 0.574 |
| 熱 | 109(56) | 115(58) | 0.760 |
| 倦怠感 | 95(49) | 95(48) | 0.920 |
| 二次症状 | |||
| 喉の痛み | 82(42) | 68(34) | 0.119 |
| 筋肉痛 | 60(31) | 53(27) | 0.374 |
| 頭痛 | 64(33) | 81(41) | 0.117 |
| 無嗅覚症 | 17(9) | 18(9) | 1.000 |
| 味覚消失 | 20(10) | 17(9) | 0.607 |
| 下痢 | 14(7) | 5(3) | 0.035 |
| 鼻咽頭スワブRT-PCRウイルス量ログ10コピー・mL -1 | 7.06(5.77–8.13) | 7.49(6.15–8.32) | 0.065 |
| S pO 2 % | 97.3±1.4 | 97.4±1.3 | 0.835 |
| WBC×10個の3細胞・mLで-1 | 5.4(4.3–6.6) | 5.3(4.6–6.5) | 0.904 |
| 好中球×10個の3細胞・mLで-1 | 2.8(2.1–3.9) | 2.9(2.2–4.0) | 0.984 |
| リンパ球×10個の3細胞・mLで-1 | 1.9(1.5–2.2) | 1.8(1.4–2.4) | 0.423 |
| 血小板×10個の3細胞・mLで-1 | 245(205–245) | 213(177–257) | 0.243 |
| CRPmg・L -1 | 6.0(2.0–15.0) | 4.5(2.0–12.2) | 0.190 |
| サイトカイン濃度pg・dL -1 | |||
| IL-6 | 0(0–4.10) | 0(0–8.34) | 0.471 |
| IL-8 | 2.79(0–12.48) | 5.51(0.38–17.91) | 0.090 |
| IL-1β | 0(0–0) | 0(0–19.45) | 0.088 |
| TNF-α | 0(0–0) | 0(0–0) | 0.179 |
| IFN-γ | 0(0–16.24) | 0(0–10.24) | 0.526 |
データは特に記載のない限り、n、n(%)中央値(四分位範囲)または平均±sdで表示。BMI: body mass index; SpO2: peripheral oxyhaemoglobin saturation; WBC: white blood cells; CRP: C-reactive protein; IL: interleukin; TNF: tumour necrosis factor; IFN: interferon. #:全身性動脈性高血圧症、糖尿病、喘息。両群間に有意な差は認められなかった。
主要評価項目
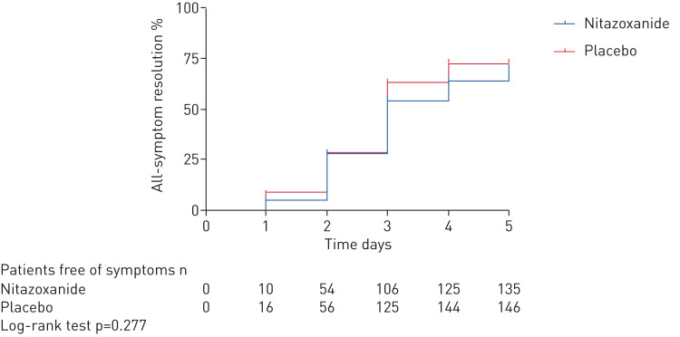
症状(空咳、発熱、倦怠感)の完全消失は、治療開始5日後にニタゾキサニド群とプラセボ群の間で差がなかった(図3,補足図S2)。
図3 治療開始5日後の症状消失のKaplan-Meier曲線
副次評価項目
治療開始5日後、ニタゾキサニド群はプラセボ群と比較してウイルス量が低下した(p=0.006)(表2)。さらに、治療開始0日目(ベースライン)(表1)から5日目(表2)までのウイルス量の減少率は、ニタゾキサニド群(55%)がプラセボ群(45%)に比べて有意に高かった(p=0.013)。治療終了時のRT-PCRによるSARS-CoV-2の陰性化は,ニタゾキサニド群29.9%,プラセボ群18.2%であった(p=0.009)(表2)。バイタルサイン(補足表S4)総白血球数、好中球数、リンパ球数、血小板数、CRP値、および血清中の炎症バイオマーカー(表2)は、ニタゾキサニド群ではベースラインと治療5日目の間に、またニタゾキサニド群とプラセボ群の間に違いはなかった。また、ニタゾキサニドの5日間の投与を完了した患者で入院した者はいなかった(補足表S3)。
表2 5日間の治療後の副次評価項目
| ニタゾキサニド | プラセボ | P –値 | |
| 参加者 | 194 | 198 | |
| 鼻咽頭スワブRT-PCRウイルス量ログ10コピー・mL -1 | 3.63(0–5.03) | 4.13(2.88–5.31) | 0.006 |
| RT-PCRステータス | 0.009 | ||
| ポジティブ | 136(70.0) | 162(82.8) | |
| ネガティブ | 58(29.9) | 36(18.2) | |
| WBC×10個の3細胞・mLで-1 | 6.1(5.1–7.3) | 6.4(5.3–7.8) | 0.080 |
| 好中球×10個の3細胞・mLで-1 | 3.4(2.6–4.4) | 3.6(2.7–4.7) | 0.327 |
| リンパ球×10個の3細胞・mLで-1 | 2.1(1.7–2.5) | 2.2(1.7–2.6) | 0.078 |
| 血小板×10個の3細胞・mLで-1 | 240(209–288) | 239(198–285) | 0.275 |
| CRPmg・L -1 | 5.0(1.0–16.2) | 4.5(2.0–13.0) | 0.445 |
| サイトカイン濃度pg・dL -1 | |||
| IL-6 | 0(0–0.03) | 0(0–0.03) | 0.992 |
| IL-8 | 2.73(0–12.24) | 2.70(0–11.42) | 0.855 |
| IL-1β | 0(0–0) | 0(0–0) | 0.399 |
| TNF-α | 0(0–0) | 0(0–0) | 0.627 |
| IFN-γ | 0(0–12.54) | 0(0–3.25) | 0.286 |
データは特に記載のない限り、n、中央値(四分位範囲)またはn(%)で示した。RT:逆転写酵素、WBC:白血球、CRP:C反応性タンパク質、IL:インターロイキン、TNF:腫瘍壊死因子、IFN:インターフェロン。
いずれの群においても、死亡例や生命を脅かす有害事象は報告されなかった。軽度および中等度の有害事象は、5日間の治療期間中に両群の患者(ニタゾキサニド30.9%、プラセボ30.4%)が経験した(表3)。最も多く見られた有害事象(グレード1および2)は、下痢、頭痛、吐き気で、両群間に有意な差はなかった。4名の患者が重度の有害事象(頭痛のみ、または下痢を伴う)を報告したが、プラセボ群の方が頻度が高かった。変色した尿はニタゾキサニド治療の既知の副作用であり、不注意による盲検化の懸念があるかもしれない。しかし、この事象は確かに治療群でより頻繁に見られたものの、プラセボ投与を受けた患者でも報告された(5.6%対1.5%)(表3)。
表3 有害事象
| ニタゾキサニド | プラセボ | p値 | |
| 参加者 | 194 | 198 | |
| 少なくとも1つの有害事象のある参加者 | 60(30.9) | 60(30.4) | 0.913 |
| 2つの有害事象のある参加者 | 22(11.3) | 18(9.1) | 0.507 |
| 3つ以上の有害事象のある参加者 | 16(8.2) | 12(6.1) | 0.438 |
| 重篤な有害事象のある参加者 | 1(0.5) | 1(0.5) | 0.999 |
| 中等度の有害事象のために治療を中止した参加者 | 6(3.1) | 1(0.5) | 0.065 |
| 詳細な有害事象 | |||
| 下痢 | 57(29.4) | 49(24.7) | 0.309 |
| 頭痛 | 34(17.5) | 32(16.1) | 0.787 |
| 吐き気 | 28(14.4) | 29(14.6) | 0.999 |
| 腹痛 | 10(5.2) | 5(2.5) | 0.197 |
| 尿の異常な色 | 11(5.6) | 3(1.5) | 0.031 |
| 嘔吐 | 9(4.6) | 3(1.5) | 0.085 |
| かゆみ | 4(2.1) | 1(0.5) | 0.212 |
| 蕁麻疹 | 1(0.5) | 3(1.5) | 0.623 |
考察
軽度のCOVID-19患者を対象としたこの多施設共同二重盲検無作為化プラセボ対照試験では、5日間の治療後、症状の解消(乾いた咳、発熱、疲労)はニタゾキサニドとプラセボの間で差がないことがわかった。ニタゾキサニドは安全で、ウイルス量を有意に減少させ、5日間の治療後にSARS-CoV-2の検査が陰性となった患者の割合をプラセボと比較して増加させた。しかし、ニタゾキサニドは、入院を予防したり、全血球数、CRP値、血清中の炎症のバイオマーカーに変化を与えたりすることはなかった。さらに、ニタゾキサニドは安価で広く入手可能であり、現在までのところ、他の推奨される治療法がこの集団において何らかの利益をもたらすことは証明されていない。
COVID-19に対するエビデンスに基づいた薬物療法が緊急に必要である。パンデミックという困難な状況下では、薬剤の再利用により、時間のかかる薬剤開発プロセスを短縮し、効果的な治療法を人々に迅速に展開することができる[2]。本試験の実施に先立ち,米国食品医薬品局(FDA)が承認した727種類の医薬品または医薬品類似化合物のうち,ヒトの臨床試験で使用された経験のあるものを集めたNational Institutes of Health Clinical Collection libraryを用いて,SARS-CoV-2に対する試験管内試験抗ウイルス活性の可能性をスクリーニングした(補足図S1)。Nitazoxanideおよびその活性代謝物であるtizoxanideは、SARS-CoV-2を感染させたVero E6,ヒト胚性腎臓(HEK 293T)および肺上皮(Calu-3)細胞において、細胞生存率の低下を誘発することなく、ウイルス量を有意に減少させた。ニタゾキサニドは1996年から市販されており、臨床でも使用されているため、その副作用プロファイルはよく知られており、今回の試験でも市販の製剤が使用された。腸管寄生虫症の治療には,500 mgを12時間ごとに投与することが承認されており,一般的に処方されているが[5],有害事象の報告はほとんどない。本試験では,我々のグループによる試験管内試験の薬理学的研究および血漿中濃度に関する公表データ[6-8]に基づき,生体内試験でのSARS-CoV-2の阻害効果を最大化するために,同じ用量を8時間ごとに投与した[7].ヒトに安全な用量での最大血清濃度と,試験管内試験での最大有効抗ウイルス濃度の比が高ければ,承認された用量でウイルス抑制を達成できる可能性が高くなると想定した[9].
Nitazoxanideは、軽度のCOVID-19患者において、治療開始5日後に評価したところ、主要評価項目を満たすことができなかった。In vitroのデータと同様に、軽度のCOVID-19患者において、ニタゾキサニドを5日間投与したところ、ウイルス量の有意な減少が認められた。この効果は、SARS-CoV-2の地域への拡散[9, 10]、罹患率[11]、死亡率[12]を低下させる可能性があり、疫学的にも影響があると考えられる。
軽度のCOVID-19患者は、症状が出てからできるだけ早く登録した。これは、この段階の感染では抗ウイルス剤がより効果的であると考えられるからである[13]。登録のためのカットオフポイントは,最初の症状が現れてから3日後としたが,SARS-CoV-2感染が確認されてから治療を開始したため,治療開始時期の中央値は症状が現れてから5(4-5)日後となった(表1).過去に行われた推定抗ウイルス剤の臨床試験では,治療開始までの期間の中央値は症状発生後13日[14],9日[15],8~9日[16],4~5日[17]であった。SARS-CoV-2のウイルス量のピークは通常、症状が出る前に起こり[18]、COVID-19の後期にはウイルスの病原性よりも全身の炎症亢進が支配的になり、その時点で抗ウイルス療法が効かなくなる可能性があるため[18, 19]、治療をもっと早く開始したほうが効果的かもしれない。さらに、解析は治療後5日目に行われた。これは、治療後の期間が長ければ、ほとんどの患者が治療とは無関係に症状が治まるからである。過去の研究では、発症から症状が治まるまでの期間の中央値は8(6.25~11.5)日と報告されている[20]。
タイミングの他に、ニタゾキサニド群に偏った結果をもたらした可能性がある2つのポイントは、発症時のCOVID-19の重症度と、サンプルの良好な人口統計学的プロファイルである。登録されたのは軽度のCOVID-19患者のみで、ほとんどが若年成人(生後18~39日)で、併存疾患を持つ患者は少なく(12~18%)併用薬の使用頻度も低かった(サンプルの20%未満)。より進行したCOVID-19においてニタゾキサニドが役割を果たすかどうかを評価するには、さらなる研究が必要である。このような観点から、Hungら[17]は最近、重症のCOVID-19患者において、ウイルス量の減少と症状の緩和を目指して、抗ウイルス療法を併用することの重要性を報告している。
ニタゾキサニドの投与回数を増やしても、有害事象の発生率に大きな変化は見られなかった。有害事象の頻度および重症度は、尿の変色(既知の無害な作用)を除き、両群間で有意な差はなく、ニタゾキサニドは軽症のCOVID-19患者に対して安全であることが示唆された。
この研究にはいくつかの限界がある。COVID-19には様々な症状があることが知られており、患者が他の症状を訴えていたにもかかわらず、3つの症状(乾いた咳、発熱、疲労)のみを主要アウトカムの分析に考慮した。患者は5日間の治療期間中、追跡調査を受けたが、治療効果の長期的な分析を行う必要がある。すべての患者は、処方された通りに1日3回薬を服用し、症状が悪化したり副作用が発現したりした場合には試験会場に戻り、有害事象の有無、COVID-19の各症状の強さ、症状の軽減・解消時期などのデータを症状日誌に記入するよう指示された。しかし、患者がこれらの指示にどの程度従ったかを確認することはできない。しかし、プラセボ対照のデザインであったため、両群ともに非遵守が生じた可能性がある。ニタゾキサニド群では、COVID-19の症状がすでに改善した後に、約3%が胃腸の不調のために治療を中止した。最後に、これらの患者では胸部CTや単純X線写真は撮影されていない。
以上のように、発症から3日以内の軽度のCOVID-19患者において、ニタゾキサニドはプラセボと比較して、治療開始5日後の症状の消失を早めるという点では有効な治療法ではなく、臨床的に関連する副次的なアウトカムを変化させるものではなかった。しかし、ニタゾキサニドは安全で、ウイルス量を有意に減少させ、治療終了後にSARS-CoV-2が陰性となった患者の割合を増加させた。

