Early Antiandrogen Therapy With Dutasteride Reduces Viral Shedding, Inflammatory Responses, and Time-to-Remission in Males With COVID-19: A Randomized, Double-Blind, Placebo-Controlled Interventional Trial (EAT-DUTA AndroCoV Trial – Biochemical)
オンラインで2021年2月1日に公開
モニタリングエディター Alexander Muacevic氏、John R Adler氏
Flavio A Cadegiani,corresponding author1,2 John McCoy,3 Carlos Gustavo Wambier,4 and Andy Goren5
概要
背景と目的
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の細胞侵入とその後の感染力は、膜貫通型プロテアーゼ、セリン2(TMPRSS2)の制御を介して、アンドロゲンとアンドロゲン受容体によって媒介される。男性型脱毛症(AGA)では、男性は新型コロナウイルス疾患(COVID-19)が重症化しやすいが、5α還元酵素阻害薬(5ARis)やアンドロゲン受容体拮抗薬を使用するとCOVID-19疾患の重症度が低下する。本研究では、COVID-19の治療薬として、一般的に使用されている広範囲で強力な5ARiであるデュタステリドの潜在的な有用性を明らかにすることを目的とした。
デザイン、設定、および参加者
本研究は外来診療所で行われた。被験者は、採用後24時間以内に採取した逆転写ポリメラーゼ連鎖反応(RT-PCR)検査が陽性の状態で診療所に来院した。被験者は全員、軽度から中等度の症状を呈していた。
介入方法
被験者はデュタステリド0.5mg/日またはプラセボを30日間またはCOVID-19が完全に寛解するまで投与された。すべての被験者は、ニタゾキサニド500mg1日2回を6日間、アジスロマイシン500mg1日5日間の標準治療を受けた。
主要評価項目と評価方法
主要評価項目は、寛解までの期間、酸素飽和度(%)RT-PCR-SARS-CoV-2の陽性率、生化学的分析(超高感度C反応性タンパク質(usCRP)Dダイマー、乳酸、乳酸脱水素酵素(LDH)赤血球沈降速度(ESR)超高感度トロポニン、フェリチン)であった。
結果
デュタステリドを服用した被験者(n=43)は、プラセボを服用した被験者(n=44)と比較して、疲労感、異臭、および全疾患期間の減少を示した(いずれもp<.0001)。プラセボ群と比較して、デュタステリドを服用した被験者は、7日目のウイルス学的寛解率(64.3%対11.8%、p=0.0094)臨床的回復率(84.7%対57.5%、p=0.03)平均酸素飽和度(標準偏差:SD)が高い(97. 0.34 mg/L [0.23 mg/L-0.66 mg/L] 対 1.47 mg/L [0.70 mg/L-3.37 mg/L]; p<.0001)乳酸値の中央値 [IQR] が低い(2. 01 mmol/L [1.12 mmol/L-2.43 mmol/L] 対 2.66 mmol/L [2.05 mmol/L-3.55 mmol/L]; p=.0049)ESRの中央値[IQR]が低い(5.0 mm/1h [3.0 mm/1h-11.0 mm/1h] 対 14.0 mm/1h [7.25 mm/1h-18.5 mm/1h]; p=.0007)。 0007)LDHの中央値(IQR)は165 U/L [144 U/L-198 U/L] 対 210 U/L [179 U/L-249 U/L]; p=.0013)トロポニン値の中央値(IQR)は0.005 ng/mL [0.003 ng/mL-0.009 ng/mL] 対 0.007 ng/mL [0.006 ng/mL-0.010 ng/mL]; p=.048)となっていた。
結論と関連性
本研究の結果から、ニタゾキサニドとアジスロマイシンによる早期治療を受けている軽度のCOVID-19症状の男性において、デュタステリドによる治療は、プラセボによる治療を受けている男性と比較して、ウイルスの排出量と炎症マーカーを減少させることが示唆された。
キーワード:COVID-19,SARS-Cov-2,デュタステリド、ニタゾキサニド、アジスロマイシン
はじめに
新型コロナウイルス019年疾患(COVID-19)の疾病負担は、女性に比べて男性に偏っており[1,2]、これは生活習慣や併存疾患の面での性差では十分に説明できない。我々はこれまでに、アンドロゲンを介した表現型である男性のアンドロゲン性脱毛症(AGA)と女性の高アンドロゲン症がCOVID-19疾患の重症度と関連することを報告していたが[3-5]、一方で、抗アンドロゲン剤の使用は疾患負担の軽減と関連することを報告していた[6-8]。
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の細胞内への侵入は、ヒト細胞の表面に発現する膜貫通型プロテアーゼ、セリン2(TMPRSS2)によるウイルススパイクタンパク質の切断に依存している。TMPRSS2酵素の唯一のプロモーターとして知られているのが,5’プロモーター領域に位置するアンドロゲン応答要素である[9,10]。SARS-CoV-2ウイルスの感染力がアンドロゲンによって制御されているという仮説は、COVID-19の疾患重症度の男性偏りがアンドロゲンに関連している可能性を示唆する我々が発表したいくつかの論文で説明されているように、もっともらしいものであり、男女ともにアンドロゲン表現型に応じた疾患パターンによって補強されている[3-5, 11-13]。したがって、アンドロゲン受容体を遮断してTMPRSS2の発現を低下させれば、SARS-CoV-2のヒト細胞への侵入が減少すると考えられ[6-8, 13-17]、このことは、抗アンドロゲン剤を使用することでCOVID-19に関連するより重篤な状態から保護されるという研究結果からも裏付けられている[6-8]。さらに、アンドロゲン受容体遺伝子の変異は、COVID-19の疾患の重症度を予測する可能性がある[13,18]。これらを総合すると、COVID-19に対する有望な治療法として、アンドロゲン受容体を減少させる薬剤の使用をさらに検討するための十分な証拠がある。
5αリダクターゼ阻害剤(5ARis)は、AGAや前立腺肥大症(BPH)によく処方される抗アンドロゲン剤である。その作用機序は、テストステロンがより強力なアンドロゲンであるジヒドロテストステロン(DHT)に変換されるのを阻害することにある[11]。5ARisは安価で、副作用の発生率も比較的低い。COVID-19に対する保護剤としての抗アンドロゲン剤の役割については、メカニズム的に妥当であり、証拠も増えてきていることから、COVID-19の治療としてデュタステリド(DUTA)を用いた早期抗アンドロゲン療法(Early Antiandrogen Treatment With Dutasteride for COVID-19 (EAT-DUTA AndroCoV))の有効性を評価することを目的とした、二重盲検プラセボ対照無作為化臨床試験(RCT)を実施した。本研究は、RCT開始時にあらかじめ決められた、より包括的な生化学的評価を無作為に受けたEAT-DUTA AndroCoV Trial参加者のサブセットの生化学的、ウイルス学的、臨床的プロファイルを分析したものである。
材料と方法
試験デザイン
COVID-19の抗アンドロゲン療法に関する二重盲検無作為化前向き調査研究のために、ソーシャルメディア、ブラジリアに拠点を置くブラジルの医療システム登録の10,900人の男性を含む患者メーリングリスト、および他の医師からの紹介により、被験者候補が募集された。本研究では、SARS-CoV-2の逆転写ポリメラーゼ連鎖反応検査(RT-PCR-SARS-CoV-2)で陽性が確認された被験者が外来を受診した。本研究は,ブラジル国立倫理委員会に登録され,承認された[承認番号:4.173.074;プロセス番号(CAAE):34110420.2.0000.0008;Comitê de Ética em Pesquisa(CEP),Conselho Nacional de Ética em Pesquisa(CONEP),Ministério da Saúde – (MS) (CEP/CONEP/MS)].研究に参加したすべての患者がインフォームド・コンセントに署名した。ベースラインの特徴、併存疾患の有無、薬の使用状況、COVID-19の臨床的特徴、検査結果、および疾患の転帰は、研究責任者が記録し、研究責任者が管理した。
試験対象者
COVID-19が疑われる被験者のスクリーニングは、研究の主要施設(ブラジル、Corpometria Institute Brasilia)で研究責任者が行った。SARS-CoV-2状態は、COBAS SARS-CoV-2 RT-PCRキットテストプロトコルに従って、RT-PCR-SARS-CoV-2キットテスト(Automatized Platform, Roche USA, Indianapolis, IN)によって実験室で確認された。追加の組み入れ基準は以下の通り。(1)18歳以上の男性、(2)COVID-19感染の持続期間が7日未満、(3)COVID-19に対する特定の治療を72時間以上行っていない、(4)デュタステリドに対する副作用の既往がない、(5)登録時の酸素飽和度(SaO2)が92%以上、(6)スクリーニング時にCOVID-19や二次的な細菌感染に関連する合併症の兆候がない。
試験方法
患者はデュタステリド群またはプラセボ群に無作為に割り付けられた。デュタステリドは0.5mg/日の用量で30日間またはCOVID-19が完全に寛解するまで投与された。すべての被験者に対して、現地保健省が提案する標準的な治療法の1つのプロトコルに従って、ニタゾキサニド500mgを1日2回、6日間食後に投与し、アジスロマイシン500mg/日を5日間食前に投与した。
本研究に登録されたすべての被験者は、臨床結果を評価されたが、予算の都合上、3分の2のサブセットの被験者には無作為に生化学的分析が行われた。生化学的/生物学的分析では、デュタステリド群とプラセボ群の間の炎症反応およびウイルス反応のさらなる違いを検出することを目的とした。登録時に2:1の無作為化を行い,0日目、7日目、14日目の間の少なくとも2つの時点で生化学的評価を行い、本解析の対象となる患者を抽出した。臨床結果は、本試験に選ばれた患者のサブセットで調整された。
試験結果
本試験のエンドポイントは、疲労および味覚・嗅覚の喪失(無味無臭)の寛解期間、無味無臭と無味無臭を含むCOVID-19全体の寛解までの期間、および無味無臭と無味無臭を含まないCOVID-19全体の寛解までの期間であった。COVID-19全体の寛解までの時間、すなわちCOVID-19の「治癒」は、症状の完全な寛解と定義した。疾患の回復は、完全に健康(完全に回復した)を100,COVID-19を使用した最悪の日を0とし,0日目(治療開始)1日目、2日目、3日目、7日目、14日目、21日目、30日I-RECOVERを被験者が評価し,0から100までの回復感を報告することで評価した。COVID-19 の臨床症状が完全になくなった患者の割合は、7 日目に決定した。酸素飽和度(%)と心拍数(bpm)は、第0日、第1日、第2日、第3日、第7日に測定した。
EAT-DUTA AndroCoV試験に登録された被験者の一部の生化学的パラメータには、7日目のRT-PCR-SARS-CoV-2,超高感度C反応性タンパク質(usCRP, mg/L)(ラテックス強化免疫比濁法)D-ダイマー(ng/mL)(免疫学的測定法)乳酸(mmol/L)(酵素学的測定法)乳酸脱水素酵素(LDH、U/L)(乳酸NAD)赤血球沈降速度(ESR, mm/1h)(キャピラリーフォトメトリー)超高感度トロポニン(ng/mL)(電気化学発光法-ECLIA)フェリチン(ng/mL)(化学発光法-CLIA)を、COVID前(入手可能な場合)と,0日目、7日目、14日目、7日目から0日目までのデルタ値、14日目から0日目までのデルタ値,0日目から7日目までと0日目から14日目までの異なるレベルの減少率で記録した。
さらに、好中球(*1000/mm3)リンパ球(*1000/mm3)好酸球(*1000/mm3)単球(*1000/mm3)を蛍光タンパク質を用いたフローサイトメトリー(XN10-Sysmex)で測定し、好中球対リンパ球の比率を算出した。
サンプルサイズの算出
COVID-19の炎症マーカーについて、p=0.05の割合の差を検出するカイ二乗検定のためにサンプルサイズを推定すること、A群に登録された被験者数とB群に登録された被験者数が等しいこと、すなわち1:1の登録比率であること、95%の被験者が試験を完了することを前提に、最低70名の被験者を募集する必要があると算出した。
統計解析
COVID-19患者の病歴、併用薬、ライフスタイルの特徴を、各群の以下の特徴に基づいて集計した。年齢、BMI、高血圧、心筋梗塞、脳卒中、心不全、脂質異常症、糖尿病、糖尿病予備力、肥満、喘息、慢性閉塞性肺疾患(COPD)がん、前立腺肥大症、前立腺がん。慢性腎疾患、肝線維症/肝硬変、臨床的うつ病、不安神経症、注意欠陥多動性障害(ADHD)不眠症、性腺機能低下症、甲状腺機能低下症、自己免疫疾患、および適応症のある薬剤を服用している。臨床的パラメータには平均値と標準偏差(SD)を、生化学的パラメータには中央値と四分位範囲(IQR)を用った。統計的有意性の判定にはノンパラメトリック統計ツールを用い、p<0.05とした。すべての統計解析には、XLSTAT version 2020.3.1.1008 (Addinsoft, Inc. New York, NY)を用いた。
結果
EAT-DUTA AndroCoV試験に登録された138名の被験者のうち、87名のサブセットが生化学分析を受け、そのうちデュタステリド群の男性43名とプラセボ群の男性44名が生化学分析を受けた(図(図11))。
図1 EAT-DUTA AndroCoV-Trial biochemical armのCONSORTフロー図

CONSORT Consolidated Standards of Reporting Trials; EAT-DUTA AndroCoV: COVID-19に対するデュタステリドを用いた早期抗アンドロゲン療法
2つの試験群のベースライン特性、併存疾患の有病率、および薬剤の使用状況を表1に示したが、すべてのパラメータで類似していることがわかった。最初の症状が出てから治療を開始するまでの平均間隔は、両群とも4.3日であった(p=n/s)。両群とも、COVID-19の追加治療を同程度の割合で受けた。グルココルチコイド療法を行った13名の参加者全員(プラセボ群6名(13.9%)デュタステリド群7名(15.9%))が、同じ薬剤(デキサメタゾン)を6mg/日の用量で3日間投与された。
表1 試験対象者の特徴
MI:心筋梗塞、CHF:うっ血性心不全、2型糖尿病:2型糖尿病、1型糖尿病:1型糖尿病、COPD:慢性閉塞性肺疾患、CKD:慢性腎臓病、ADHD:注意欠陥多動性障害、BPH:前立腺肥大症。BPH:前立腺肥大症、ACEi:アンジオテンシン変換酵素阻害薬、ARB:アンジオテンシン2受容体拮抗薬、CCB:カルシウム拮抗薬、GLP1Ra:グルカゴン様ペプチド-1受容体アナログ、SGLT2i:ナトリウム-グルコースコトラノミ SGLT2i: sodium-glucose cotransporter-2 inhibitor; DPP4i: dipeptidyl-peptidase 4 inhibitor; P: progesterone; E: estradiol; GnRH: gonadotropin release hormone; SERM: selective estrogen receptor modulators; NSAA: non-steroid antiandrogen: NSAA:非ステロイド性抗アンドロゲン剤、SSRI:選択的セロトニン再取り込み阻害剤、中枢神経系:中枢神経系、BCG:カルメットゲラン菌、SD:標準偏差、n/s:有意ではない、n/a:適用外
| プラセボ群(n = 44) | デュタステリド基(n = 43) | P値 | |
| ベースライン特性、平均(SD) | |||
| 年齢、年 | 43.8(14.1) | 40(10.8) | n / s |
| BMI、kg / m 2 | 26.1(2.2) | 26.0(3.2) | n / s |
| 治療までの時間、日数 | 4.4(1.4) | 4.3(1.4) | n / s |
| 併存疾患、n(%) | |||
| 肥満 | 4(9.3%) | 5(11.4%) | n / s |
| 高血圧 | 12(27.9%) | 7(15.9%) | n / s |
| MI | 0 | 0 | 該当なし |
| 脳卒中 | 0 | 0 | 該当なし |
| CHF | 0 | 1(2.3%) | 該当なし |
| 脂質障害 | 9(20.9%) | 9(20.4%) | n / s |
| その他の心機能障害 | 0 | 1(2.3%) | 該当なし |
| T1DMおよびT2DM | 4(9.3%) | 4(9.1%) | n / s |
| 前糖尿病 | 8(18.6%) | 5(11.4%) | n / s |
| 血糖異常 | 12(28.0%) | 9(20.6%) | n / s |
| 喘息 | 1(2.3%) | 0 | 該当なし |
| COPD | 0 | 0 | 該当なし |
| CKD | 0 | 0 | 該当なし |
| 肝線維症/肝硬変 | 1(2.3%) | 0 | 該当なし |
| 臨床的うつ病 | 2(4.6%) | 3(6.8%) | n / s |
| 不安 | 6(13.9%) | 8(18.2%) | n / s |
| ADHD | 5(11.6%) | 3(6.8%) | n / s |
| 不眠症 | 4(9.3%) | 1(2.3%) | n / s |
| 甲状腺機能低下症 | 1(2.3%) | 4(9.1%) | 該当なし |
| 自己免疫疾患 | 1(2.3%) | 1(2.3%) | 該当なし |
| 癌 | 0 | 0 | 該当なし |
| 勃起不全 | 2(4.6%) | 1(2.3%) | 該当なし |
| 性腺機能低下症 | 8(18.6%) | 8(18.2%) | 該当なし |
| BPH | 2(4.6%) | 2(4.5%) | n / s |
| 薬、n(%) | |||
| Β遮断薬 | 2(4.6%) | 1(2.3%) | 該当なし |
| ECAi | 1(2.3%) | 0 | 該当なし |
| ARB | 11(25.6%) | 7(15.9%) | n / s |
| ループ利尿薬 | 1(2.3%) | 0 | 該当なし |
| チアジド系利尿薬 | 4(9.3%) | 1(2.3%) | 該当なし |
| CCB | 2(4.6%) | 2(4.5%) | n / s |
| スタチン | 8(18.6%) | 8(18.2%) | n / s |
| その他 | 0 | 0 | 該当なし |
| アスピリン | 0 | 1(2.3%) | 該当なし |
| クロピドグレル | 0 | 0 | 該当なし |
| ワルファリン | 0 | 0 | 該当なし |
| Xa因子阻害剤 | 0 | 0 | 該当なし |
| 直接トロンビン阻害剤 | 0 | 0 | 該当なし |
| ヘパリン | 0 | 0 | 該当なし |
| メトホルミン | 10(23.3%) | 6(13.6%) | n / s |
| GLP1R類似体 | 2(4.6%) | 3(6.8%) | 該当なし |
| SGLT2阻害剤 | 7(16.3%) | 3(6.8%) | n / s |
| DPP4阻害剤 | 2(4.6%) | 1(2.3%) | 該当なし |
| Sylfonylureas | 0 | 0 | 該当なし |
| グリタゾン | 0 | 0 | 該当なし |
| アカルボース | 0 | 0 | 該当なし |
| インスリン | 0 | 0 | 該当なし |
| オルリスタット | 2(4.6%) | 2(4.5%) | 該当なし |
| レボチロキシン | 1(2.3%) | 4(9.1%) | 該当なし |
| リオチロニン | 1(2.3%) | 0 | 該当なし |
| テストステロン | 7(16.3%) | 6(13.6%) | n / s |
| アロマターゼ阻害剤またはSERM | 2(4.6%) | 2(4.5%) | n / s |
| 催眠薬 | 3(7.0%) | 1(2.3%) | 該当なし |
| SSRI | 3(7.0%) | 6(13.6%) | n / s |
| その他の抗うつ薬とユーモア安定剤 | 4(9.3%) | 4(9.1%) | n / s |
| ベンゾジアゼピン | 1(2.3%) | 0 | 該当なし |
| 非定型抗精神病薬 | 3(7.0%) | 2(4.5%) | 該当なし |
| CNS覚醒剤 | 5(11.6%) | 5(11.4%) | n / s |
| Alpha-1アドレナリン遮断薬 | 2(4.6%) | 2(4.5%) | n / s |
| GnRHアナログおよび阻害剤、NSAAおよびその他の抗アンドロゲン | 0 | 0 | 該当なし |
| オメガ3 | 3(7.0%) | 1(2.3%) | 該当なし |
| ビタミンD | 13(30.2%) | 15(34.1%) | n / s |
| 亜鉛 | 6(13.9%) | 7(15.9%) | n / s |
| ビオチン | 1(2.3%) | 0 | 該当なし |
| ビタミンC | 8(18.6%) | 7(15.9%) | n / s |
| マルチビタミン | 1(2.3%) | 2(4.5%) | 該当なし |
| ワクチンとライフスタイル、n(%) | |||
| BCGワクチン | 43(100%) | 44(100%) | n / s |
| インフルエンザワクチン(2020年) | 14(32.6%) | 14(31.8%) | n / s |
| 肺炎球菌ワクチン(2017年以降) | 3(7.0%) | 5(11.4%) | n / s |
| 現在の喫煙 | 2(4.6%) | 2(4.5%) | 該当なし |
| 定期的な身体活動 | 28(65.1%) | 32(72.7%) | n / s |
| 追加のCOVID-19治療、n(%) | |||
| イベルメクチン | 6(13.9%) | 6(13.6%) | n / s |
| ヒドロキシクロロキン | 4(9.3%) | 3(6.8%) | n / s |
| Xa因子阻害剤 | 8(18.6%) | 3(6.8%) | n / s |
| エノキサパリン | 3(7.0%) | 3(6.8%) | n / s |
| 糖質コルチコイド | 6(13.9%) | 7(15.9%) | n / s |
| ビタミンC | 4(9.3%) | 4(9.1%) | n / s |
| 亜鉛 | 3(7.0%) | 3(6.8%) | n / s |
| ビタミンD | 1(2.3%) | 2(4.5%) | 該当なし |
| コルヒチン | 0 | 0 | 該当なし |
| ブロムヘキシン | 0 | 0 | 該当なし |
| N-アセチルシステイン | 0 | 0 | 該当なし |
表2は、デュタステリドを服用した男性とプラセボを服用した男性における、主要な臨床症状の平均寛解までの期間、寛解までの全期間、Day1,Day2,Day3,Day7の疾患の重症度に関する患者報告アウトカム評価、Day0,Day7,Day14の酸素飽和度を示している。
表2 臨床結果
SD:標準偏差、n/s:有意でない
| プラセボ群(n = 44) | デュタステリド基(n = 43) | P値 | |
| 寛解までの時間、日数、平均(±SD) | |||
| 倦怠感 | 10.3(±8.4) | 5.5(±3.2) | <0.001 |
| 味覚または嗅覚の喪失(味覚消失または無嗅覚症) | 11.1(±6.6) | 5.6(±4.0) | <0.001 |
| 寛解から味覚または嗅覚の喪失を差し引いたもの | 11.7(±7.7) | 7.0(±2.9) | <0.001 |
| 全体的な症状 | 16.3(±8.3) | 9.2(±4.3) | <0.001 |
| 臨床的回復、平均(±SD) | |||
| %7日目に完全に臨床的に回復 | 57.5% | 84.1% | 0.03 |
| 1日目の臨床回復の% | 34.2(±21.4) | 60.4(±24.2) | <0.0001 |
| 2日目の臨床回復の% | 52.9(±21.3) | 78.5(±17.8) | <0.0001 |
| 3日目の臨床回復の% | 66.8(±20.7) | 89.2(±12.3) | <0.0001 |
| 7日目の臨床回復の% | 82.9(±15.0) | 97.4(±5.7) | <0.0001 |
| 酸素飽和度、平均(±SD) | |||
| 0日目 | 95.4±1.4 | 96.0±1.5 | n / s(.21) |
| 7日目 | 95.7±2.0 | 97.0±1.4 | 0.02 |
| 14日目 | 96.2±1.4 | 97.5±1.2 | 0.0012 |
| D 7-0日目 | +0.3 | +1.3 | 0.047 |
| D 14-0日目 | +0.9 | +1.3 | n / s(.25) |
疲労回復の平均寛解期間(±SD)は、デュタステリド群が5.5(±3.2)日であったのに対し、プラセボ群は10.3(±8.4)日であり(p<0.001)46.6%の短縮が認められた。味覚・嗅覚障害の平均寛解期間は、デュタステリド群5.6(±4.0)日に対し、プラセボ群11.1(±6.6)日(p<0.001)であり、49.6%の短縮が認められた。完全寛解までの期間は、デュタステリド群9.2(±4.3)日に対し、プラセボ群16.3(±8.3)日(43.2%減、p<0.001)であった。アノスミア(嗅覚脱失)とエージスミアを分析から除外すると、完全寛解までの平均日数はデュタステリド群7.0(±2.9)日に対してプラセボ群11.7(±7.7)日(43.6%減、p<0.001)であった。
ベースライン(0日目)と比較すると、1日目、2日目、3日目、7日I-RECOVERレベルは、デュタステリド群がプラセボ群に比べて有意に改善した(すべての回でp<0.0001)。7日目にまだ影響を受けている患者の割合は、デュタステリド群で15.9%、プラセボ群で42.5%であった。
平均酸素飽和度は、Day7(p=0.02)およびDay14(p=0.0012)においてデュタステリド群で高く、ベースライン(Day0)からDay7までの酸素飽和度の上昇レベルも同様であった(p=0.047)。
表33は、評価したウイルス学的および生化学的パラメータを示したもので、7日目および14日目にRT-PCR-SARS-CoV-2が陰性となった被験者の割合,0日目、7日目、14日目のusCRP、乳酸、ESR、LDH、超高感度トロポニン、Dダイマー、フェリチンのレベルを含む。ベースライン(0日目)と7日目およびベースライン(0日目)と14日目の間の変化、ベースライン(0日目)と7日目およびベースライン(0日目)と14日目の間に各パラメータの特定の目標を達成した男性の割合。
表3 生化学的結果
IQR:四分位範囲、n/s:有意でない、n/a:該当なし、RT-PCR:逆転写ポリメラーゼ連鎖反応、usCRP:超高感度C反応性タンパク質、ESR:赤血球沈降速度、LDH:乳酸脱水素酵素
| プラセボ群(n = 44) | デュタステリド基(n = 43) | P値 | |
| RT-PCR-SARS-CoV-2寛解(CT> 40サイクル)(%) | |||
| 0日目 | 0% | 0% | n / s(1.00) |
| 7日目 | 11.8% | 64.3% | .0094 |
| 14日目 | 54.2% | 88.3% | .036 |
| usCRP(mg / L)、中央値(IQR) | |||
| プレCOVID | 0.18(0.08-0.41) | 0.38(0.10-0.56) | n / s(.45) |
| 0日目 | 1.44(0.72-2.54) | 1.22(0.83-2.26) | n / s(.42) |
| 7日目 | 1.47(0.70-3.37) | 0.34(0.23-0.66) | <0.0001 |
| 14日目 | 0.39(0.21-2.32) | 0.36(0.08-0.34) | 0.0026 |
| D 7-0日目 | -64.7% | -83.9% | 該当なし |
| D 14-0日目 | -73.3% | -93.7% | 該当なし |
| 乳酸塩(mmol / L)、中央値(95%CI) | |||
| プレCOVID | 0.93(0.82-1.18) | 0.88(0.72-1.23) | n / s(.58) |
| 0日目 | 1.72(1.35-2.11) | 1.51(1.16-2.01) | n / s(.27) |
| 7日目 | 2.66(2.05-3.55) | 2.01(1.12-2.43) | 0.0049 |
| 14日目 | 1.92(1.38-2.89) | 1.48(1.22-1.89) | 0.014 |
| D 7-0日目 | +0.97(+ 0.57- + 1.69) | +0.28(+ 0.02- + 0.85) | 0.025 |
| 乳酸の増加 | 19.2% | 60% | 該当なし |
| D 14-0日目 | +0.22(-0.64- + 0.79) | -0.19(-1.15- + 0.27) | n / s(.24) |
| 0日目から14日目までの乳酸の増加<0.5mmol / L | 67.8% | 83.3% | 該当なし |
| ESR(mm / 1h)、中央値(IQT) | |||
| プレCOVID | 4.5(2.25-8.0) | 4.0(2.0-7.0) | n / s(.76) |
| 0日目 | 13.5(7.0-22.5) | 13.0(6.5-22.0) | n / s(.69) |
| 7日目 | 14.0(7.25-18.5) | 5.0(3.0-11.0) | 0.0007 |
| 14日目 | 11.5(6.5-18.0) | 4.0(3.0-5.0) | <0.0001 |
| D 7-0日目 | -4.0(-6.75- + 4.5) | -8.0(-13.0 — 1.0) | 0.017 |
| 0日目から7日目までのESRの減少> 10 mm / 1h | 16.1% | 41.4% | 該当なし |
| D 14-0日目 | -4.5(-11.0- + 4.25) | -11.5(-19.25 — 2.75) | 0.003 |
| 0日目から14日目までのESRの減少> 10 mm / 1h | 30% | 59.4% | 該当なし |
| LDH(U / L)、中央値(95%CI) | |||
| プレCOVID | 175(158-211) | 183(156-199) | n / s(.76) |
| 0日目 | 207(175-234) | 200(172-222) | n / s(.69) |
| 7日目 | 210(179-249) | 165(144-198) | 0.0013 |
| 14日目 | 177(154-202) | 147(135-160) | 0.0004 |
| D 7-0日目 | +4(-32.5- + 40.25) | -21(-53- + 18) | 0.087 |
| 0日目から7日目までの間に> 30 U / LのLDH減少 | 26.5% | 50.0% | 該当なし |
| D 14-0日目 | -26(-68–10) | -35(-76–15) | n / s(.31) |
| 0日目から14日目までの間に> 30 U / LのLDH減少 | 46.4% | 64.3% | 該当なし |
| 超高感度トロポニン(ng / mL)、中央値(IQR) | |||
| プレCOVID | 該当なし | 該当なし | 該当なし |
| 0日目 | 0.008(0.005-0.012) | 0.010(0.008-0.015) | n / s(.23) |
| 7日目 | 0.007(0.006-0.010) | 0.005(0.003-0.009) | 0.048 |
| 14日目 | 0.005(0.004-0.008) | 0.004(0.003-0.005) | n / s(.14) |
| D 7-0日目 | -0.003(-0.005-0) | -0.004(-0.007 — 0.003) | 0.094 |
| 0日目から7日目までのトロポニンの減少> 0.003 ng / mL | 52.8% | 80% | 該当なし |
| D 14-0日目 | -0.003(-0.007 — 0.001) | -0.007(-0.011 — 0.004) | .16 |
| 0日目から7日目までのトロポニンの減少> 0.005 ng / mL | 33.3% | 66.7% | 該当なし |
| D-ダイマー(ng / mL)、中央値(95%CI) | |||
| プレCOVID | 343(215-427) | 366(255-438) | n / s(1.00) |
| 0日目 | 404(289-575) | 406(266-584) | n / s(.77) |
| 7日目 | 310(220-495) | 189(242-373) | n / s(.29) |
| 14日目 | 305(216-420) | 220(200-306) | .019 |
| D 7-0日目 | -80(-182- + 52) | -104(-190 — 35) | n / s(.30) |
| 0日目から7日目までのD-ダイマーの減少 | 63.6% | 84.2% | 該当なし |
| D 14-0日目 | -70(-241- + 31) | -137(-325–16) | n / s(.20) |
| 0日目から7日目までのD-ダイマーの減少> 100 ng / mL | 42.8% | 61.6% | 該当なし |
| フェリチン(ng / mL)、中央値(IQR) | |||
| プレCOVID | 173(133-241) | 190(113-310) | n / s(.61) |
| 0日目 | 389(295-588) | 471(279-584) | n / s(.85) |
| 7日目 | 321(248-476) | 310(198-476) | n / s(.41) |
| 14日目 | 240(186-377) | 241(180-352) | n / s(.66) |
| D 7-0日目 | -83(-139 — 52) | -68(-214 — -9) | n / s(.99) |
| D 14-0日目 | -128(-262 — 72) | -135(-289 — 55) | n / s(.82) |
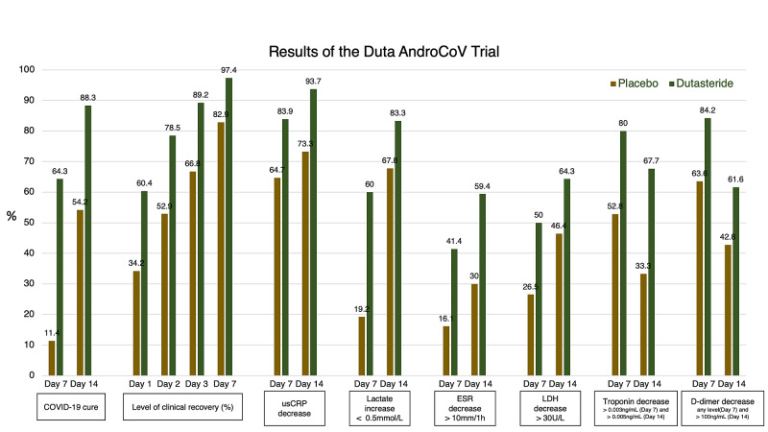
7日目において,デュタステリド群の64.7%の男性とプラセボ群の11.8%の男性で,鼻咽頭のSARS-CoV-2ウイルスまたはウイルス断片が検出されなかった(デュタステリドを追加したことにより,Day 7でウイルス学的に寛解した被験者の割合が444.9%増加した;p=0.0094).14日目には,デュタステリド群の88.3%,プラセボ群の54.2%でSARS-CoV-2が検出されなかった。
7日目のusCRPの中央値はデュタステリド群で0.34mg/L、プラセボ群で1.47mg/Lであった(p<0.0001)。14日目、usCRPの中央値は、デュタステリド群で0.36,プラセボ群で0.39であった(p=0.0026)。ベースライン値と比較して、7日目にはデュタステリド群の83.4%、プラセボ群の64.7%、14日目にはデュタステリド群の93.7%、プラセボ群の73.3%の男性でusCRPが低下した。
7日目(p=0.0049)および14日目(p=0.014)の乳酸値は、デュタステリド群がプラセボ群よりも低かった。ベースライン(0日目)から7日目までの増加量が0.5mmol/L未満という目標は、デュタステリド群では60%、プラセボ群では19.2%の被験者が達成した(p=0.007)。
ESRの中央値は、7日目にデュタステリド群で5.0mm/1h、プラセボ群で14.0mm/1h(p=0.0007)14日目にデュタステリド群で4.0mm/1h、プラセボ群で11.5mm/1h(p<0.0001)であった。第0日から第7日までの間にESRが10mm/1h以上低下したのは、デュタステリド群では41.4%、プラセボ群では16.1%であった。ベースライン(0日目)から7日目までにESRが10mm/1h以上減少するという目標は、デュタステリド群では59.4%、プラセボ群では30.0%の男性が達成した。LDH値は、7日目(p=0.0013)および14日目(p=0.0004)において、デュタステリド群がプラセボ群よりも統計的に低かった。
超高感度トロポニン値は、7日目にデュタステリド群(中央値:0.005ng/mL)がプラセボ群(中央値:0.007ng/mL)に比べて有意に低かった(p=0.048)。超高感度トロポニン値をベースライン(0日目)から7日目までの間に0.003ng/mL以上減少させるという目標は、デュタステリド群では80%、プラセボ群では52.8%が達成した。超高感度トロポニン値は、デュタステリド群の66.7%、プラセボ群の33.3%で0.005ng/mL以上減少した。
D-ダイマー値の差は14日目にのみ認められ、D-ダイマーの中央値はデュタステリド群で220ng/mL、プラセボ群で305ng/mLであった(p=0.019)。フェリチン値およびベースライン(0日目)7日目、14日目の間の変化は、すべての時期および間隔においてデュタステリド群とプラセボ群で同様であった。
プラセボ群44名、デュタステリド群43名のうち、ニタゾキサニドの使用による尿や精子の色や様相の変化を除く、少なくとも1つの副作用を報告したのは17名(38.6%)と14名(32.5%)であった。副作用はすべてグレード1および2に分類され、重篤な副作用(SAE)は報告されなかった。さらに、副作用のために治療を中断した患者はいなかった。最も多かった副作用は、下痢(それぞれ12名と11名)と吐き気(それぞれ7名と6名)であった。入院、機械的換気、死亡は報告されなかった。図2は、本研究の主な臨床的および生化学的所見をまとめたものである。
図2 EAT-DUTA AndroCoV-Trialの主な臨床・生化学的結果
EAT-DUTA AndroCoV: Early Antiandrogen Treatment With Dutasteride for COVID-19; usCRP: ultrasensitive C-reactive protein; ESR: erythrocyte sedimentation rate; LDH: lactate dehydrogenase
考察
COVID-19に対する有効な治療法を特定することは、COVID-19パンデミックとの戦いにおける優先事項である。現在までに、COVID-19治療の初期段階における介入を検証する研究はほとんど行われていない。COVID-19に対する薬理学的介入に関する大規模なRCTの大半は、抗ウイルスアプローチの時期が適切でなくなった疾患の後期に実施された。これらの制限により、これまでのほとんどの薬剤レジメンの有効性に関する決定的な知見を得ることができなかった。
本研究のウイルス学的および生化学的サブセット(n=87)は、RCT対象者全体(n=130)を代表するものであり、両者は、症状期間および寛解までの全期間が40%から50%短縮され、回復の違いが初日に早くも検出され、対照群に比べて2倍の速さで回復するなど、同様の反応パターンを示した。また、7日後に症状が残っている人は、デュタステリド群ではプラセボ群の3倍も少なかった。また、酸素飽和度についても、デュタステリド群の方が回復速度が速かった。
COVID-19のウイルス寛解は、RT-PCR-SARS-CoV-2が陰性であることで判断できる。ウイルスが検出されても、必ずしも生存しているウイルスの存在を反映しているとは限らないため、COVID-19の確認後に陰性の結果が得られれば、ほぼ100%の確率で治癒すると考えられる。デュタステリド投与群では、プラセボ投与群と比較して、7日目にCOVID-19が治癒した男性が約5倍以上、14日目にRT-PCRが陽性を維持した男性がデュタステリド投与群と比較して4倍以上であった。この大幅な差は、COVID-19の初期におけるデュタステリドの抗ウイルス活性を示す圧倒的な証拠となる。
SARS-CoV-2に対する炎症反応に関連する生化学的パラメータの減少(デュタステリド群におけるusCRP、乳酸、ESR、LDHレベルの減少など)は、COVID-19の治療におけるデュタステリドの保護的役割のさらなる証拠となる。いずれの群でも炎症は明らかに検出されなかったが、炎症状態への進行が阻止されたことが疾患期間の短縮に寄与したと考えられる。実際、生化学的所見は、デュタステリド群における症状の改善と回復率という患者報告の結果を裏付けるものであった。
全体的に、14日目よりも7日目の方が差が大きかったことから、デュタステリドの重要な影響はCOVID-19寛解のスピードを上げることであるという仮説を立てることができる。さらに、治療開始後のウイルス感染期間が短縮され、その結果、活動への復帰が早まったという効果もあった。
アンドロゲンは、循環しているものと組織で産生されるものがあるが、AGAや前立腺肥大症、前立腺がんに関与する組織のDHTの上昇やAR感受性は、循環アンドロゲン値よりもCOVID-19の重症度を予測するのに適していると考えられる。デュタステリドに対する血清テストステロンおよびDHTの変化は、早ければデュタステリド投与開始後1~2日で起こり、これは今回のRCTの期間よりも短いものである[19]。さらに、これらのホルモンの細胞内および組織内濃度は、血清中で観察される変化よりも早く発生し[20]、最終的にTMPRSS-2の発現を急速に減少させることから、本研究で観察されたデュタステリドの有効性の説明に役立つと考えられる。
今回の結果は、我々の観察研究(Pre-AndroCoV Trial)[21]の結果を補強するものであり、アジスロマイシンとヒドロキシクロロキン、イベルメクチン、ニタゾキサニドのいずれかを併用した患者において、デュタステリド0.5mg/日またはスピロノラクトン100mg/日×2回による早期の抗アンドロゲン療法が臨床およびウイルス学的転帰を改善することが示された。
デュタステリドを単独で使用した場合、COVID-19に対して有効であるかどうかは、可能性は高いものの、不確実である。デュタステリドを慢性的に使用した場合、COVID-19の重症度を低下させる保護的役割を果たすことが示唆されている。入院中の男性を対象としたCOVID-19に関する以前の観察的前向き研究では、デュタステリドを慢性的に使用している人は、高齢で心疾患の併存が多いにもかかわらず、集中治療室に入院する機会が減少していることが観察されている[6]。異なる薬剤の併用が相乗的に作用するという仮説は、複雑なSARS-CoV-2の病原性と感染性の作用機序の理論的根拠に沿ったものである。
デュタステリドの使用による回復速度の向上は、対象者の大半が医療支援を求めるCOVID-19の初期段階の後期に相当する、症状開始後4~7日目の患者に特に有効であると考えられる。この期間にCOVID-19が検出された場合、炎症段階や急性肺傷害への進行を避けるために、治療的介入により迅速な対応が必要である。
本研究では、無作為化二重盲検プラセボ対照介入試験において、包括的で強力な5ARiであるデュタステリドを投与した男性が、ニタゾキサニドおよびアジスロマイシンのみを投与した場合と比較して、COVID-19によって誘発されるウイルス量、臨床症状、疾患経過、および炎症反応が減少することを示した。低用量、他の5ARi、または他の抗アンドロゲンで同様の結果が得られるかどうかは不明である。女性に対する安全性プロファイルの欠如と有効性の不確実性から、女性を対象とした特定のRCTが実施されるまで、この集団に対するデュタステリドの使用は推奨しない。
「新規の非ステロイド性抗アンドロゲン(NSAA)であるプロキサルタミドのような強力な抗アンドロゲンは、COVID-19の治療にさらなる効果をもたらす可能性があり、現在、我々のグループが二重盲検プラセボ対照RCTで研究を行っている」と述べている。
結論
今回の無作為化二重盲検プラセボ対照臨床試験の結果から、COVID-19に対してニタゾキサニドとアジスロマイシンにデュタステリドによる早期抗アンドロゲン療法を追加することで、ニタゾキサニド+アジスロマイシン単独の治療と比較して、SARS-CoV-2ウイルスの排出量を効果的に減少させ、臨床症状を改善し、炎症反応を予防できることが示唆された。