Contents
pubmed.ncbi.nlm.nih.gov/33243230/
公開: 2020年11月26日
要旨
ヒトをはじめとする哺乳類は、細菌、古細菌、真菌や原生動物のような単細胞真核生物、蠕虫類のような多細胞真核生物、ウイルスなど、ある種の微生物によって植民地化されており、これらは全体として微生物相と呼ばれている。これらの微生物は、互いに複数の異なる種類の相互作用を持っている。これらの微生物は、免疫系や消化器系を調節したり、精神疾患、心血管疾患、代謝疾患、皮膚疾患などの様々な疾患に関与していることが多くのエビデンスから示唆されている。
さらに、彼らは糖尿病、肥満、癌や感染症のようないくつかの現在の健康問題で役割を果たしている。ウイルス感染症は、特に近年、SARSやCOVID-19のようなパンデミックが世界に多くの財政的、物理的な被害をもたらしたことで、最も一般的で問題のある健康管理の問題の一つである。
マイクロバイオータと感染症の相互作用を調査した論文は数知れず。私たちは、このパンデミックを克服するための解決策を見つけたいと考え、ウイルス感染症に対する微生物の刺激効果と抑制効果に着目した。次に、ほとんどのウイルスに対するマイクロバイオータとプロバイオティクスの両方の効果を機械論的に検討した。
しかし、これまでの腸内細菌叢と感染症に焦点を当てた研究とは異なり、呼吸器系の微生物叢と呼吸器ウイルス感染症に焦点を当て、呼吸器系はウイルスの適切な侵入場所であり、感染することで無症状、軽度、自己限界、重度、さらには致死的な感染症を引き起こす可能性があることを念頭に置いている。
最後に、COVID-19感染に対する微生物叢の影響を過大評価した。また,コロナウイルスに対する微生物叢の影響に関する論文をレビューし,新たな治療法を提案した。
序論
哺乳類の動物種やヒトは、微生物群と呼ばれる微生物によって植民地化されている。この微生物群には、細菌、古細菌、真菌、原虫、蠕虫類、ウイルスなどが含まれる[1]。これらの微生物は、消化器系[2]、口腔咽頭や呼吸器系[3]、泌尿器系や膣[4]、皮膚のいたるところに生息している[5]。ヒトの体内には、数多くの種類の微生物がコロニー化している。例えば、私たちが知る限りでは、人間の消化管遠位部には10~100兆個の微生物細胞と1000種以上の異なる細菌が生息している[6, 7]。その起源については、多くの論文によると、微生物のコロニー化は出生後すぐに始まるとされている[8]。
微生物相の形成にはいくつかの段階があり、最初は妊娠中、体重増加や代謝・ホルモン変化などの生理的変化の間 [9]、そして新生児が膣内の正常な細菌叢に直接さらされる経膣分娩の間である。その結果、母体のマイクロバイオータと子のマイクロバイオータとの間に類似性が生じる。分娩様式によって、帝王切開分娩で生まれた新生児の微生物分布は皮膚のそれに似ており、経膣分娩で生まれた新生児の微生物分布は健康な膣のそれに似ているという違いがある[8, 10]。
第三段階は搾乳期である。母乳には約10^9個/Lの細菌細胞が含まれており、母体から子供へと健康なマイクロバイオームが伝達され、病原体と競合して乳児の免疫力を高める[9,10,11]。そして、このマイクロバイオームは、犬種、家族、地理的・社会経済的要因、食事や栄養、栄養補助食品、運動、抗生物質などの薬物、年齢、炎症性疾患、糖尿病、ストレス関連要因[12]、そして最終的には遺伝的要因などのいくつかの要因の影響を受けて、徐々に成人期のマイクロバイオームへと変化していく[13,14,15,16]。例えば、双子を対象とした研究では、ビフィズス菌とラクターゼ(LCT)遺伝子座との関連や、宿主遺伝子ALDH1L1と細菌SHA-98との相関が明らかにされている[14]。
しかし、注意すべきは、遺伝的要因の役割が有意ではないかもしれないことを示唆する論文がほとんどないことである[17]。多くの論文では、人は誰でも特殊な微生物スペクトルを持っていることが示されている。一卵性双生児の間にも違いがあり、それは微生物のフィンガープリントと考えることができる[9, 14, 18]。
微生物相はまた、自身の間に複数の刺激的または抑制的相互作用を持っており、例えば、抑制効果としては、ある種の増殖抑制物質の産生を介して他の香辛料に影響を与える鼻腔ブドウ球菌種のように直接的に、または間接的に、栄養源、酸素、植民地の場所などの異なる供給源を巡って競い合っている[20]。さらに、これらの香辛料は互いに刺激的で相乗的な効果を持っている[1]。
微生物と宿主の相互作用
微生物は、ホメオスタシス、代謝、免疫、癌のような生理的または病理学的状況において、二重の重要な役割を果たしており、様々な病状を緩和したり、悪化させたりすることがある[21]。そこでここでは、ウイルス感染症に特別な注意を払いながら、さまざまな身体システムへの影響に基づいて、さまざまな疾患の病態生理への影響を分類してみた。
微生物相と免疫系
微生物相と免疫系は、いくつかの異なるメカニズムと段階を経てコミュニケーションを行っている。最初に、微生物はα-デフェンシン、分泌性IgAおよびその他のAMP(抗菌ペプチド)を誘導し、それによって自然免疫系のリンパ球に影響を与えるが、主にToll様受容体(TLR)やNOD様受容体(NLR)などの上皮細胞やマクロファージ細胞の受容体に影響を与えて自然免疫系や適応免疫系に影響を与える。TLRRは、腸の正常な粘膜免疫系の発達に関与し、炎症反応を減少させ、正常なマイクロバイオータ成分に対する免疫学的耐性を促進する。NLRは、IL-18レベルの調整、免疫応答、ジスビオーシスおよび腸の過形成に関与している[22,23,24,25,26]。これらの受容体に結合した微生物抗原は、デフェンシンのようないくつかの抗菌物質を産生するシグナル伝達経路のカスケードを開始し、Tヘルパー1や17のようないくつかのグループやサブタイプのT細胞を刺激してIL-1,IL-2,IL-15,IL-17,IL-22,IL-23を産生し、またB細胞に影響を与えて様々な抗体を産生する[25,26]。その結果、微生物叢と免疫系のバランスが変化すると、感染症[27]、炎症[28, 29]、アレルギー、口腔がんや大腸がんなどの各種がん[30, 31]、自己免疫[32]、IBD、1型糖尿病、肝疾患などの内分泌疾患を引き起こす可能性があるが、これらは「消化器系疾患」の項で詳しく説明する。一般的に、マイクロバイオームは樹状細胞、上皮細胞、ILC、T調節細胞、エフェクターリンパ球、NKT細胞、B細胞に影響を与えている[33]。
マイクロバイオータと代謝
微生物、特に腸内微生物が体の代謝に与える影響については、無菌・正常な微生物群をコロニー化した動物やヒトとの比較や、腸内培養モデルを用いた試験管内試験研究などで多くの論文がある。微生物は、ヒトゲノムにはコードされていない酵素を持っているが、生理的な役割を果たしたり、多糖類やポリフェノールなどの物質を分解したり、ビタミンの合成を助けたりする消化酵素に寄与するために必要な酵素を持っている。これによると、微生物は体のエネルギーバランスや細胞の代謝を調節することができる[34,35,36]。
微生物とがん
微生物は、様々な方法で癌に影響を与えることができる。その中には、がんを誘発するものもあれば、悪性腫瘍を予防するものもあり、その他のものはがんに影響を与えない。発がん性微生物は、3つのメカニズムを介して発がんに貢献している。
- 第一に、炎症性物質の放出を刺激して炎症を引き起こし、細胞の増殖や突然変異を促進し、癌遺伝子や血管新生を活性化させる。
- 第二に、NF-κB活性化を介して細胞のアポトーシスを抑制する。
- 第三に、発がん性物質の産生を誘導する[37]。
一方、宿主の発がんに対する防御効果を持つ微生物群は、栄養物質の解毒による悪性化の防止、炎症の抑制、宿主細胞の増殖調節に関与している[38]。例えば、上部消化管の微生物密度が低いと、食道や胃でがんを発症しやすい状態になる可能性がある[39]。他にも、口腔がん[40]、大腸がん[41]、肺がん[42]などとの関連を示す研究がある。また、プロバイオティクスは、いくつかの癌の診断や治療にも使用することができる[38, 43]。さらに、プロバイオティクスは、化学療法や放射線療法とともに、体内の粘膜に定着し、腫瘍の発生に対して作用する外来細菌を処方することができる[44]。
消化器系
いくつかの研究では、腸内細菌叢が腸の運動性に役割を果たし、いくつかのメカニズムを介して、炎症性腸疾患(IBD)過敏性腸症候群(IBS)結腸癌、抗生物質関連下痢などの消化管疾患や状態の幅広いスペクトルを誘発したり、悪化させたりすることが示唆されている[45, 46]。また、Christoph A. Thaissらは、概日時計の乱れに続く生活習慣の乱れが、糖尿病、炎症性腸疾患、および癌のようないくつかの代謝性および炎症性疾患につながることを実証している[47,48,49]。
さらに、腸内微生物叢と、心血管疾患や血圧調節、肝疾患(慢性肝炎症、非アルコール性脂肪肝、非アルコール性脂肪肝炎など)膵臓疾患など、腸とは関係のない他の疾患との関連性を示す論文もある[7, 26, 46, 50]。
新しい研究では、マイクロバイオータと肥満と糖尿病との関連が明らかにされた[51,52]。例えば、Martinらは、微生物叢とその生産物の一部が粘膜内でシグナル伝達メッセージを誘導できることを発見した。腸内分泌細胞は、CCK、PYY、GLP-1,GIP、および5-HTのようないくつかのホルモンを放出し、それによってインスリン感受性、耐糖能、脂肪貯蔵、および食欲のような代謝プロセスを調整することができる。
これは、肥満や痩身における微生物の役割を説明することができる[53]。彼らは、腸管透過性、分子模倣のような異なるメカニズムを介して、または自然免疫系または適応免疫系の変化を誘導することによって、その効果を誘導することができる。また、彼らは1型と2型糖尿病の両方を診断し、治療するために有益であることができる[54,55,56,57,58,59,60]。
神経系
微生物相、特に腸内細菌相は、多くの神経系、内分泌系、免疫系の経路を介して神経系と密接な相互関係を持っている。腸内細菌叢は中枢神経系と神経回路系に影響を与え、ENS(腸管神経系)の成熟に重要な役割を果たしている[61]。
例えば、腸-脳軸と呼ばれる脳との相互通信がある。腸管神経系と中枢神経系はともにその影響下にある。これにより、パーキンソン病、アルツハイマー病[62]、統合失調症[63]、多発性硬化症[64]、行動病[65]、不安症、うつ病[66]などの中枢神経系疾患に関与している。さらに、新生児のENS形成には微生物群が役割を果たしている[67, 68]。
最後に、血圧調節や病態形成に関与する交感神経系への影響を示す研究もある[69]。結論から言うと、最終的には中枢神経系(中枢神経系)自律神経系(ANS)腸管神経系(ENS)視床下部下垂体副腎(HPA)軸の間にネットワークが存在する。このネットワークは、腸と神経系を、求心性および求心性の自律神経経路を介して結びつけている[68]。
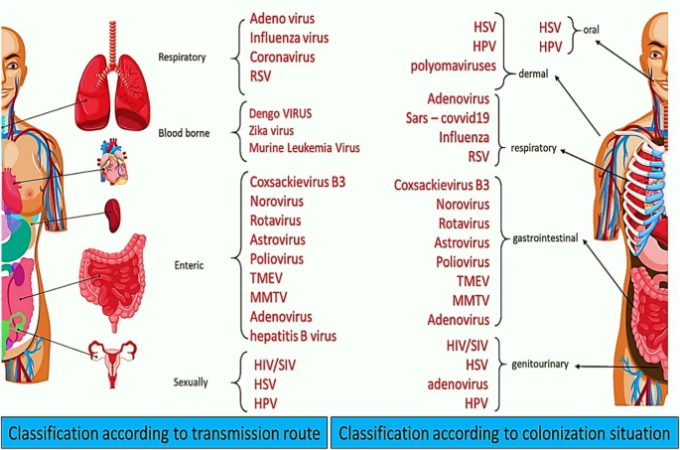
呼吸器系
数年前までは、肺は体の無菌部分として知られており、細菌の痕跡さえも検査ミスだと考えられてた。しかし、最新の技術により、肺には独自のマイクロバイオームがあり、そのマイクロバイオームの影響を受けていること、さらには腸などの他の部位のマイクロバイオームの影響を受けていることが明らかになった。
そのため、これらのマイクロバイオームが肺の健康や病理に及ぼす影響についての知識を得ることが、科学者の注目の的となっている。健康な肺の微生物群は、プレボテラ、ストレプトコッカス、ヴェイロネラ、フソバクテリウム、ヘモフィルスで構成されている。これらの微生物は、鼻、口、咽頭などの上気道から微小呼吸を経て、睡眠中に下気道や肺に移動していく。その後、宿主の免疫系と遭遇し、そのバランスが保たれている[70]。
呼吸器マイクロバイオームの形成は、遺伝的要因、分娩様式、乳児への給餌、抗生物質の投与、薬やワクチンの投与、地理的、季節的な違いなどの複数の要因の影響を受けている[71]。さらに、呼吸器疾患の一部にも役割がある。例えば、嚢胞性線維症(CF)特発性肺線維症、気管支拡張症では、下気道の細菌の多様性が増加し、一方では、緑膿菌、黄色ブドウ球菌、ブルケルデリア菌のような特定の細菌が特定の疾患で検出されている。
また、消化器疾患と呼吸器系との間には関連性がある。例えば、微生物叢の発生源による炎症性腸疾患(IBD)は、腸の障害を誘発する呼吸器疾患として呼吸器系の障害を誘発する可能性がある[70, 72, 73, 74, 75]。最近の研究では、免疫系、代謝、神経調節に重要な役割を果たす鼻咽頭、口腔咽頭、肺のマイクロバイオームが、慢性閉塞性肺疾患(腸内細菌叢に由来する)[76]、喘息[77]、嚢胞性線維症[78]、肺炎[79]、上気道感染症[80]などのいくつかの呼吸器疾患において、その質や量が変化することが示唆されている。
別の例として、一方では、呼吸器系マイクロバイオータは、吸入された毒素または汚染物質に対する感受性の理由となる傾向があり、他方では、いくつかの呼吸器系マイクロバイオータは、吸入された汚染物質を代謝し、暴露に対する宿主の炎症反応を抑制する可能性さえある。さらに、それらの組成は、それぞれの条件や疾患の下で変化する[81]。消化器癌に対する腸内細菌叢の影響を示す多くの研究があるが、肺癌に対する呼吸器微生物叢の役割を調査した研究はほとんどない。
微生物相と感染症
マイクロバイオータが宿主の健康状態に果たす役割や、様々な病原体への影響についての理解が深まってきている。微生物は、病原体のコロニー化抵抗性(病原体に対するバクテリオシンのような殺菌成分を分泌しながら、病原体と場所や栄養分の付着を競い合う)を介して病原体の活動を抑制したり、免疫細胞の分化に寄与することで宿主の免疫システムを強化したりすることができる。
SIGAを放出し、顆粒球/単球前駆細胞の増殖、局所自然リンパ球細胞、ミエロイド細胞の活性化、あるいは炎症性T細胞および前炎症性B細胞の両方の反応を誘導することは前述の通りである[24, 82, 83, 84, 85, 86]。さらに、これらの細胞は、二次的なリンパ組織:例えば、腸関連リンパ組織、孤立性リンパ小胞、パイエルパッチ、腸間膜リンパ節、および脾臓白髄などの拡張に寄与することができる[86]。例えば、腸内の炎症や抗生物質の枯渇は、微生物相の構成やコロニー化抵抗性を変化させ、病原体の増殖を促進する。
最近の研究では、病原菌、特にバンコマイシン耐性エンテロコッカス・フェシウム(Enterococcus faecium)グラム陰性エンテロバクテリア(Enterobacteriaceae)クロストリジウム・ディフィシル(Clostridium difficile)のような抗生物質耐性の病原菌と闘うために、常在菌叢が利用できることが示されている[24, 82, 83]。
もう一つの例は、サルモネラチフス菌の侵入に対抗するために、マイクロバイオータによってタイトジャンクションの完全性を維持することである[24]。また、病原体誘発性下痢症を治療するためにプロバイオティクスを示唆する研究もある[87]。さらに、皮膚微生物叢は、バクテリオシン(また、宿主免疫系へのシグナル分子であることができる抗菌ペプチド)を産生することによって抗菌抵抗性に寄与するいくつかのバクテリオシン産生株が含まれている。さらに、それらのいくつかは、MRSAやC. acnesのような皮膚病原体を阻害し、クリームやジェルを介して治療目的のプロバイオティクスとして使用することができる[88]。
微生物相およびウイルス
ウイルスは世界で最も一般的な病原体である。ウイルスは真核生物と原核生物の両方に感染する。ウイルスと微生物の間には、重要な相互作用があることを示唆する証拠がある。ウイルスは、組織特異性、体温、粘液バリア、IgAやディフェンシンを含む上皮分泌物、さらにはpH、酸化還元電位、リポ多糖類(LPS)糖鎖などのマイクロバイオータスの防御項目など、いくつかの障壁を克服する必要があり、最終的にはウイルスが上皮細胞表面に結合するための物理的障壁となる[89]。
いくつかの研究では、抗生物質の投与量を減らすことで、マイクロバイオータ組成のバランスを整えることで抗ウイルス反応を改善できることが実証されている。微生物相はウイルスが宿主に侵入する部位に存在することを考えると、恐らく互いに影響を与え合うことができると考えられる[90]。例えば、マイクロバイオータは、微生物や食事抗原に対するホメオスタシスの維持に寄与する大腸調節性T細胞の分化・活性化など、いくつかの方法で免疫システムの発達を決定している[91]。
図1 侵入してくる病原体の中で、ウイルスは最も一般的な病原体の一つである
ウイルス感染のメカニズムは、促進作用(直接的・間接的なメカニズムを含む)抑制作用(直接的・間接的なメカニズムを含む)そしていくつかの未知のメカニズムに分類される。一般的に、ウイルスは(HIVのような特定のウイルスであっても)ウイルス感染において二重の役割を持っている:ポリオウイルスやレオウイルスのようないくつかのウイルス感染を促進し、MMTVやインフルエンザのようないくつかの他のウイルスを抑制するか、あるいは二重の役割を持っている[90, 91]。
ウイルスが宿主の体内に侵入する方法はいくつかあるが、ほとんどすべての方法で粘膜上皮細胞を通過して微生物と遭遇する。例えば、腸管ウイルスは糞便-口腔伝搬をするので、腸内微生物叢と遭遇する。性感染ウイルスは、体内に入る前に性器微生物叢を克服しなければならない。エアロゾル感染は、上気道微生物叢に遭遇する呼吸器ウイルスに特有の方法である。
そして最後に、血液を媒介とするウイルスは節足動物によって直接体内に注入され、ベクターと播種された宿主の微生物相の両方に遭遇しなければならない[86]。ウイルス感染に対するマイクロバイオータの効果を研究するためには、2つの選択肢がある。第一に、安価で迅速な方法としてマウスの血流に抗生物質を注入することができるが、抗生物質の副作用や抗生物質耐性種を排除することができないなどの欠点がある。第二に、生まれた時から無菌状態で育てられた細菌のいないマウスを飼うことができる。この方法にもいくつかの問題点があるが、従来の方法に比べれば、より良い選択である[92]。
本研究では、この微生物群がウイルス感染症に及ぼす影響について、メカニズム論的な観点から考察していきたいと思う。
図2 微生物相を介したウイルス感染メカニズムの解明

ウイルスに対するさまざまなメカニズム
これらのメカニズムはより多くの研究が必要であるが、いくつかは理解されている。これらのメカニズムは、ウイルスとの直接結合、抗ウイルス剤の直接分泌、微生物-宿主細胞間の相互作用に起因するものの3つのグループに分けられる。例えば、産業界では乳酸菌(LAB)が知られており、その産生物(特にエキソ多糖類)は産業上の機能を持っている。さらに、これらの分泌物は、サケのウイルス感染症のようないくつかのウイルス感染症に対して作用する能力を有する。これらの分泌物は、その無害な性質のために治療的アプローチのための良い候補である[93]。抗ウイルス分泌物である乳酸菌(LAB)は、ウイルスに直接結合して水胞性口内炎ウイルス(VSV)を中和することができる免疫蛍光の陽性シグナルによって証明されている[94, 95]。
性感染症ウイルス
HIVとHSV
健康な膣内の支配的な微生物群は、主にL. acidophilus、L. Fermentum、L. Plantarum、L. Brevis、L. Jenseni、L. Casei、L. Catenaforme、L. Delbrueckii、L. Salivariusなどのラクトバチルス属で構成されている。これらの病原性嫌気性菌は、他の病原性嫌気性菌よりも優位に働き、膣の健康を維持している[96]。また、多くの研究により、膣微生物叢の変化が、ナイセリア淋病、クラミジアトラコマティス、トリコモナス膣炎などの泌尿器系感染症、さらにはヒト免疫不全ウイルス(HIV)ヒトパピローマウイルス(HPV)単純ヘルペスウイルス(HSV)サイトメガロウイルス(CMV)などのウイルス性性性感染症に影響を与えることが明らかにされており、これらは世界的に一般的な現在の健康問題である[97,98,99]。マイクロバイオータとプロバイオティクスは、それらに対して身体を保護し、さらには力を与えることができることを示す証拠がある。プロバイオティクスは、多くの産業上または医療上の消費がある生きた微生物である。プロバイオティクスは、膣の健康を維持し、STI(性感染症)から保護し、他の抗菌剤[100]と協力するなど、ホストの生殖器系にいくつかの利点を持っている。完全にプロバイオティクスは、HIVなどの病原体を抑制するための同様のメカニズムを持っている。そして、彼らは、いくつかの患者で排除され、我々は外因性のソースを介してそれらを復元した知っているまさに正常な体のマイクロバイオータである。
メカニズム
乳酸菌種の微生物がHIV予防に重要な役割を果たしていることを示唆する多くの研究がある。乳酸菌はいくつかのメカニズムを介してHIVから体を守っている。
まず、乳酸菌は発酵によりH2O2と酸性代謝物を産生し、HIVや他の病原体(Neisseria gonorrhoeae, C. Trachomatis, T. vaginalis, さらにはHSVウイルスなど)から体を守る。これらの酸性PHはウイルスおよびHIVのためのベクトルまたはターゲットである場合もあるT細胞、単球およびマクロファージのような免疫細胞両方を不活性にすることができる[91,94,95,100,101,102,103,104,105,106]。乳酸および特にL-乳酸は、直接的および間接的なメカニズムの両方を介してHIVに対して作用する[86]。いくつかの研究は、酸性PHだけではウイルスを阻害することができず、広範なHIVウイルス殺傷活性を有するL-乳酸分子とともに提供されるべきであることを示唆している。第一に、それは頸管膣粘液層にHIV-1をトラップし、中和された粘液中のそれよりも100倍近くゆっくりとウイルスの複製を低下させ、第二に、それは試験管内試験でHIV-1とHIV-2の両方を不活性化する。さらに、乳酸は間接的な阻害を引き起こすBV関連細菌を死滅させる[86]。
第二に、ウイルス性成分として過酸化水素を分泌し、さらにウイルスの伝達を阻害する抗ウイルス物質を分泌する。さらに、過酸化水素は、ミエロペルオキシダーゼ、好酸球ペルオキシダーゼ、ラクトペルオキシダーゼ、およびハロゲン化物(塩化物、ヨウ化物、臭化物、チオシアン酸塩)を含むいくつかの哺乳類のペルオキシダーゼと結合して、強力なウイルス性の組み合わせを作ることができる[100]。
第三に、それらはウイルスに直接結合し、ウイルスを解除することができる。乳酸菌や他のプロバイオティクス細菌は、その膜上であれ分泌物中であれ、特定のHIV阻害タンパク質を産生することができる。例えば、2つの乳酸菌株は、マンノース糖が豊富なHIVの「ドーム」に直接くっつき、HIVを中和することにつながる。一般に、微生物の表面にはレクチンと呼ばれる糖質結合タンパク質が存在する。マンノースN-アセチルグルコサミン残基は、これらのタイプの分子の例である。これらの分子はいくつかの機能を持っており、例えば、ウイルス上の炭水化物に競合的に付着し、ウイルスがマクロファージやT細胞などの免疫細胞に侵入して感染から体を守るために必要なウイルスリガンドを占有する。また、T細胞などの宿主感染免疫細胞に付着し、感染したT細胞と感染していないT細胞との間の感染連鎖を遮断する。最後に、研究は、糖タンパク質と炭水化物の両方が、膣上皮細胞の結合および病原体の排除に関与している可能性を示唆している[91, 94, 95, 100, 101, 102, 103, 104, 105, 106]。
第四に、それらは膣症を改善することができる。細菌性膣症とHIV感染との関係を実証した研究がある。BV は炎症を引き起こし、上皮細胞に損傷を与え、免疫細胞およびウイルスを接触に入れ、最終的に過酸化水素および酸性の代謝物の生産を減らすことを含む 3 つの方法によって病原体および HIV への感受性を高める [91,94,95,101,102,103,104,105,106]。膣の生理不順はHSV-2またはHIV-HSV-2の感染によって引き起こされる可能性があり、逆にBVはHSV-2またはHIV感染の増加と関連していることを示唆する研究がある[107]。BVとSTDとの関係についての最初の研究はHIV-1ウイルスを対象としたもので、妊娠中と非妊娠中とでは、膣内細菌叢の異常とHIV-1抗体陽性との間に正の関連性があることが明らかになった。また、膣内微生物異常の重症度とHIV-1抗体陽性との間には用量反応関係があることが明らかになった。つまり、膣内細菌叢に異常がある女性の膣分泌物はHIV RNAが多いということになる[98]。腟の dysbiosis および異常な腟の microbiota は、HIV の伝染のためのより高い危険をもたらすことができる IL-1β および IL-8 のようなプロ炎症性腟のサイトカインを作り出すためにボディを引き起こすことができる。また、プロバイオティクス乳酸菌は、これらのサイトカインの産生を調節することができる[98]。
第五に、抗ウイルス成分を分泌する。例えば、いくつかの細菌種はバクテリオシンを分泌しており、これは殺菌成分として知られていたが、最近になって殺菌効果もあることが明らかになってきた。カルボ環式抗生物質であるラビリンスペプチンA1およびその誘導体は、広範な抗HIVおよび抗HSV活性を有している。このバクテリオシンは、HIVに感染したT細胞と感染していないCD4 T細胞[108,109]間のウイルス細胞間の伝達をブロックする。
第六に、それらは、膣および腸の両方で彼の免疫系に力を与える;例えば、腸管粘膜バリアを維持するために腸球にエネルギー源を供給する酪酸38のような物質、およびHIV感染を悪化させる炎症および共感染を抑制する抗炎症性物質を放出することができる。一般に、自然免疫に対する微生物の抗ウイルス効果は、IL-18,インターフェロン(IFN)λ、またはIL-22経路に基づいている。一方では、それらはIL-22およびIL-18の両方の分泌を増加させ、それは、シグナル伝達物質および転写1(STAT1)および抗ウイルス遺伝子のより多くの発現につながり、他方ではIFN-λの分泌を抑制し、それはウイルスの病原性に寄与する[24, 110]。さらに、いくつかの種はNF-κBシグナル伝達経路やサイトカイン(IFN-ɛ, IL-1α, IL-6, IL-8, TNF-α mRNAなど)を調節して免疫系を強化し、TLR受容体の発現を誘導することで、HSVやHIVから体を守るために重要な役割を果たしている[101, 111, 112, 113]。
抗生物質曝露後のTLRリガンド刺激が不十分であったことが、免疫細胞の機能低下の一因であったと考えられる。抗生物質を投与したマウスのウイルスチャレンジ中にTLRアゴニストを投与すると、細胞性および体液性の両方の抗ウイルス応答が大部分回復した(図1および2)[65, 67]。さらに、腸内細菌叢が産生する細菌産物によるTLR2の活性化は、マスト細胞のウイルス感染部位へのリクルートと、マスト細胞由来の抗ウイルスタンパク質であるカテリシジンのさらなる放出に必要である(図2)[68]。しかし、腸内細菌叢が完全に確立されていない若いマウスでは、この状況は異なるようである。B型肝炎ウイルス感染モデルでは、TLR4に接触した若年マウスはウイルスの分解に失敗し、慢性感染を発症したが、TLR4変異体の若年マウスは迅速なウイルスクリアランスを示し、TLR4シグナル伝達による免疫耐性経路が若年マウスに優勢であることを示唆している[72]。興味深いことに、抗生物質治療によって誘発された腸内細菌叢の変化は一過性であり、回復可能であるようである。
ワクシニアウイルス感染の間、細菌叢はウイルス特異的CD8+T細胞をプライミングして大量のIFN-γを分泌させ、これが対応する抗ウイルス免疫を決定的に媒介する。さらに、ワクシニアウイルス感染の間、細菌産物によるTLR2の活性化は、マスト細胞をウイルス感染部位に勧誘するために不可欠である。これらのマスト細胞はまた、抗ウイルス性カテリシジンを分泌することでウイルス感染を抑制することにも貢献している。腸内細菌叢は、HIV感染者の免疫系の活性化と密接に関連している[75]。この結論は、別の独立した研究によって補強されており、消化管関連リンパ組織においてIL-4およびIL-10を産生するNKT細胞の能力は、微生物感染のマーカーの減少および免疫活性化の減少と関連していることが示されている。
第7に、微生物叢とHIVに関する研究の大部分は、膣の微生物叢を主張しているが、男性の泌尿器系の微生物叢がHIV感染に果たす役割を示す証拠がある。精液は重要なベクターであり、精液微生物叢の多様性と豊富さはHIV感染に重要な役割を持っている。例えば、精液中の細菌負荷がIL-6,TNF-α、IL-1bのような7つの炎症性ケモカインに影響を与え、それが精液中のウイルス負荷の変化につながることが研究で示されている[114]。
単純ヘルペスウイルス(HSV)およびサイトメガロウイルス(CMV)
HSVとの共感染はHIV感染を悪化させる可能性があるため、これらの細菌の抗HSV特性も重要である。HSVの場合、乳酸菌は膣内で酸性のpHを設定し、乳酸や過酸化水素を産生し、ウイルスの複製を強力に阻害し、膣粘膜でHSV-2を不活性化することが研究で明らかになっている。
また、乳酸菌Enterococcus faeciumは、Enterocin CRL35と名付けられた小さなカチオン性ペプチドバクテリオシンを放出し、これはVero細胞における単純ヘルペスウイルス関連タンパク質の合成を阻害し、それによって単純ヘルペスウイルス1型および2型の両方の後期複製段階を阻害することができ、副作用がないため、良い薬となり得る[95, 108, 114, 115,116]。
さらに、マイクロバイオータの組成を維持することは、この患者の健康を改善するための新たな治療標的となり得ることを示す多くの研究がある[117]。HIVと同様に、膣内微生物叢はHSVに直接付着したり、トラップしたりすることがある[98]。
さらに、サイトメガロウイルス(CMV)は、免疫不全患者における重要なウイルス病原体であり、多くの先天性催奇形性感染症を引き起こす可能性がある。研究は、CMVの複製および複数のCMV株への感染は、正常な膣微生物叢によって停止させることができることを示唆している[98]。さらに、馬ヘルペスウイルス1(EHV-1)は、ヘルペスウイルス科のウイルスであり、馬の呼吸器感染、ウイルス性流産、神経症状、新生児死亡など、いくつかの異なる病態を誘発する。本研究では、フラジェリンがHSVワクチン接種において強化的な役割を果たしていることを示した[118]。
STDにおける腸内細菌叢の役割
HIVに関与する微生物やプロバイオティクスは、膣内にも腸内にも存在する。私たちが知っているように、免疫細胞のほとんどは腸内に定着し、HIV感染にはいくつかの役割を持っている。感染の初期段階では、ウイルスは、CD4 + リンパ球と腸関連リンパ組織(GALT)の樹状細胞を枯渇させる。それは、腸管バリア機能障害、微生物相異常症、および微生物代謝物の末梢血流への漏出を含むいくつかの問題を引き起こす。後者は、(MIP-3,IL-6,IL-8,LL-37,およびHNP1-3)のようなプロ炎症性サイトカインまたは抗菌ペプチドのレベルの増加、および免疫細胞の活性化に関連しており、これは順番にHIVの進行を駆動することができる。最近の研究では、プロバイオティクス細菌が抗レトロウイルス治療中のHIV患者に有益な役割を持っていることが示唆されている微生物組成を維持し、粘膜および全身の炎症を減少させ、ナチュラルキラー細胞を刺激し、マクロファージの貪食活性を増加させ、インターフェロン-γ、インターロイキン(IL)-12,およびIL-18を刺激し、腸管バリアを改善する[100,119,120,121]。これらの多くの研究は、HIV感染に対する微生物叢の有益な役割を支持しているにもかかわらず、これを支持していない研究もある[122]。最後の例として、膣の生理不順は上皮の損傷をもたらすIL-33を増加させ、膣リンパ組織へのT細胞の移動を阻害するため、抗ウイルス性インターフェロンやサイトカインを分泌することができず、それによってHSV感染を促進する[121, 123]。バイオエンジニアリングされたプロバイオティクスもまた、有用な効果を有し得る。例えば、Streptococcus gordonii、L. lactis、L. plantarum、およびL. jenseniiを含む常在菌は、シアノビリン-Nと呼ばれるシアノバクテリアから、HIVのマンノース糖が豊富な「ドーム」に直接付着することができるユニークな11 kdタンパク質を産生するように設計されている。大腸の大腸菌株をバイオエンジニアリングすると、HIVのgp41融合タンパク質を占有し、HIVの肛門感染防止の原因となるヘモリシンAとハイブリダイズしたペプチドを放出することができる。また、L. plantarumやL. gasseriのFI-1,FI-2,FI-3のようなバイオエンジニアリングされたプロバイオティクスにクローニングされた他の多くのペプチドがある。また、L. reuteri RC-14のCD4D1D2IgKLC、MIP-1β、およびT-1249は、L. Casei株の細胞接着に対するgp41および人工抗体を占有することができ、それは試験管内試験で経上皮HIV-1感染をブロックしている[100, 124, 125, 126]。さらに、シミアン免疫不全ウイルス(SIV)では、糞便微生物移植(FMT)治療により、抗ウイルス性末梢Th17細胞およびTh22細胞の活性化が改善されている[91]。これらのメカニズムを知ることで、どの部分に着目しても、その部分を改善・シミュレートすることで、新たな治療法に到達できるのではないかと著者は仮説を立てた。
促進
以上のような調査にもかかわらず、HIV感染者では血漿中のLPSの濃度が高く、LPSの一部である脂質Aは、ウイルスが宿主細胞に侵入するためのツールであるgp120のV3ループ由来のペプチドと相互作用することが示唆されている研究がある[90]。また、アフリカ霊長類のHIVの祖先であるSIVは、グリセロールモノラウレートと呼ばれる抗菌性化合物によって抑制することができる。したがって、HIVやSIVも同様に微生物相を利用して病原体を発現させている可能性がある[90]。また、これらの研究では、HIV感染における微生物叢の有益な役割を支持しているにもかかわらず、この考えを支持していない研究もあることを改めて言及しておく[122]。最後の例として、膣内細菌叢は上皮の損傷をもたらすIL-33を増加させ、膣リンパ組織へのT細胞の移動を阻害するため、抗ウイルス性インターフェロンやサイトカインを分泌することができず、HSV感染を促進させる[121, 123]。さらに、短鎖脂肪酸(SCFA)は、エプスタインバーウイルス(EBV)段階の初期の溶血サイクルの活性化を介して、この段階に関与するウイルスタンパク質の発現を誘導することにより、ウイルス感染促進を誘導する微生物成分である。さらに、ヒストン脱アセチラーゼ阻害剤であるSCFAはすべてヘルペスウイルスを再活性化できるが、エプスタインバーウイルスを再活性化するものは少ないというデータがある[127]。我々が指摘したように、フラジェリンは、ヘルペスワクチン学において有益な役割を有するが、HIV-1の侵入およびプロモーター活性を増強し、細胞外ウイルスの産生を増加させる[128]。
ヒト乳頭腫ウイルス(HPV)
HPVは、肛門がん、性器がん、口咽頭がんなどのいくつかのがんを引き起こし、異形成および子宮頸部悪性腫瘍のリスクを高めるオンコウイルスである[129]。HPVは、インターフェロンの誘導、マクロファージの活性化、NK細胞の刺激などのいくつかのメカニズムを介して、膣粘膜感染、粘膜免疫および炎症を誘発することが知られている。HPV感染中のプロ炎症性サイトカイン、活性酸素種、ウイルスDNAの統合、および慢性炎症は、膣粘膜環境および代謝を変化させ、その結果、膣マイクロバイオータを変化させる[130]。例えば、マイクロバイオータの研究では、CSTs III(L. inersの微生物優勢)またはCST-IVのサブタイプを持つ女性のAtopobium、Prevotella、Gardnerella、そしていくつかの研究ではMegasphoeraとL. gasseri種の割合が高いことが実証されており、おそらくHPV陽性の女性はHPV陽性であり、HPV陽性の女性の割合が高く、またHPV陽性の女性ではウイルスの増強とクリアランスが遅くなることが示されている[121, 131]。また、HPVはクラミジア・トラコマティスのように他の感染症を助長することもある[132]。さらに、マイクロバイオータがD-乳酸を産生し、過酸化水素を産生し、微生物の物理的バリアを形成して膣上皮細胞へのHPVの付着をブロックすることで、HPV感染を防ぐことができることを示す証拠がある[96, 114]。いくつかの研究では、膣微生物叢、HPV感染、および臨床的な子宮頸部新生物との間の関連が実証されている。このように、Gardnerella vaginalisとLactobacillus gasseriの異常率が高く、Lactobacillus crispatus、Lactobacillus iners、Lactobacillus taiwanensisの異常率が低くなることで起こる腸内細菌叢の異常は、ニトロサミンのような発がん物質を産生することでHPV感染とHPV依存性子宮頸部新生物を誘発し、逆の状況ではHPVクリアランスと改善を促進することができる。他にも多くの研究が行われているが、HPV関連の癌における微生物の役割については、細菌の違いはほとんどない[96, 130, 133, 134]。しかし、一般的には、膣微生物叢におけるHPV免疫経路のメカニズムは完全には解明されておらず、さらなる調査が必要である[121]。
血液生まれのウイルス
デングウイルス
デングウイルス(DENV)は昆虫伝搬型ウイルスで、年間3億9000万人が感染している。これは、Aedes aegyptiと呼ばれる昆虫ベクターを介して感染する [135]。これらの昆虫は、場合によってはウォルバッハ菌と呼ばれる常在菌を持っており、他の微生物相と協力して、Toll様受容体(TLR)免疫経路によって制御される抗菌ペプチド産生遺伝子のより多くの発現を誘導することにより、ウイルス複製を阻害することにより、間接的にデングウイルスに対する昆虫の感受性を低下させる [135, 136]。MyD88遺伝子のサイレンシングを介したToll経路の抑制は、デング熱の増加をもたらした。Wolbachia は、Toll 免疫経路の基底レベルの刺激を介してその効果を誘導する [86]。さらに、抗生物質を投与した昆虫では、より高いレベルのウイルス力価を示した [90]。したがって、ウォルバッハ菌のような他の種の微生物相をプロバイオティクスとしてヒトの治療目的で使用することが可能ではないかと考えた。また、少なくともバイオエンジニアリングによってそれらの代謝物を生産することは可能であるが、実際のメカニズムを理解するには、より多くの研究が必要である。
ムリン白血病ウイルス
Murine leukemia virus (MuLV)は、レトロウイルス科のエンベロープ型ガンマレトロウイルスウイルスであり、マウスの白血病/リンパ腫の原因となる。血液生まれのウイルスであり、搾乳や分娩を介して垂直感染するほか、出生時の咬傷や引っ掻き傷のような他のルートでも感染する[86]。微生物相は、リンパ球の分裂・増殖を誘導し、ウイルスの複製を促進することで、マウスのGF(Germ-feee)MLV感染を増加させる。ある研究では、GFマウスはSPFマウスよりもMLV誘発白血病に対する抵抗性が高いことが明らかにされている[137]。しかし、GFマウスにおける本ウイルスとMLV感染に対する微生物叢の陽性、陰性、中性の効果を示す研究は相反するものがあり、おそらくその系統や実験ミスによるものと思われる。例えば、いくつかのMuLVウイルスは、汚染性の乳酸脱水素酵素レベリングウイルスを含み、これは全身性のリンパ球活性化を発揮する[91,138]。
リンパ球絨毛膜炎ウイルス
リンパ球性絨毛膜炎ウイルス(LCMV)は、Arenaviridae科に属するエンベロープ型のRNAウイルスであり、マウスにおいて急性および慢性感染の両方を引き起こす可能性がある[139]。微生物相はLCMV特異的なCD8+ T細胞応答とIgG抗体価を低下させ、これが抗ウイルス応答と感染期間の短縮につながる。抗生物質を投与されたマウスのCD8+ T細胞は、より多くの抑制性受容体を発現し、より少ないエフェクター分子を発現する。抗生物質処理マウスとは異なり、SPFマウスのマクロファージはより高い抗ウイルス応答を示す。抗生物質で処理したマウスの腸内細菌叢の異常は、LCMV感染に対する自然免疫応答および適応免疫応答を低下させる[137]。
腸管ウイルス
上述したように、消化管または腸管ウイルスは、糞便-口腔感染を有する。ウイルス感染症と腸内細菌叢は、互いに異なる影響を及ぼす。微生物相は、ウイルス感染を抑制または促進することができ、逆に、ウイルス感染はユービオシスまたは腸内細菌叢の異常を誘発することができ、さらにはそれらの中のいくつか、例えばマウスのノロウイルス(MNV)のように、細菌のいないマウスでは、腸内細菌叢の有益な役割を置き換えることができる[140]。ロタウイルス、ノロウイルス、およびアストロウイルスのような最も一般的な腸内ウイルスは、消化管に感染し、重度の小児下痢および胃腸炎につながる非伸長性RNAウイルスである。リオウイルスよりも、マウス乳腺腫瘍ウイルス(MMTV)やポリオウイルスも本来は腸内ウイルスである。インフルエンザやコクサッキーウイルスB3ウイルスのような一部の全身性ウイルスでも腸内結腸を持っている[7]。
ロタウイルス
ロタウイルス(RV)は、Reoviridae科に属する非伸長型の二本鎖RNAウイルスであり、小児下痢による1~5歳児の死亡原因の中で最も一般的なものの1つであり、世界全体で年間20万人が死亡していると推定されている[137]。研究は、マイクロバイオータとロタウイルスの間には二重の関係があることを示唆している:ロタウイルス感染はバクテロイデス属の組成の変化を誘導することができ、マイクロバイオータとプロバイオティクスはロタウイルス感染において有効な治療薬であることが実証されている[141]。ラクトバチルス・ラムノサス(Lactobacillus rhamnosus)のようなプロバイオティクスは、ウイルス性下痢の持続時間と拡散の両方を減少させることができる。例えば、微生物の可溶性分泌物は、腸管上皮細胞表面の糖鎖を変化させてロタウイルスの付着を防ぐことで、腸内のロタウイルス感染をブロックする[137]。また、ロタウイルスフラジェリンが活性化したTLR5経路は樹状細胞に影響を与え、(IL)-22の放出を誘導する。また、NLR Family CARD Domain Containing 4(NLRC4)依存性のIL-18放出を増加させる。IL-22は上皮細胞とその増殖を正常な状態に維持し、IL-18はアポトーシスを介して感染した上皮細胞を排除する。したがって、この経路は直ちにロタウイルス(RV)感染を除去し、RVクリアランスを促進する[142]。さらに、Bifidobacterium breveとガラクトおよびフラクトオリゴ糖を混合したシンバイオティクスの組み合わせは、IFNγ、IL-4,TNF-α、TLR2の産生を増加させ、RVウイルスに悪影響を及ぼす。結論として、ビフィズス菌は免疫寛容性を低下させ、粘膜防御力を高めるなどの免疫応答を誘導することで、間接的にRVウイルスに影響を与えていると考えられる[143]。しかし、ロタウイルスに対する微生物の効果を示す研究もあり、例えば、ヒト乳オリゴ糖にはビフィズス菌などのプロバイオティクスが含まれており、免疫応答を介してRVウイルスの感染促進につながっている。そのため、抗生物質による治療では、IgA産生細胞の改善を介してRVへの侵入を抑制することで感染を減少させることができる。また、抗生物質処理したマウスやGFマウスでは、微生物叢が不足するとロタウイルス抗原のレベルが低下し、感染が遅延して感染力が低下することが報告されている[144]。さらに、バンコマイシン処理したヒトでは、プロテオバクテリアが増加し、バクテロイデスの量が減少することで、RVワクチンの免疫原性やRVの脱落が促進される[145, 146]。また、常在菌は、血清中のIgAやIgG、糞便中のIgAなどのウイルス特異的抗体量を減少させることで、抗ウイルス性体液性反応の活性化を抑制する。抗生物質治療は腸内のウイルス特異的抗体分泌細胞を維持してマイクロバイオータを回復させ、低用量のデキストラン硫酸ナトリウムの投与はロタウイルス特異的抗体の産生の増強につながり、このことがマイクロバイオータがロタウイルスに好影響を与える理由である[91, 147]。
ノロウイルス
ノロウイルスは、ノロウイルス科の一本鎖RNAの非伸長性腸管ウイルスであり、糞便-口腔経路を介して感染するほか、食中毒性ウイルスでもある。ノロウイルスは、ウイルス性胃腸炎の一般的な原因であり、先進国では小児重症下痢症の最も一般的な原因となっている。ノロウイルスの治療法やワクチンはまだなく、下痢、嘔吐、吐き気、腹痛、短期発熱がその症状である[137, 148, 149]。ノロウイルス属は7つのジェノグループ(GI-GVIII)に分類される。例えば、GIウイルスとGIIIウイルスはヒトへの感染を担っているが、GV分類には存在しないマウスノロウイルス(MNV)の株がある。マウスノロウイルスは、ヒトには影響を与えないが、実験的な研究には適していると考えられる。また、ヒトとマウスのどちらの株でも、微生物相に起因するプラスの影響とマイナスの影響が類似していることがわかる[150]。
抑制研究
ルミノコッカス科とFaecalibacterium spp.の密度と抗NoV抗体価との間には正の関係があり、これらの細菌がNoV感染に対して保護的な役割を果たしている可能性が示唆された。従来、Faecalibacterium spp.は抗炎症菌として知られていたが、そのメカニズムは不明であった。さらに、MNVの場合、Bacillus spp.の分泌成分であるポリ-g-グルタミン酸(g-PGA)は、インターフェロン-b(IFN-b)シグナル伝達経路を増加させることでMNoV感染を調節することで、マウスをMNV-1感染から保護することが知られている[151]。レチノイン酸依存性の研究のほとんどはMNVを対象としたものであったが、レチノイン酸治療がHNoV感染のリスクを低下させることを明らかにした研究もある[152]。乳酸菌は、IFNβやIFNγなどのインターフェロンの発現を介してマウスノロウイルス(MNV)の複製を抑制し、感染期間を低下させる。レチノイン酸は単独でも抗ウイルス効果はあるが、微生物叢に沿って強くなる。MNV-1は乳酸菌を減らし、レチノイン酸やビタミンAはそれらを回復させる。したがって、ビタミンAやレチノイン酸の抗ウイルス効果は、ラクトバチルス属のインターフェロン産生によるものであるという結論を導き出すことができる[153]。さらに、ビタミンAは、MNV感染RAW 264.7細胞におけるIFN-βおよびIFN-γ発現をアップレギュレートするLactobacillus spp.などの腸内微生物叢の変調を介して抗ウイルス効果を誘導することを明らかにした研究がある。そして、IFN-γは、MNV感染に対する適応免疫応答を促進する。他の研究はこの考えをより確信させた;例えば、グラム陰性微生物はLPSを産生し、それがIFNsの分泌を誘導し、MNVの複製を抑制することにつながる[154]。
促進
多くの研究によれば、抗生物質の投与によりウイルス性ノロウイルスの感染が抑制されることが示されており、これは微生物相の役割を示している。ヒトノロウイルスの場合、ほとんどの研究では、VP1カプシドタンパク質を介して、ヒトノロウイルスは微生物相とHBGAなどの宿主表面成分の両方に直接付着していることが示唆されている。それにもかかわらず、ヒトノロウイルスはHBGAを持たない微生物相にも結合できることを示唆する研究もある。したがって、それは異なる株または他の未知の付着成分に起因する可能性があると結論づけることができる[149, 155]。結論として、ウイルスへのHBGAの付着は、細菌のリガンドによるウイルス粒子の安定化(特に熱安定化)につながり、その後、糖鎖結合したウイルス粒子は、直接的なメカニズムとして、標的細胞の受容体へのウイルスの付着および宿主から宿主への伝達を促進する。さらに、それらは、宿主免疫に影響を与え、免疫耐性を準備することを介して間接的な効果を誘導することができ、それは、より多くのウイルス複製につながり、また、ウイルスの組換えを促進することにもつながる(149,155]。別の研究では、試験管内試験B細胞培養系において、HBGAを産生する微生物群がHNoV複製の補因子として重要な役割を持ち、細菌性HBGAの投与だけでも十分であることが明らかにされた[155, 156]。さらに、抗生物質による治療は、間接的にStat1やIrf3などの抗ウイルス受容体の発現を促進し、IFN-λのようなサイトカインの発現を促進する[91]。微生物はSPFマウスでは上皮病変を誘発して上皮防御を損傷するが、GFマウスでは効果がない。そのため、IL-10誘導を介して腸内炎症を引き起こし、より多くのウイルスの伝達と複製につながる[157]。さらに、ベシクル・クロークド・ウイルス・クラスター(VCVCs)は、便中に存在する無視できないウイルス集団であり、遊離ウイルスよりも感染力が高い[158]。例えば、それらは、ノロウイルスおよびポリオウイルスの両方を含み、また、異なるウイルス株間の共感染および組換えを増加させるポリオウイルスのような他のウイルスも含む。微生物相は、直接的または間接的にウイルスのクラスタリングを媒介することができ、これがウイルス感染性を高める[151]。また、マイクロバイオータは胆汁酸の調節を介してHNoVの感染を調節している。HNoVカプシドは胆汁酸に直接付着し、HBGAとの結合を促進することでHNoVの複製を用量依存的に増加させる。このことは、HNoVの補酵素として作用する胆汁成分が、その作用に細菌の代謝を必要とすることを示している[151]。
アストロウイルス
これらは世界的に小児の胃腸炎症例の約2~9%を占めると報告されている。免疫不全マウスをマウスアストロウイルス(STL5)でコロニー化すると、腸内ラムダインターフェロン(IFN-l)が誘導される[7]。
レオウイルス
リオウイルスは、リオウイルス科に属する非発生型の二本鎖RNAウイルスであり、腸内に植民地化する腸内ウイルスであるが、通常は無症状である[7]。抗生物質を投与したマウスやGFマウスでは、レオウイルスの複製や病原性が低下する。このことから、そのメカニズムはよくわかっていないが、マイクロバイオータがレオウイルスの複製と発病を促進していることがわかった[137]。ポリオウイルス感染でもレオウイルス感染でも,グラム陰性菌とグラム陽性菌との直接的な相互作用を介してウイルスの安定性,特に耐熱性を高めている.例えば、これらのウイルス感染の前に抗生物質を投与して微生物を枯渇させると、ウイルスの病原性が低下することを示すいくつかの研究がある[91]。結論から言うと、レオーウイルスは、細菌の外側エンベロープ成分に直接影響を与えることを介してグラム陽性菌とグラム陰性菌の両方と協力することができ、また、LPSやGPを用いてグラム陽性菌やグラム陰性菌に緩く付着して標的細胞に侵入することもできる[159]。しかし、LPSだけではこれらの効果を引き起こすことはできず、その働きを完了させるためにはグラム陰性細菌の細胞表面に存在する他の成分を必要とする。この事実を確認するために、大腸菌とインキュベートしたレオウイルスは、LPS単独と比較してより安定性が高いことを示した研究がある[159]。
ポリオウイルス
ポリオウイルスは、Picornaviridae科の一本鎖RNAウイルスで、糞便-口腔経路で感染することができる。腸内で数日かけて複製された後、中枢神経系に移行し、そこで病原性を示し、麻痺を引き起こすことが知られている。また、ポリオウイルスはヒトポリオウイルス受容体(PVR)を必要とするヒト病原体であり、実験のためにはPVRトランスジェニックマウスを使用しなければならない[7, 160]。微生物相は、直接的および間接的なメカニズムの両方を介してポリオウイルスの複製と病原体を悪化させる。一方では、グラム陽性およびグラム陰性の両方の微生物は、それらの多糖類をポリオウイルスに結合させ、早期のRNA放出を防止することにより、ウイルスを安定化させる。例えば、N-アセチルグルコサミン量を有する微生物が放出するペプチドグリカンやLPSは、40℃以上の温度でもポリオウイルスと結合し、ウイルスの熱安定化を誘導する。一方、LPSはポリオウイルスの細胞内受容体や標的細胞への結合を促進する[137]。また、感染開始前にポリオウイルスを微生物とインキュベートすることで、高温に耐性を持ちながら薬物グアニジン塩酸塩(DrugSTempR)や高温に敏感でありながら薬物グアニジン塩酸塩に耐性を持つ(DrugRTempS)のような異なる表現型間での遺伝的組み換えや共感染の可能性が高まることがわかった[91]。さらに、ポリオウイルスとインキュベートしたUV不活性化微生物でさえ、独立して仕事をすることができる細菌表面多糖類(LPSおよびペプチドグリカン)のために、ウイルスの安定化を誘導することができることは興味深いことである[91]。この事実のためのより多くの自信は、ウイルスのカプシドタンパク質VP1-T99Kに1つのアミノ酸を置くことによってLPSへの低い結合トロピズムを持っている変異体ポリオウイルスを使用して準備された。変異型ウイルスは、生体内では野生型と比較して、複製、付着、病原性は同等であったが、腸を通過した後のマウス糞便中での安定性は野生型と比較して低かった[161]。
マウス乳腺腫瘍ウイルス(MMTV)
マウス乳腺腫瘍ウイルス(MMTV)は、レトロウイルス科に属するエンベロープ型腸管ウイルスであり、感染した母乳を介して子供に垂直感染し、消化管感染症を引き起こしたり、感染したりする。TMEVは自然界では腸内ウイルスであるが、その病原性と複製は神経細胞内にあり、マウスでは多発性硬化症を引き起こす[7, 162]。リポ多糖類(LPS)のような微生物群の成分が、LPSのパターン認識受容体(PRR)であるTLR4の活性化を介して中枢神経系の炎症を増加させることで、TMEVの複製や感染、疾患を悪化させることが研究で明らかにされている[137]。結論として、MMTVはLPSを利用してTLR4の発現を刺激してIL-6を誘導し、それはまた、T-reg細胞の免疫調節の役割を調節し、免疫寛容を準備するための重要なサイトカインとして免疫抑制性サイトカインIL-10の量を増加させることにもつながる。このカスケードは最終的にTLR4/MyD88経路を介してウイルスが免疫系から脱出するのを助ける。その結果、LBPsを持たないマウスから分離されたMMTVでさえ、LPSを捕捉してTLR4を刺激することはできなかった[138]。さらに、フォローアップ研究では、LPS受容体がウイルスエンベロープ形成に寄与し、ウイルスの拡散を促進することが明らかにされている[162]。つまり、MMTVはCD14,TLR4,MD-2などのLPS結合タンパク質をウイルスエンベロープに取り込み、次世代のために利用しているということである[149]。
アデノウイルス
アデノウイルスは、呼吸器や腸管を介してヒトに感染する。ヒトアデノウイルスは、アデノウイルス科の非伸長型二本鎖DNAウイルスである。微生物は、ヘルペスウイルス、ヒトパピローマウイルス、ポリオマウイルス、オルソウイルス、レトロウイルスなどに対する抗ウイルス成分であるディフェンシンを産生することができる。アルファデフェンシン5のようなデフェンシンはヒトアデノウイルスに直接結合し、エンドソームでのアンコートを防ぐことで培養細胞内でのウイルス複製を制限するが、正確なメカニズムは不明のままである[6, 137]。
B/C型肝炎ウイルス
B型肝炎ウイルス感染症は慢性持続感染であり、Ab分泌B細胞との相互作用を介して腸内微生物叢によって抑制される。腸内細菌叢は、糞便微生物移植(FMT)治療のたびにB型肝炎ウイルス(HBV)e-抗原(HBeAg)量を減少させる[91]。
コクサッキーウイルスB3
コクサッキーウイルスB3(CVB3)は、ピコルナビル科エンテロウイルス属に属する非伸長型一本鎖RNAウイルスである[163]。最初に、抗生物質治療は、全身性ポリオウイルスおよびCVB3の力価を低下させるが、これは、微生物相がCVB3の感染を促進することを意味し、その後、CVB3の感染および播種の両方の動力学を低下させる。ヒト盲腸マウスとGFマウスの両方において、抗生物質処理がCVB3力価を低下させることが示されており、その理由は、抗生物質処理により、硬膜自然免疫応答が増加し、DNAウイルスとRNAウイルスの両方に対する抗ウイルス活性が増加するからである[137, 164]。
呼吸器系ウイルス
呼吸器は、微生物の流入やコロニー化が最も適切な部位の一つであり、無症状、軽症、重症、さらには致死的な感染症を引き起こす可能性がある。腸管微生物叢に関する研究は多くあるが、呼吸器微生物叢に関する研究はほとんど行われていない。微生物は上気道では密度が高く、下気道では徐々に減少していく。遠位気道や肺は微生物から隔離されているようである。
しかし、いくつかの研究でも、肺にも特定の微生物が存在することが明らかになっており、肺には微生物が存在しないという事実は、培養、サンプリング、測定するための高度な技術の欠如に起因している。肺と気道の両方に存在するこれらの微生物は、喘息、嚢胞性線維症、慢性閉塞性肺疾患などの呼吸器疾患においても重要な役割を果たしている[165,166,167,168,169]。
Leungらの研究では、上気道マイクロバイオームがFirmicutes、Proteobacteria、Actinobacteriaで構成されていることが実証された[170]。さらに、ある研究では、健康なヒトの肺には一貫した明確な微生物群は存在しないが、興味深いことに、上気道の微生物群と同様の特殊なスペクトルの微生物が存在すると結論づけている。このことは、上気道と下気道の微生物叢の間に有意な関連性があることを主張している[171]。さらに、呼吸器系感染の原因となる最も一般的な病原体であるウイルス感染は、その病原性と同時に、疾患の重症度に応じて呼吸器系微生物叢を変化させることから、これらの微生物叢が患者の免疫活性化状態に関与していることが示唆されている[172]。
ヒトライノウイルス
ヒトライノウイルス(RV)は感冒の主な原因であり、患者の罹患率と死亡率が高い呼吸器感染症の頻発原因である [173, 174]。Toivonenらは、HRVのコロニー化と微生物相の変化との間に強い関連があることを発見した[175]。Korten らは、HRV 感染症と呼吸器微生物叢との間には、初期の段階で活発な相互作用があることを示している。より正確には、HRVの症状を伴う感染症は、微生物の密度と多様性の短期的な変化と相互作用している。また、より一般的な症状を伴う HRV 感染症では、生後 1 年目の終わりに微生物の多様性に長期的な影響を与える。さらに、成人を対象とした研究では、症候性HRVのコロニー化期間中は微生物の多様性が低下することが明らかになっている[176]。
インフルエンザAウイルス
インフルエンザは、インフルエンザウイルスによって引き起こされる急性呼吸器疾患である。インフルエンザは宿主上皮細胞に感染する伝染性疾患に分類される[177]。インフルエンザウイルスは、ヘマグルチニン(HA)とノイラミニダーゼ(NA)と呼ばれる2つの主要な表面糖タンパク質を持っている。HAはウイルスと標的細胞の受容体(シアル酸)との間で融合を行い、NAは末端のシアル酸と隣接する糖残基との間のa-ケトシド結合を破壊・切断する[178]。インフルエンザウイルスにはA,B,Cの3つのタイプがあり、命名はウイルスの核およびマトリックス中のタンパク質の抗原性の多様性に基づいている。インフルエンザAウイルス(IVA)は最もパンデミックなタイプである[178]。IVAは呼吸器系の急性感染症を引き起こす。研究では、IVA感染時の下気道微生物組成の低レベルの質的変化が示されている[179]。細菌負荷の増加などの変化は、呼吸器だけでなく腸などの他の部位でも二次感染のリスクを高める可能性がある[180]。このように、IAV感染は腸内マイクロバイオータ群集にも影響を与える。IAVは粘液層の完全性を破壊するので、免疫応答を印象づけることができる[179]。また、IAVは下痢のような胃腸炎の症状を引き起こす可能性がある[181]。インフルエンザに感染している人は、何らかの胃腸の不都合や障害を経験することがある。それは、その部位での以前の活動的な感染の二次的なものであったり、呼吸器からの感染粒子を飲み込んだ結果であったりして、その感染粒子が消化管に移行して症状を引き起こすことがある[182]。微生物相は、腸内の抗ウイルス免疫応答の有意な減少に関連する方法でインフルエンザウイルスに影響を与える可能性がある。そのため、抗生物質による治療は、H7N9インフルエンザウイルス感染マウスに悪影響を及ぼす可能性がある[183,184,185]。抗生物質治療を受けたインフルエンザ感染マウスは、T細胞のレベルが低く、T細胞はまた、TNF-α、MIP-1α、IL-2,およびIFN-γを産生する能力が低い;さらに、抗生物質治療は、肺マクロファージにいくつかの影響を与える。抗生物質治療によって引き起こされる腸内細菌叢の異常は、インフルエンザ感染時に肺系マクロファージの抗ウイルス遺伝子としてのMx1,Ifnb,Il1b,Tnfaの発現レベルを低下させる[111]。抗生物質は腸内細菌叢の多様性を低下させる可能性があり[186]、インフルエンザウイルス性と腸内細菌叢の多様性との間には関係がある[113]。この腸内細菌叢の多様性の低下は、まさにH7N9感染者に起こっていることであり、これらの感染者では大腸菌や腸球菌のコロニー化が増加していることが明らかになっている[183]。
ある研究では、インフルエンザ感染前の鼻や咽頭の微生物叢が、症状の持続期間やウイルスの感染に影響を与えていることが明らかになっている。例えば、様々な細菌群集は、ウイルスの排出期間を延長し、感染の兆候は早いが症状の持続期間が長いNeisseria logotypeのような関連症状の早期発生を引き起こす[187] マイクロバイオータの回復治療は、腸内二次感染の発生率を減少させるが、外因性呼吸器感染は減少しない[188]。マイクロバイオータは抗ウイルス成分を産生することができ、これはウイルスに対して直接的または間接的な効果を有する。例えば、微生物由来のLPSは、インフルエンザに直接結合してその安定化を低下させることができる[189]。別の研究からの別の例として、鼻の微生物としてのS. Epidermidisは、巨大な細胞外マトリックス結合タンパク質(Embp)を分泌することにより、試験管内試験および生体内試験の両方の抗インフルエンザウイルス活性を示すことが明らかにされている[190]。さらに、微生物叢は免疫応答を誘導することができる。例えば、マウスのClostridium orbiscindensによって産生されるデスアミノチロシン(DAT)は、I型インターフェロンを誘導し、このシグナル伝達経路を活性化することを介して、インフルエンザ感染およびその肺免疫病理を予防する[191]。HIV感染症のような非インフルエンザウイルス感染症では、乳酸菌Enterococcus faeciumがウイルスを直接捕捉するメカニズムがいくつか存在することに注目すべきである[91]。別の研究では、微生物による抗ウイルス効果は、自然免疫系の活性化閾値を確立する微生物シグナルによるものであると結論づけている。これらのシグナルはマクロファージにおけるIFN活性化遺伝子の発現を減少させることで感染に影響を与える。そのため、ABXマウス(抗生物質治療を受けたマウス)のマクロファージは、I型およびII型のIFNを制御する能力が低下している[111]。IFN系のI型(IFN-I)は、抗ウイルス免疫応答の第一ラインである[192]。したがって、基本的に免疫系はインフルエンザ感染においてもこの成分を産生する。マウスを用いたある研究では、インフルエンザ感染時にIFN-Iが腸内細菌叢にも変化をもたらすことが示されている。証拠は、腸内細菌叢の変化による肺に誘導されたIFN-Iは、炎症を起こした腸内でのサルモネラ菌の増殖を増加させ、他の部位への全身的な伝播を誘導することができることを示している。このような腸内細菌叢の異常は、常在性義務性嫌気性細菌叢の減少と腸内プロテオバクテリア叢の増加とともに示されている[182]。一般的に、腸内微生物叢とプロバイオティクスであるラクトバチルス・パラカセイ(Lactobacillus paracasei)やラクトバチルス・プランタラム(Lactobacillus plantarum)は、IL-33,IL-1α、IL-β、IL-12,IFNγのような炎症性サイトカインの両方を上昇させ、また、インフルエンザ感染時には肺のNK、マクロファージ、樹状細胞のような自然免疫細胞の存在を増加させる。また、IL-10を増加させ、肺の炎症反応の低下と抗ウイルス反応の調整の両方につながる[138, 193]。マウスを用いた研究では、プロバイオティクスがインフルエンザ感染症に有益であることが実証された。ビフィドバクテリウム・ブレベYIT4064を摂取したマウスは、プロバイオティクスを摂取しなかったマウスと比較して、血清中の抗インフルエンザウイルスIgGのレベルが高いことが示された[194]。別の研究では、ビフィドバクテリウム・ロンガムMM-2のようなプロバイオティクスを摂取したマウスの肺やパイエル病巣で、IL-2,IL-12,IL-15,IL-21,IL-18,およびIL-1Βの発現が高いことが示されている。Lactobacillus casei Shirota、Lactobacillus pentosus S-PT84,Lactobacillus plantarum 06CC2,Lactobacillus rhamnosus、Lactobacillus paracasei、Lactobacillus gasseri TMC0356,Lactobacillus brevis KB290,Lactobacillus acidophilus L-92,L. Plantarum DK119またはLactobacillus fermentum CJL-112を介した免疫応答として、IL-6,IL-4,IL-5,IL-10レベルの低下が認められた。Plantarum DK119またはLactobacillus fermentum CJL-112では、プロバイオティクス処理群のマウスではTh1を介した免疫応答としてIL-6,IL-4,IL-5,およびIL-10レベルの低下が認められた[195]。インフルエンザAウイルスに感染したマクロファージは、ヒトT細胞でIFN-γ合成を誘導するサイトカインを分泌している[196]。さらに、インフルエンザ感染が肺障害を引き起こすと、肺由来のCCR9+ CD4+ T細胞の一部が小腸に移動し、IFN-γの産生を開始することが示されている。IFN-γは腸内細菌叢を媒介し、ウイルス感染時に腸内細菌叢の変質を引き起こす。微生物相の変化は腸内の上皮細胞に影響を与え、それによってIL-15の産生を刺激し、これはPR8感染(呼吸器感染)を介してTh17細胞の分極を促進する。その後、小腸ではTh17細胞の数が有意に増加し、それがIL-17Aを中和し、腸の損傷を減少させる[181]。インフルエンザ感染における腸内細菌叢の減少は、肺からリンパ系組織への樹状細胞(DC)の移動を阻害することができる。そのため、CD4+やCD8+のT細胞の増殖やB細胞の分化を阻害する[113]。他の研究では、T細胞の分化・増殖にもマイクロバイオータの影響があることが示されている[29]。さらに、一戸らの別の研究では、肺でのCD4+やCD8+ T細胞などのリンパ球の低増殖の結果として、腸内細菌叢がインフルエンザウイルス感染に対する自然免疫応答と適応免疫応答の両方を制御する能力があることが明らかにされた。この問題は、Toll様受容体リガンドの局所または遠位注入によって悪化する[195]。しかし、以前に、黄色ブドウ球菌は、インフルエンザ感染症においてTLR2シグナル伝達経路を刺激することにより、末梢CCR2 + CD11b + 単球のリクルートと、それに続くM2マクロファージへの成熟を誘発し、急性肺損傷を増強することが発見されていた[197]。インフルエンザ感染に対する微生物叢の抑制的役割を支持するほとんどの研究とは異なり、微生物叢が抗ウイルス応答に対して調節的な効果を持たない可能性を示唆する研究があることに注目すべきである。例えば、以前の研究では、ネオマイシンはHSVやインフルエンザAウイルスのようないくつかのウイルスに対して抑制効果を有するが、その抗ウイルス活性はネオマイシン自体によるものであることが明らかにされていた。それは、いくつかの樹状細胞のTLR3を活性化し、IFN刺激遺伝子の発現の増加をもたらすが、これはネオマイシン自身が責任を負っているものであり、マイクロバイオータとは関係がない[138, 170]。ChabanらとLeungらは、2つの異なる研究で、プロテオバクテリア、特にEnterobactericeaeとMoraxellaceaeのファミリーが、インフルエンザ感染者では、正常な非感染者よりも頻度が高いことを明らかにした。結論として、これらのエビデンスは、プロテオバクテリアの種がインフルエンザA感染における二次感染と相関している可能性を示唆している[170]。エビデンスは、マウスの致死的なインフルエンザウイルス感染に対するGFマウスへのマイクロバイオータの修復の効果を明らかにした。菌叢はIL-10やIL-13産生を介して炎症を減少させ、死亡率を低下させることが明らかになっている。HIVウイルス」の項で述べたように、LPSがTLR4を活性化すると、インフルエンザやHIVなどのウイルス感染症では、特に急性の全身敗血症や慢性炎症性疾患を引き起こす。インフルエンザ誘発性致死性は、単球由来の樹状細胞を刺激し、炎症性サイトカインの分泌を誘導することができるTLR4アゴニストの損傷関連分子パターン(DAMP)のTLR4刺激作用に起因しており、FP7はHMGB1によるDCの活性化を防止した[199]。ロタウイルスやインフルエンザウイルス、さらにはヘルペスウイルスなどのウイルス感染症におけるフラジェリンの治療的役割は、いくつかの研究で証明されている。例えば,ある研究では,インフルエンザAウイルス感染マウスの肺におけるウイルス負荷を減少させるフラジェリン投与の治療的役割が明らかにされている[200]。フラジェリンをインフルエンザワクチンや不活化インフルエンザウイルスと一緒に投与すると、TLR5を介してインフルエンザウイルスに対するIgAおよびIgGの力価が上昇する。これらのエビデンスは、フラジェリンが治療成分として、また強力な粘膜アジュバントとしての役割を強化していることを示している[201]。さらに,フラジェリンはHSVワクチン接種においても強化的な役割を果たしている[118].
呼吸器性合胞体ウイルス
呼吸器同期ウイルス(RSV)は、世界的に若年層の下気道入院や死亡率の原因となっている最も一般的な病因である。呼吸器同期型ウイルス気管支炎には、異なる微生物群が全身の免疫経路を調節することで、異なる影響を与えている。StreptococcusとHaemophilus influenzaeはRSVウイルスを抑制し、Staphylococcus aureusはRSVウイルス感染の重症化を促進する。これらは、マクロファージや好中球などの免疫細胞を活性化させるための前炎症性遺伝子の発現を制御しており、未知のメカニズムを介している[202]。2019年のPersiaらによる別の研究では、鼻腔内微生物叢(β多様性として評価)と白血球レベル、Lambda3およびβIFN遺伝子発現とTh1/Th2応答との間の重要な相互相関が明らかにされた[203]。さらに、呼吸器微生物であるCorynebacterium pseudodiphtheriticumは、T細胞亜集団の増加を介して、TNF-α、IL-6,IFNγ、およびIFNβ分泌を誘導することで、呼吸器同期ウイルス(RSV)に対する抗ウイルスTLR3応答を制御している[204, 205]。Munozらは、RSV免疫予防はRSV感染症に対して臨床的には有益であるが、特に呼吸器の脆弱性が最も高い時期には臨床的には有益であるが、呼吸器微生物叢に長期的な変化を引き起こす可能性があることを明らかにした[206]。RSVと微生物相の間の最後の相互作用は、ヒアルロン酸(HA)と呼ばれる細菌成分であり、RSVのようなウイルスによる炎症、腫瘍、ウイルス感染に役割を持っている。HAは、Streptococcus spp.、E. fecalis、大腸菌、L. lactis、枯草菌、Agrobacterium spp.を含むいくつかの細菌によって産生され、一方、Streptococcus A、B、C、G、S. Pneumoniae、C. Perfrigensを含むいくつかの他の細菌は、ヒアルロニダーゼを産生することによってHAを分解する[207]。
エボラウイルス
正常な皮膚から得られたケラチノサイトは、タンパク質のトロンボスポンジン(TSP、THSDとも呼ばれる)ファミリーに結合して接着し、拡散する;この相互作用は、サイトカインを放出し、TSPタンパク質の発現を刺激することによって、皮膚における細胞が介在する免疫応答を開始する役割を果たしている可能性がある(Varani et al 1988)。TSPは、ケラチノサイトの付着および拡散を促進し、基底細胞層の正常な成長を維持する上で重要な役割を果たしている可能性がある。
エボラウイルスのマイクロRNA(miRNA)の発見は、エボラウイルス感染時の免疫逃避、内皮細胞の破裂、組織の溶解がエボラウイルスのmiRNAの効果の結果であることを示唆している。いくつかのmiRNAがトロンボスポンジンmRNAの3′未翻訳領域に結合し、その安定性と翻訳活性を制御することが示されている。本研究では、バイオインフォマティクス手法を用いた実用的なワークフローを用いて、Propionibacterium acnes由来の短いRNA配列がmiRNAとして機能する可能性があることを発見した。その後、共通の標的遺伝子を解読した。これらのRNA配列は、同じトロンボスポンジンタンパク質THSD4に結合する傾向があり、エボラウイルス、プロピオンバクテリウム・アクネス、ヒト由来のmiRNAが相乗的に標的に結合することが重要であることが示唆された。これらの結果は、エボラウイルス感染におけるトロンボスポンジンタンパク質とmiRNAの分子機構についての重要な知見を提供するものである。
現在のところ、EHFの治療に有効な特定の治療法は示されていない。したがって、感染症を克服するためには、通常、支持療法のみが行われているが、致死率は依然として高いままである。EBOVは直接の皮膚接触により感染が拡大する可能性がある。最近の研究では、EBOV感染はEBOV miRNAの作用の結果であることが提案されている(Liang et al 2014)。前述したように、P. acnesのような皮膚マイクロバイオーム内の微生物は、潜在的に宿主を保護するために重要な役割を果たしている。
最近の研究では、EBOV感染がEBOV miRNAの活性を介して起こり得ることが示されている(Liang et al 2014)。上述したように、P. acnesは宿主保護において重要な役割を果たす可能性がある。そこで、本研究では、配列アラインメントに基づいてP. acnesの短いRNA配列を検出するためのバイオインフォマティクスアプローチを確立し、それに応じて、これらのP. acnes配列がmiRNAとして作用し、共通の標的遺伝子THSD4の発現を調節することにより、EBOV感染からヒトを保護する可能性があることを示した[208, 209]。
ウイルス感染が微生物相に与える影響(ユービオシスまたはジスビオシス)について
SIV/HIV
HIV感染は腸管関連リンパ組織(GALT)を損傷し、腸内細菌を調節するTh17細胞の数を減少させる。いくつかの方法でHIV感染は、自然免疫系と適応免疫系の両方が常在菌を修飾することができないように、マイクロバイオータ組成の変化を引き起こす可能性がある、例えば、CD4 T細胞の防御ができないように。もう一つの理由は、慢性的な炎症状況の結果である炎症耐性微生物の存在である可能性がある。腸内細菌叢の変化は、大腸炎の発症やメタボリックシンドロームのような他の問題につながる可能性がある[210]。交替には、病原性細菌の増加が含まれる。例えば、研究では、潜在的に病原性のあるVeillonella、Prevotella、Megasphaera、およびCampylobacter種の範囲の増加を示すHIV感染者における舌マイクロバイオーム組成物の交替が示されている[211]。別の研究では、HIV患者の腸内マイクロバイオータにおいて、Brachyspira、、Catenibacterium、Escherichia、未分類Enterobacteriaceae、未分類Fusobacteriaceae、Mogibacterium、およびRalstoniainの増加を示した[212]。口腔内マイクロバイオームは、カンジダのレベルが上昇し、同時にピキアのレベルが低下している証拠として、真菌の交替も含めて変化する可能性がある。ピキアは、栄養競争のようないくつかの競争を介してカンジダに対して生息する役割を果たしているためである[213]。また、HIV陽性患者の口咽頭マイクロバイオームでは、プロテウス属、エンテロコッカス属、バクテロイデス属、プレボテラ属、クロストリジウム属が最も一般的な微生物である[214]。SIV感染では、このような交互作用も起こる。例えば、慢性SIV感染チンパンジーでは、一時的な微生物相の変化が観察され[210]、慢性SIV感染バーベットサルの腸内マイクロバイオームでは、プロテオバクテリア/スクシニブリオの減少が示されている[215]。
インフルエンザ
インフルエンザは急性感染を引き起こし、これは腸内および呼吸器マイクロバイオームの両方の完全性に何らかの変化をもたらす[179]。例えば、H1N1およびH5N1 IAVのような、そのような種のインフルエンザAウイルス(IAV)への激しい感染。マイクロバイオータの不均衡は、細菌性スーパーインフェクションのような感染後の問題のリスクを高める可能性がある[180]。インフルエンザ感染症では、肺で産生されるI型インターフェロン(IFN-Is)は、必須嫌気性細菌の減少と消化管内のプロテオバクテリアの濃縮を引き起こし、マイクロバイオームの不均衡を引き起こす;また、このIFNはサルモネラ菌誘発性大腸炎に対する免疫応答の低下を引き起こし、腸管内のサルモネラ菌のコロニー化を誘導する[182]。さらに、サルモネラチフス菌の重感染の場合、腸内細菌叢の不均衡の結果として細菌性病原体に対する感受性が高まることが示されている[179]。鳥インフルエンザウイルスサブタイプH9Nに感染したニワトリを対象とした他の研究では、ラクトバチルスとエンテロコッカスの減少に加えて、大腸菌を中心としたEscherichia種の増加が示されている[216]。小児のIAV感染により鼻咽頭(NP)微生物叢が変化する可能性がある。感染した鼻咽頭微生物叢ではMoraxella, Staphylococcus, Corynebacterium, Dolosigranulumなどの菌が少なく,通常はStreptococcusやPhyllobacteriumなどが発見される.これらの患者では、ストレプトコッカス、ナイセリア、ヘモフィルスが減少しているようである。また、シネトバクター、未分類アシドバクテリア、ラルストニア、シュードモナス、ラクノクロストリジウム、ハロモナスも患者群で顕著に増加している。口腔内細菌叢についても、ストレプトコッカス、ナイセリア、ヘモフィルス、ロチア、フソバクテリウム、グラヌリカテラ、ジェメラの減少など、いくつかの変化が見られる。他の研究では、インフルエンザA(H1N1)感染者の上気道からは以下の菌種が最も多く検出されていることが示されている。Enterobacteriaceae, Moraxellaceae, Streptococcaceae, Carnobacteriaceae, Pasteurellaceae, Oxalobacteraceae [218]。
ノロウイルス
ヒトノロウイルス(HnoV)は、消化管に感染し、風土病またはパンデミック型としていくつかの急性胃腸炎を引き起こす[219]。HnoVは、そのカプシドと細菌抗原としてのいくつかの細菌表面糖質との相互作用によって腸内細菌叢に直接影響を与えることができ、別のメカニズムでは、細菌上のシアル酸残基に結合して腸内細菌叢に影響を与えることができる[220]。マウスのノロウイルス(MNV)は、マウスの腸内上皮バリアの障害を引き起こし、腸管の免疫系全体に存在する微生物群集と止血のバランスを崩すことになる。このアンバランスは、炎症性腸疾患(IBD)の危険因子を持つ患者では病気を促進する[157]。2群のマウス(感染マウスと非感染マウス)の腸内細菌叢を比較した研究では、重要な違いは見られず、野生型マウスではMNVによる腸内細菌叢の変化に対して抵抗性があることが示された[221]。MNVとHnoVに関連したマイクロバイオータの不均衡では、FirmicutesとBacteroidetesのレベルの増加が見られた[220]。ノロウイルスに関連した腸内マイクロバイオームの変化の一例として、バクテロイデスの減少とプロテオバクテリア群集の上昇が挙げられる [222]。
ロタウイルス
ロタウイルス(RV)は、乳幼児や若年者の胃腸炎[223]の主な原因の一つであり、下痢から死に至るまでの様々な問題を引き起こす可能性がある。RV感染は腸内マイクロバイオータ組成に影響を与える。子豚を対象とした研究では、RV感染した子豚の腸内細菌叢において、BacteroidetesとBacteroidiaの比率が上昇し、FirmicutesとErysipelotrichiaの比率が低下していることが確認されている。また、一部の細菌群で顕著な変化が見られ、Bacteroidaceae、Helicobacteraceaeの濃縮、Porphyromonadaceae、Lactobacillaceae、Erysipelotrichaceaeの感染子豚での減少が認められている[224]。ロタウイルス予防接種には経口投与の形態がある。ワクチンに反応した乳児では、腸内細菌叢の中のプロテオバクテリアとエガテラのレベルが高く、ワクチンに反応しなかった乳児では、フソバクテリアと腸内細菌科のレベルが高かったという証拠が示されている[225]。したがって、腸内細菌叢はRVウイルスに異なる影響を与えたり、反対に影響を与えたりする可能性がある。
肝炎(HBVおよびHCV)
B型肝炎ウイルスまたはヘパドナウイルスは肝臓に感染する。感染は一過性のものと慢性のものがある [226]。慢性感染は肝硬変や肝細胞癌(HCC)につながる可能性がある[227]。肝臓は胆管と血液の2つの経路で腸とつながっている。腸から離れた血液はすべて肝臓を通過しなければならないので、肝臓病は腸に影響を与え、病気の副作用として腸内細菌叢を変化させる可能性がある[228]。B型肝炎ウイルス[HBV]感染者の口腔内微生物叢にはいくつかの違いがある。HBV(HBV-CLD)による慢性肝疾患患者では、Firmicutes/Bacteroidetesが減少していることが示されている。HBVによる口腔内微生物叢の変化のパターンは、肝硬変(LC)状態と慢性B型肝炎(CHB)状態でも同じである。H2S-やCH3SHを産生するフィロタイプはHBV感染症で増加し、口臭の原因となる。Fusobacterium、Filifactor、Eubacterium、Parvimonas、Treponemaなどは、そのようなフィルタイプの一部である。これらの菌は腸に移行して腸内微生物叢の組成に変化をもたらす可能性があり、この変化の産物はHBV誘発性肝疾患の発症に影響を与える可能性がある[229]。腸内細菌叢の異常は、肝炎感染症の発症を終末期の状況に誘導することができる。ウイルス性肝炎(HBVおよびHCV)は、肝硬変の最も一般的な原因である。肝硬変は粘膜免疫系に影響を与え、すべての相対的なサイトの微生物叢のいくつかの変更を行う。肝硬変患者の便中微生物叢では、バクテロイデスの減少、プロテオバクテリアとフソバクテリアの上昇が確認されている。また、肝硬変の重症度と腸内細菌叢のいくつかの細菌との関係も明らかになっており、例えば、ストレプトコッカス科では正の関係があり、ラクノスピラセ科では負の関係があることが明らかになった。別の研究では、肝硬変における真菌の種類と細菌の種類の関係を発見した[230]。HCVは急性型と慢性型の2つの感染形態を引き起こす。C型慢性肝炎患者は、肝硬変または肝細胞がん(HCC)のような重篤な状態に陥る。慢性C型肝炎患者では、腸内細菌叢が変化しており、例えば、C型肝炎患者、肝硬変患者、HCC患者、肝硬変患者では、プロテオバクテリアの比率が上昇し、バクテロイデテスやファーミキュートスの菌叢が減少している。このことは、マイクロバイオータの変化による病原性と、HCCの進行など患者の重症度との関係を示している可能性があると考えられる。ある研究では、HCV患者の腸内マイクロバイオータのα種は健常者よりも低いことが示された。アクチノバクテリアのレベルは高く、ビフィズス菌の組成は健康な人に検出されただけである[231]。
コロナウイルス(SARSおよびCOVID-19)
コロナウイルスは、エンベロープ型の陽性一本鎖RNAウイルスで、ヒトと動物の両方に感染する可能性がある。コロナウイルスには7種類の亜型があり、主に風邪の原因となるヒトに感染する。しかし,近年,10年ごとに重症急性呼吸器コロナウイルス(SARS),中東呼吸器症候群(MERS),COVID-19などのβ型コロナウイルスからの最新のコロナウイルスが世界的に深刻な健康問題を引き起こしている[233].
SARSとCOVID-19は、肺炎に加えて[234]、様々な消化器症状を引き起こす[235]。したがって、今回の研究で議論されているように、コロナウイルスと微生物相(特に肺微生物相)は相互に相互作用している。つまり、両者はウイルス感染に対する感受性を調節することができ、またウイルス病原体によって調節されることができるということである[236]。そして、そのメカニズムの一部でさえ、他のウイルス感染症と全く共通している。
さらなる研究により、より多くの類似性、より共通のメカニズム、そしてより多くの新しいメカニズムが明らかになるかもしれないが、それらのいずれかがCOVID-19の治療法や診断法になる可能性がある。例えば、HAは免疫系やウイルス感染に対して一般的な共通の作用を持っているので、COVID-19に対して抗ウイルス作用を持つことが期待されている[207]。
例えば、COVID-19とSARSの違いにもかかわらず、COVID-19とSARSはアンジオテンシン変換酵素2(ACE2)のような共通の受容体を持っている。ACE2は急性肺障害のようないくつかの疾患に関与しており、また、消化管の機能にも不可欠な役割を果たしている。ACE2は、腸内の天然アミノ酸に関連するトランスポーターの発現に必要とされる[238]。
アンジオテンシン変換酵素2(ACE2)はコロナウイルスに共通の受容体であり、ヒト腸球に存在する消化に関わる酵素である。コロナウイルスは、他のファミリーよりも変異が多いRNAウイルスである。その結果、その進化の過程で、結合受容体と結合モードの両方に交互に変化が起こる。しかし、それらの腸内標的細胞は、肺のものとは異なり、一定である。
研究は、細菌性病原体とmicrobiotasまたはプロバイオティクスの両方が、プロバイオティクスコロナウイルスの受容体を上昇させることを示唆している[239]。ACE2のアミノ酸輸送機能は、腸内細菌叢と関連している。そのため、ACE2の変異は腸内細菌叢の組成に影響を与え、抗菌ペプチドの発現を低下させる。
一方で、腸内マイクロバイオームがACE2の作用に影響を与えることを示すエビデンスもいくつか存在する。例えば、COVID-19では、これらの可能性のある仲介のいくつかは、ビフィズス菌のようなプロバイオティクス種によって、また、乳酸菌、すなわちL. gasseri [240]によって行われることができる。
一方、SARS_CoV_2感染は、腸管内で発現するACE2を減少させる。その結果、循環血管新生細胞(CACs)も減少し、腸管内皮を危険にさらすことになり、腸内環境を悪化させる可能性がある[241]。これらのエビデンスは、ACE2を介在させたCOVID-19と微生物との相互作用を示唆している。
臨床的証拠ではまだ証明されていないが、中国の国家衛生委員会と国家伝統医学管理局は、プロバイオティクスの投与は、腸内微生物のバランスを維持し、感染症死亡率を減少させることができる二次/共感染を予防するために有益であると宣言した。
一般的に、バランスのとれた腸内微生物叢は、腸炎や人工呼吸器関連肺炎を減少させることができ、インフルエンザ感染などの肺のいくつかのウイルスの複製を抑制することができる。肺微生物叢は、局所的または全身的な炎症反応、宿主免疫反応、粘膜層防御、最終的に二次的な細菌感染を発揮するなどのいくつかの因子を変化させることで、感染を悪化させることができる[236, 242]。
Liuらが行った研究では、試験管内試験でも生体内試験でも、少なくとも1つのヒトコロナウイルス感染において重要な抗ウイルス的役割を持つ72種類の化学薬品と27種類の抗体を調べた。これらの薬剤の多くは、細胞へのウイルスの侵入および細胞内でのウイルスの複製を阻害したり、宿主の免疫応答を調節したりする。さらに、抗マラリア薬(例えば、クロロキンおよびメフロキン)抗真菌薬(例えば、テルコナゾールおよびラパマイシン)および抗生物質(例えば、テイコプラニンおよびアジスロマイシン)のような抗菌薬は、コロナウイルスとの戦いにおいて有益であるように思われる。
これらの抗生物質による治療は、感染に対して直接的な効果を有するかもしれないし、あるいは、浸透性ウイルスに記載された例のように、微生物相の変化を誘発するかもしれない。微生物相は、ヒトの代謝およびウイルス感染に対する免疫応答において重要な役割を果たすので、それらは、コロナウイルスに対して、または有利に、微生物相が介在するメカニズムを調節することができる。
しかし、現在のウイルス感染や細菌の内因性または外因性の共感染から体を守るための予防法として利用できるが、抗生物質の投与はジスビオスを誘導することで有害な影響を及ぼす可能性があることに言及しておくべきである[243]。
最近、Georg Andersonは、ストレスがメラトニンと微生物酪酸の両方に影響を与えてCOVID-19の持続時間と重症度を増加させる要因であることを示唆している。ストレスは腸内細菌叢や腸管透過性の変化を誘導し、概日リズムにも影響を与え、免疫細胞の機能、特にCOVID-19への反応において重要な役割を果たしている。
アルコール、糖分、脂肪分の多い食生活やストレスによる腸内微生物異常は、酪酸のような短鎖脂肪酸の産生を減少させ、COVID-19感染を抑制するために免疫細胞や中枢神経系のグリア細胞の働きを強化する。微生物は、異なる抗ウイルス効果のスペクトルを持つ異なるタイプの酪酸を再販している。
これらの抗ウイルス作用は、インフルエンザウイルスのようなウイルスの共通制御因子であるHDACを阻害するエピジェネティックな制御特性に起因しており、COVID-19との戦いに有益であると考えられている。また、免疫応答における酪酸の役割は、メラトニン作動経路を調節することで、免疫細胞が炎症状態から鎮静状態へと変化することを可能にしていると考えられている[245, 246]。
腸の透過性に関しては、リーキー腸は肺にその微生物群を輸出し、肺の微生物群を変化させることに注意すべきである。この腸内マイクロバイオータは、患者の換気の必要性や生存率の向上に重要な役割を果たしている。例えば、我々は、マイクロバイオータの変化によって引き起こされる腸管透過性の上昇は、全身の循環にLPSと食事物質をリークにつながることができることを見た。
これは、LPSのパターン認識受容体(PRRR)であるTLR4の活性化を介して、インフルエンザ、HBVおよびHIVにおけるウイルスの複製および伝達を悪化させる[137]。さらに、この経路は、免疫抑制性サイトカインの放出につながり、調節性T細胞および樹状細胞の免疫調節効果を低下させる。
これらの変化はすべて、免疫応答からウイルスを逃がし、ウイルス感染を促進することにつながるので、著者はCOVID-19に対しても効果があるのではないかと仮説を立てた[244]。さらに、MMTVはCD14,TLR4,MD-2などのLPS結合タンパク質を次世代のためにウイルスエンベロープに利用するが、これはCOVID-19に対しても起こる可能性がある[149]。
Meazziらによる後期コロナウイルスに関する別の研究では、最も一般的な微生物群はFirmicutes、BacteroidetesおよびActinobacteriaであることが明らかにされた。つまり、FCoV陽性猫では、FirmicutesとBacteroidetesがFCoV陰性猫と比べて多いか少ないかであった。また、腹膜炎を起こした5匹中3匹の猫では微生物相の類似性が認められた。このように、すでにいくつかの違いが検出されている可能性がある。彼らは、猫の腸内細菌叢の組成の変化は、腸性ネココロナウイルス(FCoVs)の突然変異によって引き起こされ、宿主の免疫応答を乱すネコ感染性腹膜炎(FIP)の悪化につながる可能性があると結論付けた。微生物はFCoVの遺伝子多型を変化させることができ、これはウイルスの複製に関連している[247]。したがって、COVID-19の治療に有用である可能性が疑われた。
SARS-CoV-2およびCOVID-19患者の微生物組成は、Community acquired pneumonia(CAP)患者と類似していた。微生物多様性は通常よりも有意に低く、病原体のいずれか、または口腔および上気道の微生物群が優勢であった。しかし、どちらにも特別な微生物パターンは見られない。また、SARS関連死は急性呼吸窮迫症候群(ARDS)と相関することが多く[248]、COVID-19患者の状態はARDSのような重篤な状況に発展する可能性がある[249]。ARDS患者は通常、機械的な換気を必要とし、それが微少な吸引を引き起こすことがある。このようにして、腸内細菌は肺に移行し、肺のマイクロバイオームはバクテロイデテスやエンテロバクテリア科などの腸内細菌によって濃縮されることになる[250]。これまでの研究では、SARS_CoV_2患者の口腔および上気道のマイクロバイオータは、病原体と常在菌のレベルが高いことが示されている[236]。
フラジェリンのようなマイクロバイオータ粒子は時にダメージ関連分子パターン(Damp)として作用し、toll-like receptor 5(TLR5)経路のような免疫経路を刺激する。このことは、インフルエンザやロタウイルス感染症ですでに見られている。フラジェリンは、グラム陽性細菌と陰性細菌の両方の細菌べん毛に存在する構造タンパク質である。フラジェリンは、主に抗菌応答を増加させるが、抗ウイルス活性も持っている。ロタウイルスでは、フラジェリンはTLR5経路を活性化して樹状細胞に影響を与え、IL-22を放出している。また、NLR Family CARD Domain Containing 4 (NLRC4)に依存したIL-18の放出を増加させた。IL-22は上皮細胞とその増殖を正常に維持し、IL-18はアポトーシスを介して感染した上皮細胞を排除する[251]。したがって、この経路は直ちにロタウイルス(RV)感染を除去し、RVクリアランスを促進する[252]。フラジェリン応答はインターフェロン(IFN)応答とは独立していることに注意することが重要である。コロナウイルスは、構造タンパク質および非構造タンパク質を介してタイプIのIFN抗ウイルス応答をハイジャックすることができることを考えると、フラジェリン-TLR5軸を利用することは、SARS-CoV-2を標的にして排除するための効果的な抜け道を提供することができる。皮肉なことに、フラジェリンはTLR5を介したIFN-βの産生およびそれに続くI型IFN応答の活性化を誘導することも可能であることが最近明らかになっており、これはコロナウイルス感染時に障害された抗ウイルス免疫防御を回復するための潜在的な手段を提示している[253, 254]。
フラジェリンウイルス感染症の有益な役割は、いくつかの研究によって証明されている。例えば、ある研究では、インフルエンザAウイルス感染マウスの肺におけるウイルス負荷を減少させることができるフラジェリン投与の治療的役割が明らかにされている[200]。フラジェリンをインフルエンザワクチンや不活化インフルエンザウイルスと併用することで、TLR5を介してインフルエンザに対するIgAおよびIgGの力価が上昇することが示唆されている。これらの研究は、フラジェリンが治療成分として、また強力な粘膜アジュバントとしての役割を強化することを示している[201]。さらに、馬ヘルペスウイルス1(EHV-1)はヘルペスウイルス科のウイルスであり、馬の呼吸器感染、ウイルス性流産、神経症状、新生児死亡など、いくつかの異なる病態を誘発する。本研究は、フラジェリンがHSVワクチン接種において強化的な役割を果たすことを示した[118]。結論として、フラジェリンは、肺樹状細胞の成熟、上皮のアポトーシスの抑制、上皮細胞の維持、カテリシジン依存性抗菌応答の誘導、新生児肺抗原提示細胞の活性化に重要な役割を持っている[253, 255]。これらはいずれもCOVID-19感染において重要であり、この感染における微生物由来フラジェリンの有益な役割を示唆している。
一方、いくつかの研究では、フラジェリンのNF-κBシグナル伝達のTLR5活性化が、肺上皮細胞へのレンティウイルスシュードウイルスの付着を促進することが報告されている。つまり、TLR5の活性化はSARS-CoV-2感染を促進し、有害な炎症反応を誘導する可能性があるということである。つまり、IL-18およびIL-22の投与だけで、有害な効果の中に有益な効果があるということになる。いずれにしても、コロナウイルス感染の初期段階で示された免疫応答の欠如は、TLR5アゴニストが感染の初期段階で最も有用であることを示唆しているかもしれないが、一方で、クロロキンがTLRを認識する核酸の阻害剤であることから、メディアではクロロキンが後期の感染に対して最も有用であると誇大に宣伝されている[253]。いずれにしても、TLR5活性化の利益またはコストは、COVID-19の発症機構に関する知識を拡大し、適切なウイルス段階での適切な治療標的へと導いてくれるであろう。TLR5と同様に、宿主ヌクレアーゼ162を介したNETの分解は、そのような介入がHaemophilus influenzaeのような特定の病原体の燃料源として報告されているため、潜在的なリスクを有する可能性がある[11]。したがって、もしSARS CoV-2が同様の戦略を用いているならば、これもまたその病原体の発生を促進する可能性がある。しかし、コロナウイルスが宿主ヌクレアーゼを介したネットの分解を病原性のために利用することを関連づけた論文はこれまでにない;したがって、この関係を研究することで、2つの新しい知見のうちの1つが得られる可能性がある。(i) コロナウイルスの病原性の未踏のメカニズム、または (ii) 異常な自然免疫応答の制御を通じて COVID-19 を倒すための潜在的な治療法(すなわち DNase I) [253] である。ロタウイルス感染に対するフラジェリン保護に関するこれまでの研究に基づいて、我々は、感染後48時間以内にフラジェリンが最も強力に作用するという仮説を立てた。
結論
最後に改めて言及しなければならないのは、ウイルス感染におけるマイクロバイオータの役割やウイルスがマイクロバイオータ組成に及ぼす影響についての論文はあるものの、それらがどのように機能するのかについての理解は十分ではないということである。また、この問題は単一の微生物種間の相互作用だけではなく、異なる宿主、異なるマイクロバイオータ、異なるウイルス間の経路の複雑なネットワークに直面している。
フラジェリンはマウスのRV感染抑制効果[142]で知られてたが、これまでの報告では、TLR5やNF-κBの活性化を介してインフルエンザ、麻疹、エボラ、ラッサ、水胞性口内炎ウイルスなどのウイルス感染を肺上皮細胞培養で促進することが示されている[256]。これらの逆説的な結果は、これらの研究で利用された微小環境やモデルの違いに起因している。私たちは、これらの相互作用がどれだけ複雑で未知のものであるかを示すために、これらの研究を思い起こさせてくれる。
しかし、マイクロバイオータとウイルス感染症の間のこれらのメカニズムを知ることは、細菌の分泌物に由来するか、またはバイオエンジニアリングを介して製造された化学薬品、および体内で植民地化し、それらに関連する抗ウイルス応答を誘導することができるプロバイオティクス薬の両方を生成するのに役立つ。さらに、これらは、前治療やワクチン免疫学のブースターとして利用することができる。
ワクチン学の分野では、経口腸管ワクチン、特にロタウイルスワクチンにマイクロバイオティクスが免疫原性を発揮し、ワクチンの有効性を向上させることを見出している。また、マイクロバイオータの標的が特定のワクチンと患者集団の両方に関連していることも確認されている[232]。
病原体といえば主にウイルスを思い浮かべるが、健康な人々の共生微生物群でありながら、未だに研究されていないウイルスが存在することは特筆すべきことである。これらには、バクテリオファージや植物微生物群のほか、真核生物のウイルスも含まれるが、これらのウイルスは宿主の細菌や食生活に依存して、個人個人の中に存在している。また、これらの微生物は、ウイルス感染に抑制的または凝集的に影響を与える可能性があるが、より詳細な研究が必要とされている。
最後に、マイクロバイオーム・バイオバンクをヒトや動物の両方に拡大する必要があり、今後の生物医学研究や産業界での研究に役立つと考えられる[257]。
