Contents
Drugs that offer the potential to reduce hospitalization and mortality from SARS-CoV-2 infection: The possible role of the sigma-1 receptor and autophagy
www.ncbi.nlm.nih.gov/pmc/articles/PMC8290373/
Published online 2021 Jul 15.
James Michael Brimson,a,b Mani Iyer Prasanth,a,b Dicson Sheeja Malar,a,b Sirikalaya Brimson,c Premrutai Thitilertdecha,d and Tewin Tencomnaoa,b
概要
はじめに SARS-CoV-2に対する新しいワクチンが利用できるようになったにもかかわらず、世界の一部の地域では利用が進まず、供給に問題が生じている。そのため,患者の入院を防ぎ,医療システムの負担を軽減することができる薬剤が依然として必要とされている。シグマに親和性のある薬剤は、SARS-COV-2の最も重篤な症状に対する保護を提供する可能性があり、シグマ-1受容体との相互作用によって死亡率を防ぐことができるかもしれない。
対象分野 この総説では、SARS-CoV-2感染症におけるシグマ-1受容体とオートファジーの役割を検証し、それらがどのように関連しているのかを考察している。著者らは、シグマリガンドがSARS-CoV-2に起因する症状、合併症、死亡をどのように軽減するかを明らかにし、これらの薬剤から最も恩恵を受ける可能性のある患者コホートについての洞察を提供している。
専門家の意見 シグマに親和性のある薬剤は,シグマ1受容体との相互作用を介して,SARS-CoV-2の最も深刻な症状を予防する可能性がある。シグマ-1受容体のアゴニストは、ミトコンドリアの保護、損傷したミトコンドリアや漏出したミトコンドリアを除去するマイトファジーの活性化、ERストレスの防止、カルシウムイオン輸送の管理、感染に応じた細胞死を防ぐオートファジーの誘導などを行う可能性がある。
キーワード:COVID-19,フルボキサミン、フルオキセチン、ドネペジル、クロルプロマジン、SARS-CoV-2,シグマ-1,オートファジー、クリティカルケア、Long-COVID
1. はじめに
SARS-CoV-2(COVID-19としても知られている)パンデミックは、世界的に大きな健康被害をもたらしており、社会的・政治的状況に影響を与えるとともに、医学の分野にも相当な負担をかけており、世界中の医療システムが大きなプレッシャーにさらされている[1]。観察される一般的な症状は、咳、発熱、息苦しさである[2,3]。多くの場合、症状は軽度または全くないが、かなりの少数(約5%)の症例では症状が重度となる。急性肺損傷や呼吸困難、心不全、そしてこれらの重症例の中には心停止による死亡例もある。ポジティブな症例と死亡率は常に増加しているが、ワクチンの開発が希望を与えてくれる。しかし、ワクチン接種プログラムの実施には時間と資源が必要であり、その間にも感染率は上昇し続け、現在のワクチンに耐性を持つ可能性のある新たな変異株や変異株が出現する危険性がある。そのため、患者を集中治療室に入れず、医療システムへの負担を軽減する効果的な治療法が、特にまだワクチンを入手できていない発展途上国では、依然として必要とされている。
研究者たちは、SARS-CoV-2の神経学的症状を示す証拠を見つけており、これは予後を左右する可能性がある[4]。SARS-CoV-2に感染したと診断された患者236人379人を対象とした最近の研究では、感染後6カ月間に神経系疾患を発症するリスクが有意に上昇することが示された。集中治療室に入院した患者では、その後に神経系疾患と診断された割合は40%以上で、25%以上がそのような診断を初めて受けてた。これらの疾患には、頭蓋内出血、虚血性脳卒中、パーキンソン病、認知症、不安障害、気分障害、その他の精神疾患などが含まれていた[5]。SARS-CoV-2感染による神経病理学的影響は、主に(i)ウイルスによる直接的な傷害、(ii)炎症性亢進状態に続発する神経・血管病理、(iii)血管障害・凝固障害、(iv)感染後の自己免疫、(v)重症化(敗血症、低酸素症)による神経学的結果などがあり[4,6]、これらは中枢神経系だけでなく、末梢神経系にも影響を及ぼす可能性がある。しかし、これまでの研究では、感染後に発症する神経系疾患は、ウイルスが神経系に直接侵入するのではなく、体内での反応によるものではないかと考えられている[3,7]。
SARS-CoV-2は中枢神経系に影響を与え、それによって虚血性脳卒中を引き起こし、炎症性マーカーの上昇と内皮機能障害によって示される[7-9]。また,脳症,脳炎,出血を伴う場合と伴わない場合の急性脱髄性脳脊髄炎,横髄炎なども報告されている[4]。また,ギラン・バレー症候群(GBS),腕神経叢症,多発性紅斑性神経炎,ミオパチーなどが中枢神経系の症候群として報告されている[2,6]。しかし、現在のパンデミックからの回復期においては、回復した患者の長期的なケアのための戦略を計画することによって、感染後の疲労も優先されるべきである[10,11]。
新薬の開発には、コストと時間がかかる。主要な化学者は、新しい化学物質の製造には、それぞれ7つ以上の合成ステップが必要だと推定している[12]。さらに、これらの新薬は、市場に出る前に安全性と有効性をテストする必要がある。重要な安全性試験にすでに合格している医薬品は、特に新しく開発されたワクチンを利用できない発展途上国において、人命や資源を救うことができる。そのような薬剤の例としては、患者に抗うつ剤を投与することで、初期の観察研究から報告されているように、SARS-CoV-2による入院、挿管、死亡のリスクが減少することが示されている[13]。
本レビューでは,容易に入手可能な薬剤を用いてSARS-CoV-2感染による入院・死亡率を低下させる可能性を取り上げ,その保護効果の背後にあるシグマ-1受容体関連のメカニズムの可能性を推測している。
2. SARS-CoV-2感染症とオートファジー
一般に、コロナウイルスは2つのメカニズムのうちの1つを介して細胞に侵入する。(1)ウイルスRNAが細胞膜の融合孔から細胞質内に侵入 (2)エンドサイトーシス [14,15]。SARS-CoV-2は,スパイクタンパク質(S)を介して細胞表面の受容体であるアンジオテンシン変換酵素2(ACE-2)に結合し,膜貫通型セリンプロテアーゼ2(TMPRSS2)によるプロテアーゼ活性を介して活性化される.タンパク質分解により放出されたフラグメントS2は、細胞膜に結合し、ウイルスゲノムを宿主の細胞質内に移行させる[16]。TMPRSS2の存在はこのメカニズムに有利であり、プロテアーゼの発現がないため、ウイルスの侵入はエンドサイトマシンによって媒介され、スパイクタンパク質はリソソームのカテプシンLによって処理され、活性化される[17]。細胞内に侵入すると,ウイルスRNAは複製を開始し,細胞複製機構を制御して必要なタンパク質を産生し,その後,小胞体やゴルジ体で組み立てられ,エキソサイトーシスによって細胞外に放出される。
SARS-CoV-2は、小胞体の機能を乗っ取り、分泌タンパク質や構造タンパク質を処理してパックし、宿主の機能を損なう。小胞体にウイルスタンパク質が蓄積されると小胞体ストレスが生じ,細胞のホメオスタシスを維持するために,アンフォールドタンパク質応答(UPR)が活性化される[18].Binding-immunoglobulin protein/78kDa glucose-regulated protein(BiP/Grp78)は、UPR機構のマスターレギュレーターとして機能し、下流のエフェクターであるinositol-requiring protein 1α(IRE-1α)protein kinase RNA-like endoplasmic reticulum kinase(PERK)activating transcription factor 6(ATF6)を制御する。小胞体ストレスによってGrp78が放出されると、3つの膜貫通型受容体が活性化され、負担を軽減するために特定の時間だけ細胞の機械を再プログラムする信号が送られる [19]。しかし,ストレス状態が長く続くと,オートファジーやアポトーシスが起こるようになる[20]。HEK293T細胞にSARS-CoV-2スパイクタンパク質を過剰発現させると、Grp78の発現が誘導され、さらにPERKの活性化によってリン酸化eIF2αの発現が増加し、ストレス状態が緩和されることが示されている。同様に,ある症例対照研究では,SARS-CoV-2感染者では,健常者と比較して,CHOPの発現に変化はないものの,Grp78とPERKが有意に増加しており,感染時にUPR機構が活性化されていることが示されている[21]。バイオインフォマティクスの手法を用いて,ヒトのマイクロRNA(miRNA)とSARS-CoV-2のゲノムとの相互作用の可能性が予測されている[22]。miRNAは,宿主の抗ウイルス細胞防御に関与しており,ウイルスタンパク質の翻訳を阻害したり,免疫反応を制御したりする可能性がある[23,24]。小胞体ストレス誘発剤であるチュニカマイシンをヒト肺上皮細胞に投与すると、miRNAの発現が低下することが報告されており、SARS-Cov-2によって誘発される小胞体ストレスも同様の結果をもたらす可能性があると考えられている[25]。バイオインフォマティクスの研究により、ホストのmiR-34a-3pとmiR-495-5pの減少は、XBP-1sとGrp78の発現を増加させ、細胞の生存を促進することが明らかになった。さらに、miR-376b-3pとの相互作用は、mTORおよびオートファジー機構を調節する可能性があり、SARS-CoV-2は宿主のmiRNAを調節して、感染細胞の小胞体機構を好意的にハイジャックし、宿主の免疫系から逃れることができるという仮説が立てられた[22]。
オートファジーは、真核細胞の間で進化的に保存されたダイナミックなプロセスであり、細胞のホメオスタシスを維持するために、損傷した小器官、バクテリア、ウイルス粒子、折りたたまれていないタンパク質などを除去する。このプロセスは,損傷した小器官がオートファゴソームに取り込まれることから始まり,オートファゴソームはリソソームと融合し,リソソームではタンパク質分解酵素の助けを借りて内容物が分解される[26]。ウイルス感染は,オートファジーを活性化したり阻害したりする可能性があり,ウイルスや宿主細胞の種類によっては,免疫系から逃れるための諸刃の剣のような働きをすることが研究で指摘されている。例えば,単純ヘルペスウイルス1,コクサッキーウイルスB,サイトメガロウイルス[27-29]はオートファジーを阻害するが,ヒト免疫不全ウイルス,インフルエンザウイルス,C型肝炎ウイルスは,その複製と増殖のためにオートファジーを誘導する[30-32]。SARS-CoV-2は、いくつかの細胞プロセスに干渉することで、増殖のためのオートファジープロセスを阻害していることが示唆されている。ネットワークプロファイリングやトランスクリプトーム解析では、SARS-CoV-2がオートファジーに障害を与え、GSK3βのアップレギュレーションやオートファジー関連遺伝子SNAP29,リソソーム酸性化遺伝子のダウンレギュレーションのいずれかによってオートファジーフラックスを阻害し、ウイルスの逃避と伝播に寄与していることが報告されている[33,34]。Gassen et al 2020)は,SARS-CoV-2感染症では,AMPK,mTORC1の阻害により,解糖やタンパク質翻訳が低下することを報告している.さらに、スペルミジンのダウンレギュレーション、AKT1/SKP2を介したBeclin-1の分解、オートファジーフラックスの減少、P62レベルの上昇も観察され、オートファジーの阻害を示した。ATG-14におけるBeclin-1のダウンレギュレーションに続く減少は、STX17-SNAP29-VAMP8 SNAREを介したオートファゴソームとリソソームの融合を制御しており、そのプロセスの崩壊を示している。
SARS-CoV-2感染に伴い,Vero-6細胞ではオートファゴソームの形成が増加したが,成熟度とオートファジックフラックスが低下したことが[35]で報告されており,著者らは付属タンパク質ORF3aを単独で発現させると不完全なオートファジーが引き起こされることを示している.ORF3aは,後期エンドソーム/リソソームに局在し,HOPS(homotypic fusion and protein sorting)複合体(VPS11,VPS16,VPS18,VPS33,VPS39,VPS41からなる)と相互作用し,後期エンドソーム/リソソームへのVPS39の蓄積を誘導することで,VPS39を含む機能的なHOPS複合体の形成に影響を与える。HOPS複合体は,シンタシン17(STX17)と相互作用することで,オートファゴソームとリソソームの融合の仲介に関与している[36]。ORF3aは,HOPS複合体とSTX17との相互作用を阻害し,STX17-SNAP29-VAMP8 SNARE複合体の形成を妨げ,オートファゴソームの成熟に障害をもたらす[37].別の研究では,ORF3aは,オートファゴソームの形成に関与するBeclin-1-Vps34-Atg14複合体を誘導し,オートファゴソームの成熟を促進するBeclin-1-VPS34-UVRAG複合体を阻害することが示されている。後者の複合体が阻害されることで、オートファゴソームとリソソームの融合が阻害され、ウイルス粒子の分解を助ける。紫外線抵抗性関連遺伝子(UVRAG)とクラスIIIホスファチジルイノシトール3キナーゼであるVPS34は、Beclin-1と同じ結合部位で競合してそれぞれの複合体を形成するが、Beclin-1-UVRAG複合体はATG14よりも機能的に重要で競合性が高く、分解を促進する[38]。しかし、ORF3aはUVRAG-Beclin-1複合体の形成を低下させ、ATG14が結合部位でより競合するようになり、不完全なオートファジーを促進した[35]。Yuen et al 2020)は,VPS34の上流であるULK1に対する阻害剤SBI0206965やクラスI PI3-Kを阻害する3-メチルアデニンよりも,阻害剤VPS34-IN1を用いてVPS34を標的にした方が,Vero-6細胞におけるSARS-CoV-2感染を有意に抑制できることを示した[39].これらの結果は,SARS-CoV-2が完全なオートファジー機構を利用しているのではなく,そのプロセスに関与するコンポーネントのいずれかを利用している可能性を示している.オートファジー調節剤であるクロロキン、ヒドロキシクロロキン、クロミプラミン、メフロキン、ROC-325を用いた予備的研究では、SARS-CoV-2の細胞毒性作用を軽減することが示されている[40]。このように、オートファジーとSARS-CoV-2の伝播との関連性が報告されていることから、オートファジーを調節する薬剤を用いた治療戦略は、このウイルスとの戦いに役立つ可能性がある。
3. シグマ1受容体の活性化とオートファジー
近年、シグマ-1受容体をオートファジー活性の調節に関連づける研究がいくつかなされている。その中で最も説得力があるのは、シグマ-1受容体をノックアウトすると、オートファジーが不完全になり、オートファゴソームが蓄積されることである[41]。さらに,シグマ-1陰性細胞にシグマ-1遺伝子の完全長コピー(切断型ではなく)をトランスフェクションすると,オートファジー機能が回復する[41]。シグマ-1受容体がオートファジーに関与していることを示す証拠は,PRE-084およびANAVEX2-73(シグマ-1アゴニスト)がUKL-1のリン酸化の増加を伴うオートファゴソームの生合成を誘導することを示す研究によってさらに強化されている[42].さらに,フルオキセチン,フルボキサミン,イミプラミンなど,シグマ-1受容体に親和性のある多くの抗うつ薬が,さまざまな研究でオートファジー反応を誘発することが示されている[43-46]。オートファジーの制御異常は,アルツハイマー病を含むいくつかの神経変性疾患の重要な要素として知られており[47],近年,シグマ-1受容体は,オートファジーだけでなく,神経変性に関与しうる他の細胞メカニズムにも直接・間接的に影響を与える標的であることが明らかにされている[48]。最近の研究では,フルボキサミンを用いてシグマ-1受容体を刺激すると,IRE1経路を阻害することにより,オートファジーが活性化され,心筋線維症が予防されることが示されている[49]。
4. シグマ-1受容体とSARS-CoV-2
シグマ-1受容体は,膨大な数の組織に発現しているシャペロンタンパク質で,主に小胞体やミトコンドリア関連膜(MEM)に存在し,様々な受容体[50],イオンチャネル[51-53],Gタンパク質[54,55]と相互作用している。シグマ-1受容体は,活性化されると細胞膜(PM)に移動し,他のタンパク質と解離して,結合免疫グロブリンタンパク質(BiP)などの複合体を形成することがある[56].シグマ-1受容体は、細胞のストレスを管理する役割を果たしており、その活性化は、カルシウムをミトコンドリアに運ぶことで、小胞体ストレスやミトコンドリアストレスを防ぐと考えられている[57]。そのため,シグマ1受容体のアゴニストは,細胞保護作用を持つ傾向があり,アルツハイマー病などの神経変性疾患の治療薬の開発につながっている[58-60]。
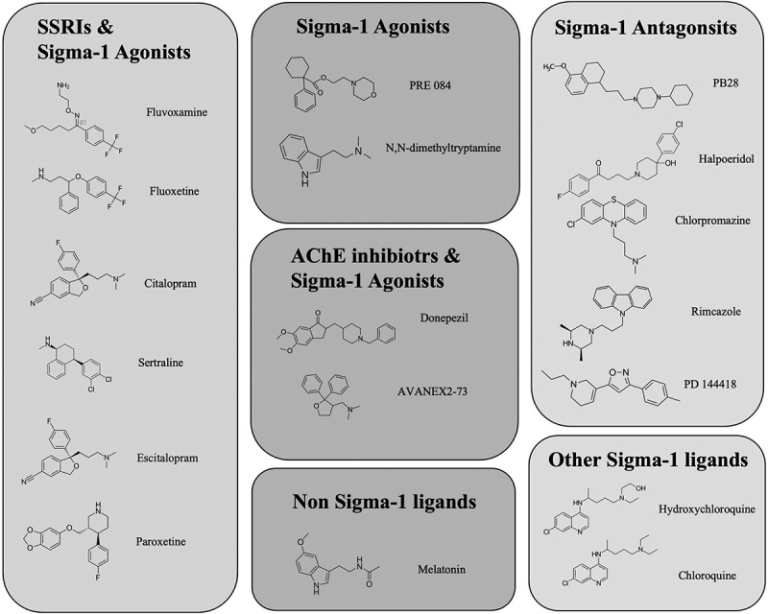
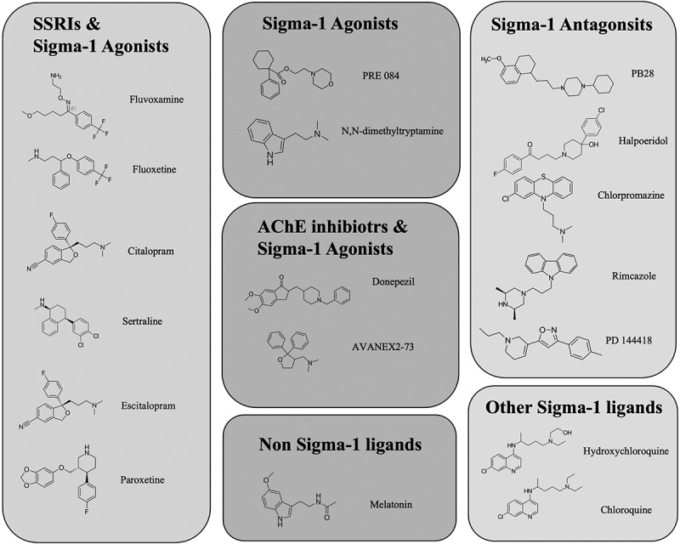
タンパク質相互作用マッピング研究では,69種類の化合物(FDA承認薬29種類,臨床試験中の薬12種類,前臨床化合物28種類)が標的とする66種類の薬効のあるヒトタンパク質または宿主因子が同定された。特に注目されたのはシグマ受容体(Sigma-1およびTMEM97/Sigma-2)で,PB28,ハロペリドール,クロペラスチン,PD144418,ヒドロキシクロロキンなどのシグマリガンド(図1)は,10~100nMの範囲でウイルスの感染性を阻害する活性を有していた[61].シグマ-1受容体のノックダウンおよびノックアウト研究では、SARS-CoV-2の複製の有意な減少が示された[62]。さらに、染色体9p13.3にあるシグマ-1受容体の遺伝子座に着目したゲノム解析では、一塩基多型(SNP)rS17775810のマイナーホモ接合体TTアリル(機能喪失や運動ニューロン疾患に関連するSNP)は、ヘテロ接合体TCアリルやホモ接合体CCアリルに比べて死亡率が低い(0%)ことが確認された(16. 2%)さらにSARS-CoV-2のウイルス複製におけるシグマ-1受容体の役割を示唆している[63]。
図1 シグマ-1受容体に関連する活性を持つ様々な化合物の構造
5. 他のパンデミックにおけるオートファジー、シグマ-1受容体、およびそのリガンドの役割について
オートファジーは、ウイルスが宿主の免疫システムから範囲を回避する際に重要な役割を果たしている。S-phase kinase-associated protein 2 (SKP2)を遺伝的または薬理学的に阻害すると,BECN1のユビキチン化が減少し,オートファジー・フラックスが促進され,MERS-CoVのウイルス複製が抑制されるという研究結果がある[64]。C型肝炎ウイルス(HCV)は、小胞体ストレスを誘発することで、あるいはウイルスタンパク質(p7イオンチャネルタンパク質、NS5A)の過剰発現とBeclin-1との相互作用によって、オートファジーを直接活性化することができる[66,67]。Dreuex et al 2009)は、オートファジー機構はHCVウイルス粒子の侵入や分泌には必要なく、代わりにレプリコンの複製やライフサイクルに必要であると報告している[68]。A型インフルエンザウイルス(H1N1)の場合,ウイルスのヘマグルチニン糖タンパク質が宿主細胞膜上の熱ショックタンパク質90AA1と結合すると,Akt/mTOR経路が阻害され,オートファジーが誘導される[69].ジカウイルスのウイルスタンパク質(NS4A, NS4B)は,共にAkt/mTOR経路を抑制し,オートファジーを促進するが,これはLC3-IIレベルの上昇からも指摘できる[70].小分子によるシグマ1受容体の活性化は,オートファジーを誘導することが報告されている[42].他のウイルス感染症におけるシグマ-1受容体の役割は,シグマ-1受容体によるC型肝炎ウイルス(HCV)RNA複製の初期段階の制御を示す報告[71]や,コカインによるシグマ-1受容体のアゴニズムがミクログリア細胞におけるHIV-1の発現を増加させることを示す報告[72]を除いて,十分に研究・報告されていない.さらに,コカイン投与前にシグマ-1受容体アンタゴニストを使用すると,HIV-1感染マクロファージにおけるカテプシンBの発現が減少し,アポトーシスシグナルが減少することが明らかになった[73]。
シグマ-1受容体リガンドは,さまざまなウイルス感染症に対してしばしば試験されていた。例えば,クロロキンは多くのウイルスに対して活性を示する。クロロキンの投与は,インターフェロンシグナルに適合した妊娠中のSJLマウスにおける慢性ジカウイルス感染症の垂直感染を有意に減弱させ,AG129マウスにおける急性ジカウイルス感染時の死亡率をより低い副作用で減弱させた[74]。ヒドロキシクロロキンは、NS2B-NS3のプロテアーゼ活性を阻害することで、ジカウイルスの加水分解と成熟を助け、胎盤細胞への感染を減少させる[75]。クロロキンの誘導体は、子宮頸部細胞におけるジカウイルスの複製を阻害することができた[76]。弱塩基であるクロロキンは、エンドソーム、ゴルジ小胞、リソソームなど、ウイルスが侵入、複製、成熟に依存している酸性の小器官内に蓄積する可能性がある[77]。無作為化三重盲検プラセボ対照パイロット試験では、クロロキンによる治療が、他のウイルス治療に反応しないHCVウイルスRNAレベルを低下させることが報告されている[78]。HCVレプリコンをトランスフェクトしたHuh-7細胞にクロロキンを投与すると、ウイルス関連のオートファジーを標的としてウイルスの複製を阻害した[79]。同様に,クロルプロマジンおよびトリフルオペラジンは,Vero E6細胞株において,EC50値がそれぞれ5.76および12.9μMのMERS-CoVおよびSARS-CoVの感染を強く阻害した[80]。クロルプロマジンの処理は,カベオリン-1陰性のHepG2細胞におけるSARS-CoVのクラスリン依存性侵入を有意に阻害し[81],MERS-CoVの複製および細胞間融合を適度に阻害した[82]。MDCK細胞をクロルプロマジンで前処理すると、クラスリンを介したH1N1ウイルスの侵入が阻害される[83]。フルオキセチンは、非構造ウイルスタンパク質2 Cに立体特異的に結合することで、コクサッキーウイルスの複製を阻害する[84,85]。ウイルスの侵入,複製,成熟,宿主細胞内でのオートファジーの調節におけるシグマ-1受容体の役割を考えると,シグマ-1受容体に関連した様々なウイルス感染症の詳細な研究は,より良い洞察を与え,使用される薬剤の作用様式の可能性を広げるだろう。
6. シグマ受容体医薬品とSARS-CoV-2
6.1. フルボキサミン
Luvoxという商品名で販売されているフルボキサミン(図1)は、選択的セロトニン再取り込み阻害剤であり、抗うつ剤として知られているが、ERのシグマ-1受容体(Ki 36 nM)[60]を活性化し、サイトカインの産生を減少させることもできる[86]。現在までに、SARS-CoV-2感染による入院に対するフルボキサミンの保護効果について、2件の二重盲検無作為化プラセボ対照試験が実施されており、さらに大規模な試験が世界各地で進行中である。完成した研究のうち、152人の被験者を対象とした1つの無作為化二重盲検臨床試験では、息切れや入院を伴う低酸素状態と定義される臨床的進行が、観察のみの場合の8%から、フルボキサミンを1日300mgまで投与した場合には0%に減少したことが報告された[87]。フルボキサミンを服用している65人の患者と服用していない48人の患者を対象とした2つ目の研究では、入院の発生率はそれぞれ0%と12.5%であり、14日後の残存症状の持続率は、フルボキサミンと無治療でそれぞれ0%と60%であった[88]。これらの研究はいずれも小規模なものであり、2番目の研究はプラセボを含まない(無治療の患者のみ)が、いずれもフルボキサミンが必要な入院、挿管、死亡を予防できることを示唆する非常に有望な初期データを示している。さらに、フルボキサミンは、長期的な症状(2週間以上)を防ぐこともできるようである。しかし、SARS-CoV-2治療薬としての使用を推奨するには、より大規模な無作為化プラセボ対照試験が完了するのを待たなければならない。
コロナウイルスの複製は、小胞体と関連しており[89-91]、小胞体ストレスを誘発し、アンフォールドタンパク質応答を活性化することが示されている[92,93]。したがって,フルボキサミンは,シグマ-1受容体アゴニストとして,従来の炎症経路を阻害することなく,小胞体ストレスやサイトカイン分泌を抑えて,細胞ストレスを軽減することができる。この細胞保護作用は、SARS-CoV-2感染によってもたらされるサイトカインストーム症候群による心筋障害の予防に役立つと考えられる[94,95]。シグマ-1受容体はIRE-1α活性を調節し、小胞体ストレスを軽減することが示されており、げっ歯類を用いた研究では、シグマ-1受容体アゴニストは、敗血症の前臨床モデルにおいて、心臓を保護し、生存率を高めることが示されている[86]。IRE-1は、コロナウイルス感染に起因するオートファジーの誘導に不可欠である[92]。したがって,シグマ-1受容体の活性化によるIRE-1の阻害は,SARS-CoV-2がその複製の一部としてオートファジー経路をハイジャックするのを防ぐ可能性がある.フルボキサミンはまた、ホルモンであるメラトニンのバイオアベイラビリティを高めることが示されており[96,97]、それ自体がSARS-CoV-2の感染(後述)に役割を果たしている可能性がある[98-101]。
SARS-CoV-2ウイルスは、その複製プロセスの一部としてミトコンドリアをハイジャックし、検出を回避する[102]。その結果,ミトコンドリアの脱分極が起こり,ミトコンドリアDNAが,シトクロムCやカルシウムイオンなどのミトコンドリア成分とともに細胞質に放出される.これらの成分の放出は、アポトーシスや細胞死の引き金となる[103]。これは特に肺や心臓の組織で問題となり、ここでの損傷は感染した患者に深刻な影響を及ぼす可能性があるからである。フルボキサミンでシグマ-1受容体を刺激すると、心筋細胞においてミトコンドリアのカルシウム動員が回復し、ATP産生が回復することが示されており[104]、心臓組織に対しても他の有益な効果(抗酸化作用を含む)があることがわかっている[105,106]。さらに、sigma-1 KOマウスは、ミトコンドリアのエネルギー動態に関連した心機能障害を持っているようである[107]。
6.2. フルオキセチン
フルオキセチンは、選択的セロトニン再取り込み阻害剤(SSRI)抗うつ剤であり、シグマ-1受容体アゴニスト(Ki 214-240 nM)[108](商品名Prozacで販売)であり、いくつかの免疫調節作用[109]を有するとともに、オートファジーの誘導剤でもある[110]。フルオキセチンの試験管内試験研究では,SARS-CoV-2を阻害するが,狂犬病ウイルス,ヒト呼吸器合胞体ウイルスの複製,ヒトヘルペスウイルス-8,単純ヘルペスウイルス1型などの他のウイルスは阻害しないことが示されている。このことから、フルオキセチンは、より一般的な経路を活性化または阻害するのではなく、SARS-CoV-2を特異的に阻害する作用があると考えられる。有効量は1~50μM程度と報告されており[111,112]、SARS-CoV-2感染の細胞培養モデルでは、50μM以下の濃度では無毒性である[112]。
6.3. ドネペジル
ドネペジルは、アルツハイマー型認知症の治療に用いられる神経保護剤である。ドネペジルは、抗アセチルコリンエステラーゼ活性を有するだけでなく、シグマ-1受容体アゴニストでもある。ラット実験では、ドネペジルはラット脳内のsigma-1R部位を用量依存的に占有することが示されている[113]。また、[11C]SA4503を用いたヒトでのPET試験では、ドネペジルの経口投与により、脳内のsigma-1受容体部位を60~75%占有することが示された[114]。ドネペジルは,網膜神経節細胞において,神経突起の伸長を促進し,オートファジーフラックスを誘導することにより,神経保護作用を引き起こすことが示されている[115]。
さらに、ドネペジルはAMPKを活性化することも報告されており、mTORに依存しないメカニズムでオートファジーを誘導することが可能であることが示されている[116]。さらに、複数の研究で、ドネペジルのマイトファジーおよびオートファジーに対する有益な効果が、心臓の虚血および再灌流障害に関して調べられている[117,118]。これらを総合すると、ドネペジルの潜在的なシグマ-1アゴニスト活性、細胞保護特性、およびオート/マイトファジー制御に関するこれらの証拠は、SARS-CoV-2に感染した患者を治療する際に有益であると考えられる。しかし、実際にドネペジルの投与が有益であるかどうかを確認するためには、さらなる研究が必要である。
6.4. メラトニン
メラトニン(MN)は、シグマ-1受容体アゴニストであるN, N-ジメチルトリプタミン(DMT)と類似した構造を持っている(図1)。DMTと構造が似ているものの,MNはアミンであるDMTとは異なりアミドであり,MNがシグマ-1受容体に結合したり活性化したりするという証拠は現在のところない。しかし、ラットのシグマ-1受容体アゴニストを用いた研究では、(+)-N-アリルノルメタゾシンが夜間にMNの産生を増強することが示されている(日中には作用しない)[119]。MNは、夜間に松果体から分泌されるホルモンで、主に睡眠サイクルの調節に関連している。フルボキサミンは、ホルモンであるメラトニンのバイオアベイラビリティを高めることが示されており[96,97]、メラトニンの補給とSARS-CoV-2感染に関する研究も進行中である。このことは、高齢の患者はメラトニンレベルが低下しており、SARS-CoV-2関連死に対して脆弱であるという事実と相関していると思われる。さらに、メラトニンは、抗酸化物質および抗炎症物質として作用する。全身の組織では、ミトコンドリアがメラトニンを合成することができるという多くの証拠がある[120,121]。メラトニンは、酸化ストレスを緩和し、ミトコンドリアのオートファジー(mitophagy)の標的として作用することができる。上述したように、SARS-CoV-2は、ミトコンドリアの脱分極、シトクロムCの放出、酸化ストレスを引き起こす。マイトファジーの調節がうまくいかないと、メラトニンの分泌量が変化したり、ダメージを受けたミトコンドリアが取り除かれずに細胞内でさらなる酸化ストレスが発生したりする可能性がある。
6.5. クロロキンとヒドロキシクロロキン
クロロキンとヒドロキシクロロキンは、抗マラリア薬であり、シグマ-1受容体に中程度の親和性を持つ自己免疫疾患の治療に用いられることもある。クロロキンは、オートファジーを阻害する濃度よりも低い濃度で、シグマ-1受容体依存的に細胞保護作用を発揮することが以前に示されており[122]、SARS-CoV-2治療薬の候補として期待されている。SARS-CoV-2が発生した初期段階では、感染の症状を遅らせたり予防したりするための治療法を探すのに奔走していた。ヒドロキシクロロキンは、SARS-CoV-2感染症の予防に有効であることを示唆する試験管内試験データやいくつかの小規模な非対照研究に加え、忍容性のある安全性プロファイルを備えていることから、当初は様々な保健機関(インド、中国、韓国、イタリアなど)からSARS-CoV-2感染症の治療薬として推奨されていた[123]。ヒドロキシクロロキンには、網膜症、低血糖症、生命を脅かす不整脈、心筋症など、生命を脅かす可能性のある多数の副作用がある。心臓突然死のリスクを減らすために、アジスロマイシンと一緒に処方された[124]。ヒドロキシクロロキンは 2020年3月に当時のアメリカ合衆国大統領であるドナルド・J・トランプ氏に支持されたこともあり、薬の需要が高くなった[125]。しかし 2020年6月の時点で、臨床研究ではヒドロキシクロロキンを投与した入院患者にほとんどメリットがないことが示されており[126-129]、さらに憂慮すべきは、ヒドロキシクロロキンがSARS-CoV-2の入院患者の死亡リスクを高める可能性を示した研究であった[130]。その後、データの不正や、SARS-CoV-2入院患者の治療にヒドロキシクロロキンの使用を支持する研究の妥当性を理由に、発表された研究の撤回も行われた[131]。その後、安全性への懸念と有効性の欠如により、世界保健機関(WHO)と米国国立衛生研究所(NIH)は、SARS-CoV-2感染症の治療にヒドロキシクロロキンを使用しないよう勧告し、その臨床試験は中止された。
6.6. PB28
PB28は,シグマ-1受容体とシグマ-2/TMEM97の両方に親和性があり(それぞれ0.38nMと0.68nM)[132],シグマ-1のアンタゴニスト,シグマ-2のアゴニストとして作用する.PB28は、SARS-CoV-2感染の重症度を軽減できる薬剤として同定されている[61]。PB28は、SARS-CoV-2感染の重症化を防ぐ役割に関して、かなり詳細にレビューされている[133]。PB28のSARS-CoV-2感染予防効果を説明する有力な仮説の1つに、InsP3受容体とSARS-CoV-2のNSP6タンパク質が関係していると考えられる。NSP6タンパク質は、小胞体に位置し、オートファジーを調節し[134]、オートファゴソームによるウイルス成分のリソソームへの送達を妨げることで、さらなる感染を有利にしている。PB28がSigma-InsP3受容体複合体に結合すると、小胞体におけるNSP6の活性が調節される。PB28は、NSP6の結合を誘導する一方で、リソソームの漏出を介して酸化ストレスを誘発し、その結果、細胞保護的なオートファゴソームの活性化を引き起こす可能性がある[135]。
6.7. ハロペリドール
ハロペリドールは、シグマ-1受容体とシグマ-2/TMEM97の両方に親和性を持つ抗精神病薬である。シグマ-1受容体拮抗薬である。Gordonらは,ハロペリドールをSARS-CoV-2感染の重症度を制限できる薬剤として同定し,SARS-CoV-2を2-12nMのKiで阻害した[61]。さらに,ハロペリドールとNSP6タンパク質とのドッキング解析では,ハロペリドールが-7.7kcal/molの親和性スコアで結合することが示されており,KDがナノからマイクロモルの範囲にあることが予測されている[136]。しかし、初期の観察的臨床研究では、ハロペリドールを投与しても、ハロペリドールを投与していない患者と比較して、挿管や死亡の関連リスクに変化はなく、退院までの時間にも影響しないことが示されていることに留意すべきである[137]。
6.8. クロルプロマジン
クロルプロマジンは、シグマ-1受容体に親和性のある神経弛緩薬で、シグマ-1受容体拮抗薬である[138]。クロルプロマジンは、サルおよびヒトの細胞(VeroおよびA549)において、SARS-CoV-2感染を予防することが示されており、IC50はそれぞれ8.2 µMおよび11.3 8.2 µMであった[139]。再びハロペリドールと同様に、SARS-CoV-2感染症で入院した患者を対象とした観察研究では、クロルプロマジンを服用した患者は、服用していない患者と比較して、クロルプロマジンの投与とSARS-CoV-2感染症による死亡率の低下との関連性が示された[139]。しかし、これらの観察研究には限界があり、クロルプロマジンを服用したSARS-CoV-2患者は、服用していない患者に比べて非常に少ない。
7. 神経学的症状および感染後の神経学的疾患におけるSigma-1受容体の役割
7.1. 脳卒中
SARS-CoV-2は急性虚血性脳卒中の独立した危険因子であり、SARS-CoV-2感染者では虚血性脳卒中患者が統計的に有意に増加するという研究結果がある[140]。また、システマティックレビューでは、SARS-CoV-2感染者と脳卒中の割合はほぼ2%、入院中の死亡リスクは約35%であり、70歳以上の患者が最もリスクが高いという臨床データが示されている[141]。SARS-CoV-2感染者が初めて脳卒中を発症する確率は、インフルエンザやその他の呼吸器感染症の患者よりも統計的に高く、それぞれのオッズ比は1.7であった。さらに、ITUに入院した患者は、ITUでの治療を受けなかった患者に比べて、初回の脳卒中のリスクが高く、オッズ比は3.5であった[5]。シグマ-1受容体は、虚血性脳卒中からの回復時に有益な保護メカニズムに関与していることが示されている。研究では,シグマ-1受容体の活性化が,脳虚血に関与する炎症反応を調節することが示されている[142]。再灌流開始時にsigma-1受容体アゴニストであるdimemorfanを投与すると、NF-κB経路の阻害を介して炎症性サイトカインであるMCP-1およびIL-1βの発現が減少した[143]。さらに,塞栓症による脳梗塞発症後(3時間および24時間)にPRE-084を投与すると,梗塞体積が有意に減少し,炎症性サイトカインが抑制され,抗炎症性サイトカイン(IL-10やIL-4など)が促進された[144].Nrf-2抗酸化経路の活性化は、虚血性脳卒中の患者に恩恵をもたらすもう一つのメカニズムであり[145]、フルボキサミンやカタメシン(SA4503)[146]などのシグマ-1受容体アゴニストを用いてシグマ-1受容体を介して活性化することは、脳卒中の回復を助けるだけでなく、SARS-CoV-2の症状がさらに悪化するのを防ぐことができる。興味深いことに、シグマ-1受容体拮抗薬S1RAの使用は、脳卒中によるダメージを軽減し、脳卒中後の神経学的障害を改善することも示されている[147]。
7.2. 脳症(Encephalopathy)
脳症と脳炎は、SARS-CoV-2感染症の合併症であり、脳症や脳炎に罹患した人は、通常、予後不良の重篤な状態にある。脳症は、発熱、頭痛、発作、局所的な神経学的障害、意識の変化(精神的混乱、眠気、深い昏睡状態として現れることもある)などの急性臨床症状を引き起こす脳のびまん性炎症が特徴である[148]。SARS-CoV-2患者は、インフルエンザやその他の呼吸器感染症患者と比較して、脳炎を発症するオッズ比がそれぞれ1.8と2.3と、統計的に有意に増加していた。これまでのところ、シグマ-1受容体が脳症を直接治療できることを示す証拠はほとんどないが、シグマ-1受容体が酸化ストレスを軽減し、多くの抗炎症経路を活性化することを考慮すると、シグマ-1受容体を標的とすることが有益である可能性がある。特に、感染が血液脳関門(BBB)を通過して脳症に至る前にシグマ-1リガンドを用いてSARS-CoV-2感染を治療する場合は、その可能性が高いと考えられる。
7.3. 認知症
SARS-CoV-2感染による神経学的後遺症の一つとして認知症が挙げられており、インフルエンザ感染と他の呼吸器感染に対するオッズ比はそれぞれ2.33と1.71である[5]。SARS-CoV-2は様々な方法で中枢神経系に侵入するが [149]、おそらく感染したリンパ球がBBBを通過することにより[150]、このBBBの破壊時に、あるいは嗅覚神経細胞や腸神経細胞への感染を介して侵入する [151]。高齢になると、BBBの完全性が失われるため、高齢者はSARS-CoV-2の神経侵入を受けやすくなる[152]。SARS-CoV-2に感染すると、アルツハイマー病の発症リスクが高まるという証拠が増えている。SARS-CoV-2に感染すると、ミクログリアやアストロサイトの活性化を介して神経炎症が誘発され、炎症性サイトカインであるIL-1β、IL-6,IL-12,TNF-αが産生され、これらのサイトカインが神経変性疾患に関与することが研究で明らかになっていると考えられている[153]。さらに、SARS-CoV-2感染により重度の炎症が生じた場合、サイトカインストームによりBBBの完全性が損なわれ、神経細胞やグリア細胞にダメージを与える可能性があり、これがアルツハイマー病につながる後遺症の基礎病理の一部である可能性がある。
SARS-CoV-2に感染した患者は、感染後3ヶ月までの間に、特に海馬において低酸素性変化や脱髄病変、脳の機能的完全性の変化を示している[154,155]。脳の海馬領域は、特に感染に弱く[156]、海馬の萎縮は、アルツハイマー病患者によく見られる神経認知機能の低下をもたらす[157,158]。フルオキセチンのような中等度から高度のシグマ1親和性を有するSSRIによる治療は、ストレスによる萎縮を防ぎ[159]、さらには海馬の神経新生を誘導することが示されている[160]。
もう一つの興味深い仮説は(まだ証明されていないが),アミロイドβ(Aβ)の抗菌作用により,SARS-CoV-2の感染に対して,免疫反応の一環としてAβの発現が増加し,脳内でのAβの沈着が増加するというものである[161]。
シグマ-1受容体は、認知症、特にアルツハイマー病に関して広く研究されており[48]、シグマ-1受容体に親和性があり、シグマ-1受容体のアゴニストとして作用するアルツハイマー病治療薬がいくつか登場している。SARS-CoV-2患者は、アルツハイマー病の病態の一部であるストレスや神経炎症経路の多くを緩和する可能性があるため、シグマ-1製剤の恩恵を受ける可能性がある。
7.4. パーキンソン病
パーキンソン病がSARS-CoV-2に対する脆弱性をもたらすかどうかは不明であるが、パーキンソン病はいくつかのウイルス性脳炎の結果としてしばしば観察されるものである[162]。シグマ-1受容体薬が脳炎を治療するという証拠は今のところほとんどないが、脳炎につながる神経炎症経路を防ぐことで、パーキンソン病の発症につながる下流の影響を防ぐことができるかもしれない。さらに,シグマ-1受容体は,プリドピジン[164]やPRE-084[165]など,パーキンソン病の治療を目的とした数多くの薬剤の標的となっている[163]。さらに、シグマ-1受容体は、パーキンソン病の初期段階では発現量が少ないことが示されている[166]。いくつかの研究では、様々な培養細胞株のドーパミン誘導細胞死がシグマ-1受容体リガンドによって予防できることが示されており[58,167]、これらの活性の多くは、酸化ストレスの予防、小胞体およびミトコンドリアのストレスの予防を中心としている。
7.5. メンタルヘルス
SARS-CoV-2のパンデミックにより、うつ病、不安症、自殺などの症例が大幅に増加している。この増加の原因として考えられるのは、病気にかかることへのストレスや恐怖心[168]、社会的孤立[169]、失業による経済的負担、既存の神経学的疾患の悪化の可能性、あるいはSARS-CoV-2感染による脳への深刻な変化[170]などが関係しているのではないかと考えられている。
シグマ-1受容体は多くの神経症状と密接な関係があり[60]、多くのシグマ-1受容体アゴニストは動物において抗うつ様の活性を持ち[59,171]、シグマ-1 KOマウスはうつ様の表現型を示す[172]。
8. 不安や抑うつと死亡率との関連について
不安や抑うつと死亡率との関連は、特に心臓病学[173]や腫瘍学においてよく研究されている。これらの精神疾患が世界的に見て実質的な死因であり、予防可能であるかどうかを評価するために、精神疾患と死亡率との相関関係について数多くの研究が常に検索されている。WalkerらWalker、McGee[174]は203の関連論文のメタ分析を行い、精神障害のある人が死亡する確率は、精神状態が良好な人のそれよりも2倍高いことを発見した[174]。また、入院患者の死亡率は、一般的に病期が進行していたり、併存疾患があったりする傾向があるため、外来患者よりも有意に高かった[174]。最も一般的な精神疾患の一つであるうつ病は、過剰死亡率と関連していることが証明されており[175]、慢性閉塞性肺疾患(COPD)を除き、異なる疾患関連うつ病群(がん、心臓、腎臓疾患など)のリスクは同程度であった[176]。心血管疾患、うつ病、シグマ-1受容体の発現には関連性があることが示されており、フルボキサミンはげっ歯類において心筋保護作用と抗うつ作用を示している[177,178]。SARS-CoV-2感染による死亡リスクが心血管疾患を持つ患者では大幅に上昇することを考えると、このことは可能な治療法に関して興味深いものとなるだろう。SARS-CoV-2の発生は、膨大な数の死者を出し、治療法やワクチンの入手可能性の不確実性、社会的コミュニケーションの制限、検疫、厳重な隔離措置など、精神衛生上の悪影響をもたらした。この直接的なストレスは、精神科患者の心的外傷後ストレス障害(PTSD)症状、うつ病、不安、ストレス、不眠症、感情管理、自殺願望のレベルをかなり悪化させた[179]。また、SARS-CoV-2の診断を受けた精神科医の既往歴を持つ患者は、精神科医のいない感染者よりも高い死亡率を示し[180]、重度の精神疾患(SPD)を持つ患者は、一般的な精神疾患(CMD)を持つ患者よりも若くしてSARS-CoV-2により死亡することが報告されている[181]。このことから、精神科の病歴や重症度は、死亡リスク要因として欠かせない要素であると考えられる。SARS-CoV-2の影響は、その後の精神疾患のリスクが高くなることで、回復後の生存者にまで残されていた[182]。一般の人々にとって、SARS-CoV-2のパンデミックは、特に女性、学生、低所得者、低学歴の回答者において、抑うつや不安のレベルを高める可能性がある[183]。その主な理由の1つは、社会的なつながりの欠如や孤独感であり、これがうつ病の原因となり、その後、早死ににつながる。この危険因子は、肥満度2および3に相当すると指摘されている[184]。顕著な抑うつと不安のもう一つの原因は、経済的なダメージであり、これはさらに精神衛生に長期的な影響を与え、結果として寿命を縮め、さらには自殺にまでつながる可能性がある[185]。驚くことではないが、世界レベルでの心理的・精神的障害の有病率は、パンデミック後に絶えず増加しており、ストレス、不安、うつ病のカテゴリーにそれぞれ約30%が含まれている[186]。したがって、予防と治療的リハビリのための心理学的戦略を考慮する必要がある。シグマ-1アゴニストには抗うつ作用があり、さらに、一般的に使用されている抗うつ剤の多くは、シグマ-1受容体に親和性を持っている[59,60]。このことは、SARS-CoV-2感染の症状を治療し、鬱症状を予防し、同時に心肺を保護することに関しては、非常に興味深いことであると考えられる[187]。
9. 結論
安全で効果的なワクチンが展開されているにもかかわらず、国民の一部にはワクチンを受けることへの疑念や不本意さがある。さらに、一部の国ではワクチンの供給を確保することが難しく、先進国では需要がないために投与量が無駄になっている。SARS-CoV-2は今後も拡大を続け、アルファ(B.1.1.7)ベータ(B.1.351)デルタ(B.1617.2)ガンマ(P.1)などの変異株が出現し、最悪の場合、ワクチンを回避したり、さらに毒性が強くなって死に至ることも考えられる。このため、感染症の重症度を軽減し、患者をITUに入れないようにする薬は、世界中の医療システムの負担を軽減し、何千人もの命を救うことになる。フルボキサミンのような薬剤は、SARS-CoV-2感染の最悪の症状を予防する可能性がある薬剤として確認されており、小規模な臨床研究ではこれを裏付ける結果が出ている(表1)。フルボキサミンが本当に初期の研究で示されたような効果を発揮するかどうかを確かめるには、より広範な進行中の臨床研究の結果を待つ必要がある。
表1 SARS CoV-2に作用する可能性のあるSigma-1受容体を介した薬剤
| 薬の名前 | プロパティ | 利点 | アクションモード | 短所 | 参考文献 |
|---|---|---|---|---|---|
| フルボキサミン | 選択的セロトニン再取り込み阻害薬、および抗うつ薬。 シグマ1受容体アゴニスト |
フルボキサミンは、1日あたり最大300 mgのフルボキサミンで、息切れまたは入院と相まって、臨床的進行を減少させました。 別の研究では、入院の発生率と残存症状の持続性は0%であると報告されました |
フルボキサミンは、従来の炎症経路を阻害することなく、小胞体ストレスとサイトカイン分泌を減らすことによって細胞ストレスを減らすことができ、それによって心臓の損傷を防ぎます。 フルボキサミンはメラトニンの生物学的利用能を高めることができます |
より大規模なランダム化プラセボ対照試験が必要です | [ 87、88、94、95 ] |
| フルオキセチン | SSRIおよびシグマ1受容体アゴニストオートファジーを誘発する可能性のある抗うつ薬 | invitroでSARSCoV-2の増殖を阻害することができます | フルオキセチンはSARSCoV-2を阻害するように特異的に作用し、他のウイルスの増殖を阻害することはできませんでした | 活性を確認するためにinvivoおよび臨床試験を行う必要があります | [ 108、110-112 ] |
| ドネペジル | 抗アセチルコリンエステラーゼおよびシグマ-1受容体活性を有する神経保護剤 | ドネペジルは、脳内のシグマ1受容体部位を占有し 、AMPKの活性化とともに、神経突起伸長を促進し、オートファジーフラックスを誘導することによって神経保護効果を誘導する可能性があります。 |
活性を確認するために、invitro、invivoおよび臨床試験を行う必要があります | [ 114–116 ] | |
| メラトニン | 睡眠サイクルに関連するホルモン | フルボキサミンはメラトニンの生物学的利用能を高めることが報告されています | 主にミトコンドリアで合成されるメラトニンは、抗酸化剤および抗炎症剤として作用し、マイトファジーを活性化します | SARSCoV-2はマイトファジーに損傷を与える可能性があります。活性を確認するために、 invitro、invivoおよび臨床試験を行う必要があります |
[ 96、97、120、121 ] |
| ヒドロキシクロロキン | シグマ1受容体アゴニスト活性を持つ抗マラリア薬 | インビトロおよびいくつかの小規模な管理されていない研究は、SARSCoV-2感染の予防におけるその有効性を示唆しました | 該当なし | 臨床研究では、ヒドロキシクロロキンで治療された入院患者にはほとんどメリットがないことが示されましたが、SARCoV-2入院患者の死亡リスクが高まる可能性があります。 | [ 123、126~130 ] |
| PB28 | シグマ1受容体の拮抗薬 | SARS-CoV-2感染の重症度を予防する | PB28はSigma-InsP3受容体複合体に結合し、オートファゴソームの活性化につながるNSP6活性の調節をもたらします | 活性を確認するために、invitro、invivoおよび臨床試験を行う必要があります | [ 61、133-135 ] |
| ハロペリドール | シグマ-1(拮抗薬)およびシグマ-2活性(作動薬)を有する抗精神病薬 | SARS-CoV-2感染の重症度を制限します。 ドッキング研究は、ハロペリドールがNSP6と効果的に結合できることを示唆しています |
NSP6の活性化は、オートファジーの活性化につながる可能性があります | 臨床研究は、ハロペリドール治療は、ハロペリドールで治療されていない患者と比較して、挿管または死亡の関連リスクを変化させず、退院までの時間にも影響を与えないことを示しています。 | [ 61、136、137 ] |
| クロルプロマジン | シグマ1受容体活性を有する神経弛緩薬 | サルとヒトの細胞および一部の患者におけるSARS-CoV-2感染の重症度を予防する | わからない | クロルプロマジンを服用したSARS-CoV-2患者はごくわずかであり、さらに研究を行う必要があります | [ 138、139 ] |
10. 専門家の意見
SARS-CoV-2 の発生は、世界中の医療システムに多大な負担をかけており、感染の波が次々と押し寄せ、感染率や新しく開発されたワクチンへの反応が異なる新種の株が出現している。1918年のインフルエンザ(スペイン風邪)以来、最悪のパンデミックとなった事態に終止符を打つため、世界の人々にワクチンを接種しようとする大きな努力がなされており、世界各地で様々な割合でワクチン接種プログラムが進行している。特に資源の乏しい発展途上国でのワクチンへのアクセス、誤った情報、アストラゼネカ社のワクチンで血栓のリスクが明らかになった(決定的ではないし、まれではあるが)ことによる予防接種への恐怖心など、世界中でのワクチン接種を阻む障害がある。優先すべきことは、命を救うことと医療システムへの負担を減らすことであり、入院やITUケアの必要性を防ぐ薬はその両方を可能にする。次に、SARS-CoV-2の長期的な影響(長距離の症状)がある。これを抑制することは、人々の健康と福祉に良い影響を与える。第三に、SARS-CoV-2感染が神経疾患の発症リスクを高めるという最近の証拠がある。フルボキサミンなどのシグマ1受容体リガンドは、SARS-CoV-2感染の3つの側面すべてに有益であると考えられる。初期の臨床研究では、入院や死亡を防ぎ、長期的な(long haul)症状の一部を抑えることができる可能性が示されており、直接的または間接的に神経症状の一部を防ぐことができるかもしれない。
シグマ-1受容体とSARS-CoV-2の感染および複製には強い関連性があり、シグマ-1受容体KOが複製を減少させ、フルボキサミンなどのシグマ-1受容体リガンドが入院や死亡を防ぐことが研究で示されている。シグマ-1受容体を占有する薬剤は、アゴニストとアンタゴニストの両方が有益であると思われるので、SARS-CoV-2感染症の負の側面のいくつかを防ぐのに十分であるかもしれない。しかし、SARS-CoV-2の症状を予防する薬剤を選択する際には、シグマ-1受容体のアゴニストを選択するべきだという議論がある。シグマ-1受容体のアゴニストは、ミトコンドリアを保護し、ダメージを受けたミトコンドリアや漏出したミトコンドリアを除去するマイトファジーを活性化し、ERストレスを防ぎ、カルシウムイオン輸送を管理し、感染に伴う細胞死を防ぐオートファジーを誘導する可能性もある。これにより、心臓や肺において、長期的な症状や死につながる細胞/組織の損傷を防ぐ、必要とされる保護機能が提供される可能性がある。さらに、SARS-CoV-2感染時にITUでの治療を必要とした人々の神経疾患のリスクが高まっていることが最近明らかになったことから、SARS-CoV-2感染時および感染後の神経保護戦略としてシグマ-1リガンドの可能性が指摘されている。特に、アルツハイマー病に対するドネペジル、T-817MA、ANAVEX2-73,AF710B、筋萎縮性側索硬化症、多発性硬化症に対するプリドピジン、うつ病に対するフルボキサミン、イミプラミン、オピプラモール、イグメシン、セルトラリンなど、多くのシグマ-1アゴニストが神経疾患の治療に大きな可能性を示している。
SARS-CoV-2感染による神経学的影響を考慮し、SARS-CoV-2パンデミックがもたらした神経学的疾患の増加による将来的なリスクを評価することは、非常に重要であると思われる。特に、これらの神経系疾患を早期に発見することで、より有益な治療結果が得られる可能性があるため、過去に感染したことのある人を対象に、これらの神経系疾患をスクリーニングする対策を講じる必要があるかもしれない。
SARS-CoV-2に感染した際に最も死亡リスクが高い患者コホートは、60歳以上の高齢者と、心血管疾患や呼吸器疾患などの併存疾患を持つ患者である。さらに、SARS-CoV-2による死亡リスクは、女性よりも男性の方が高いとされている[188]。シグマ1受容体の活性化は、心血管疾患や呼吸器疾患の治療に有益であることが示されているため(前臨床試験では、ストレス時に心臓や肺を保護する効果がある)[107,177,189]、心血管疾患などの併存疾患を持つ60歳以上の男性は、フルボキサミンなどの薬剤による治療から最も恩恵を受けると考えられる。また、60歳以上で心血管疾患などの合併症を有する女性や、若年層で心血管疾患や呼吸器疾患に罹患している人など、他のリスクグループもシグマ-1受容体医薬品の恩恵を受ける可能性があり、これらのコホートにおいて集中的な治療の必要性を回避し、死亡リスクを低減することができる。また、SARS-CoV-2に感染していない他の患者の治療に充てることができるため、医療システムへの負担も軽減される。
SARS-CoV-2の治療においては、不安やその他の精神障害と死亡率との関連性も懸念される。特に、社会的距離を置くことや隔離措置により、これらのケースが増加する可能性がある。フルボキサミンのような抗うつ薬は、シグマ1受容体の活性化により、SARS-CoV-2の診断から生じる不安や抑うつを軽減するなど、さまざまな方法で死亡率を低下させる可能性がある。
パンデミックからの脱出は、ワクチン接種と社会的距離を置くことで、ウイルスのさらなる拡散を防ぐことになるが、その間、入院を防ぎ、死亡率を下げ、SARS-CoV-2感染による長期的な症状を防ぐ薬剤が必要とされているのである。シグマ-1受容体は、ウイルスの感染と複製を防ぎ、ウイルスによる心臓、肺、脳などの重要な組織へのダメージを軽減する、一石二鳥のターゲットとなり得る。
資金調達について
J.M.B.およびM.I.P.は,チュラロンコン大学Rachadapisek Sompote Fund for Postdoctoral Fellowshipから資金提供を受けた。D.S.M.はチュラロンコン大学のThe Second Century Fund (C2F) for Postdoctoral Fellowshipからの資金提供を受けている。
記事のハイライト
シグマ1受容体リガンドとSARS-CoV-2感染の影響の減衰との間には関連性があるようだ。
自食機能や細胞生存におけるシグマ-1受容体の役割を考えれば、シグマ親和性を持つ薬剤がSARS-CoV-2感染症に効果を発揮する理由がわかるかもしれない。
フルボキサミンは,SARS-CoV-2感染症の重篤な症状を有意に予防することが[少なくとも1つの小規模な研究で]実証されている。
また、フルボキサミンは、SARS-CoV-2感染の長期的な影響を防ぎ、SARS-CoV-2感染後の神経学的な問題を予防する可能性がある。
多くのシグマ1受容体アゴニストは、動物において抗うつ様作用を示し、シグマ1ノックアウトマウスは、うつ様表現型を示す。
このボックスには、論文に含まれる重要なポイントがまとめられている。