Contents
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8394389/
Drug Repurposing, an Attractive Strategy in Pancreatic Cancer Treatment: Preclinical and Clinical Updates
オンライン 2021年8月5日に公開されている。
概要
簡単な概要
この総説の目的は、すでに承認されている最も有望な非がん治療薬のうち、世界的に最も死亡率の高い悪性腫瘍の一つである膵臓がんの治療にも有用であると考えられるものについて、最新情報を提供することである。現在の化学療法の選択肢はこの癌では満足のいくものではなく、悲惨な膵臓癌治療を改善するために、より効果的で毒性の低い薬剤が緊急に必要とされている。他の適応症で承認されている薬剤をがん治療に使用すること(再利用)は、用量設定や安全性プロファイルなど、新規創薬に伴ういくつかの問題を克服し、臨床導入を加速させる可能性を秘めた魅力的なアプローチである。この総説では、膵臓癌治療における再利用の候補となる薬剤の作用機序と生物学的標的を提案し、抗癌作用に関連があると思われる標的に焦点を当てて報告する。最後に、がん免疫療法は、一部の反応性腫瘍では顕著な長期寛解をもたらすが、膵臓がん患者ではほとんど効果がないことを考慮して、いくつかのリパーパス薬候補の抗腫瘍免疫反応を活性化する能力に関する最近の動向を議論し、これは臨床効果に特に関連する可能性がある。
要旨
膵臓癌は、切除不能な進行期になるまで患者に症状が現れることが少なく、世界的に最も死に至る悪性腫瘍の一つである。現在の化学療法の選択肢は満足できるものではなく、悲惨な膵臓がん治療を改善するために、より効果的で毒性の低い薬剤が緊急に必要とされている。膵臓がん治療における癌治療以外の薬剤の再利用は、非常に有望な治療オプションであり、現在、様々な化合物がこの腫瘍の治療における再利用の候補として検討されている。本レビューでは、FDAに承認されている最も有望な非がん領域の再利用薬候補のうち、膵臓がんにおける顕著な臨床および前臨床データを示すものについて最新情報を提供する。また、提案されている作用機序と、これらの薬剤が膵臓がんにおいて調節する既知の分子標的にも焦点を当てている。さらに、バイオインフォマティクスを用いた探索的な解析により、膵臓がん再治療薬候補の中には、未解明の腫瘍関連ターゲットが存在することが示唆された。最後に、これらの薬剤が示す免疫調節作用についての最近の進展について述べる。これにより、膵臓がんにおいて単剤ではほとんど効果のない、承認された抗がん剤である免疫調節剤との相乗効果で、その応用の可能性が広がるかもしれない。
キーワード:膵臓管癌、薬剤の再配置、再利用薬、腫瘍微小環境、免疫調節作用
1. はじめに
膵臓がん(PC)は,世界的に最も死亡率の高い悪性腫瘍の1つであり,今後10年以内に欧米諸国におけるがん関連死の第2位の原因になると予測されている[1]。膵臓がんの5年生存率はわずか9%で、この予後の悪さは、主に診断の遅さに起因している。というのも、患者は進行して切除不能になるまで、ほとんど症状を示さないからである。さらに、他の腫瘍と比較して、膵臓がんの治療法や生存率の改善は過去数十年にわたって限られており、そのため、標準的な化学療法に対する満足な反応が得られないという問題が依然として残っている[2]。現在、ゲムシタビンとFOLFIRINOXおよびゲムシタビン/ナブパクリタキセルなどの併用療法が膵臓がんの主要な治療法となっているが、これらの治療法は毒性が強く、世界的に見ても全生存期間において限られた優位性しかない[3]。さらに、BRCA1/BRCA2遺伝子変異やNTRK1-3融合遺伝子などの特定の異常を標的とした新しい薬剤の潜在的な効果は、患者の小さなサブグループに限られている[4]。同様に、免疫チェックポイント阻害剤(ICI)を用いた治療法は、理想的には高い免疫原性を有する腫瘍であるミスマッチ修復(MMR)欠損の膵臓がん患者に有益な可能性があるが、残念ながらそのような患者では控えめな結果しか得られていない[5]。根治手術は、膵臓がんの唯一の治療法だが、切除可能な段階で診断される患者はごく一部(15〜20%)で、ほとんどの患者は手術後に再発します[6]。したがって、悲惨な膵臓がん治療を改善するためには、より効果的で毒性の低い新規の薬剤が必要となる。
新しい抗がん剤の開発は、費用と時間のかかるプロセスであり、細胞や動物を使った広範で堅牢な研究に続いて、前臨床試験の結果を実証するための手段である臨床試験によって、ヒトでの安全性と有効性を検証する必要がある[7]。平均13年かかるこのプロセスは,非常に困難なものである。なぜなら,有望な新規化学物質が,予想外の安全性の問題の発生や,患者での有効性の欠如により,医薬品として承認されるまでに必要な臨床試験の段階を進められない可能性があるからである[7,8,9]。このような状況において,承認済みの薬剤をがん治療に再利用することは,魅力的な代替アプローチであり,新規創薬に伴ういくつかの問題を克服できる可能性を秘めている[10,11,12]。この点に関して、このアプローチの主な強みの一つは、再利用の候補となる薬剤は、元の適応症での臨床使用の履歴が十分に記録されており、薬物動態、薬力学、投与量、毒性のプロファイルが既に確立されていることである。そのため、原則として、新しい適応症/疾患のターゲットに対する有効性を評価するための第2相臨床試験から直接始めることができ、候補薬剤の失敗のリスクを減らすことができるため、臨床開発を加速することができる。さらに、再利用薬を臨床に導入するために必要な投資は少ないと思われるが[13]、第3相試験や薬事規制にかかる費用は、同じ適応症の新薬の場合とほぼ同じであると思われる[11]。
薬剤再利用の最初の成功例は、主にセレンディピティ(偶然)の発見によるものであったが、その後、がん治療に再利用できる可能性のある非がん治療薬を特定するための体系的な戦略が生まれた[10,11]。これらの戦略は、基本的に、計算機的アプローチと実験的アプローチの2つのカテゴリーに分類される[10,11]。前者は,バイオインフォマティクスツール(パスウェイ/ネットワークマッピング,シグネチャーマッチング,分子ドッキングなど)を併用したハイスループット分析に依存し,また,レトロスペクティブな臨床分析の場合のように電子カルテ(EHR)を系統的に評価する。もう一つは、主に活性に基づいたもので、新規標的と既知の薬剤との間の関連する相互作用を特定するための結合アッセイ(例:プロテオミクス技術、化学遺伝学的アプローチ)や、影響を受ける標的を事前に知らなくても、共通の表現型基準(例:増殖、エクソソーム生合成の調節、細胞周期プロファイリング)を選択することを中心とした細胞ベースの表現型スクリーニングを採用している[11,14]。現在、がん治療に再利用することに成功した非がん治療薬がいくつかある[11]。例えば、サリドマイドは、もともと妊婦のつわりの治療薬として処方されていたが、重篤な催奇形性の副作用のために市場から撤退した。しかし、偶然にも結節性紅斑(ENL)の治療に有効であることがわかり、次に、2006年に高齢の進行性多発性骨髄腫患者の第一選択薬として、メルファランおよびプレドニゾンとの併用療法が再承認された[15]。同様に、心血管疾患に使用されるβ遮断薬(BB)のプロプラノロールは、2008年に偶然その有効性が報告されて以来、乳児性血管腫(IH)の治療にも広く適応外で使用されており、2014年にはIH治療用のユニークな小児用経口製剤としてFDAの承認を得ている[16,17]。もう一つの例は、選択的エストロゲン受容体モジュレーター(SERM)のクラスに属するラロキシフェンで、元々は閉経後女性の骨粗鬆症の予防と治療のために承認されていた。2007年には、臨床試験データのレトロスペクティブな分析により効果的な再利用が行われ、閉経後のER+/PR+進行乳がんの女性に対する治療薬としてFDAの承認を得た[18]。このように,低コストで,すでに承認されている非がん治療薬をがん治療に採用することは,特に膵臓がんをはじめとする難治性で比較的まれな悪性腫瘍の場合には,貴重な機会であると考えられる[11,19]。
この総説では,膵臓がんにおける顕著な臨床および前臨床データを示す最も有望な再利用薬候補(図1)について最新情報を提供するとともに,これらの非がん治療薬によって調節される分子メカニズムおよび標的に焦点を当て,その治療関連性についての洞察を広げることを目的とする。また、膵臓がんでのin vivo試験や臨床試験が行われていない薬剤については、膵臓がん治療におけるリパーパス候補としての価値を考慮し、他の腫瘍で示された最も重要なデータの概要を示している。
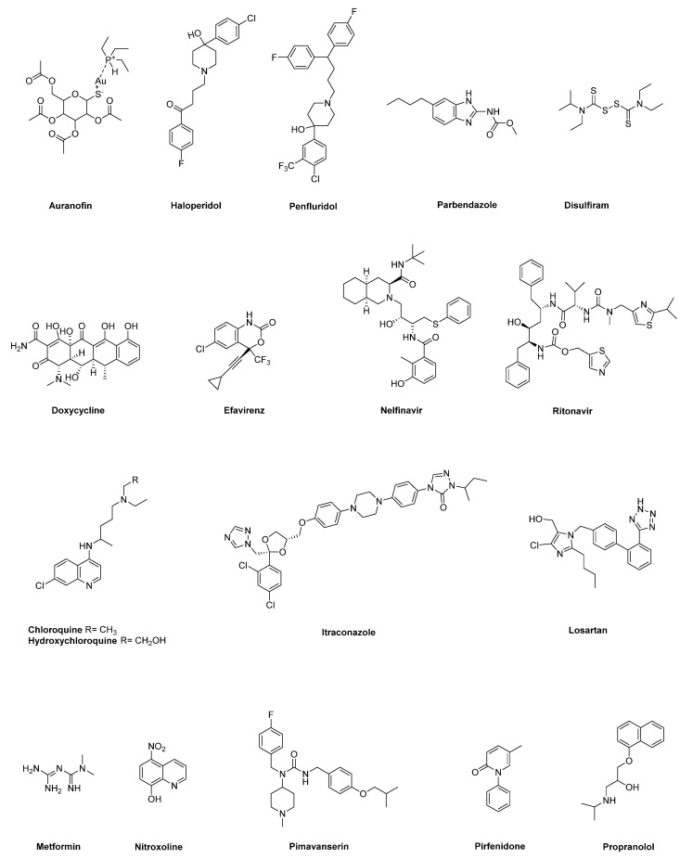
図1 本総説で取り上げた膵臓癌治療における再利用薬候補の化学構造
2. 膵臓癌における薬剤候補の再利用。前臨床試験と臨床試験の結果
FDA承認の非がん治療薬が膵臓がんにおいて抗腫瘍効果を示すという,有望なデータを報告する研究が増えている。このセクションでは,前臨床および臨床研究の最新情報を紹介し,膵臓がん治療への再利用の候補として,異なる治療カテゴリーに属するさまざまな非腫瘍薬の妥当性を検討した(表1,表2,図2)。文献調査のために,Medlineデータベース(https://pubmed.ncbi.nlm.nih.gov/,アクセス日:2021年4月)を,”pancreatic cancer”,”repurposed drug”,”drug repurposing”,”drug repositioning “などの複数のキーワードを組み合わせて検索した。また、2021年5月にアクセスしたウェブサイト「https://clinicaltrials.gov/」を通じて、各候補の臨床データの情報を検索した。膵臓がん動物モデルでの研究が不足している薬剤については、NCI Developmental Therapeutics Program(NCI/DTP)のデータベースにもアクセスし(https://dtp.cancer.gov/、2021年7月アクセス)、他のがんモデルでのin vivoの結果を検索した。膵臓がん治療への再利用が期待される最も有望な非腫瘍薬候補についてバランスのとれたレビューを提供するために、レビューに含まれ議論されている前臨床および臨床研究の両方は、トピックとの関連性を考慮して著者が選択したものである。
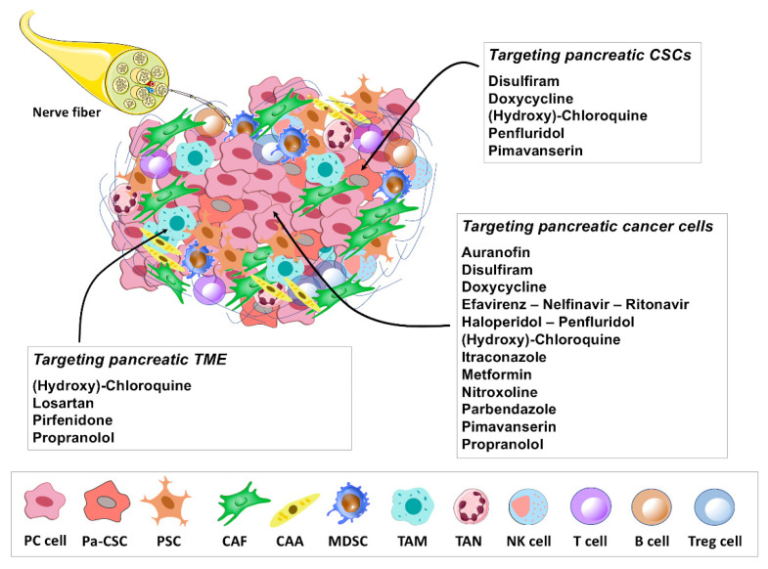
図2 膵臓がんにおけるリパーパス薬候補が示す優先的なターゲティングの概要
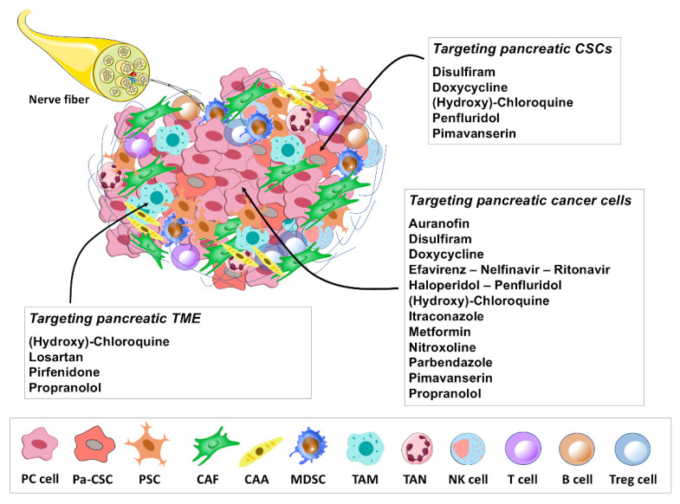
この図は、膵臓がん細胞と膵臓がん関連間質内の細胞成分との緊密なクロストークを特徴とする、複雑な膵臓がん腫瘍微小環境を表している。この総説で取り上げられている再治療薬候補は、腫瘍微小環境(TME)構成要素、膵臓癌(PC)細胞および/または膵臓癌幹細胞(CSC)を調節する能力を示す前臨床試験の証拠に基づいてグループ化されている。膵臓癌における抗腫瘍作用の分子標的/メカニズムを表1に示す。膵臓がん幹細胞(Pa-CSC)、膵臓星状細胞(PSC)、がん関連線維芽細胞、がん関連脂肪細胞(CAA)、骨髄由来抑制細胞(MDSC)、腫瘍関連マクロファージ(TAM)、腫瘍関連好中球(TAN)、ナチュラルキラー(NK)、制御性T細胞(Treg)。
表1 再利用可能な医薬品候補と、それらが膵臓がんで調節すると提案されている分子経路
| 薬名 | 元 の適応症 |
研究の種類 | 研究の主な結果 (膵臓がんにおける提案された分子標的/作用機序) |
参照。 |
|---|---|---|---|---|
| オーラノフィン | 関節 リウマチ |
インビトロ/ 動物モデル |
TrxR1とHIF1αを阻害すると、膵臓がん細胞内の抗酸化活性が低下し、その後アポトーシスが起こる。膵臓がん同所性マウスモデルにおける原発部位での抗腫瘍効果および遠隔臓器転移の抑制 | [ 20 ] |
| インビトロ/ 動物モデル |
ROSの蓄積とそれに続くカスパーゼ3/7活性化およびタンパク質分解PARP切断によるアポトーシスの誘導を介した栄養欠乏条件下での膵臓がん細胞に対する優先的な細胞毒性。膵臓がん異種移植モデルにおける腫瘍増殖の抑制 | [ 21 ] | ||
| インビトロ/ 動物モデル |
人工ヒト嚢胞(e)イナーゼと組み合わせて使用した場合のオートファジーフラックスの阻害とともに、ミトコンドリアのROSとアポトーシスの増加。併用治療による膵臓がん異種移植片の腫瘍増殖の抑制 | [ 22 ] | ||
| ハロペリドール | 精神病 | インビトロ/ 動物モデル |
小胞体ストレス、遊走および細胞周期進行の障害、膵臓がん細胞におけるアポトーシスの誘導を促進することによる増殖の阻害につながるDRD2の遮断; 同所性異種移植片膵臓がん腫瘍を有するマウスにおける腫瘍サイズの縮小および転移性播種 | [ 23 ] |
| 試験管内で | 転写調節の後成的修飾を介してDUSP6遺伝子の発現を回復することによる膵臓がん細胞生存率の阻害 | [ 24 ] | ||
| ペンフルリドール | 精神病 | インビトロ/ 動物モデル |
小胞体ストレスを誘発し、オートファジーとアポトーシスを引き起こすことによる膵臓がん細胞増殖の阻害。異種移植片および同所性膵臓がんモデルにおける腫瘍増殖の減少 | [ 25、26 ] _ _ |
| 試験管内で | PP2Aの活性化を介した、膵臓がん細胞の増殖の阻害、細胞周期停止およびアポトーシスの促進。ゲムシタビンと組み合わせて使用した場合のゲムシタビン耐性およびゲムシタビン感受性膵臓がん細胞の生存率に対する相乗効果 | [ 27 ] | ||
| インビトロ/ 動物モデル |
PRLRのJAK2結合部位との結合を介した、JAK2–STAT3およびERK / AKTシグナル伝達の阻害は、オートファジーの誘導とともに、コロニーおよびスフェロイド形成の抑制につながる。膵臓がんの異なる異種移植マウスモデルにおける腫瘍増殖の減速 | [ 28 ] | ||
| パルベンダゾール | 腸内 寄生虫 感染症 |
試験管内で | 微小管組織の変化、不規則な有糸分裂紡錘体の形成および倍数体細胞の出現を介したアポトーシス、細胞周期摂動およびDNA損傷応答の促進とともに、膵臓がん細胞の増殖、クローン形成および遊走の阻害; ゲムシタビンと組み合わせて使用した場合の膵臓がん細胞生存率に対する相乗効果 | [ 29 ] |
| ジスルフィラム | 慢性 アルコール依存症 |
インビトロ/ 動物モデル |
銅に結合したジスルフィラム代謝物(DDTC-Cu)によって形成される複合体は、プロテアソーム活性の障害を通じて膵臓がん細胞増殖の阻害を誘導する。ユビキチン化タンパク質の蓄積、p27のアップレギュレーションおよび腫瘍組織におけるNF-kB発現のダウンレギュレーションを伴う、膵臓がんの異種移植マウスモデルにおける腫瘍増殖の減少 | [ 30 ] |
| インビトロ/ 動物モデル |
銅に結合したジスルフィラム代謝物(DDTC-Cu)によって形成される複合体は、NF-kB幹細胞経路のダウンレギュレーションを通じて膵臓がん細胞の既存のCSCおよび放射線誘発CSCの枯渇を誘発する。5-FUおよび放射線療法と組み合わせて使用した場合の、球体形成が減少した同系マウス膵臓がんモデルにおける抗腫瘍効果 | [ 31 ] | ||
| インビトロ/ 動物モデル |
三酸化ヒ素およびアスコルビン酸と組み合わせて使用した場合の、細胞内ATP枯渇およびROS放出を介した、K-Ras変異膵臓がん細胞株におけるアポトーシス死経路の促進。3剤併用によるPANC-1異種移植片を有するマウスの腫瘍増殖の減少 | [ 32 ] | ||
| 試験管内で | ERストレス/IRE1α-XBP1経路の活性化、IRE1αとの直接相互作用、またはp97 / VCPセグレガーゼとプロテアソームのNPL4補因子の阻害を含む間接的なメカニズムによる、膵臓がん細胞におけるオートファジー依存性アポトーシスの誘導、ROSの生産とともに | [ 33 ] | ||
| ドキシサイクリン | 細菌 感染症 |
インビトロ/ 動物モデル |
アポトーシス促進遺伝子を活性化し、抗アポトーシス遺伝子を抑制し、細胞周期を混乱させ、血管新生促進性IL-8の発現を阻害することによる膵臓がん細胞増殖の阻害。膵臓がんの異種移植マウスモデルにおける腫瘍増殖の80%の減少 | [ 34、35 ] _ _ |
| 試験管内で | バルク癌細胞と正常な線維芽細胞の両方の生存率に影響を与えることなく、膵臓がん細胞における腫瘍球形成の阻害 | [ 36 ] | ||
| 試験管内で | ゲムシタビンと組み合わせて使用した場合、ATP枯渇を介して膵臓がん細胞増殖の低下につながるミトコンドリアタンパク質合成の阻害。ミトコンドリア膜電位を低下させ、ROS産生を促進することによるゲムシタビン誘導アポトーシスの増強 | [ 37 ] | ||
| インビトロ/ 動物モデル |
PAR1 / FAK / PI3K / AKTシグナル伝達経路のダウンレギュレーションによる膵臓がん細胞の成長、移動、浸潤、腫瘍球形成の阻害。E-カドヘリン発現の増加とビメンチンおよびCD133発現の減少を伴う、5-FUと組み合わせて使用した場合の皮下Panc-1異種移植片モデルにおける膵臓がん細胞生存率および腫瘍増殖の80.5%の減少に対する相乗効果 | [ 38 ] | ||
| エファビレンツ | HIV感染 | 試験管内で | 異なる膵臓がん細胞株におけるクローン原性の障害とアポトーシスの誘導 | [ 39 ] |
| 試験管内で | 放射線と組み合わせて使用した場合、ERK1 / 2およびp38MAPKストレス経路の両方のリン酸化とともに、ROS産生およびミトコンドリア膜脱分極を含むメカニズムを介した膵臓がん細胞増殖の阻害 | [ 40 ] | ||
| ネルフィナビル | HIV感染 | インビトロ/ 動物モデル |
膵臓がん細胞におけるAktリン酸化の阻害により、野生型細胞株とK-ras変異細胞株の両方の放射線増感が増強される。放射線と組み合わせて使用した場合の、Capan-2含有異種移植片における腫瘍増殖の相乗的減速 | [ 41 ] |
| 試験管内で | 細胞周期に影響を与え、アポトーシスを促進することによる、別個の膵臓がん細胞におけるクローン原性および生存率の障害。ニトロキソリンと組み合わせて使用した場合の膵臓がん細胞における相乗的な抗腫瘍効果 | [ 42 ] | ||
| リトナビル | HIV感染 | 試験管内で | 内因性アポトーシス経路を誘発し、細胞内のAktおよびRbリン酸化の抑制を介して細胞周期機構を妨害することによる膵臓がん細胞生存率の阻害。膵臓がん細胞の運動性と侵襲性の障害; ゲムシタビンと組み合わせて使用した場合の膵臓がん細胞における抗増殖効果の増強 | [ 43 ] |
| (ヒドロキシ)-クロロキン | マラリア 全身性 エリテマトーデス 関節 リウマチ |
インビトロ/ 動物モデル |
いくつかの膵臓がん細胞株における増殖の阻害; 膵臓がんのマウス異種移植モデルにおける生存率の改善 | [ 44 ] |
| インビトロ/ 動物モデル |
IL-6発現とECMタンパク質産生の低下によるPSCのオートファジーの阻害は、PSCの静止状態につながる。同所性膵臓がんマウスモデルにおける浸潤特性と肝転移形成の減弱 | [ 45 ] | ||
| 試験管内で | 低酸素状態での効果が増強された、転移性膵臓がん細胞株における生存率の阻害 | [ 46 ] | ||
| 試験管内で | 化学療法薬によって誘発されるオートファジーを介した細胞保護メカニズムを逆転させることによる5-フルオロウラシルまたはゲムシタビンの抗増殖効果の増強 | [ 47 ] | ||
| インビトロ/ 動物モデル |
オートファジーの阻害は、ROS放出、リソソーム膜透過化、およびその後の膵臓がん細胞のアポトーシスを介してゲムシタビン誘発細胞毒性の増加をもたらす。ゲムシタビンと組み合わせて使用した場合の異種移植膵臓がんモデルにおける腫瘍増殖の減少 | [ 48 ] | ||
| インビトロ/ 動物モデル |
膵臓がんのオルガノイドモデルとPDXモデルの両方で、ERK / MAPK阻害剤と組み合わせて使用した場合の抗腫瘍効果の増強。これは、ミトコンドリア機能と解糖活性の障害により、膵臓がん細胞にオートファジー依存性の状態を誘発する。 | [ 49 ] | ||
| インビトロ/ 動物モデル |
オートファジーの阻害により、膵臓がん細胞表面でのMHCクラスI発現が回復し、膵臓がん免疫回避メカニズムの1つが元に戻る。二重免疫チェックポイント阻害剤(抗CTL4および抗PD-1)と組み合わせて使用した場合の膵臓がんのマウスモデルにおける腫瘍増殖の減速 | [ 50 ] | ||
| インビトロ/ 動物モデル |
CXCL12 / CXCR4シグナル伝達の阻害、ERKおよびSTAT3のリン酸化の低下、ヘッジホッグシグナル伝達のダウンレギュレーション、Pa-CSCの排除につながる。膵臓癌PDXモデルにおける腫瘍形成性および浸潤性の低下; ゲムシタビンと組み合わせて使用した場合、一次異種移植片を有するマウスの転帰の改善 | [ 51 ] | ||
| イトラコナゾール | 真菌感染症 | インビトロ/ 動物モデル |
ROS放出、ミトコンドリア膜脱分極およびBak-1活性化を介したアポトーシスの誘導による膵臓がん細胞増殖の阻害。膵臓がん異種移植片腫瘍増殖の阻害 | [ 52 ] |
| インビトロ/ 動物モデル |
TGF-β/ SMAD2 / 3シグナル伝達抑制を介した膵臓がん細胞の遊走、浸潤およびEMTの障害とともに、アポトーシス誘導による膵臓がん細胞生存率の阻害。膵臓がんのGEMMにおける腫瘍増殖の阻害 | [ 53 ] | ||
| ロサルタン | 高血圧 | インビトロ/ 動物モデル |
AT1Rの遮断は、VEGF合成の阻害と膵臓がん細胞増殖の抑制につながる。ゲムシタビンと組み合わせて使用した場合のラット同所性膵臓がんモデルの生存利益の改善 | [ 54 ] |
| インビトロ/ 動物モデル |
ロサルタンとそれに続くゲムシタビンをロードした磁性メソポーラス有機シリカ球の連続投与によるインビボでの膵臓がん成長の阻害は、腫瘍のECMにおける間質I型コラーゲンおよびヒアルロン酸成分の減少をもたらす | [ 55 ] | ||
| インビトロ/ 動物モデル |
AT1Rの遮断は、CAFによる間質コラーゲンおよびヒアルロン酸産生の障害を引き起こす。腫瘍灌流、酸素、化学療法およびナノ治療薬の送達を強化することにより、同所性膵臓がんマウスモデルの全生存期間を改善 | [ 56、57 ] _ _ | ||
| 動物モデル/ 患者 |
AT1Rの遮断は、PSC活性化の防止、CD8 + T細胞の増加、IL-1β、TAN、およびTregの減少により、肥満誘発性線維症の減弱、腫瘍の進行、および化学療法に対する反応の改善をもたらす。 | [ 58 ] | ||
| 動物モデル | 異常なTGF-β活性、コラーゲン沈着およびTregの蓄積を阻害することにより、膵臓がんの進行の減速および膵臓がんの同所性モデルにおける生存率の改善 | [ 59 ] | ||
| メトホルミン | 2型糖尿病 | 試験管内で | ATP産生の低下、AMP / ATP比の増加、AMPKシグナル伝達の活性化、それに続く膵臓がん細胞増殖を阻害するmTORのダウンレギュレーションにつながる呼吸複合体Iの阻害 | [ 60 ] |
| インビトロ/ 動物モデル |
インスリン/ IGF-I受容体の活性化と下流のシグナル伝達メディエーターであるIRS-1およびAktの抑制による膵臓がん細胞増殖の阻害。膵臓がん異種移植片マウスモデルにおける腫瘍増殖の阻害 | [ 61、62 ] _ _ | ||
| ニトロキソリン | 尿路 感染症 |
試験管内で | 生存率とクローン原性の阻害、細胞周期停止とアポトーシスの誘導、Na / KATPaseポンプの調節解除、β-カテニン経路、細胞質ゾルの鉄恒常性、ROS産生とミトコンドリアの脱分極による膵臓がん細胞の遊走と浸潤の障害; ネルフィナビルと組み合わせて使用した場合の膵臓がん細胞における相乗的な抗腫瘍効果 | [ 42、63 ] _ _ |
| ピマバンセリン | パーキンソン 病 精神病 |
インビトロ/ 動物モデル |
Oct-4、SOX2およびNANOG癌幹細胞マーカーのダウンレギュレーションにつながるAkt / Gli1シグナル伝達カスケードの廃止による、膵臓がん細胞における生存率の阻害、アポトーシスの促進、および腫瘍球形成の抑制。膵臓がんの皮下および同所性異種移植片モデルの両方における腫瘍増殖の減少 | [ 64 ] |
| ピルフェニドン | 特発性肺線維症 | 試験管内で | PSCと膵臓がん細胞の両方における増殖の阻害と細胞周期停止の促進 | [ 65 ] |
| インビトロ/ 動物モデル |
PDGF-A、HGF、ペリオスチン、I型コラーゲンおよびフィブロネクチンの抑制を介したPSCの増殖、浸潤および遊走の阻害。腫瘍間質相互作用を破壊することにより、膵臓がん細胞およびPSCを同時移植したマウスにおける膵臓がんの成長および転移の抑制 | [ 66 ] | ||
| 動物モデル | αSMA陽性細胞とコラーゲン沈着を減少させることによるHapT1由来の同所性ハムスター膵臓がんモデルにおける線維形成反応と腫瘍増殖の阻害 | [ 67 ] | ||
| 試験管内で | 膵臓がん細胞におけるゲムシタビン耐性の復帰につながるCHI3L1およびFN1の阻害 | [ 68 ] | ||
| インビトロ/ 動物モデル |
ピルフェニドンとゲムシタビンを統合したリポソームベースのナノメディシンは、PSCのコラーゲンIとTGF-βのダウンレギュレーションを誘発する。間質性線維症の減少と薬物灌流の増加による膵臓がん細胞とPSCの同時移植マウスにおける腫瘍増殖の減速 | [ 69、70 ] _ _ | ||
| インビトロ/ 動物モデル |
ピルフェニドンとゲムシタビンを統合した有機シリカナノ粒子は、コラーゲンIとフィブロネクチンECM成分の減少とともに、アポトーシス誘導による膵臓がん細胞生存率の阻害を誘導する。コラーゲンIとフィブロネクチンの減少と血管内浸透圧の増強による膵臓がん細胞とPSCの同時移植マウスにおける腫瘍増殖の減少 | [ 71 ] | ||
| プロプラノロール | 高血圧 | インビトロ/ 動物モデル/ 患者 |
単剤として、およびゲムシタビンと組み合わせた、初代ヒト膵臓がんオルガノイドの生存率の阻害; ADRB2遮断によるK膵臓がんマウスの生存期間の延長とともに、腫瘍増殖、浸潤性および癌関連免疫抑制の廃止。手術を受け、非選択的BBを受けているステージII / IIIの膵臓腺癌患者の臨床転帰の改善、神経密度の低下、神経周囲浸潤の低下、BDNFの染色の低下を示す(遡及的データ) | [ 72 ] |
| インビトロ/ 動物モデル |
B1 / B2アドレナリン受容体の遮断は、アポトーシスを誘導し、NF-kB、AP-1、CREBの発現、およびMMP-9、MMP-2、VEGFの発現を阻害することにより、膵臓がん細胞の増殖と浸潤を抑制する。標的遺伝子 | [ 73、74 ] _ _ | ||
| 動物モデル | 膵臓がんの慢性的にストレスを受けた免疫担当同所性同系マウスモデルにおいて腫瘍増殖の阻害および生存期間の延長をもたらすB1 / B2アドレナリン受容体の遮断 | [ 75 ] | ||
| 動物モデル | Fz1、Wnt-1、およびビメンチンの発現を減少させることにより、膵臓がん異種移植動物モデルにおけるストレス誘発性腫瘍増殖の阻害をもたらすB1 / B2-アドレナリン受容体の遮断 | [ 76 ] | ||
| 動物モデル | α7nAChR、ERK1 / 2およびp-CREBのダウンレギュレーションとともに、EGFおよびVEGFのcAMP依存性放出の遮断を介した、NNKによるエタノール誘発性膵炎のハムスターにおける膵臓がん発生の予防 | [ 77 ] |
略語の説明 チオレドキシン還元酵素1(TrxR1)、Hypoxia-inducible factor-1 α(HIF1α)、活性酸素種(ROS)、ポリ(ADP-リボース)ポリメラーゼ(PARP)、ドーパミンD2受容体(DRD2)、小胞体(ER)、二重特異性ホスファターゼ6(DUSP6)、プロテインホスファターゼ2A(PP2A)、Janus kinase 2-signal transducer and activator of transcription 3(JAK2-STAT3)。細胞外シグナル調節キナーゼ/プロテインキナーゼB(ERK/AKT)、プロラクチン受容体(PRLR)、ジエチルジチオカルバミン酸/銅(DDTC-Cu)、核内因子kB(NF-kB)、がん幹細胞(CSC)、5-フルオロウラシル(5-FU)、エンドリボヌクレアーゼイノシトール要求酵素1α(IRE1α)、X-Box Binding Protein 1(XBP1; 核タンパク質局在化タンパク質4(NPL4);ヒトユビキチン選択的タンパク質分離酵素p97(別名VCP;valosin-containing protein)、p97/VCP分離酵素;ヒト免疫不全ウイルス(HIV);マイトジェン活性化プロテインキナーゼ(MAPK);レチノブラストマタンパク質(Rb);膵臓星状細胞(PSC);細胞外マトリックス(ECM)。患者由来の異種移植(PDX)、主要組織適合性複合体(MHC)、細胞傷害性Tリンパ球抗原4(CTL4)、C-X-Cモチーフケモカインリガンド12/C-X-Cケモカイン受容体タイプ4(CXCL12/CXCR4)、膵臓癌幹細胞(Pa-CSCs)、BCL2アンタゴニスト/キラー1(Bak-1)、上皮間葉転換(EMT)。TGF-β/SMAD2/3;遺伝子操作マウスモデル(GEMM);アンジオテンシンII 1型受容体(AT1R);血管内皮増殖因子(VEGF);がん関連線維芽細胞(CAF);インターロイキン1β(IL-1β);腫瘍関連好中球(TAN)。トランスフォーミング成長因子β(TGF-β)、AMPキナーゼ(AMPK)、哺乳類ラパマイシン標的(mTOR)、インスリン様成長因子I(IGF-I)、インスリン受容体基質1(IRS-1)、プロテインキナーゼB/神経膠腫関連癌遺伝子ホモログ1(Akt/Gli1)、オクタマー結合転写因子4(Oct-4)。SRY-Box転写因子2(SOX2)、ホメオボックスタンパク質(NANOG)、血小板由来成長因子サブユニットA(PDGF-A)、肝細胞成長因子(HGF)、α平滑筋アクチン(αSMA)、キチナーゼ3-ライク-1(CHI3L1)、フィブロネクチン(FN1)、アクチベータータンパク質1(AP-1)、cAMP応答エレメント結合タンパク質(CREB)、マトリックスメタロプロテアーゼ9(MMP-9)。マトリックスメタロプロテアーゼ2(MMP-2)、フリズルド-1(Fz1)、遺伝子改変膵臓がんモデルマウス(K膵臓がんマウス)、B2アドレナリン受容体(ADRB2)、β遮断薬(BB)、脳由来神経栄養因子(BDNF)、ニコチン由来ニトロソアミン(NNK)、上皮成長因子(EGF)、α7ニコチン性アセチルコリン受容体(α7nAChR)。
表2 膵臓がんを対象とした再利用薬を検討している介入型臨床試験の概要
| 再利用された薬 | トライアルコード/ スタディリファレンスの登録 |
段階 | 介入 | n。忍耐 | ステータス/結果 |
|---|---|---|---|---|---|
| クロロキン/ ヒドロキシクロロキン |
NCT01777477 [ 78 ] |
私 | m膵臓がんのGEM +クロロキン | 9 | 安全; 1 PR; 2 SD mTTP:4 カ月mOS:7.6カ月 |
| NCT01128296 [ 79 ] |
I / II | r膵臓がんのネオアジュバントGEM +ヒドロキシクロロキン | 35 | 安全; 94%切除率 77%RO切除率 OSおよびDFSは循環PBMCにおけるLC3-II発現と相関していた |
|
| NCT01978184 [ 80 ] |
ランダム化II | ネオアジュバントGEM / nabP±r膵臓がん / br膵臓がん中のヒドロキシクロロキン | 64 | エバンスIIグレードの回答率: 55.9%対10% |
|
| NCT01506973 [ 81 ] |
ランダム化II | 未処理のla膵臓がん / m膵臓がん中のGEM / nabP±ヒドロキシクロロキン | 112 | 12か月のOS:41%vs。49% ORR:38.2%vs。21.1% mOS:11.1 vs. 12.1 mo |
|
| NCT04132505 | 私 | m膵臓がん中のビニメチニブ+ヒドロキシクロロキン | 39 | 採用 | |
| NCT03825289 | 私 | a膵臓がん / m膵臓がんにおけるトラメチニブ+ヒドロキシクロロキン | 33 | 採用 | |
| NCT04386057 | ランダム化II | LY3214996±前処理されたla膵臓がん / m膵臓がん中のヒドロキシクロロキン | 52 | 採用 | |
| ジスルフィラム | NCT02671890 | 部分的に ランダム化されたI |
難治性/ GEMで前処理されたm膵臓がんのジスルフィラム |
74 | 採用 |
| NCT03714555 | II | FOLFIRINOX、GEM / nabP、またはGEMで処理され、CA19.9が上昇しているm膵臓がんのジスルフィラム+グルコン酸銅 | 42 | 採用 | |
| ネルフィナビル | [ 82 ] | 私 | 局所的にla膵臓がんでのネルフィナビル+化学放射線療法 | 12 | 安全 |
| NCT01068327 [ 83 ] |
私 | br膵臓がん / la膵臓がんのネルフィナビル+ SBRT | 46 | 安全 | |
| [ 84 ] | II | ネルフィナビル+ la膵臓がんでの化学放射線療法 | 23 (薬が入手できないために時期尚早に閉鎖) |
1年-OS :73.4% mOS:17.4カ 月1年PFS:21.8% mPFS:5.5カ月 |
|
| [ 85 ] | I / II | La膵臓がんのオレゴボマブ+ SBRT +ネルフィナビル | 11 (治療基準の変更により早期閉鎖) |
安全 | |
| NCT02024009 [ 86 ] |
ランダム化II | GEM / nabとそれに続く化学放射線療法±la膵臓がんでのネルフィナビル | 289 | 採用 | |
| ロサルタン | NCT01821729 [ 87 ] |
II | ロサルタン+ FOLFIRINOX + la膵臓がんでの化学放射線療法 | 49 | R0切除率:65% |
| NCT04539808 | II | ネオアジュバントFOLFIRINOX / GEM-nabP +化学放射線療法+ r膵臓がん / br膵臓がんのロサルタン | 40 | 採用 | |
| メトホルミン | NCT01971034 [ 88 ] |
II | GEMに不応性のla膵臓がん / m膵臓がん中のメトホルミン+パクリタキセル | 20 | 無駄のために終了 |
| NCT01210911 [ 89 ] |
ランダム化II | GEM /エルロチニブ±メトホルミン(la膵臓がん / m膵臓がん) | 121 | mOS:56.7%対63.9%(ns) | |
| NCT01167738 [ 90 ] |
ランダム化II | m膵臓がんにおけるシスプラチン/エピルビシン/カペシタビン/ GEM±メトホルミン | 60 | 無駄のために終了 | |
| NCT02336087 | 私 | GEM / nabP +栄養補助食品+ la膵臓がんのメトホルミン | 21 | アクティブ、募集していない | |
| NCT01666730 | II | m膵臓がん中のFOLFOX6 +メトホルミン | 50 | 完了、結果は公開されていない | |
| NCT02153450 | 私 | r膵臓がん / la膵臓がんのSBRT +メトホルミン | 8 | 完了、結果は公開されていない | |
| NCT02005419 | II | 切除された膵臓がんにおけるメトホルミン+ GEM | 300 | 完了、結果は公開されていない | |
| プロプラノロール | EudraCT 2018-000415-25 [ 91 ] |
ランダム化II | r膵臓がんにおける周術期プロプラノロール+エトドラク対プラセボ | 80 | 採用 |
略語:r膵臓がん=切除可能な膵臓癌、br膵臓がん=境界切除可能な膵臓癌、la膵臓がん=局所進行膵臓癌、m膵臓がん=転移性膵臓癌、PR=Partial Response、SD=Stable Disease、mPFS=無増悪生存期間(中央値)、mOS=全生存期間(中央値)、mTTP: 進行までの期間(中央値);ORR=全奏功率;GEM=ゲムシタビン;nabP=nab-パクリタキセル;SBRT=定位体放射線治療。
2.1. オーラノフィン
オーラノフィンは、トリエチルホスフィン基で安定化されたAu-S結合を有する経口投与可能な有機金錯体である(図1)。この化合物は,炎症,リソソーム酵素の放出,マクロファージによる貪食を抑制し,関節リウマチの進行を遅らせることができるため,関節リウマチの治療薬として承認されている[92]。興味深いことに,いくつかの研究では,膵臓がんを含むさまざまな腫瘍に対するオーラノフィンの抗がん作用が,単剤または併用で報告されている[20,21,22,93,94,95]。特に、最初の研究では、オーラノフィンが複数の膵臓がん細胞株の生存率に影響を与え、IC50値はすべて5μmol/L以下であった。おそらく、主要な酸化還元システムの1つであるチオレドキシンレダクターゼ1(TrxR1)を阻害することで、がん細胞内の抗酸化活性が低下し、その後アポトーシスが誘導されると考えられている[20]。著者らは、オーラノフィンが抗腫瘍作用の追加的なメカニズムとして、低酸素誘導因子-1α(HIF1α)も阻害する可能性を示した[20]。Ex vivoおよびin vivo試験では、オーラノフィンの抗腫瘍効果が原発部位で発揮され、遠隔地の臓器への転移が完全に抑制されることが示された[20]。これらの結果に関連して,Onoderaら[21]は,オーラノフィンが,栄養不足の状態にある膵臓がん細胞に対して,栄養不足の状態にある膵臓がん細胞よりも優先的に細胞毒性を示すことを報告した。そのメカニズムは,活性酸素の蓄積と,それに続くカスパーゼ3/7の活性化およびタンパク質分解的なPARP切断によるアポトーシスの誘導が関与している。また,オーラノフィンは,膵臓がんの異種移植モデルにおいて,シスプラチンと同等の効力で腫瘍の成長を抑制することができ,動物への副作用も認められなかった[21]。興味深いことに、遺伝的背景の異なる複数の膵臓がん細胞において、オーラノフィンは、細胞外のL-Cysプールを枯渇させることにより、複数のマウス腫瘍モデルにおいて酸化ストレスと選択的ながん細胞毒性をもたらすことが既に示されている人工ヒトCyst(e)inaseと併用すると、ミトコンドリア活性酸素の増加とアポトーシスを促進し、オートファジーフラックスを阻害した[22,96]。さらに、オーラノフィンとシスト(e)イナーゼの併用療法は、全身毒性を伴わずに、膵臓がん異種移植片の成長を相乗的に抑制したことから、臨床応用を視野に入れて、複数の抗酸化経路を標的とした治療戦略を検討する根拠となった[22]。
オーラノフィンは、前臨床試験で有望な結果を示したにもかかわらず、現在、新しい抗リウマチ薬の出現により、本来の効能ではほとんど使用されていないことに留意すべきである。そのため、世界のいくつかの市場で販売中止となっており、このことが臨床試験への供給や臨床採用の可能性を妨げている可能性がある[19]。
膵臓がんに対するオーラノフィンの臨床試験は行われていない。しかし、この薬剤は、マーカー上昇を伴う無症候性卵巣がん患者を対象とした小規模なパイロット試験で検証され、安全性が確認されている[97]。さらに、慢性リンパ性白血病を対象とした第I-II相試験が行われたが、結果は提供されていない(NCT01419691)。
2.2. 抗精神病薬(ハロペリドール、ペンフルリドール)
ハロペリドールとペンフルリドールは、ヒドロキシピペリジン系の抗精神病薬(図1)で、主にドーパミンD2受容体(DRD2)を遮断することにより、いくつかの精神疾患に伴う症状を抑えるために使用されている[98]。興味深いことに,これらの薬剤は,いくつかのin vitroおよびin vivoの腫瘍モデルにおいて,関連する抗腫瘍特性を有することが報告されている[99]。Jandaghiらは,膵臓がんのトランスクリプトームプロファイルと組み合わせたパスウェイおよびネットワークベースのアプローチを用いて,健康な膵臓組織サンプルと大規模な膵臓がん腫瘍のセットを比較することで,DRD2の発現がPDACで増加し,膵臓がん細胞の増殖と生存に重要な役割を果たしていることを示した[23]。そこで,ハロペリドールを用いてDRD2の活性を薬理学的に遮断すると,正常な線維芽細胞に対する毒性は最小限に抑えながら,小胞体ストレスを促進することで膵臓がん細胞の増殖を抑制することができた。また、ハロペリドールは、膵臓がん細胞の移動に影響を与え、細胞周期の進行を妨げ、アポトーシスを誘導した。驚くべきことに、同所性の膵臓がん腫瘍を移植したマウスにハロペリドールを投与すると、腫瘍の大きさと転移を有意に減少させ、動物の体重には影響を与えなかった[23]。Kimと共同研究者は、ハロペリドールが膵臓がんにおいて抗腫瘍活性を発揮する別のメカニズムを提案した[24]。ハロペリドールは、細胞外シグナル調節キナーゼ1/2(ERK1/2)に選択的なホスファターゼであるDual-specificity phosphatase 6(DUSP6)遺伝子の発現を回復させることにより、少なくとも部分的にMIA PaCa-2膵臓癌細胞の生存率に影響を与えることが示された。実際,DUSP6は,膵臓がんの癌抑制遺伝子として関与しており[100],特に,MIA PaCa-2細胞では,イントロン1の過メチル化によって発現が抑制されている。このようなシナリオにおいて,ハロペリドールは,MIA PaCa-2細胞におけるDUSP6遺伝子のDNA脱メチル化を促進することが示された。DUSP6は、脱リン酸化や核転位阻害などによりERKシグナルに影響を与え[101]、ERKシグナルを遮断すると、がん細胞の増殖や浸潤が抑制されることを考えると、ハロペリドールが膵臓がん細胞で促進するDUSP6遺伝子の転写制御におけるエピジェネティックな変化が、その抗増殖活性に寄与していると考えられる。ペンフルリドールについては、小胞体ストレスの誘導、オートファジーとそれに続く膵臓がん細胞のアポトーシスに関連したメカニズムにより、異なる膵臓がん細胞株で抗増殖作用を示した[25,26]。In vitroの結果は、異種移植や同所性の膵臓がんモデルでも確認され、Penfluridolは膵臓腫瘍の成長を著しく抑制した[25,26]。さらなる抗増殖メカニズムとして,ペンフルリドールは,プロテインホスファターゼ2(PP2A)の活性化を介して細胞周期の停止とアポトーシスを促進することで,膵臓がんの成長に影響を与えることが報告されている[27]。興味深いことに,ペンフルリドールは,ゲムシタビンとの相乗効果により,ゲムシタビン抵抗性およびゲムシタビン感受性の膵臓がん細胞の生存率に影響を与えることができた[27]。さらに最近では、Dandawateと共同研究者が、プロラクチン受容体(PRLR)に基づくシグナル伝達が膵臓がんで活発であることを示し、ペンフルリドールが膵臓がんの成長に影響を与える新しいメカニズムを提案した[28]。実際,ペンフルリドールは,PRLRのJAK2結合部位を標的とすることで,がん細胞の増殖,移動,アポトーシス,および幹細胞機能の付与に重要な役割を果たすJAK2-STAT3およびERK/AKTシグナルを抑制することが示された。その結果、penfluridolは、コロニーやスフェロイドの形成を抑制し、オートファジーを誘導することで、膵臓がん細胞の増殖を抑制した。さらに,ペンフルリドールは,さまざまな膵臓がんの異種移植マウスモデルの成長を遅らせることができ[28],膵臓がん治療におけるペンフルリドールの再利用の可能性を裏付けた。
臨床試験に関しては、膵臓がんでの研究は報告されておらず、一般的には、肺がんにおけるジヒドロレンペロンを除いて、がんにおける抗精神病薬に関する臨床試験は不足している[103]。
2.3. ベンズイミダゾール系の駆虫薬
ベンズイミダゾール系の駆虫薬は、腸内寄生虫の治療のために人と獣医の両方で広く使用されている薬剤群である[104]。興味深いことに,このファミリーのいくつかのメンバーが,膵臓がんを含む複数の腫瘍モデルにおいて,in vitroおよびin vivoで抗腫瘍効果を示すことを報告する研究が増えてきている[29,105,106,107]。特にFlorioらは,パルベンダゾール(図1)が,治療用血漿濃度の範囲内の用量で,アポトーシス,劇的な細胞周期の乱れ,およびDNA損傷反応を促進することにより,膵臓がん細胞の成長を阻害し,クローン形成性を消失させることを示した[29]。メカニズム的には,パルベンダゾールは,膵臓がん細胞の微小管の構造を大きく変化させることができ,その結果,不規則な有糸分裂紡錘体の形成や倍数体細胞の急速な出現が促進されると考えられている。注目すべきは、パルベンダゾールと膵臓がん標準化学療法薬であるゲムシタビンを併用すると、膵臓がん細胞の生存率に相乗的な影響を与えることであり、臨床応用の観点からもパルベンダゾールの妥当性が支持されている。興味深いことに,薬学的に活性な化合物は,多数の作用機序で複数の分子標的を調節する可能性があることを考慮し,インシリコの標的予測法を用いて,より広範なベンズイミダゾール系化合物の推定上の多薬理学的プロファイルを検討した[106]。特に,フェンベンダゾールとメベンダゾールの2つの誘導体については,バイオインフォマティクスツールによって,MAPキナーゼp38α,血管内皮増殖因子受容体2(VEGFR2),チロシン-プロテインキナーゼABLといった,これまであまり検討されていなかったがん関連の標的が,非常に高い確率で浮き彫りにされた[106]。ベンズイミダゾール系駆虫薬の腫瘍学への再利用の可能性を考慮すると、これらの予測を検証するために、膵臓がんおよび他の腫瘍モデルを用いたin vitroおよびin vivoの研究がさらに必要である。
少なくとも2つの初期段階の試験では、進行がん(主に大腸がん)に対するアルベンダゾールの試験が行われ[108,109]、良好な忍容性が確認された。そのうちの1つでは、進行した膵臓癌の患者2名が登録された[108]。
2.4. ジスルフィラム
ジスルフィラム(DSF)は,N,N-ジエチルジチオカルバミン酸の酸化的二量化によって生じる有機ジスルフィドであり(図1),慢性アルコール中毒の治療薬として臨床現場で広く使用されている。メカニズム的には,この薬剤はアルデヒド脱水素酵素(ALDH)を不可逆的に阻害し,その結果,アセトアルデヒドが蓄積され,アルコールを摂取すると不快な症状が引き起こされるというものである[110]。興味深いことに、いくつかの研究では、DSFが、がん細胞の幹細胞化と密接に関係する細胞代謝のALDH関連プロセスを阻害することで、単剤または併用療法として有望な抗腫瘍作用を示すことが報告されている[111]。さらに,DSFは,2価の銅イオン(Cu2+)とキレートしてDSF/Cu複合体を形成し,強力なプロテアソーム阻害剤として作用することで,がん幹細胞(CSC)の生物学的維持に関与する重要な転写因子であるNF-kBの活性化を阻止することができる[112]。注目すべきは、これらの経路が膵臓がんにおいてもDSFによって調節されていることである。Hanらは,DSFの主要代謝物であるジエチルジチオカルバミン酸(DDTC)が,銅の存在下でDDTC-Cu(I)二核錯体を形成し,プロテアソーム活性を阻害することで,in vitroでの膵臓がん細胞の増殖やin vivoでの腫瘍の成長に影響を与えることを示した。これに関連して,SW1990 膵臓がん細胞を移植したマウスにDDTC-Cu(I)を投与すると,ユビキチン化されたタンパク質が蓄積し,腫瘍組織ではp27の発現が上昇し,NF-kBの発現が低下することが示された[30]。膵臓がんの幹細胞を標的とした場合,DSF/Cuは,NF-kB-stemness遺伝子経路のダウンレギュレーションを介して,膵臓がん細胞株のパネルにおいて,既存のCSCおよび放射線誘発CSCを枯渇させるのに有効であることが示された。さらに、DSFと5-FUと放射線治療の併用は、化学療法と放射線治療のみの場合と比較して、合成マウス膵臓がんモデルの成長を最も効果的に抑制し、動物への毒性もなく、この顕著な抗腫瘍効果は球体形成の減少と関連しており、DSFが治療誘発性幹細胞をブロックする可能性を裏付けている[31]。また、別の研究では、臨床的に達成可能な濃度の三酸化二ヒ素およびアスコルビン酸と併用することで、Rasに変異のある膵臓がん細胞株において、DSFがアポトーシスからアポネクローシスへの死経路の切り替えを、代替的な細胞死の形態として促進する可能性が示された[32]。これらの効果は、細胞内のATPの枯渇と活性酸素種(ROS)の放出に関連しており、PANC-1異種移植片を移植したマウスの腫瘍の成長に3剤の併用が顕著に影響するというin vivoの実験でも支持された[32]。興味深いことに,Zhangらは,膵臓がんにおけるDSFの抗腫瘍性をさらに説明するために,別の作用機序を検討した[33]。著者らは、DSF/Cuが、ERストレス/IRE1α-XBP1経路の活性化を通じて、膵臓がん細胞における細胞傷害性オートファジー依存性アポトーシスを促進する可能性を示した[33]。この活性化は,IRE1αとの直接的な相互作用によって,あるいは,p97/VCP分離酵素やプロテアソームのNPL4補因子の阻害と活性酸素の産生を伴う間接的なメカニズムによって起こると考えられている[33]。
最近、前治療歴の多い肝転移性がん患者を対象に、ジスルフィラムの固定用量(1日250mgを経口投与)と銅の用量漸増を組み合わせた第I相試験の結果が発表された。評価対象となった16名の患者のうち、用量制限のある毒性は認められず、4名の患者は病状が安定していることが確認された。膵臓がんを投与された唯一の患者は病状が進行した[113]。現在、膵臓がん患者を対象としたジスルフィラムの臨床試験が2件実施されている。1つ目の臨床試験は、化学療法とジスルフィラムの併用を検討する、部分的に無作為化された第1相試験である。対象となる患者は、治療を担当する腫瘍医の判断で化学療法を受けている難治性のがん患者、またはゲムシタビンで治療を受けた転移性の膵臓がん患者である。本試験では、74名の患者が登録される予定で、ジスルフィラムの最大許容量を設定し、筋肉の衰えを抑制して化学療法に対するがんの感受性を高めることができるかどうかを検証することを目的としている(NCT02671890)。また、FOLFIRINOX、Gemcitabine+nab-Paclitaxel、またはGemcitabine単剤の投与を受けている転移性膵臓がん患者で、CA19.9レベルが上昇しているが、放射線学的には病勢進行の兆候がない患者を対象に、グルコン酸銅とともにジスルフィラムの第II相パイロット試験が実施されている。本試験の主要評価項目はCA19.9の血漿中濃度の変化の評価であり、副次評価項目は有効性に関するものである(NCT03714555)。
2.5. ドキシサイクリン
ドキシサイクリンは、テトラサイクリン系の半合成広域抗生物質であり(図1)、細菌のタンパク質合成を阻害することにより、いくつかの細菌感染症の治療に使用されている[114]。ドキシサイクリンは,この活性に加えて,血管新生やマトリックスメタロプロテアーゼ(MMP)活性の阻害作用を示したことから,これらの特性を利用して,いくつかの悪性腫瘍に対する影響の可能性が検討された[115]。膵臓癌において,ドキシサイクリンは,プロアポトーシス遺伝子を活性化し,アンチアポトーシス遺伝子を抑制し,細胞周期を乱し,血管新生を促すIL-8の発現を抑制することで,膵臓がんの成長に影響を与えることが示された[34,35]。また,ドキシサイクリンは,膵臓がんの異種移植マウスモデルにおいて,腫瘍の成長を80%減少させた[34]。ミトコンドリアのリボソームが細菌のリボソームと進化的に関連していることを考慮すると,テトラサイクリンを含むいくつかのクラスの抗生物質が,副作用としてミトコンドリアを標的とし,ミトコンドリアの生合成と機能を阻害することはよく知られている[36,116]。Lambらは、偏りのないプロテオミクス手法を用いて、単層と比較してマンモスフィアではいくつかのミトコンドリア関連タンパク質の発現が増加していることを示し、タンモスフィアの形成がミトコンドリアの生合成に依存しているという仮説を支持した[117]。これらの考察に基づいて,著者らは,複数の癌細胞株における腫瘍球形成を阻害する上で,ドキシサイクリンを含むミトコンドリアを標的とするさまざまな抗生物質の能力を検討した[36]。具体的には,ドキシサイクリンは,バルクのがん細胞と正常な線維芽細胞の両方の生存率に影響を与えない濃度で,膵臓がん細胞の腫瘍球形成を抑制した。このことは,腫瘍の再発,転移,薬剤耐性の原因となる,腫瘍を形成するがん幹細胞を選択的に標的とする可能性を示している。同様に、Dijkらは、ドキシサイクリンによるミトコンドリアのタンパク質合成の阻害とゲムシタビンの併用により、ATPの枯渇を介して膵臓がん細胞の増殖が低下することを示した。さらに、この併用療法は、ミトコンドリアの膜電位を低下させ、ROSの産生を促進することで、ゲムシタビンによるアポトーシスを促進する[37]。最近、Liuらは、プロテアーゼ活性化受容体1(PAR1)阻害剤であるドキシサイクリンが、膵臓がんがん幹細胞の特性に及ぼす影響をin vitroおよびin vivoで検討した[38]。特に、著者らは、PAR1が膵臓がん細胞の癌幹細胞の特徴とEMTを促進することを示している。この観点から、ドキシサイクリンは、PAR1/FAK/PI3K/AKTシグナル伝達経路のダウンレギュレーションを通じて、膵臓がんの成長、移動、浸潤、腫瘍球形成に影響を与える。さらに、異なる化学療法剤と併用することで、ドキシサイクリンは膵臓がん細胞の生存率に相乗効果をもたらし、特に5-FUの効果を高めることがわかった。これらの知見は、生体内でも確認されており、Panc-1皮下移植モデルにおいて、ドキシサイクリンと5-FUの併用は、単剤と比較して膵臓がん細胞の増殖を80.5%抑制し、E-Cadherinの発現が増加し、VimentinとCD133の発現が減少した[38]。
膵臓がんに対するドキシサイリンの臨床試験に関する発表データはない。抗がん剤としては、進行した腎細胞がんを対象にインターフェロンαとの併用で第2相試験が行われたが、残念な結果に終わった[118]。しかし、この薬剤は、ネオアジュバント化学放射線療法を受ける切除可能な膵臓がん患者を対象としたwindow-of-opportunity試験で検証されている。この試験の目的は、手術前にドキシサイクリン100mgを1日2回、8週間投与することで、幹細胞の細胞死効果を評価することである(NCT02775695)。
2.6. HIV阻害剤(エファビレンツ、ネルフィナビル、リトナビル)
抗ウイルス剤は,肝炎,インフルエンザ,サイトメガロウイルス,免疫不全ウイルス(HIV)など,さまざまなヒトの感染性ウイルス疾患の治療に用いられている[119]。中でも,HIV阻害剤であるエファビレンツ,ネルフィナビル,リトナビルは,膵臓がんをはじめとするさまざまな腫瘍で抗がん作用を示すことから,特に注目されている[120,121]。特に,エファビレンツは,1,4-ジヒドロ-2H-3,1-ベンゾオキサジン-2-オン骨格(図1)を有する抗ウイルス剤で,HIV-1感染者に対して長期的に良好な忍容性を示した[122]。この薬剤は,異なる膵臓がん細胞株において,クローン形成を阻害し,アポトーシスを誘導した。この薬剤は,HIV患者の異なるコホートで使用されたときに達成されたものと同等のIC50値で生存率に影響を与えた[39]。さらに、エファビレンツの放射線増感作用が膵臓がん細胞で報告されており、放射線とエファビレンツを併用することで、抗増殖作用が増強された。このメカニズムには、活性酸素の生成とミトコンドリア膜の脱分極、および癌細胞におけるERK1/2とp38 MAPKの両ストレス経路のリン酸化が関与している。膵臓がんの動物モデルにおけるエファビレンツの研究は行われていないが,ヒト甲状腺未分化癌や肺扁平上皮癌などの他の癌モデルではin vivoで抗腫瘍効果を示した[123,124]。ペプチド擬態薬であるネルフィナビル(図1)に関しては,上皮成長因子受容体/HER2過剰発現膵臓がん細胞株における抗腫瘍効果を検討した研究がある[41]。実際,膵臓がんに共通する特徴であるK-rasの恒常的な活性化は,PI3K/AktおよびRaf/MEK/ERK下流シグナル伝達経路の活性化を通じても,放射線耐性を付与する[125,126]。この点に関して,Kimpleらは,ネルフィナビルと他のHIVプロテアーゼ阻害剤がAktシグナルを遮断し,in vitroとin vivoの両方でがん細胞を放射線増感する能力があることから,膵臓がんの放射線増感剤としてのネルフィナビルの役割を研究した[41,127]。ネルフィナビルは,臨床的に達成可能な用量で,in vitroでは膵臓がん細胞株のAktリン酸化を阻害することで有効性を示し,野生型およびK-ras変異細胞株の両方を放射線増感させた。同様に、臨床的に適切な線量の放射線とネルフィナビルの経口投与を組み合わせて治療したCapan-2ベアリング異種移植片においても、phospho-Aktレベルが有意に低下し、マウスにおける腫瘍の成長を相乗的に遅らせることができた[41]。Veschiらの研究では、遺伝的プロファイルが異なる複数の膵臓がん細胞株を用いて、ネルフィナビルの抗腫瘍効果を単剤または併用で検討した[42]。ネルフィナビルは、膵臓がん細胞の細胞周期に影響を与え、アポトーシスを促進することで、クローン形成を阻害し、生存率を低下させた。興味深いことに、ネルフィナビルは、膵臓がん治療ですでに承認されている標的薬であるエルロチニブの有無にかかわらず、膵臓がんにおけるもう1つの再利用薬候補であるニトロキソリン(下記参照)と併用すると、これらの抗腫瘍効果が増強され、相乗効果が得られた[42]。ネルフィナビルは、膵臓がんでの再利用の有望な候補薬と思われるが、この薬剤に関する主要な問題がまだ残っている[19]。実際,現在,ネルフィナビルは本来の適応症ではほとんど使用されておらず,欧州ではもはや販売されておらず,この点が臨床試験への供給を困難にしている可能性がある[19]。リトナビルは,HIV患者に有効で,比較的副作用の少ないペプチド系HIVプロテアーゼ阻害剤(図1)であり,膵臓がんの抗腫瘍効果が確認されている。具体的には,Batchuらは,リトナビルが,内在性アポトーシス経路を誘発し,これらのがん細胞におけるAktおよびRbのリン酸化の抑制を介して細胞周期機構を妨害することにより,膵臓がん細胞の生存率に影響を与えることを報告している[43]。さらに、この薬剤は、膵臓がん細胞の運動性と浸潤性を阻害する。驚くべきことに、リトナビルは、ゲムシタビンと併用することで、臨床的に妥当な非毒性量で、膵臓がん細胞においてより大きな抗増殖効果を発揮し、膵臓がんの再利用薬候補としての可能性を裏付けている[43]。efavirenzと同様に、リトナビルも膵臓がんの動物モデルでは試験されていない。しかし,リトナビルは,他の腫瘍モデルにおいて,単剤または併用で増殖を抑制する効果があることが証明されている[128,129,130]。
前述のHIV阻害剤の中で、ネルフィナビルは、膵臓がんの相対的な放射線抵抗性のために、従来の分割照射または定位放射線治療と組み合わせて、境界切除可能または局所進行の膵臓がんで試験された。一般的に、第I相試験では、抗レトロウイルス治療の標準的な用量(1250mg/日)での忍容性が確認されており、観察された毒性のほとんどはネルフィナビルとは無関係であると考えられている[82,83]。特に、抗がん剤としてのネルフィナビルの最大耐量(MTD)は、膵臓がんを含む様々ながんに対して決定され、HIV管理のために承認された用量の2.5倍であることが判明した[131]。ネルフィナビルは、少なくとも2つの第2相試験[84,85]でも検討されているが、いずれも薬剤が入手できなかったり、最適な治療ができなかったりしたため、早期に終了している。過去の対照群との間接的な比較により、治療に対する反応率が上昇する可能性が示されているものの、発表された研究の中には、本剤の付加的な効果を明確に評価できるものはない。しかし、ある研究では、奏効は、機能的画像で評価した腫瘍の低酸素と灌流のネルフィナビル投与後の変化と関連していた[84]。ネルフィナビルの有用性に関する主要な洞察は、おそらくSCALOP-2試験から得られるだろう。SCALOP-2試験では、最初の用量設定段階が完了し、ネルフィナビルのMTDが1250mgに設定された[86,132]。SCALOP-2試験では、患者は、ゲムシタビン/nab-パクリタキセル、カペシタビン、標準または高線量放射線治療を追加で3サイクル受け、ネルフィナビルを1250mg/日で投与する群としない群に無作為に分けられる予定である[86]。
2.7. ヒドロキシクロロキンとクロロキン
クロロキンとヒドロキシクロロキンはいずれも4-アミノキノリン(図1)で、マラリアや、ループスや関節リウマチなどの自己免疫疾患の治療薬として承認されている[133]。これらの薬剤は,いくつかの悪性腫瘍において,がん細胞と腫瘍微小環境の構成要素の両方に作用し,抗腫瘍効果を示すことが示されている[134,135]。その抗腫瘍効果は、主にオートファジーの阻害に起因しており、オートファジーによって代謝ストレス産物の分解が妨げられ、その結果、細胞のアポトーシスが促進されることになる[134,136]。オートファジーは複雑なプロセスで、がん細胞がエネルギーの恒常性と細胞の生存を維持するために、固形がん内の細胞回転率の上昇に伴う代謝活性の増加と低酸素によって生成された生体エネルギー代謝ストレス生成物を再利用することを可能にしている[137]。オートファジーは、特に膵臓管内新生物(PanIN)が膵臓がんに進行する後期に亢進することが示されており、化学療法と標的療法の両方に対する耐性に関与していると考えられている[44,138]。Yangらは、クロロキンが複数の膵臓がん細胞株の増殖を低下させ、膵臓癌のマウス異種移植モデルの生存率を顕著に改善することを初めて証明した[44]。同様に,Endoらは,クロロキンによるオートファジーの阻害が,膵臓星状細胞(PSC)の静止状態を促進し,浸潤性サイトカインであるIL-6の発現や細胞外マトリックスタンパク質の産生を低下させることで,同所性膵臓がんマウスモデルにおける浸潤特性や肝転移形成を抑制することを示した[45].さらに、Frieboesらは、クロロキンが転移した膵臓がん細胞株の生存率に影響を与え、その効果は低酸素状態で増強されることを示した[46]。しかし、前臨床試験では有望な結果が得られたため、膵臓がん治療におけるクロロキンの臨床評価が促されたが、その後の臨床試験では、クロロキンの単剤療法での有効性は限られているか、全くないことが報告された[139]。そこで、いくつかの研究では、クロロキンと異なる分子標的や経路に作用する他の薬剤との併用効果が検討された。この点、化学療法ががん細胞の自食作用を高め、それによって細胞の生存が促進されることが、治療に対する抵抗性のメカニズムであることを考慮すると[138]、標準的な化学療法に自食作用の阻害を目的とした治療を組み合わせることで、その抵抗性を逆転させることができると考えられる。橋本らは,PANC-1およびBx膵臓がん-3膵臓がん細胞株において,5-フルオロウラシルやゲムシタビン処理に対する細胞保護メカニズムとして,オートファジーが強く誘導されることを示した[47]。驚くべきことに,クロロキンと5-フルオロウラシルまたはゲムシタビンを併用することで,これらの膵臓がん細胞株における2つの化学療法剤の抗増殖効果が増強された[47]。興味深いことに,Fuらは,異種移植膵臓がんモデルにおいて,クロロキンがゲムシタビンと協力して増殖を抑制することを示したが,Yangらによる以前の研究[44]とは異なり,クロロキン単独では効果がなかった[48].さらに,膵臓がん細胞におけるクロロキンによるオートファジーの阻害は,ゲムシタビンによる細胞毒性を高めるATG7 siRNA戦略よりも効果的であり,クロロキンを前処理した後にゲムシタビンを投与すると,活性酸素種(ROS)の放出が顕著に誘発され,その結果,リソソーム膜の透過とそれに続くアポトーシスが促進された[48]。これらのデータは、膵臓がん治療におけるクロロキンのゲムシタビン化学療法増感剤としての役割を示唆している。
ゲムシタビンに加えて、クロロキンはさまざまな前臨床膵臓がんモデルにおいて他の薬剤との併用が有効であることが判明した。特に、ERK/MAPK阻害剤とクロロキンを併用することで、膵臓がんのオルガノイドモデルと患者由来の異種移植(PDX)モデルの両方において、クロロキンによる増殖抑制効果が相乗的に増強された[49]。具体的には,ERK/MAPKシグナルを阻害すると,膵臓がん細胞のミトコンドリア機能と解糖系活性が損なわれ,その結果,オートファジー依存性の状態が生じ,クロロキンによるオートファジー阻害に対する感受性が高まることがわかった[49].in vitroおよびin vivoのモデルでは、クロロキンによるオートファジーの阻害が、膵臓がん細胞の免疫逃避を妨げることが示されている[50]。
さらに、クロロキンの抗腫瘍活性を説明するために提案されているオートファジーとは異なるメカニズムとして、膵臓CSCs(Pa-CSCs)におけるCXCL12/CXCR4およびヘッジホッグシグナル伝達経路の阻害が少なくとも部分的に関係しているとされている[51]。特に、Balicらは、クロロキンがCSCにおけるC-X-Cケモカイン受容体4型(CXCR4)の内在化を促進し、ケモカイン(C-X-Cモチーフ)リガンド12(CXCL12)に対する細胞の感受性を低下させることで、初代膵臓がん細胞培養においてPa-CSCを優先的に排除することを示した。CXCL12/CXCR4シグナルをクロロキンで阻害すると、細胞外シグナル調節キナーゼ(ERK)やシグナル伝達因子・転写活性化因子3(STAT3)のリン酸化が抑制され、ヘッジホッグシグナルもダウンレギュレーションされたという。後者の経路は、生理的条件下では静止しているが、その活性化は、腫瘍の発生や、幹のような攻撃的な表現型の維持に関与している。In vivoでは、クロロキンを単独またはゲムシタビンと併用して処理した細胞は、膵臓がんPDXモデルのパネルにおいて、腫瘍性と浸潤性が劇的に低下し、初代異種移植片を移植したマウスの成績も改善した[51]。本研究では、クロロキンをPa-CSCsの阻害剤として使用することを支持しており、腫瘍の大部分を標的とするゲムシタビンベースのアプローチと組み合わせることが可能である。
切除不能/転移性がん患者のファーストラインまたはレイトライン治療としてのゲムシタビンとクロロキンの併用は、第I相試験で評価され、安全性と忍容性が確認されている[78]。同様に、ゲムシタビンと併用したヒドロキシクロロキンの安全性と忍容性は、第I/II相試験(NCT01128296)で評価されている。切除可能な膵臓がん患者35名を対象に、術前に固定用量率のゲムシタビンを2回注入し、1日あたりのヒドロキシクロロキンの用量をエスカレートさせて31日間連続して投与した[79]。治療は安全で忍容性が高く、用量制限のある毒性や治療の遅れはなかった。注目すべきは、この研究では、末梢リンパ球のLC3-IIレベルをオートファジー阻害の代替マーカーとして使用したことである。興味深いことに、LC3-II レベルが上昇した患者は、PFS および OS の改善を示した。切除率と R0 切除率は、同じ施設で行われた過去のシリーズよりも高いことが報告された [79,140]。しかし、本研究の規模が限られており、比較が間接的であることから、これらの結果は慎重に考慮する必要がある。
ヒドロキシクロロキンは、切除可能または境界切除可能な腫瘍を有する98人の患者が、ゲムシタビン/ナブパクリタキセルを単独または本剤との併用で2サイクル受けた無作為化第2相試験でも評価された(NCT01978184)。観察された退薬率は36%で、両群間に有意差はなかった。グレードIIB以上の病理組織学的奏効率は併用群で有意に高く(55.9%対10%)、Ca19.9の血清レベルの低下と相関していた。また、ヒドロキシクロロキンの投与は、腫瘍標本におけるSQSTM1/p62の染色性の増加と関連しており、これはオートファジーの低下を示唆するものであり、免疫細胞による腫瘍への浸潤も高かった。オートファジーの低下と免疫細胞による腫瘍浸潤の増加は、in vitroおよび動物モデルで観察された腫瘍の免疫逃避機構を元に戻すという、本薬の有益な役割と一致している[50]。OSおよびRFSには差が認められなかった[80]。進行性/転移性がんにおいては、ゲムシタビン/ナブパクリタキセルの1次治療にヒドロキシクロロキンを併用した場合の効果を検討した無作為化第II相試験が行われた(NCT01506973)。この試験では、1年後のOSの改善は見られなかったが、全奏功率はヒドロキシクロロキンを投与された患者で有意に高く(38.2%対21.1%)、毒性の増加は管理可能であった[81]。このことは、Zehら[80]によって観察された病理組織学的応答の増加とともに、これらの薬剤と化学療法の併用の理想的な設定は、応答の増加がより高い切除率を意味する可能性のある術前であることを示唆している[81,138]。
前臨床のデータでは、KRASまたはBRAFの変異によって引き起こされる癌(膵臓癌の90%)において、RAS-RAF-MEK-ERK経路の阻害によってオートファジー依存性が高まることが一貫して示されている[49,141]。さらに、クロロキンまたはヒドロキシクロロキンは、RAF(ビニメチニブ)、MEK(トラメチニブ)またはERK(SCH772984、ウリクセルチニブ)の阻害剤と相乗効果を発揮し、腫瘍の成長を抑制することが示されている[49,141]。また、Kinseyらは、重度の前治療を受けた膵臓がんの患者に、トラメチニブとヒドロキシクロロキンを併用した症例を報告している。この患者は、治療開始4カ月後にRECIST基準による部分奏効を達成した[141]。このエビデンスに基づき、ヒドロキシクロロキンとビニメチニブ(NCT04132505)、トラメチニブ(NCT03825289)またはERK阻害剤LY3214996(NCT04386057)のいずれかとの併用を評価するために、少なくとも2つの第I相および1つの第I/II相臨床試験が活性化している。
2.8. イトラコナゾール
イトラコナゾールは、合成された広域抗真菌トリアゾール薬(図1)であり、真菌のエルゴステロール生合成経路の規制緩和を通じて作用する[142]。この薬剤は、経口全身投与で、数ヶ月間継続できる比較的安全な治療薬として使用されており、副作用はほとんどない[142]。興味深いことに、本薬の抗腫瘍活性は、単剤または標準的な化学療法薬との併用により、いくつかの腫瘍において多数のin vivo、in vitroおよび臨床的証拠によって十分に証明されている[143]。イトラコナゾールの有望な抗腫瘍特性を説明するために、内皮細胞増殖の抑制、血管新生の防止、自食作用による成長停止の誘導、P-glycoprotein薬物排出ポンプの阻害による薬物耐性の逆転など、複数の基礎的なメカニズムが提案されている[143]。さらに,イトラコナゾールは,膵臓癌で異常に調節されていることが知られているヘッジホッグシグナル伝達経路に影響を与えることが示されているが,このシグナル伝達経路が膵臓がんの進行において促進的または制限的な役割を果たしていることを示す矛盾した結果が示されている[144,145,146]。実際、現在までに、膵臓がんにおけるイトラコナゾールの抗腫瘍効果を検討した前臨床研究はほとんどなく、臨床試験も行われていない[147]。具体的には、Jiangらは、この薬剤が活性酸素の放出を通じてアポトーシスを誘導し、ミトコンドリア膜の脱分極とBak-1の活性化を促進することで、in vitroで膵臓がん細胞の成長を阻害することを報告している[52]。イトラコナゾールは,in vivoでも効果があり,膵臓癌の異種移植腫瘍の成長を有意に抑制し,動物に対する毒性はないことが示された[52]。同様に,Chenらは,イトラコナゾールがアポトーシスを誘導することで膵臓がん細胞の生存率を阻害し,少なくともTGF-β/SMAD2/3シグナルの抑制によって,膵臓がん細胞の移動,浸潤,上皮間葉転換(EMT)を障害することを示した[53]。さらに,イトラコナゾールは,自然に膵臓がんを発症する膵臓がんの遺伝子操作マウスモデル(GEMM)において,腫瘍の成長を抑制することができた[53]。イトラコナゾールは,悪性腫瘍の進行に不可欠な複数の経路を調節すると考えられており,膵臓がん治療における再利用薬候補としてのイトラコナゾールの治療効果を裏付けるためには,さらなる研究が必要であると考えられる。
イトラコナゾールの抗腫瘍効果は、一次治療または二次治療後に進行した転移性膵臓がん患者のレトロスペクティブな単施設コホートで評価されている[148]。彼らは、3剤併用療法(ドセタキセル、ゲムシタビン、カルボプラチン)とイトラコナゾールを併用して治療を受け、全奏功率(ORR)は37%であった。その後、90%以上の患者がイリノテカンを含むレジメンとイトラコナゾールで治療を受け、最終的なORRは47%であった。毒性は限られており、61%の患者に見られた輸血を必要とする貧血を除いては、ほとんどなかった。OSの中央値は11.4カ月で、公表されている二次治療試験の包括的な分析で報告された6カ月を大幅に上回った[149]。著者らは、この転帰の改善がイトラコナゾールの抗がん作用に関連している可能性を示唆しているが、この研究のレトロスペクティブな性質から、3剤併用療法に依存している可能性も否定できないことを認めている[148]。
2.9. ロサルタン
ロサルタンは、選択的で非ペプチド性のアンジオテンシンII 1型(AT1)受容体拮抗薬(ARB)(図1)で、高血圧治療の比較的安全な薬剤として広く使用されている[150]。一般的に,レニン・アンジオテンシン・アルドステロン系(RAAS)とその主要構成要素(生理活性のあるアンジオテンシンIIとそのAT1およびアンジオテンシンIIタイプ2(AT2)受容体サブタイプを含む)は,血圧の恒常性と電解質バランスを調節する因子としてよく知られている。様々な臓器や組織で局所的なRAASシグナルが検出され、細胞生物学的プロセスや、炎症などの病態生理学的プロセスとの関連性が指摘されている[151]。驚くべきことに、アンジオテンシンIIは、腫瘍の微小環境において、パラクラインおよび/またはオートクラインシグナルとして作用し、それによって、炎症細胞のリクルートを促進することを示す多くの証拠がある。これにより、腫瘍成長因子の分泌が増加し、細胞の増殖と間質細胞の成長を促進し、さらに血管内皮成長因子(VEGF)の発現をアップレギュレートすることで腫瘍の血管新生を促進することがわかっている[151,152,153,154]。これらの考察に基づき、ロサルタンは、膵臓癌を含む様々な前臨床腫瘍モデルにおいて、その抗血管新生、抗線維化、ひいては抗新生物の可能性について広範囲に試験された[155,156,157,158]。特に、ロサルタンとゲムシタビンを併用したラット同所性膵臓癌モデルでは、AT1R遮断によるVEGF合成阻害と膵臓がん細胞の増殖抑制が関与するメカニズムにより、生存率が向上することが指摘されている[54]。同様に、Liらは、ロサルタンに続いてゲムシタビンを担持した磁性メソポーラス有機シリカ球を順次投与する併用療法は、単剤療法と比較して、マウスでの毒性は無視できる程度で、膵臓がんの成長を有意に抑制することを報告している[55]。さらに、Chauhanらは、ロサルタンが、膵臓がんなどの脱落性腫瘍において、がん関連線維芽細胞(CAF)から放出されるプロフィブロティック・シグナルの発現を低下させることで、間質のコラーゲンとヒアルロン酸の産生を阻害することを示した[56]。この効果は、腫瘍血管の減圧を促進し、腫瘍の灌流を大幅に改善することで、酸素、化学療法、ナノ治療薬の送達を促進し、同所性膵臓がんマウスモデルにおける全生存率を向上させる[56,57]。これらの効果は、異なるARBの存在下でも一貫して観察されたことから、ARBの抗腫瘍活性は、オフターゲット効果ではなく、AT1Rの阻害によって媒介されることが示唆されていることに留意すべきである[56]。興味深いことに、同じ著者らは、膵臓がんのマウスモデルと患者の両方において、肥満は、脂肪細胞、脂肪細胞から分泌されたIL1βによってリクルートされた腫瘍関連好中球(TAN)、および膵臓星状細胞(PSC)の間の複雑なクロストークによって、腫瘍の脱落および膵臓がんの成長を促進すると報告した[58]。このようなシナリオにおいて、ロサルタンによるAT1Rの遮断は、肥満に起因する線維化や腫瘍の進行を抑制し、化学療法への反応を改善することが示された。さらに、この遮断は、膵臓がんの微小環境の免疫細胞にも影響を与え、腫瘍の免疫逃避を逆転させるのに有益な役割を果たすことが示唆された[58,59]。注目すべきは、CAFsの切除、または膵臓がんに対するより一般的な間質を標的としたアプローチは、矛盾した結果をもたらし、間質成分がいかに癌の進行を促進または妨げているかを強調していることである[155,159]。この点で、従来の化学放射線療法に加え、免疫療法や血管新生療法と併用する抗線維化剤としてのロサルタンは、腫瘍の転移リスクを増加させないと考えられることから、特に注目されている[155]。
癌細胞への化学療法のデリバリーを改善するロサルタンの効果は、ゲムシタビンのDNAへの取り込みと造影CTスキャン解析から得られた膵臓がん組織の輸送特性との相関性を目的とした、術中のゲムシタビンと1~3週間のロサルタン経口投与の臨床試験(NCT01276613)の副次的評価項目として検討されている。しかし、結果はゲムシタビン投与群についてのみ提供されている[160]。Liuらは、連続した794人の膵臓がん患者のコホートにおいて、アンジオテンシン阻害剤(AI)の慢性的な使用と生存率とをレトロスペクティブに相関させた[161]。多変量解析と傾向スコア解析により、AIの使用を前提とすると、アジュバント化学療法とは別に、非転移性患者の生存期間が有意に延長することが示唆された。これは、間質の正常化と抗腫瘍免疫反応の刺激によるものと思われる。このような背景から、局所進行膵臓がん患者49名を対象に、ロサルタンを併用したネオアジュバントFOLFIRINOXを8サイクル投与した後、化学放射線療法(CRT)を実施した第2相臨床試験が実施された[87]。本試験の主要評価項目は、陰性マージンでの切除率(R0)を評価することであった。非無作為化デザインと研究の規模が限られているため、ロサルタンの貢献度について結論を出すことはできないが、61%というR0切除率が観察されたことは勇気づけられる[87]。ロサルタンの役割については、多施設共同の第Ⅱ相試験で明らかになるだろう。この試験では、切除可能または境界切除可能な膵臓がんの患者が、最初にFOLFIRINOXを4サイクル投与される。奏効した場合や病勢が進行しなかった場合には、さらに4サイクルの治療を行い、毒性や病勢が進行した場合にはゲムシタビン/ナブパクリタキセルに切り替える。最後に、患者は手術前に短期または長期の化学放射線療法を受ける。ロサルタンは、治療期間中ずっと投与される(NCT04539808)。
2.10. メトホルミン
メトホルミンは、ビグアナイド系化合物(図1)で、前臨床の膵臓がんモデルでの抗がん作用が広く研究されており、直接作用と間接作用の両方があるとされている。中でも、がん細胞に対する直接的な作用は、呼吸器複合体Iの阻害によるミトコンドリアの酸化的リン酸化の阻害により、ATP産生量が減少することに起因すると考えられる[162]。これにより、AMP/ATP比が上昇し、AMPKシグナルが活性化され、結節性硬化症複合体2(TSC2)のリン酸化を介して哺乳類ラパマイシン標的(mTOR)を負に制御することで、タンパク質合成の低下と細胞増殖が誘導される[60,163,164,165]。メトホルミンは、間接的に膵臓がん細胞の成長に影響を与える可能性もある。特に、肝臓のエネルギー状態を低下させることで、糖新生を介した内因性グルコースの生成を減少させる[166]。その結果、グルコースの血中濃度が低下し、二次的にインスリン濃度が低下し、インスリン/インスリン様成長因子-1のシグナル伝達が低下する。これにより、PI3K/AktおよびRas/Raf/mitogen activated protein (MAP) kinase経路を介した下流のシグナル伝達の両方が減衰する [61,62,167,168]。しかし、このようなシグナル伝達経路に対する効果とは対照的に、メトホルミンは、患者由来の異種移植のマウスモデルにおいて、膵臓がんの成長を抑制することができなかったことに留意すべきである[169]。一方、メトホルミンの抗腫瘍効果は、CD8+ T細胞への直接作用[170]や発癌性マイクロRNAの阻害によっても媒介される可能性があることが示されている[171]。興味深いことに、メトホルミンは、さまざまな前臨床がんモデルにおいて、PD-L1/PD-1を介した免疫逃避を阻害することが示された[172]。
このような証拠と、膵臓癌患者に糖尿病が多いことから[173]、これらの患者に標準化学療法の補助としてメトホルミンを投与することが正当化された。過去10年間に、膵臓癌の糖尿病患者におけるメトホルミンの効果を評価するいくつかのレトロスペクティブコホート研究が発表されたが、結果はまちまちであった[174,175,176,177,178,179,180,181,182]。しかし、これらの研究では、異なるメタアナリシスで示されたように、膵臓がん患者の生存率に対するメトホルミンの全体的なプラス効果が示唆された[183,184,185]。
一方、3つの第2相試験(うち2つは無作為化試験)では、いずれもメトホルミンを前提としていない、あるいは非糖尿病の膵臓がん患者が登録されており、メトホルミンの有益な効果は示されなかった。Braghiroliらは、ゲムシタビン抵抗性の進行膵癌患者を対象に、メトホルミンとパクリタキセルの第II相、Simonの2ステージ試験を行った。この試験は、最初の20人の患者を登録した後、仮説としていた病勢コントロール率(DCR)を達成することができず、したがって、無益であるとして終了した[88]。Kordes氏らは、第II相無作為化プラセボ対照試験において、局所進行/転移性疾患の一次治療または二次治療としてゲムシタビンとエルロチニブにメトホルミンを追加した場合の効果を評価した[89]。この治療法が選択されたのは、メトホルミンとEGFR-チロシンキナーゼの阻害剤が相乗効果を発揮するという前臨床の証拠があったからである[186,187]。さらに、本試験で到達した血漿中のメトホルミン濃度は、同剤で治療を受けている糖尿病患者の血漿中濃度(約7μmol/L)と同程度であった。本試験では、6ヵ月間のOSの50%増加を検出するための検出力があり、少なくとも120名の患者の登録が必要であった。6ヵ月後のOSについては、両群間に有意差はなかった(プラセボ群:63.9%、メトホルミン群:56.7%)。グレード3~4の有害事象の発生率は両群間でほぼ同じであったが、メトホルミン(1,000mg、1日2回)の投与量がプラセボよりも減少し、投与サイクル数(中央値)も3サイクル対5サイクルと少なくなった。メトホルミンの血漿中濃度が高いほど生存率が向上したことから、著者らは、本試験で用いられた抗糖尿病薬の用量では、効率的なメトホルミンの細胞内濃度が得られないと主張した[89]。実際,メトホルミンの抗腫瘍効果を示したin vitroモデルの多くは,mmol/Lの範囲の超生理的な薬物濃度を用いているが,糖尿病患者の血漿濃度は通常µmol/Lの範囲であることに留意すべきである。
もうひとつの無作為化第II相試験は、転移性病変を有する患者を対象に、シスプラチン、エピルビシン、カペシタビン、ゲムシタビンの4剤併用療法(PEXG)にメトホルミンを追加投与し、その有効性を検証した非盲検試験である[90]。本試験の主要評価項目は、6ヵ月間のPFSの絶対値が20%(50%から70%)増加するかどうかを評価することであった。予定していた78名の患者のうち60名が登録された後の事前の中間解析では、メトホルミン群と対照群の間で6ヵ月PFSに差は認められなかった(42%対52%)。OS中央値は対照群で10.4カ月、6.8カ月、DCRは対照群で79.5%、メトホルミン群で64.5%であった。多変量Cox解析のPFSでは、メトホルミン群で進行リスクが有意に上昇していた(HR=2)。したがって、本試験は無益であるとして終了した。メトホルミンを投与された患者の予後が悪くなる傾向が認められたのは、この薬剤が活性酸素の発生を抑える能力を持ち、それが化学療法の効果に拮抗している可能性に関係しているかもしれない[188]。
報告されているランダム化試験の方法論的および臨床的限界は、メトホルミンの潜在的な有益性を覆い隠す要因として提唱されているが [189]、レトロスペクティブな観察研究の本質的な限界も無視できない。その中には、がんの病期、糖尿病の既往、メトホルミン使用の誤分類など、コホートの不均一性が示唆されている。時間に関連したバイアス、特にimmortal time bias [190]は、メトホルミン効果の過大評価につながる可能性がある[178,191]。実際、メトホルミンを仮定した時間を考慮した場合、観察研究[178,180,182]やメタアナリシス[192,193]の結果は、メトホルミンの優位性が明らかになるだけであることを示唆している。しかし、報告された無作為化試験の方法論的および臨床的な限界は、メトホルミンの利点を隠す可能性のある要因として提唱されている[189]。
2.11. ニトロキソリン
ニトロキソリンは、8-ヒドロキシキノリン(図1)に属する古くからある抗生物質で、尿路感染症の治療に用いられていたが、いくつかの腫瘍の異種移植モデルや遺伝子組み換えマウスモデルなどの前臨床がんモデルにおいて抗腫瘍活性を示すことで注目された[14,194,195,196,197]。最近、ニトロキソリンは、膵臓がんにも有効であることが判明した[42,63,198]。この薬剤は、細胞周期を変化させ、アポトーシスを促進することで、さまざまな膵臓がん細胞株の生存率に影響を与えることができた。さらに、試験した3つの膵臓がん細胞株の間では、その遺伝的背景の違いからか、効力に若干の差はあるものの、膵臓がん細胞の自己再生能力、移動、侵入を著しく阻害した[42,63,198]。驚くべきことに,ニトロソリンとHIVプロテアーゼ阻害剤であるネルフィナビルをエルロチニブの有無にかかわらず併用すると,膵臓がん細胞の生存率に対して用量依存的な相乗効果が得られ,単剤の場合と比較して,細胞周期が大きく乱れ,クローン生成能が劇的に低下し,より一貫してアポトーシスが促進された[42]。膵臓がん細胞におけるニトロキソリンの抗がん作用の可能なメカニズムを解明するために,プロテオミクスと機能解析に基づく統合的なアプローチが採用された[63]。その結果,ニトロキソリンは,これまでに知られていた,あるいは知られていなかった,膵臓がんにおける複数の重要な生物学的経路や発がん性タンパク質に影響を与え,抗がん作用を説明する役割を担っていることが明らかになった[14,63,194]。具体的には、ニトロソリンは、Na/K ATPaseポンプやβ-カテニン経路の調節を介して、活性酸素の生成を促進し、DNA損傷反応を誘導した。さらに,ニトロソリンは,細胞の生体エネルギーに関与する分子の調節を促進し,ミトコンドリアの脱分極と細胞質鉄の恒常性の障害をもたらした[63]。
膵臓がんに対するニトロキソリンの臨床研究はない。しかし、ニトロキソリンは、中国で筋層非浸潤性膀胱癌の治療を目的とした第2相臨床試験が承認されており(CTR20131716)、この試験の結果はまだ発表されていない[196]。
2.12. Pimavanserin
ピマバンセリンは,パーキンソン病精神病の治療薬として新たに承認された非定型の尿素系抗精神病薬(図1)である[199]。最近,RamachandranとSrivastavaは,膵臓がんにおけるピマバンセリンのin vitroおよびin vivoでの有望な抗腫瘍効果を報告した[64]。この薬剤は,ゲムシタビンに対して異なる感受性を持つ複数の膵臓がん細胞の生存率とクローン生成性に影響を与え,正常な膵臓上皮細胞と肺線維芽細胞には無視できる程度の影響を示した。これらの抗増殖作用は、アポトーシスの誘導とともに、膵臓癌の発癌機構としてよく知られているAkt/Gli1シグナルカスケードの阻害を介していた[200,201]。さらに、pimavanserinは、Oct-4、SOX2、NANOGを含むいくつかのGli1下流の癌幹細胞マーカーの発現を阻害し、PANC1腫瘍球のサイズと数を抑制した。In vivoでは、ピマバンセリンの経口投与により、皮下および同所性異種移植片の両方で腫瘍の成長が著しく低下したが、一般的な毒性の兆候やマウスの行動変化は見られず、この薬剤が膵臓がんに再利用される候補としての可能性が支持された[64]。
これまでのところ、膵臓がんにおけるピマバンセリンの臨床試験は報告されておらず、全体的に見て、がんにおけるこの薬剤に関する臨床試験は不足している。
2.13. ピルフェニドン
ピルフェニドンは、特発性肺線維症の治療薬として承認された経口活性のある合成2-ピリジノン(図1)である[202]。特筆すべきは,肺線維症や肝線維症のいくつかのin vitroおよびin vivoモデルにおいて,TGF-β,PDGF,I型コラーゲンの産生に影響を与えることで,線維化や脱落形成,さらには線維芽細胞の増殖を抑制する効果があることを証明したことである[203,204,205]。抗線維化作用を考慮して、ピルフェニドンは、膵臓がんを含む、デスモプラズムを頻繁に示す上皮性癌でも試験された[206,207]。デスモプラジアは、膵臓の星状細胞(PSC)の異常な活性化によるもので、正常な状態では膵臓の全細胞数の4-7%を占める。デスモプラジアの組織学的特徴としては、細胞外マトリックスの過剰産生、PSCの広範な増殖、α-平滑筋アクチン(SMA)を発現する筋線維芽細胞様の細胞への変化、少数の免疫細胞、内皮細胞、神経、マトリックスタンパク質などが挙げられる。デスモプラズムは、癌の進行を促進し、効果的なドラッグデリバリーを低下させる。
ピルフェニドンは,PSCおよび異なるヒト膵臓がん細胞において,細胞増殖を抑制し,G0/G1細胞周期停止を誘導することが示された[65]。ピルフェニドン処理した膵臓がんではp21の発現が増加したが、CDK2の発現は増加せず、有意なアポトーシスは見られなかった[65]。別の研究では、ピルフェニドンがPSCおよび膵臓がん細胞に対して用量依存的な抗増殖効果を示すことが一貫して示されたが、低用量で使用した場合、膵臓がん細胞よりもPSCに対してより強い抑制効果を示した[66]。さらに,この薬剤はPSCの浸潤と移動を有意に減少させた。興味深いことに,ピルフェニドンで処理したPSCは,膵臓がん細胞の増殖,浸潤,移動を促進しなかった。これは,PSC細胞における血小板由来成長因子A(PDGF-A),肝細胞成長因子(HGF),ペリオスチン,I型コラーゲン,フィブロネクチンの産生が抑制されたためである[66]。In vivoでは、ピルフェニドンは、腫瘍と間質の相互作用を破壊することで、膵臓がんの成長と転移を抑制することができた[66]。特に、ペリオスチン(骨芽細胞特異的因子2)は、コラーゲンの線維化を制御し、Wntシグナルを活性化し、癌幹細胞や転移をサポートする[208]。このタンパク質は、膵臓がんで過剰に発現しており、予後の悪化と関連している[66]。SUIT-2膵臓がん細胞とPSCを共移植したマウスでは,SUIT-2細胞のみを移植した場合に比べて,シリウスレッド陽性領域が大きく,α-SMA陽性細胞が多い,顕著なデスモプラズムが認められた。ピルフェニドンは,SUIT-2細胞とPSCを共移植した腫瘍では,成長,膵臓がんNA指数,シリウスレッド陽性領域,α-SMA陽性細胞を有意に減少させたが,SUIT-2細胞単独の腫瘍では減少しなかった[66].さらに、ピルフェニドンは、HapT1由来の同所性ハムスター膵臓がんモデルにおいて、デスモプラティック反応および腫瘍の成長を阻害し、α-SMA陽性細胞数、コラーゲン沈着、および増殖細胞数(Ki67減少)を減少させたことが報告されている[67]。抗炎症性の腫瘍関連マクロファージ(TAM)から放出される細胞外小胞(EV)は,ERKとβ-カテニンの活性化を介してゲムシタビンに対する膵臓がんの感受性を低下させる[209]。マクロファージ由来のEVの最も豊富なタンパク質の中に,キチナーゼ3-ライク-1 (CHI3L1) とフィブロネクチン (FN1) が検出された[68]。特に、これらのタンパク質は、マクロファージが多く存在し、薬剤耐性や患者の生存率の低下を伴う膵臓がんサンプルの間質で検出された。ピルフェニドンは、膵臓がん細胞のCHI3L1とFN1を阻害し、ゲムシタビンに対する抵抗性を部分的に回復させた[68]。ピルフェニドンとゲムシタビンを統合したβ-シクロデキストリン(β-CD)修飾マトリックスメタロプロテアーゼ-2(MMP-2)応答性リポソーム(LRC-GEM-PFD)およびマトリックスメタロプロテアーゼ-2(MMP-2)応答性ペプチドハイブリッドリポソーム(MRPL)-ピルフェニドン複合体は,膵臓がん微小環境への薬剤の浸透性を高め,ゲムシタビンの灌流を改善するために合成されたものである。LRC-GEM-PFDは、PSCのコラーゲンIとTGF-βをダウンレギュレートし、間質の線維化を減少させ、薬剤の灌流を増加させ、腫瘍の成長を抑制した[69,70]。さらに、pirfenidone/gemcitabineの中空メソポーラス有機シリカナノ粒子(HMON)複合体は、SW1990 膵臓がん細胞のアポトーシスを助長し、ECMのコラーゲンIとフィブロネクチン成分を減少させることで、良好な浸透性を示し、ゲムシタビンの放出と細胞毒性を改善した[71]。In vivoでは、この複合体はECMのコラーゲンIとフィブロネクチン成分をダウンレギュレートし、アポトーシスと血管内浸透圧を増加させ、SW1990/PSC腫瘍ベアリングマウスの腫瘍の成長を抑え、生存期間を延長した[71]。
膵臓がん患者を対象としたピルフェニドンの臨床試験は報告されていない。注目すべきは、神経線維腫症1型の患者を対象とした2つの第2相試験が終了し、わずかな活性を示したことである[210,211]。
2.14. プロプラノロール
敏感な神経系と自律神経系の両方が膵臓を支配しており、免疫系やストレス反応を調節したり、神経の侵入を誘導したりすることで、膵臓がんの発症と進行において極めて重要な役割を果たしている[212,213,214]。膵臓がんに共通する特徴は、「神経周囲への浸潤」であり、これは、「神経新生」、自律神経系による腫瘍への豊富な浸潤、高い神経密度、顕著な神経肥大、およびノルエピネフリンの過剰発現と関連している[215,216]。注目すべきは、膵臓がんのマウスでは、正常な膵臓と比較して、神経面積が30倍に増加していることである[72]。膵臓がん患者では、71-100%が癌細胞による膵臓内および膵臓外の神経周囲への浸潤を示し、これは患者の生存に大きな影響を与える[217]。また、膵臓がんや腫瘍細胞の局所微小環境は、神経成長因子(NGF)や脳由来神経栄養因子(BDNF)などの神経栄養因子(NT)を分泌することで神経の成長を促し、軸索誘導やシナプス可塑性を媒介し、神経を傷害から守り、腫瘍細胞の浸潤を増強する[216,218]。特に、交感神経系の有病率、カテコールアミン濃度の上昇、または副交感神経活動の低下は、膵臓がんの成長と進行を刺激する[219]。一方、交感神経の活動が低下したり、副交感神経の緊張が高まったりすると、保護効果が得られる[219]。注目すべきは、慢性的なストレスと急性のストレスの両方が、交感神経系の活性化を引き起こすことである。この点に関して、膵臓がん患者の心理的ストレスレベルは、すべての種類のがんの中で最も高いという結果が出ている[220]。ストレス反応は、内因性カテコールアミン(ノルエピネフリンおよびエピネフリン)の放出と、Gタンパク質共役型受容体のスーパーファミリーに属するBアドレナリン受容体(B1およびB2)のアップレギュレーションによって調節される。
このようなシナリオにおいて,非選択的なB2/B1アドレナリン拮抗薬であるプロプラノロール(図1)は,膵臓がんの前臨床モデルや患者においても有益な効果を示すことが示された[72,73,74,75]。原理的には、cAMP/PKA経路のみを阻害する選択的なBBに比べて、非選択的なβ遮断薬(BB)は、cAMP/PKA経路とRas経路の両方を阻害する能力があるため、がんの進行を抑制する効果が大きい可能性があることに留意すべきである[73,74]。Zhangらは、プロプラノロールが、アポトーシスを誘導し、核内因子κB(NF-1)、activator protein 1(AP-1)、cAMP response element binding protein(CREB)などの浸潤の原因となる因子の発現や、MMP-9、MMP-2、血管内皮増殖因子(VEGF)の標的遺伝子の発現を抑制することで、in vitroおよびin vivoで膵臓がん細胞の増殖および浸潤を抑制することができると報告している[73,74]。興味深いことに、Parteckeらは、慢性的なストレスと活性化されたβアドレナリン受容体のシグナル伝達が、臨床的に適切な免疫不全の同所性シンジェニックマウスの膵臓がんモデルに与える影響を明らかにした[75]。慢性ストレスを受けたマウスでは,MMP2/MMP9の発現が亢進し,ストレスマーカーであるステロイドやカテコールアミンの産生に重要な酵素である副腎チロシン水酸化酵素が誘導され,免疫応答が抑制され,CD4が減少し,腫瘍内Tregsが増加する傾向が見られ,腫瘍の増殖と生存率の低下が認められた。プロプラノロールは、上述の作用を打ち消すことで、ストレスによる腫瘍の成長を抑制し、慢性的にストレスを受けたマウスの生存期間を延長した[75]。同様に、LiとXuは、プロプラノロールがFrizzled-1 (Fz1)、Wnt-1およびvimentinタンパク質の発現を減少させることによって、膵臓がん異種移植動物モデルの腫瘍成長に対する恐怖ストレスの影響をブロックすることを示した[76]。また,Bernhard W. Renzらは,K膵臓がん膵臓癌モデル動物の膵臓の交感神経切除(ガングリオン切除)とゲムシタビンの併用により,マウスの生存率が有意に改善したことを示し,局所的に投与されたカテコールアミンが癌の成長に寄与しているという考えを支持した[72]。同様に、プロプラノロールは、3つのヒト初代膵臓がんオルガノイドの生存率を低下させ、特にゲムシタビンと併用した場合には、膵臓がんにおけるβ-アドレナリンシグナルと神経-癌の相互作用の関連性が支持された[72]。さらに、β2アドレナリン受容体(ADRB2)を遮断することで、腫瘍の成長、浸潤、がんに関連する免疫抑制を抑制し、K膵臓がんマウスの生存期間を延長した。実際、これらの遺伝子操作された膵臓がんマウスモデルではADRB2が著しく亢進しており、それによってNGFとBDNFの産生が増加し、NGF/Trk経路が刺激され、膵臓神経密度が向上している[72]。Al-Wadeiらによるさらなる研究では,プロプラノロールが膵臓がんを予防することが示された。Al-Wadeiらの研究では,プロプラノロールが,β-アドレナリンアゴニストであるニコチン由来ニトロサミン(NNK)によるエタノール誘発性膵炎のハムスターにおける膵臓がんの発達を,cAMP依存性のEGFおよびVEGFの放出の遮断,α7ニコチン性アセチルコリン受容体(α7nAChR)のダウンレギュレーション,細胞外シグナル制御プロテインキナーゼ(ERK1/2)およびp-CREBを含むメカニズムによって予防することが示された[77]。さらに、ステージII/IIIの膵臓腺がん患者のコホートにおいて、BBの影響をレトロスペクティブに分析した。これらの患者は、手術を受け、プロプラノロールを含む非選択的なBBを投与されていたが、BBを投与されていない患者や選択的なB1Bを投与されている患者と比較して、腫瘍内のS-100+構造の減少(神経密度の低下)、BDNFの染色の減少、神経周囲への浸潤/神経の低下傾向、および生存率の向上が認められ、ADRB2遮断と膵臓がんの臨床転帰との間に相関関係があることが裏付けられた[72]。
PROSPER試験は、現在進行中の第2相無作為化試験で、切除可能な膵臓がん患者を対象に、プロプラノロールとエトドラクの組み合わせを周術期に合計25日間使用した場合の評価を行う。本試験の主要評価項目は、この方法の安全性と実現可能性である。副次的な目的として、本試験では、生存率の向上における2つの薬剤の有用性を評価する。本試験には、併用療法の作用機序を評価するトランスレーショナルセクションが付随している[91]。
3. 再治療薬候補の分子標的。インシリコ解析からのヒント
表1にまとめたように、再治療薬は、がん細胞と腫瘍微小環境の構成要素の両方において、膵臓がんの生物学に関与する複数の分子標的に影響を与える大きな可能性を持っているこれらの薬剤は、標準的な化学療法に対する後天的な耐性の原因となる、代謝のリプログラミング、免疫系の変化、がん幹細胞経路の活性化を調節することができる。実際、すでに検証されているターゲットに加えて、他のターゲットが再創薬候補の抗腫瘍効果に重要な役割を果たしている可能性も考えられる。この総説で取り上げた生物活性小分子の可能性をさらに見極めるために、一般に公開されているウェブツールSwissTargetPredictionを用いて行った探索的分析によると、抗がん剤として重要な役割を果たす可能性のある、未開拓のがん関連ターゲットがさらに存在することが示唆された。ターゲット・フィッシングとも呼ばれるこのバイオインフォマティクスのアプローチでは,計算された記述子にしたがって,これらの薬剤の化学構造に関する重要な情報を評価することができる[221]。さらに,このツールを用いることで,再利用された薬剤のより広範な多薬理学的プロファイルを評価し,副作用を予測することができる。具体的には,本レビューで紹介した再利用薬の既知および代替の標的を,高性能なインシリコ予測と類似性の原理に基づいて解明した。表3では,各再医薬化薬について,0.6以上の確率で予測される主なヒト標的を報告している。確率スコアは、ソフトウェアによって直接提供され、計算される。1の値は100%の確率に相当し,0.6以上の値は60%以上の確率スコアに相当する.ここで示した閾値は,ソフトウェアによって計算されるターゲットの数を制限するために選ばれたものである.従って、有用な薬理学的評価を提案するために、より信頼性の高い情報を提供するために、スコアが0.6未満のターゲットは除外した。ほとんどの化合物で、高い確率の結果が得られたことは注目に値する。予測された標的は、がんの生物学に関与している場合もあれば、そうでない場合もあり、また、興味深いことに、それらのうちのいくつかは、がん治療に関連する潜在的なオフターゲットとして考えられる可能性もある。今後の研究では、再利用された薬剤と予測された膵臓がんの新規ターゲットとの間で、本ツールが提案する可能性のある相互作用を検証する必要がある。
表3 SwissTargetPredictionツールによる各再処方薬の予測分子標的とプロバビリティスコア(≧0.6)
| 再利用された薬 | 予測されるターゲット(確率スコア) |
|---|---|
| オーラノフィン | — |
| ハロペリドール | 5-HT2b受容体(1)、ドーパミンD5受容体(1)、アルファ-2aアドレナリン受容体(1)、アドレナリン受容体アルファ-2(1)、ヒスタミンH2受容体(1)、アルファ-2bアドレナリン受容体(1)、ムスカリンアセチルコリン受容体M5(1)、ドーパミンD1受容体(1)、ムスカリン性アセチルコリン受容体M2(1)、セロトニン1a(5-HT1a)受容体(1)、ムスカリン性アセチルコリン受容体M1(1)、ドーパミンD2受容体(1)、ドーパミンD4受容体(1)、ノルエピネフリントランスポーター(1)、Alpha-1dアドレナリン受容体(1)、セロトニン2a(5-HT2a)受容体(1)、セロトニン2c(5-HT2c)受容体(1)、セロトニントランスポーター(1) 、Alpha-1aアドレナリン受容体(1)、ヒスタミンH1受容体(1)、カリウムチャネルサブファミリーKメンバー2(1)、Muオピオイド受容体(1)、ドーパミンD3受容体(1)、HERG(1)、シグマオピオイド受容体( 1)、セロトニン7(5-HT7)受容体(1)、セロトニン6(5-HT6)受容体(1)、Histone H1.0(1)、P糖タンパク質1(1)、抗エストロゲン結合部位(AEBS)(1) |
| ペンフルリドール | — |
| パルベンダゾール | — |
| ジスルフィラム | アルファ-2aアドレナリン受容体(1)、アルファ-2bアドレナリン受容体(1)、ドーパミンD1受容体(1)、ドーパミンD2受容体(1)、ドーパミンD4受容体(1)、ミューオピオイド受容体(1)、ドーパミンD3受容体( 1)、カッパオピオイド受容体(1)、ドーパミントランスポーター(1)、CCケモカイン受容体タイプ4(1)、インターロイキン-8受容体B(1)、アデノシンA3受容体(1)、チトクロームP450 1A2(1)、セロトニン6 (5-HT6)受容体(1)、MAPキナーゼERK1(1)、CCケモカイン受容体2型(1)、モノグリセリドリパーゼ(1)、セロトニン1b(5-HT1b)受容体(1) |
| ドキシサイクリン | — |
| エファビレンツ | — |
| ネルフィナビル | ニューロキニン2受容体(0.97)、Muオピオイド受容体(0.97)、チロシンプロテインキナーゼFYN(0.74)、ドーパミンD1受容体(0.74)、ノルエピネフリントランスポーター(0.74)、アデノシンA3受容体(0.74)、チトクロームP450 3A4(0.74) |
| リトナビル | シトクロムP4503A4(0.64)、ニューロキニン2受容体(0.62) |
| クロロキン | HERG(1)、キノンレダクターゼ2(1)、プリオンタンパク質(1)、ヒスタミンN-メチルトランスフェラーゼ(0.67)、ヒスタミンH3受容体(0.67) |
| ヒドロキシクロロキン | ムスカリン性アセチルコリン受容体M2(1)、アルファ-1dアドレナリン受容体(1) |
| イトラコナゾール | — |
| ロサルタン | タイプ1アンジオテンシンII受容体(1)、アンジオテンシン変換酵素(0.91)、シトクロムP450 2C9(0.91) |
| メトホルミン | — |
| ニトロキソリン | シクロオキシゲナーゼ-2(1)、メチオニンアミノペプチダーゼ2(1) |
| ピマバンセリン | — |
| ピルフェニドン | — |
| プロプラノロール | セロトニン2b(5-HT2b)受容体(1)、セロトニン1b(5-HT1b)受容体(1)、アドレナリン作動性受容体ベータ(1)、ベータ-1アドレナリン受容体(1)、セロトニン1a(5-HT1a)受容体(1 )、セロトニン2a(5-HT2a)受容体(1)、セロトニン2c(5-HT2c)受容体(1)、セロトニントランスポーター(1)、ベータ3アドレナリン受容体(1)、シグマオピオイド受容体(1)、チトクロームP450 2D6(1)、チトクロームP450 1A2(1)、セロトニン6(5-HT6)受容体(1) |
(-)はSwissTargetPredictionツールで予測された分子標的の確率スコアが0.6未満であることを示す。
4. 再利用可能な医薬品候補化合物の免疫調整能
最近注目されている研究分野は、再利用医薬品候補の免疫調整能である。免疫チェックポイント阻害など、抗腫瘍性免疫反応の活性化に基づく治療戦略は、一部の反応性腫瘍において顕著な長期寛解を達成しているが、これらの治療法に反応する進行性腫瘍患者はごく一部に過ぎないと言われている。膵臓がんは特にこれらの治療法に反応しないため、膵臓がん患者やその他のこれらの治療法に抵抗性の患者において、腫瘍細胞を免疫調整療法に感作できる薬剤が強く求められている。この総説で報告されているように、クロロキン、メトホルミン、ロサルタン、プロプラノロールなどの膵臓がんの再利用薬候補は、抗腫瘍免疫反応に有益な効果があると思われる。これらの薬剤は、それぞれ異なるメカニズムで作用する。クロロキンによるオートファジーの阻害、あるいは遺伝学的アプローチは、膵臓がん細胞表面での主要組織適合性複合体(MHC)クラスIの発現を回復させ、膵臓がんの免疫逃避の主要なメカニズムの1つを元に戻すのに有効であることが示された[50]。実際,膵臓がん細胞では,MHC-I分子のほとんどがオートファゴソームに封じ込められており,これがT細胞による腫瘍抗原の認識を妨げ,膵臓がん細胞の免疫逃避に寄与していることが明らかになった[50]。膵臓がんのマウスモデルにおいて、クロロキンによるオートファジーの阻害は、抗CTL4および抗PD-1を含むデュアル免疫チェックポイントブロック(ICB)療法に対する抗腫瘍効果を増強したが、併用療法では腫瘍の成長を遅らせることはできたものの、完全な腫瘍の根絶には至らなかった[50]。さらに、クロロキンとICBを投与した腫瘍では、細胞傷害性T細胞の浸潤が増加しており、オートファジーが膵臓がん細胞の免疫原性を調節する重要な因子であるという考えが支持された。クロロキンと同様に、メトホルミンもまた、前臨床モデルにおいて、免疫チェックポイントブロック(ICB)療法に対する反応性を高める[172]。特に、メトホルミンによって活性化されたAMPKは、in vitroおよびin vivoのさまざまな腫瘍モデルにおいて、PD-L1の小胞体関連分解を介してPD-L1/PD-1シグナル伝達経路を抑制するのに有効であると考えられている[172]。メラノーマ、乳癌、大腸癌において、メトホルミンは抗CTLA4治療との併用で相乗効果を発揮した[172]。膵臓がんにおけるメトホルミンの免疫調節効果は知られておらず、この免疫原性の低い腫瘍の新たな研究分野になるかもしれない。ロサルタンによるAT1Rの遮断は、PSCの活性化とそれに伴うIL-1βの発現低下を防ぐことで、CD8+T細胞の増加とともに、膵臓がんのTMEにおけるTANと制御性T細胞(Tregs)を減少させることが示された[58]。同様に、ロサルタンは、膵臓がんの同所性モデルにおいて、異常なTGF-β活性を阻害し、コラーゲンの沈着を抑制し、Tregsを集積させることができた[59]。これらの知見は、ロサルタンが、典型的な免疫抑制的な膵臓がん微小環境を逆転させる可能性を示唆しており、さらなる調査が必要である。プロプラノロールは、メラノーママウスモデルの腫瘍間質において、骨髄系細胞(特に好中球)の浸潤を減少させ、細胞障害性腫瘍浸潤リンパ球を増加させ、細胞障害性細胞による腫瘍のより良い制御を回復させるのに有益である[222]。腫瘍浸潤免疫細胞に対するこれらの効果は、膵臓がんにおいてさらなる研究が必要である。
さらに、抗腫瘍免疫応答を改善する可能性のあるリパーパス薬の候補として、膵臓がんSK9欠失と同様に、高コレステロール血症の治療薬として臨床的に承認されている膵臓がんSK9中和抗体が、さまざまながんモデルマウスにおいて抗PD1療法と相乗効果を示すことが報告されている。膵臓がんSK9中和抗体は、MHC-Iタンパク質の腫瘍細胞表面へのリサイクルを促進することで、MHC-Iタンパク質の発現を増加させ、その結果、リソソームでの分解に対抗することができる[223]。膵臓がんSK9レベルが腫瘍内T細胞浸潤のマーカーおよび膵臓がん患者の生存率と逆相関していることを考慮すると、膵臓がんSK9中和抗体と免疫チェックポイントブロックの併用が膵臓がんにおいても有益であるかどうかを研究することは興味深いと思われる。
5. 最後に、今後の展望について
非がん治療薬をがん治療に再利用することは、有望かつ貴重な治療機会であり、特に進行した疾患や、膵臓がんのように代替治療法がない化学療法抵抗性の腫瘍を持つ患者には有効である。本レビューでは、前臨床試験および臨床試験において、さまざまな非がん治療薬が示す抗腫瘍効果について概説した。議論されているように、再利用された薬剤は、がん生物学において重要であることが知られている、あるいはこれまで知られていなかった複数の経路や分子標的を調節する大きな可能性を持っており、おそらく有効性が向上し、標準的な化学療法剤に対する耐性を克服することができる。さらに、再利用された薬剤候補を含む薬剤の組み合わせは、がんに関連する別の経路を調節することにより、個々の薬剤が示すものとは異なる抗腫瘍活性を示す新たな実体として作用する可能性がある。この可能性は、膵臓がん治療におけるより効果的な新しい戦略を模索する上で、重要な分野となるだろう。上述したように、もう一つのエキサイティングな研究分野は、再利用可能な薬剤候補の免疫調節能に関するものである。膵臓がんは、他の進行性腫瘍における最も効果的な治療戦略の1つである免疫療法アプローチに特に反応しにくい。クロロキン、メトホルミン、ロサルタン、プロプラノロールなどの再治療薬候補は、異なるメカニズムで抗腫瘍免疫反応に有益な効果をもたらすと考えられる。これらの薬剤の中には、前臨床モデルにおいて、免疫チェックポイント阻害剤を用いた治療に対する反応を高めることが示されたものもある。このことは、膵臓がんにおいて単剤ではほとんど効果のない、承認された抗がん剤である免疫調整剤との相乗効果により、臨床応用の可能性を広げる可能性があるため、特に重要だ。
抗がん剤として再利用できる非がん剤の限界の一つは、前臨床試験で抗腫瘍効果を得るために使用した用量に関連しており、本来の適応症に必要な用量を超えてしまう可能性がある。しかし、高用量を必要とするからといって、必ずしもその高用量がヒトで毒性を持つとは限らず、安全性評価のために対象となる集団での用量設定試験が必要となる。さらに、原理的に他の薬剤との併用療法は、抗腫瘍効果を得るために必要な用量を下げることができ、これにより各薬剤の元の用量を増やすという問題を回避できる可能性がある[224]。再利用医薬品候補が臨床現場で成功するために直面するその他の問題としては、法的責任や安全性、知的財産権、特許や規制の障壁、さらには、投資収益率が低いと予想されるため製薬会社が臨床試験機関に資金を提供しないことなどが挙げられるが、これらに限定されるものではない[11,19,225]。この点、再利用試験は、非営利団体、病院、学術団体などの非製薬企業によって管理されることが多く、これらの企業は、ラベル拡張のための厳しい規制の必要性についての知識が限られている可能性があり、このことが、有望な再利用医薬品候補の臨床現場での実施を複雑にしている可能性がある[11,19]。
結論として,薬剤の再利用は,腫瘍学において,特に膵臓癌のように成功した治療戦略がない腫瘍の場合には,検討する価値のある魅力的な選択肢である。この総説で述べたように,膵臓癌における再利用のための非腫瘍学的な薬剤候補がいくつかあり,そのうちのいくつかは現在,臨床試験が行われている。しかし,臨床応用の可能性を考えると,さらなる臨床試験が必要である。