2020年12月31日
pubmed.ncbi.nlm.nih.gov/33390561/
イネス・エルビーニ・ドゥイブ1,2,*
1 チュニジア、チュニス、チュニスのパスツール研究所、バイオモレキュール・ヴェニン応用研究所。
2 チュニス・エルマナル大学、チュニス、チュニジア
要約
2019年に中国の武漢で新規コロナウイルス、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)が同定された。臨床的には、コロナウイルス疾患2019(COVID-19)と陽性診断された患者では、呼吸器症状だけでなく、他の臓器障害も認められる。また、多くの患者で無呼吸、老衰、頭痛を中心とした神経症状が観察された。中枢神経系(CNS)に一旦入ると、SARS-CoV-2は、静穏潜伏状態のいずれかに常駐するか、または最終的には神経炎症および神経免疫活性化の長期化を特徴とする重度の急性脳炎につながる活発な状態に常駐することができる。SRAS-CoV-2は、細胞侵入受容体としてアンジオテンシン変換酵素2(ACE2)を必要とする。血液脳関門(BBB)の内皮細胞におけるこの受容体の発現は、SRAS-CoV-2が既知のコロナウイルスと比較して、より高い神経浸潤性を有する可能性があることを示している。本レビューでは、SRAS-CoV-2の脳への影響に関する利用可能な情報を要約し、その神経浸潤の潜在的な経路を特定する傾向がある。また、潜伏型のSARS-CoV-2が神経変性疾患の発症に及ぼす長期的な影響についても理解を深めることができた。結論として、SRAS-CoV-2の脳内持続感染は、数十年に渡って緩やかに進化するヒトの神経変性疾患に関与している可能性があると考えられる。
キーワード SRAS-CoV-2,神経トロピズム、神経侵入、神経変性疾患
1. 序論
コロナウイルス(CoV)は、ニドウイルス目コロナウイルス科コロナウイルス属(Coronvirinae)に属する陽性センスRNAウイルスである(1)。このファミリーは、アルファ、ベータ、ガンマ、デルタの4つのサブグループに分類される。アルファ、ベータのコロナウイルスは哺乳類のみに感染し、通常、ヒトでは呼吸器症状を、動物では胃腸炎を引き起こす(2)。ヒトに病気を引き起こすCoVはすべてコウモリなどの動物起源のものがある(3)。現在、ヒトに感染する可能性のあるCoVは7種類ある。HCoV-229E、HCoV-NL63,HCoV-HKU1,HCoV-OC43,MERS-CoV、SARS-CoV-1,SARS-CoV-2の7つのCoVがある(4)。これらのCoVのうち、HCoV-NL63,HCoV-229E、HCoV-OC43,HKU1の4つのCoVは通常、インフルエンザ症状を引き起こし、過去20年間にパンデミックを引き起こしている(5,6)が、SARS-CoV-1以外のHCoV-229EとHCoV-OC43は神経細胞に感染することが示されている(6)。
SARS-CoV-1と高度に相同性の高い配列を共有するSARS-CoV-2は、現在のCOVID-19発生の原因となっており、7000万人以上の患者が診断され、161万2000人以上が死亡している。これらの統計は 2002年のSARS-CoV-1と2012年のMERS-CoVの合計をそれぞれ上回っている(5)。
CoVは、その表面にある王冠のようなトゲがあることからその名が付けられた。CoVは宿主細胞へのアクセスを得るために、スパイクタンパク質(S)に依存する。S1には、宿主細胞の受容体に結合する受容体結合ドメイン(RBD)が含まれている。SARS-CoV-2もまた、可変RBDを含むスパイクタンパク質で覆われている。RBDは、すべての組織で発現しているアンジオテンシン変換酵素2(ACE2)受容体に結合し、最も活性が高いのは回腸および腎臓で、次いで心臓、脳、肺、血管、胃、肝臓である(7,8)。
SのACE2受容体への結合は、標的とする組織におけるウイルス感染性と相関し、臨床結果を左右する(9)。例えば、SARS-CoV-2の肺のII型肺細胞のACE2受容体への結合は、下気道の炎症のカスケードを誘発する(5)。実際、COVID-19患者の98%がパンデミックの第一波で低酸素性呼吸不全を伴う臨床肺炎を発症した(1,5)。その結果、この感染症は呼吸機能だけでなく、心血管の恒常性をも変化させると臨床家は結論づけている(10)。
現在のパンデミックのパンデミック期間が短いにもかかわらず、頭痛、無感覚、老衰(11,12)を含むいくつかの神経学的および神経放射線学的表現型が報告されており、その後、筋肉の痛み、意識の変化が続く。SRAS-CoV-2の神経トロピズムに関するデータが少ないことから、他のCoVとの類似性を踏まえて、その特徴をより深く理解することを試みる。実際、SARS-CoV-2と他のベータコロナウイルスとの構造的類似性を考慮すると、すべてのCoVが同様の神経侵襲性および神経栄養作用を有することが強く疑われる。実際、SARS-CoV-1とSARS-CoV-2は、エネルギーとダイナミクスのバランスをとることにより、同等の結合親和性を有している(13,14)。
神経浸潤の原因となる病態の解明はこれからであるが、SARS-CoV-2が神経栄養性を有するかどうか、また感染後の神経変性疾患に寄与するかどうかという疑問に答えることが急務となっている。
2. 神経学的発現
COVID-19患者の神経学的症状に関する情報はまだ少ない。しかし、SRAS-CoV-2が脳内に侵入して神経疾患を誘発することはよく知られている。このようなCoVの神経侵襲性は、SARS-CoV-1,MERS-CoV、HCoV-229E、HCoV-OC43,マウス肝炎ウイルス(MHV)、およびブタ脳筋炎コロナウイルス(HEV)については、ほとんどの場合、よく報告されている(15)。
SRAS-CoV-2ウイルス感染後の神経疾患に関する最初の研究は 2020年3月中に報告された。実際、中国の北京大丹病院の研究者は、遺伝子配列決定により脳脊髄液(脳脊髄液)がSRAS-CoV-2に陽性と判定されたCOVID-19の患者を記載し、確認した(16)。別の研究では、中国でCOVID-19と診断された214人の患者を評価したが、そのうち36%に急性脳血管障害や意識障害を含む神経学的症状が認められた(17)。フランスからの最近の研究では、COVID-19患者64人中58人に脳症、顕著な動揺、錯乱を含む神経学的問題が報告されている(18)。COVID-19の臨床例で最も一般的な神経学的症状は、頭痛、無神経症、および老年期障害である。興味深いことに、これら3つの神経学的症状は疾患の早期に発現しており、臨床障害の予測因子と考えられる。また、脳卒中、意識障害、脳症などの神経学的所見も示された。以上のことから,SARS-CoV-2の神経浸潤と神経トロピズムの可能性が示唆された。
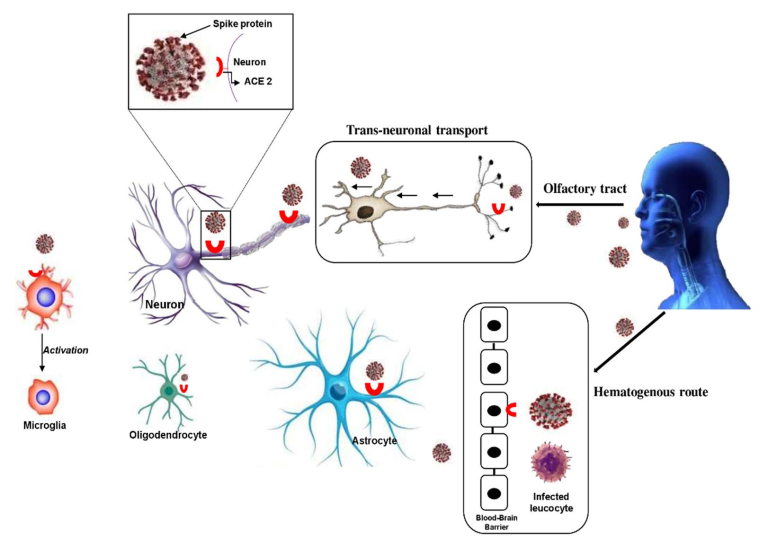
図1. SARS-CoV-2 の神経侵入経路。SARS-CoV-2が脳に侵入する最も具体的な経路
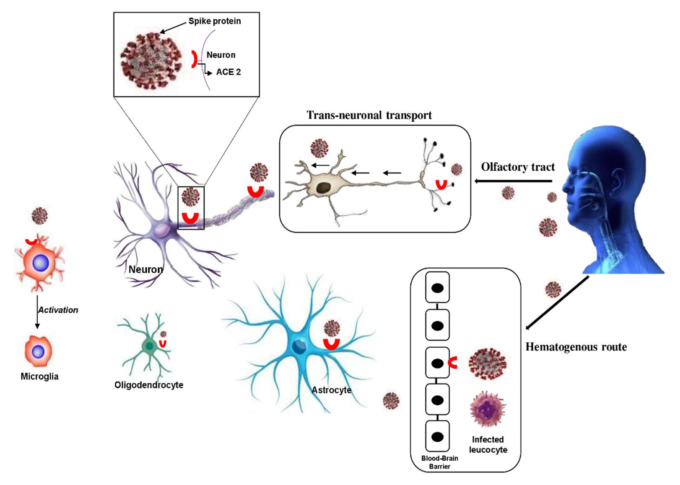
(i) 血液脳関門(BBB)を経由した血行性ルートでは、SARS-CoV-2はBBBの神経血管ユニットに直接感染する。したがって、感染した遊走白血球はBBBを渡り、局所の神経細胞に感染するために解放される。
(ii) 神経細胞を経由した経路。SARS-CoV-2は、嗅覚受容体を含む末梢神経線維、肺ネットワーク、腸管神経系を介して神経系に侵入する可能性がある。ACE2:アンジオテンシン変換酵素2。
3. SARS-CoV-2の神経浸潤
以下のセクションでは、2つの特徴を明らかにしていく。(i)SARS-CoV-2感染後、特定の患者がどのようにして神経疾患を発症するのか、(ii)ウイルスが神経細胞に直接作用するのか間接的に作用するのか、の2点である。
SARS-CoV-2の中枢神経系への侵入経路については、BBBの存在はあるものの、血行性の経路がウイルスの脳への侵入経路である可能性が高いと考えられる。また、神経細胞経路も神経刺激性ウイルスが脳に侵入するための重要な経路であることが報告されている。SARS-CoV-2は、嗅球に近接した篩骨の篩状板を横切ることができる(11,19,20)。実際、SARS-CoV-2は、まず末梢神経末端に侵入し、その後、逆行性または前向性輸送の方法でシナプス接続ルートを介して中枢神経系にアクセスする可能性がある。また、BBBを介した白血球の移動もウイルスの神経侵入経路として考えられる(21)。以下では、SARS-CoV-2の神経侵入経路を図1にまとめた。
3.1. 血液脳関門からの感染
血液脳関門は、中枢神経系の恒常性維持に重要な高度に選択的な関門である。BBBは末梢の血液-脳間交換を制御し、毒素や病原体が中枢神経系に侵入するのを防ぐ。BBBの機能的および構造的完全性は、主に脳の毛細血管を覆う脳微小血管内皮細胞(BMEC)の特定の特徴に依存している。これらの細胞は、接着剤と密結合複合体の集合体によって緊密に接続されている(22)。アストロサイト、ペリサイト、内皮細胞で構成されるBBBの複雑な構造にもかかわらず、ニューロウイルスはBBBを破壊し、それを回避するために進化してきた(23)。SARS-CoV-2がBBBを介して拡散するメカニズムとしては、2つの可能性が考えられる。
- (i)第一のメカニズムはBMECsの感染によるものであり
- (ii)第二のメカニズムはBBBを通過する白血球の感染によるものである。
したがって、SRAS-CoV-2神経病因の特徴はBBBの破壊であると考えられる。
SRAS-CoV-2ウイルスは、神経血管ユニットに感染したり、細胞損傷を誘発したり、あるいは神経炎症につながる自然免疫応答や適応免疫応答を誘発したりすることで、BBBの完全性を損なう可能性がある(24)。SRAS-CoV-2によるBBB侵襲は、BMECのタイトジャンクションのウイルス誘発による破壊と相関し、BBB機能障害と透過性の亢進をもたらす。実際、BMECはACE2受容体を発現しているため、MHVなどのCoVsウイルスの潜在的な細胞標的としてすでに報告されている(25)。SRAS-CoV-2のSタンパク質はBMEC細胞表面でACE2と相互作用し、内皮細胞に感染し、ウイルスの中枢神経系への侵入を促進することができるが、BBBを阻害することはないと考えられる。BBBの障害は、タイトジャンクションタンパク質の分解とMMPsの増加を伴って、後に観察されることができるが(25)。この仮説は、BMECsにおけるSRAS-CoV-2のウイルス複製に関するデータから確認することができる。一方、日本脳炎ウイルス(JEV)(27)西ナイルウイルス(WNV)(28)ヒト免疫不全ウイルス1型(HIV-1)(29)などの神経向性ウイルスによるBBB破壊では、タイトジャンクションタンパクの発現低下が特徴的である。実際、これらのウイルスはタイトジャンクションmRNAの転写レベルの低下を誘導した(30)。
タイトジャンクション複合体の破壊は、しばしば活性酸素種(ROS)の生成の亢進と関連している。標的細胞にウイルスが感染すると、ミトコンドリアの損傷やNADPHオキシダーゼの活性化を誘発し、結果的に高活性酸素の発生(31 )を引き起こし、有害な影響をもたらす(32)。実際、活性酸素は脂質、タンパク質、核酸を含むすべての生物学的分子を標的とすることができ、その結果、様々なサイトカインやプロテアーゼが放出され、BBBの血管系にダメージを与えることになる(31)。また、アストロサイトは酸化ストレスを受けやすい(33)。このことは、HIV-1のようなウイルス性タンパク質への曝露がアストロサイトの酸化還元ストレスに対する感受性を高めることを示したMasanetzとLehmannによって確認されている(34)。
一方、SARS-CoV-1は、ACE2を発現するリンパ球、顆粒球、単球に感染することが示されている(35,36)。感染した白血球は、トロイの木馬のようなダイアペシスを介してBBBを阻害する(37,38)。しかし、Tリンパ球はSARS-CoV-2の感染を可能にするが、ウイルスの複製をサポートしないことが実証されている(19,26)。
したがって、COVID-19の特徴である全身の炎症はBBBの透過性を高め、感染した免疫細胞やサイトカイン、ウイルスが中枢神経系に侵入し、神経細胞やグリア上のACE2と相互作用することを可能にしている(39)。このように、BBBは免疫細胞やウイルスの中枢神経系へのアクセスを制御することで、神経向性ウイルスの発症に重要な役割を果たしている。一旦、ウイルスが神経細胞組織へのアクセスを獲得すると、ウイルスの出芽のサイクルを開始し、神経細胞組織をさらに損傷させる可能性がある。
3.2. ウイルスの神経細胞間伝播を介した感染
臨床研究によると、CoVsの神経侵入は、(i)感染したニューロンを介した経シナプス伝達、および(ii)嗅神経を介した侵入によって達成される可能性が高いと考えられる。
嗅覚系は、ヒトウイルスの中枢神経系への侵入経路としてよく知られており、脳の大脳辺縁構造に接続されているため、ウイルスが中枢神経系に感染する可能性がある。嗅覚伝達によって中枢神経系に急速に伝播する神経向性ウイルスとしては、Theiler’s murine encephalomyelelitis virusやWNVなどが知られている(28,40)。
最近の報告では、鼻腔がSARS-CoV-2の侵入口となっていることが報告されている(19,21)。特に、嗅覚上皮(OE)は、SARS-CoV-2の早期検出に適した生物学的サンプルの供給源である。嗅覚上皮は、神経細胞と非神経細胞の両方を含む連続的に再生する組織である。したがって、嗅覚管は、SARS-CoV-2が脳に伝達されるための重要なチャネルとなる。
一方、CoVは、エンドサイトーシスまたはエキソサイトーシス機構を利用した経シナプス伝達を介して逆行性に伝播すること、およびビヒクルウイルスから神経細胞体への小胞輸送の高速軸索輸送機構を利用して伝播することが示されている(19)。例えば、HIVおよびHCoV-OC43はいずれも、逆行性の高速軸索輸送を用いて神経細胞に感染することが示されている(41)。ここでは、ACE2のニューロン発現は、樹状突起およびソーマへの取り込みを介してSARS -CoV-2の感染を促進する(21)。一旦脳脊髄液に入ると、ウイルスは心肺機能を制御する核がある脳幹を含む大部分の脳領域に到達する可能性がある(42,43)。また、脳幹の吻側部ベントロラ側髄質領域にはACE2の活性がある。以前に示されたように、SRAS-CoV-1やMERS-CoVは、肺からシナプス結合ルートを介して脳幹に侵入することができる(21,44,45)。したがって、脳幹におけるSARS-CoV-2の神経浸潤が急性呼吸不全の一因である可能性がある(46,47)。
4. SARS-CoV-2の神経栄養と炎症
SARS-CoV-2 が動物またはヒトの脳に炎症を誘発したかどうかはまだ確認されていないが、他の CoV が脳を標的にして炎症や脳脊髄炎を引き起こすことは文献で十分に確立されている。例えば、ヒト HCoV-OC43 は小児の脳炎と関連している(48) 。さらに、SARS 患者の 脳脊髄液 から SARS-CoV-1 RNA が検出されている ( 49) 。さらに、ヒトの HCoV-OC43 や動物の CoV が中枢神経系に到達し、脳炎を引き起こすことが明らかになった (50)。しかし、SRAS-CoV-2 のトロピズムがどのように脳内の急性炎症を媒介するのかという疑問が残っている。SRAS-CoV-2は脳内に入ると、アストロサイト、オリゴデンドロサイト、ミクログリアを標的とする前にBBB受容体上の内皮細胞やニューロン上で複製するという科学的データに基づいて、この疑問に答えることができる。また、最近、ACE2がニューロン、アストロサイト、オリゴデンドロサイトに発現していることが示された(19)(図2)。興味深いことに、ACE2は黒質、脳室、中側頭回、後帯状皮質に高濃度に存在することが示された(39)。
SRAS-CoV-2が脳に到達すると、自然免疫系は感染に対する宿主防御の第一線として機能する。SRAS-CoV-2は、Toll-Like Receptor(TLR)を含む病原体認識受容体(PRR)による病原体関連の分子パターンの認識を通して、ウイルス感染を検出する。感染後、神経ウイルス性CoVは炎症性サイトカイン、ケモカイン、MMPの有意な増量を示し、これらはすべて細胞の抗ウイルス反応を開始する役割を果たす(51-53)。好中球やマクロファージを含む他の細胞は、CoVs感染直後に中枢神経系に勧誘された主要な自然免疫細胞である(54,55)。ここでは、SRAS-CoV-2はTNF-α、IL-6,CCL2およびCXCL10産生を誘導した;おそらくBMECによる保護IFN-β産生を阻害した(56)。
一方、TLRsはCoVs感染に対する宿主の防御に寄与している(57)。実際、TLR3 および TLR7 シグナルは、神経細胞における WNV の神経栄養感染を制限することが実証されている (58,59)。このように、TLR3およびTLR7は、ウイルスの神経侵入後のBBB透過性を高めた。同様に重要なのは、アストロサイトのMHV感染中にTLR-2およびTLR-4の活性化が報告され、その後のIFN-I型の発現およびIL-6サイトカインのアップレギュレーションが報告されたという最近の実証である(60)。実際、MHV-A59とSARS-CoV-2は、IL-6が関与する炎症性サイトカイン反応など複数の類似性を持っている(60,61)。
別の面では、自然免疫系がSRAS-CoV-2をロックダウンすることに失敗した場合、適応免疫系が活性化され、ゆっくりと全身性でウイルス特異的であるため、免疫学的記憶の刺激につながる。適応免疫応答は、通常、細胞介在性免疫と体液性免疫を含み、CD4+ Tヘルパー細胞、CD8+ 細胞傷害性T細胞、B細胞の作用を伴う。ここでは、SRAS-CoV-2感染は、適応免疫応答のT細胞とウイルス特異的抗体の作用によって除去される可能性がある。それにもかかわらず、ウイルスが免疫系から逃げ出した場合、ウイルス感染はすべての中枢神経系組織に広がる可能性があり、ウイルス複製の増加や過剰反応性の自然免疫反応を引き起こす。その後、SRAS-CoV-2ウイルスによるグリア細胞の活性化は、複数の炎症性ケモカインおよびサイトカインの産生をもたらす。実際、MHVなどのCoV株は、CCL5およびCXCL10の供給源となり得るアストロサイトを活性化することが示された(62,63)。
注目すべきは、活性化されたミクログリア細胞は、ニューロンに有害なTNF-αの主要な供給源となり得ることである(64)。したがって、中枢神経系における炎症性サイトカインIL-6,IL-15,IL-1βおよびTNF-αのレベルの上昇は、不可逆的なニューロン障害を誘発する可能性がある(64)。さらに、これまでの研究では、CoVがグリア細胞を攻撃すると、IL-12,IL-16,IL-17,IL-18などの炎症性因子が大量に放出されることが示されている(60)。また、SRAS-CoV-2による感染中枢神経系のケモカインCCL2レベルの上昇は、炎症性および免疫抑制性の環境を確立する可能性がある(65)。したがって、炎症性因子は脳損傷の病態生理過程の一つとなり得る。
図3Aに示すように、SRAS-CoV-2感染後にアップレギュレートされるサイトカインストームは、通常、リンパ球およびマクロファージを含む炎症性細胞の感染部位へのリクルートに関連するであろうプロ炎症性サイトカインで構成されている。
要約すると、SRAS-CoV-2ウイルスによる感染ニューロンは、グリア細胞の活性化を誘導することもできるケモカインを産生する可能性があり、このケモカインは炎症性ケモカインおよびサイトカインの優勢を産生する(図3A)。これらの炎症性メディエーターは、BMEC間のタイトジャンクションの完全性を低下させることにより、BBBを破壊することができる。炎症性メディエーターは、さらにBBBを破壊し、周辺部から中枢神経系への炎症性細胞の浸潤を増加させることができる。増加した炎症性浸潤は、さらなる神経炎症および神経細胞傷害につながる可能性がある(図3B)。さらに、いくつかのサイトカインのレベルは、SARS-CoV-1感染後の回復後、数ヶ月から数年にわたって上昇することが報告されている(66)ことから、長期的な神経炎症に寄与する可能性のある感染後の炎症性前駆状態を導く。それにもかかわらず、感染後の脳が神経細胞の脱髄または神経変性の発症に寄与する経路を決定するための高度な研究が必要である。
図2 SRAS-CoV-2感染時の急性炎症の模式図
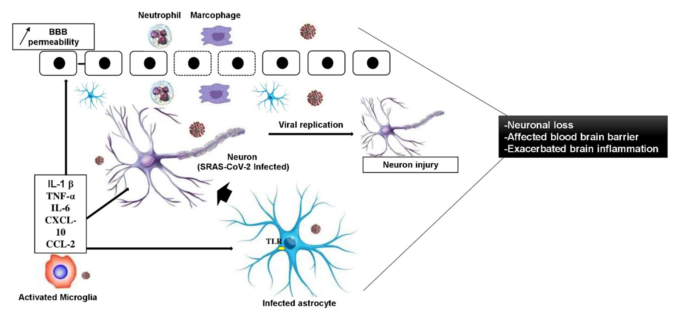
神経細胞が感染すると、ウイルスは増殖・複製を開始し、サイトカインやケモカインの産生を伴う神経細胞傷害の第一ラウンドを引き起こす。これらのサイトカイン/ケモカインはミクログリアやアストロサイトを活性化し、炎症性サイトカイン/ケモカインの産生をさらに刺激し、神経細胞のさらなる損傷に寄与する。また、サイトカインやケモカインは、脳内の免疫細胞を活性化し、BBB機能障害を開始および/または増強し、BBB上のタイトジャンクションの構造を変化させる。さらに、白血球(マクロファージおよび好中球)の経内皮移動は、急性神経組織障害を引き起こす。BBB:血液脳関門、TLR:Toll-Like Receptors。
5. SARS-CoV-2の持続感染と神経変性
では、SRAS-CoV-2への感染が、症状のある個体と無症状の個体の両方で長期的な神経損傷をもたらす可能性があるかどうかを文書化した。最初のシナリオでは、神経細胞がSRAS-CoV-2の潜伏リザーバーとして機能する可能性があると仮定している。第二のシナリオは、脳内での長期的な神経炎症の可能性を仮定したものである。一般的に、これら、2つの可能性は、アポトーシスと酸化ストレスの経路を活性化し、神経変性を引き起こす可能性がある。
実験データでは、動物の脳組織におけるウイルスの拡散は血管内皮機能障害を伴うことが示されており、認知機能障害に寄与することが報告されている(67 )。さらに、HCV-OC43およびSARS-CoV-1を直接接種した感受性のあるげっ歯類では、数ヶ月間ウイルスRNAが存在し、神経細胞の変性を引き起こし(68)最終的にはアポトーシスを引き起こす急性脳炎を発症した(69)。実際、Jacomyらは、CoV感染後のアポトーシスが、マウス海馬のCA1層とCA3層で観察される神経細胞の喪失に関与するメカニズムであると推測している(70)。また、ChenとLaneは、MHVがマウスの脳で神経細胞死を誘発するメカニズムとしてアポトーシスを挙げている(71)。これらの結果から、図3Cに示すように、アポトーシスによる神経細胞死の主な原因はカスパーゼではないかと考えられる。実際、カスパーゼ3は神経細胞のアポトーシス過程の主要なメディエーターであることが明らかにされている(72)。注目すべきは、アポトーシスに関連するシグナル伝達経路の変化は、アルツハイマー病(73)およびパーキンソン病(PD)(74)に関与していることが記載されている。したがって、SRAS-CoV-2が潜伏感染時に神経細胞のアポトーシスを調節することは、最終的には神経細胞の変性や脳損傷につながる神経細胞のプロセスの変化に関係している可能性がある。
酸化ストレスは、SRAS-CoV-2潜伏感染が神経変性を誘導する別のメカニズムである(図3Bおよび3C)。標的細胞におけるウイルス感染は、高活性酸素の発生をもたらすミトコンドリア損傷を誘導することができる(75)。さらに、MMPsの活性化を介したタイトジャンクション複合体の破壊は、多くの場合、活性酸素の発生の亢進と関連している(76 )。注目すべきことに、最近の研究では、酸化ストレスがAD(77)、PD(74)、多発性硬化症(MS)などの神経変性疾患と関連していることが示されている(78)。例えば、AD患者は全体的に活性酸素レベルの増加を示し、一方で抗酸化能力は低下している(79)。重要なことに、活性酸素の発生は、シナプス機能障害を促進することが知られているアミロイドβ(Aβ)タンパク質の凝集体と関連している(80)。また、脱髄や軸索損傷に関連する活性酸素産生の上昇レベルは、MSで報告されている(81)。
図3. SRAS-CoV-2潜伏型の神経トロピズムとその神経変性疾患との相互関係の提案モデル。
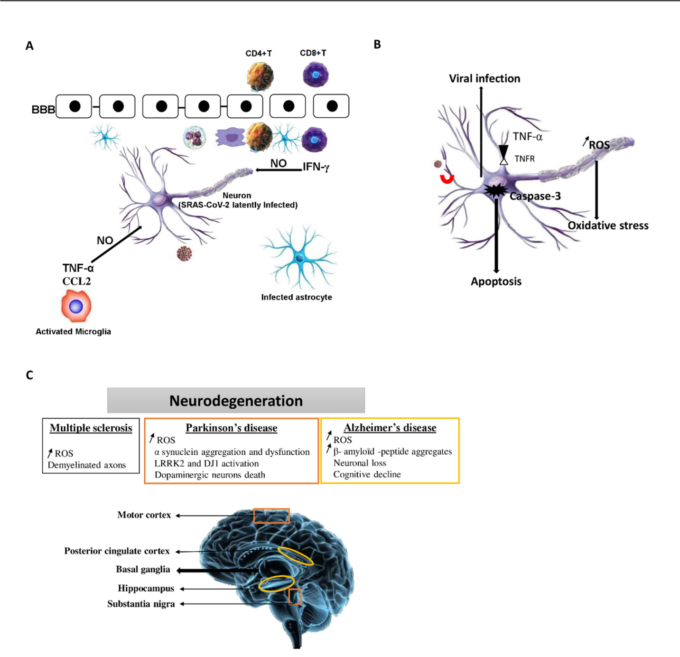
A)SRAS-CoV-2潜伏型脳感染症。SRAS-CoV-2潜伏型は、CD8+およびCD4+ T細胞の浸潤によって特徴づけられる。重要なことは、これらのT細胞は潜伏感染したニューロンの近くに局在していることである。さらに、CD8+ T細胞はIFN-γを分泌することができる。SRAS-CoV-2が脳に持続的に感染している間、免疫細胞が脳に浸潤する結果として、TNF-αやIL-1βなどのサイトカインがBBBに影響を与え、脳の炎症を悪化させる可能性がある。
B)TNF-αとIFN-γの相乗効果により、脳内に酸化ストレスが誘導され、一酸化窒素誘発性の神経変性や脱髄が亢進する可能性がある。さらに、SRAS-CoV-2は、細胞のプロセスを調節し、潜伏型のウイルスは、シグナル伝達カスケードの異なる段階でアポトーシスにつながるイベントを阻害します。
C)箱は、アルツハイマー病(オレンジ色の箱)、パーキンソン病(黄色の箱)、多発性硬化症(黒の箱)で起こるアポトーシス、酸化ストレス、神経細胞傷害に関連した細胞過程や病態を示しています。神経変性疾患の病態は、運動野、後帯状皮質、脳室、黒質を含むヒトおよびげっ歯類の脳の複数の領域で発現している。
BBB:血液脳関門、活性酸素:活性酸素、ACE2:アンジオテンシン変換酵素2。
NO:一酸化窒素、TNFR:TNFα受容体。
5.1. 多発性硬化症に関連したSARS-CoV-2感染後の症状
コロナウイルスは、長い間、MS 疾患の原因となりうる、あるいはMS 疾患を増強する可能性のあるウイルスの候補として挙げられていた(82-85)。最近の臨床例研究では、再発寛解型MS(RRMS)患者におけるSRAS-CoV-2の有病率を健常対照者の有病率と比較して評価している(5,86)。多発性硬化症患者の組織および体液サンプルからCoVsの遺伝物質が発見されたことで、このもっともらしい仮説が可能になった。実際、HCV-229Eは、MSの最初のエピソードの間に患者の脳脊髄液から分離された(87)。それ以前にも、多発性硬化症患者の脳からHCoVが分離されている(88)。さらに、いくつかの実験モデルでは、MSの自己免疫変化を誘発する環境因子を調べるためにCoVを使用している(25,89-90)。例えば、MHV3に感染したマウスが最初の感染を生き延びると、免疫媒介性脱髄疾患を発症する(25,91)。感染したマウスの脊髄を分析すると、ミエリンの完全性の喪失は、ウイルス抗原と炎症性免疫細胞の両方が継続的に存在していること(92)酸化的傷害(93)およびミエリン合成の喪失(94,95)と関連していることが確認されている。また、Savarinらの研究では、多発性硬化症患者の血液中のCD4+ T細胞の割合が減少していることが報告されており、これはCoVs感染に対する反応の低下と関連している可能性がある(96,97)。多発性硬化症患者におけるCoVs感染によるT細胞の制御不良とT細胞の枯渇が、これらの患者におけるCoVsの再活性化につながる可能性がある。しかし、この仮説を確認するためにはさらなる研究が必要である。
5. 2. アルツハイマー病と関連したSARS-CoV-2後感染
疫学と死後アルツハイマー病の脳におけるデータは、ウイルス感染がアルツハイマー病の発症に寄与する可能性を示唆している。例えば、CoVsの遺伝物質は脳サンプルで検出され、アミロイドβタンパク質と共局在することが判明している(98)。重要なことに、SRAS-CoV-2はアミロイドβタンパク質の蓄積を誘導することができる。
実験モデルでは、HCoV-OC43はマウスの神経病変を誘導した(70)だけでなく、リポカリンアポD蛋白質のアップレギュレーションも誘導した(99)。また、高齢トランスジェニック3xTg-ADマウスでは、MHVは神経炎症を誘発し、タウ値を悪化させ、認知機能を低下させた(100)。炎症を介したタウの病理学的特徴の悪化は、海馬のCA1ニューロンのグリコーゲン合成酵素キナーゼ(GSK)-3βを阻害することによって効果的にブロックされる認知機能の障害につながる(100)。注目すべきは、SRAS-CoV-2で損傷を受けた中枢神経系の領域は、記憶や認知プロセスに関連する大脳皮質と皮質下層構造からなる大脳辺縁系に関連していることである(図3C)。これらの知見は、脳内に潜伏しているSRAS-CoV-2がこの組織にアミロイドβの沈着を増加させ、素因のある患者では病気の発症を加速させる可能性を示唆している。
5. 3. パーキンソン病と関連したSARS-CoV-2後感染
COVID-19の重篤な形態に苦しんでいる患者では、ドーパミン合成経路の全身的な障害の仮説を考慮に入れ、さらに探索する必要がある。実際、大脳基底核およびドーパミンに富む脳領域は、SRAS-CoV-2に対して脆弱な標的であるように思われる(図3C)。その結果、慢性的な神経炎症は、大脳基底核機能障害、BBB透過性の変化、および神経変性をもたらす。
以前に示されたように、HCoV-OC43 をマウスに腹腔内接種すると、マウスではミクログリアの活性化と神経炎症が誘導され(101 )その後、脳炎、神経細胞の変性、および運動機能の低下が引き起こされた(70,101)。
ヒトでは、パーキンソン病患者の脳脊髄液中にHCV-OC43およびHCV-229Eが検出されている(102 )。特筆すべきは、鼻腔内/眼内接種により脳内でCoV RNAが検出され、死後の分析では大脳基底核における炎症や白質浮腫などの脳病理の存在が示されたことである(102 )。
一方、神経向性ウイルスは、DJ1やロイシンリッチリピートキナーゼ2(LRRK2)などのPD関連タンパク質のレベルに影響を与えることが示されている(103)。DJ1は早期発症パーキンソン病に関連する遺伝子であり、神経細胞におけるドーパミンおよび活性酸素バランスの重要な調節因子である(74)。実際、病的なLRRK2およびDJ1の活性化は、試験管内試験および生体内試験のニューロトロピックウイルスモデルにおいて、神経炎症および神経細胞損傷の重要なメディエーターであることが判明した(103,104)。さらに、Ijomoneらは、SRAS-CoV-2由来のウイルス剤が、ミクログリアの活性化と酸化ストレスを介して、黒質領域におけるα-シヌクレインの凝集とオリゴマー化を誘導することを提案している(72)。
6. 議論
本研究では、SRAS-CoV-2の潜伏型が脳内での悪影響や神経変性疾患の誘発に関与していることを明らかにした。ここでは、SRAS-CoV-2の神経侵襲性と脳への影響に焦点を当てた。SRAS-CoV-2の脳への神経浸潤性を明らかにするために、SRAS-CoV-2の神経浸潤性を明らかにした。同様に、COVID-19( 19)の時代のCoVの神経病理発生と神経学的症状を調べたZubairらによって報告されている。同様に重要なことは、COVID-19の長期的な影響が神経変性疾患の病因因子として暗示されているようであることの実証である(24,55)。
さらに、神経細胞、アストロサイト、オリゴデンドロサイトにおけるACE2受容体の発現は、SRAS-CoV-2のニューロトロピズムに寄与している(19)。このことから、SRAS-CoV-2の脳内持続感染は、数十年の歳月をかけて徐々に進化していくヒトの神経変性疾患に関与している可能性がある。特筆すべきは、10年後にSARS患者の脳脊髄液中にSARS-CoV-1 RNAが検出されたことである(49)。
特に、COVID-19パンデミックが感染者における神経変性疾患の発症率の増加につながるかどうかを決定するための縦断的研究が緊急に必要である。これらの推測を確認するためには、さらなる研究が必要である。したがって、我々は、計画的なコホート研究によって強力な結果が得られることを示唆している。また、SARS-CoV-2感染後の神経変性や神経変性に関する情報を得るためには、実験的研究や死後試験を行うことが必要であると考えられる。残念ながら、我々のレビューは2019年12月から 2020年8月までに発表された研究に限定されているため、神経変性疾患と関連したSRAS-CoV-2ウイルスの実験的報告を見逃している可能性がある。さらに、我々の研究戦略により、我々はウイルスの神経侵入と神経トロピズムの両方を含む研究、および神経学的症状の記述が不十分な研究に焦点を当てました、なぜならば、現在発表されている症例報告と臨床研究の数が少ないからである。第三に、ウイルスを標的とした新規治療法を確立するためには、抗ウイルス治療法についての詳細な情報収集が必要である。現在のところ、SRAS-CoV-2ウイルスに特異的な抗ウイルス剤やワクチンは存在しない。しかし、SRAS-CoV-2ウイルスに対して活性な化合物が報告されており、アミノキノリン(105,106)やメラトニン(107)などの直接作用型抗ウイルス剤や宿主標的型抗ウイルス剤が含まれているが、これらの化合物のほとんどは実験モデルや臨床試験には至っていない。そのためには、このウイルスのトロピズムと病態を深く理解することが治療法の開発に不可欠である。
最後に、我々は本レビューを通じて、SARS-CoV-2の神経毒性をよりよく理解し、直接的な(直接感染を介した)影響と間接的な(炎症性/抗炎症性シグナル伝達の亢進に関連する二次的影響を介した)影響の中枢神経系への影響を評価するために、部分的に脳脊髄液を提供することを示唆している。この目標は、脳のイメージングや脳組織の検査を含む学際的なアプローチを用いて達成されなければならない。
7. 結論
本レビューでは、SRAS-CoV-2のニューロトロピズムと神経変性疾患の発症との関連を解明するために、いくつかの文献データに基づいて、一連の可能性のある追加の病態生理学的メカニズムを強調している。以上の研究結果から、SRAS-CoV-2の神経侵襲性と神経刺激性、および脳への影響が確認された。
神経浸潤の正確なメカニズムは明らかにされていないが、ウイルスが脳に到達するには、2つの侵入経路(BBB構造を介した血行性経路とシナプスを介した伝達経路)があることが示唆されている。実際、ウイルスは、アポトーシスや細胞酸化など、ニューロンやグリアの多くの重要な細胞プロセスを調節することができる。
以上のことから、SRAS-CoV-2が神経細胞に感染すると脳に障害が生じることが示唆されている。これらの仮説は、SRAS-CoV-2と神経変性との相互関係を評価するためのさらなる研究を必要としている。したがって、我々は、デザインされたコホート研究により、この可能性のある関係について強力な結果が得られることを示唆している。同様に、実験モデル(試験管内試験および生体内試験)での将来の課題は、SARS-CoV-2感染後の可能性のある神経損傷についてより多くの光を当てることができる。