Contents
Divulging the Intricacies of Crosstalk Between NF-Kb and Nrf2-Keap1 Pathway in Neurological Complications of COVID-19
pubmed.ncbi.nlm.nih.gov/33683626/
要旨
COVID-19感染症の重症度は日々急増している。日に日に症例数が増加しており、重症化の背景にある病原機序の理解がますます重要になってきている。現在では、感染症が主に呼吸器系で発現することがよく知られているが、他の臓器系の関与が多くの研究で明らかになっている。SARS-CoV-2 は、このレビューで議論されている多数の提案されたメカニズムによって神経系に侵入することができる。NF-κB と Nrf2 はそれぞれ炎症反応と抗酸化反応を担う遺伝子を制御する転写因子である。本レビューでは、COVID-19 の特徴であるサイトカインストームと酸化ストレスに関与する NF-κB と Nrf2 の経路に特に焦点を当てている。免疫傷害が神経侵入と神経炎症の重要なメカニズムであることから、神経学的合併症にはこれら、2つの経路が関与している可能性がある。また、これらのシグナル伝達経路のクロストーク機構についても議論されている。このような病態に対応するためには、合成および天然の免疫調節剤が有望な候補であると考えられる。
序論
2019年12月、中国・武漢で肺炎を呈する症例が複数発生した。下気道から検体を採取したところ、原因菌は新規コロナウイルスと同定された[1]。原因菌のゲノム解析の結果,SARS-CoV-2(重症急性呼吸器症候群新型コロナウイルス型)であることが判明した[2,3].COVID-19は2020年3月11日にWHOによりパンデミックのステータスを受けた[4]。2019年12月に中国・武漢で初めて報告されて以来、症例数と死亡者数は日々急増しており、この病気は長い道のりを歩んできた。COVID-19の主要な症状は呼吸器であることが知られているが、いくつかの証拠が神経系にも関与していることを示唆しており、その結果、さまざまな神経学的合併症が生じる[5,6]。いくつかの研究では、中枢神経系(CNS)と末梢神経系(PNS)の両方に関連した神経学的合併症の発生率が確立されており、これらは記事中でさらに引用されている。これらは、意識障害、頭痛、めまい、パラ感覚、脳炎、感染性中毒性脳症、急性脳血管障害、および多くの他のものの形で見ることができる。これらは感染症の重症期の患者さんに多くみられる[7,8]。認知機能障害や記憶障害は、ごく少数の研究で報告されている。シカゴの入院患者50人を対象としたレトロスペクティブ研究では、患者の24%が短期記憶障害を呈し、13人が認知機能障害を呈したことが明らかになった[9]。英国の別の研究では、精神状態が変化したCOVID-19患者が、虚血性脳卒中、脳内出血、中枢神経系血管炎、脳症、脳炎などの他の神経学的合併症とは別に、新発症精神病、神経認知(認知症様)症候群、情動障害などの神経認知機能障害を有することが報告されている[10]。神経侵入の可能性のあるメカニズムも提案されているが、まだ明確にはなっていない。脳へのウイルスの侵入は、BBB(血液脳関門)の内皮細胞または血液-脳脊髄液関門の上皮細胞によって媒介されるか、またはCOVID-19感染時のサイトカインストームで産生される炎症性細胞を介して行われる。嗅覚、腸神経系、呼吸器系を介した逆行性軸索輸送が、他の脳感染経路として考えられる。SARS-Cov2ウイルスは、肺や下気道に存在する力学受容体や化学受容体などの末梢神経末端に侵入した後、シナプスに接続された経路を介して脳の延髄の心肺中心部にアクセスできる可能性があることが、ますます多くのエビデンスで示されている。
血液循環は、ウイルス粒子と炎症性メディエーターの脳への侵入を促進するもう一つの経路である[11]。もう一つのメカニズムは、低酸素による脳の腫脹、脳血管拡張、虚血による頭痛、脳血流の閉塞を引き起こす低酸素による傷害であり、低酸素が治療されないと悪化し、昏睡や脳卒中を引き起こす可能性があるとされている[7]。その詳細なメカニズムについては、NF-κB と Nrf2 経路を中心に考察してきた。
SARS-CoV-2感染における多数のサイトカインの放出は、現在、様々な研究で十分に証明されている。武漢で行われた研究では、COVID-19で入院した非ICU患者よりもICU患者の方がIL-2,IL-10,IL-7,TNF-α、およびその他の炎症性マーカーのレベルが高かった[12]。重症患者452人を対象とした別の同様の研究では、286人の重症患者のうち、炎症性サイトカインおよび感染に関連するバイオマーカーのレベルの上昇が重症感染患者で認められた。T細胞、単球、好塩基球、好酸球の数が低かった [13]。別の研究では、COVID-19の重症患者では、C反応性タンパク質、Dダイマー、フェリチン、IL-6,IL-10,IL-2R、TNF-αのレベルが増加し、Tリンパ球、CD8 + T細胞、CD4 + T細胞のレベルが著しく低下していることが認められた[14]。この炎症亢進の経路はNF-κBを介したものであることがいくつかの研究で証明されている。韓国人被験者 48 人を対象とした研究では、NF-κB シグナル伝達経路に関与する遺伝子が、サイトカインや炎症マーカーのレベルの増加とともにアップレギュレートされていることが明らかになり、COVID-19 患者の高炎症反応にこの経路が関与していることが示された[15]。NF-κB(核内因子κB)は、免疫応答および炎症応答に関与する遺伝子を制御する誘導性転写因子からなるファミリーである。これらは通常、IκBファミリーおよびいくつかの他の関連タンパク質を含む抑制性タンパク質によって隔離された形で細胞質に存在する。IκBファミリーの最も顕著なメンバーは、IκBαである。炎症中のIκBのリン酸化は、NF-κBの放出を導く。したがって、NF-κB活性化は炎症性疾患の特徴である[16]。
Nrf2(核内因子エリスロイド2関連因子-2)は、酸化ストレスや新電子ストレスから細胞を保護する様々な酵素をコードする遺伝子を形成する転写因子である。また、炎症反応を調節する炎症性遺伝子を転写的に抑制する。通常、Nrf2はその阻害剤であるKeap1と結合した状態で細胞質に存在している。細胞がストレスを受けると、親電性または活性酸素(ROS)の発生がNrf2-Keap1複合体の解離を引き起こし、Nrf2は核内に移動して酸化還元恒常性および抗酸化反応に関与する多数の遺伝子の転写を刺激する [17]。COVID-19患者の生検により、これらの患者ではNrf2抗酸化応答に関連する遺伝子が抑制されていることが明らかになった。また、試験管内試験実験では、Nrf2誘導性タンパク質の発現もダウンレギュレーションされており、COVID-19患者ではこの経路が抑制されていることが明らかになっている[18]。Nrf2活性化因子に関する研究では、Nrf2がサイトカインをコードする36の遺伝子をダウンレギュレートし、COVID-19患者のサイトカインストームを減少させることが示された[19]。
上記の研究はすべて、COVID-19の発症にNrf2とNF-κBが関与していることを示唆している。神経学的合併症のメカニズムの一つがサイトカインによる免疫傷害を介していることから、これらの合併症におけるこれらのシグナル伝達経路の関与は十分に帰することができる。また、トランスジェニックマウスを用いた研究では、Nrf2経路が活性化されると酸化ストレスが抑制され、マウスの認知機能が改善されることが明らかになった。また、Nrf2経路を遮断すると、酸化的傷害が生じ、神経細胞の生存率が低下することが明らかになった[20]。COVID-19患者ではこの経路がダウンレギュレーションされていることが報告されていることから、これが認知機能低下の原因の一つである可能性がある。これら両方の経路の詳細なシグナル伝達と、SARS-CoV-2の神経学的侵襲への関与についても議論されている。また、これら、2つの経路間のクロストークの潜在的なメカニズムについても検討した。Nrf2-Keap1経路を修飾したり、NF-KBを阻害したりして、クロストークに影響を与えることができる免疫調節剤は、前述の経路で標的とされている病態に対応するための有望な候補である。また、COVID-19に対する治療薬として検討されている有望な候補のまとめについても議論した。
SARS-CoV-2の構造
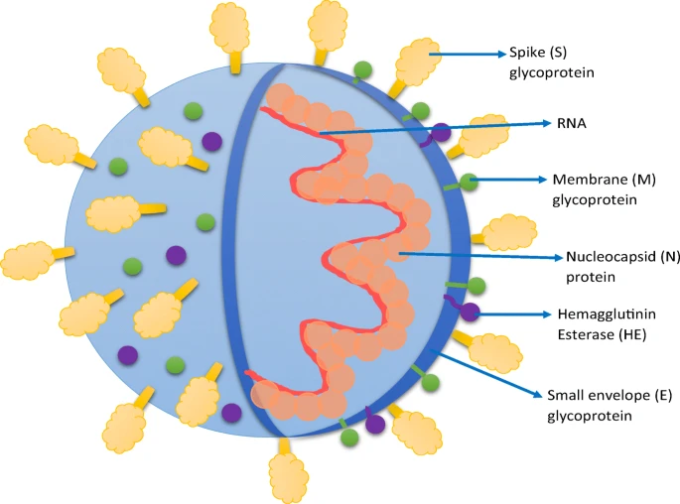
SARS-CoV-2は、一本鎖ポジティブセンスRNAを持つβ型コロナウイルスである。SARS-CoV-2はコロナウイルス科に属し、直径は80~220nmである[1]。SARS-CoV-2は、小エンベロープ(E)糖タンパク質、スパイク(S)糖タンパク質、ヌクレオカプシド(N)タンパク質、膜(M)糖タンパク質、その他の付属タンパク質の4つの主要な構造タンパク質を有している。M糖タンパク質は、膜を3回にまたがっている最も豊富なタンパク質である。Nタンパク質は核酸物質と結合してウイルスの複製サイクルに関与しているほか、感染に対する宿主細胞の細胞応答にも関与している。S糖タンパク質は約150kDaの重さがある。これは、ウイルス外表面にスパイクの形で存在する膜貫通型のタンパク質である。宿主細胞の受容体であるACE2との結合のみを担っている。HE(ヘマグルチニンエステラーゼ)4a/b、および3a/bタンパク質のようないくつかの付属タンパク質は、ウイルスの複製およびゲノムの維持に関与している[21,22]。スパイク糖タンパク質は、宿主細胞受容体であるACE2およびCD147受容体(バジジンまたはEMMPRINとも呼ばれる)との結合に関与している。CD147は、免疫グロブリンスーパーファミリーに属する膜貫通型糖タンパク質であり、腫瘍や炎症性プロセスの場合に発現が増加することを示している[23]。最近の研究で、SARS-CoV-2がACE2とは別にCD147受容体に結合することが示された。スパイク糖タンパク質とCD147の間には直接的な相互作用があり、この受容体をブロックすることでウイルスの複製が抑制されることが報告されている[24]。今日まで、嗅覚上皮細胞や呼吸器上皮細胞では非常に低いタンパク質レベルで発現しているACE2受容体を介してSARS-COV-2が宿主細胞に侵入することに注目が集まっていた。このことから、ACE2の発現が低い細胞では、ウイルスと宿主細胞の相互作用を促進するために補因子が必要とされる可能性があることが観察された。さらに、COVID-19患者では神経症状が一般的であるという報告が増えているにもかかわらず、ACE2はほとんどの神経細胞には存在していない。したがって、ACE2はSARS-COV-2の唯一の侵入点ではないという仮説を支持するものである。科学的文献によると、SARS-CoV-2スパイクタンパク質は、ニューロピリン-1受容体(NRP-1)のb1b2ドメインにも結合できることが示されている。NRP1受容体はヒトの呼吸器上皮および嗅覚上皮に存在し、COVID-19に感染した患者の嗅覚上皮ではNRP1の発現が亢進していることが観察された。COVID-19感染者の剖検報告から得られた嗅覚上皮の病理学的解析から、NRP1はSARS-CoV-2ウイルスの感染力を有意に増強させた[25, 26]。Moutalらの別の研究報告[27]では、SARS-COV-2の宿主細胞への侵入にNRP1が関与していることが明らかになっている。SARS-COV-2のスパイク蛋白質と血管内皮増殖因子A(VEGF-A)の両方がNRP-1に結合していることから、彼らはスパイク蛋白質によってVEGF-A/NRP-1シグナル伝達が阻害されるかどうかを試験した。その結果、VEGF-Aをトリガーとした感覚ニューロンの発火は、NRP-1阻害剤と同様にスパイクプロテインによって阻害されることが確認され、COVID-19の侵入と感染の促進にNRP1が関与していることが実証された。
図1 SARS-CoV-2の構造
SARS-CoV-2感染症の症状
COVID-19は主に感染者の呼吸器飛沫を介して広がる。COVID-19の主な症状は、発熱、疲労、乾いた咳などである。ある研究では、138人の患者のうち26.1%の患者がARDS(急性呼吸窮迫症候群)不整脈、ショックなどの合併症に進行していた。これらの患者のほとんどは高齢で、すでに併存疾患を持っていた [28]。別の研究では、発熱、咳、息切れが主な症状であるのに対し、筋肉痛、錯乱、喉の痛み、頭痛、鼻漏、下痢、胸痛、吐き気嘔吐があった患者の割合は少なかった。患者の17%がARDSを発症した[29]。
これらの呼吸器症状とは別に、いくつかの研究で、患者は神経学的症状も示すことが示されている。システマティックレビューでは、主な中枢神経系の合併症として、虚血性脳卒中、急性骨髄炎、脳脊髄炎、頭蓋内出血が報告されている。末梢神経系の合併症は主にGBS(ギラン・バレー症候群)とベル麻痺であり、横紋筋融解症は骨格筋の主な症状であった[30]。153人の患者を対象とした英国全体のサーベイランス研究では、62%が脳血管イベント(虚血性脳卒中、74%;脳血管炎、1%;脳内出血、12%;その他の脳血管イベント、13%)を有していた;31%が精神状態の変化を示していた(脳炎、18%。特定できない脳症、23%;精神病を含む神経精神障害、59%、43%;神経認知障害、26%およびその他の精神障害、36%);5%が末梢障害(GBS、67%;その他の末梢障害、23%)を示し、2%がその他の神経学的障害を有していた[10]。
214人の被験者を対象とした別の研究では、36.4%が神経学的所見を有し、そのうち24.8%が中枢神経系関連、8.9%が末梢神経系関連であった。中枢神経系関連はめまい16.8%、意識障害7.5%、頭痛13.1%、急性脳血管障害2.5%、てんかん0.5%、運動失調0.5%であった。末梢神経系関連の所見は、低脳症が5.6%、低痙攣が5.1%、神経痛が2.3%であった[8]。フランスの患者も神経学的特徴を示し、58人中84%が神経学的合併症を示した。45人の患者のうち15人がICUからの退院後に認知障害を示し、主に見当識障害、不注意、命令への反応不良を特徴としていた[31]。ICUに入院した4人の重症COVID-19患者の別の症例研究では、退院後に認知機能障害が認められ、主に前頭症候群と記憶障害として現れた。しかし、これは免疫グロブリン療法を5日間行うとすぐに寛解した[32]。入院中にせん妄と診断されたCOVID-19患者71人を対象とした別の研究では、退院後4週間後の電話面接で42%の患者で認知機能スコアが低下していた[33]。
また、126例のMRI脳所見では、急性または亜急性の梗塞が32例、微小出血が14例、白質脳症が17例、低酸素性虚血性脳症が1例、レプトメニンジア増強が14例に認められた[34]。別の研究では59例中33.9%の患者が嗅覚障害の味覚障害を報告している。味覚障害は8.5%、加齢臭は1.7%、嗅覚低下は5.1%であった。また、味覚障害と嗅覚障害の混合も18.6%の患者で報告され、そのうち味覚障害と嗅覚障害は3.4%、味覚障害と嗅覚障害は3.4%、加齢障害と嗅覚障害は3.4%、加齢障害と嗅覚障害は8.5%であった[35]。
疫学
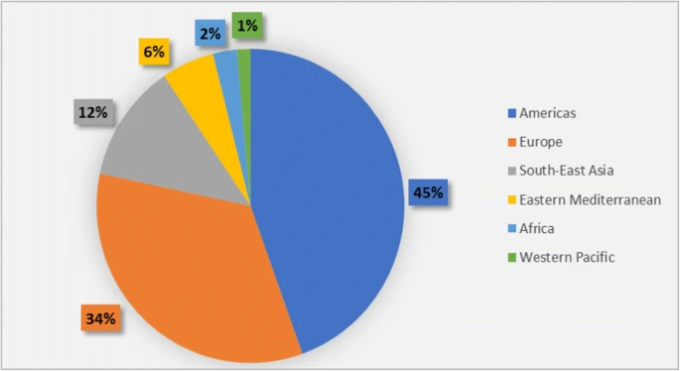
2019年12月に武漢で最初の症例が出現したことで、SARS-CoV-2は全地域に広がり、多くの国が深刻な影響を受けている。WHOによると、10月11日時点で全世界で3700万人の症例と100万人以上の死亡が報告されており 2020年11月24日までに新たに6万7000人の死亡と700万人の症例が追加され、全世界で5780万人の症例と130万人以上の死亡が報告されている[36]。2020年12月22日に発表されたWHOの週間疫学アップデートによると、12月20日のパンデミック開始以来、7500万人の症例と160万人の死亡が報告されている。症例数が最も多く報告されたのは米国、ブラジル、トルコ、ロシア連邦、インドの5カ国で、米国は14%、ブラジルは8%、ロシア連邦は1%未満の増加であったのに対し、トルコは11%、インドは18%の減少であった[37]。2021年2月13日現在、全世界で107,838,255人の確定症例と2,373,398人の死亡が報告されている。確定症例数が最も多かったのは米州地域で、最も少なかったのは西太平洋地域であった。国別では、米国、インド、ブラジルが確定症例数の上位3カ国となっている[38]。図2は、2021年2月13日現在の状況を数字で示したものである。
図2 2020年2月13日現在のWHO地域におけるCOVID-19確定症例の割合
いくつかの研究では、女性よりも男性の方がCOVID-19感染の有病率が高いことが示されている。合計221,195人の参加者を含む57の研究のメタアナリシスでは、男性のプール有病率は55.00であり、男性の方が感染しやすいことが示された。この分析では、この差は男性の喫煙とアルコール消費の発生率が高いことに起因していると考えられている [39]。43人の患者を対象とした別の症例シリーズ分析では、死亡率は女性に比べて男性の方が高いことが明らかになった。感染症により死亡した37人のうち、男性は70.3%、女性は29.7%であった。男性の死亡者数は女性の2.4倍であった[40]。これは、X染色体には、男性よりも女性の方が自然免疫応答や適応免疫応答を強くする免疫関連遺伝子が多く含まれていることに起因すると考えられる[41]。ウイルスの感染はヒトからヒトへ、主にくしゃみ、咳、または感染者との直接接触による呼吸器飛沫を介して行われる[42]。飛沫は表面にも感染し、これらの表面に触れた後、同じ手で口や鼻を触ることでも感染することがある。潜伏期間は一般的に2日から 14日の間で変化する[43]。SARS-CoV-2についても、いくつかの研究で基本再生産数R0が推定されている。当初は1.4~6.49の範囲と推定されていた。その後、多数の研究を解析した結果、R0の平均値は3.28,中央値は2.79と推定された。その結果、2-3がヒトからヒトへの感染を示す信頼性の高い範囲であることがわかった。スーパー・スプレッダーは100人以上に感染する可能性がある[42]。
病因
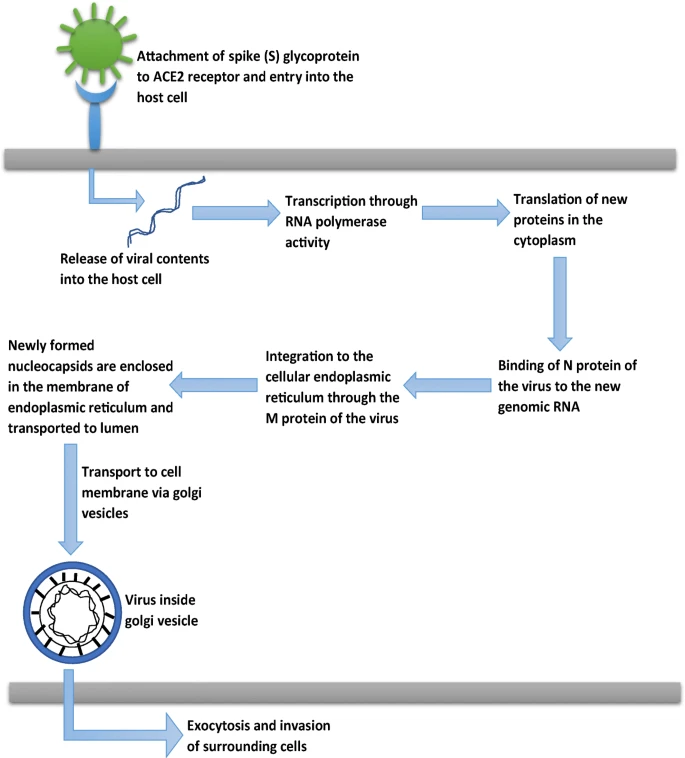
いくつかの研究では、ACE2受容体がSARS-CoV-2が宿主細胞に侵入する経路であると主張されている[44, 45]。ACE2は、肺の肺胞上皮細胞および小腸の腸細胞で発現していることがわかっている。ACE2受容体は、I型とII型の両方の肺胞細胞で発現している。また、口腔粘膜や鼻粘膜、鼻咽頭にも存在している。脳では、ACE2の発現は内皮と血管平滑筋細胞に認められた[46]。脳でのACE2発現は他の臓器に比べて低い。SARS-CoV-2の外表面には、宿主細胞へのウイルスの侵入を媒介すると考えられている膜貫通スパイク(S)糖タンパク質が収容されている。S1とS2は、S糖タンパク質の2つのサブユニットである。S1サブユニットは、ACE2受容体のPD(ペプチダーゼドメイン)に直接結合するRBD(受容体結合ドメイン)を持っている。S2サブユニットは、ウイルスと宿主細胞膜の膜融合においてその役割を果たしている[44]。SARS-CoV-2がACE2受容体に結合した後、TMPRSS2プロテアーゼによるタンパク質分解的切断が起こる。この際、まず、S2サブユニットを安定化させるS1/S2切断部位でプライミングが起こる。その後、構造変化によりS糖タンパク質を活性化する第二の切断が起こり、ウイルスと宿主の細胞膜が融合する。この後、ウイルスの内容物が宿主細胞に放出され、ウイルスの複製が開始される。ウイルス中に存在するNタンパク質は、新しいゲノムRNAと結合し、小胞体(小胞体)への統合はMタンパク質によって促進される。これらのヌクレオカプシドは小胞体の膜に封入され、ゴルジ小胞によって細胞内腔に運ばれ、細胞膜に運ばれる。エキソサイトーシスを経て、これらのウイルス粒子は細胞外空間に到達し、周囲の上皮細胞に侵入する。これがウイルスの群集拡散の段階である[47]。図3は、COVID-19の病態を示している。
図3に示すように、COVID-19の病態を示す。
図3 COVID-19の病態生理
呼吸器の病態は、SARS-CoV-2が鼻上皮のACE2受容体に結合して伝播と局所的な複製を受けることから始まる。これにより、ウイルス負荷は低いが、限られた免疫応答と高度な感染性の個体が発生する。次の段階では、ウイルスは上気道に移動し、発熱、乾いた咳、倦怠感などの臨床症状を呈する。感染した細胞は、CXCL-10(C-X-Cモチーフケモカインリガンド10)やインターフェロン-β、λの放出により、より大きな免疫反応を起こす。ここから約5分の1の患者では下気道に感染が進行する。肺浸潤が発生し、インターロイキン-1,6,8,120,12,TNF-α、MCP-1(単球化学吸引性タンパク質)などのサイトカインや炎症性マーカーが放出される。これらのケモカインは好中球、CD8およびCD4 T細胞を引き付け、肺組織内でのそれらの隔離が始まり、それが肺障害として顕在化する。I型およびII型の肺胞細胞が感染し、重度の瘢痕化および線維化が起こり、びまん性肺胞損傷を引き起こし、最終的にARDS(急性呼吸窮迫症候群)として顕在化する [47, 48]。
SARS-CoV-2の脳への侵入経路も様々に提案されている。ウイルス粒子や放出された炎症性メディエーターは、血液脳関門のタイトジャンクションを破壊することで、脳に直接到達することができる。また、血液循環の停滞は、毛細血管上皮上のACE2受容体とのスパイクタンパクの結合を促進する可能性がある[11]。神経経路としては、呼吸器系、嗅覚系、腸管神経系を経由した逆行性軸索輸送によるものが考えられる。鼻細胞から嗅球を介して脳に直接到達し、視床と脳幹に移動して神経炎症と脱髄反応を引き起こす可能性がある。心肺機能は脳幹の一部で発生する。したがって、第一線の作業者は、COVID-19の呼吸器の影響を人工呼吸器などの方法で治療している可能性があるが、これはCOVID-19で呼吸器の部位が影響を受けている場合には効果がない可能性がある[49, 50]。呼吸器系の末梢神経末端への侵入はまた、シナプスを介して中枢神経系へのウイルスアクセスを提供する可能性がある。同様に、ENS(腸管神経系)の交感神経求心性ニューロンもまた、ウイルスが消化管に感染する際に、中枢神経系へのウイルスの侵入点となる可能性がある[11]。別のメカニズムとしては、脳細胞のミトコンドリアで嫌気性代謝を引き起こす低酸素障害が考えられ、これにより、脳の腫脹、脳血管拡張、虚血性脳卒中、脳血流閉塞などの原因となる酸性化合物の蓄積が引き起こされる。局所サイトカイン産生による免疫傷害は、血液脳関門の伝染性を高めるため、別のメカニズムである可能性がある[7]。また、脳血管障害のある患者では炎症反応が高いことが示されており、高炎症が脳卒中の発症率を高める高凝固状態につながる可能性を示唆している[51]。ACE2受容体への結合もまた、血圧の上昇をもたらし、脳出血の可能性を高める[7]。認知機能の低下に関与するメカニズムはまだ完全には明らかにされていないが、神経系の直接感染、全身性高炎症反応、急性呼吸窮迫症候群(ARDS)侵襲的換気、およびCOVID-19に使用される薬剤の鎮静または副作用に起因する可能性がある[52]。図4は、SARS-CoV-2の神経浸潤の様々な可能性のある経路を描いている。
図4 SARS-CoV-2が宿主細胞に侵入した後の神経浸潤の様々な経路が提案されている
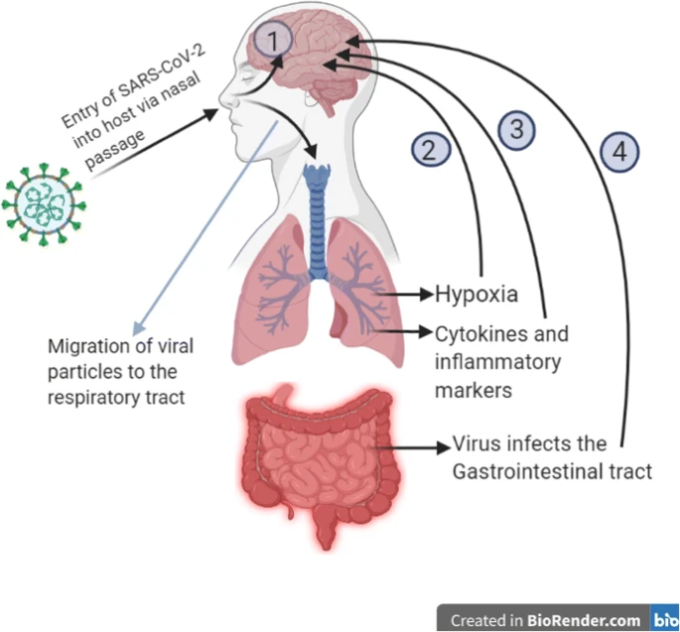
1-鼻から嗅球を介したウイルス粒子の脳内への直接移行、2-肺損傷による低酸素状態で脳細胞のミトコンドリアに嫌気性呼吸が起こり、酸性化合物が蓄積して脳の腫脹、虚血、脳血流障害を引き起こす。3- サイトカインストームの間に放出されたサイトカインと炎症性マーカーは血液脳関門に移動し、その伝染性を高め、脳に浸潤する。
神経学的合併症とその可能性のあるメカニズム
頭痛
いくつかの研究で、COVID-19患者では頭痛が一般的な初期症状であることが報告されている [8, 29]。痛みはほとんどがテンポ-頭頂部または額に向かって前方に報告された。最初に示唆されたメカニズムは、鼻腔内に存在する三叉神経終末へのウイルスの直接侵入であった。第二に、三叉神経血管の活性化は、内皮細胞上に存在するACE2受容体を介して起こる可能性があり、これも頭痛を引き起こす可能性がある。第三に、COVID-19の間に放出されるサイトカインおよびプロ炎症性メディエーターもまた、頭痛の原因となりうる血管周囲三叉神経終末を誘発しうる[53]。
脳血管イベント
COVID-19における過炎症反応によるインターロイキン(IL-6,IL-7)C反応性タンパク質(CRP)および他の炎症性マーカーのレベルの上昇は、すでに存在するアテローム性動脈硬化性プラークをより破裂しやすくする[54]。もう一つのメカニズムは、ウイルスがこれらの受容体に結合することでACE2が枯渇し、RAS(レニン-アンジオテンシン系)のバランスを崩して虚血イベントを引き起こす可能性があることである[55]。このACE2のダウンレギュレーションはまた、脳の自己調節機能障害につながる血管収縮を引き起こす可能性がある。これは血圧の上昇として現れ、動脈の破裂を引き起こして出血を引き起こす可能性がある [56]。
脱髄性疾患
システマティックレビューでは、急性脳脊髄炎は4例で報告されているが、急性骨髄炎は5例で報告されていると分析されている[57]。提案されたメカニズムは、COVID-19感染後の二次的な免疫過剰反応による骨髄炎である。COVID-19で放出されるサイトカインがこの疾患における脊髄の関与を説明する可能性がある。
脳炎
脳炎と診断された患者の脳脊髄液から SARS-CoV-2 RNA が検出された [59]。脳炎のメカニズムは2つの可能性が示唆されており、1つは嗅神経および三叉神経終末を介してSARS-CoV-2が中枢部に浸潤することである。もう一つの理由は、血液脳関門の伝染性を高め、中枢神経系に到達するプロ炎症性サイトカインによる浸潤である可能性がある [57]。
脳症
錯乱からせん妄へと進行し、昏睡や昏睡へと進行することは、重症化したCOVID-19患者における感覚の変化の症状である可能性がある[60]。重症のCOVID-19患者では、びまん性白質T2の過緊張と拡散の制限が報告されている。正確な原因はまだ明らかにされていないが、遅発性低酸素後白質脳症によるものではないかと提案されている。白質脳症は低酸素症後約10~14日後に起こると提案されており、これはオリゴデンドログリア細胞の死や脱髄にもつながる可能性がある。他の病因としては、脳の直接感染、感染後の脱髄、敗血症に伴う脳症などが考えられる [61]。報告されている急性壊死性脳症(ANE)は、SARS-CoV-2に関連したサイトカインストームによるものであると提案されている。プロ炎症性サイトカインのレベルが急激に上昇すると、血液脳関門の伝染性が高まり、浮腫や壊死を引き起こす可能性があるため、血液脳関門に損傷を与える。
発作
中枢神経系におけるウイルス感染およびその後の脳内炎症性経路の活性化は、発作閾値を低下させ、てんかん発症を促進することができる[63]。脳内の様々な炎症性マーカーの蓄積による局所的な皮質刺激も発作を引き起こす可能性がある。中枢神経系のウイルス性脳炎だけでなく、ウイルスの直接的な侵入も発作の他の原因となりうる [57, 64]。電解質や代謝の不均衡、低酸素症、炎症過程を呈する重篤な患者も、発作や異常な脳波を経験することがある [65]。
認知機能の低下および記憶喪失
先に述べたように、COVID-19感染後の短期記憶喪失や神経認知障害を報告している研究は少ない。主に提案されている神経変性のメカニズムは、慢性的な全身性炎症である[52]。ある研究では、認知機能障害を呈した患者における炎症性因子とC反応性蛋白(CRP)のレベルの相関関係を確立した。この研究は感染後2~3週間程度で行われたため、評価は短期的なものであった。炎症誘発性認知機能低下の適切な証拠を確立するためには、さらなる長期的な研究が必要である。また、COVID-19で入院した際の注意力の変化とCRP値の間に有意な相関関係があることも示されている[66]。
ギランバレー症候群
分子模倣は、病原体が末梢神経の構成要素に類似したエピトープを持つGBSのメカニズムである可能性が高い。宿主免疫系はウイルス感染と戦うために抗体を産生する。これらの抗体は交差反応して末梢神経に結合し、神経細胞の機能障害を引き起こす [57, 67]。
においおよび味覚の喪失
これらは、COVID-19の最初の症状のいくつかである。これらのメカニズムとして最も提案されているのは、SARS-CoV-2が嗅上皮のACE2受容体に結合し、嗅神経を介して嗅球に広がる神経細胞に入り込み、嗅覚の喪失を引き起こすというものである[60]。嗅覚喪失の頻度は高い。化学感覚障害を報告した者のうち、65%がその後にCOVID-19のPCR陽性を示した[68]。
神経筋接合部と骨格筋の異常
筋痛、全身筋肉痛および疲労はCOVID-19の一般的な症状である。筋損傷は、特にCOVID-19の重症例で多く認められた[8]。主な危険因子として提案されているのは、急性呼吸窮迫症候群(ARDS)敗血症、全身性炎症反応である。ACE2受容体は筋細胞にも存在するため、ウイルスが直接細胞に侵入して筋損傷を引き起こす可能性がある。過炎症性サイトカインストームもまた、免疫介在性の筋損傷を引き起こす可能性がある[69,70]。
NF-κBおよびNrf2経路に関連する神経合併症とその病態
NF-κB経路とCOVID-19
NF-κB (nuclear factor κ-light-chain-enhancer of activated B cells)転写因子ファミリーは、炎症につながる刺激のメカニズムを提供する多くの細胞シグナル伝達経路の多能性調節因子である。転写因子は、ニューロンの樹立の初期段階から発生する軸索や樹状突起の成長に影響を与える [71]。リポ多糖受容体複合体は、細胞外マトリックスに存在するトール様受容体とアダプタータンパク質によって形成される。シグナル経路はNF-κBの活性化につながる。血液脳関門は、中枢神経系への免疫原性細胞の侵入を防ぐ[72]。刺激された細胞は、カノニカルなNF-κB経路だけでなく、非カノニカルなNF-κB経路によっても制御される。また、NF-κB転写因子は神経細胞以外にもグリア細胞や脳血管にも豊富に存在し、NF-κBの多様な機能が神経細胞周囲の炎症反応を制御している。NF-κB転写因子は脳内に豊富に存在し、多様な機能を発揮している[73]。COVID-19 の病態は、以前に発見されたウイルス性疾患であるサイトメガロウイルス、MERS、水痘と類似している。同様に、COVID-19 は NF-κB 経路の活性化を引き起こす可能性があり、最終的には脳内血栓塞栓症に伴う脳卒中や神経障害を引き起こす可能性がある。高まった免疫応答は、特に、サイトカインストームは、顆粒球コロニー刺激因子におけるIL-6,IL-10,IFN-γ、およびTNF-αの上昇によって特徴付けられる[74]。自然免疫原性細胞および適応免疫原性細胞の遺伝的誘導はNF-κBの影響を受ける。規制緩和された活性化は、自己免疫性炎症およびインフラマソーム放出と関連して活性化されたT細胞を導く[75]。前臨床研究では、NF-κBは様々な炎症性メディエータの調節に影響を与えてた。パルテノリドのようなNF-κBの阻害剤を投与すると、感染症の減少が見られた。NF-κB の転写は、マイトジェンによって活性化されたプロテインキナーゼによってリン酸化された IκB の分解によってアンマスクされる[76]。アップレギュレーションされたプロ炎症性遺伝子は、過剰なサイトカインや活性酸素をもたらし、小脳の損傷や神経伝達物質に関連した神経原性障害を引き起こす[77]。
Nrf-2およびCOVID-19
Nrf2は塩基性ロイシン転写因子に属し、抗酸化遺伝子を発現することで酸化ストレスに影響を与えている[78]。Nrf2は細胞質に存在し、Nrf2の阻害因子として知られているkeap1と結合している。活性酸素が発生すると、Keap1とNrf2の複合体は解離し、その結果、Nrf2は核に向かって移動し、標的遺伝子を刺激して抗酸化作用を誘発し、その活性化により炎症からの保護が強化される[17]。ミトコンドリア経路に加えて、第1相および第2相薬物代謝酵素の発現がアップレギュレーションされることもこの経路の特徴である。アップレギュレーションされた標的遺伝子には、グルタチオンSトランスフェラーゼ、カタラーゼ、ヘムオキシゲナーゼ1,スーパーオキシドジスムターゼなどがある。これらは、酸化的分解からニューロンの機能を保護する。酸化的分解、炎症性アップレギュレーション、ミトコンドリアの機能不全を含むすべての主要な要因は、神経変性疾患のリスクにさらされる脳の老化に寄与している。Nrf2は、そのような病態に対する魅力的な有効性により、COVID-19感染症の場合に有益であることを証明することができる[79]。酸化種によって誘導されるストレスを消去するために、Nrf2は放出され、安定化され、トランスロケーションされる。Nrf2は、オンオフスイッチとして作用し、内因性の抗酸化緩和をもたらす。ホスホイノシトール-3キナーゼ、プロテインキナーゼ、膵臓濃縮キナーゼのようないくつかのキナーゼもまた、Nrf2活性の調節因子として作用する[80]。マイトジェン活性化プロテインキナーゼは、細胞外で調節されたプロテインキナーゼを含む酵素である。それらは、プロリンアミノ酸のすぐ隣に存在するアミノ酸セリン、スレオニン残基上のリン酸化反応を触媒する。マイトジェン活性化プロテインキナーゼ経路は、酸化ストレスに応答して働き、Nrf2経路の誘導に示唆されている[81]。シグナルは細胞外制御キナーゼとマイトジェン活性化キナーゼによって媒介され、そのシグナルはグルタミン酸システインリガーゼ調節サブユニット遺伝子のアップレギュレーションに達し、Nrf2の核内転座に影響を与える。Nrf2とKeap1は直接標的にされないが、マイトジェン活性化キナーゼはNrf2の核内への転座に直接関与している[82]。
NF-κB と Nrf2 パスウェイの間のクロストーク
ウイルスが宿主内部で複製された後、自然免疫原性反応により、多くの炎症性メディエーター、すなわちマクロファージや樹状細胞が活性化され、サイトカインや活性酸素種に対抗する。活性酸素と炎症性サイトカインは赤血球を傷つけ、ヘムと遊離イオンを放出する。呼吸バーストは、最終的に酸化ストレスを引き起こすスーパーオキシドラジカルと過酸化水素を発生させる。サイトカインストームは、NF-κB経路を介したサイトカイン発現のアップレギュレーションの結果である。このストームは、組織に深刻な損傷を与える原因となる[83]。
アストロサイトにスクラッチ傷害を誘導した研究では、この傷害がNF-κB活性のアップレギュレーションを引き起こし、その結果、IL-6,IL-1β、TNF-α、およびMMP9(炎症過程を悪化させるマトリックスメタロペプチダーゼ9-ゼラチナーゼ)の過剰発現をもたらすことが明らかになった。この過剰発現は、Nrf2ノックアウトアストロサイトでは野生型よりも悪化し、より多くのアストロサイトが死滅することが判明した[84]。別の実験では、Nrf2 欠損マウスは TNF-α 刺激でより大きな炎症性遺伝子の発現を示した。LPS(リポ多糖)活性化後のNF-κB活性化は、Nrf2欠損マウスの肺、MEF(マウス胚性線維芽細胞)腹膜マクロファージにおいても高いことがわかった。これらはまた、TNF-αまたはLPSに反応してより高いIKKキナーゼ活性を示した[85]。これらの研究は、Nrf2とNF-κBの間の相互作用の可能性を指摘している。これらの経路が転写レベルでお互いに抑制効果を発揮することが提案されている。このクロストークは、Nrf2 が NF-κB を阻害する場合と、その逆の場合の両方が考えられる。
Nrf2は、酸化ストレスに応答して多数の抗酸化酵素および細胞保護酵素を産生する[86]。その一つであるHO-1(ヘモオキシゲナーゼ-1)は、ヘム中のポルフィリン環を一酸化炭素、Fe2+、ビリルビンに変換するビリベルジンに開裂する触媒として作用し、ヘムの代謝に関与している[87]。ある研究では、内皮細胞におけるHO-1の過剰発現は、TNF-α誘導性の炎症性接着分子発現(E-selectinおよびVCAM-1(血管細胞接着タンパク質1))を阻害することが示された。この阻害は、転写速度を阻害することによってmRNAレベルであることが判明した[88]。これは、Nrf2経路がHO-1発現を増加させることでNF-κB経路の活性化を阻害し、サイトカイン放出を減少させるというクロストークの一つの方法を表している。また、酸化ストレスはIKK(IκBキナーゼ)を活性化させ、NF-κBの阻害因子であるIκBをさらにリン酸化し、ポリユビキチン化を媒介としたプロテアソーム分解を引き起こし、NF-κBを放出させる。核に移行し、炎症性遺伝子の転写につながる。Nrf2経路は、IκB-αの分解を阻害し、その安定化とNF-κB介在性の転写を阻害する。したがって、プロ炎症性サイトカインの放出は抑制される[86]。
NF-κB はまた、Nrf2 媒介の ARE (antioxidant response element) 発現を調節することができる。ARE は Nrf2 の作用のためのゲノムの部位であり、NF-κB の常用サブユニットである p65 は ARE を介して遺伝子の発現を抑制する効果を発揮することができる[87]。CBP(CREB結合タンパク質)-p300複合体は、内在性ヒストンアセチルトランスフェラーゼ活性を有するNrf2の転写共活性化因子である。これによりヒストンのアセチル化が起こり、クロマチン構造が緩み、DNAが転写活性のために露出する[87]。ある研究では、NF-κB/p65 が ARE 遺伝子の転写を減少させ、CBP を減少させ、HDAC3(ヒストン脱アセチル化酵素 3)の ARE 領域へのリクルートを促進することで、Nrf2-ARE 経路に拮抗することが示されている[89]。このことは、酸化ストレスやサイトカインストームが亢進した場合にNF-κBの活性化がNrf2経路を抑制するという見方を強めている。
Nrf2が結合した形で細胞質に存在するKeap1は、IKKβをネガティブに制御することがわかっている。HSP90(ヒートショックプロテイン90)は、タンパク質の折り畳みを助けるシャペロンタンパク質である。Keap1は、オートファジー分解の引き金となるIKKβへのHSP90の結合を阻害することが観察されている。また、Keap1はリン酸基と結合する残基を隠すことでIKKβのリン酸化を減少させる。この全体の相互作用の結果、IKKβがリン酸化されないためにIκB-αが安定化され、その結果、NF-κBシグナリングが減少することになる[87, 90]。図5は、神経学的合併症につながるCOVID-19感染によって媒介されるNF-κBとNrf2経路の間のクロストークを示す。
図5 COVID-19 感染による NF-κB と Nrf2 パスウェイのクロストークが神経学的合併症を引き起こす
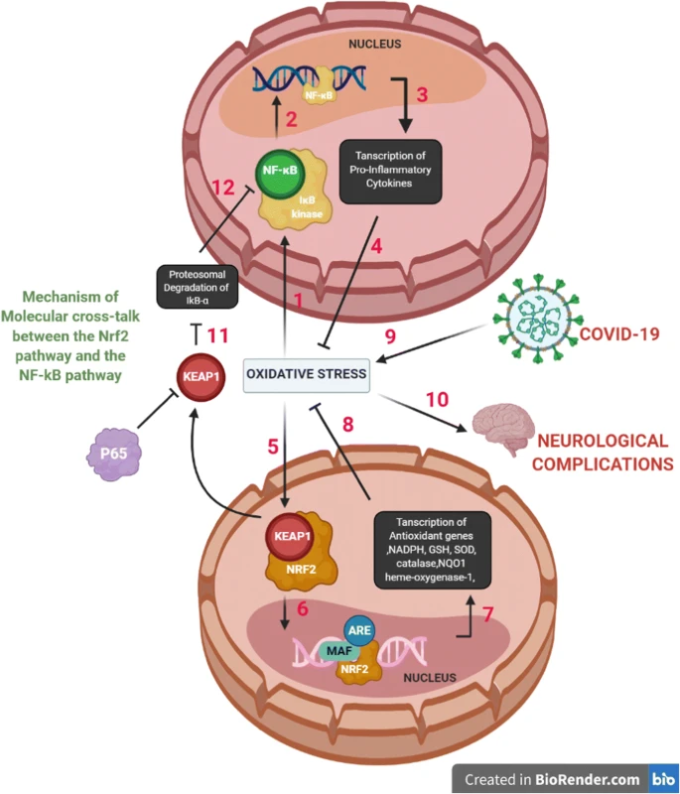
(1) 酸化ストレス/サイトカインストームの亢進は、IKβキナーゼの活性化をもたらし、NF-κB阻害剤であるIkB-αのリン酸化を引き起こし、IkB-αのプロテアソーム分解をもたらす。(2) NF-κBは核内に移行した後、その領域であるp65サブユニットに結合し、p65はKEAP1の阻害剤となる。(3) これにより、プロ炎症性サイトカインや、TNF-α、IL-β、IL-6,iNOS、COX-2などの遺伝子が転写される。(4)NF-kB経路とそれに寄与するプロ炎症性サイトカインが酸化状態を悪化させる。(5)酸化ストレスはNrf2シグナル伝達経路の活性化をもたらし、その結果、Nrf2はその阻害剤であるKeap1から解離する。(6) その後、Nrf2は核に移動し、Mafタンパク質や抗酸化応答エレメント(ARE)と結合する。(7)抗酸化遺伝子やNADPH、GSH、SOD、カタラーゼ、ヘムオキシゲナーゼ-1,NQO1などの第二相酵素の転写が起こり、活性酸素を抑制する。(8) 全体的に、遺伝子介入とそれに伴う転写は、Nrf2経路が酸化ストレスを軽減することを示している。(9) COVID-19感染は酸化ストレスを誘導する。(10)酸化ストレスは神経学的合併症を引き起こす。(11)遊離Keap1はIkB-αの分解を防ぐ。(12) NF-kB経路の阻害
自己免疫疾患の既往歴のある患者はCOVID-19の重大なリスクがある。ウイルスを緩和するための免疫抑制剤の投与により、自己免疫への関心が暗示されている[91]。調節性T細胞の機能不全は、多くの自己免疫疾患の原因と考えられてきた。Nrf2がKeap1(Kelch-like ECH-associated protein 1)によって全身的に活性化されると、組織の炎症が増強される。一方、そのノックダウンは、T細胞およびサイトカイン産生を減少させる。Nrf2誘導は、調節性T細胞の機能不全を緩和し、特に後者がさらにストレスを受けるCOVID-19の場合には、自己免疫疾患を緩和することができる[92]。NF-κBは、自己免疫攻撃における炎症を促進するとともに、免疫原性耐性を媒介する役割を持っている。NF-κB は調節性 T 細胞の形成を促進し、胸腺に位置する自己反応性 T 細胞を削除する役割を果たしている。このように、NF-κB は免疫恒常性の維持と COVID-19 で引き起こされる自己免疫の予防に中心的な役割を果たしている [93]。
NF-κB および Nrf2 経路に作用する各種モジュレーター
COVID-19は、患者の免疫細胞が攻撃されてサイトカインストームが起こるのが特徴である。治療の主力は抗ウイルス剤の使用である。免疫調節剤は、合成およびハーブの両方とも、ウイルスの攻撃の重篤な影響に対処し、解決する上で適切である。これらの免疫調節剤は、既存のアプローチとの相乗効果で作用し、補助療法または予防として作用する[94]。Nrf2およびNF-κB経路は、COVID-19における炎症性病理の発生および進行に関与している。したがって、これらの重要なシグナル伝達経路間のクロストークを標的とした免疫調節剤は、この致命的なパンデミックに取り組む上で革新的なアプローチを提供し、COVID-19に関連する神経学的合併症に取り組む上で一筋の光明を示している。表1 は、Nrf2 と NF-κB パスウェイ間のクロストークを標的とする薬剤の包括的な要約を示している。図6は、COVID-19に対する有望なモジュレーション剤を示している。
表1 Nrf2 と NF-κB パスウェイ間のクロストークを標的とした薬剤の概要
| ドラッグ | 分類 | アクション | 参照 |
|---|---|---|---|
| デキサメタゾン | Nrf-2アゴニスト糖質コルチコイド | 増強されたIκB発現、NF-κBは細胞質に保持されます。 | [ 95 ] |
| *レムデシビル | Nrf-2アゴニスト | 減少したdsRNA | [ 96 ] |
| N-アセチルシステイン | NF-κBアンタゴニスト、アミノ酸誘導体 | IκBのダウンレギュレートされたリン酸化 | [ 97 ] |
| フマル酸ジメチル | NF-κB拮抗薬、フマル酸のジメチルエステル | Nrf2依存性およびNrf2非依存性経路による炎症の軽減 | [ 17 ] |
| エピガロカテキン3-ガレート | Nrf-2アゴニスト | 細胞内へのSARS-CoV-2Sタンパク質の侵入を可能にするプロテアーゼ酵素である阻害されたフューリン | [ 17 ] |
| 4-オクチル-イタコン酸 | Nrf-2アゴニスト | 炎症誘発性サイトカインの放出を阻害した | [ 98 ] |
| オメガ3脂肪酸 | NF-κB拮抗薬、α-リノレン酸 | 炎症マーカーの減少と抗酸化能の増加 | [ 99 ] |
| 大豆イソフラボン | NF-κB拮抗薬、フラボノイド | 上腕血流を介した拡張の増加、抗酸化マーカーの改善 | [ 79 ] |
| カルノシン酸 | NF-κBアンタゴニスト、ジテルペノイド | 樹状突起の脊椎喪失の減少、記憶力と学習の改善 | [ 100 ] |
| クルクミン | Nrf-2アゴニスト、ジアリールヘプタノイド、 | 活性化されたNrf2経路およびHO-1やNQO1などの標的遺伝子の誘導発現による抗酸化効果 | [ 101 ] |
| レスベラトロール | Nrf-2アゴニスト、天然ポリフェノール | Keap1の遮断によりNrf2シグナル伝達を刺激した。 | [ 102 ] |
| バルドキソロンメチル | Nrf-2アゴニスト、半合成トリテルペノイド | NRF2転写の増加による酸化ストレスからの細胞および組織の保護 | [ 103 ] |
| スルファサラジン | NF-κB拮抗薬、疾患修飾性抗リウマチ薬 | IκBαのリン酸化を阻害し、NF-κBの活性化を阻害しました | [ 104 ] |
| メサラミン | Nrf-2アゴニスト、疾患修飾性抗リウマチ薬 | 翻訳後修飾の阻害 | [ 104 ] |
| チオフェナセタミド | NF-κBアンタゴニスト、チオフェン | NF-κBのp65サブユニットに特異的に結合し、DNAとNF-κBの結合を阻害しました | [ 105 ] |
| ニンニク | Nrf-2アゴニスト | 活性化されたNrf2-抗酸化応答要素(ARE)経路。 | [ 106 ] |
| ケルセチン | NF-κB拮抗薬、フラボノイド | 阻害されたマクロファージ炎症性タンパク質2、TNF誘導インターフェロンガンマ誘導性タンパク質 | [ 107 ] |
| オシマムサンクタム | NF-κBアンタゴニスト | サイトカイン、IL-6、TNF-α、MIP-1α、MCP-1の阻害された遺伝子発現 | [ 108 ] |
| ヒドロキシケイ皮酸 | NF-κBアンタゴニスト | NF-κBの阻害されたDNA結合 | [ 104 ] |
| ニクロサミド | Nrf-2アゴニスト | p62のAMPKを介したリン酸化 | [ 109 ] |
| リコピン | NF-κBアンタゴニスト | カッパBリン酸化の阻害剤 | [ 110 ] |
| β-カロテン | NF-κBアンタゴニスト | 活性酸素種を除去する | [ 111 ] |
| リトナビル | NF-κBアンタゴニスト | Aktリン酸化を減少させる | [ 112 ] |
| カルコン | Nrf-2アゴニスト | Nrf2依存性酵素の発現を誘導する | [ 113 ] |
| 人参 | Nrf-2アゴニスト | Nrf2タンパク質の発現を増加させる | [ 114 ] |
| フェノフィブラート | Nrf-2アゴニスト | p62依存のKeap1分解を通じてNrf2を活性化する | [ 115 ] |
図6 COVID-19に対する有望な調節剤

視点と結論
COVID-19は 2020年3月11日にWHOからパンデミックのステータスを受けた。2019年12月に中国の武漢で最初の症例が発生して以来、この病気は長い道のりを歩んでおり、症例数と死亡者数は日々急増している。酸化ストレスと炎症性サイトカインストームは、この致命的なウイルスに関する病理学の重要な特徴である。議論されている多くの研究は、患者の重度の神経学的合併症を示唆する実質的な証拠を指摘している。様々な薬剤が、治療法のための緊急の必要性に対応するために再利用されていた。ワクチンの開発と早期承認は、世界中で急ピッチで進められている。地球の市民が効果的なワクチンを待っている間、この致命的な疾患に対応するための革新的な治療アプローチのための悲惨な必要性がある。両方、NF-κB と Nrf2 シグナル経路の間のクロストークは、COVID-19 患者の神経学的合併症の中心にある。合成および天然の両方の免疫調節剤は、前述の経路で標的とされる病態に対応する上で有望な候補となり得る。免疫調節剤は、既存のアプローチと相乗効果を発揮し、補助的な治療や予防として作用し、酸化ストレスを特異的に標的とすることで既存のアプローチを凌駕し、結果的に重度の神経障害につながる病態を根絶し、弱体化させることができる。
