Contents
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8006026/
オンラインで2021年3月9日に公開
リューディガー・ハードランド(Rüdiger Hardeland)
アレハンドロ・ロメロ・マルティネス(学術編集者
概要
メラトニンは、様々な目的で臨床前および臨床で使用されている。その中には、概日リズムの再調整に関連するものもあれば、メラトニン受容体MT1およびMT2の飽和を超える量を使用するものもあり、時間生物学的な目的には適していない。
メラトニンを時間生物学的に適切に利用するための条件や、高濃度での保護作用について概説している。概日リズムの再調整には、受容体の親和性に応じて、mg以下の用量が必要である。しかし、これには位相応答曲線を考慮する必要がある。位相応答曲線には、サイレントゾーン、遅延部、移行点、前進部がある。
注目すべきは、サイレントゾーンにある薄明かりメラトニンオンセット(DLMO)である。この段階では、メラトニンは入眠を誘導することができるが、概日マスタークロックはシフトしない。睡眠の開始も概日リズムの制御下にあるが、この時点で睡眠と概日リズムの感受性は切り離されている。
睡眠効果の限界としては、投与量、作用時間、個人の反応の悪さなどが挙げられる。特に敗血症やウイルス性疾患における抗酸化作用や抗炎症作用を目的とした数百mgまでの高用量のメラトニンの使用は、メラトニンの組織レベル、ミトコンドリアでの形成、フリーラジカルの解毒などの観点から検討する必要がある。
* *
キーワード:サーカディアン、エントレインメント、炎症、メラトニン、ミトコンドリア、受容体飽和度
1. はじめに
メラトニンは、前臨床的にも臨床的にも、数多くの病気や障害に対する保護薬として試験されてきた。しかし、前臨床試験では、メラトニンの生理的役割が十分に証明されているにもかかわらず、その一部しか使用されていない。実際、大部分の研究は異なる分野である抗酸化保護に焦点を当てており、時間生物学的に意味のある方法で適用できる量よりもかなり高い量を使用していた。時間生物学的側面と抗酸化的側面の間の相互関係が明らかになることもあるが[1,2]、異なる用量の適合性は依然として懸念事項であり、混乱を招いている。
* *
メラトニンの時間生物学的役割は古くから確立されている。メラトニンの主な分泌源は、哺乳類、鳥類、その他様々な脊椎動物の松果体であり、松果体はこの化合物を概日的に合成・放出し、夜間に顕著な最大値を示す[3,4,5,6]。しかし、これは季節的に繁殖する生物に優先的に関係するが、人間にとってはわずかな重要性しかない[7]。
哺乳類では、主に夜間に分泌されるメラトニンは、概日マスタークロックである視交叉上核(SCN)によって操縦され、ニューロン接続を介して松果体に伝達される[5,6,8]。さらに,メラトニンの形成は,SCNへの入力経路[9,10]と松果体への入力経路[11]によって調節される。
松果体からは、メラトニンが循環系と、松果体の凹部を経由して脳の第3脳室に、さらに高濃度で放出される[12,13,14]。何十年もの間、メラトニンの役割は、「暗闇」という信号をすべてではないにしても多くの器官に伝達することにあると考えられてきた[5,15,16]。
それによって、概日リズムのマルチオシレーターシステム内の望ましくない逸脱が修正され、多様な概日リズムの内部同期化と外部からの時間の合図への同調の両方に貢献することになる[17,18]。また、メラトニンがSCNに直接作用して、概日リズムの位相を変化させることも示唆されており、これはメラトニンの時間生物学的役割として知られている[19,20,21,22]。
循環しているメラトニンが時間生物学的作用の主な原因であると考えられていたが、最近の証拠では、メラトニンが第三脳室に放出され、そこからメラトニンが隣接するSCNに直接アクセスすることが、さらに重要であると考えられている[23,24]。
* *
しかし、これらの時間生物学的考察は、メラトニンが松果体でのみ生成されるのではなく、他の器官、おそらくすべての器官でも生成されるという重要な事実を無視している[25,26]。松果体以外の組織に存在する量は全く無視できるものではなく、むしろ松果体や循環系に存在する量を桁違いに上回っている[25,27,28,29]。
このことは昔からよく知られているが、多くの研究者はこの点を見逃している。そのため、「松果体がメラトニンの主な合成場所です」という誤った記述をよく目にする。実際には、松果体は循環しているメラトニンの主要な供給源にすぎず、組織のメラトニンは通常の状態ではあまり放出されない [25,30]。
* *
メラトニンは体内の様々な場所で合成されており、松果体よりもはるかに大量に合成されているという事実は、メラトニンの生理的役割を時空間生物学的な側面を超えた形で定義する必要性を示している。組織のメラトニンの概日変化は、松果体や循環系のそれよりもはるかに小さいか、あるいはほとんど存在しないため、このことはより重要だ[25,30,31]。
メラトニンを用いて人間を治療するという点では、時間生物学を超えた別の応用分野が開かれている。特に、外因性に投与されたメラトニンによる抗酸化保護の分野では有効である。詳細は後述するが、酸化的損傷を防止するために、はるかに高用量が適用されている。
このような治療法は、長年にわたって極めて生理的ではないと考えられてきたが、現在では別の意味で受け入れられるようになっている。このような観点から、投与量を議論し、組織の損傷を防ぐための正当な高用量と時間生物学的な要求とを比較することは、否定できない必要性があると思われる。
2. 時空間生物学的治療の基礎。
受容体親和性、薬物動態、位相応答曲線
哺乳類では,MT1とMT2という2つのGタンパク質共役型受容体(GPCR)[32,33]が,既知のメラトニンの受容体を介した作用のほとんどを決定している。これらの受容体の発現,調節,および下流経路の詳細については,別の場所で発表されている[25,34,35,36]。
一般的に、受容体の親和性はリガンドの生理的レベルに対応していなければならず、リガンドの変化に応じてアップレギュレーションとダウンレギュレーションの両方を可能にするために、せいぜいリガンド濃度が中程度に上昇した範囲で半飽和状態になる程度である。
メラトニンが血流を介して標的細胞に輸送される限り、半飽和度は血漿中の最大レベル(≦1nM)よりも低くなければならないことになる。実際、ヒトのMT1とMT2のpKi値は、研究によって多少の違いはあるものの、ほとんどがそれぞれ10と9.5の範囲であることが判明している[37,38]。
したがって,概日リズムや睡眠などの概日関連機能をリセットするには,血漿中のメラトニン濃度が0.1〜1nMの範囲にあることが必要である。投与量を算出するには、バイオアベイラビリティを考慮する必要がある。バイオアベイラビリティは、取り込み(投与経路による)代謝破壊(特に肝初回通過代謝による排泄)体内分布によって制限される。
代謝破壊と排泄の結果、通常の用量で経口投与された即時放出型メラトニン(1~3mg)の半減期は、循環系ではかなり短く、ほとんどが20~30分、時には45分程度とされている[39,40]。
しかし、クリアランスの値は投与量および投与経路によって異なる。投与量を10 mgに増やした場合[41]や、直腸や膣内投与などの他の投与経路を試した場合[42]には、半減期が長くなることが報告されている。循環系におけるメラトニンの存在感を高めるためには、もちろん高用量を使用することが可能であるが、一過性の受容体の過飽和を犠牲にしなければならない。これが適切であるかどうかは議論の対象となっている。別の場所で議論されているように[36]、過飽和状態のGPCRは、C末端の修飾とβ-アレスチンの結合により内在化することができる。MT2ではいくつかのケースで内在化が証明されたが、MT1の場合はその証拠がかなり弱いままであった[36]。
* *
他の結合部位を介したMT1/MT2に依存しない作用も原理的には可能であるが、その関連性は医学的な文脈では十分に検討されていない。さらに、頻繁に引用されてきたそのような作用のうちのいくつかは、依然として不確かであるか、あるいは却下されている。
以前、「メラトニン受容体MT3」として議論されたタンパク質は、NRH:キノン酸化還元酵素2(NQO2;別名キノン還元酵素2,QR2)という酵素として同定された[43,44,45]。しかし,NQO2はメラトニンによって活性化されず,むしろ阻害され,既知のシグナル伝達経路を開始せず,メラトニンに対して十分な特異性を持っていない。
そのため,受容体としての必要条件を満たしていない[25]。レチノイドオーファン受容体(ROR),特にRORα,その他のスプライス変異株やホモログなどの転写因子は,多くの論文で核内メラトニン受容体として検討されてきたが,適度な濃度ではメラトニンと結合しないことが判明している[46,47,48]。
メラトニンの結合は、カルレティキュリンと、カルレティキュリンに相同性のある2つの核内タンパク質でも報告されており[49]、チューブリンでも報告されている[50,51]が、時間生物学的効果との関係を示す証拠は今のところない。
このことは、カルモデュリン(CaM)の結合部位についても同様であると思われるが[52]、カルモデュリンの結合部位については、より詳細に研究されている。しかし、親和性の観点から、その関連性が議論されている[32]。CaMへの結合だけでは生理的役割を果たすには不十分かもしれないが、Ca2+/CaMで活性化される酵素と結合してコンフォメーションが変化すると、その親和性はかなり高くなるようだ[53]。CaMを介したメラトニンの作用は、様々な細胞機能の概日変化に関与している可能性があるが、概日振動子の位相リセットに関与しているという証拠はない。
* *
時間生物学的有効性に基本的に関連するもう一つのポイントは、概日サイクル内のタイミングに関するものである。生化学的シグナルを含め、どのような時間的手掛かりによる位相のリセットも、投与された時点に依存する。この依存性は、通常、位相応答曲線(PRC)として記述される。
これは、概日周期内での位相変化の程度と方向として、その限りで非常に重要である。PRCには通常、遅延部分と前進部分があり、その間には実質的な変化が起こらないサイレントゾーンがある。メラトニンのPRCは、人間の場合(図1)視力のある人とない人で決定されている[19,54,55,56]。
PRCの詳細をよく見ると、よく読まれている「就寝30分前にメラトニンを摂取する」という推奨は、リセットするには不十分なままであることがわかる。この時間帯に低用量のメラトニンを投与すると、むしろ確実に入眠を誘導することができるが、これではまだ概日時計をシフトさせることはできない[22]。
通常、概日の基準点とされる薄明かりメラトニンオンセット(DLMO)の概日位相は、通常、概日時間14時間(CT14)付近に見られるが[22]、これは、位相シフトが起こらない拡張サイレントゾーン内にある(図1)。
PRCの遅延部分は,通常,その数時間後に始まり,CT22付近で最大値に達する。遅延から前進への変化を示すCT2付近の移行点を経て、最大の前進はCT6,つまり早朝に観測される。これらの詳細から得られる教訓は、フェイズシフトと睡眠開始を混同しないことである[22]。ただし、睡眠開始も概日リズムの制御下にあり、SCNは睡眠誘導にも関与している[57,58,59,60]。
図1 位相応答曲線(PRC)によるメラトニンによる位相のリセット
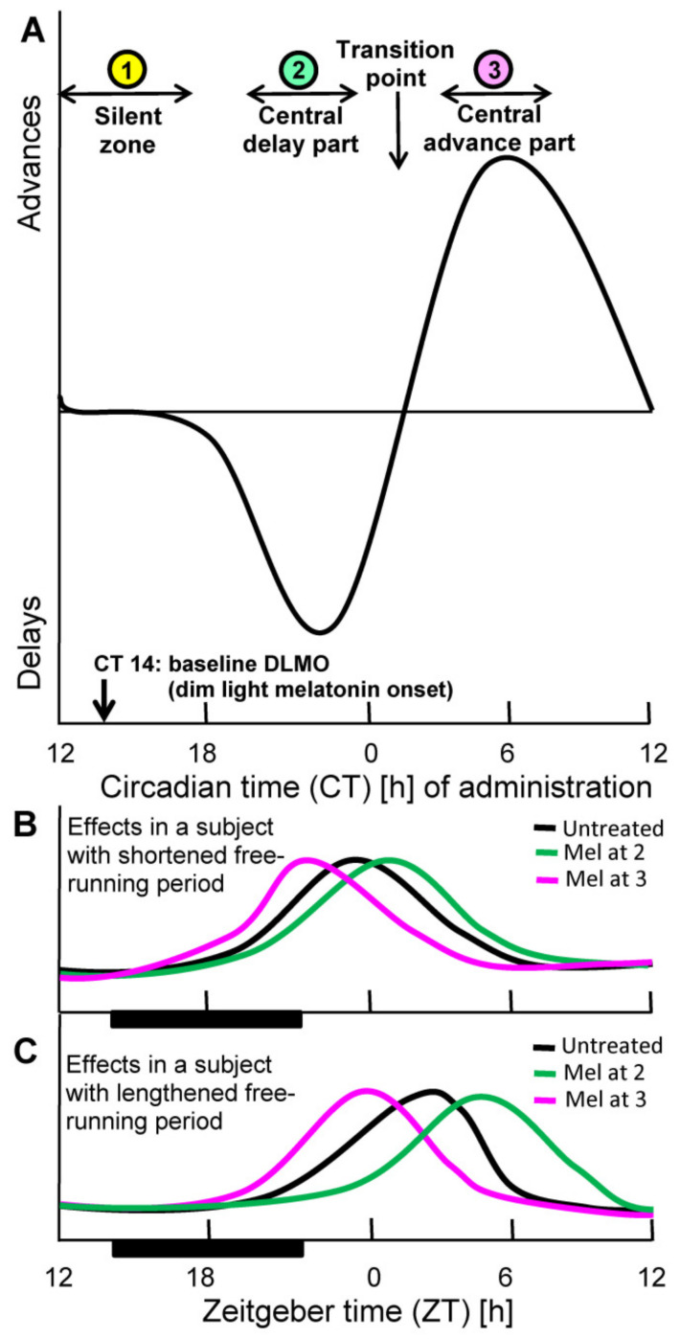
(A): 低用量の即時放出型メラトニンに対するヒトPRCの模式図。この曲線は,Lewyらが0.25 mgのメラトニンで得たデータに基づいている[26]。原理の理解を助けるため,オリジナルのデータは省略している。
注目すべきは、このようなPRC曲線の位相シフトの程度(ここでは非常に数時間の範囲)やその他の詳細も用量に依存していることである。しかし,10mgのような高用量では,PRCの振幅は必ずしも大きくならず,むしろ小さくなる可能性がある[61]。
PRCは,自発期間の位相をサーカディアンタイム(CT)に換算したフリーランニング条件下で決定される(フリーランニングの1サイクル=24主観時間)。リセット能力の影響は、拘束された状態でも検出可能であり、最大値などのサーカディアンリズムの顕著な特徴の位相位置の変化によって明らかになる。
(B,C): 自発期間が短い被験者(B)と長い被験者(C)を対象に、PRCの異なる位相でメラトニンの効果を予測したが、明暗サイクルの同期条件下では(黒棒:暗闇)。同期条件下では,時間はツァイトゲーバー時間(ZT)として標準化されており,12:12時間の明暗サイクルでは,ZT 0が光の開始に対応し,明暗サイクルがずれている場合は,ZTが暗期の中間に調整される。なお、わかりやすくするために、朝に最大となるような概念的なリズムを描いている。
本当はSCNの振動子遺伝子のリズムが望ましいのであるが、ヒトではそのようなデータはない。他のヒトの細胞や組織における振動子遺伝子のリズムも報告されているが、前臨床試験では、その位相が組織間で大きくずれていることがわかっており、適切ではない。
* *
注目すべきは、PRCの形態が用量に依存することである。高用量では、上昇したメラトニンの存在がPRCの大部分を覆い、異なる機能を持つ部分が統合される。例えば、就寝時に高用量を投与し、数時間以内にクリアされない場合、血中濃度の上昇が遅延部分にまで及んでしまうと、位相の遅延を引き起こす可能性がある。
しかし、より適切なタイミングで投与し、遅延相の途中でSCNの概日振動子を叩くことができれば、より効率的である。SCN内の異なる相の統合という問題は、実際、メラトニンの投与量が多い場合は少ない場合よりも同調能力が低くなることにつながる[54,62]。
同調の文脈では、同調信号の形態もその有効性に関係することを考慮に入れるべきである。別の場所で説明したように[22]、概日リズムの発振器は、信号の恒久的な高さとの関係を記述するパラメトリックなものよりも、急激な増加を特徴とするいわゆるノンパラメトリックな信号の方がより効果的であることに敏感である。
メラトニンの場合、パラメトリックな指標は最終的に到達した濃度になる。そのため、緩やかな増加であっても、より高いレベルに向かってゆっくりと増加するよりも、むしろ急激な増加の方が効果的な場合がある。
したがって、メラトニンをDLMO前後に投与して遅延部分まで投与した場合の効果は、PRCの遅延部分の直前または開始時に投与したよりも低いがより適切なタイミングで投与した場合よりも劣ることが予想される。
3. 組織および器官のメラトニン
多くの症例でメラトニンの組織濃度が測定されているが[26,27,28,29,30]、まだすべての臓器ではない。それにもかかわらず、既存のデータは、組織のメラトニンが基本的に重要であることを明確に示している。ここでは、体のさまざまな部位に関する利用可能なデータをすべてまとめるのではなく、この洞察の重要な結果を取り上げる。
ここ数年で特に注目されているのは、ミトコンドリアでのメラトニン合成と、その結果としてのミトコンドリアおよび細胞質でのメラトニン濃度である。メラトニンのミトコンドリア形成は,細胞生物学的に確立された仮説として最初に提案されたが,ネズミの卵母細胞で初めて実証され[64],より詳細にはラットの脳で実証された[31],続いて脈絡叢に関するさらなる証拠が示され[65],皮膚についても同様の仮説が示された[66]。
メラトニンとミトコンドリアの関係および植物分野での同様の知見の詳細については、ref. [67]。 特に、メラトニンの濃度は、脊椎動物の細胞の他のコンパートメントよりもミトコンドリアで高いことが分かっている[67,68]。
メラトニンは、ミトコンドリア内での合成に加えて、静脈注射などで外因性に投与されると、これらのオルガネラに蓄積されることがある。このことは,自由に動き回るラットにおいて,メラトニンを昼間に継続的に注入して夜間のレベルにし,その分布を[3H]標識画分で追跡した際に,説得力をもって示されている[61]。最近では,SARS-CoV2などのウイルスがミトコンドリアをハイジャックしたことで,ミトコンドリアでのメラトニン生成が注目されている[69]。
組織のメラトニンの関連性、ほとんどの臓器からの放出量の少なさ、ミトコンドリア-シトソーリック間の濃度勾配などから、研究者たちは、以前からよく言われていた、すべての膜を容易に通過する自由拡散性の分子という仮定を捨てなければならなくなった。
この仮定は、メラトニンの両親媒性と人工脂質二重膜で得られたデータに基づいていた[70,71]。しかし、ほとんどの組織からの放出率が低いことから、メラトニンは細胞から出ることはできないが、本当に簡単に細胞に入るのかという疑問が生じた[30]。
もしこれが非受容体タンパク質によるメラトニンの封じ込めによるものでなければ、ほぼ自由に拡散するというのは間違っていたことになる。実際、メラトニンの細胞膜への取り込みは、GLU/SLC2A(solute carrier 2A)型のトランスポーターによって促進されることが明らかになっている[72,73]。
SLC2Aはスーパーファミリーの1つであるため,より具体的なサブタイプの特徴を明らかにすることが望まれる。なぜなら,SLC2Aタンパク質はグルコースの輸送体として知られており,血中濃度がかなり高いためにメラトニンに勝る可能性のある化合物だからである。
したがって、メラトニンの取り込みに関与するSLC2Aサブフォームは、おそらくグルコースに対する親和性が低いと考えられる。少なくとも、典型的なユニポーターであるSLC2Aタンパク質が関与していることで、メラトニンがうまく放出されないにもかかわらず、輸入される理由が説明できる。
メラトニンの細胞質からミトコンドリアへの取り込みは、PEPT1/2トランスポーターによるものとされているが[74]、これもまた、その作用がプロトン駆動であることから、広く一方向性の輸送を説明することになる。
* *
以上のことから、ミトコンドリアにおけるメラトニン濃度の高さに関する知見は、細胞内受容体の問題を提起している。実際,神経細胞のミトコンドリア外膜にMT1が存在することが報告されている[31]。
また,胃内皮細胞では,MT1とMT2の両方がミトコンドリア膜に存在することが確認されている[75]。もし、ミトコンドリアに存在するメラトニン受容体が、細胞膜に存在するものと同じ親和性を持ち、修飾によってこの点が変化しないのであれば、メラトニンによる調節は、循環系と同じ濃度範囲で行われなければならないことになる。
メラトニンが細胞質または膜間から受容体に入る限り [76]、メラトニンが、必要な補酵素が存在する合成部位であるミトコンドリアマトリックスから大量に放出されない限り、これは問題にならないかもしれない。しかし、高用量のメラトニンを投与するなどして受容体の飽和状態を超えて濃度が上昇した場合、MT1および/またはMT2を介した効果は、飽和状態に近いレベルでの効果を超えることはできないと考えられる。しかし、多くの研究では、飽和濃度をはるかに超えるはずの用量を使用している。このようなアプローチは、生理的な調節範囲を超えているように思われたため、長年、多くの研究者に疑問視されてきた。
* *
しかし、メラトニンには重要な特性があるため、このような判断は早計だったかもしれない。例えば,メラトニンはミトコンドリア遷移伝染性孔(mtPTP)と相互作用し,阻害や開口時間の短縮を引き起こすが [77,78,79],この効果は受容体の飽和よりも高濃度(µMレベル [77]よりもやや低い)を必要とする。
さらに,活性酸素種と直接相互作用する[80,81,82,83]。もちろん、メラトニンによる抗酸化保護は、フリーラジカルの消去に限らず、受容体を介した様々な他の効果から成り立っている[25,84,85]。しかし、スカベンジャーとしての特性は、受容体の飽和を超えて、保護効果を桁違いに増加させることができる。
実際、MT1/MT2のダブルノックアウトマウスでは、脳虚血による神経細胞の損傷に対する抗酸化保護が可能であることが記録されている[86]。高濃度メラトニンの有効性と有用性を裏付けるためには、このようなデータがもっと望まれる。
4. 機関および研究者によるメラトニンの許容性に関する対照的な判断
多くの研究者や臨床医の間では、メラトニンは特に注意が必要な薬剤として考えられているようである。これにはいくつかの理由が考えられる。まず、血中のメラトニン濃度が低いことから、外因性投与でこの濃度を超えてはいけないと考えられているようである。
しかし、唯一の生理学的指標である血中濃度を考慮すると、組織内のメラトニンの量が多いことは無視されてしまう。第二に、メラトニンは以前、避妊薬などの生殖生物学を阻害する目的で研究的に使用されていたが[87,88]、明らかに懸念される問題となっている。
メラトニンは、季節的に繁殖する生物の生殖を効果的に制御するが[89,90,91]、プロラクチン分泌にいくつかの影響があるにもかかわらず、非季節的に繁殖する人間との同等の関連性は検出されていない[92]。メラトニンの避妊効果は、合成黄体ホルモンであるノルエチステロンとの相乗効果にほぼ集約されている[87]。
第3に、メラトニンの長期投与により、ヒトの男性の精子数が減少することが報告されているが、これはごく少数の人にしか観察されなかった[93]。これらを総合すると、睡眠改善などの治療のためにメラトニンを慎重に検討することになった。
この決定は、ラメルテオン(8mg)やアゴメラチン(25または50mg)などの合成メラトニン作動薬の承認用量がはるかに高いこととは対照的であるが、これらの化合物はより高い、または同様の受容体親和性を示しており[60,94]、特にアゴメラチンの場合は毒性が懸念されている[95]。
もちろん、1mg以下の非常に中等度のメラトニン量でも、入眠潜時の短縮には十分であるが[22,96]、2または3mgのような承認された量では、夜通しの睡眠維持には不十分である。睡眠維持を改善するためには、50mgや100mgといった高用量が提案されている[97]。50mgの用量が時折使用され、一定の成功を収めている[98]。
* *
日周調節の治療には低用量しか認められていないが、保護の目的ではかなり高用量が使用されている(セクション5参照)。実際、十分な保護効果を得るためには、生理的濃度を超える強いメラトニン濃度が必要であった。メラトニンの優れた忍容性は、ALS患者を対象とした研究で証明されており、患者は1日300mgのメラトニンの座薬を最長2年間使用した[99]。
バイオアベイラビリティーの観点からは、直腸に投与することで初回通過代謝による損失が少なくなるため、この用量は経口投与の場合の同量よりも高くすべきである[100,101]。さらに高用量の1g/日が皮膚科および内分泌科の患者に1ヶ月間投与されたが、重篤な副作用は見られなかった[102]。
同様に、動物のウイルス性疾患や新生児の敗血症の治療に成功した様々な研究においても、高用量が適用されており、その内容については別の項でまとめられている[100]。用量換算によると,体重75kgの成人には600mg/日が推奨されており,最大5回の部分投与で経口投与されることになっている[100].この用量は,COVID-19における炎症性サイトカインストームとそれに伴う凝固障害およびミトコンドリア障害を抑制するために提案された[100]。
他の論文でも、100~400mg[103]や約600mg[104]といった高めの用量が推奨されている。肝切除に関する研究では、メラトニンの安全マージンは75kgの人で3750mg/dと決定された[105]。
これらのデータを総合すると、少なくとも、一過性の概日リズム障害や内分泌バランスの乱れの可能性よりも、患者の救出が圧倒的に重要な生命の危機に瀕した状況下では、概日リズム障害、睡眠障害、うつ病の治療薬として承認されている用量よりも、桁違いに高用量のメラトニンが可能であり、許容できることが明らかになった。
5. 時間生物学的治療法と非時間生物学的治療法の理論的根拠
メラトニンは多くの効果を発揮する単一の化合物に過ぎないが、様々な分野での作用をすべて同一視するのは間違い。この意見は、主に異なる器官への多面的な作用を指しているのではなく[25]、機能的な分野、特に概日調節、抑うつ効果、細胞保護を指している。これらの分野には間違いなく相互関連があるが、投与量とタイミングに関しては区別することが重要だと思われる。
* *
睡眠は、睡眠導入を含め、概日系によって制御されているが、それだけではない。特に、睡眠時間や睡眠の質が不十分な場合に生じる睡眠への恒常的な働き [96,106,107]や、感染症に伴う免疫学的な睡眠誘導を考慮しなければならない [108,109]。
もちろん、これらの異なる影響は、重なり合ったり、相互に干渉したりすることもある [107,110,111]。さらに、メラトニンも概日リズムと免疫学的調節の両方に関与している[25,110,111,112,113]。しかし、メラトニンの睡眠に対する作用は、一般的に概日系を介して行われるわけではない。
いわゆる睡眠ゲートの開放は概日リズムの制御下にあるが、メラトニンによる睡眠誘導は必ずしも位相シフトと関連していない[22]。これらの考察の結果、概日マスタークロックおよびSCNによって直接制御される機能に対する効果は、一見したところ、受容体飽和前後またはそれよりもやや低い低用量のメラトニン、すなわち1〜3mgの経口投与で達成することができる。
これは、他のMT1またはMT2を介した機能についても同様に判断することができる。特に、睡眠導入潜時の短縮には、1mg以下でもそのような低用量が必要であることが経験的に示されている[96]。
* *
しかし、これらの結論にはいくつかの実用的な限界がある。その1つは、循環におけるメラトニンの半減期の短さに関するものである。効果をより長く持続させたい場合、短時間作用型の製剤では十分ではない。長時間作用型の錠剤でも、十分に満足できるものではないかもしれない[60]。
第2の限界は,PRCの見落とされがちな特性に起因する。まず、メラトニンは、DLMOの周辺では位相の変化が乏しい[19,22]。そのため、位相シフトを行うには、セクション2で説明したように、PRCの遅延部または前進部でメラトニンを上昇させる必要がある。
第2に、人間がメラトニンによって達成する位相シフトの範囲はかなり低く、通常の状態ではごく数時間の範囲にとどまる。しかし、位相シフトが望まれる条件を、(1)緊張している人、(2)経度的な飛行などで失調したことのある人、(3)緊張していない人、例えば盲目の人、に区別することは重要である。
* *
条件(1)の場合、メラトニンで可能な小さなシフトは、PRCに従って時間的に適切な適用が必要である。就寝時に短時間作用型の製剤を使用する場合は、遅延部分まで十分な量を投与する必要がある。これは、患者の概日リズムの乱れが自由行動期(=自発期)の短縮につながっている場合に、特に推奨される方法である。
このような状況は、特に双極性タイプのうつ病性障害では珍しくなく、期間の短縮がミスアライメントを引き起こす[114]。自由行動期間が短くなると、拘束された状態では、活動やその他の身体機能の開始が早まる。周期の拡大は,したがって,それぞれのサーカディアンリズムの位相位置の正常化につながる。
一見すると、活動/休息サイクルの短縮がなぜ問題になるのかわからないかもしれない。このシステムは、SCNとの結合が異なる多数の周辺振動子から構成されており[17,115]、そのため、解離して内部の非同期化を引き起こす可能性がある[17,114]。
このような内部のずれは、健康問題を引き起こすと考えられている[116,117]。しかし、周期の概日逸脱は、自発的な周期の伸長のためにも存在し、同様に内部のずれや気分障害につながる。したがって、期間の延長によって引き起こされる双極性障害の患者は、期間の短縮を必要とし、それは事前のシフトによって達成することができる。
これらは、夜の終わりにPRCの前段で投与されるメラトニンによって可能となる[19,22]。この場合、メラトニンの作用を延長する必要がないため、かなり少量のメラトニンで十分である。
なぜなら、最大の前進は通常、夜の終わりと一致するからである。さらに、メラトニンの上昇は、その鎮静作用のために朝には望ましくない。注目すべきは、メラトニンが適切なタイミングで分泌されると、遅延シフトと前進シフトの両方を必要に応じて起こすことができることである。この点で、頻繁に処方される抗うつ薬であるリチウムとは区別される。リチウムは自発期間を拡大するため、自発期間が短い場合には適しているが、自発期間がとにかく長い患者には逆効果となる[114]。したがって、双極性障害の患者にメラトニンを投与する前に、生理の長さのずれを示す概日位相の位置を決定することが強く推奨される。この薬剤は、単なる従来の抗うつ剤ではなく、その時間生物学的特性を考慮する必要がある[114]。重要なのは、1回の位相シフトでは逸脱期間の永久的な修正には不十分であり、反復が必要であるが、メラトニンのような忍容性の高い化合物であれば問題はない。
条件(2)では、メラトニンはリズムの再トレーニングに成功している[20,21,118,119,120]。しかし、時差ぼけの治療に関する経験は多岐にわたっている。多くの人が否定的な結果を出しているのは、ある程度、時間生物学的な根拠を無視していることと関係がある。
まず、メラトニンのPRCによると、経度的なフライトによる大きな位相のずれは、メラトニンの1回の投与では補正できず、せいぜい数時間のずれにとどまることが明らかになっている。したがって、メラトニンは時差ぼけを即座に修正するものではなく、繰り返し使用することで適応を促進することができる[118,119]。第2に、時差ぼけの治療を成功させるためには、体内リズムを望ましい方向にシフトさせるためにPRCを考慮する必要がある。
第3に、時差ぼけは、マルチオシレーターシステム内の解離に起因する部分がある。例えば,活動/休息サイクルは,体温のリズムから簡単に切り離すことができる。この観察は,かつて内部の非同期化の発見につながった[121]。人間の活動/休息サイクルは、体温リズムに比べて、可能な自発的期間の範囲がかなり広い(時には30時間以上)。
その結果、前者は後者よりも簡単に同調することができる。筆者は、トランスメリディアン・フライトの2日後に活動リズムがほぼ完全に再調律されたのに対し、通常は夕方に見られる体温の最大値が数日間にわたって朝のままであったことから、この違いを個人的に経験した。
メラトニンによって多振動系の一部の振動子が同期するという証拠はあるものの、同調の具体的な速度に関する十分な情報はなく、このギャップを埋めることが必要である。最後に、移動中やその後の新しい環境下で経験する明暗パターンも適応の結果に寄与する。
一般的に、(1)と(2)の条件では、光によるリセットまたは再同期を常に考慮する必要がある。このことは、メラトニンと光の併用療法にも利用できる。メラノプシンを発現している網膜神経節細胞による光の知覚を考慮して、それぞれのPRCに応じて適切な段階で適用されるべきである[114]。
* *
条件(3)では、光不感症の非訓練盲人はもちろん、リセットに適した任意の段階でメラトニンによる治療を容易に行うことができる。メラトニンの有用性は、いくつかのケースで実証されている[54,55,62,118]。ここでも、低用量で十分であり、セクション2で述べたように、10mgのような高用量は低用量よりも効率が悪い[62]。
* *
低用量のメラトニンは,主に2つの目的,すなわち,(a)気分療法を含む概日リズムのリセット,(b)入眠の促進,に適用できる。しかし、完全な睡眠の継続には期待できない。このことは、少なくとも、睡眠障害の強い人、特に高齢者においては明らかである。
従来の用量である2~3mgのメラトニンで、睡眠時間や睡眠の質の改善は得られるが、完全な睡眠維持という目的は実質的に達成されていない[60,122,123,124]。ラメルテオンのような合成メラトニン作動薬は、この点においてメラトニンよりもやや効率的であるが、この記述はすべての合成メラトニン作動薬にも有効である[60,69,125]。
睡眠維持をより効果的にサポートするために、メラトニン50または100mgのような高用量が提案されているが[97]、十分に大規模な臨床研究にはまだ適用されていない。代替案としては、特にメラトニンの分泌が著しく低下している患者に使用するために、一晩中をほぼカバーするようなかなり徐放性の製剤が考えられる。
しかし、この可能性についても懐疑的な見方が残っているかもしれない。Weishauptらの研究[99]では、患者を毎日300mgのメラトニン坐薬で最長2年間治療したが、メラトニンは比較的ゆっくりと放出され、血中濃度はかなり持続的に上昇したが、被験者の約半数だけが睡眠継続の改善を報告し、他の被験者は報告しなかった。
これは、治療を受けた人が重篤な疾患に罹患していたことを意味している。しかし、このことは、不眠症の研究でメラトニンを使用する際の主要な、そしてほとんど対処されていない問題、すなわち、治療を必要とする睡眠障害の原因が特定されていないことを示唆しているが、これは特に高齢者や病気の被験者に見られる。これらの原因は、概日リズムや松果体機能障害とは全く異なる可能性があり、おそらく多くの高齢者、特にいくつかの合併症やポリファーマシーを持つ高齢者では未確認のままであると考えられる。
* *
セクション4で述べたように、メラトニンは概日リズムの再調整や入眠促進に必要な濃度よりもはるかに高い濃度で使用することができる。しかし、このような治療によって長期にわたる受容体の過飽和状態が引き起こされるとすぐに、これらの用量による実質的な概日効果を期待することはできない。
メラトニン作動性シグナルが恒常的に増強された場合、PRCのさまざまな部分が影響を受け、それらが統合されて、正味の位相シフト効果が減少するか、消滅する可能性があると想定される。しかし、永久的な過飽和状態の結果として、ヒトにおいて受容体の脱感作が起こるかどうか、あるいはどの程度起こるかについては、まだ十分に研究されていない。
一方、鎮静の観点から観察される高濃度メラトニンによる作用には、メラトニンまたはその代謝物であるN1-アセチル-5-メトキシキヌラミン(AMK)のいずれかによるCaM媒介nNOS活性化の阻害など、MT1およびMT2活性化以外の作用も含まれる可能性がある[126,127,128]。
さらに、イオンチャネルへの影響も考えられるが、そのほとんどはMT1またはMT2シグナルに起因するものであり、そのような影響を得るためには、多くの研究で強い過飽和用量が必要とされている。アプローチの違いや用量反応性の検討がなされていないことを考えると、この可能性について詳細に議論するのは時期尚早であろう。
* *
受容体の過飽和状態が長く続くと、中枢および末梢の概日リズムに対するメラトニンの効果がなくなると考えられるが、メラトニンのシグナルサイクルがないからといって、概日リズムに強い影響があるわけではない。これは特にSCNの振動子について有効であろう。
いくつかの変化を完全に排除することができないにせよ、概日振動子の持続的な循環は可能性が高い。この点で、高用量、あるいは超高用量のメラトニンを適用することは、概日時計をひどく乱すことの注意点として捉えるべきではない。いずれにしても、超高用量のメラトニンは、通常、重篤な病気を治療したり、患者を生命の危機から救ったりするために適用される。このような状況では、概日リズムの問題は後退しなければならない。
強力な高用量は,概日リズムの調節やGPCRシグナリング以外のメラトニンの付加的な特性を利用する場合に特に適用される。例えば,mtPTPへの結合(mtPTPは1μMよりわずかに低い濃度で半飽和状態になる)[77]や,フリーラジカルの消去(他の抗酸化剤が効かなくなる濃度で効果を発揮する)などが挙げられる。
最も破壊的な酸化性フリーラジカルへの高い親和性とは別に、メラトニンの他の2つの顕著な特性を考慮する必要がある。1つ目は、これらの反応で、進行するプロオキシダントラジカル反応連鎖を開始しない代謝物を形成することであり[84,129]、2つ目は、ラジカルスカベンジャーカスケードを開始することである。このカスケードは、最初に4つの連続した反応について説明され[130]、後に10の無害化されたラジカルにまで拡大された[131]。
* *
高濃度を必要とするこれらのラジカル解毒作用の関連性は、合成メラトニン作動薬の有効性の限界にも光を当てている。メラトニンがフリーラジカルを効率的に除去し、プロオキシダント反応連鎖を起こさないという好ましい特性を持つものはないが、これはインドール類にも明確に言えることであり、一方、いくつかの非インドール性作動薬は除去能力が低いか、プロオキシダント代謝物を生成すると結論づけることができる[60,95,125]。さらに,メラトニンのような極めて高い忍容性を示すアゴニストは他にはないと思われる。
6. 結論
メラトニンは様々な目的で使用することができ、投与量も非常に広範囲にわたる。作用がGPCR MT1またはMT2に依存する限り、循環するメラトニンの生理的範囲で半飽和状態にある受容体親和性によれば、数mgまたは1mg以下の低用量で十分である。
このことは、特に入眠の誘導や、概日リズムの位相シフトや周期の長さの調節などの時間生物学的効果に当てはまる。また、大部分の臓器に関わる他の多くの生理機能の調節にも関連している。さらに、抗酸化酵素のアップレギュレーションや、MT1/MT2依存の免疫機能の制御なども含まれる。
これらの生理学的作用の多くは、概日振動系の変化とは必ずしも関連していないが、メラトニンのこれらの作用は通常、リズム制御に対応している。この基本的な重要性については、しばしば見落とされている。このメッセージは、リズム機能に対する作用は、概日振動子の変化と同じではないということである。
* *
この違いは、メラトニンのPRCを見ると特によくわかる。発振器の位相変化は、特定の適用段階でのみ可能であり、その範囲と重要な方向性の両方に関して変化する。PRCのサイレントゾーンでは、メラトニンは発振器を大幅にシフトさせることはないが、暗闇を示すメッセージを伝えることは十分可能である[22]。この最も顕著な例は、サイレントゾーンでうまく機能する睡眠開始の誘導である。
* *
低用量のメラトニンに敏感な生理学的パラメータはいくつかあるが、機能不全の場合は十分に改善されない。例えば、睡眠維持に対するメラトニンの有効性は比較的低い。これはある程度、循環系におけるメラトニンの半減期の短さと関係している可能性があり、複数の研究者が結論づけているように、長時間作用型のメラトニン作動薬や徐放性製剤が作られるようになった。
統計的に明らかな総睡眠時間と睡眠の質の改善が報告されていたが、通常、一晩中の完全な睡眠の継続は観察されなかった。睡眠維持をさらに改善するために高用量(50または100mg)を提案し適用することは妥当であり、部分的には成功した[97,98]。
しかし、300mgのような高用量の経腸投与でも、治療を受けたコホートのかなりの数の被験者で完全な睡眠維持が保証されなかった[99]。言い換えれば、メラトニンは単なる睡眠薬ではない。睡眠を改善しようとしても、不眠症の病態生理学的原因が問題となる。このことは、合成メラトニン作動薬にも当てはまる。
* *
しかし、高用量のメラトニン(最大600mg、または用量換算による動物での各量)は、特に虚血、ウイルスまたは細菌感染、敗血症からの救出を含む抗酸化および抗炎症治療の目的で適用することに成功している[86,100,105,133,134,135,136,137,138,139,140,141,142,143]。
死に至る可能性のある急性疾患から生命を守るという目的は、治療によって概日系が阻害されるかどうかにかかわらず、高用量の使用を正当化するものである。しかし、メラトニンを概日系の一成分としか考えていない限り、時計の乱れは思ったほど深刻ではないかもしれない。
メラトニンが大量に分泌されても発振器が停止してしまうと考える理由はない。つまり、時計をシフトさせたり、周期をごくわずかに延長したりする化合物である。メラトニンには、投与量が増えても反応性の高い有害な中間体を解毒するという利点もあり、これは合成メラトニン作動薬にはない特性である。さらに、メラトニンの優れた忍容性も評価されるべきである。
