Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7432597/
Dietary Gluten and Neurodegeneration: A Case for Preclinical Studies
要旨
セリアック病(セリアック病)は主に腸管を侵す自己免疫疾患であるが、かなりの数の患者が神経学的障害を示すことを示す証拠が増えている。神経学的症状を呈するセリアック病患者の約40%は、神経組織トランスグルタミナーゼ-6(tTG6)に対する抗体を循環させている。神経学的機能障害を予防するために早期診断とグルテンフリー食(GFD)の厳格な遵守が推奨されているが、生活の質を全体的に向上させるためには、より良い治療戦略が必要とされている。
マイクロバイオータ-腸-脳軸の調節障害、抗tTG6抗体の存在、およびエピジェネティックなメカニズムは、病因に関与している。また、循環または腸由来の細胞外構造、および生体分子凝縮物および細胞外小胞を含む細胞外構造が、疾患の発症に寄与している可能性もある。
セリアック病、非セリアックグルテン過敏症(NCGS)および/または神経変性を有する個体における調節不能な腸内恒常性を形成するためのいくつかの道筋がある。GFDやプロバイオティクスに加えて、フィトや合成カンナビノイドなどの栄養補助食品は、より良い予後に向けて宿主マイクロバイオームを形成することができる新しいアプローチを表している。
最後に、我々は非ヒト霊長類(NHPs)を含む将来の前臨床研究のためのデータに基づいた根拠を提供し、植物性および合成カンナビノイドなどの栄養補助食品の効果を調査するために、単独またはGFDとの組み合わせで、食餌性グルテン誘発神経変性を予防/軽減する。
キーワード
グルテン、セリアック病、神経変性、組織トランスグルタミナーゼ2・6,アカゲザル、OCLN、PPARγ、カンナビノイド、バイオシス、生体分子凝縮物、細胞外小胞
1. はじめに
早くも1908年には、末梢神経炎、運動失調、脊髄の部分変性など、消化管「スプルー」患者の神経学的異常や合併症の最初の報告が出始めていた[1]。食餌性グルテン関連(セリアック)神経障害の最初の体系的な裏付けとなった証拠は、Cookeら[2]が電子顕微鏡とバイタル(H&E)染色の組み合わせを用いてセリアック病(セリアック病)の成人患者から採取した筋生検の神経変性病変を報告した1966年に遡る。その後、1962年には、57歳のセリアック病患者の神経疾患に起因する最初の死亡例が報告された[3]。この患者の死後の所見を、同じく進行性の中枢神経系(中枢神経系)障害を示した他の9例のセリアック症例と比較した。その結果、小脳、深部灰白質、脳幹、脊髄における進行性の神経変性が、これらの患者の共通の病理組織学的特徴であると結論づけられた [3]。また、47歳の脊髄小脳変性症患者を対象とした別の報告では、セリアック患者にグルテンフリー食(GFD)を投与することで、消化器症状だけでなく神経症状の安定化にも有益な効果があることが明らかにされた[4]。ミクロネシアの離島に住む人々を対象とした疫学調査では、伝統的なグレインフリー食と欧米型(グレインリッチ)食を食べている人々の間で、後者のグループでは統合失調症の発症率が有意に高いことが示されている[5]。それにもかかわらず、神経疾患とグルテンを含む食事の摂取との関連性を指摘した最初の報告の多くは、直接的な証拠や詳細な分析を欠いてた。
組織トランスグルタミナーゼ(tTGすなわち腸管組織トランスグルタミナーゼ-2(tTG2)の役割に関する多くの証拠がセリアック病の発症に関連して出現した後、ここ数十年で状況は変わり始めている[8]。tTG2はグルテン/グリアジンの脱アミド化/トランスアミド化過程での翻訳後修飾に加えて、自己抗原として機能し、それによってtTG2自己抗体の形成を誘導することが確立された。tTG2自己抗体の存在はほぼ100%のセリアック患者に見られるが、非セリアックグルテン過敏症(NCGS)患者ではごく一部にしか見られない[9]。tTGの神経アイソフォームであるtTG6の関与は、アルツハイマー病(AD)やハンチントン病(ハンチントン病)を含むいくつかの神経変性疾患の発症に示唆されており、tTG6は異常に蓄積されたアミロイドや微小管関連タンパク質の分解に寄与することが報告されている[10]。さらに、tTG6はグルテン失調症や多発性硬化症(MS)などの運動障害の病態に関与していることが示された[11,12,13,14]。また、成人の統合失調症患者においても、循環中の抗tTG6抗体の増加レベルが検出された[15]。最後に、自閉症スペクトラム障害(ASD)やダウン症(DS)と診断されたセリアック病およびNCGS患者のヒト白血球抗原(HLA)タイピングは、特定のHLAハプロタイプと腸-脳軸の調節障害との間に決定的かつ有意な関連性があることを示している[16,17,18]。
また、精神病や複数エピソードの統合失調症患者では、抗グリアジン抗体が高い割合で認められるが、必ずしも脱アミド化グリアジンやtTGに対する抗体(自己抗体)が高いわけではないことが示されており、グリアジンに対する神経免疫反応がセリアック病とNCGSで異なることが確認されている[19]。一方、抗グリアジン抗体のセリアック病予測値は比較的低い(~70~80%)ため、神経変性患者ではその存在はさらに少ない/予測できない可能性がある。さらに、抑制性神経伝達物質γ-アミノ酪酸の合成に重要なタンパク質であるグルタミン酸脱炭酸酵素(GAD)に対する抗体は、グルテン感受性の神経疾患患者には存在するが、セリアック病患者には存在しないことが明らかになった[20]。神経障害を持つセリアック患者の神経tTG6を認識する自己抗体に加えて、シナプシンI(神経細胞のシナプス小胞神経グリア細胞、プルキンエ細胞に反応する自己抗体が同定された[21,22,23]。
これらのことから、グルテンによる神経変性は、セリアック病とNCGSでは病態が異なる深刻な現象であることが明らかになった。グルテン失調症[12]や末梢神経障害[24]を有するセリアック病患者でTG6抗体の高値が検出されていることから、TG6はセリアック病の神経学的症状(中枢神経系と末梢神経系の両方)に重要な役割を果たしていると提案されている。NCGS患者ではtTG2/6が関与していないため、部分的に消化された免疫毒性のあるグルテンペプチドが全身循環に入り、血液脳関門を通過し、腸から脳に浸潤するHLA-DQ2/DQ8制限セリアック病4 T細胞とともにこれらのペプチドが、NCGS患者の中枢神経疾患を促進する炎症性サイトカインを産生する可能性が提案された[25,26,27,28]。あるいは、セリアック病およびNCGS患者からの生体分子凝縮物および細胞外小胞を含む循環または腸由来の細胞外構造物は、漏れのある腸管上皮バリアを利用して、それらの炎症性カーゴを脳に送達する可能性がある。
2. 結果
2.1. 前臨床試験のエビデンス
現在のところ、グルテンと神経変性との関連を示す前臨床証拠は限られている。実験用マウスでグルテン失調症を開発する試みにもかかわらず、そのような努力は限られていたか、成功しなかった[29,30]。
セリアック病の実験誘発アカゲザルモデル、すなわちグルテン感受性腸症(グルテン感受性腸症)を用いた研究では、いくつかのタイトジャンクションと、ヒトの血液脳関門でも発現していることが知られているゾヌリンやハプトグロビン-2などの関連タンパク質が、セリアックアカゲザルでは調節障害を受けていることが実証された[31]。セリアック病患者では、ゾヌリンやオクルーディンを含む腸管タイトジャンクションタンパク質の発現低下が、上皮透過性の亢進、すなわちリーキーガットと関連していた[32]。さらに、ゾヌリン受容体はハプトグロビン-2の前駆体として同定されている[28]。同様に、我々はセリアックマカクの十二指腸において、腸管タイトジャンクションタンパク質であるゾナオクルーデンス-1(ZO1)とクラウディン-1の有意なダウンレギュレーションを報告している[32]。最近の研究では、セリアックマカクの十二指腸上皮でオクルーディンタンパク質の発現が著しく低下していることを検出した(図1)。セリアックマカクの十二指腸上皮の先端側と基底側のオクルージンタンパク発現が完全に消失していることが認められた(図1A)が、健常対照のマカクでは基底側の高発現が認められた(図1B)。精神病患者を対象とした研究から得られた証拠は、血清ハプトグロビン-2のレベルの上昇を確認したもので、セリアックマカクから得られた知見と一致している[28,31]。セリアックマカクにおけるゾヌリンの調節障害および発現障害は、ゾヌリンとハプトグロビン-2の両方が血液脳関門の機能に悪影響を与える可能性があることを示唆している[28,31]。最後に、グルテンを含む食事を与えられたセリアックマカクでは、神経学的機能の異常に関連した一連の異常遺伝子も同定された [33]。セリアック病の神経学的形態に関連する可能性のある素因遺伝子は、メッセンジャーRNA(mRNA)プロファイリングによって同定された。CADPS2(ASDCAPN13(ADBACE2(AD、DSDSCR5(DSおよびPINK1(パーキンソン病(PD)[33]。これらのmRNAの発現レベルは、健康なマカクでは動揺しておらず、GFD上のセリアックマカクでは最小限にとどまっていた。これらの知見を裏付けるとさらに拡大するために、アカゲザルのセリアックモデルを採用したより多くのトランスレーショナル研究が必要とされている。
図1

セリアックマカクの十二指腸上皮では、オクルーディン(OCLN)タンパク質の発現が有意に減少している。すべてのパネルは、核染色(青)のためのOCLN(緑サイトケラチン(赤)およびTopro3とのトリプルラベルを含む。コロカリゼーションは黄色に見える。セリアックマカク(A)の十二指腸上皮(DE)のオクルーディンタンパク質(白矢印)染色の顕著な損失に注意してほしい。対照的に、オクルーディンタンパク質(B)の染色は、対照的なサルの十二指腸上皮で強い。両方のパネルの倍率は40×である。アカゲザルと交差反応するオクルーディン(Cat#LS-B2437)抗体は、Lifespan Biosciences, Seattle, WA, USAから購入した。
2.2. 食事性グルテン誘発性神経障害のメカニズム
tTG2活性の亢進は、遺伝的素因を持つ人では自己免疫反応やグルテン感受性腸症、すなわちセリアック病につながることが確立されている[34,35,36]。グルテン消化に加えて、tTGが介在するグルタミン脱アミド化は、一部のセリアック患者では、パーキンソン病、ハンチントン病、アルツハイマー病患者の神経変性の特徴の一つである脳βアミロイドの凝集を引き起こす可能性がある[37,38,39,40,41,42]。しかし、神経細胞の機能障害がセリアック病患者のすべての人に起こるのか、あるいはこれらの患者の一部に限定されているのかは明らかではない。tTGは腸内だけでなく、中枢神経系を含む全身組織で自己抗原として認識されること、脳のβアミロイド重合を引き起こすこと、炎症や癌の発生を促進することができることから、多くの疾患に対する魅力的な創薬標的となっている[36,37,39,43]。セリアック病の病態をよりよく理解し、tTG阻害剤の一部を治療薬として使用することを目的として、相当数の阻害剤、プローブ、基質が化学的に設計された [44,45]。しかし、これらの化合物を生体内試験でtTG関連疾患の治療に使用することは簡単ではなく、ヒトの疾患を忠実に再現したモデルを用いたトランスレーショナルバリデーションを徹底的に行う必要がある。さらに、tTGなどのセリアック病関連タンパク質の翻訳後修飾に対する微生物代謝異常の寄与は、腸-脳軸の機能に影響を与えることが示唆されている[46,47]。
2.3. マイクロRNAのエビデンス
マイクロRNA(miRNA)の役割を評価することは、セリアック病の発症に伴う炎症反応を制御する可能性を秘めた重要なエピジェネティックメカニズムであるため、セリアック病において大きな関心を集めている。miRNAは20〜23ヌクレオチド長の小さなRNA分子で、3’非翻訳領域(UTR)上の相同配列(miRNAシードヌクレオチド2〜7と3’UTRの間の相同塩基対)に結合することにより、遺伝子発現を転写後に調節する。miRNAは、細胞増殖、分化、アポトーシス、細胞シグナル伝達、免疫応答、炎症応答などの細胞内プロセスの大部分を制御することが知られているが、これらに限定されない。過去10年以上にわたり、セリアック病発症におけるmiRNAの役割は、腸生検や末梢血から分離された免疫細胞において研究されていた。十二指腸ピンチ生検を用いて、Magniら[48]は、重度の病理組織学的病変を有するセリアック病患者において、miR-192-5p、miR-31-5p、miR-338-3p、およびmiR-197の有意なダウンレギュレーションを同定した。miR-192-5pのダウンレギュレーションと一致するように、自然免疫応答に重要な役割を持ついくつかのバイオインフォマティクス的に予測された標的、すなわちケモカインC-X-Cモチーフリガンド2(CXCL2)とヌクレオチドオリゴマー化ドメイン2(NOD2)は、mRNAとタンパク質の両方のレベルで顕著なアップレギュレーションを示した。別の研究では、Vairaら[49]は、炎症によって誘発されたmiR-192-5pのダウンレギュレーションをさらに確認した。興味深いことに、miR-192-5pは潰瘍性大腸炎患者でもダウンレギュレーションされており、腸の恒常性維持に重要な役割を果たしていることが示唆されている[50]。さらに、miR-31-5p、miR-338-3p、miR-197の標的と予測されるフォークヘッドボックスP3(FOXP3Run関連転写因子1,インターロイキン-18も生検組織で有意に高い発現を示した。さらに最近では、miR-192/215とmiR-200ファミリーの発現が徐々に低下し、miR-17/92およびC19MCのmiRNAの発現が難治性セリアック病およびセリアック病を伴う腸管T細胞リンパ腫で上昇することが示されている[51]。これらのmiRNAのダウンレギュレーションの結果、構成性シグナル伝達物質および転写3(STAT3)活性化とMYCプロトオンコジーンBHLH転写因子(c-Myc)を介したがん化シグナル伝達と、難治性セリアック病およびその後のリンパ腫形成との関連が提案されている[51]。
miR-192-5pとは異なり、小児セリアック病ではmiR-449aの発現が有意に増加していた [52]。miR-449aの直接の標的として、ゴブレット細胞の増殖と分化に関わるNotch受容体1(NOTCH1)とクルッペル様因子4(KLF4)が検証された。その結果、miR-449aがNOTCH1とKLF4をネガティブに制御していることが明らかとなり、セリアック病患者の小腸では、杯細胞数が著しく減少していた。興味深いことに、miR-21およびmiR-31も小児セリアック病の循環非侵襲的バイオマーカーとして同定されている [53]。小児セリアック病患者の血清中にmiR-21の増加とmiR-31の減少が確認された。さらに、miR-21はIgA-tTG2自己抗体の存在と相関していた。
自然免疫応答遺伝子を標的とした研究とは別に、グルテン感受性腸症のアカゲザルモデルを用いた我々の研究では、miR-204の上昇が腸管タイトジャンクションタンパク質claudin-1を直接標的とすることが確認されており、その結果、セリアックマカクの十二指腸におけるタンパク発現が有意に低下していることが確認されている[32]。さらに、腸管の炎症は腸管バリアの破壊と相まって、顕著な腸内環境の異常を伴っていた[32]。腸管バリアの破壊は、腸内微生物および微生物の副産物の全身循環への移動を促進しうる。長年にわたるセリアック病の症例では、微生物の移動が長期化すると肝クリアランスを超えることがあり、それによってリポ多糖類(LPS)が蓄積し、血液脳関門を通過し、中枢神経系のミクログリア細胞を活性化して神経炎症や神経細胞の損傷を引き起こす可能性が高くなる(図2)。これらの知見から、セリアック病患者の腸内炎症を促進し、最終的には神経障害を引き起こす可能性のあるmiRNAを媒介するメカニズムが明らかになった。興味深いことに、我々が以前に発表した後天性免疫不全症候群(AIDS)のシミアン免疫不全ウイルス(SIV)感染アカゲザルモデルを用いた研究では、フィトカンナビノイドが抗炎症性miRNAの発現を誘導し、T細胞の増殖/活性化を抑制し、腸管タイトジャンクションタンパク質の発現を維持することで、腸管の炎症を抑制する能力があることが実証されている[54,55]。これらの後者の知見は、単独で、または他の免疫生物学的製剤と組み合わせて、食事性グルテン誘発性腸炎、上皮バリア障害、およびセリアック病患者の神経疾患を含む腸外合併症を軽減するための実行可能な栄養補助食品としてのカンナビノイドの可能性を強調している(図2)。
図2
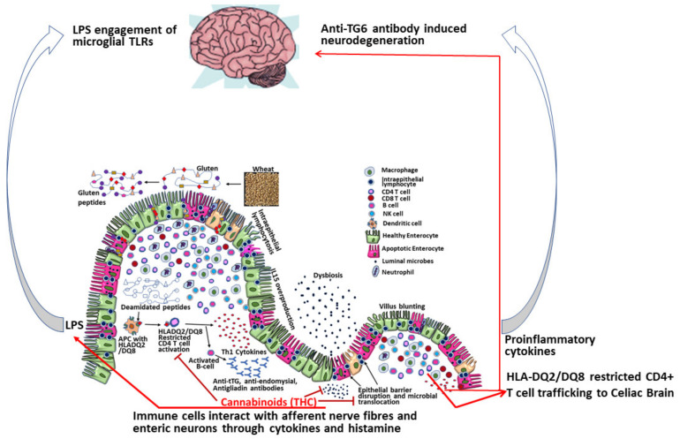
セリアック病患者における中枢神経系(中枢神経系)疾患の免疫病理学と、グルテン誘発の腸および中枢神経系炎症を緩和するための栄養補助食品としてのフィトカンナビノイドの潜在的な有益な(治療)役割。THC-δ-9-テトラヒドロカンナビノール; LPS-リポ多糖; TG6-トランスグルタミナーゼ-6; TLR-トール様受容体; APC-抗原提示細胞。
2.4. 腸内環境異常と神経変性の関連性
腸-脳軸の恒常性が、加齢の進行、肥満、食事、および薬物の使用に関連して乱される可能性があることが推測されている[26]。グルテンを含む食事の消費によって素因がある(セリアック病/NCGS)人に誘発される慢性的な腸内炎症は、腸の機能異常やリーキー腸と密接に関連している[32,54]。我々や他の研究者は、グルテンによる食餌性炎症や腸内環境異常が、神経炎症、認知、神経変性の遺伝的調節因子の摂動と関連していることを実証してきた[33,56,57]。分子機序学的な観点から、抗炎症(末梢、腸、神経炎症)効果[58]および抗ジスビオーシス効果[59]を有する重要な遺伝子であるペルオキシソーム増殖因子活性化受容体γ(PPARγ)の発現は、潰瘍性大腸炎[60]およびセリアック病[61,62,63]の患者においてかなり低下していることが知られている。Byndlossら[59]は、PPARγのダウンレギュレーションがEnterobacteriaceae(プロテオバクテリア属)に属する細菌のジスビオティック拡大と義務的嫌気性細菌の相対的な存在量の減少と関連していることを実証した。セリアック患者と同様に、我々はセリアックマカクの十二指腸上皮において、健康なコントロールマカク(図3B)と比較して著しく減少したPPARγの発現を検出した(図3A)。オクルージンタンパク質発現(図1A)と同様に、セリアックマカクの十二指腸上皮からのPPARγタンパク質発現のかなりの損失が検出された。したがって、PPARγのダウンレギュレーションは、セリアックマカクの腸内炎症およびそれに続く腸内環境異常を促進し、ひいてはセリアック病患者の腸内環境異常を促進する可能性がある。
図3
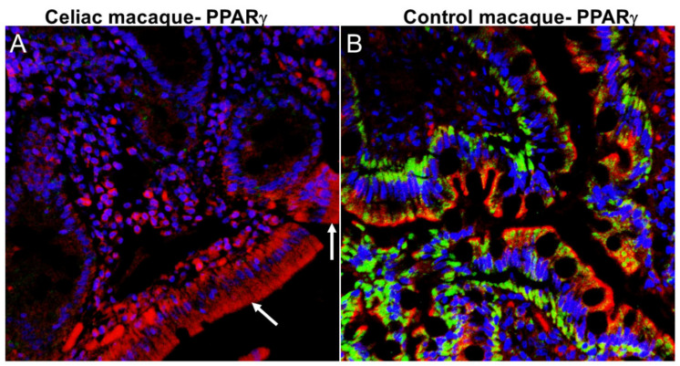
ペルオキシソーム増殖因子活性化因子受容体γ(PPARγ)タンパク質の発現は、セリアックマカクのDEで有意に減少している。すべてのパネルは、核染色(青)のためのPPARγ(緑サイトケラチン(赤)およびTopro3とのトリプルラベルを伴う。コロカリゼーションは黄色に見える。セリアックマカクのDEにおける顕著な損失PPARγ(A)(白矢印)染色に注意してほしい。対照的に、PPARγタンパク質(B)染色は、コントロールマカクのDEで強い。両パネルの倍率は40×。アカゲザルと交差反応するPPARγ(Cat#LS-B651-50)抗体は、Lifespan Biosciences, Seattle, WA, USAから購入した。
腸内環境異常に関連した神経障害は、GFDを厳格に遵守することによって解決できることを示唆するのは、単純化しすぎであろう。それにもかかわらず、罹患者の炎症経路と微生物の分類に関する研究は、すでに新しい予防と治療戦略の策定のための道を開いている[32]。したがって、それは自閉症や他の神経発達障害を持つ個人におけるジスビオーシスの寛解が、これらの疾患の治療の最初のステップである可能性が示唆された[64]。グルテンフリー食(GFD)は、セリアック患者におけるPPARγ発現の回復に成功を示しているが[62]、GFD上のセリアック病患者における腸内炎症の持続と相まってグルテン汚染のリスクは、より良い治療法を開発する必要性を強調している。したがって、慢性炎症を軽減し、腸管粘膜の治癒と修復を促進し、上皮バリアの完全性とマイクロバイオームを回復させることは、セリアック研究コミュニティの最優先事項である。PPARγは、炎症性腸疾患(IBD)患者において一般的に処方されている抗炎症性アミノサリチル酸塩の効果を伝達する主要な機能性受容体であることが報告されているため[65]、PPARγの発現を増強することは、グルテン誘発性腸炎の臨床管理のための有望なアプローチであると考えられる[66]。これに関連して、5-アミノサリチル酸(5-ASA)として知られるメサラジンは、新たにセリアックと診断された患者から得られた十二指腸生検のex vivo培養において、酸化バーストを減少させ、PPARγの発現を誘導することが示されている[66]。さらに、メサラジン処理はまた、核内因子κB(NFκB)および一酸化窒素を産生する酵素である一酸化窒素合成酵素2(NOS2)のタンパク質レベルを低下させた[66]。義務的嫌気性細菌は、PPARγシグナル伝達を活性化して宿主上皮細胞による硝酸塩および酸素電子受容体の産生を制限することで、Enterobacteriaceae(プロテオバクテリア属)に属する切片性嫌気性細菌の増殖を阻害することが示されている[59]。したがって、セリアック患者およびマカクにおけるPPARγシグナル伝達の減少は、NOS2の活性化を促進し、その結果、一酸化窒素の産生を増加させ、この一酸化窒素は腸管腔内で非毒性の硝酸塩に分解され、硝酸塩還元酵素をコードするEnterobacteriaceaeファミリーのメンバーに呼吸電子受容体として豊富に利用可能になる可能性がある。5-ASAは有効であったが、副作用も生じている[67]ことから、腸内の不衛生を減少させ、微生物産物が脳に到達して神経炎症性シグナル伝達を活性化するのを防ぐためにPPARγシグナル伝達を回復させ活性化する新しいアプローチを開発することが重要となっている。さらに、この文脈において、我々は最近、試験管内試験培養細胞株およびex vivo結腸移植培養物においてPPARγ発現を直接トランス活性化するカンナビノイドの能力を実証した[68]。最も注目すべきは、SIVに感染したアカゲザルのAIDSモデルを用いて、デルタ-9-テトラヒドロカンナビノール(THC)のような天然に入手可能な植物性カンナビノイドを長期的に制御された低用量で投与すると、腸の炎症[55]だけでなく、口腔内の小唾液腺の炎症も抑制されることを発見したことである[69]。具体的には、慢性的にSIVに感染したアカゲザルをTHCで治療した場合、口腔内微生物のホメオスタシスの維持に重要な口腔内細菌種の保存状態が良好であった(Mohan personal communication)。さらに、慢性的なTHCは、歯周炎に関連する病原性細菌の相対的な豊富さを有意に減少させた(Mohan個人的なコミュニケーション)。これらの知見は、腸や神経の炎症を抑制し、上皮バリアの完全性を回復させ、セリアックだけでなく、腸の他の慢性炎症性疾患における腸内細菌叢の異常を予防するための、安全でありながら薬理学的に実現可能な新しいアプローチを示すものであり、刺激的で有望なものである。
2.5. 細胞外構造物-生体分子凝縮物および細胞外ベシクルのセリアック病関連神経変性の発症における潜在的な役割
すべての細胞が細胞外構造物(細胞外構造物)の形で個別の生化学的環境を作り出しており、宿主の健康や病気を調節する複雑な生化学反応を組織化し、調整するために使用されていることがますます明らかになってきている。このレビューの目的のために、細胞外構造物は、2つのアーキタイプ、すなわち、i)膜なし生体分子凝縮物(生体分子凝縮体sおよびii)膜内包細胞外小胞(細胞外小胞s)から構成される非複製性の生物由来の細胞構造として定義されている。生体分子凝縮体は熱力学的に媒介された液液相-液相分離によって集合するが、液状の生体分子凝縮体は可逆的なアミロイド線維または不溶性の凝集体に変化することが知られている[70]。生体分子凝縮体生物学の詳細はまだ進化しているが、本質的に乱れた領域を持つRNAとタンパク質が、生体分子凝縮体sの細胞内組成、サイズ、および形態に影響を与える重要な因子であることが示されている[71,72]。生体分子凝縮体sとは異なり、細胞外小胞は少なくとも1つの膜を含む。細胞外小胞は、アポトーシス細胞の分解の産物として放出されるアポトーシス体、細胞表面からの膜小胞の外側への発芽と分裂によって生成されるマイクロベシクル、多胞体の逆発芽によって生成されるエキソソームなど、少なくとも3つの異なるサブタイプで構成されている[73,74]。これらの細胞外小胞サブタイプは大きさによって特徴づけられるが、大きさの範囲は重複している。アポトーシス体のサイズは一般的に大きく(500~4000 nmマイクロベシクルのサイズは通常50~2000 nmの範囲であり、ほとんどが200 nmより大きく、エキソソソームのサイズは30~100 nmである [75,76,77]。サイズの範囲にもかかわらず、異なる細胞、組織、および生物はサイズの異なる小胞を放出する。細胞外小胞のもう一つの特徴は、多様なタンパク質のサブセット、異なるRNA種(mRNA、miRNA、tRNAなどdsDNA、染色体外DNA、脂質、病原体由来の産物、違法薬物や認可薬物を含む生理活性カーゴを封入する能力である [78,79,80]。細胞外小胞の多様な性質、およびそのサイズと貨物組成の重複を考慮して、我々はアポトーシス体、マイクロベシクル、およびエクソソソームを包含するために細胞外小胞という用語を使用することにする。生体分子凝縮体と細胞外小胞の両方が、疾患、免疫学的、環境的な攻撃に対する宿主の応答を制御している。したがって、生体分子凝縮体は転写やストレス応答などの様々な生理的文脈で重要な役割を果たしており[81,82]、癌や神経変性疾患などの病態でも重要な役割を果たしている[83,84,85]。細胞外小胞 は遠位および近位の細胞間通信 [86,87,88] および細胞間の生物学的相互作用 [89,90,91] を媒介し、神経炎症 [92]、過敏性腸症候群 (IBS) [93]、そして潜在的には セリアック病 [94] に関与している。
2.6. 細胞外構造物と神経変性
細胞外構造物-生体分子凝縮体sと細胞外小胞は、様々な疾患の状況下で有益な役割と有害な役割の両方を果たす。中枢神経系の細胞成分と細胞成分の間の複雑なクロストークに依存する中枢神経系に関しては、生体分子凝縮体sと細胞外小胞は、炎症関連の神経変性疾患、例えば、アルツハイマー病、前頭側頭型認知症(FTD)、筋萎縮性側索硬化症(ALS)ハンチントン病、パーキンソン病などにおいて、抗炎症反応と抗炎症反応の両方を示すことが示されている。神経変性疾患が、細胞質または核内タンパク質の局所的な凝集の形で生体分子凝縮体を関与させていることは議論の余地がないが、これは神経変性を促進すると考えられている[95]。神経関連生体分子凝縮体の例としては、微小管関連タンパク質タウ(MAPT)の蛋白質集合体、43 kDaのRNA結合タンパク質タールDNA結合タンパク質(TDP-43)の細胞質包接体、肉腫(FUS)で融合したもの、およびポリグルタミン(polyQ)の集合体が挙げられる[96]。タウ凝集体はADに多く見られ、TDP-43とFUSはALSとFTDに多く見られ、ポリQはハンチントン病に多く見られる一方で、ポリQはハンチントン病に多く見られる[96]。興味深いことに、生体分子凝縮体の凝集体は、これらの疾患の進行性と一致して、ある脳領域から別の脳領域に広がると考えられている[97]。生体分子凝縮体と同様に、細胞外小胞も病因に関与しており、これらの膜構造は神経免疫相互作用に不可欠な要素である。例えば、中枢神経系由来の細胞外小胞は末梢循環に存在する[95,96]。中枢神経系の細胞外小胞は脳の神経免疫状態を評価する上で重要な役割を果たしている。例えば、中枢神経系損傷または神経変性疾患に対する炎症性反応の開始、伝播、および解決は、サイトカイン、miRNA、または微生物産物に依存していることが知られており、これらはすべて細胞外小胞に存在することが示されている[79,98,99,100,101,102]。さらに、細胞外小胞は末梢炎症性分子の中枢神経系への伝達を媒介する [103]。生体分子凝縮体sと細胞外小胞は構造と機能が異なるが、その機能には収束があるように思われる。生体分子凝縮体sと細胞外小胞の両方が、アミロイドβペプチド(Aβ)[104,105,106]とタウ[95,107]の存在などの神経免疫メカニズムによって病態が部分的に決定される神経変性疾患の病態形成に寄与することが示唆されている。
2.7. 細胞外構造物と腸脳関門
腸と脳は解剖学的には異なるが、これらの臓器間にはクロストークが存在し、腸内細菌叢由来の生体分子凝縮体や細胞外小胞が腸管免疫やその調節、脳との相互作用に重要な役割を果たしているのではないかという仮説を立てている。感染因子や合法・違法物質の使用による腸内マイクロバイオームの変化は、免疫応答の変化と関連している[108]。さらに、腸内細菌叢の異常は炎症性および代謝障害を促進する[109]。これらは、サッカリバクテリア(旧TM7,Akkermansia muciniphila、Bacteroides acidifaciens細菌[110]、またはBacteroides fragilis由来の細胞外小胞[111]など)の細胞外小胞に見られるように、腸または血液由来の生体分子凝縮体や細胞外小胞に刷り込まれている可能性がある。このように、細胞外構造物を基盤としたネットワークは、腸と脳をつなぐ役割を果たしている可能性がある。このような細胞外構造物の役割は、セリアック病関連の神経変性を含む神経変性の発症に寄与している可能性がある。
実際、Van Den Elsen[112]によってレビューされているように、腸内細菌叢は腸と脳のクロストークに影響を与える。複数の研究では、宿主およびマイクロバイオータ由来の細胞外小胞の両方が全身循環に入り、そのような細胞外小胞が血液脳関門(BBB)の両側の炎症性経路間のクロストークを媒介することが示されている[113,114]。末梢細胞から発生した細胞外小胞は、様々な神経学的欠損に寄与することが示されている[115,116,117,118]。一方、心筋炎、関節炎、炎症性肺疾患[119,120,121,122]に対して抗炎症性を有する間葉系幹細胞由来の細胞外小胞は、様々な中枢神経系病態においても炎症を減少させる[123,124,125,126,127]。
細胞外小胞がどのようにBBBを破るのかは不明であるが、我々や他の研究者は細胞外小胞がメタロプロテアーゼの放出を促進し、細胞外マトリックスの再編成、上皮バリアの調節、炎症性細胞のリクルートを促進することを示している[128]。さらに、免疫/炎症性および上皮細胞特異的マーカーを含む細胞外小胞は、IBD患者の血液および腸管内腔で上昇しており、このような細胞外小胞濃度の高さは疾患の重症度と相関している[129]。これに関連して、血液/腸管組織における荷担細胞外小胞の増加と腸管透過性の亢進との間には因果関係があることがIBSで報告されている[93]。したがって、血液中の中枢神経系由来細胞外小胞の検出 [130] と比較して、血液由来細胞外小胞の中枢神経系への侵入とミクログリア細胞による取り込み [103] で示されるように、脳と末梢の間のコミュニケーションは双方向の相互作用であることは明らかである。したがって,これらの相互作用はいずれもBBBを介した細胞外小胞媒介輸送の後に発生したに違いない.
腸や神経変性に関連した生体分子凝縮体や細胞外小胞がどのようにして発生するのか、また、腸を介した神経変性を制御する能力の背後にある正確なメカニズムはまだよくわかっていないが、我々は我々の研究や文献に基づいて複数の可能性を提案している。第一に、腸内細胞やマイクロバイオータから放出された細胞外構造物は、マトリックスメタロプロテアーゼ(MMP)やマイクロバイオータ由来の細胞外構造物媒介による多糖類やイノシトールポリリン酸塩の分解などの分解酵素で装飾されている可能性がある。第二に、そのような分解性分子は、細胞外構造物が上皮バリアにアクセスして横断し、全身循環にアクセスし、他の臓器、および脳に到達する能力を促進する可能性がある。第三に、損なわれた腸管上皮バリアおよびBBBは、細胞間移動および炎症性貨物の沈着を促進することができる。あるいは、末梢細胞外構造物は、他のメカニズムを使用して、傍細胞移行、マイクロピノサイトーシス、クラスリン媒介エンドサイトーシス、またはカベオリン媒介エンドサイトーシスを介して、中枢神経系に到達するか、またはその逆に到達する可能性がある。
3. 結論
要約すると、セリアック病、NCGSおよび/または神経変性を有する患者における腸内恒常性の異常を形成するためのいくつかの手段がある。GFD [62]、プロバイオティクス [131]、および選択的カンナビノイド受容体アゴニストなどの合成カンナビノイドを含む栄養補助食品に加えて、関連する神経病理学的障害の予後を改善するために宿主マイクロバイオームを形成しうる他の進化した戦略 [132] がある。これらのアプローチを最も有望なものに絞り込むためには、セリアック病のアカゲザルモデルを用いた前臨床試験が、これらの目標を達成するのに役立つであろう。

