Contents
Diet-Derived Fatty Acids, Brain Inflammation, and Mental Health
www.frontiersin.org/articles/10.3389/fnins.2019.00265/full
西洋社会は、前世紀の間に食習慣の劇的な変化を経験した。現代の栄養プロファイルは、典型的には飽和脂肪と精製された砂糖が豊富で、特に肥満や糖尿病、代謝性疾患の現在のパンデミックに、減少した身体活動と一緒に、主な貢献要因として認識されている。これらの条件と並んで、近年では、脳疾患、特に気分障害の有病率が徐々にかつ大幅に増加していることが目撃されている。実質的な臨床/疫学的証拠は、代謝性疾患と神経精神疾患の間の相関関係を支持しているが、後者の病因のメカニズムは、しばしば多因子であり、因果関係のリンクを確立するのは困難であった。神経炎症は、不健康な食生活によって引き起こされる末梢代謝異常と関連している可能性のある脳障害の特徴として際立っている。食事性脂肪酸は、高カロリー肥満食の構成要素として、炎症反応に関与するシグナル伝達分子として、両方の二重の役割を果たす可能性があるので、特に関心がある。ここでは、炎症過程や神経細胞の機能に直接関連するシグナル分子としての脂肪酸の役割に焦点を当てて、食事関連の栄養バランスの不均衡と神経精神疾患を接続する現在の文献をレビューする。
序論
西洋社会は、前世紀の間に顕著な栄養の移行を経験した。産業革命と大量の都市化に主に起因する複数の要因は、野菜、果物、繊維、魚(PopkinとGordon-Larsen、2004年、Popkin et al 2012)の摂取量を減らしながら、加工食品や動物由来の食品、飽和脂肪や精製された砂糖の消費量の増加に向かって人口の栄養プロファイルを駆動していた。さらに、これらの変更された食習慣は、現代のライフスタイルは非常に肥満を作る、より大きなポーションサイズと削減されたエネルギー支出に関連付けられている(ブレイとPopkin、1998;ヒルとピーターズ、1998;コペルマン、2000;バートゥード、2012)。同じ時間スパンの間に、気分障害の有病率は、進化する診断基準と他の交絡因子(Hagnell、1989,日高、2012)を考慮しても、欧米諸国で大幅に増加している。食事と精神的健康との関連メカニズムがよりよく理解されるようになると、蓄積された証拠は、現代/西洋の食事がこの増加のドライバーの1つであるかもしれないことを示唆している(Jacka et al 2010年; O’Neil et al 2014)。
このリンクに対処するために、 “栄養精神医学”(ローガンとジャッカ、2014)の新興分野は、最も頻繁に不安や気分障害、最も頻繁にパンデミックしている精神疾患の発生率と進行上の食事の分離された栄養素と全体的な品質の両方の影響を検証する臨床研究に焦点を当てている。並行して、この分野では、人間の食事と行動の複合的な複雑さに関連する課題を克服しようと努力しているが、その両方を制御し、一貫して評価することは困難です(Jacka, 2017)。
現代のライフスタイルと栄養行動がエネルギーの余剰と脂肪組織の拡大という形でのその貯蔵を促進することは議論の余地がないが(Spiegelman and Flier, 2001マクロニュートリエント組成-タンパク質、炭水化物、脂肪のバランス-の正確な関連性は、体重調節の下で議論されているままである。一部の著者は、肥満や代謝障害の発症に栄養素の単一のタイプの不釣り合いな貢献のために主張しているが、他の人は、そのような病理学は、正のエネルギーバランスに代わりに正々堂々と休んで、食事組成物に大きく依存していないことを支持している。
ブレイとポプキン(2014)は、例えば、炭水化物の増加摂取量は、主にグルコース/果糖飲料、現代社会で追加された糖類の主な供給源の形で、肥満と代謝条件(ブレイ et al 2004;ブレイとポプキン、2014)の現代的なパンデミックの主要なドライバであることを示唆している。実際、多数のメタアナリシスは、糖質消費とインスリン抵抗性、非アルコール性脂肪肝疾患(NAFLD肥満および2型糖尿病のリスク増加との間の正の相関を示している(Ludwig et al 2001年;Bray et al 2004年;Malik et al 2006年、2010年;Montonen et al 2007年;Ouyang et al 2008年;Brayら、Popkin et al 2014年;Mosca et al 2017)。このような相関関係は、総エネルギー摂取量をコントロールした場合には一貫して示されていないが、著者らは、砂糖入り飲料から得られる付加カロリーは、他のカロリーの摂取を効果的に抑制しないため、他の場所で補うことができない傾向があると主張している。メカニズム的には、肝臓でのフルクトースの取り込みと代謝の増加は、肝臓内脂質量の増加をもたらすde novo lipogenesis(DNL)を刺激し、非常に低密度のリポタンパク質とトリグリセリドの生産と分泌の増加につながる。長期的には、これらの変化は、内臓脂肪組織における脂肪貯蔵の増加および筋肉などの組織における異所性脂質沈着をもたらし、インスリン抵抗性をさらに助長し得る(Lê et al 2009;Stanhope et al 2009;Stanhope et al 2016;Mock et al 2017)。
一方、KhanおよびSievenpiper(2016)によって強調されたように、米国成人による糖質摂取量の減少のより最近の傾向は、肥満および代謝障害の減少を伴っていない。さらに、上述したように、アイソカロリックダイエットを用いたほとんどの対照試験では、肥満に対するいかなる種類の栄養素の特定の寄与が示されておらず、総エネルギー量が最も関連する変数であることが示唆されている(Kahn and Sievenpiper, 2014; Khan and Sievenpiper, 2016)。
脂肪摂取量の役割については、Huら(2018)は最近、脂肪、炭水化物、タンパク質の割合が異なる29種類の食事の長期的な効果を5つの異なるマウス系統で比較した説得力のある報告書を発表した。驚くべきことに、彼らは、食事中の脂肪含有量がエネルギー摂取量と脂肪率の増加に関与する唯一の要因であることを発見した。この観察は、脂肪と連動した快楽駆動によって説明されたが、彼らは糖質で同様の効果を観察しなかった(Hu et al 2018)。特定の食事組成が、食事自体のエネルギー密度とは無関係に、より高いエネルギー摂取量を駆動する可能性があるという事実は、この分野、特に臨床試験の設計と実施において、さらなる複雑さの層を追加している。
Huら(2018)は、この知見の翻訳可能性、およびヒトで同等の研究を行うことの実現可能性について興味深い議論を提示している。しかし、他の栄養素と比較して高いエネルギー含有量に起因するものであれ、カロリー摂取量の増加を促す報酬価値に起因するものであれ、あるいは特異的ではあるがまだ完全には解明されていないシグナリングや代謝異常に起因するものであれ、脂肪消費量の増加がダイエット関連疾患の発症に与える影響は、長年にわたって十分に文書化されてきた(最近の優れたレビューについては、Ludwigら(2018)を参照のこと)。体脂肪蓄積に対する総脂肪摂取量の関連性については議論が残っており、いくつかの研究では因果関係がないことが示されているが(Curb and Marcus, 1991; Willett, 1998, 2002; Vergnaud et al 2013食餌性脂肪からの過剰なエネルギー摂取は、脂肪率上昇の重要な因子として確立されている(Horton et al 1995; Bray and Popkin, 1998)。
脂肪組織の幻想的なリモデリング能力は、栄養の利用可能性とエネルギーの余剰に応答して、脂肪細胞の肥大と過形成を可能にする。しかし、病理学的条件下では、適応の必要性が組織の能力を上回る。低酸素および脂肪球細胞死は、マクロファージのリクルートおよび分極、炎症性マーカーの増加、サイトカインおよびケモカインの分泌、および遊離脂肪酸(FFA)フラックスにおける調節障害をもたらす(Sun et al 2011)。
増加した循環FFAと炎症性因子はまた、インスリン抵抗性とグルコースホメオスタシス、2型糖尿病(2型糖尿病M)の中核的な側面の規制緩和の中心である(GreenbergとObin、2006)。肥満と2型糖尿病Mは現在、世界の人口の大部分に影響を与えており、世界的な伝染病と考えられており、肥満は2型糖尿病Mの主要な危険因子である(Barnes, 2011)。
注目すべきは、食事の脂肪酸組成が、その肥満誘発性プロファイルおよび全体的な毒性に影響を与えることが示されていることである。特に、飽和脂肪酸(SFA)の濃縮は、多価不飽和脂肪酸(PUFA)を濃縮した食事よりも体脂肪の蓄積が大きく、満腹感が低い食事を誘発する結果となる(Lawton et al 2000年;Piers et al 2003年;Moussavi et al 2008年;Phillips et al 2012)。さらに、過剰なSFAの消費は、循環中のSFAを増加させ、脂肪組織における炎症過程に関与する遺伝子の発現を増加させ、インスリン感受性を低下させ、ヒトにおける肝内トリグリセリド含有量を増加させることが示された(Vessby et al 2001年;van Dijk et al 2009年;Rosqvist et al 2014)。
長期的な縦断的研究は、PUFAの低摂取量およびコレステロールおよびSFAの高摂取量を、アルツハイマー病を含む認知機能障害および認知症の発症リスクの増加にリンクさせている(Kalmijn et al 1997; Morris et al 2003a,b、2004; Barnard et al 2014; Reichelt et al 2017)。この文脈では、高脂肪食と座り仕事のライフスタイルによって引き起こされる代謝のアンバランスが、特に血漿FFAの高レベル、慢性低悪性度炎症、インスリン抵抗性および2型糖尿病M(De Felice, 2013)との関連性に起因して、重要なアルツハイマー病リスク因子を構成することが示唆されている。さらに、中年期にPUFAsの適度な摂取が老化の認知症リスクを減少させるように見えるのに対し(Laitinen et al 2006)飽和およびトランス不飽和脂肪の消費は、正の意味でアルツハイマー病のリスクの増加と関連していることが判明している(Morris et al 2003b)。地中海式食生活の遵守と果物や野菜、魚、ω-3(n-3 PUFA)を豊富に含む油の頻繁な消費は、アルツハイマー病と認知症を予防することができる要因として提案されている(Scarmeas et al 2006; Barberger-Gateau et al 2007,2011)。さらに、高齢者(65~90歳)の認知機能に著しい障害のない高齢者(65~90歳)の認知能力は、野菜、果物、ビタミンの摂取量が多く、一価不飽和脂肪酸、SFA、コレステロールの摂取量が少ない被験者の方が良好であった(Ortega et al 1997)。
メタボリックシンドローム、2型糖尿病Mおよび脳機能障害との間には密接な関係が存在し、気分障害と認知障害の両方を包含している(Ott et al 1996;De Felice、2013;Santos et al 2016;Rebolledo-Solleiro et al 2017)。このリンクの根底にあるメカニズムは、栄養の不均衡に起因する可能性がある神経炎症と脳インスリンシグナル伝達異常、両方に主に基づいて表示される(Luchsinger、2012年にレビューされた; De FeliceとFerreira、2014年; Holt et al 2014年; Sevilla-González et al 2017)。
以下のセクションでは、我々は、特にうつ病性障害で、食事性脂肪酸と精神衛生上の潜在的な役割との間の接続に利用可能なデータに焦点を当てている。我々は、神経炎症とインスリンシグナル伝達のモジュレーターとしての可能性に起因する、どのように探る、脂肪酸は、食事と精神的健康の間の相互作用への鍵となる可能性がある。我々はまた、ますますうつ病の病態生理に関与するドーパミン作動系は、食事の選択肢によって影響を受ける可能性がある方法を探求するより最近の仕事のいくつかを説明する。
ヒト集団研究
観察研究は数多く行われているが、食生活と気分障害の関連性に関するランダム化比較試験(RCT)は比較的少ない。2014年に実施されたメタアナリシス(Lai et al 2014)では、食事パターンとうつ病との関連性を検討したところ、20件の観察研究が包含基準を満たしていたが、RCTは1件のみであった。これらの著者らは、果物、野菜、魚、全粒穀物の多くの摂取を含む「健康的な」食生活がうつ病と逆相関していると結論づけた。同じ頃、Psaltopoulouら(2013)が行った別のメタアナリシスでは、うつ病を主なアウトカムとする9つの観察研究と認知機能を評価する8つの研究を調査し、同様の結論に達した。彼らは、Laiら(2014)が健康的と分類した食事パターンと同様の食事パターンである地中海式食生活の遵守と、うつ病と認知機能障害の両方の発生率の低下との間に有意な関連があることを発見した。
ヒトは通常、単一の種類の食物を単独で摂取することはないため、脂肪酸などの栄養素を単独で摂取する研究は困難であるだけでなく、パワーを高めるために潜在的な関連性を交換することになる。したがって、特定の栄養素の役割を扱う問題にアプローチするために、著者はしばしばサプリメントや観察研究に頼り、研究結果と栄養素の摂取量や代謝レベルを反映した特定のバイオマーカーとの間の相関を求めている。興味深いことに、大うつ病性障害(MDD)患者1,233人の合計を登録した13の無作為化プラセボ対照試験のメタアナリシスでは、うつ病症状に対するオメガ3系PUFAサプリメントの有益な効果が実証された(Mocking et al 2016)高用量でより大きな効果があり、抗うつ薬と同時に治療されている患者では、MDD治療におけるオメガ3系脂肪酸の潜在的な補助的役割を示唆している。
他のいくつかのメタアナリシスと疫学研究からの結果は、PUFAsの減少したレベルが認知や気分障害の発症に関与している可能性があり、それらの疾患の治療標的となる可能性があることを示唆している。14の研究のメタ分析は、抑うつ症状や社会不安障害を持つ被験者は、n-3 PUFA、エイコサペンタエン酸、20:5n-3(EPA)とドコサヘキサエン酸、22:6n-3(DHA)の低い循環レベルを持っていたこと、および/または対照被験者よりもn-6 PUFA、アラキドン酸、20:4n-6(ARA)の高いレベルを持っていたことを発見した(Lin et al 2010)。さらに、大うつ病患者の眼窩前頭前野および前頭前皮質の死後分析では、対照群と比較して低いDHAレベルが示された(McNamara et al 2007、2013)。さらに、精神病の超高リスク表現型を持つ69人の若年者を対象とした最近の7年間の追跡調査では、EPAおよび/またはDHAの低レベル、および赤血球膜のホスファチジルエタノールアミン画分中のn-6/n-3 PUFA比の高レベルが、気分障害を特異的に予測することが示された(このコホートでは、追跡期間中に24人の患者がMDDの診断を受け、2人が双極性障害の診断を受けた;Berger et al 2017)。Altogogether、これらおよび他の研究では、これらの非常に有病率の高いと泪の病気で栄養精神医学のアプローチのための基礎を提供し、気分や認知障害の病態にPUFAsを暗示している。
げっ歯類モデルの高脂肪食
人間の健康に高脂肪食の影響に関する現在の推論の多くは、動物モデル、主にげっ歯類での研究に基づいているか、または影響を受けている。人間のように、脂肪が濃縮された食事は、動物モデルの急速な体重増加と代謝変化を誘導する。高脂肪食」という用語は、脂肪がエネルギー摂取量の最も高い割合に相当する研究を説明するために広く使用されているが、その割合は、総エネルギー摂取量の20〜60%の範囲であり、食事の組成は、動物由来の脂肪または植物油を含んでいてもよい。さらに、対照食の組成は標準化されていないことが多く、非精製チャウを対照食として使用し、対照食の組成についての言及を完全に省略している研究もある(Buettner et al 2007; Hariri and Thibault、2010)。さらに、高脂肪食への暴露が開始されたときの年齢はまた、研究の間で変化している。高脂肪食の傘の下での研究における標準化の欠如は、研究間の比較を確立する上で観察されたアウトカムと難易度の大きな変動性につながる。
異なるプロトコルにもかかわらず、食事中の過剰な脂肪の効果のいくつかは、マウスで中心的かつ堅牢であるように見える。徐ら(2003)による画期的な報告では、例えば、高脂肪食(脂肪から60%のカロリーまでを含む)への長期暴露によってC57BL/6Jマウスで誘導された肥満は、脂肪球数とサイズ、体重、空腹時血糖値の増加、および誘導高インスリン血症(徐 et al 2003)を産生した。これらの代謝変化は、脂肪を多く含む食事を短期間摂取した後でも起こることが後に示された(Lee et al 2011)。
Hotamisligilら(1993)は、代謝障害の遺伝モデルであるdb/db、ob/ob、tub/tub、およびfa/faマウスを用いて、糖尿病および肥満誘発性インスリン抵抗性におけるTNF-αの中心的役割を実証した(Kleinert et al 2018で最近レビューされた)。これらのマウスにおいて、Hotamisligilら(1993)は、脂肪細胞におけるTNF-αの発現の増加および循環中のこのサイトカインの高レベルと同様に、インスリン抵抗性をもたらすことを示した。これらの知見に沿って、Xuら(2003)は、白色脂肪組織におけるマクロファージの過剰なリクルートとADAM8,MIP-1α、MCP-1,MAC-1,F4/80,およびCD68の発現の上昇が、慢性炎症の確立、および循環中のプロ炎症性サイトカイン、特にTNF-αおよびIL-6の産生および放出の増加に寄与していることを示した。これらの結果は、後に他の人によって裏付けられ、より広い画像に肥満誘発性炎症を位置づけた(Hotamisligil et al 1993; WellenおよびHotamisligil、2003; Xu et al 2003; Lumeng et al 2007; Eder et al 2009)。
高脂肪食マウスモデルは、FFA誘発性2型糖尿病Mに関与する分子機構の解剖に役立っている。それは最初に循環中の過剰なFFAは、そのような脂肪細胞、肝臓、筋肉などのいくつかの組織で、インスリンシグナル伝達とグルコース代謝を阻害することがヒトで示された。過剰なFFAは、漿膜へのGLUT4転座の減少を介して筋肉のグルコース輸送および代謝を減少させ(Roden et al 1996IRS-1セリンリン酸化を増加させ、インスリン刺激PI3キナーゼ活性を減少させることにより、インスリンシグナル伝達を阻害することが示された(Goodyear et al 1995;Dresner et al 1999)。そのような順番にIRSをターゲットにしたJNKとIKKβなどのストレスキナーゼの活性化で絶頂に達するこのプロセスにおける炎症性応答の重要な役割は、高脂肪食マウスモデル(ユアン et al 2001年;ヒロスミ et al 2002年;Arkan et al 2005)に記載されていた。
肥満や高脂肪摂取モデルで観察される飽和脂肪酸の増加は、重要な細胞機能に影響を与える内在性の炎症性の潜在性を持っている。脂肪酸は、脂肪細胞およびマクロファージにおけるToll様受容体4(TLR4)シグナル伝達を活性化し、炎症性シグナル伝達を誘導する可能性があり(Shi et al 2006年TLR4を欠失したマウスは、高脂肪食誘発性肥満およびインスリン抵抗性から保護されることが示された(Poggi et al 2007年;Davis et al 2008)。TLRは、様々な微生物危険関連分子パターン(DAMPs)および病原体関連分子パターン(PAMPs)を認識し、細胞内シグナル伝達応答をオーケストレーションするI型膜貫通受容体のファミリーであり、感染症および炎症性疾患において重要な役割を果たしている。哺乳類において記載されている少なくとも13のTLRのメンバーの中で、免疫応答への関与という点で最も特徴づけられるのはTLR2およびTLR4である(Fessler et al 2009)。TLR4は、MyD88依存性およびMyD88非依存性のプロ炎症性シグナル伝達経路、ならびにNFκB応答を活性化することにより、自然免疫系において重要な役割を果たしている(Lu et al 2008)。
気分障害はげっ歯類モデルでは完全に再現できない。不完全に理解されていない病因に加えて、気分障害には、不適切な罪悪感や自殺行為など、人間の経験外には存在しないかもしれない症状が含まれている(Krishnan and Nestler, 2011)。しかし、げっ歯類モデルでは、絶望感や無気力感の行動相関など、抑うつ症状に似た症状を示すことがある。高脂肪食を与えられたラットおよびマウスの最近のデータは、以下で議論されるように、食事誘発性の炎症性プロセスと因果関係があるかもしれない高脂肪食とそのような抑うつ表現型との間の正の関連を示唆している(Yang et al 2016; Arcego et al 2018; Hassan et al 2018)。
飽和脂肪酸と神経炎症。気分障害との関連性の可能性
ミクログリア細胞は、脳の病理学的変化に迅速に反応し、その形態および貪食行動を変化させ、NO、プロテアーゼ、およびTNF-αおよびIL-1βなどのサイトカインを分泌することにより、細胞毒性反応を増大させる(Kreutzberg, 1996)。パルミチン酸などのSFAは、視床下部ミクログリアにおけるTLR4受容体の活性化を誘導し、サイトカイン放出を刺激することが示されている(Valdearcos et al 2014高脂肪食が脳の炎症につながる潜在的なメカニズムを示す。これらのサイトカインはシナプス可塑性に重要な役割を持っており、神経新生を阻害する可能性があるので、特に、海馬-学習と記憶だけでなく、うつ病や抗うつ薬の効果にも関与する重要な脳領域は、IL-1β、IL-6,およびTNF-αのレベルが変化した場合に脆弱である(Sheline、2011; Calabrese et al 2014)。
ミクログリアとアストロサイトは、正常なシナプス機能に不可欠である。ミクログリアによるシナプス剪定は、シナプスの成熟と神経伝達に不可欠である(Paolicelli et al 2011アストロサイトは重要な代謝と可塑性機能を保持している間(Beattie et al 2002; SinghとAbraham、2017)。重要なのは、齧歯類における高脂肪食誘発性抑うつ様行動だけでなく、認知機能障害は、脳の炎症と関連している。例えば、Dutheilら(2016)は、古典的な代謝変化に加えて、16週間高脂肪食(脂肪としてのカロリーの60%)を与えられたラットは、インスリンシグナル伝達障害と海馬におけるIL-6,IL-1β、およびTNF-αなどのサイトカインの増加レベルと並んで提示する無気力行動を示すことを示した。ターンでは、長期的な高脂肪食にさらされたマウスは、TNF -αと海馬の活性化ミクログリアの存在の血清と海馬レベルの増加と、モリス水迷路の空間記憶障害を持っていることが示されただけでなく、減少した樹状突起の分岐と複雑さ(Heyward et al 2012年;ジョン et al 2012)。
SFAと細菌性リポ多糖類(LPS)の脂質部分との間の構造的類似性に沿って、いくつかの証拠のラインは、SFAがTLRのリガンドとして作用することを示唆している。試験管内試験実験は、SFAがTLR2を活性化して炎症性応答を誘導することを示しており(ErridgeおよびSamani、2009;Huang et al 2012多数の報告は、SFAを免疫細胞におけるTLR4媒介シグナル伝達経路にリンクさせている(Park et al 2009;RogeroおよびCalder、2018)。BV-2ミクログリア細胞株および初代ミクログリア培養物の両方を用いて、Wangら(2012)は、パルミチン酸およびステアリン酸が反応性ミクログリア表現型を誘導し、TLR4依存性の方法で炎症性マーカーのレベルを増加させることを実証した。SFA、ラウリン酸、パルミチン酸、ステアリン酸は、不飽和脂肪酸やPUFAではなく、マクロファージにおけるNF-κB活性化とCOX-2および他の炎症性マーカーの発現を誘導することが示されたが、その効果はドミナントネガティブTLR4細胞で抑制された(Lee et al 2001)。さらに、肝臓分泌タンパク質であるフェトゥイン-A(FetA)は、FFAとTLR4活性化の間のアダプタータンパク質として示唆されており、FFAをTLR介在性炎症に結びつけている(Pal et al 2012)。しかしながら、重要なことに、SFA受容体としてのTLRの役割は、まだ議論の余地がある。この概念に対する最も最近の挑戦は、SFAがマクロファージにおけるTLR4の直接的なリガンドではなく、その代わりにこれらの細胞における脂質代謝を変化させることによってプロ炎症性シグナル伝達に寄与することを示唆するLancasterら(2018)による説得力のある報告であった。彼らは、直接的な標的ではないにもかかわらず、TLR4依存性のプライミングがSFA誘導性炎症性シグナル伝達のための要件であることを示すことで、これらの結果を過去の文献所見と和解させている。
炎症は気分障害の重要な因子として浮上している。気分障害を呈する患者は、TNF-α、IL-6,およびIL-1βなどのサイトカインの血漿レベルの上昇、ならびに血球中の炎症性マーカーの発現の増加を示す(MechawarおよびSavitz、2016年にレビューされている)。高脂肪食の消費量の増加は、マウスにおけるうつ病様行動および情動障害に関連しており(Wang et al 2017年;Arcego et al 2018年;Vagena et al 2018年;Xu et al 2018年)神経炎症は、これらの行動変化の重要なモジュレーターである可能性がある。パルミチン酸は、インターフェロン-γに応答してミクログリアの遊走および貪食活性を廃止し、したがって、試験管内試験での炎症性チャレンジ後のこれらの細胞の保護応答に影響を与える(Yanguas-Casas et al 2018)。MDD患者の脳組織の死後分析では、対照群と比較して扁桃体でパルミチン酸が6.5%増加し、オレイン酸が6.2%減少していることが示されており(Hamazaki et al 2012特定の脂肪酸のレベルの変化が脳機能障害に関与している可能性をさらに示唆している。
神経炎症と気分障害との間には、トリプトファンをキヌレニンに変換する酵素であるインドラミン-2,3-ジオキシゲナーゼ(IDO)のミクログリア発現に対するプロ炎症性サイトカインのポジティブな効果があると考えられる(Wichers and Maes, 2004; Dantzer et al 2008)。この代替経路のアップレギュレーションによる脳内トリプトファンの利用可能性の低下は、トリプトファン水酸化酵素によって行われるセロトニン合成の律速段階である5-ヒドロキシトリプトファンへの変換を遅らせる可能性がある。注目すべきことに、関与する唯一の因子とは程遠いが、セロトニンの枯渇は、動物モデルにおいて抑うつ症状を誘発し、特定の条件下でヒトにおいて気分に影響を与えることが示されている(Ruhé et al 2007; O’Connor et al 2009)。さらに、キヌレニン代謝の亢進は、活性酸素種(ROS)の発生源である3-ヒドロキシキヌレニンとNMDA受容体アゴニストであるキノリン酸の過剰産生をもたらす可能性があり、これらはいずれもうつ病に独自の意味合いを持つ可能性がある(Müller and Schwarz, 2007)。
神経炎症と気分を結びつけるもう一つの可能性のあるメカニズムには、モノアミン作動性経路の酸化ストレスに対する脆弱性が正確に関係している。テトラヒドロビオプテリン(BH4)は、トリプトファン水酸化酵素、フェニルアラニン水酸化酵素(フェニルアラニンをチロシンに変換するチロシン水酸化酵素(チロシンをドーパミン合成の速度制限段階であるL-DOPAに変換する)などの酵素反応に必要な必須の補酵素である。BH4は、強い炎症性コンテクストで起こりそうなイベントである活性酸素によって容易に不活性化され、したがってドーパミンおよびセロトニンレベルに影響を与える可能性がある(Swardfager et al 2016年にレビューされている)。注目すべきことに、上記のセロトニンの役割に加えて、最近の報告では、ドーパミンの神経伝達、特に腹側索野-核足部回路におけるドーパミンは、抑うつ表現型および社会的行動の発現に不可欠であり、したがってその枯渇は気分障害に寄与し得ることが示されている(Tye et al 2012;Gunaydin et al 2014;Matthews et al 2016)。
多価不飽和脂肪酸、神経炎症と気分障害へのリンク
過去数十年で世界的に観察された栄養の変遷は、乳製品、植物油、赤身肉の摂取量の増加を介して、人間の食事でSFAとオメガ6(n-6)PUFAを大量に導入している。食事プロファイルのこの変化は、さらに、オメガ3(n-3)PUFAsの重要な供給源である果物、野菜、豆類、穀物、魚の消費量の減少を伴っていた。これらの変化は、オメガ-6/オメガ-3比が約1:1から10:1に増加し、20-25:1以上に達し、欧米諸国を中心とした世界人口のオメガ-3欠乏症が憂慮される結果となった(Simopoulos, 2011)。
オメガ3とオメガ6のPUFAは、炭化水素鎖のメチル末端に最も近い二重結合の位置に応じて、これらの2つのグループに分類され、一緒に、多価不飽和脂肪酸(VLC-PUFAs)の非常に長い鎖ファミリーを構成している。ヒトにおける主なVLC-PUFAは、膜リン脂質の構成要素であり、重要なシグナル伝達分子であるオメガ3PUFA、EPAおよびDHA、およびオメガ6PUFA、ARAである(Zarate et al 2017)。ヒトでは、VLC-PUFAは、必須脂肪酸であるリノール酸(LA)およびα-リノレン酸(ALA)の食事摂取から少量ずつ内因的に合成される。これらは、連続的に伸長して炭素鎖に二重結合を含む伸長酵素と脱サチュラーゼ酵素の作用により、ARA、EPA、DHAの合成の前駆体となる。このように、これらの栄養素を食事で十分にバランスよく摂取することは、健康な発育、生存、老化のために必要である(Calder, 2018)。
脳は脂質が豊富な臓器であり、その脂質の約35%がPUFAである(Yehuda er al)。 DHAとARAは、脳細胞内の主要なPUFA成分である。彼らは、主に細胞膜(脳組織のグラムあたり約10,000 nmol)でグリセロリン脂質としてエステル化されて発見されているが、また、非エステル化形態(脳組織のグラムあたり約1 nmol)ではるかに低い量で発見されている。これらは、ニューロン、グリア細胞、内皮細胞の構造成分やシグナル伝達分子として作用する(Bazinet and Layé, 2014)。ヒトおよび主に動物モデルにおける研究により、PUFAは、リポタンパク質またはアルブミン輸送を介して、リゾホスファチジルコリンとしてエステル化された形態で、または非エステル化された形態で、フリップフロップ機構を介した受動的拡散によって、または脂肪酸結合タンパク質(FABPs脂肪酸輸送タンパク質(FATP脂肪酸トランスロカーゼ(FAT/CD36)および主要ファシリテータースーパーファミリードメイン含有タンパク質2(Mfsd2a)などのタンパク質輸送体を介して脳に入ることが明らかにされている(Lauritzen et al 2001; Umhau er al 2001年;Umhau et al 2009年;Domenichiello et al 2014年;Nguyen et al 2014年;Chen et al 2015年;Liu et al 2015年;Pan et al 2015年、2016年;Hachem et al 2016)。) PUFAは、シナプス可塑性、神経伝達、代謝、神経新生、神経炎症および神経保護を含む脳機能において重要な役割を果たす(BazinetおよびLayé、2014)。驚くことではないが、したがって、PUFAs(特に、DHA)の減少または不均衡な食事供給および脳レベルは、認知障害および気分障害を含む脳障害と関連している(下記参照)。
アデニル酸シクラーゼおよびプロテインキナーゼA(PKA)活性の増加を介したセロトニン(5-HT1および5-HT4βアドレナリン作動性およびドーパミン(D1およびD2)受容体シグナリングの調節に加えて(Liu et al 2015PUFAは、気分障害の重要な病因因子である神経炎症において重要な役割を果たす(Chang et al 2015;Yirmiya et al 2015;Chen et al 2018)。オメガ-6およびオメガ-3 PUFAは、炎症性調節に対して反対の効果を有する。ARAは、免疫細胞における炎症プロセスを調節する生理活性分子であるエイコサノイドの重要な前駆体である。炎症性刺激に反応して、膜リン脂質はホスホリパーゼA2(PLA-2)によって切断され、シクロオキシゲナーゼ(COXリポキシゲナーゼ(LOXチトクロームP450の基質であるARAを放出する。これは、プロスタグランジン(PGトロンボキサン(TXおよびロイコトリエン(LT主要なプロ炎症性メディエーターの合成を刺激する(Innes and Calder, 2018)。双極性障害患者の脳の死後分析では、前頭皮質におけるARAの放出と下流代謝の調節障害が示され(Kim et al 2009)リチウム、バルプロ酸、カルバマゼピンなどの気分安定剤が脳内のARAカスケードを修飾することが明らかになっている(Kim et al 2009)。これらの知見は、食事からのARAのレベルの増加は、脳細胞における炎症反応の悪化と調節障害につながり、したがって、気分障害に関連するメカニズムに寄与する可能性があることを示唆している。
試験管内試験研究では、オメガ3系PUFAsがミクログリア機能を変調させることが示された。例えば、EPA治療は、試験管内試験でプロ炎症性サイトカイン(IL-1β、IL-6,およびTNF-α)のミクログリア産生を阻害し(Liuzzi et al 2007)オメガ3 PUFAの補充は、ミクログリアの活性化を阻害し、いわゆる古典的なプロ炎症性M1からラットの脳損傷モデルにおける神経保護M2表現型にミクログリアプロファイルをシフトさせた(Chen et al 2018)。ミクログリア膜に取り込まれると、脳細胞における強力な免疫調節因子として記載されているDHAは、細胞表面受容体によるLPSの認識をブロックし、核内因子κB(NF-κB)活性化およびIL-1βおよびTNF-αの合成を阻害した(De Smedt-Peyrusse et al 2008)。さらに、DHAは、LPSによって誘発された神経炎症を抑制し、海馬CA1錐体ニューロンのシナプス構造と機能を回復させた(Chang et al 2015)。脳内でn-6からn-3 PUFAに変換するFat-1マウスでは、DHAを富化した食事を与えることで、プロ炎症性サイトカイン、ミクログリア活性化、抑うつ様行動、およびBDNFレベルの低下のLPS誘発性増加が予防された(Gu et al 2018)。
オメガ3 PUFA、主にEPAは、ARA由来の炎症性メディエーターの生合成に関与する酵素の競合基質である。PUFAの消費量の増加は、これらの脂肪酸のレベルが増加した膜リン脂質組成物をもたらし、ARA由来の炎症性メディエーターの減少をもたらす(Calder, 2015でレビューされている)。さらに、DHAおよびEPAは、レゾルビンおよびプロテキンなどの抗炎症作用およびプロレゾルビン作用を有する重要な脂質メディエーターの前駆体である。レゾルビンD1(RvD1)およびレゾルビンE1(RvE1)は、例えば、プロ炎症性サイトカイン、すなわちTNF-α、IL-6,およびIL-1βのLPS誘発性ミクログリア発現を減少させる(Rey et al 2016)。
脂肪酸、ミクログリアの変化、および気分障害
近年、腸内細菌叢-脳軸は神経炎症や神経精神疾患の発症に関与していることが指摘されている。ブルキナファソのアフリカの農村部の子供たち(農村部の食事を食べさせられた)とヨーロッパの子供たち(近代的な西洋食を食べさせられた)を比較分析したところ、2つのグループ間で腸内細菌叢に有意な差があることが示された(De Filippo er al)。
腸内マイクロバイオームは、食事組成物に迅速に反応する。マウスモデルを用いて、Davidらは、動物性または植物性の製品で濃縮された食事への短期暴露が、マイクロバイオータ組成物および微生物遺伝子発現を変化させることを示した(David et al 2014)。高脂肪食を給餌することは、マウスの腸内細菌生態系のシフトを引き起こした(Daniel et al 2014)。より最近では、8週間のための高脂肪食を与えられたマウスは、Bacteroidetesの人口の相対的な減少とFirmicutesの人口の増加を伴う抑うつ症状のような表現型を提示することが示されていると、彼らの糞便マイクロバイオームのシアノバクテリア(Hassan et al 2018)。興味深いことに、MDD患者は、健康なコントロールと比較した場合、Firmicutes、ActinobacteriaおよびBacteroidetesの異なる豊富さを示した。同じ研究では、MDD患者由来の糞便微生物叢をマウスに移植すると、健康なコントロール個体由来の微生物叢をコロニー化した場合と比較して、うつ病様の行動が得られた(Zheng et al 2016)。同様に、うつ病患者由来の糞便性微生物叢を、微生物叢枯渇ラットに移植すると、無気力症および不安様行動が誘発された(Kelly et al 2016)。
微生物相の変化がどのようにして気分障害につながるのか、その根底にある詳細なメカニズムは明らかにされていないが、神経炎症が潜在的なメカニズムとして現れている。無菌マウス由来のミクログリアは、コントロールマウス由来のミクログリアと比較すると、炎症および防御応答に関連する遺伝子の発現の減少、および未熟なプロファイルを示した(Matcovitch-Natan et al 2016; Fung et al 2017)。さらに、マイクロバイオータの複雑性は、ミクログリアの機能において中心的な役割を果たし、健康および疾患における神経炎症応答を調節している(Erny et al 2015)。
アディポネクチン
アディポネクチンは、脂肪細胞から放出され、血漿中に多く、脳脊髄液中には低濃度で存在するホルモンである(Ebinuma et al 2007)が、気分障害と関連しており、特に長期的な影響に関しては、食生活の変化が行動と関連している可能性がある。アディポネクチンの循環レベルとその受容体であるAdipoR1とAdipoR2(脳を含むいくつかの臓器に存在)の活性化によって誘発される反応は、肥満や糖尿病などの炎症や代謝状態によって調節されることが示されている(Hotta et al 2000; Yang et al 2002)。一貫性のあるヒトのデータは不足しているが、アディポネクチンは、マウスにおいて抗うつ作用(Liu et al 2012)および抗炎症作用(Ouchi and Walsh、2007)を有する。また、運動や環境の充実が神経新生、気分、認知に及ぼすポジティブな効果のメディエーター候補であることも示されている(Chabry et al 2015)。
インスリン-ドーパミンリンク
Kleinriddersら(2015)は、インスリン抵抗性の結果として、脳内のインスリンシグナル伝達の低下が、モノアミンオキシダーゼのレベルの増加とドーパミンクリアランスの増加をもたらしたことを示した。彼らはさらに、このドーパミン代謝の変化がマウスの加齢に伴う不安や抑うつ様行動につながったことを示し、気分障害におけるドーパミンシグナル伝達の上述のますます重要な役割と一致する結果を示した。
彼らの以前の結果(Kleinridders et al 2015)を補完するために、同じグループは後に条件付きインスリン受容体ノックアウトマウスを使用して、アストロサイトにおけるインスリンシグナル伝達が、グリオトランスミッターATPの放出を介して、ドーパミン伝達を調節する役割を有することを示した(Cai et al 2018)。彼らの結果は、アストロサイトにおけるインスリン受容体の活性化がMunc18cを活性化してATP外分泌を促進し、それがドーパミン神経ニューロン上のP2X受容体に作用してドーパミン放出と正常な気分行動を調節することを示唆している。これらの結果はまた、ドーパミンシグナル伝達が変化し、インスリン抵抗性のシナリオで気分障害に寄与する可能性があるという結論につながった(Cai et al 2018)。
さらに、FordahlおよびJones(2017)は、高脂肪食の長期摂取が、足底核におけるインスリンシグナル伝達を障害し、ドーパミン作動性端末におけるドーパミン再取り込みを減少させることをマウスで実証した。注目すべきは、インスリンシグナル伝達を回復させることでこの欠損を元に戻すことができ、インスリン感受性の低下がこの領域のドーパミン作動性の変化の原因である可能性を示唆している(Fordahl and Jones, 2017)。
視点と結論
抗うつ薬の失敗率が高いことを考えると、少なくとも30%の患者が薬理学的治療の複数回のラウンド(Sinyor et al 2010)に無反応であること、および認知症のための有効な、疾患修飾治療の欠如と、気分や認知障害のための食事療法の介入の見通しは魅力的である。特筆すべきは、メンタルヘルスへの潜在的な食事のアプローチに関与するターゲットは、実際には神経炎症(例えば、TLRとサイトカイン受容体)と脳のインスリンシグナル伝達(図1)を含む、現在の臨床試験で薬物療法のためのターゲットと重複する可能性がある。この目標を達成するための重要なステップは、脳内の栄養素やシグナル伝達分子としての脂肪酸の明確ではあるが相互依存的な役割と、脳機能や機能障害への影響を理解し、解剖することであろう。最後に、ヒトが単独で消費する食物はないので、これは、炎症とインスリンシグナル伝達の両方で競合するプレーヤーとしての他の栄養素、特に炭水化物の可能性を探るためのより大きな取り組みの一環として行われるべきである(DiNicolantonio et al 2018)。
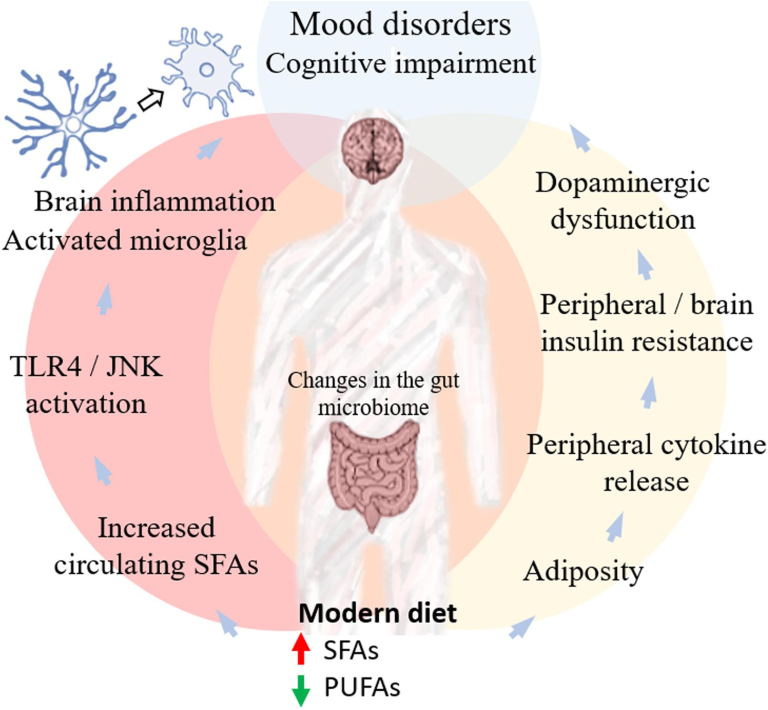
図1 食事とメンタルヘルスをリンクする経路欧米諸国
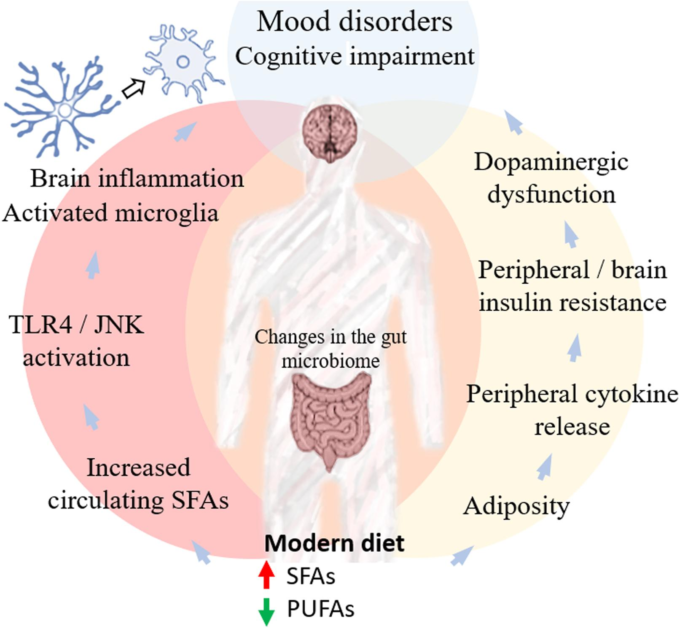
を中心とした現代社会で見られる栄養の変遷は、SFAの消費量の増加とPUFAの摂取量の減少をもたらした。脂肪を豊富に含む食事からの過剰なエネルギー摂取は、脂肪酸の貯蔵を増加させ、マクロファージの募集とプロ炎症性サイトカインの循環レベルを増加させ、その結果、脂肪組織のリモデリング能力を超えている。サイトカインレベルの増加は、JNKやIKKβなどのストレスキナーゼの活性化につながり、その結果、IRS-1のセリンリン酸化が増加し、インスリン刺激性PI3キナーゼ活性が低下し、中枢性および末梢性インスリン抵抗性を引き起こす。脳の炎症およびインスリン抵抗性は、認知障害に関与していることが示唆されている(De Felice et al 2014年;Ferreira et al 2014年にレビューされている)。最近の報告では、脳内のインスリンシグナル伝達の低下がドーパミンの代謝と放出に影響を与え、気分障害に寄与していることがさらに示唆された(Cai er al)。 このドーパミン機能障害が認知障害にも関係しているかどうかは、まだ解明されていない可能性がある。食餌性脂肪からの過剰なエネルギー摂取は、遊離脂肪酸(FFA)フラックスの調節障害をさらにもたらし、循環中のPUFAを減少させ、SFAを増加させる。正確なメカニズムはまだ議論の余地があるが(Lancaster et al 2018いくつかの報告では、SFAがTLR4依存性のシグナル伝達経路を活性化して、ミクログリアにおける炎症反応を増加させ、脳の炎症を誘導し、気分障害と認知機能障害の両方の発症に関与する別の潜在的なメカニズムであることが示されている。同時に、食事の選択は腸内細菌叢に影響を与えることが知られており、神経炎症反応を制御している可能性がある。これらの相互に関連するメカニズムは、脂肪を多く含む食事に関連する脂質の不均衡と、神経精神疾患および認知障害の発症および進行との間の関連を示唆している。