Contents
- Dementia prevention, intervention, and care: 2020 report of the Lancet Commission
- 報告書 概要
- はじめに
- 認知症の予防
- 低中所得国の認知症
- 認知症の特定の潜在的な危険因子
- 認知症予防のための組み合わせ戦略の臨床試験
- PAFの合計計算
- 新しいシステマティックレビューにおける新たに選択されたリスクの組み入れ
- 認知症の介入とケア
- アルツハイマー病のバイオマーカーと検出
- 表2 アミロイドーシス単独および神経変性および軽度認知機能障害の存在下での女性のアルツハイマー病発症の年齢別10年リスク
- 認知症の人への介入の原則
- 診断が下された後の介入
- 運動と身体活動
- 認知症の神経精神症状に対する介入
- 図8 認知症と診断された患者で抗精神病薬を処方された人の割合
- 認知症の人は他の病気を持っている
- 認知症とCOVID-19
- 入院
- 図9 認知症の人の入院率を認知症のない人と比較したシステマティックレビューとメタアナリシスで、年齢と性別をコントロールした
- 体調不良、せん妄、認知症
- 超高齢、虚弱、認知症との関連性
- 図10 アルツハイマー病の病態とアルツハイマー型認知症の臨床診断との関連性に関するモデレーション分析(年齢・性・学歴で調整した場合)
- 認知症における看取りケア
- 結論
Dementia prevention, intervention, and care: 2020 report of the Lancet Commission
www.ncbi.nlm.nih.gov/pmc/articles/PMC7392084/
報告書 概要
若年死亡率の低下に伴い、認知症を含む高齢者の数は増加している。しかし、教育、栄養、ヘルスケア、ライフスタイルの変化などの改善により、多くの国で認知症の年齢別発症率は低下している。全体として 2017年のLancet Commission on dementia prevention, intervention, and careでモデル化された認知症の9つの潜在的な危険因子である、教育不足、高血圧、聴覚障害、喫煙、肥満、うつ病、運動不足、糖尿病、社会的接触の少なさを支持するエビデンスが増えてきている。認知症の危険因子をさらに3つ追加し、説得力のある新しいエビデンスを得た。これらの因子は、過度のアルコール消費、外傷性脳損傷、大気汚染である。我々は新しいレビューとメタアナリシスを完成させ、認知症予防の12の危険因子のライフコースモデルを更新した。修正可能な12の危険因子を合わせると、世界の認知症の約40%を占めており、理論的には認知症を予防または遅らせることが可能である。予防の可能性は高く、認知症の発生が多い低所得国や中所得国(低中所得国)ではより高い可能性がある。
私たちの新しいライフコースモデルとエビデンスの統合は、世界的な政策的意味合いを持つ。認知症予防のためには、ライフコースの中で早すぎることも遅すぎることもない。中年期(45~65歳)や後期(65歳以上)の危険因子は、認知症の予備力や神経病理学的発症の引き金に影響を与える。文化、貧困、および不平等は、変化を必要とする主な推進要因である。最も困窮している個人は、これらの変化を最も必要としており、最も高い利益を得ることができる。
政策は、すべての人のための幼児教育を優先すべきである。頭部外傷を最小限に抑え、有害な飲酒を減らせば、若年発症の認知症や晩年発症の認知症を減らす可能性がある。中年期の収縮期血圧は、認知症を遅らせたり予防したりするために、130mmHg以下を目指すべきである。後期になっても禁煙することで、このリスクは軽減される。受動喫煙は認知症の危険因子としてはあまり考えられていない。多くの国では、受動喫煙を制限している。政策立案者は、特に大気汚染の多い地域では、大気質の改善を急ぐべきである。
認知症を予防する特定の活動についてのエビデンスはほとんど存在しないが、中年期以降も認知的、身体的、社会的に活動的であることを推奨する。補聴器の使用は、難聴による過剰リスクを減少させるようである。中年期から晩年にかけての持続的な運動は、肥満、糖尿病、心血管系のリスクを減少させることで、認知症を予防する可能性がある。うつ病は認知症のリスクになるかもしれないが、晩年になると認知症がうつ病を引き起こす可能性がある。行動を変えることは難しく、純粋に因果関係があるとは限らないが、個人が認知症リスクを減らす可能性は非常に大きい。
低中所得国では、誰もが中等教育を受けることができるわけではなく、高血圧、肥満、難聴の割合が高く、糖尿病や喫煙の有病率が高く、認知症の予防が可能な認知症の割合がさらに高くなっている。
アミロイドβやタウのバイオマーカーはアルツハイマー型認知症への進行リスクを示するが、これらのバイオマーカーのみで認知が正常な人の多くは発症しない。障害や機能的な不安を持つ患者やその家族にとって正確な診断は重要であるが、日常診療での事前診断を支持するエビデンスは存在しない。
認知症の病因に関する我々の理解は、新しい病理学的原因の最新の記述により、変化しつつある。特に90歳以上の高齢者では、混合型認知症が多くみられる。血液バイオマーカーは、将来の診断アプローチに有望であり、脳脊髄液や脳画像マーカーよりもスケーラブルである。
認知症ケアの多くはウェルビーイングが目標である。認知症患者は多くの領域で複雑な問題や症状を抱えている。介入は個別化され、本人だけでなく家族の介護者も考慮しなければならない。神経精神症状を管理するために、患者のニーズに合わせて心理社会的介入を行うことは、少なくとも短期的には有効であるというエビデンスが蓄積されている。介護者へのエビデンスに基づいた介入は、何年にもわたって抑うつ症状や不安症状を軽減し、費用対効果も高い。
認知症の人の認知には、身体的な健康を維持することが重要である。認知症の人は同年代の人に比べて身体的な健康問題を抱えているが、地域の医療ケアを受けることが少なく、ケアへのアクセスや組織化が特に困難であることが多い。認知症の人は他の高齢者に比べて入院が多く、その中には自宅で管理できる病気も含まれている。COVID-19のパンデミックでは、認知症患者は不均衡に死亡している。入院は苦痛であり、予後不良と高額な費用が伴う。医療従事者は、認知症が知られていない高齢者で、頻繁に入院したり、せん妄を発症したりする認知症を考慮すべきである。せん妄は認知症の人によく見られ、認知機能の低下を助長する。病院では、適切な感覚刺激、水分摂取の確保、感染症の回避などのケアを行うことで、せん妄の発生率を減らすことができるかもしれない。
キーメッセージ
- 認知症の3つの新しい修正可能な危険因子
- 2017年のLancet Commission on dementia Prevention, intervention, and care lifecourse modelに、3つの修正可能な危険因子(過度の飲酒、頭部損傷、大気汚染)を追加することを新たなエビデンスが支持している。
- 12の危険因子を修正することで、認知症の最大40%を予防または遅らせることができるかもしれない。
- 予防に意欲的であること
- 予防は政策と個人の問題である。認知症のリスクと緩和への貢献は早期に始まり、生涯を通じて継続するものであり、早すぎても遅すぎてもいけない。これらの行動には、公衆衛生プログラムと個人に合わせた介入の両方が必要である。集団戦略に加えて、社会活動、認知活動、身体活動、血管の健康を向上させるために、政策は高リスク群を対象とすべきである。
- ライフコース全体のリスク因子に対する具体的な行動
- 40歳前後から中年期に収縮期血圧130mmHg以下の維持を目指す(高血圧症の降圧治療は認知症の予防に有効な唯一の薬として知られている)。
- 難聴には補聴器の使用を奨励し、過度の騒音曝露から耳を保護して難聴を軽減する。
- 大気汚染や副流煙への暴露を減らす。
- 頭部外傷を予防する。
- アルコールの誤飲や週21単位以上の飲酒は認知症のリスクを高めるため、アルコールの使用を制限する。
- 後期になっても認知症のリスクを減らすことができるため、喫煙を避け、禁煙支援を行う。
- すべての子どもに初等・中等教育を提供する。
- 肥満と糖尿病のリンク状態を減らすこと。中年期、場合によっては晩年の身体活動を維持すること。
- 睡眠などの認知症の危険因子に生活習慣を介入させることで、一般的な健康状態を改善することができる。
- 不平等に取り組み、認知症の人を守る。
- 多くの危険因子は、特に黒人、アジア人、少数民族、および脆弱な集団で発生する不平等を中心に集積している。これらの要因に対処するには、健康増進だけでなく、人々が生活する環境を改善するための社会的行動も必要である。例えば、身体活動が当たり前のように行われている環境を作ること、栄養のパターンを改善することで加齢とともに上昇する血圧の人口分布を減らすこと、潜在的な過度の騒音曝露を減らすことなどが挙げられる。
- 認知症は高所得国よりも低所得国・中所得国(低中所得国)の方が増加しているが、これは人口の高齢化と修正可能な危険因子の頻度が高いためである。予防的な介入は低中所得国において認知症の最大の減少をもたらす可能性がある。
認知症患者に対しては、以下のことを推奨する。
- 診断後の総合的なケアの提供
- 認知症の人の診断後のケアは、身体的・精神的な健康、社会的ケア、支援に取り組むべきである。認知症の人の多くは他の病気を抱えており、健康管理に苦労しており、その結果、予防可能な入院につながる可能性がある。
- 精神神経症状の管理
- 特定の多成分介入は認知症の人の神経精神症状を減少させ、選択される治療法である。向精神薬は効果がないことが多く、重篤な副作用がある可能性がある。
- 家族介護者へのケア
- 家族介護者への具体的な介入は、うつ病や不安症状に対する長期的な効果があり、生活の質を向上させ、費用対効果が高く、費用を節約できる可能性がある。
認知症の予防、介入、ケアに今すぐ行動することで、認知症の人とその家族、ひいては社会の生活と死期を大幅に改善することができる。
はじめに
世界では約5,000万人が認知症で生活しており、この数は2050年までに1億5,200万人に増加すると予測されており、特に認知症患者の約3分の2が生活している低所得中所得国(低中所得国)では増加している1。認知症は個人、家族、経済に影響を与え、世界的なコストは年間約1兆米ドル(約103兆円)と推定されている1。
認知症の予防、介入、ケアに関する2017年のランセット委員会2 を再招集し 2017年の論文以降に最も大きな影響を与える可能性のある進歩のエビデンスを特定し、その作業を発展させることを目的とした。私たちの学際的な国際的な専門家グループは、利用可能な最善のエビデンスについて発表し、議論し、合意した。私たちは、異なる研究ラインから得られたエビデンスの一貫性を評価する三角測量の枠組みを採用し、これをエビデンス評価の基礎として使用した。可能であれば、質の高いシステマティックレビュー、メタアナリシス、または個別の研究を用いて最良のエビデンスを要約したが、これらの研究がこの分野に重要な知識を追加している場合には、それを用いた。認知症の潜在的な危険因子の分析に必要な新しいエビデンスを生み出すために、必要に応じてシステマティックな文献レビューやメタアナリシスを実施した。この枠組みの中で、システマティックレビューやメタアナリシスを含むエビデンスの物語的な統合を提示し、そのバランス、強み、限界を説明する。我々は、低中所得国における認知症リスク、認知症のリスクと防御因子、アルツハイマー病の発見、認知症における多臓器症、認知症の影響を受ける人への介入に関する新しいエビデンスを評価した。
ほとんどすべてのエビデンスは高所得国(HIC)での研究から得られたものであるため、他の国ではリスクが異なる可能性があり、介入には文化や環境の違いに応じた修正が必要となるかもしれない。この考え方は、高所得国であれ低中所得国sであれ、ライフサイクルの不利益に関連した認知症を理解する必要性の重要性を裏付けている。
認知症の病因に関する我々の理解は変化している。例えば、あるコンセンサスグループは、TDP-43蛋白症を伴う海馬硬化症を、通常80歳以上の高齢者に見られ、アルツハイマー病よりも進行が遅く、死後に検出され、アルツハイマー病に類似または併存することが多い大脳辺縁系優位性加齢性TDP-43脳症(LATE)認知症と説明している3。このような状況は、臨床症候群がどのように特定の基礎疾患と関連しているのか、また関連していないのか、年齢を超えてどのように変化していくのか、という点に注目が集まっていることを反映している。しかし、LATEが有効な臨床診断として用いられるようになるまでには、さらなる研究が必要である。
高所得国で最も急速に増加している人口統計学的グループは、90歳以上の高齢者である。このように、これまでまれであったこの人口集団における人間の生物学的研究と、彼らのニーズを満たし、彼らのウェルビーイングを促進することの両方に焦点を当てる絶好の機会が存在している。
認知症の予防
認知症の患者数は増加している。認知症有病率の将来の傾向についての予測は、前提条件や地域によって異なるが、一般的には高齢化に関連した有病率全体の大幅な増加を示唆している。例えば、Global Burden of Diseases, Injuries, and Risk Factors Studyによると、1990年から 2016年までの世界の認知症の年齢標準有病率は比較的安定していたが、高齢化と人口増加に伴い、認知症患者数は1990年から2倍以上に増加している4。
しかし、米国、英国、フランスなどの多くの高所得国では、同様の方法や対象集団を用いて収集した過去数十年のコホートに比べて、より最近生まれのコホートでは年齢別発症率が低く5 (図1)認知症の年齢別発症率は低下しているように見える6 。しかし、これらの国では肥満や糖尿病の増加、身体活動の低下がこの傾向を逆転させている可能性がある8, 9。対照的に、日本、韓国、香港、台湾の年齢別認知症有病率は、低中所得国のアルツハイマー病と同様に増加しているように見えるが、比較研究では診断方法が常に同じかどうかは不明である5, 6, 7。
図1 認知症の発生率に関する5つの研究から、新コホートと旧コホートを比較した発生率比5
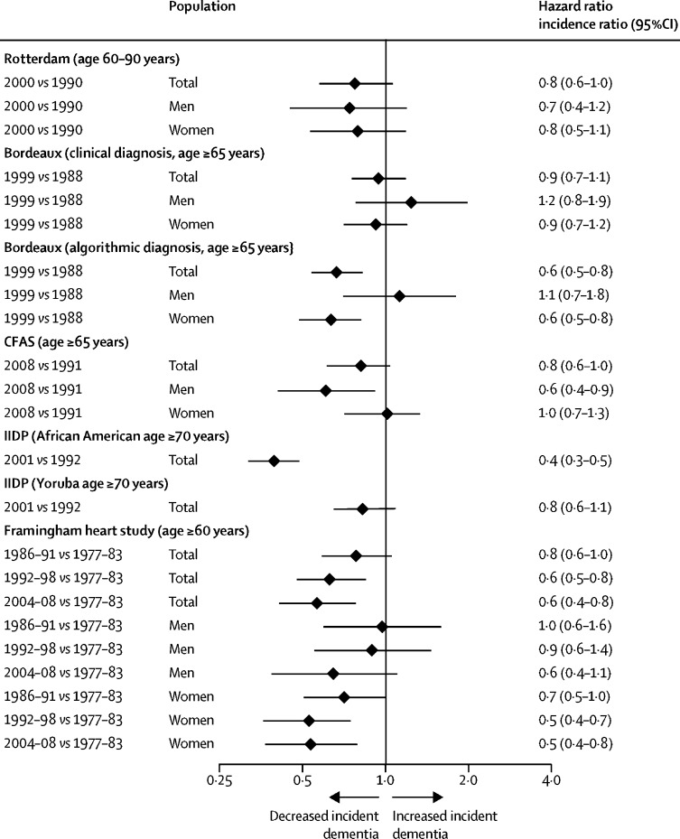
米国とナイジェリアのIIDPプロジェクト、フランスのボルドー研究、オランダのロッテルダム研究、年齢で調整。米国のFramingham Heart Study、年齢と性で調整。英国のCFAS、年齢、性、地域、貧困層で調整。ただし、他のいくつかの国では年齢別認知症有病率が増加している。IID=Indianapolis-Ibadan Dementia。CFAS=Cognitive Function and Ageing Study. Wu et al,5よりSpringer Natureの許可を得て編纂。
英国の変化をモデル化すると 2016年から 2040年までに認知症患者数が57%増加し、年齢別罹患率が安定していればその70%に相当する10 。また、モデルでは、自立した人と複雑な介護を必要とする人の両方が将来的に増加することが示唆されている6。
例えば、中年期の肥満や高血圧は将来の認知症を予測するが、認知症のある人や発症している人では、通常、体重も血圧も後年になると下がる9 。
図2は認知症からの保護のメカニズムをまとめたもので、その中には病理学的・神経病理学的な損傷にもかかわらず認知的予備力が増加または維持されるものもある。15, 16 コンセンサス論文では、予備能を個人の臨床像と神経病理の違いを考慮した概念と定義している。また、この概念をさらに神経生物学的な脳予備能(例えば、あるタイムポイントでのニューロンやシナプスの数)脳の維持(遺伝学やライフスタイルに基づいて、脳の変化や病理学的発達を時間の経過とともに減少させることで、任意のタイムポイントでの神経生物学的資本として)認知的予備力としての適応性に分類している。認知的予備力は変化可能であり、その定量化には、教育、職業の複雑さ、余暇活動、残差アプローチ(人口統計学的変数と脳の測定値によって説明されない認知の分散)またはそのような予備能の根底にあるかもしれない機能的ネットワークの同定などの代理測定を使用している15, 16, 17, 18, 19, 20
図2 認知症における認知的予備力の増強・維持とリスク低減のための脳内メカニズムの可能性
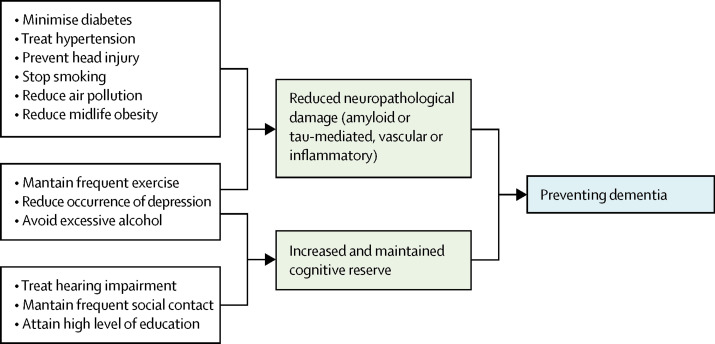
教育水準の低さなどの早期生活因子は、結果として生じる認知的予備力に影響を与える。中年期や老年期の危険因子は、加齢に伴う認知機能の低下や神経病理学的発達の引き金に影響を与える。認知的予備力の仮説と矛盾しないのは、高齢女性は同年代の男性よりも認知症を発症しやすいということである。17, 18, 19, 20, 21 身体的に健康な人ほど、認知障害がなくても神経病理の負担が大きくなる可能性がある。文化、貧困、不平等は、認知的予備力への変更を必要とする重要な障害であり、その推進要因でもある。
24 運動は、体重や糖尿病のリスクを減らし、心血管機能を改善し、グルタミンを減少させ、海馬の神経新生を促進する可能性がある25。HDLコレステロールの増加は、軽度の認知障害における血管リスクやアミロイドβ(Aβ)病理に伴う炎症から保護する可能性がある26。
低中所得国の認知症
平均寿命の延長と危険因子の負担が大きいため、低中所得国の認知症患者数は高所得国よりも急速に増加している。私たちは以前、9つの修正可能な潜在的危険因子を合わせて、世界の認知症人口帰属率(PAFs)の35%と関連していることを計算した。
27 修正可能な9つの潜在的危険因子の国別有病率を考慮した計算では、中国ではPAFが40%、インドでは41%、中南米では56%となっており、どの危険因子の頻度の推定値を使用するかによっては、これらの数値はさらに高くなる可能性がある28, 29。現在のところ実施されていない場合は、教育へのアクセス、高血圧の原因と管理、難聴の原因と治療、肥満の社会経済的・商業的要因に対処する国の政策を実施することで、多くの国でリスクを減らすことが可能である。30 我々は、栄養失調の母親の妊娠中の健康状態の悪さ、難産、早期の栄養失調、マラリアやHIVと並んで感染症の重荷を背負っての生存など、他の危険因子を考慮することはできなかった。
31 メタアナリシスでは、中国国内で認知症の発生率にばらつきがあることが判明しており、北部の有病率が高く、中部の有病率が低いことから、900万~500万人が認知症と推定されている。
これらのデータは、低中所得国のリスク推定と各設定に合わせた介入をより正確に行うために、より焦点を絞った研究が必要であることを示している。
認知症の特定の潜在的な危険因子
早期(教育)中年期(高血圧、肥満、難聴、外傷性脳損傷、アルコール乱用)後期(喫煙、うつ病、運動不足、社会的孤立、糖尿病、大気汚染)の危険因子は、認知症リスクの増加に寄与する可能性がある(表1)。これらの危険因子については良好なエビデンスが存在するが、うつ病のような晩年の因子は認知症の進行に双方向の影響を与える可能性があり、認知症の進行にも関与している。
表1 認知症リスク因子12項目のPAF
| 認知症の相対リスク(95%CI) | 危険因子の有病率。 | コミュニティ | 重み付けされていないPAF | 加重PAF * | |
|---|---|---|---|---|---|
| 幼少期(<45歳) | |||||
| 少ない教育 | 1・6(1・3–2・0) | 40・0% | 61・2% | 19・4% | 7・1% |
| 中年(45〜65歳) | |||||
| 難聴 | 1・9(1・4–2・7) | 31・7% | 45・6% | 22・2% | 8・2% |
| 外傷性脳損傷 | 1・8(1・5–2・2) | 12・1% | 55・2% | 9・2% | 3・4% |
| 高血圧 | 1・6(1・2–2・2) | 8・9% | 68・3% | 5・1% | 1・9% |
| アルコール(> 21ユニット/週) | 1・2(1・1–1・3) | 11・8% | 73.3% | 2・1% | 0・8% |
| 肥満(ボディマス指数≥30) | 1・6(1・3–1・9) | 3・4% | 58・5% | 2・0% | 0・7% |
| 後年(65歳以上) | |||||
| 喫煙 | 1・6(1・2–2・2) | 27・4% | 62・3% | 14・1% | 5・2% |
| うつ病 | 1・9(1・6–2・3) | 13・2% | 69・8% | 10・6% | 3・9% |
| 社会的孤立 | 1・6(1・3–1・9) | 11・0% | 28・1% | 4・2% | 3・5% |
| 運動不足 | 1・4(1・2–1・7) | 17・7% | 55・2% | 9・6% | 1・6% |
| 糖尿病 | 1・5(1・3–1・8) | 6・4% | 71・4% | 3・1% | 1・1% |
| 大気汚染 | 1・1(1・1–1・1) | 75・0% | 13・3% | 6・3% | 2・3% |
データは相対リスク(95%CI)または%。全体加重PAF=39-7%。PAF=人口帰属率。
*加重PAFは、共同体性で調整した場合のPAF全体に対する各リスク因子の相対寄与度である。
次のセクションでは 2017年の委員会のエビデンスベースに追加する、リスクと一部の緩和を含む、新たに発表された関連する研究や例示的な研究について簡単に説明する。我々は、大規模で人口を代表する研究、またはエビデンスがほとんど存在しない分野の小規模な研究を選んだ。これらの研究をライフコース順に、またライフコース内では母集団に帰属する因子の大きさの順に論じている。
教育と中年期・晩年期の認知刺激
到達した教育レベル
2, 35, 36, 37 新しい研究では、教育によって全体的な認知能力が上昇し、脳の可塑性が最も高まる思春期後半にプラトーに達する前に、教育によって上昇することが示唆されている。このことは、認知刺激が初期の生活の中でより重要であることを示唆している。明らかな後期効果の多くは、認知機能の高い人が認知刺激的な活動や教育を求めていることによるものかもしれない38。
認知維持
中国で行われた大規模な研究では、教育レベルの異なる人々にアピールすると判断された活動を考慮して、成人期の認知活動と教育レベルの高い人々の活動を分離しようとした40。この研究では、逆因果関係を減らすために、ベースラインから3年以内に認知症になった人を除外した。
この知見は、中年期の活動が後期の認知能力の向上と関連しているという小規模な研究と一致している。例えば、30~64歳の205人を66~88歳まで追跡調査したところ、旅行、外出、音楽、芸術、身体活動、読書、第二言語の会話は、教育、職業、後期の活動、現在の脳の構造的な健康状態とは無関係に、認知能力の維持と関連していた41。同様に、1936年生まれの498人の成人期の知的活動、特に問題解決に従事することは、認知能力の低下の速度ではないが、認知能力の獲得と関連していた42。
認知機能の低下
使うか、使わないかの仮説は、精神活動が一般的に認知機能を改善する可能性があることを示唆している。45 その後、1658人を対象とした12年間の研究では、勤務年数ではなく定年年齢の高齢化が認知症リスクの低下と関連していることが明らかになった。47 別の研究では、健康、年齢、性別、富を調整した場合、退職者(n=18 575,平均年齢66歳)と非退職者を比較して、退職に起因するエピソード記憶の喪失が2倍に増加していることが明らかになっている。
正常な認知と軽度の認知障害における認知介入
認知介入または認知志向型治療は、一般的または特定の認知領域を改善するための戦略やスキルから構成される50 。
一般集団を対象とした3つのシステマティックレビューでは、訓練された領域は改善するかもしれないが、コンピュータ化された認知トレーニングを含む特定の認知介入による一般化された認知の改善の証拠は見出されなかった52, 53, 54。
軽度認知障害を対象とした少なくとも4時間のコンピュータ認知訓練(n=351,対照n=335)の17の対照試験のメタアナリシスでは、訓練後の一般的な認知能力に中等度の効果が認められた(Hedgesのg=0-4,0-2-0-5);55が、質の高い研究は少なく、認知症予防に関する長期的な質の高いエビデンスは現在のところ存在していない。第三のシステマティックレビューでは、質の高い5つの研究(4つのグループ指導型研究と1つのコンピュータによる研究)を同定し、軽度認知障害における認知トレーニングの効果に関するエビデンスは結論を出すには不十分であると結論づけている。健康な高齢者、軽度認知障害者、認知症者を対象とした認知トレーニングのメタアナリシスの包括的で質の高い系統的な概要では、ほとんどの研究が低水準であり、陽性であり、ほとんどの研究が統計的に有意であったが、研究の水準が低く、結果が不均一であったため、臨床的に価値があるかどうかは不明であった(図3)。
図3 認知障害のある高齢者とない高齢者における認知重視治療の客観的認知転帰を調査したメタアナリシスのプール結果
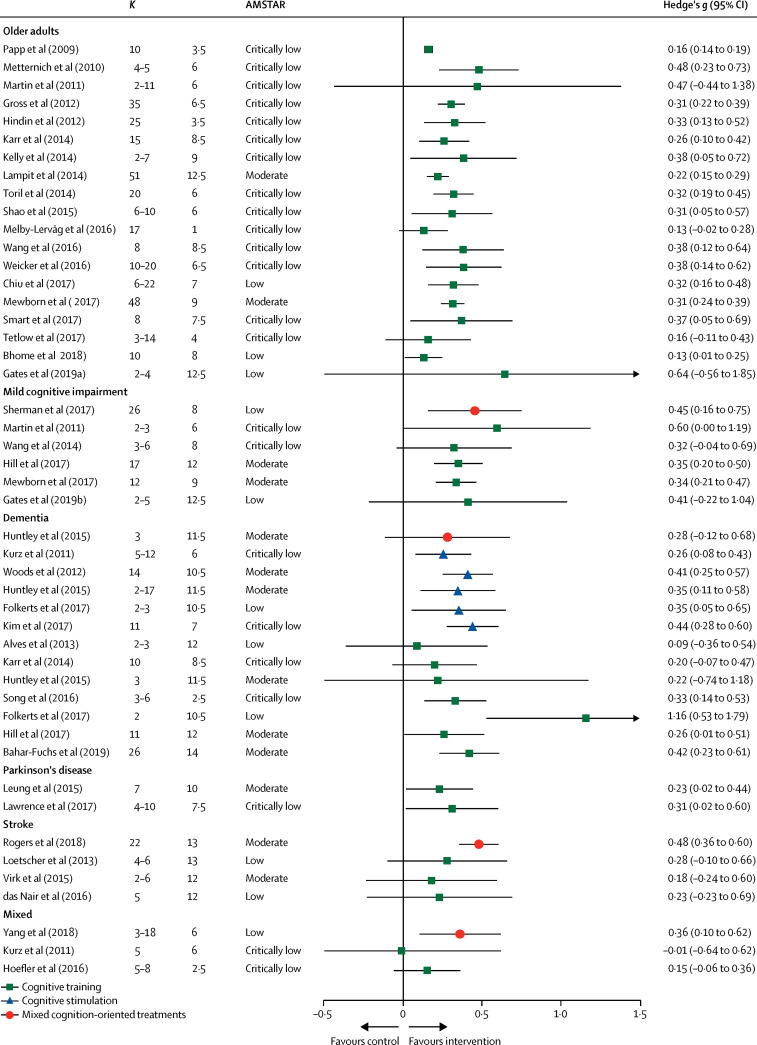
Kは解析に含まれた一次試験の数を表す。各アウトカム領域内で複数の効果量が報告されているレビューの場合、複合体が作成され、Kは効果推定値に寄与した一次試験の数の範囲を表する。AMSTAR=A MeaSurement Tool to Assessess systematic Reviews(最大スコア16)。Gavelin et al,51よりSpringer Natureの許可を得て引用。
無症候性軽度認知障害における認知に対する行動活性化の唯一の無作為化比較試験(RCT)(221人)では、行動活性化対支援療法は、記憶力低下の2年間の発生率の低下と関連していた(相対リスク[RR] 0-12,0-02-0-74)57。
聴覚障害
最初の報告では、ベースラインの認知が正常で、WHOの難聴の閾値である25dBの難聴を呈している人を対象とした研究のメタアナリシスを用いて、認知症のPAFが最も高かった。2017年の委員会では、9~17年以上追跡調査した集団では、認知症のRRは1~9であり、追跡調査期間が長いため、逆の因果関係のバイアスは考えにくいことが示された。米国の人口を代表する平均年齢59-4歳の6451人を対象とした横断的研究では、聴力が10dB低下するごとに認知力が低下することが明らかになっており、不顕性レベルの聴力障害(25dB以下)が認知力低下と有意に関連していることが示されている59。
病因はまだ解明されていないが、ベースラインの認知障害のない成人194人(ベースライン平均年齢54-5歳)を対象とした米国の小規模プロスペクティブコホート研究では、少なくとも2回の脳MRI検査を行い、平均19年間の追跡調査を行った結果、聴力測定法で測定された中年期の聴覚障害は、海馬や内耳皮質を含む側頭葉の音量低下の急峻さと関連していることが明らかになった60。
補聴器
65歳以上の3,777人を対象とした25年間のプロスペクティブ研究では、補聴器を使用している人を除き、自己申告による難聴者で認知症の発症率が増加していることが明らかになった61。62 50歳以上の高齢者2040人を対象とした米国の全国代表調査では、2年ごとに18年間にわたって検査を行った結果、補聴器の使用開始後、即時想起と遅延想起の低下が、他の危険因子を調整しても少ないことが明らかになった。これらの前向き研究の追跡期間が長いことから、認知症を発症している人が補聴器を使用しにくくなっている可能性よりも、補聴器の使用が予防的であることが示唆された。難聴は認知刺激の減少により認知機能の低下をもたらす可能性がある。
外傷性脳損傷(TBI)
国際疾病分類(ICD)では、軽度外傷性脳損傷を脳震盪、重度外傷性脳損傷を頭蓋骨骨折、浮腫、脳損傷または出血と定義している。単発の重度外傷性脳損傷は、ヒトおよびマウスモデルでは、広範な高リン酸化タウ病理と関連しており、APOE ε3対立遺伝子と比較してAPOE ε4を有するマウスでは、外傷性脳損傷後に海馬の高リン酸化タウが多く見られる。67 認知症リスクは、外傷性脳損傷後6ヵ月間が最も高く(4-1,3-8-4-3)外傷性脳損傷を受けた人の受傷回数が多いほど増加した(1回の外傷性脳損傷では1-2,1-2-1-3,5回以上の外傷性脳損傷では2-8,2-1-3-8)。外傷性脳損傷のリスクは他の身体部位の骨折よりも高く(1-3,1-3-1-3)逆因果関係のバイアスを減らすために、外傷性脳損傷後2年以内に認知症を発症した人を除外した後も上昇したままであった67。
67 同様に、50歳以上の300万人以上を対象としたスウェーデンのコホートでは、外傷性脳損傷は1年後の認知症リスクを増加させ(OR3-5,95%CI3-2-3-8)30年後もリスクは低下したものの、上昇したままであった(1-3, 1-1-1-4)。 68 ICDで定義された単一の軽度の外傷性脳損傷は重度の外傷性脳損傷よりも認知症リスクが低く、多重の外傷性脳損傷はさらにリスクを高めた(単一の外傷性脳損傷ではOR 1-6,95%CI 1-6-1-7,重度の外傷性脳損傷では2-1,2-0-2-2,多重の外傷性脳損傷では2-8,2.5-3-2)。また、早期発症のアルツハイマー病を対象としたあるコホート内の症例対照研究では、外傷性脳損傷が危険因子であり、数や重症度に応じて増加していることが明らかになった。
退役軍人は職業性外傷性脳損傷のリスクが高く、正式な記録を残すことで長期的な追跡調査が可能になる。外傷性脳損傷を受けた退役軍人178,779人と外傷性脳損傷を受けていない退役軍人との間で傾向を比較した研究では、認知症リスクは外傷性脳損傷の重症度と関連していることがわかった(意識喪失のない軽度の外傷性脳損傷ではHR2-4,95%信頼区間2-1-2-7,意識喪失のある軽度の外傷性脳損傷では2.5,2-3-2-8,中等度から重度の外傷性脳損傷では3-8,3-6-3-9)70。71
脳震盪を起こした高齢者28,815人を対象としたコホート研究では、平均追跡期間3-9年で6人に1人が認知症を発症し、認知症のリスクが2倍になることが明らかになった。スタチンは傷害に関連した脳浮腫、酸化ストレス、アミロイドタンパク凝集、神経炎症を緩和する可能性があるため、今後のRCTの実施が示唆されている。
72 慢性外傷性脳症という用語は、スポーツ頭部外傷について述べているが、まだ完全には解明されておらず、幅広い範囲の神経病理と転帰を網羅しており、現在の見解はほとんど推測に基づいたものである。その証拠はその後、スコットランドの元サッカー選手を対象とした研究で、死亡診断書に記載されているアルツハイマー病(HR 5-1, 95% CI 2-9-8-8)と、認知症関連の薬を処方されている(OR 4-9, 95% CI 3-8-6-3)が、医療記録には記載されていないことが対照群よりも多いことが報告されたことで強化された。
高血圧
中年期の高血圧が持続することは、後期認知症のリスクの増加と関連している。1440人からなるFramingham Offspringコホートでは、収縮期血圧の上昇(中年期に140mmHg以上、平均年齢55歳)は、18年間の追跡調査期間中に認知症を発症するリスクの増加(HR 1-6,95%CI 1-1-2-4)と関連していた12。同じコホートにおいて、理想的な心血管パラメータ(現在の非喫煙者、体格指数[BMI]18-5-25kg/m2,定期的な身体活動、健康的な食事、最適血圧<120/<80mmHg、コレステロール、正常な空腹時血糖)を有する中年後期(平均年齢62歳)の人々と、これらのリスクのうち少なくとも1つを有する人々とを比較した75。75 理想的な心血管パラメータを持つ人は、全原因性認知症(HR 0-8,95%CI 0-1-1-0)血管性認知症(0-5,0-3-0-8)臨床的に診断されたアルツハイマー病(0-8,0-6-1-0)の10年リスクが低かった。英国の公務員8639人を対象としたコホート研究では、50歳時の収縮期血圧が130mmHg以上であっても、60歳や70歳では認められず、認知症リスクの増加と関連していた(1-4, 1-1-1-7)。
さらに別のコホート研究では、40歳からと定義される中年期の高血圧は、脳容積の減少と白質肥大容積の増加と関連していたが、アミロイド沈着は認められなかったと報告しており、メカニズムについての潜在的な洞察を提供している76。
降圧剤、アスピリン、スタチン剤
50歳以上の高血圧患者9361人を対象とした米国およびプエルトリコの収縮期血圧介入試験(SPRINT)は、集中治療群(収縮期120mmHg未満を目指す、n=4678)では、標準治療群(収縮期140mmHg未満、n=4683)に比べて心血管イベントおよび死亡が有意に少なかったため、早期に中止された78 。標準治療群と比較した集中治療群では、介入期間終了から平均2年、ベースラインから5年以内の認知症症例数が1000人年あたり8-6例(HR 0-8,95%CI 0-7-1-0)に対し、集中治療群では7-2例であった。事前に指定した副次的転帰も、軽度認知障害(14-6例/1000人年 vs 18-3例/1000人年;HR 0-8,95%CI 0-7-1-0)軽度認知障害または認知症の合併(20-2例/1000人年 vs 24-1例/1000人年;HR 0-9,95%CI 0-7-1-0)79の集中群で減少しており、軽度認知障害のリスクの減少を示唆した最初の試験となった。追跡調査から失われた人々は、継続した人々よりも認知症のリスクが高かったが、追跡調査率は介入群によって差がなかった80。
6つの研究が重複している高血圧を下げるための血圧降下薬の4つのメタアナリシスでは、効果の複合的な推定値が示されている。いずれのメタアナリシスでも、臨床的に診断されたアルツハイマー病だけでなく、あらゆる認知症の転帰について、介入群で認知症が減少したことが示唆されている。最初のメタアナリシスでは、血圧を低下させる薬物の無作為化比較試験(RCT)を対象とし、限界的な有意差(RR 0-9, 95% CI 0-9-1-0)で10%程度のリスク低下が報告された(81)。2つ目は、利尿薬の15の臨床試験と観察研究、52,599人(年齢中央値76歳)追跡期間中央値6-1年(認知症HR0-8,95%CI0-8-0-9,アルツハイマー病0-8,0-7-0-9)を対象とした。 83 4番目はカルシウム拮抗薬のみを処方された人に焦点を当てたもので、高血圧症の高齢者75239人(年齢中央値72歳、追跡期間中央値8-2)からなる10のRCTと観察研究が含まれており、認知症リスクの低下を示している(RR 0-7,95%CI 0-6-0-9)84。
図4 高血圧者における降圧薬使用と認知症発症との関連性
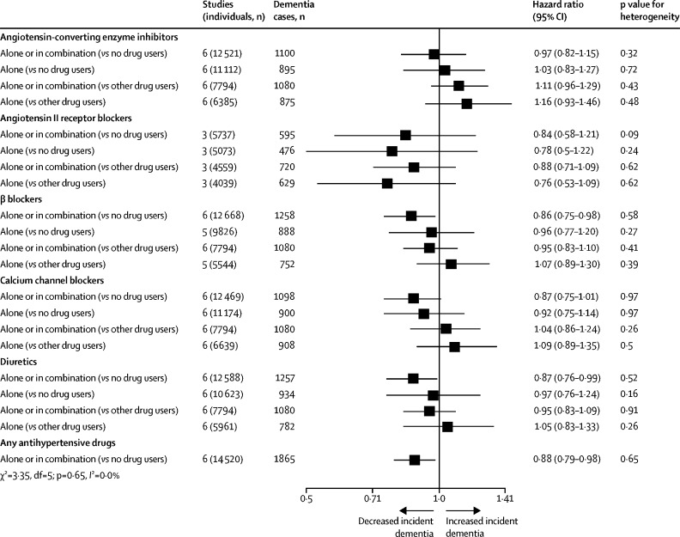 認知症のリスクがある高齢者にスタチンを投与しても、認知機能の低下や認知症を予防しないという良好なエビデンスが報告されている。
認知症のリスクがある高齢者にスタチンを投与しても、認知機能の低下や認知症を予防しないという良好なエビデンスが報告されている。
86 あるRCTでは、65歳以上の健康な成人19,114人を対象にアスピリン100mgとプラセボを比較したところ、認知症(HR 1-0,95%CI 0-8-1-2)死亡、身体障害、心血管疾患は4-7年の間に減少しなかったことが報告されている。
身体的不活動、運動、フィットネス
身体活動の研究は複雑である。身体活動のパターンは、年齢、世代、罹患率によって変化し、性別、社会階級、文化によっても異なる。これらの研究は、リスク軽減と逆因果関係の両方の可能性を持つ複雑な関係を示唆している。
1~21年間の縦断的観察研究のメタアナリシスでは、運動が認知症リスクの低下と関連していることが示されている。
2017年の委員会以降、30~60歳の参加者28,916人を対象としたHUNT研究が発表され、この分野におけるこれまでの文献を補強している。対照的に、10人308人の28年間の追跡調査を報告したWhitehall Studyでは、週に2~5時間以上の中等度~活発な身体活動を自己申告した場合、10年間の認知症リスクは低下したが、28年間の認知症リスクは低下しなかったと報告されている。しかし、ある44年間の研究では、スウェーデンの人口を代表する女性191人(平均年齢50歳)を対象に、ベースラインのピークフィットネスが低かった参加者の32%、中程度だった参加者の25%、高かった参加者の5%が認知症を発症したと報告している(高対中程度のHR 0-1,95%CI 0-03-0-5,低対中程度のHR 1-4,0-7-2-8)。
90 比較的若年層の成人を対象とした19の観察研究の個人レベルのメタアナリシスでは、404 840人の参加者のデータ(平均ベースライン年齢45-5歳、平均追跡期間14-9)が含まれており、診断前10年間に運動不足だった人では、全原因性認知症(HR 1-4,95% CI 1-2-1-1-7)と臨床的に診断されたアルツハイマー病(1-4,1-1-1-1-7)の発症率が増加していたと報告されている91。しかし、認知症発症時期の10-15年前に測定した認知症リスクには、心血管疾患を併存している人を除いて差は認められなかった(RR1-3,95%CI 0-8-2-1)。
認知症の進行により運動をしなくなることがあるので、運動不足は認知症の結果であるか原因であるか、あるいはその両方であり、心血管疾患を合併している人ではよりリスクが高いかもしれない。他の転帰と同様に、運動はリスクのある時期に近い時期に継続して行う必要があるかもしれない。
運動の臨床試験
2017年の委員会以降、いくつかのメタアナリシスとシステマティックレビューが発表されており、その中で我々が含めた3つの質の高いメタアナリシスが発表されている。最初のものは、50歳以上の認知的に正常な成人を対象に、1回あたり45~60分持続する任意の頻度の中等度または精力的な運動を調査した、総参加者数が不明確な39のRCTが含まれていた。この解析では、1回45-60分の中等度または高強度の抵抗運動(13研究)または有酸素運動(18研究)について、全体的な認知機能の改善(標準平均差[SMD]=0-3,95%CI 0-2-0-4)が報告されたが、ヨガについては両者の間に差はなかった。93 軽度認知障害者を対象としたRCTの第2のメタアナリシスでは、介入群(0-3,0-1-0-0-5)で全体的な認知能力が向上し、有酸素運動の効果はより高い(0-6,0-5-0-6)ことが示された。94 この研究ではアウトカム指標として認知症はなかった。長期の運動に関するRCTの第3のメタ解析では、5つの研究(4つが12ヵ月、1つが24ヵ月)で、ベースラインの認知が正常な2878人が参加した95。著者らは、本研究では認知症、軽度認知障害、臨床的に有意な認知機能低下を軽減するための運動の有意な効果は示されなかったが、パワー不足であったと結論づけた。2017年の委員会以降、WHOのガイドラインが発表されており、これらを参考にした特定の活動レベルを示唆しており、さらに1つのシステマティックレビューでは運動の効果に関する性差を検討している。
糖尿病
2017年の委員会では、認知症の危険因子としての糖尿病について報告した。認知症の危険因子としての糖尿病を治療済みと未治療を区別することは、観察研究では困難である。14のコホート研究で2型糖尿病を有する200万人以上の患者からのプールメタアナリシスでは、認知症102 174人を含む14のコホート研究において、糖尿病はいずれかの認知症のリスクの増加と関連していた(RR 1-6,95%CI 1-5-1-8,女性は1-6,男性は1-4-1-8)98)。99 しかし、糖尿病のコホート研究のメタアナリシスでは、メトホルミンを服用している糖尿病患者は、他の薬を服用している患者や薬を服用していない患者に比べて、断面的には認知機能障害の有病率が低く(3つの研究でOR 0-6,95%CI 0-4-0-8)縦断的には認知症の発症率が低下した(6つの研究でHR 0-8,95%CI 0-4-0-9)ことが報告されている。しかし、別の解析では、インシュリン療法の有害性が考えられる(1-2, 1-1-1-1-4)が、認知症の発症に対するメトホルミンの保護効果は認められなかった(3件、RR1-1, 95% CI 0-5-2-4);しかし、これはインシュリン療法を受けている2型糖尿病患者の糖尿病の重症度を考慮したものではなかった99。
全体的に2型糖尿病は将来の認知症発症の危険因子であることは明らかであるが、特定の薬がこの危険性を改善するかどうかは不明である。糖尿病の集中的なコントロールが認知症のリスクを低下させるわけではない。
複合的な心血管リスク因子
個々の心血管リスク因子の研究では、通常、個々の人に集まる他の心血管リスクをコントロールしている。これは、リスクが発生する組み合わせや文脈を考慮していない。50歳の7899人を25年間追跡した英国の研究では、4つの行動関連(喫煙、食事、身体活動、BMI)と3つの生物学的指標(空腹時血糖、血中コレステロール、血圧)に基づいて心血管系の健康スコアを計算し、それぞれ3点満点のスケール(0,1,2)でコード化されている。 100 良いスコアは、行動関連(サブスケールのHR/1ポイント増分0-9,95%CI 0-8-0-9)と生物学的サブスケール(0-9,0-8-1-0)の両方について、認知症リスクの低下(HR 0-9,95%CI 0-9-1-0)と関連しており、心血管疾患のない人の追跡調査(0-9,95%CI 0-8-1-0)で維持されていた。これらの著者らはまた、このスケールのスコアと海馬萎縮および総脳体積との関連性を報告したが、白質増強は報告していない。この結果は、中年期における心血管リスク因子のクラスタリングの重要性を強調している。このサンプルにおける個々のリスク因子の研究では、他の個々のリスクをコントロールしても有意な関連は示されていなかったからである。
過度のアルコール消費
102 アルコールと認知や認知症の転帰との複雑な関係について、詳細なコホート研究や大規模な記録に基づく研究など、さまざまな情報源からのエビデンスが増えてきている。アルコールは文化的パターンやその他の社会文化的、健康関連の要因と強く関連しているため、エビデンスベースを理解することは特に困難である。
フランスの5年間の入院患者3100万人以上を対象とした縦断的研究では、アルコール使用障害(ICDで定義されている有害な使用や依存)が認知症リスクの増加と関連していることが明らかになった(女性はHR3-3-3,95%CI3-3-3-4,男性は3-4-4,3-3-3-3-4)。
様々な定義を用いた軽度から中等度の飲酒に関する45の研究を取り入れたシステマティックレビューでは、飲酒しない場合に比べて認知症のリスクが低下すると報告されている(RR 0-7; 95% CI 0-6-0-91)。105, 106 英国のバイオバンクの40~73歳の男女ボランティア13 342人を対象とした5年間の追跡調査では、飲酒者は少なく、棄権者は分析していない。この研究では、週に12単位以上の飲酒をした人は、飲酒量が少ない人に比べて知覚照合課題の反応時間がわずかに低下したと報告されている(β2=-0-0-07,95% CI -0-09~-0-04)。また、14単位以上の飲酒はMRI上の右側海馬の萎縮と関連していた。
体重管理と肥満
世界的に高齢化が進む中、BMIの変化に伴い、太りすぎは新たな懸念材料となっている。35歳から65歳までの589 649人を含む19件の縦断的研究のレビューから、BMIの増加と認知症との関係を支持する新たなエビデンスが42年まで追跡調査された。肥満(BMI≧30; RR 1-3, 95% CI 1-1-1-1-6)ではあるが、太りすぎではない(BMI 25-30; 1-1, 1-0-1-2)ことが後期認知症と関連していることが報告されている。前述のメタアナリシスで引用した2つの研究を含む、成人(18歳以上)300万人の個人レベルのデータのメタアナリシスでは、前臨床および前駆性認知症の可能性が高い前に測定された体重の増加109は、認知症リスクの増加と関連していた(RR1-3,BMIの1-1-1-7/5単位の増加)11。
中年期の体重減少と認知症リスク
平均年齢50歳の認知症のない過体重・肥満成人を対象とした7件のRCT(468名)と13件の縦断的研究(551名)のメタアナリシスでは、BMIが25以上の人で2kg以上の減量が注意力と記憶力の有意な改善と関連していることが明らかになった。1件を除くすべての研究は65歳未満の若年者を対象としていた。RCTでは8-48週間で記憶力の改善が報告され(SMD=0-4,95%CI 0-2-0-6)短期縦断的研究では中央値24週間で改善が認められた(SMD=0-7,95%CI 0-5-0-8)が、長期的な効果や認知症予防のための減量の効果に関するデータはない。
喫煙
喫煙者は非喫煙者に比べて認知症リスクが高く2 、認知症を発症する可能性のある年齢よりも前に早死にするリスクが高いため、喫煙と認知症リスクの関連性に偏りや不確実性が生じている。世界的に見ると、非喫煙者の成人の35%、小児の40%が副流煙にさらされていると推定されているが、副流煙への暴露と認知症リスクへの影響に関する文献は少ない。ある研究では、55~64歳の女性では、副流煙への暴露は記憶力の低下と関連しており、他の交絡因子をコントロールした後でも、暴露時間とともにリスクが増加することが示されている115。
うつ病
うつ病は認知症の発症と関連しており、さまざまな心理的・生理的メカニズムが考えられる。うつ病は認知症の前駆症状や初期段階の一部でもある。認知症発症の数年前に発症した認知症神経病理が抑うつ症状の原因となる逆因果関係も考えられる。これらの説明は相互に排他的なものではない。糖尿病と同様に、うつ病を認知症の危険因子と考えている研究では、治療したうつ病と未治療のうつ病を区別しているものは少ない。62,598人の参加者を対象とした32の研究のメタ解析では、2年から17年の追跡調査で、抑うつエピソードは認知症の危険因子であることが示された(プール効果量2-0,95%信頼区間1-7-2-3)。ノルウェーのHUNT研究では、心理的苦痛の症状が25年後の認知症を予測することが示唆されたが、不確実性の範囲は広い(HR1-3, 95% CI 1-0-1-7)。英国のWhitehall研究では、10人の189人を追跡調査し、晩年にはこれらの症状が認知症リスクを増加させるが、若年では増加しないと報告している(追跡調査11年HR 1-7; 95%CI 1-2-2-2-4; 追跡調査22年1-0, 0-7-1-4)。34, 117 71-89歳の当初は認知的に健康な男性4922人を対象とした14年間の縦断的研究では、うつ病は認知症の発症率の1-5倍(95%CI 1-2-2-0)と関連していたが、この関連性はうつ病発症後5年以内に認知症を発症した人によって説明されていた118。
抗うつ薬の使用はそのリスクを低下させなかった。オーストラリアのアルツハイマー病神経画像化イニシアチブの軽度認知障害とうつ病の既往歴を持つ755人を対象とした研究では、動物モデルでアミロイドプラークの生成とプラーク形成を減少させることで知られるシタロプラムのような選択的セロトニン再取り込み阻害薬(SSRI)治療の効果を検討した119 。抗うつ薬治療を受けた人と受けていない人では、治療を受けた人と受けていない人の間に違いがあるように思われる。このように、抗うつ薬による治療が認知症リスクを軽減するかどうかという問題は、依然として未解決のままである。
社会的接触
社会的接触は認知症の予防因子として認められているが、認知症の進行に伴って孤立も起こる可能性がある。いくつかの研究では、社会的接触が少ないと認知症のリスクが高まることが示唆されている。中年以降はほとんどの人が結婚しているが、高齢になる頃には、夫よりも長生きしているため、社会的な接触が少なくなるため、不釣り合いな数の女性が寡婦になっている。このような世代では、婚姻関係は社会的関与に重要な役割を果たしている。さらに、ほとんどの結婚は比較的若い世代であり、既婚者は通常、独身者よりも対人接触が多い。世界中の812,047人を対象としたシステマティックレビューとメタアナリシスでは、生涯独身者(RR1-4,95%CI 1-1-1-9)と寡婦(1-2,1-0-1-4)では既婚者に比べて認知症リスクが高く、その関連性は異なる社会文化的環境で一貫していた。120 性を調整した研究では、男女間にリスクの差があるかどうかは不明であるが、教育と身体的健康を調整した研究では差が持続していたので、既婚者の方が身体的健康と教育が高い傾向にあるという理由だけではなく、社会的接触が多いことに起因しているのかもしれない。社会的孤立と認知に関する51の縦断的コホート研究のシステマティックレビューとメタアナリシスには、ベースライン時に50歳以上の102,035人の参加者が含まれており、2-21年の追跡調査が行われた。
新しいメタアナリシスでは、長期(10年以上)の研究では、社会的関与の良さが認知症リスクを適度に保護する(n=8876,RR=0-9,95%CI 0-8-1-0)が、孤独感は認知症リスクとは関連していないことが明らかになった。
122 孤独感と認知症の転帰に関する長期(10年以上)の研究は行われていない。英国の28年間の追跡調査では、10人308人を対象とした研究で、60歳での社会的接触の頻度が高いほど、15年間の追跡調査で認知症リスクが低いことが明らかになった(1標準偏差の社会的接触頻度のHRは0-9,95%信頼区間0-8-1-0)。123 日本の縦断的コホート研究では、平均10年の追跡調査で65歳以上の成人13,984人を対象に、婚姻状況、家族との交流、友人との接触、コミュニティグループへの参加、有給労働の有無の5段階の社会的接触尺度を算出した。このスコアは認知症リスクの減少と直線的に関連しており、5点満点の人は、最低の人に比べて認知症になる可能性が46%減少した。
社会的孤立の意味と認識には明らかな文化的差異があるにもかかわらず、社会的接触を増やすことによる保護効果の知見は、研究やメタアナリシスにおいて、異なる環境や男女のどちらにも概ね一貫している118, 120, 121。
社会的介入
認知症に対する社会的介入の効果についてのエビデンスはほとんどないが、60歳以上で正常な認知力を持つ576人の成人を対象とした質の低いRCTのシステマティックレビューでは、ファシリテートされたミーティングや考察グループが全体的な認知力の改善やフォローアップ時の脳量の増加と関連していることが明らかになっている118。
大気汚染物質
大気汚染と粒子状物質は、非伝染性疾患に関連するものを含め、健康状態の悪化に関連している。注目されているのは、それらが脳に及ぼす潜在的な影響である。動物モデルは、空気中の粒子状汚染物質が脳血管疾患や心血管疾患、アミロイドβ沈着、アミロイド前駆体タンパク質処理を介して神経変性プロセスを加速することを示唆している125, 126。大気汚染物質による認知症の高レベル化は、残留交絡の可能性がまだ残っているが、動物モデルでの効果は、ライフコースの剥奪によって引き起こされるもの以上の生理学的効果を示す証拠である。
二酸化窒素(NO2)濃度が高い(>41-5 μg/m3;調整後HR 1-2,95%CI 1-0-1-3)交通機関の排気ガスからの微粒子状物質(PM)2.5(1-1,1-0-1-2)127,128,129,および住宅用木材燃焼からのPM2.5(1μg/m3増加でHR=1-6,95%CI 1-0-2-4)は、認知症発症率の増加と関連している。127, 128, 129 大気汚染物質曝露と認知症発症の1~15年追跡調査を行った13件の縦断的研究を含む2018年までの研究の系統的レビューでは、PM2.5,NO2,一酸化炭素への曝露がすべて認知症リスクの増加と関連していることが明らかになった24。米国の大規模な10年間の研究では、PM2.5による認知症と過剰死の帰属負担は、特に黒人やアフリカ系アメリカ人や社会経済的に恵まれないコミュニティで高く、米国のガイドラインを超える粒子状PM2.5濃度と関連していた。
睡眠
睡眠が認知症に影響を与えるメカニズムはまだ明らかになっていないが、睡眠障害はβアミロイド(アミロイドβ)沈着131, 132,グリンパティック系クリアランス経路の活性化低下133,低悪性度炎症、タウの増加、低酸素症132, 134,心血管疾患と関連しているとされている。
2つのメタアナリシスで同様の知見が示された。1つ目は平均9~5年の追跡期間を持つ縦断的研究を統合したもので、2つ目は睡眠の測定方法が異なる質の異なる横断的および前向きコホート研究を報告したものである。睡眠障害は大まかに定義され、多くは自己申告であり、睡眠時間の短・長時間、睡眠の質の低下、概日リズムの異常、不眠症、閉塞性睡眠時無呼吸などが含まれていた。これらすべての睡眠障害は、睡眠障害がない場合と比較して、全原因性認知症(RR 1-2,95%CI 1-1-1-3)137および臨床的に診断されるアルツハイマー病(1-6,1-3-1-9)のリスクが高いことと関連していたが、すべてのコホート研究では、ベースラインで認知機能障害や認知症があった人を解析対象から除外しているわけではなかった138。睡眠時間と軽度認知障害や認知症のリスクとの間にはU字型の関連が報告されており、5時間未満では5時間以上、7時間未満、10時間以上の睡眠(2-2,1-4-3-5)に比べて認知症のリスクが高く(HR=2-6; 95% CI 1-4-5-1)全原因性認知症や臨床的に診断されたアルツハイマー病のリスクは同程度である135, 139, 140, 141。
アルツハイマー型の病態の蓄積につながる睡眠の減少のメカニズムは、より多くの睡眠とより少ない睡眠の両方が認知症リスクの増加と関連しているというエビデンスと矛盾している。135, 142 催眠術の使用はリスクを高める可能性があるが、これは不明であり 2018年の研究139では、関連性の所見が逆因果関係や交絡因子と関連していることが示唆されている。ベンゾジアゼピンの使用を考慮した場合、ある研究では睡眠時間はもはや有意ではなかったが139 、すべての研究では有意ではなかった。135 催眠薬を服用している人は、睡眠時間にかかわらず、服用していない人よりも認知症のリスクが高かった。
ダイエット
認知症における多くの微量栄養素の役割と健康状態をめぐる論争が続いており、栄養と食事成分の研究は困難である。観察研究では、葉酸やビタミンB群、ビタミンC、D、E、セレンなどの個々の成分に焦点を当てた研究が行われてきたが、その中でも特に葉酸やビタミンB群、ビタミンC、D、E、セレンなどは潜在的な保護因子として注目されている。その一例として、58~99歳の960人の参加者を対象とした縦断的コホート研究では、1日1~3食分に相当する緑の葉野菜の摂取量が最も多いと報告された人は、摂取量が最も少ないと報告された人に比べて、4~7年間の認知機能の低下が少なかった(β=0=0-05標準化単位 95% CI 0-02-0-07)。8255人の中年期の食生活を3回評価したプロスペクティブコホート研究では、平均25年近く追跡調査した結果、心血管疾患を持つ人を除いて、健康的な食事パターンも地中海式食事も認知症を予防しないことがわかった。
食事療法の介入
全食と同様に、多栄養素の介入にも関心が寄せられている。サプリメント(A、B、C、D、E、カルシウム、亜鉛、銅、マルチビタミン、n-3脂肪酸、抗酸化ビタミン、ハーブ)のRCTを含むシステマティックレビューとコクランレビューでは、中年(45~64歳)または高齢者(65歳以上)の認知機能の維持または認知症の予防にサプリメントを使用することについてのエビデンスが不足していることが明らかになった。 148, 149 コクランレビューでは、軽度認知障害者の認知機能にビタミンB群を6~24ヶ月間補充しても150 、ビタミンEを補充しても、軽度認知障害から認知症への進行を防ぐことに有益な効果があるというエビデンスはないことが示されている。ドコサヘキサエン酸、ビタミンB12,B6,葉酸、その他の栄養素を含む多栄養飲料を311人に投与した24ヶ月間のRCTでは、進行性アルツハイマー病の認知機能の低下を防ぐのに有意な効果は認められなかった152。
認知機能が正常な471人の参加者を対象とした2つのRCTのメタアナリシスでは、地中海食は対照群と比較して全体的な認知機能を改善することがわかった(SMD 0-2, 95% CI 0-0-0-0-4)153。
WHOのガイドラインでは、認知機能低下や認知症のリスクを減らすために地中海食を推奨しているが、ビタミンBとE、多価不飽和脂肪酸、マルチコンプレックスのサプリメントは推奨すべきではないと結論づけている97。
認知症予防のための組み合わせ戦略の臨床試験
FINGER RCTは、フィンランドの全国調査から募集した60~77歳の心血管リスク因子を持つ1260人を対象に、認知機能の低下と認知症を予防するために2年間のマルチドメイン介入を実施したもので、同様のマルチドメイン研究が2017年の委員会で議論された2。同様のマルチドメイン研究は2017年の委員会で議論された2 FINGERでは、ベースラインの社会人口統計学的、社会経済学的、認知、心血管系の状態に関係なく、介入群ではコントロール(包括的神経心理テスト電池Zスコア0-02,95%Cl 0-00-0-04)と比較して認知機能の低下が小群で減少したことが示された155 。
高齢者のインターネットカウンセリングを通じた健康的な高齢化(Healthy Ageing Through Internet Counselling in the Elderly:HATICE)研究では、2つ以上の心血管系リスク因子を有するオランダ、フィンランド、フランスの高齢者(65歳以上)2724人を募集した157, 158。この研究では、血管系リスク因子の自己管理の改善を目的とした対話型のインターネットプラットフォームとコーチによる遠隔サポートを、基本的な健康情報を提供する非対話型の対照プラットフォームと比較した。18ヵ月目の心血管リスク複合主要アウトカムでは、介入群で対照群と比較してわずかな改善が観察されたが、これは主に体重減少によるものであり、認知症リスクスコアは介入群でわずかに低かった(平均差-0-15,95%CI-0-3~-0-0)。より大きな効果が観察されたのは、ベースラインリスクが高い若年層(65-70歳)と低学歴層であり、リスクの高い集団を対象とすることがより効果的であることが示唆された。World Wide FINGERSなど、いくつかの多領域予防試験が進行中である。
PAFの合計計算
エビデンスが更新されたため、当初の9つの危険因子に加えて、アルコール過剰摂取、外傷性脳損傷、大気汚染を認知症のライフコースモデルに組み込んだ。アルコール過剰摂取、外傷性脳損傷、大気汚染の新しいRRを算出するために、文献を系統的にレビューし、アルコール過剰摂取と外傷性脳損傷については新たにメタアナリシスを行った。その他の9因子については、前回の分析で得られたRRと危険因子の有病率の値を用い 2017年委員会と同じ方法で共同性を算出した2
PAFの計算
我々は、英国のコミュニティ居住成人1万人以上の代表サンプルを用いて、データが存在する11の危険因子の共同性(危険因子のクラスタリング)159を計算し、各因子の固有のリスクを計算できるようにした。外傷性脳損傷を測定するデータセットが見つからなかったため、関心のある他の11の危険因子との共同性を計算することができなかった。そこで我々は他の11の共同体の平均を用いて加重PAFを計算し、外傷性脳損傷を含めることができた。社会的接触の代理指標として同居を、大気汚染曝露の代理指標として都市性を用いた。我々の分析では、4つの主成分が発見され、11の危険因子間の総分散の55%を説明し、実質的な重複を示唆した。付録(p 2)はPAF式と共同性の計算手順を示しており、次に我々の新しいメタアナリシスについて詳しく説明し、図を更新して新しい計算を行うために使用した。
新しいシステマティックレビューにおける新たに選択されたリスクの組み入れ
アルコール
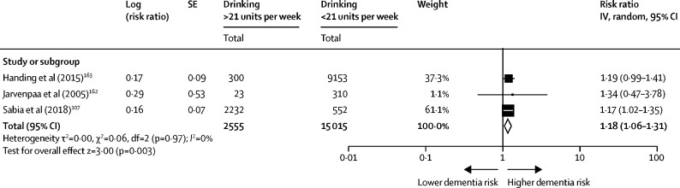
検索は、開始から 2019年10月29日まで、Embase, Allied, and Complementary Medicine, MEDLINE, PsycINFOの用語 “dementia” OR “dement*”で行った。OR “アルツハイマー病” OR “血管性認知症”, “アルツハイマー*” AND “アルコール” OR “エタノール” OR “アルコール*” OR “drink*” 160 我々は包含基準を使用した:アルコール摂取量は加齢とともに減少する傾向があるため、中年期の飲酒を測定したオリジナルの集団ベースのコホート研究、ベースライン時に単位または週当たりの飲酒回数(1回の飲酒で1~5回)で定量化したアルコール消費量161,有効な臨床的尺度を用いて追跡調査時に全原因性認知症の有無を確認した研究である。我々は追加データを求めて著者に連絡を取った。162 3件の研究が我々の包含基準を満たしていた107, 162, 163 我々はGeneric Inverse Variance法を用いたランダム効果メタアナリシスにおいて、HRをRR164に変換し、生データ162を用いてRR165を算出した。週21単位(168g)以上の飲酒に関連するRRは、軽度の飲酒と比較して1-18(95%Cl 1-06-1-31;図5)であった。世界的な推定値が見つからなかったため、イングランド健康調査所の大酒量有病率の数値を使用してPAFを計算した。加重PAFは0-8であった。
図5 中年期の週21単位以上の飲酒と軽度の飲酒とを比較した認知症の相対リスクのメタ解析
脊髄損傷
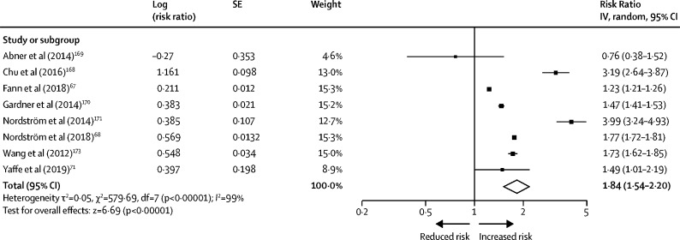
すべての重症度の外傷性脳損傷の全原因認知症に対するRRを推定するために、Embase、Medline、PsycINFOを2016年1月1日から 2019年10月21日まで検索し、以前の検索を更新した166の用語(「外傷性脳損傷」、「頭部損傷」、「脳損傷」、「外傷性脳損傷」)AND(神経変性、「認知機能障害」、「認知症」、「アルツハイマー病」、「パーキンソン病」、「前頭側頭型認知症」)を用いて検索した。164, 167 我々は、独自の集団ベースのコホート研究、ベースラインで報告された全重症度の外傷性脳損傷、有効な臨床指標を用いて追跡調査時に全原因の認知症が確認されていることを包含基準とした。166 プールされたRRは1-84(95%CI 1-54-2-20)であったが、外傷性脳損傷の全重症度からの全原因性認知症については(図6)研究ごとの推定値には不均一性があった(母集団が異なるためか)。我々は、メタ解析で得られた12-1%の外傷性脳損傷成人有病率を用いてPAFを算出した。
図6 全重症度の中年期外傷性脳損傷に関連する全原因性認知症の相対リスクのメタアナリシス
汚染
2019年のシステマティックレビューでは、観察研究を総合して、大気汚染による認知症リスクの一貫した増加が認められたが、異種比較対照群はメタアナリシスの対象にはならなかった24 。全原因による大気汚染曝露の評価、ベースライン時の認知機能の正式評価の使用、全原因による認知症の発生報告、成人(年齢≧18歳)のデータ、最低6ヵ月の追跡調査を有する縦断的研究を含めた。メタアナリシスが不可能であったため、我々はバイアスのリスクが低く中等度であった全原因性認知症の転帰を有する唯一の全原因性大気汚染の研究からのデータを使用した。この集団ベースの観察コホートは、汚染物質濃度が世界で最も低いカナダの人口ベースのコホートで、平均ベースライン年齢67歳の2,066,639人を対象とした。PM2.5とNO2の最も高い3つの四分位と最も低い四分位への暴露の帰属率は6-1%(4-8-7-5)であった。加重PAFは2-3であった。
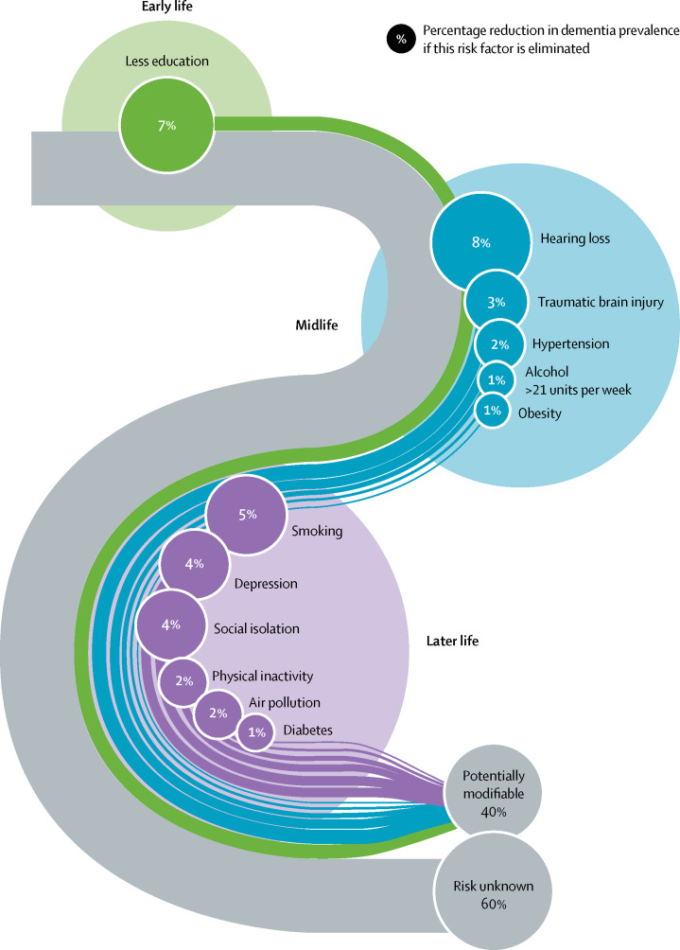
表1は、有病率、共同体率、相対リスク、共同体率で調整した非加重および加重PAFを示している。図7は、3つの新しい危険因子を含む、修正可能な認知症の潜在的危険因子の更新されたライフコースモデルを示している。
図7 認知症の潜在的な修正可能な危険因子の母集団帰属率
強さと限界
本委員会はこれまでで最も包括的な分析であり 2017年の委員会を更新し、潜在的に可逆性のある危険因子についてPAFを算出するのに十分な説得力のある新たな危険因子のエビデンスを提示した。我々は、選択した危険因子について体系的に文献をレビューし、我々の合成を更新し、共同性を計算するためのデータを特定するために、例示的な新しい文献を提供した。その結果、認知症の全症例の約40%が12の潜在的に修正可能な危険因子と関連しているという希望的観測が得られた。
この新しいモデルを計算するための仮定を行った。認知症のリスクについては世界的な数値を用いたが、リスク因子の有病率は国によって異なり、世界的な研究の多くは高所得国からのものであるため、データが不足しているため低中所得国は過小評価されている。リスク因子と認知症との間には因果関係があると仮定しているが、エビデンスの乏しいリスク因子は除外し、慎重に検討している。12の危険因子をすべてまとめた単一のデータベースは存在しないが、英国のデータベースで11の危険因子を見つけ、外傷性脳損傷については平均値を用いて共同性を計算した。残りの11因子については共同体率を計算した。他の地理的集団、あるいは年齢層や性別の分布が異なる集団における共同体性の知見がどこまで異なるかは不明である。社会的孤立は明示的に測定されておらず、有病率を考慮する際には同居などの近似的なプロキシを使用しなければならないことがわかった。
具体的には、アルコール乱用と認知症との関連についてのエビデンスは高所得国から得られており、全体像を把握するためには低中所得国からの今後の研究が必要である。大気汚染への曝露は生涯にわたって変化し、貧困や剥奪と表裏一体である。しかし、動物モデルでの影響は、生涯にわたる貧困によって引き起こされるもの以上に、特定の生理学的影響を示唆している。また、このリスク因子と他のリスク因子の教育との重複も考慮し、貧困と強く反比例する教育の補正は、交絡因子の少なくとも一部に対処することになる。しかし、大気汚染の認知症発症への影響を報告したある研究の結果では、教育やその他の危険因子を補正する前と補正後の推定値にほとんど差がなく、交絡因子の残存はほとんどないことが示唆された。
修正可能な危険因子と認知症を結びつける縦断的な証拠は、一般的に観察データの因果関係の基準を満たしている(強度、一貫性、生物学的妥当性、時間性、用量反応、コヒーレンス、準実験的研究、例えば、より多くの教育を受けている、補聴器を使用しているなど)。認知症発症年齢に近いリスクを測定した場合、前駆的変化が認知症に影響を与えたり、認知症を引き起こす可能性が高い。あるいは、危険因子が前臨床病理に作用したり、認知症を発症させたりすることもある。このように、若年発症の認知症では過度のアルコールや外傷性脳損傷が特に重要であるが、若年性認知症の多くは遺伝的リスクが関係している。また、生物学的脆弱性が高い時期には、リスク因子がより重要になるかもしれないが、これまでの研究では断定できない。リスクや保護効果を得るために必要な曝露の期間や、生活の中で変化する際の相互関係は明らかではないが、曝露の期間が長ければ長いほどより強い効果が得られると考えられる。さらに、我々の共同体の数値が示すように、危険因子は重複している。複数の危険因子を持つことが相加的な効果なのか、相乗効果なのかは、これらのデータからは立証できない。関連性は因果関係を証明するものではないが、すでに述べたように、いくつかの高所得国における有病率と罹患率の低下は、ここで推定された危険因子の少なくともいくつかが認知症の臨床症状と因果関係を持っていることを示唆している。
重要なポイントと提言
我々は 2017年の委員会モデルに認知症の3つの修正可能な危険因子(過度のアルコール、外傷性脳損傷、大気汚染)を追加することを支持する十分な新しい証拠があると判断する。2017年の委員会で示唆された9つの危険因子(教育、高血圧、聴覚障害、喫煙、肥満、うつ病、運動不足、糖尿病、社会的接触)に関する最新のエビデンスを追加することができた。175, 176, 177, 178 2017年の委員会で指摘したように、他の研究者は以前、他のいくつかの危険因子を考慮に入れてAPOε4に関連するリスクの推定値を7%で計算しており、この推定値は、修正可能な危険因子が認知症においていかに相対的に重要であるかを浮き彫りにしている2, 179。
いくつかの危険因子については、リスクのパターンとその人の他の健康状態(身体的、精神的)が特に重要であるかもしれない。現在のところ、地中海式または北欧式の食事は、特に健康的なライフスタイルの一つの構成要素として、認知機能が損なわれていない人の認知機能の低下を予防する上で価値があることを示唆するエビデンスがあるが、どのくらいの期間、またはどのくらいの年齢の間に摂取する必要があるのかは不明である。認知症予防の手段として、ビタミン、油、混合栄養補助食品を追加で摂取することは推奨しない。
認知機能の低下、全原因性認知症、アルツハイマー病を予防するための介入に関するRCTのデータは少ない。いくつかの重要な人生の影響については、特に法定教育年齢の変更などの自然実験に関連した観察データしか得られない。これらの影響は可能な限り体系的に調査すべきである。その他の影響は理論的には調査可能であるが、中年期のリスク因子や保護因子を調査するために必要な長期追跡調査や、より長期の研究での無作為化されていない無作為化されていない無作為化は困難である。認知や認知症の発症などの中間的なエンドポイントを研究に用いることは、認知症の転帰と密接な関係を持つ中間的なマーカーが存在しないため、特定の個人、年齢、性別について確実に予測できるかどうかは不明である。全体的に見て、高血圧の治療に関するエビデンスは最も強く、中年期を通じて高血圧は脳卒中がなくても認知症のリスクを増加させる。
より多くのエビデンスが必要であることは明らかであるが、有害な影響を与えずに認知症になる可能性を減らす方法が明確に示されれば、他の健康と福祉にも利益をもたらすからである。
認知症リスク低減のための推奨戦略には、集団全体を対象としたものと、対象を絞ったものの両方がある(パネル)。特に、黒人、アジア人、少数民族など、社会的に不利な立場にある人々がリスクを抱えていることを忘れてはならない。
パネル
認知症リスク低減のための推奨戦略
リ
リスクは、黒人、アジア人、少数民族を含む、社会的に不利な立場にある集団において特に高い。
母集団全体
- 世界中のすべての人のために幼児教育を優先する
- 国民全体の高血圧リスクを低減する社会的公衆衛生政策の実施
- ライフコース全体で社会的、認知的、身体的活動を奨励する政策を開発する(特定の活動がより保護的であるという証拠はない)。
- このリスク要因にさらされるリスクを軽減するために、ライフコースを通して難聴のリスクを検討する。
- 職業や交通機関を含む関連する環境で、重度の脳外傷のリスクを低減する。
- 大気汚染への曝露を減らすための国内および国際的な政策
- 子どもと成人の両方を対象に、喫煙への曝露を減らし、喫煙を減らし、禁煙を奨励するための国内および国際的な取り組みを引き続き強化する。
個人を対象とした
- 高血圧を治療し、中年期にはSBP<130mmHgを目指す。
- 難聴には補聴器を使用してほしい。
- 1週間に21単位以上の飲酒を避ける、または禁じる。
- 個人が危険性の高い頭部外傷の予防
- 禁煙は年齢に関係なく有益
- 健康的な食事の提供と運動量を増やす環境を整えることで、肥満と糖尿病の関連疾患を減らす。
- 中年期、場合によっては後期の身体活動を維持する。
効果についてはまだまだ学ぶべきことがあるが、修正可能な認知症の割合であっても、避けたり遅らせたりすることは、すべての人にとって国家的な優先事項であるべきである。
認知症の介入とケア
すべての認知症が予防可能なわけではなく、認知症への介入とケアに関する最新のエビデンスを紹介する。これまでは、認知症の特定のサブタイプ、特にアルツハイマー病に重点が置かれてきたが、アルツハイマー病は長年にわたり、様々な診断基準(DSM IVやDSM Vなど)で概念化されてきた。バイオマーカーは信頼性と妥当性を示す必要があり、認知症の場合は、例えば、ヒトパピローマウイルスは子宮頸がん、高血圧は脳卒中の場合と同様に、臨床症候群の転帰と密接かつ明確に関連している必要がある。
アルツハイマー病のバイオマーカーと検出
臨床的な認知症と関連した神経変性のマーカーとしては、脳の容積減少、すなわち海馬の容積減少、内葉皮質や内側側頭皮質の菲薄化などがあり、構造イメージングで確認されている。最も研究されている分子マーカーはアルツハイマー病で、アミロイドとタウであり、PETや脳脊髄液で臨床的に検出される。このような研究を解釈する上では、異なる年齢における特定の病態の有病率が重要である。例えば、母集団由来の研究では、50-59歳では3%未満であったプラークが、80-89歳では約40%にまで増加することが示されている。
アミロイドイメージング
アミロイドイメージングは、ゴールドスタンダードの比較対象が神経病理学または臨床診断のいずれかである場合、認知的に正常な人とアルツハイマー病の人の両方において、高感度かつ特異性で脳内アミロイドを検出し、アルツハイマー病を他の神経変性疾患と区別している183。アミロイドイメージングは認知症の診断検査ではないが、米国の研究では、地域社会から無作為に選ばれた高齢者1671人(平均年齢71歳)を募集した。10年間の追跡調査では、PET陽性者はアミロイド陰性者と比較してアルツハイマー病の発症確率が高い(HR 2-6,95%CI 1-4-4-9)。アミロイド陽性の軽度認知障害者では、その確率(HR 1-9, 95% CI 0-9-3-9)は、アミロイド陰性者(1-6, 0-8-3-4)とあまり変わらなかった。
同様に、オーストラリアで行われた599名のボランティア(平均年齢70歳)を対象とした8年間の追跡調査では、認知的に正常なPETアミロイド陽性者は、アミロイド陰性者に比べてアルツハイマー病発症のリスクが高いことがわかった(17-7% vs 8-1%;OR 2-4, 95% CI 1-5-4-0)。 184 PETアミロイド陽性であった266人のうち80%以上は8年以内に認知機能障害を発症しなかった。正常な認知または軽度の認知障害を持つアミロイド陽性者とアミロイド陰性者の5年後のフォローアップでは、リスクの増加の同じパターンを発見した(2-6,1-4-4-9)。リスクはまた、年齢1年ごとに増加する(HR 1-05,95%CI 0-55-2-0/年)およびAPOEε4状態(2-6,1-4-5-0)。
他のマーカーを持たないアミロイド陽性者のほとんどは、生涯の間にアルツハイマー病認知症を発症していない。他のバイオマーカーを持たないアミロイド陽性者の生涯リスクのモデルでは、ベースラインで認知機能が正常な90歳女性では8-4%、75歳女性では23-5%、65歳女性では29-3%とされている。10年リスクはかなり低いので、アミロイドバイオマーカーのみで認知機能は正常で神経変性もない65歳女性の10年アルツハイマー病リスクは2.5%、男性は2-3%であるが、神経変性を伴うとリスクは高くなる(表2)。
表2 アミロイドーシス単独および神経変性および軽度認知機能障害の存在下での女性のアルツハイマー病発症の年齢別10年リスク
| 正常状態1 | アミロイドーシス状態2 | 神経変性状態3 | アミロイドーシスと神経変性状態4 | 軽度認知障害とアミロイドーシスおよび神経変性状態5 | 軽度認知障害と神経変性状態6 | |
|---|---|---|---|---|---|---|
| 60年 | 0・2(0・06–0・8) | 1・3(0・6–2・5) | 3・6(1・1–14・2) | 7・1(4・5–10・9) | 93・5(91・1–95・0) | 57・2(48・2–67・9) |
| 65年 | 0・5(0・14–1・8) | 2・5(1・2–4・9) | 4・3(1・4–15・0) | 10・7(6・8–16・2) | 91・7(89・2–93・5) | 55・4(46・6–65・8) |
| 70年 | 1・1(0・34–3・5) | 4・7(2・4–8・7) | 5・5(2・0–16・6) | 15・5(10・0–22・8) | 88・6(85・8–90・6) | 52・2(43・8–62・4) |
| 75年 | 2・2(0・74–6・5) | 7・8(4・1–14・0) | 7・3(2・9–19・0) | 20・8(13・7–29・7) | 83・8(80・7–86・2) | 47・4(39・6–57・0) |
| 80年 | 3・7(1・3–9・8) | 11・1(6・0–18・7) | 9・3(3・9–20・9) | 24・4(16・4–33・8) | 75・8(72・2–78・7) | 40・0(33・1–48・6) |
| 85年 | 4・7(1・8–11・0) | 11・5(6・5–18・5) | 9・7(4・3–19・3) | 23・1(15・8–31・2) | 63・7(59・6–67・2) | 30・0(24・5–37・2) |
| 90年 | 3・8(1・5–8・2) | 8・2(4・7–12・9) | 7・1(3・3–13・3) | 16・8(11・5–22・6) | 46・7(42・7–50・2) | 19・1(15・3–24・3) |
データは相対リスク(95%CI)または%。Elsevierの許可を得てBrookmeyerとアミロイドβdalla185から転載。
全体的に、PETで測定したアミロイドとタウの状態とMRIで得られた一般集団由来のサンプルでの皮質厚の知識は、わずかな改善を加えるだけで、臨床的変数と遺伝的変数を持つモデルよりも記憶力の低下を予測するために臨床的に重要ではないかもしれない186。
原因不明の認知機能障害を持つ患者にアミロイドPETを使用すると、アルツハイマー病の臨床診断に変化が生じ、187,時には薬の処方にも変化が生じる。PETの使用が患者のケアを改善するのか、ケアコストを減少させるのかは不明である。認知症の原因が混在している人が多く、陽性の結果がアルツハイマー病のみを示すわけではない。
体液バイオマーカー
PETイメージングは非常に高価であり(米国では3,000米ドル)一部の臨床現場では使用されているが、より広い集団での有用性を理解するための研究課題となっている。188 アミロイドの複合血液バイオマーカーは、日本やオーストラリアでの研究に参加していた60~90歳の参加者を対象に、発見時のデータセットと検証時のコホートで検査したところ、受信機操作特性曲線下の面積は発見時で96~7%、検証時で94~1%であった。血液バイオマーカーはアミロイドPET測定188に対して80%以上の感度と特異度を有し、アミロイドβ1-42の脳脊髄液濃度と相関していた。これらの結果は他のアミロイド血中バイオマーカー189,190と類似しており、共通の基準となる基準への調和が今では不可欠である。現在では、脳脊髄液 アミロイドβ1-42/1-40比とアミロイドPETは交換可能と考えられているが、脳脊髄液タウのバイオマーカーは、現在ラジオリガンドによって測定されている脳のタウとは弱い相関しかない。ハンチントン病、多発性硬化症、軽度認知障害、アルツハイマー病の人は、神経変性のマーカーである血中ニューロフィラメント光濃度が上昇している可能性がある。
ポイントと結論
臨床現場で有用なバイオマーカーを使用するためには、結果に及ぼす年齢や性別の影響を含めて、適用される集団を十分に理解しておく必要がある。PETや体液中のアミロイドとタウの測定は、高齢者の認知機能障害のリスクが高いことを示すという妥当な証拠があるが、これらのマーカーを持つほとんどの認知機能正常者は臨床的に関連する時間内に認知症を発症しないため、個人レベルでは予後を予測することはできない。否定的なアミロイドの結果は、原因が不明なときに認知機能障害を持つ人々 の現在のアルツハイマー病の病理学を除外するために有用であり、個々 の個人が次の数年の間にアルツハイマー病を開発する可能性は低いことを示している。高濃度のニューロフィラメント光は、神経変性プロセスを示すが、その原因を示すものではない。バイオマーカーの診断的価値については、異なる代表的な集団において、また、特に低中所得国の人々においては検討されていない。血液バイオマーカーの潜在的な利点は、低コストであることと、多くの環境で広く受け入れられ、適用可能であることである。医療の多くの分野では、より信頼性の高い診断検査は、原因と症状の区別(発熱と結核)や危険因子と疾患の評価(高コレステロール血症や虚血性心疾患)を助けるために、疫学的研究や公衆衛生研究、試験などの研究を向上させてきた。認知症症候群の根底にある生物学的研究のために開発されたバイオマーカーも同様に価値評価の対象となる。
認知症の人への介入の原則
2017年の委員会では、患者や家族から懸念が提起された場合、正確な診断が有用であることを議論した。そのような診断は、可能性のある未来の計画を立てるための介入や利用可能な場合にはサービスへの入り口となり、また家族への支援や研究への入り口となる。残念ながら、これらのサービスは必ずしも利用できるとは限らない。認知症に関する国の計画では、タイムリーな診断をサポートし、本人や家族への支援を提供している。
懸念のない人へのスクリーニングは行っていないが、米国の予防タスクフォースによる厳密なシステマティックレビューでは、有益性と有害性の証拠がないことが明らかになった。197 生活の質、気分、または診断率の向上という点で明確な有益性も有害性も見出されなかった。
認知症の人は、多くの領域で症状を伴う複雑な問題を抱えている。支援や介入を提供する側は、本人を全体として考慮しなければならないし、本人の状況や家族や友人などの身近な介護者も考慮しなければならない。2 サービスが十分に提供されていない状況下では、この考え方は課題であり、今後も課題となるだろう。認知症は認知に影響を与える病気であるため、活動を計画する能力に影響を与え、認知症の人は、例えば音楽を聴いたり、庭や公園に出かけたりするなど、自分の好きなことをするための支援が必要になることが多い。ウェルビーイングは認知症ケアの目標の一つである。
診断が下された後の介入
薬剤
コリンエステラーゼ阻害薬は、軽度から中等度のアルツハイマー病患者の認知や日常生活動作の改善に有用であり、メマンチンは中等度から重度のアルツハイマー病には併用して処方することも、それぞれの薬剤を別々に使用することも可能である2, 199, 200 しかし、ほとんどの国で使用可能であるにもかかわらず、フランスでは、臨床医の注意を他の介入から逸らす一方で、わずかな利益しかもたらさないと考えられているため、これらの薬剤はもはや報酬を与えられていない。201 アミロイドβ治療薬の進歩は報告されておらず、モノクローナル抗体(例:ソランズマブ、クレネズマブ)やアミロイドβペプチドの産生に関与するプロテアーゼであるβ-セクレターゼの阻害剤の第3相試験では否定的な結果が報告されている。202 以前は無益とされていたAducanumabも、現在ではさらなる結果が発表されている。3種類の5HT6拮抗薬とカルシウム拮抗薬のニルバジピン203, 204も効果がない。これらの薬剤は、いわゆる治療濃度での治療中にも血管の漏れに大きな影響を与えている。このような副作用の長期的な影響は不明である。抗タウ剤、抗アミロイド剤、抗炎症剤が引き続き注目されており、特にアミロイドβ産生を標的とした場合には、症状前の介入が必要であるという主張もあるが、有効性の証拠205はなく、標的症状を悪化させるという証拠もいくつか存在するのが現状である206。
認知症の人の認知訓練
軽度認知症の389人を対象とした12の対照試験のメタアナリシスでは、4時間以上のグループベースのコンピュータによる認知トレーニング(平均年齢66~81歳、女性参加者63~5%)を実施したところ、全体的な認知能力に小さな統計的に有意な有益な効果が認められたが、これはバーチャルリアリティやビデオゲームの2つの試験(SMD=0~3,95%CI 0~0~0~5)に牽引されたもので、1つはバイアスのリスクが低いもの、1つは高いものであった55。
コクラン・レビュー207では、認知トレーニングに関する33の試験が発見されたが、そのうち1つだけが上記の試験と重複しており、軽度から中等度の認知症患者約2000人が参加しており、そのほとんどがバイアスのリスクが高いか不確かなものであった。207 認知トレーニングを受けた人は、通常の治療や非特異的な活動と比較して、全体的な認知に小から中程度の効果があり(SMD 0-4, 95% CI 0-2-0-6)言語流暢性などの特定の認知能力にも効果があり、その改善は数ヶ月から1年間持続した。認知訓練が認知刺激療法よりも優れていることを示唆する直接的な証拠は観察されなかった。
運動と身体活動
認知症と身体活動RCT208では、中等度から高強度の有酸素運動と筋力運動のトレーニングは、軽度から中等度の認知症患者の認知機能障害を遅らせることはないが、体力は改善した。米国の認知症における障害軽減研究209 では、60 歳以上の認知症患者 255 名とその家族介護者を対象に、ケースマネージャーが 6 週間にわたり、運動教育、楽しい出来事を増やすためのトレーニング、活性化行動の結果としての問題解決アプローチを含む多要素介入を家庭で実施し、140 名(54-9%)をフォローアップした。この研究では、介入前と介入後の比較で、身体活動量の増加、30分以上の運動摂取日数の増加(効果量0-6,95%CI 0-4-0-8,介入後13ヵ月時0-3,0-1-0-5)が認められた。
認知症の神経精神症状に対する介入
精神神経症状は認知症の人によく見られ、しばしば集団化している。これらの症状は認知症に先行している可能性があり、タウやアミロイド神経病理と関連している。しかし、認知症患者の病歴や環境に関連した他の要因も存在する可能性がある。神経変性は、ストレス因子や誘因に対する脆弱性の増大につながる可能性がある。遺伝学、認知的予備力、回復力、医学的併存疾患、介護者の反応を含む環境などが、これらの関係を変化させる可能性がある。ニーズと対応はまた、個人のものであり、その人自身の社会的、文化的、歴史的文脈と関連している。神経精神症状の第一段階の評価と管理は、基本的な健康に焦点を当てるべきである:症状の説明と診断;痛み(有効な痛みの評価を使用することが役立つかもしれない)病気、不快感、空腹感、孤独感、退屈、親密さの欠如、心配などの原因を探し、害のリスクを考慮しながら、これらの行動を軽減する2。
これらの症状に対する薬物療法の有効性を示す新しいエビデンスは存在しない。低用量(1日0~5mg)のリスペリドンやその他の抗精神病薬は有効な場合もあるが、効果がないことが多く、副作用もある2。これらの向精神薬は、神経精神症状に対する有効性のエビデンスはないが、害がある可能性があるという明確な証拠を示している;例えば、トラゾドンやベンゾジアゼピンは、転倒に関連した傷害を増加させる。
図8 認知症と診断された患者で抗精神病薬を処方された人の割合
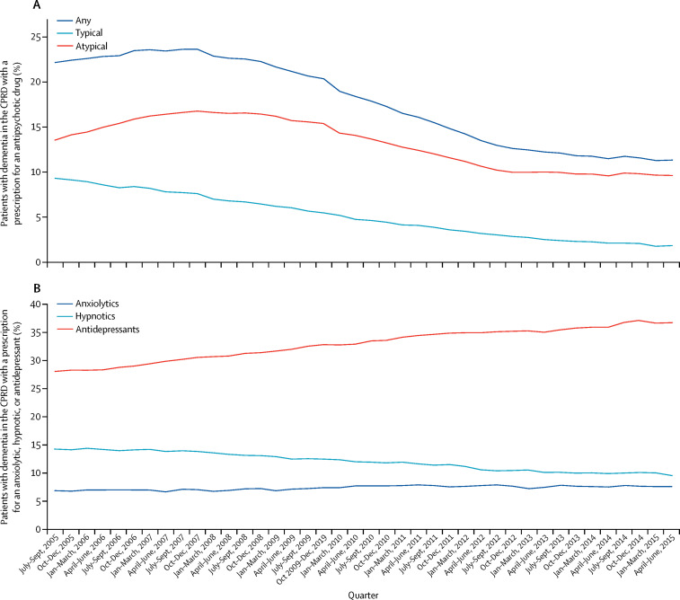
(A)と抗不安薬、催眠薬、抗うつ薬を処方された人の割合(B
CPRD=Clinical Practice Research Datalink. Donegan et al,211よりElsevierの許可を得て転載。
人を中心としたエビデンスに基づく心理社会的介入の有効性については、少なくとも短期的には徐々にエビデンスが蓄積されてきている。ドイツでは、在宅で介護者と一緒に、あるいは一人で生活している認知症患者634人(平均年齢80歳)を対象に、コンピュータ支援看護師によるアセスメントを用いて、個人に合わせた介入モジュールを決定した後、集学的チームによる話し合いと医師との同意を得て、看護師による認知症ケアマネジメントの6ヶ月間のクラスターRCTが実施された。ミニ精神状態検査(MMSE)の平均値は23で、認知症の正式な診断を受けたのは38%のみで、参加者の大多数(51%)は軽度の認知症だったが、中等度の認知症もあれば重度の認知症もあった。介入は、治療とケアの心理社会的管理、服薬管理と介護者支援、精神科医や神経科医との教育と話し合いで構成されていた。介入は、通常のケアと比較して、神経精神症状の転帰の改善と関連していた(Neuropsychiatric Inventory [NPI]スコア-7-5,95%CI-11-1~-3-8)が、この効果は通常のケアの悪化によるものと考えられた(通常のケアではNPIは7-2から15-2に増加したが、介入群ではNPIは7-6から8-2に増加していた)。このような神経精神症状のグループ間の減少は、他の研究結果から推測すると、抗精神病薬の投薬で予想されていたものよりも大きかった。生活の質に対する効果は、介護者と同居している人にのみ明らかであった。
213 この研究では、介入直後に全体的な神経精神症状が大幅に減少したことが報告されており、神経精神医学的インベントリー(スコアの平均差24-3,95%信頼区間3-1-45-6)と機能的依存と疼痛については、在宅のテーラーメイド活動プログラムを受けた群で改善したが、4ヵ月後にはその効果は持続しなかった。非完結者はより重度の神経精神症状を呈していた。
抑うつ状態
2017年の委員会以降、認知症のうつ病を治療するための抗うつ薬の2つの新しいシステマティックレビューでは、認知症患者に対する抗うつ薬治療は、プラセボと比較して症状のコントロールの改善につながらないという中程度の質の高いエビデンスが報告されている214,215。
撹拌
216 この重要な行動に関するエビデンスは増えつつあり、そのほとんどが介護施設の環境に焦点を当てている。216 この重要な行動についてのエビデンスは増加しているが、そのほとんどがケアホームの環境に焦点を当てたもので、これらの人々が最も影響を受けていることから、これらの知見は貴重である。
217, 218 ケアホームで多成分の学際的介入を実施した専門家による2つの新しいクラスターRCTでは、動揺の軽減に成功している。WHELD研究219は、精神神経症状の有無にかかわらず、認知症の人とのコミュニケーションの改善を目的とした、人を中心としたケアを提供している。この研究では、社会的、感覚的な体験やその他の活動の実施、抗精神病薬の見直しについての教育、身体的な問題への対応が行われ、9ヵ月後のCohen Mansfield Agitation Inventory (CMAI)の低下が認められた(MD -4-3点、95%CI -7-3~-1-2)。この介入により、8週間後(NPI-1-1-1点、95%信頼区間-0-1~-2-1;CMAI-4-7点、-0-6~-8-8)および12週間後(NPI-1-6,-0-6~-2-7;CMAI-5-9,-1-7~-10-1)に激越の減少がみられた。221 さらに別のRCTでは、スタッフがグループに分かれて6セッションの介入を行い、医療的、心理的、または社会的なアンメットニーズに関連するものとしての動揺を理解し、これらのニーズを満たすための戦略を実施するために、記述、調査、作成、評価のアプローチを用いてスタッフを指導した研究が行われた。このように、認知症患者の大多数を占める在宅生活者に関する知識には大きなギャップがある。
認知症における精神病症状
認知症の精神病の管理は非薬理学的介入から始めるべきであるが、認知症の精神病に対する介入の有効性に関するエビデンスは、動揺に対する介入よりも弱い。しかし、抗精神病薬の休薬に関するコクラン・レビューでは、抗精神病薬治療に反応した認知症患者を対象とした2つの試験が報告されている。これらの試験では、抗精神病薬の中止は症状の再発と関連していることが報告されている225 。一般的には、抗精神病薬を中止しても全体的な神経精神症状、有害事象、生活の質、認知機能にほとんど差がないか、ないかという質の低いエビデンスがあった。
アパシー
無関心は関与の反対であり、関心の低下、自発性の低下、活動性の低下を意味すると概念化されている。認知症のある人は、認知症のない人と同様に、より多くの活動に参加するが、そのためには追加の支援が必要である。認知症の無気力感に対するメチルフェニデートとプラセボの薬物RCTに参加した少数の人々のコクラン・レビューでは、無気力感評価尺度(MD -5-0, 95% CI -9-6 to-0-4, n=145, 3研究、質の低いエビデンス)ではわずかな改善が見られたが、NPI無気力感サブ尺度(MD -0-1, 95% CI -3-9 to 3-7, n=85, 2研究)では改善しなかったことが示されている。
睡眠
認知症の睡眠に対する薬物療法が有効であるというエビデンスはなく230,早期死亡、入院の増加、転倒などの弊害があるというかなりのエビデンスが存在する。
介護者
認知症症状ではなく精神神経症状に関連した介護者の苦痛は、ある研究では医療サービスの利用と費用の増加と関連していた232。8セッションのSTrAtegies for RelaTivesの介入を6年間追跡調査したRCT233の報告では、介護者の抑うつ症状と症例レベルのうつ病リスクに対して継続的な有効性が認められ(調整済みMD -2-00;95%CI -3-4~-0-6)患者関連費用は介入を受けなかった人に比べて約3倍低かった(中央値5759ポンド対最終年16,964ポンド;p=0-07)。 233 別の米国の研究234では、663人を追跡調査し、平均年齢77歳、55%が女性であった。認知症の人の症状よりも介護者の抑うつが認知症の人の救急外来利用を予測し、73%(RR 1-73,95%CI 1-3-2-3)の増加を示した。
機能
英国のRCTでは、軽度から中等度の認知症(MMSE≧18,平均24)の参加者475人とその家族介護者に対して、作業療法士や看護師による自宅での治療による個人の目標達成に焦点を当てた14回の認知リハビリテーションが行われた。介入群では、通常の治療と比較して3ヵ月と9ヵ月間の目標達成率が増加したと報告されている(効果量0-8,3ヵ月と9ヵ月の両方で95%CI 0-6-1-0)235 。全体的な効果の大きさをメタアナリシスしないRCTのシステマティックレビュー236では、地域で認知症とともに生活する人の機能を改善した介入はすべて、集団介入ではなく個人介入であると結論づけられている。これらは、在宅での理学療法士による有酸素運動(2 つの研究、大きい方は肯定的、アルツハイマー病 140 人、小さい方は否定的、アルツハイマー病 30 人)個別認知リハビリテーション(軽度または中等度認知症、2 つの研究、認知予備群 257 人、対照群 255 人)在宅活動に焦点を当てた作業療法(軽度から中等度認知症、3 つの研究、201 人の介入、191 人の対照群)は対照群に比べて機能低下を軽減したが、集団運動療法や回想療法は効果がなかったとしている。 236
認知症の人は他の病気を持っている
認知症の人は他の病気の罹患率が高いだけでなく、ケアの計画を立てるのが特に困難であることが多いからである。認知症の人は、家族や医療従事者に症状を伝えることを忘れたり、合意した計画を理解したり、それに従ったりすることに苦労したり、飲み忘れや食べ忘れをしたりする可能性が高く、転倒や感染症の発生率が高くなっている。
プライマリーケアで認知症と診断された人の約70~80%は、他に少なくとも2つの慢性疾患を持っている。一般的な高齢者に比べて、認知症の人は脳血管疾患、243,244,245,246,脳卒中、247 パーキンソン病、243,245 糖尿病、245,247 皮膚潰瘍、不安・抑うつ、243,245 肺炎、失禁、電解質障害の割合が高い。
認知症とCOVID-19
重症急性呼吸器症候群コロナウイルス2は、中国湖北省で初めてウイルス性肺炎患者から発見された。英国の死亡診断書によると、認知症とアルツハイマー病が最も一般的な基礎疾患であり 2020年3月から5月の死亡者数は11,950人(COVID-19が関与する死亡者全体の25-6%)であることが示されている。病気とそれに伴う距離の取り方は、家族の介護者のストレス、孤独感、神経精神症状、向精神薬の使用を増加させ、将来の認知症を含む合併症につながるのではないかとの懸念が表明されている。テクノロジーを利用した遠隔介入もいくつかの場所で実施されている。
認知症の人は、身体的な距離感や衛生面など、必要な行動の変化を理解していなかったり、覚えていなかったりするため、ウイルス感染を減らすための対策を実行するのに苦労することがあり、自分自身や介護者のリスクを高めることになる。
この状況は、多くの入居者が認知症であり、多くの国でCOVID-19による死亡者が259, 260, 261人も出ており、半数以上の入居者が入院しているとの報告がある介護施設では特に問題となっている。米国の介護施設では、COVID-19が確認された10,576人のうち、認知症の入居者がCOVID-19症例の52%を占めているが、死亡者全体の72%を占めている(リスクは1.7倍増加)。職員が十分かつ厳密に保護されていればCOVID-19を発症する可能性は低いという証拠は存在するが、多くの職員が体調を崩し、死亡した職員もいる。この状況は、認知症の入居者のケアにおいて、他の人と一緒に食事をしたり活動に参加したりするのではなく、自分の部屋に留まることが求められている場合には、特に関係がある。261 個人宅やケアホーム、病院への面会者の制限は、認知症の人に大きな苦痛を与え、なぜ人がマスクをしているのか理解できない、誰がマスクをしているのかわからない、唇を覆っているときの言葉がわからない、などの問題を引き起こす可能性がある。制限がないということは、面会者も危険にさらされている可能性があるということである。
COVID-19の認知症患者への影響は、検査・保護具のための医療予算、医療制度の能力、ケアホームの提供の質、労働力の移動のパターンが小さいため、低中所得国sでは特に深刻であると考えられる。
このように、認知症の人は、年齢、多動性、身体的な距離の維持が困難であることから、COVID-19の影響を特に受けやすい。
私たちは、スタッフや入所者をケアホーム間で移動させないことや、COVID-19の状態が不明な場合に新たな入所者を入所させないことなど、保護具や衛生面での厳格な公衆衛生対策が、認知症の人への影響を軽減することを推奨する。また、ケアホームのスタッフの感染症検査を頻繁かつ定期的に行い、症状が出ているときには入所できないように病欠手当を支給し、COVID-19フリーの人だけがケアホームで生活できるように、退院後の暫定ケアを設定することも必要である。住民検査は、ホーム内でCOVID-19に曝露されている場合には、症状のある人だけでなく、無症状の人も対象とすべきである。将来的には、入院を望まない人でも酸素療法を受けられるように、多くの施設が酸素療法を提供できるようになるかもしれない。さらに、認知症の親族が介護施設で認知症の親族を安全に訪問できるように、COVID-19から身を守るために必要な機器や簡単なトレーニングを親族に提供することで、孤立を減らすことも重要である。このような緊急事態への対応や今後の公衆衛生上の緊急事態への対応を伝えるためには、さらなるエビデンスが必要である。
入院
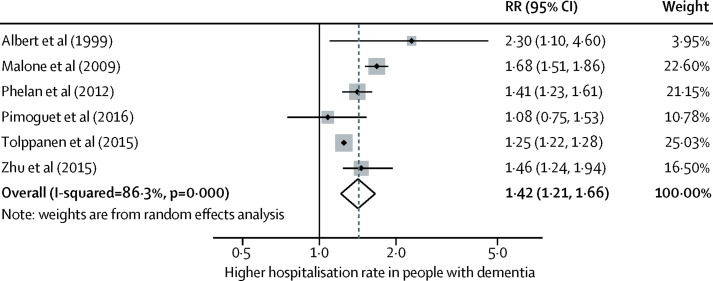
認知症の人の入院は、苦痛を伴う機能的・認知的低下や高額な経済的コストなど、意図しない結果につながる。265, 266, 267 認知症の人の入院は、同じような病気の人に比べて1.4倍から4倍多い。
認知症患者277人432人を対象とした34の研究を含むシステマティックレビューとメタアナリシスによると、2つのグループを比較した6つの研究では、認知症患者は認知症のない人に比べて、年齢、性別、身体的併存症を調整した後の入院が増加していることがわかった(RR1-4,95%CI1-2-1-7,図9)。認知症患者の入院率は、質の高い研究では一人当たり年間0-37~1-26人であったが、入院は地域社会で管理可能な状態(予防可能な入院)であることが多い。272, 273 認知症患者の身体的不健康、特に疼痛、転倒、糖尿病、失禁、感覚障害の早期発見と管理が重要である199, 274, 275 しかし、教育、運動、リハビリテーション、遠隔医療が認知症のない高齢者の入院を減少させているにもかかわらず、認知症患者の入院を減少させた介入はない276 。
図9 認知症の人の入院率を認知症のない人と比較したシステマティックレビューとメタアナリシスで、年齢と性別をコントロールした
認知症の人の質の高いケアには、同じ状態の人のケアに時間がかかる。
278 最適なケアを行うためには入院患者の認知症の認識が必要であるが、認知症は発見されなかったり、記録に残っていないことが多い。
体調不良、せん妄、認知症
認知症とせん妄はしばしば併発する。ある病院の入院患者調査では、80歳以上の高齢者の35%近くがせん妄を経験しており、認知障害のある人はそうでない人に比べて15倍のせん妄を発症するリスクがあった(OR 15-3,95%CI 5-2-45-4)。 282 認知症が知られていないせん妄を経験した人は、将来認知症と診断される可能性が他の人に比べて高い。284 さらに、認知症のない高齢者は、何らかの原因で緊急入院した場合、入院していない人に比べて2倍以上の速さで認知機能が低下しており、重症化した病気が認知機能の低下と関連していることが示唆されている。認知症におけるせん妄の危険因子には、感覚障害、疼痛、多剤併用、脱水、尿路感染症や便失禁などの併発疾患、慣れない環境や変化した環境などがある。
せん妄予防に関する研究のほとんどは、認知症のない人を対象としている。水分補給、せん妄の原因となる薬物の中止、麻酔の深さのモニタリング、睡眠促進などが示唆されている。しかし、コリンエステラーゼ阻害薬、抗精神病薬、メラトニンなどの薬物療法の有効性に関するエビデンスはない。この集学的治療は、毎日の訪問、オリエンテーション、治療活動、睡眠強化、早期動員、視覚と聴覚の適応、体液の補充、感染予防と便秘、疼痛、低酸素症の管理、摂食介助からなる。
せん妄の予防・治療薬のネットワークメタアナリシスには認知症の人の研究が含まれていないため、認知症やせん妄の人には適用できない可能性があるため、これを利用してせん妄の人に薬を勧めることはできない。
認知症におけるせん妄の管理に関する質の高い研究はほとんど存在しない。ある RCT では、65 歳以上で急性入院した 600 人の錯乱状態の高齢者を対象に、専門医や精神保健施設でのケアと通常のケアを比較したところ、在宅日数や入院日数の主要アウトカムに差は見られなかったが、家族の満足度は向上したと報告されている。コリンエステラーゼ阻害薬、抗精神病薬、鎮静作用のあるベンゾジアゼピン系薬剤は効果がなく、抗精神病薬とベンゾジアゼピン系薬剤は死亡率や罹患率と関連している。
超高齢、虚弱、認知症との関連性
先進国で最も急速に増加しているのは90歳以上の高齢者である。認知症で死亡した高齢者(n=1079,平均年齢90歳)の死後検死では、アルツハイマー病の神経病理学的特徴が、アルツハイマー病と診断された人の認知機能低下の約半分を占めていることがわかった。認知症の原因としてはアルツハイマー病の神経病理が最も多いが、アルツハイマー病の変化が単独で起こることはほとんどなく、純粋なアルツハイマー病の病理を持つ人は9%に過ぎなかった300。認知症を発症していないアルツハイマー病の病態を持つ人は、低濃度のプラークやもつれでも認知症を発症した人に比べて、加齢に伴う健康障害が少ない傾向にある。アルツハイマー病の病態と認知症の状態との関係は、虚弱度(年齢、性別、教育を調整したもの)によって異なり、虚弱度の増加はアルツハイマー病の病態と認知症の関係を弱めていることが示された(図10)。このアプローチは、後期の多くの疾患を支える特定の年齢関連プロセスに焦点を当てた新しいタイプの治療法が、認知症の発症率や重症度を低下させる可能性を示唆している。
図10 アルツハイマー病の病態とアルツハイマー型認知症の臨床診断との関連性に関するモデレーション分析(年齢・性・学歴で調整した場合)
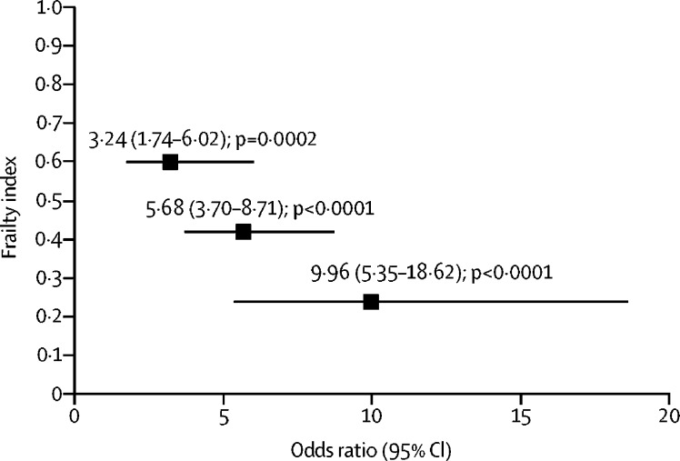
虚弱体質の増加に伴い、アルツハイマー病の神経病理学的診断と臨床診断が一致する確率が低下した。Wallece et al,22よりElsevierの許可を得て転載。
認知症における看取りケア
認知症で亡くなる人の数は増加しているが、最善の看取りのためのエビデンスは乏しい。認知症の年齢標準死亡率(3~6%)の傾向は、1990年から 2016年の間にわずかに増加しており、アメリカと日本では顕著に増加し、西ヨーロッパと中央ラテンアメリカでは減少している4。認知症は死亡診断書に記載されることが多くなっており、これが増加の一因となっている。
302, 303 認知症の経過は予測できないことが多く304 、緩和ケアの開始は予後ではなく必要性を反映したものでなければならない。
304 あるRCTでは、認知症が進行した人のケアに関する家族や医師の目標に関する意思決定支援をテストしたところ、ケアプランの緩和ケアの内容が増加した。
307 したがって、認知症の人に力を与え、死の質を向上させることを目的とした事前のケアプランは、理論的には認知症になる前に誰もが行うべきことかもしれない。309 しかし、事前のケアプランは、介護者の意思決定の不確実性を減らし、ケアの質を向上させることができるかもしれない。
認知症で死を迎える人のパートナーは、他の原因による死別に直面している人よりも精神的な健康状態が悪い311 。これは、特に認知症の進行状況について、個人的に、あるいは家族や職員が個別に相談することで、敏感でタイムリーな情報を提供することで改善される可能性がある。
結論
315 本委員会の報告書では、認知障害や認知症の発症を遅らせるための政策や個人の変更、認知症の人やその家族を支援・治療し、生活の質を向上させるためのより良い方法を明記している。
認知症の人を支援するための複雑な身体的疾患や社会的ニーズの整理を含めた介入は、全体として見たときに大きな効果を発揮する。私たちの目標は、認知症の人とその介護者に適切なレベルのウェルビーイングを提供するためのリソースを世界的に提供し、個々のケアや政策決定の指針となるようなより良いエビデンスベースを提供することである。質の高いケアがあれば、認知症の人も家族もサポートされていると感じることができる。
