Contents
Dehydroepiandrosterone and Dehydroepiandrosterone Sulfate in Alzheimer’s Disease: A Systematic Review and Meta-Analysis
www.ncbi.nlm.nih.gov/pmc/articles/PMC6449476/
潘雄峰、1 呉信仁、1 アティパッツァ・カミンガ、1、2 シ・ウー・ウェン、3、4 劉愛中、1、*。
要旨
背景と目的
これまでの研究では、アルツハイマー病とデヒドロエピアンドロステロンおよびデヒドロエピアンドロステロン硫酸のレベルとの関係について、一貫性のない結果が得られていた。本研究では、この関係に関する先行研究の結果を評価するために、システマティックレビューとメタアナリシスを行った。
方法
このアウトカムに関連する研究は、2018年3月にPubMed、Embase、Web of Science、Psyc-ARTICLESの電子データベースからシステマティック検索を用いて取得した。アルツハイマー病とデヒドロエピアンドロステロンおよびデヒドロエピアンドロステロン硫酸塩のレベルとの関連の強さを、標準化平均差を用いてランダム効果モデルを用いて測定した。
結果
31件の適格研究が最終解析に含まれた。デヒドロエピアンドロステロンのレベルとアルツハイマー病との間には統計的に有意な関連はなかった(標準化平均差。0.51、95%信頼区間。-0.44~1.45、Z=1.06、p=0.29)。) 一方、アルツハイマー病患者では、対照群よりも低レベルのデヒドロエピアンドロステロン硫酸が観察された(標準化平均差。-0.69、95%信頼区間。-1.17~-0.22、Z = -2.84、p < 0.01)。)
結論
デヒドロエピアンドロステロン硫酸濃度の低下はアルツハイマー病の重要な指標となる可能性があるが、デヒドロエピアンドロステロン硫酸が診断ツールとして使用できるかどうかはさらなる研究が必要である。
キーワード
デヒドロエピアンドロステロン、デヒドロエピアンドロステロン硫酸、アルツハイマー病、メタ解析、システマティックレビュー
序論
アルツハイマー病は、言語障害を含む知的衰退と記憶力の低下を特徴とする複雑な病因を持つ進行性の神経変性疾患である(Sheltens et al 2016)。近年、世界的にアルツハイマー病の発症率が増加している(The Lancet、 2016)。そのため、アルツハイマー病は世界的に大きな公衆衛生上の問題となっている。アルツハイマー病の早期発見/診断は、介入の実施に役立つ可能性があり、それによって疾患の進行が改善され、負担が軽減される可能性がある(Scheltens er al 2016)。本格的な認知症症候群が現れるまでには、長い前臨床段階がある(Anderson et al 2017)。感度と特異性の高いバイオマーカーは、アルツハイマー病の病態生理の調査に役立つ可能性があり、これはアルツハイマー病の早期発見に役立つ可能性がある(Liu er al 2018)。認知神経科学における最近の進歩は、デヒドロエピアンドロステロン(DHEA)やデヒドロエピアンドロステロン硫酸(DHEA-S)などのバイオマーカーが、アルツハイマー病のスクリーニング、治療、予防のための有望な新しい選択肢である可能性があることを提案している。これに関して、いくつかの研究では、DHEAおよびDHEA-Sの濃度が加齢とともに低下する可能性が示唆されている(Goncharov and Katsia、 2013)。生理学的には、DHEAとDHEA-Sの両方が副腎皮質の網状帯から生じる(Rammouz et al 2011a)。さらに、特定のニューロンもまた、少量のDHEAおよびDHEA-Sを産生しやすい。これらの物質(DHEAおよびDHEA-S)は脳内に豊富に存在し、細胞膜受容体を介してニューロンの活動を調節する。重要なことに、DHEAおよびDHEA-Sは神経活性ステロイドであり、アルツハイマー病の発症に寄与する可能性があり、シナプス結合性および神経細胞の分化に影響を与えることにより、脳の老化に重要な役割を果たしている(Rammouz et al 2011b)。
DHEAとDHEA-Sがアルツハイマー病と関連付ける傾向は、多くの仮説をもたらする。例えば、アルツハイマー病個体におけるDHEAおよびDHEA-Sレベルの低下は、異なる実験モデルにおける記憶促進、神経保護、神経細胞可塑性および神経新生に対するDHEAおよびDHEA-Sの効果が広く文書化されている観点から、この疾患の病因に重要な関係を有する可能性がある(ZdrojewiczおよびCiszko、2001;Klinge et al 2018)。より具体的には、DHEAとDHEA-Sのアンバランスは、神経伝達の乱れの進行に重要な役割を果たしており、これは、アミロイドβ(アミロイドβ)タンパク質の細胞外沈着物、老人斑、および細胞内線維性のもつれの存在をさらに誘発し、それゆえに、低活動性、歩行障害および認知機能の低下のような前認知症の症状を誘発するであろう(Arbo et al 2018)。興味深いことに、既存の臨床研究では、アルツハイマー病患者は線条体、小脳、視床下部のDHEA-Sレベルが低いことも示唆している。その上、視床下部におけるDHEA-Sとphospho-tauタンパク質レベル、線条体および小脳におけるDHEA-Sとアミロイドβペプチドレベルの間に負の相関が観察された(Weill-Enger et al 2002年;Jiménez-Rubio et al 2017)。要約すると、DHEA-Sは非常に長い半減期を持っており、それゆえに、アルツハイマー病の状態や進行を評価するための魅力的なバイオマーカーになるかもしれない(Legrain et al 2000)。
したがって、先行する証拠は、DHEAとDHEA-Sがアルツハイマー病患者の認知機能低下症状の病態生理に関与しているという仮説を支持している。しかし、他の研究の結果はこの仮説と矛盾していた。そのため、データ集計の金字塔となりうるメタ解析を行う必要があった(Rasmuson et al 2011)。また、DHEAやDHEA-Sは、その効果や潜在的なリスクについて厳密な科学的評価がなされることなく、多くの国で健康補助食品として販売されてきた(Racchi et al 2003)。そこで本研究では、DHEAおよびDHEA-Sレベルとアルツハイマー病との関連性に関する先行研究の結果をまとめ、この関連性の強さを定量化した。
方法
探索戦略と選択基準
本システマティックレビューおよびメタアナリシスは登録され、International Prospective Register of Systematic Reviewsのウェブサイト(CRD 42018112810)にプロトコルの全文がアップロードされた。また、本システマティックレビューおよびメタアナリシスは、コクランハンドブックのガイドラインに準拠し、Preferred Reporting Items for Systematic Reviews、 and Meta-Analyses(PRISMA)ガイドラインで推奨されている通りの結果を報告した(Moher er al)。 4 つの電子データベースから関連する研究・論文を検索した。PubMed、Embase、Web of Science、Psyc-ARTICLESの4つの電子データベースから検索した。私たちの検索は、データベースの開始から 2018年3月8日までに英語で発表されたすべての論文に限定した。経験豊富な司書が我々の検索戦略を設計し、以下の概念に関連するキーワードを用いた。1)デヒドロエピアンドロステロン(DHEA)またはデヒドロエピアンドロステロン硫酸塩(DHEA-S);および(2)アルツハイマー病。4つのデータベースの詳細な検索戦略は付録1に記載されている。
適格性の基準
(1)健康な対照群とアルツハイマー病症例を比較した症例対照研究である場合、研究は適格とみなされた;(2)DSMやNINCDS-ARDRAのような標準化された基準に基づいてアルツハイマー病診断基準を使用した。(3) アルツハイマー病患者と対照群のDHEAとDHEA-S濃度を測定した;(4) アルツハイマー病患者と対照群のDHEAとDHEA-S濃度の平均と標準偏差(SD)を報告した。(1)レビュー論文または症例報告;(2)他の精神疾患と組み合わせてアルツハイマー病を研究した;(3)軽度認知障害(MCI)または血管性認知症患者で、DHEAおよびDHEA-Sレベルに影響を与える可能性のある向精神薬または他の薬剤を使用した;(4)動物実験または試験管内試験(in vitro)実験;(5)灰色文献(すなわち、未発表の報告)であった場合は、研究は除外された。
著者のうち2人[XPとAC]が独立して論文をスクリーニングし、適格な研究を選択した。意見の相違があった場合は、最終的な決定は対応する著者[AL]と協議して行った。
データ抽出
対象となる研究を選択した後、2 人の著者[XW と AC]は、本研究の目的に応じて以下の変数の情報を独自に抽出した。(1)筆頭著者名および出版年、(2)研究の国、(3)研究デザイン、(4)被験者の平均年齢および標準偏差(平均、SD(5)被験者の性別分布、(6)アルツハイマー病評価方法、(7)試料の種類、試料採取時間、保存温度およびアッセイ方法などのDHEAおよびDHEA-S測定値、(8)DHEAおよびDHEA-S濃度の平均およびSD。抽出したデータはすべて EpiData 3.0 で整理し、Excel に保存した。
品質評価
対象となる研究の質の評価には、Newcastle-Ottawa Quality Assessment Scale(NOS)を用いた(Wells er al)。 それぞれの研究は、以下の3つの観点から評価された。(1)選択性(4 点):サンプルの代表性、定義の妥当性、対照群の選択の妥当性、(2)比較可能性(2 点):試験デザインや解析に基づき、異なるアウトカム群の被験者が比較可能であるか、交絡因子が抑制されているか、(3)アウトカム(3 点):曝露の確認、症例と対照群の確認方法が同一であるか、無反応率、の 3 つの観点から評価した。あらかじめ定められた採点基準に基づき、0~9 点の合計点で、7~9 点、3~6 点、0~3 点の研究をそれぞれ高品質、中等度、低品質と評 価した。この評価も2人の著者[XWとAC]が独立して行い、不一致はグループ考察で解決した。品質評価の採点方法と各項目の点数を付録 2 に示す。
統計的分析
すべての解析は R ソフトウェア(バージョン R i386 3.4.2)を用いて行った。まず、登録されたすべての研究のメタアナリシスを行い、アルツハイマー病患者と健常対照者のDHEAとDHEA-Sの濃度を比較した。DHEA濃度の平均値と対応する標準偏差(SD)はnmol/mLに換算し、DHEA-S濃度はμmol/mLに換算した。その後、アルツハイマー病とDHEAおよびDHEA-S濃度の間の関係の強さを評価するために、対応する95%信頼区間(CI)を持つ標準化平均差(SMD)が計算された(Higgins et al 2003; Pan et al 2018a)。効果の大きさは、SMDが0.8を超える場合は大きく、0.5から0.8の間の場合は中等度、0.5未満の場合は低いと考えた。異質性はコクランのQ統計量によって評価され、登録された研究間の異質性の可能性を反映するためにI2検定も使用された(Higgins et al 2003; Pan et al 2018b)。I2 = 0%は不均質性がないことを示し、I2 = 100%は最大の不均質性を示した。選択したすべての研究から定量的証拠を供給し、要約SMDの分散を最小化するために、ランダム効果モデル(I2>50%の場合)または固定効果モデル(I2≤50%の場合)を用いた(Berkey er al)。
サブグループ分析は、使用した組織試料の種類、試料の保存温度、DHEAおよびDHEA-Sの測定に使用したアッセイ法、研究の国、研究のNOS、アルツハイマー病患者の年齢、使用したアルツハイマー病評価ツールの影響を調べるために実施した。感度分析は、個々の研究を順番に除外することで結果に有意な影響を与えるかどうかを検討するために行われた。最後に、エッガー漏斗図を作成して、出版バイアスの有無について対称性を評価し、エッガーの線形回帰検定を用いて検証した(Egger er al)。 すべての統計的検定において、効果量推定の有意水準は5%とし、すべての検定は両側検定とした。
結果
文献検索
検索戦略の結果、598本の関連論文が得られたが、そのうちPubMedから111本、Embaseから167本、Web of Scienceから277本、PsycARTICLESから43本であった。合計31本の論文が含まれており、最終的な分析に含まれた(図1)。
図1 原文参照
研究選択のフローチャート。データベースから検索された関連する研究が評価され、選択または除外されたプロセスを示す。
対象となる研究の特徴
表1は、対象となる31件の研究の特徴を示している。これらの研究では、アルツハイマー病患者1、017人と健康な対照者1、171人の間でDHEA-S濃度を比較し、アルツハイマー病患者318人と健康な対照者297人の間でDHEA濃度を比較した。これらの研究のNOSスコアは5から8の間で変化し、4つの研究は高品質と評価され、27の研究は中等品質と評価された。
表1 原文参照
米国、米国、英国、英国、アルツハイマー病、アルツハイマー病、RIA、ラジオイムノアッセイ、脳脊髄液、脳脊髄液、ELISA、酵素免疫吸着法、HPLC、高速液体クロマトグラフィー-タンデム質量分析、GC/MS、ガスクロマトグラフィー-質量分析計、NR、報告なし、DSM、精神障害の診断・統計マニュアル、NOS、ニューカッスル-オタワ質評価スケール。
全体的な比較
図2は、ランダムエフェクトモデルを用いたメタアナリシスの結果を示したものである。アルツハイマー病患者と健常対照者のDHEA濃度を比較した15研究を取り上げたところ、有意差はなく(k=15、SMD=0.51、95%CI:-0.44~1.45、Z=1.06、p=0.291不均一性はかなりのものであった(I2=95.4%)。1、017人のアルツハイマー病患者と1、171人の健常対照者の間でDHEA-S濃度を比較した28の研究についての同様の分析は、DHEA-S濃度が対照者よりもアルツハイマー病患者で有意に低いことを示した(k = 28、SMD = -0.69、95%CI:-1.17から-0.22、Z = -2.84、p = 0.004しかし、高い不均一性(I2 = 95.3%)を有することを示した。図3は、両グループのDHEA-S濃度のフォレストプロットを示している。
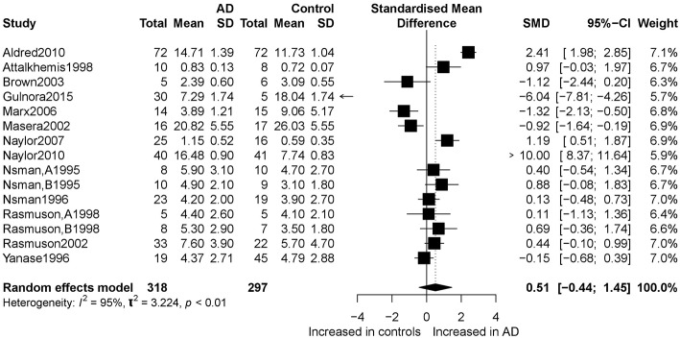
図2
アルツハイマー病参加者と対照者間のDHEAのフォレストプロット。アルツハイマー病とコントロール間のDHEAの違いの研究効果サイズ。各データマーカーは研究を表し、データマーカーの大きさは、その研究の個体数の合計に比例する。各DHEAの要約効果サイズは、ダイヤモンドで示されている。アルツハイマー病、アルツハイマー病;SMD、標準化平均差。
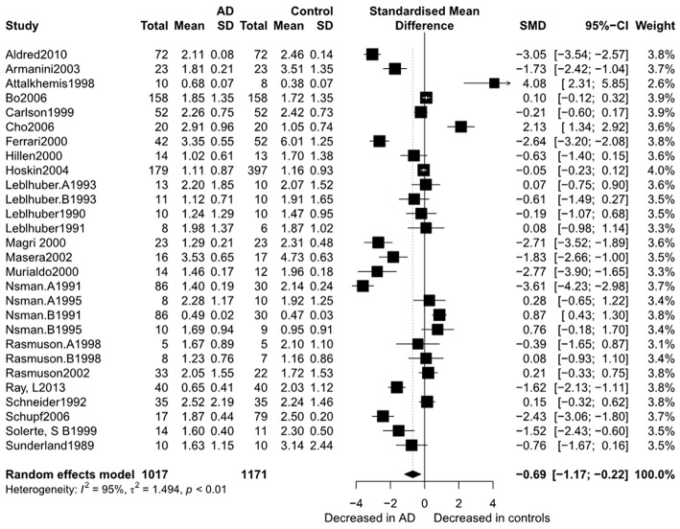
図3
アルツハイマー病参加者とコントロール間のDHEA-Sのフォレストプロット。アルツハイマー病とコントロール間のDHEA-Sの違いの研究効果サイズ。各データマーカーは研究を表し、データマーカーの大きさは、その研究の個体数の合計に比例する。各DHEA-Sの要約効果サイズは、菱形で示されている。アルツハイマー病、アルツハイマー病;SMD、標準化平均差。
サブグループ解析
表2、33は、サブグループ分析の結果を示している。80歳以上の患者を対象とした研究では、健常対照群に比べてアルツハイマー病患者で高いDHEA濃度が観察された(k=5、SMD=2.54、95%CI:0.32~4.76、Z=2.24、p=0.025)。また、スウェーデンからの研究のみを考慮した場合、DHEA濃度は健常対照者よりもアルツハイマー病患者の方が有意に高かった(k=6、SMD=0.40、95%CI:0.08~0.72、Z=2.46、p=0.014)が、不均一性はなく(I2=0%異質性は認められなかった。さらに、DHEAの測定に朝採りやRIA(Radioimmunoassay)を使用した場合、異質性はかなり低かった。一方、RIA以外の血漿またはアッセイ法を用いた場合には、アルツハイマー病患者と健常対照者の間でDHEA-S濃度に有意な差は認められなかった。さらに、アルツハイマー病 が NINCDS-ARDRA で評価されていない場合や、研究国がイタリアでない場合には、アルツハイマー病 患者と健常者との間で DHEA-S 濃度に有意な差は認められなかった。興味深いことに、NOSスコアの高いサブグループ解析では、全体解析の不均一性と比較して、不均一性が顕著に低かった。アルツハイマー病の重症度が全体の転帰に影響を与えるかどうかをさらに調べるために、DHEAとDHEA-Sに関して2つの追加のサブグループ解析を行った。DHEAに関しては、異なる重症度のアルツハイマー病を分離した2つの探索的サブグループ解析が行われたが、異なる重症度のアルツハイマー病を持つ個人と対照群との間には有意差はなかった。それにもかかわらず、中等度アルツハイマー病患者では対照群に比べて有意に低いDHEA-Sが認められた(k = 17、SMD = -1.12、95%CI -1.71; -0.53、Z = -3.72、p = 0.002)。また、軽度または重度のアルツハイマー病患者と対照群との間には有意差は認められなかった。
表2 原文参照
表3 原文参照 DHEA-Sサブグループ分析
感度およびバイアス分析
感度分析では、個々の研究を1つずつ省略した後のSMDと対応する95%CIにはほとんど変化がなく、今回のメタアナリシスのデータは比較的安定していることが示唆された。DHEAとDHEA-Sのグラフエッガー漏斗プロットは対称的であり、エッガーの検定ではそれぞれ0.58と0.18のP値が得られ(図4含まれた研究の公表バイアスの可能性が低いことが確認された。
図4
DHEA(A)とDHEA-S(B)のエガーファンネルプロット。出版バイアスを評価するためのエガーファンネルプロット。プロットは、メタアナリシスに含まれる研究の効果量の関数としての研究サイズを示す。ドットは各研究を表している。
考察
私たちの結果は、アルツハイマー病とDHEA濃度の間には関連性がないことを示した。一方、DHEA-S濃度は、アルツハイマー病患者では健康な対照群に比べて有意に低かった。最近のいくつかの研究では、DHEAとDHEA-S濃度がアルツハイマー病と関連していることが示唆されているが、結果は一貫性がない。いくつかのレビューが発表されており、それらはDHEAとDHEA-Sレベルがアルツハイマー病を発症するリスクに役割を果たす可能性があることを示唆している(Cho et al 2006; AldredとMecocci、2010)。私たちの知る限りでは、これは、アルツハイマー病ステータスとDHEAとDHEA-S濃度の関連性を探るための最初のメタアナリシスである。
注目すべきは、DHEAがテストステロンの前駆体であり、テストステロン濃度とアルツハイマー病のリスクに関する最近のメタアナリシスでは、血漿テストステロン濃度の低下が高齢者被験者におけるアルツハイマー病のリスクの増加と有意に関連していることがわかった(Lv et al 2016)。いくつかの系統の研究では、高齢者被験者のテストステロンが加齢に伴う記憶障害を改善することが示されている(Resnick et al 2017)。さらに、ある研究では、高齢のオスザルは海馬の酵素3β-ヒドロキシステロイドデヒドロゲナーゼの発現が低下していることが証明された(Sorwell et al 2012)。その結果、彼らはDHEAをテストステロンに集中的に変換する能力が低下しており、これが我々のDHEAの発見を説明する可能性がある。
DHEA-Sについては、アルツハイマー病の神経活性ステロイド仮説では、DHEA-S因子が関与するプロセスの障害の結果として、脳の変化を仮定した(GoncharovとKatsuia、2013DHEA-Sは、患者の脳の変化や高齢男性の認知機能に重要な役割を持っていることを示した。アルツハイマー病におけるDHEA-SとDHEA濃度のこれらの変化を説明する分子機構の理解を深めるためには、さらなる研究が必要である。実験研究では、DHEA-Sは主要なニューロステロイドであり、有益な神経保護特性を表示し、学習や記憶などの変化した認知プロセスを改善することが示された(Klinge et al 2018)。一方、いくつかの研究では、加齢に伴うステロイドホルモンの減少が神経変性疾患の発症および進行に重要な役割を果たす可能性があることが報告されている(de Menezes et al 2016)。DHEA-Sの濃度は加齢とともに低下することが確認されており、これは免疫系の機能不全、酸化ストレスの増加、認知機能の低下と関連している(Klinge er al 2018)。
さらに、DHEA-Sは抗酸化作用や抗炎症作用も生み出すことがエビデンスとして示されている。実験研究では、DHEA-S濃度がラットおよびヒト海馬ニューロン細胞を酸化ストレス誘発細胞損傷から保護することが実証されている(Vieira-Marques et al 2016年;Nguyen et al 2017)。注目すべきは、蓄積された証拠は、プロ炎症性サイトカインが神経斑(アルツハイマー病の特徴)に存在し、DHEA-Sによって調節される可能性があることを示している(Barger et al 2000)。さらに、活性化されたミクログリアによって媒介される炎症は、アルツハイマー病の病態生理における重要な因子として知られている(Barger et al 2000)。証拠はまた、DHEA-Sの補充が神経細胞の生存および分化を大幅に増加させ、培養中のマウス脳細胞におけるアストログリア増殖率を減少させることを示している(Bologa et al 1987)。さらに、既存のデータはまた、DHEA-Sにその神経保護効果を与えると信じられている誘導体である7β-ヒドロキシ-エピアンドロステロン(7β-OH-EpiA)で処理すると、ラット海馬におけるタウタンパク質免疫反応性のアミロイドβ誘発性の増加を防ぐことを示唆している(Dudas et al 2004)。
興味深いことに、動物研究では、DHEA-Sをラットに投与すると、作業記憶、参照記憶、および空間記憶の欠損を減少させることが証明されている(Maurice et al 1998)。これらの効果は、いくつかの動物モデルで認められた。嗅球摘出誘発性認知障害、D-ガラクトースによって誘発される老化、および老化を伴う脳内アミロイドβ投与(Maurice et al 1998;Markowski et al 2001;Chen et al 2008;Sakr et al 2014)。臨床研究では、高齢者では、男性が前立腺癌に対するアンドロゲン遮断療法などの介入後に認知障害に陥る可能性があることが示されている(McHugh et al 2018)。この介入の結果、これらのホルモン(テストステロン、DHEA、DHEA-S)と標的組織との相互作用が不活性化されるか、またはそれらのレベルが低下する。その結果、DHEAおよびDHEA-Sが臓器および組織において有する効果の著しい減少がある(Sun et al 2018)。先行する知見は、中高年被験者の記憶変化の原因とアンドロゲン抑制についての貴重なエビデンスを提供する可能性がある。このように、アルツハイマー病においては、DHEA-Sの機能不全がアルツハイマー病の病態生理における新たなプレーヤーとして仮説が立てられている。全体として、この仮説は我々の知見と一致している。したがって、DHEA-Sは将来的にアルツハイマー病を軽減するための効果的な介入の基礎を提供する可能性がある。
さらに、本研究では、対象となる研究の異なる特定サブグループによって結果が変化するかどうかを確認するために、サブグループ分析を実施した。特定のサブグループには比較的少数の研究が含まれており、これが解析の統計的効率を低下させていた。したがって、これらのサブグループ分析の結果は探索的なものと見なすべきであり、慎重に解釈すべきである。
全体比較の結果とは逆に、このメタ分析では、スウェーデンで実施された研究では、健康な対照群に比べてアルツハイマー病患者ではDHEA濃度が有意に高いことが示された。この結果は、DHEAとアルツハイマー病の関係を調査する際に、国や地域によって異なる均質なグループを形成する可能性があることを示唆しているかもしれない。しかし、この仮説を確認するためには、より多くの将来の調査が必要である。本研究では、対象となる研究ではこれらの特徴がほとんど報告されていなかったため、社会的政治経済的、民族的、技術的レベル、文化的要因の観点から異質性を評価することはできなかった。したがって、研究の国はこれらの特性をすべて含んでいるため、代替となりそうなものと考えた(Tafazzoli er al)。 さらに、このメタアナリシスでは、80歳以上の被験者を登録した研究の中で、アルツハイマー病患者では健康な対照者よりも有意に高いDHEA濃度が観察されたことが示された。DHEAとDHEA-Sの濃度は加齢とともに低下する可能性があることを示唆する証拠が増えている。それはまた、DHEAとは対照的に、DHEA-S濃度は健康な対照群よりもアルツハイマー病患者で有意に低かったことに注意することが重要である。これは、DHEAがDHEA-S合成の基質であり、この点から、アルツハイマー病患者ではスルファターゼの活性またはDHEA-Sの生体変換の分子機構が障害されていることが示唆されるかもしれないので、理にかなっているだろう(Aly et al 2011)。アルツハイマー病患者におけるDHEAおよびDHEA-Sレベルの変化を説明する分子機構を理解するためには、さらなる調査が必要である。DHEA-Sレベルの低下は、異なる重症度のアルツハイマー病の形態と関連している(Valenti et al 2009)。我々の知見は、DHEA-Sレベルの低下が中等度アルツハイマー病の病態生理における代償的プロセスの一部である可能性を示唆している。これは、なぜ軽度アルツハイマー病の代償期ではDHEA-S調節が正常であったのに対し、中等度アルツハイマー病では、DHEA-S障害の程度が異なる結果となる代償期にまで発展したのかを説明することができるかもしれない。さらに、この代償機構の破綻が重度アルツハイマー病の発症の背景にあると考えられる。したがって、DHEA-Sと重症度の異なるアルツハイマー病との関係について、これらの仮説を検証するために、より多くの前向きな研究が必要であることは明らかである。また、今回のメタ解析では、血漿中のDHEA-Sを測定した場合、またはRIAではない方法で測定した場合、アルツハイマー病患者と健常対照者の間でDHEA-Sの濃度に有意な差は認められないであった。我々の結果は、DHEA-Sとアルツハイマー病の関係を測定する際に血清サンプルとRIAを用いた研究の方が、より高い均質性を持つ可能性を示唆しているかもしれない(Huayllas et al 2018)。しかし、対象となる研究のほとんどがサンプル採取と分析の間のタイムラグを報告していないことを考慮すると、アッセイ結果に大きな影響があったかもしれない。また、生化学的測定におけるこれらの固有の変数、異なるアッセイ方法および標準化されたアッセイ方法の欠如、異なる研究が実施された広いタイムスパン(研究デザインの他の変数に加えておよび研究集団は、異なるサブグループ間の比較を非常に信頼性の低いものにしている(Tamae er al)。 サブグループ分析から、RIAの技術が他の技術よりも信頼性が高いことを推論したり、血清サンプルが他のサンプルよりもDHEA-Sの分析に適していることを推論したりすることは不適切である。したがって、アルツハイマー病とDHEA-Sの関係を研究する際には、測定方法やサンプルを比較するために、より多くの将来の調査が必要である。これらの調査では、研究デザインに明記されている交絡因子をすべて考慮に入れる必要がある。
限界
このシステマティックレビューとメタアナリシスにはいくつかの制限がある。第一に、アルツハイマー病とDHEA濃度との関連性に関する適格な研究の数が限られていたため、この分析ではパワーが不足していた。第二に、メタアナリシスのためのすべての研究は、因果関係の推論を行うことができないデザインのケースコントロールであった。第三に、人種・民族、年齢、性別、肥満度、喫煙、飲酒、血圧など、DHEAとDHEA-Sの濃度に影響を与える可能性のあるいくつかの因子は、サンプルサイズが限られているため、検討されなかった。アルツハイマー病患者と健康な対照群との間のDHEAとDHEA-Sの両方の濃度に関する研究では、高い不均一性が観察されたが、これは研究デザインと研究集団の大きなバリエーションを考えると驚きではなかった(Villemagne and Chételat、 2016)。最後に、我々はアルツハイマー病のみに焦点を当てたため、アルツハイマー病の前駆症状としてのMCIは除外された(Ströhle er al 2015)。したがって、分析は探索的なものと見なすべきであり、結果は慎重に解釈されるべきである。
結論
上記の制限にもかかわらず、本研究の知見は重要な意味を持っている。特に、本研究の結果は、DHEA-S濃度の低下がアルツハイマー病の発症に関連している可能性があるという仮説を支持している。しかし、DHEA-Sが診断ツールとして使用できるかどうかは、さらなる研究が必要である。アルツハイマー病発症の過程でのDHEAとDHEA-S濃度の長期的な変化のメカニズムを評価するためには、前向きの研究が必要である。また、大規模な無作為化比較試験は、DHEAとDHEA-Sのサプリメントがアルツハイマー病患者の認知機能の低下を遅らせることができるかどうかを実証することができる。この種の無作為化比較試験の結果はまた、アルツハイマー病のバイオマーカーとしてのDHEAとDHEA-Sの有用性の証拠を提供することができる。
