Decreased Serum Brain-Derived Neurotrophic Factor (BDNF) Levels in Patients with Alzheimer’s Disease (AD): A Systematic Review and Meta-Analysis
www.ncbi.nlm.nih.gov/pmc/articles/PMC6358753/
要旨
アルツハイマー病(AD)患者と軽度認知障害(MCI)患者の血清脳由来神経栄養因子(BDNF)のレベルを報告する先行研究の結果は、相反するものであった。そこで、我々は、健常対照者と比較して、アルツハイマー病患者およびMCI患者における血清BDNFの総計レベルを検討するためにメタアナリシスを行った。ADと健常対照(HC)との比較のために15の研究が含まれた(n = 2067)。血清BDNF値はアルツハイマー病患者で有意に低かった(SMD。-0.282;95%信頼区間[CI]。SMD:-0.535~-0.028;有意な不均一性:I2 = 83.962)。) メタ回帰では、年齢(p < 0.001)とMMSEスコア(p < 0.001)が、これらの研究における所見の異質性を説明できる有意なモデレーターであることが同定された。さらに、アルツハイマー病患者とMCI患者の間(8試験、n=906)およびMCIとHCの間(9試験、n=5090)では、血清BDNFレベルに有意な差は認められなかった。すべての研究において、MCIではなくアルツハイマー病患者は健常対照者と比較して血清BDNFレベルが有意に低かった。今回のメタ解析では、認知症における血清BDNF値の変化の方向性が確認された。この知見は、末梢性BDNFレベルの有意な変化は、認知症スペクトラムの後期になって初めて検出されることを示唆している。認知症におけるBDNFの分子機構、介入試験への影響、今後の研究の方向性について議論した。
キーワード:システマティックレビュー、メタ解析、メタ回帰、BDNF、アルツハイマー病、軽度認知障害、認知
1. はじめに
アルツハイマー病(AD)は、米国における死因の第6位であり、世界で最もパンデミックしている認知症であり、65歳以上の高齢者の認知症の約50~60%がADに起因するとされている[1,2,3]。世界では、ADや他のタイプの認知症に苦しんでいる人が約3,600万人おり、認知症患者の数は2050年までに世界で8,000万人に達すると予測されている[4]。
この衰弱性疾患のさらなる理解を深めるために、アルツハイマー病患者では多数の神経化学的変化が確認されている。病理的変化には、アミロイドβ-42の凝集、神経原線維のもつれの形成につながるリン酸化タウの増加[5]、低悪性度の炎症または炎症の亢進、コリン作動性機能の低下[6]、および脳由来神経栄養因子(BDNF)レベルなどの神経栄養因子の変化が含まれる。
BDNFは認知および記憶の調節に顕著な役割を果たしている。BDNFは、ニューロンの生存、機能、および発達を促進するタンパク質のファミリーに属するニューロトロフィンである[7]。BDNF遺伝子の発現は、記憶、学習、高次認知機能に不可欠な大脳皮質、海馬、前脳基底領域に見られる。BDNFは、シナプス間の神経新生と神経伝達を促進し、シナプスの成長を促進し、シナプス可塑性を調節する [8]。BDNFはまた、記憶形成に重要な海馬長期増強を誘導する[8]。Weinsteinらは、より高い末梢BDNFレベルが高齢者をADから保護することを発見した。BDNFレベルを1標準偏差だけ高くすることで、ADや認知症のリスクは33%低下した[9]。
アルツハイマー病患者を対象とした臨床研究では、BDNFの末梢レベルの調査は依然として論争の的となっている。AD 患者の末梢レベルが健常対照群と比較して高いことを報告した様々な研究があるが、逆の結果を報告した研究もあった。さらに、アルツハイマー病患者と健常対照者(HC)との間でBDNFのレベルに差がなかったと報告した研究もあった[10]。軽度認知障害(MCI)と健常者(HC)の間の血清BDNFを検討した文献には、相反する知見も存在する[3,11,12,13,14,15,16,17]。n = 4463人の大規模研究では、血清BDNFレベルとMCIとの境界線上の関連が示された(オッズ比、95%信頼区間:1.41,1.00-1.99)。しかし、信頼区間には1の値が含まれており、解釈が困難であった[18]。所見のこれらの不一致の潜在的な原因の中には、募集プロセス、診断基準、疾患のステージ、年齢、ミニメンタル状態検査(MMSE)スコア、性別、および教育の違いが含まれる可能性がある[3]。これらの測定におけるもう一つの重要なモデレーターは、BDNFのプロ型か成熟型かを測定したかどうかである。2つの形態は細胞死を促進し、成熟型BNFは細胞生存を促進することで反対の機能を持つという相反する効果を持つため、しばしば軽視されているが、この問題を考慮することは必須である[2]。これまでの結論が出ていないため、システマティックレビューとメタアナリシスにより、健康な対照群と比較して、アルツハイマー病患者やMCI患者におけるBDNFの血清レベルを検討する必要がある。
我々は、横断的研究から収集した神経認知障害の異なるステージを代表する3つのグループの血清BDNFの総計レベルを調べた。本研究では2つの仮説を提案した。第一に、アルツハイマー病患者は健常者やMCI患者に比べて血清BDNFの値が低いという仮説を立てた。第二に、MCI患者は健常対照者に比べてBDNFの血清レベルが低いという仮説を立てた。
2. 方法
研究開始から 2017年までの間に、これらのオンラインデータベース上で包括的な文献検索を行った。Pubmed、Embase、PsychINFO、BIOSIS、Science Direct、Cochrane CENTRAL。使用した検索語は、「BDNF」、「脳由来神経栄養因子」、「軽度認知障害」、「アルツハイマー病」であった。検索は英語論文のみに限定した。
2.1. 除外基準
我々は、BDNF の血清レベルの平均値または中央値を関心のある主要変数として検討した横断的研究および症例対照研究をすべて検索した。(1)横断的または症例対照研究、(2)関心のある主要変数の一つとして BDNF の血清レベルを分析した研究、(3)研究参加者の 2 つのグループ(MCI または AD の被験者と健常対照群のいずれか)間で BDNF の血清レベルを比較した研究、(4)AD、MCI、健常対照群の 3 つのグループすべてについて BDNF の血清レベルを比較した研究が対象となった。
2.2. 除外基準
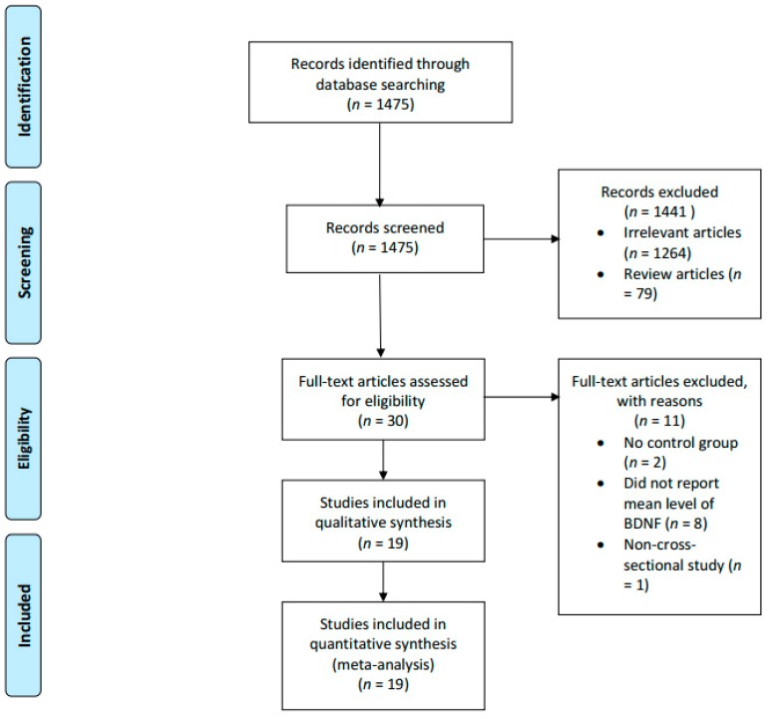
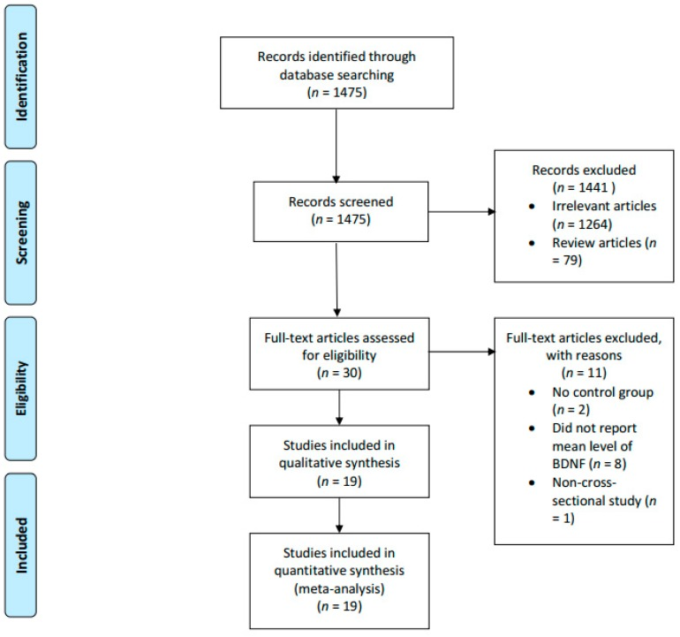
研究は、BDNF、MCI、AD と無関係であったり、レビュー論文や動物実験であったりする場合には除外された。第二に、健常対照群と比較せずに、MCIまたはアルツハイマー病患者のBDNFのレベルのみを報告した研究も除外された。第三に、血清BDNF値の平均値や中央値を報告していない研究も除外した。最終的には、除外基準と除外基準の両方を満たした19件の研究を分析した(図1)。
図1 試験選択のプロセスを説明するPRISMA図
3. 統計解析
すべての統計解析には Comprehensive Meta-Analysis Version 2.0 (New Jersey, NJ, USA)を使用した。原稿に中央値と四分位間の範囲しか記載されていない研究については、Hozoら[19]に従って平均値と標準偏差の推定を行った。メタアナリシスには、レビューされた研究における潜在的な不均一性を考慮してランダム効果モデルを使用し、その後フォレストプロットを作成した。標準化平均差(SMD)を計算し、アルツハイマー病患者、MCI患者、健常対照者間の平均BDNFレベルの差を表した。95%の信頼区間も含まれていた。異質性の検定は、同質性を仮定してカイ二乗分布として分布するQ統計量を用いて行った。異質性とは、研究結果の間の系統的な差のことであり、単に偶然に起因するものではない。I2 統計量は、研究間の不均一性を調べるために利用された。目安として、I2=0%は不均質性がないことを示唆し、I2=25%は不均質性が低いことを示唆し、I2=50%は中等度の不均質性を示唆し、I2=75%は高い不均質性を示唆している[20]。出版バイアスを調べるために、Eggerの回帰検定を行った。
高い不均一性を持つモデルについては、メタ回帰を行い、含まれている様々な研究における血清BDNFレベルの不均一性に寄与している可能性のある不均一性の原因を特定した。メタ回帰分析では、回帰係数(β関連するz値、p値が報告された。
4. 結果
関連性のある可能性のある最初の研究1475件から、最初のスクリーニングの後、1441件の研究が除外された。残りの30件の潜在的研究は、包含基準および除外基準に照らし合わせてスクリーニングされた。11件の研究がさらに除外され、最終的に19件の研究が解析に含まれた。
19の研究のうち15の研究は、AD群と健常対照群の血清BDNF値の比較を可能にするのに十分なデータを提供した(表1)。8件の研究では、AD群とMCI群の血清BDNF値の比較に十分なデータが得られた。19件の研究のうち9件は、比較のためにMCI群と健常対照群の平均/中央値の血清レベルを報告した。大多数の研究では、BDNFの4つの主な調節因子である年齢、教育年数、ミニ精神状態検査(MMSE)スコア、性別のみが報告されていた。そのため、末梢性BDNFレベルに影響を与えることが知られているが、他の交絡因子やモデレーターは解析に含まれていなかった。
表1
A)アルツハイマー病(AD)患者と健常対照者(n = 2067)を比較した血清脳由来神経栄養因子(BDNF)レベルと研究特性。MCI:軽度認知障害、MMSE:mini-mental state examination;(B)アルツハイマー病患者とMCI患者を比較した血清BDNF値および試験特性(n = 906);(C)MCI患者と健常対照者を比較した血清BDNF値および試験特性(n = 5090)。
原文参照
さらに、表2は、対象となった19件の研究の主要な方法論的特性と質をまとめたものである。特筆すべきは、ほとんどの研究では、研究デザインもパフォーマンスの検出力とサンプルサイズの計算も明確に記述されていなかったことである。検出力とサンプルサイズの計算を報告した研究は1件のみであった[11]。また、研究への登録時にAD/MCIと診断されてからの年数や疾患期間もすべての研究で報告されていなかった。レビューされた研究の約半数が向精神薬の使用を報告しており、広範囲の薬物を網羅していた。実験室での測定については、血清脳由来神経栄養因子(BDNF)レベルを測定する実験スタッフのマスキングもすべての研究で報告されていない。すべての研究で血清BDNFの測定に使用されたアッセイが報告されているが、いくつかの異なるメーカーのアッセイが採用されていた。
表2 主要な方法論的特性と実験室変数
原文参照
5. フォレストのプロット
図2Aは、15の研究[3,11,12,13,14,16,17,21,22,23,24,25,26,27,28]の結果を、アルツハイマー病患者と健常対照者の血清BDNFレベルを比較したものである。このプロットから、アルツハイマー病患者は健常対照と比較して血清BDNFレベルが有意に低かった(ランダム効果モデルを用いたプールされたSMD。-0.282,95%CI:-0.535~-0.028,z = -2.175,p = 0.030)。) 研究間の不均一性は有意であった(τ2 = 0.193,Q = 87.294,df = 14,p < 0.001,I2 = 83.962)。報告されている4つの不均一性の原因の効果をさらに調べるためにメタ回帰分析を行ったところ、平均年齢が不均一性に有意に寄与していることがわかった。(β=0.0548,z=3.32,p < 0.001)。MMSEスコアも同様に異質性に有意な影響を与えた(β = 0.0518, z = 3.52, p < 0.001)。他の2つのモデレーター、性/女性の割合(p = 0.1764)と教育年数(p = 0.2909)は、含まれた研究の異質性には影響を与えなかった(表3)。

図2
AD、MCI、および健常対照(HC)間の血清BDNFレベルのメタ解析。A)アルツハイマー病患者の血清BDNFレベルの標準化平均値の差を健常対照群と比較したフォレストプロット、(B)MCI患者の血清BDNFレベルの標準化平均値の差をADと比較したフォレストプロット、(C)健常対照群の血清BDNFレベルの標準化平均値の差をMCIと比較したフォレストプロット。
表3 健常対照群と比較したアルツハイマー病患者の血清BDNFレベルのメタ回帰の結果
モデレータ/ 研究数/ β /z /p
年齢 /15 /0.0548 /3.32 /<0.001
MMSEスコア/ 15 /0.0518/ 3.52/ <0.001
性別(女性の割合)/ 13/ 0.0104/ 1.35 /0.1764
教育年数/ 7 / 0.0181/ 1.06/ 0.2909
図2Bは、アルツハイマー病患者とMCI患者の間で血清BDNFレベルを比較した8つの研究[3,11,12,13,14,15,16,17,29]を示している。その結果、両群間の血清BDNF値に有意差は認められなかった(ランダム効果モデルを用いたプールされたSMD。-0.042,95%CI:-0.324~0.240,z = -0.291,p = 0.771)。)
図2Cは、MCI患者と健常対照者の血清BDNFレベルを比較した9つの研究[3,11,12,13,14,16,17,18,29]を示す。有意差は観察されなかった(ランダム効果モデルを用いたプールされたSMD。-0.084,95%CI= -0.344~0.176,z= -0.634,p= 0.526)。)
6. 発表バイアス
発表バイアスは、エッガーの回帰検定を用いて検定した。この検定に基づいて、アルツハイマー病患者と健常対照群との間の血清BDNFレベルには発表バイアスはなかった(切片=-0.78,p=0.6278)。また、他のグループ間の比較においても、出版バイアスは認められなかった。
7. 考察
本研究では、アルツハイマー病患者、MCI患者、健常対照者におけるBDNFの血清レベルを比較した。その結果、アルツハイマー病患者の血清中BDNFレベルは健常対照者に比べて有意に低いことが結論づけられた(15研究、n=2067)。アルツハイマー病患者とMCI患者(8研究、n = 906MCI患者と健常対照者(9研究、n = 5090)の間では、両方の比較でわずかに低下したレベルがあったが、血清BDNFレベルに統計的に有意な差はなかった。メタ回帰では、年齢(p < 0.001)とMMSEスコア(p < 0.001)が、これらの研究における所見の異質性を説明できる有意なモデレーターであることが明らかになった。
我々は、血清BDNFレベルの低下は、ADの疾患経過における後期のイベントであると仮定している。そのため、MCI患者ではまだ血清BDNF値の変化を有意に検出することはできない。また、様々な障害に反応して神経保護戦略としてBDNFレベルが上昇する疾患の初期段階が存在する可能性を示唆する実質的な報告もあった[14]が、これはMCI患者における血清BDNFレベルの上昇を報告しているここに含まれる研究のいくつかによって支持された。一方、MCI患者のBDNFレベルは、様々な生物学的特性、生活習慣、心理社会的要因が複雑に相互作用していることに依存している可能性がある。そのため、MCI患者の中には、BDNFレベルの低下をもたらす防御因子や戦略が不足している可能性がある。このことが、本レビューの対象となった研究で報告されているように、MCI患者の平均血清BDNF値の違いにつながっている可能性があり、いくつかの研究では高値が報告され、他の研究では低値が報告されている(表1,図2B,C)。しかし、アルツハイマー病患者では、血清BDNFレベルが有意に低下していることが検出される(図2A)。これは、神経細胞の損傷が広範囲に及ぶアルツハイマー病患者では、保護因子やその他の因子がBDNFレベルを維持できなかったためと考えられる。アルツハイマー病患者では、認知予備能が大きく消耗し、神経細胞の損傷がBDNFによる修復を超えており、代償機構が破綻している可能性があり、その結果、健常対照群と比較して、アルツハイマー病患者の血清BDNFレベルが統計的に有意に低下した(図2A)。
メタ回帰では、年齢(p < 0.001)とMMSEスコア(p < 0.001)が、これらの研究における不均一性と矛盾する所見を説明できる有意なモデレーターであることが明らかになった(表2)。被験者の年齢が高く、MMSEスコアが高いほど、血清BDNF値の平均値に標準差が大きいことがわかった。このことが、MMSEスコアの高いMCIで血清BDNF値に有意差が認められなかった理由の一つかもしれない。年齢とMMSEスコアが血清BDNFレベルに及ぼす影響を調べるためには、さらなる研究が必要である。これらの研究では、末梢血中BDNFレベルの不均一性に寄与した可能性のある他の修飾因子が知られているが、それらは定期的に報告されていない。したがって、これらの他の修飾因子の効果を調べることはできない。
そのようなモデレーターの1つが向精神薬の使用である。しかし、ここでレビューされた研究のうち、このモデレーターを報告しているのは約半数にすぎない。向精神薬、特に認知障害や大うつ病性障害(MDD)の治療薬は、血清BDNFレベルに影響を与えることが示されている。例えば、Leyheらによる研究では、アルツハイマー病患者をドネペジルで15ヶ月間治療することで、血清BDNFレベルが健常対照と同様のレベルに回復したことが示されている[23]。さらに、抗うつ薬治療を受けた抗うつ薬未使用のMDD患者でも、血清BDNFレベルが基本レベルに回復していることが示されている[30]。
さらに、ここでレビューされた研究の大部分を含むバイオマーカー研究に典型的な比較的小さなサンプルサイズの研究では特に、検出力とサンプルサイズの計算を考慮する必要がある。60 人のコホートサイズでは、20%の差を仮定した場合、BDNF レベルの統計的に有意な差を検出できると仮定されており、検出力は 0.80,type-I 誤差は 0.05 [31] である。BDNFレベルに10%の差があると仮定した場合、200人という比較的大きなコホートサイズが必要である。実際、このサンプルサイズが必要であるために、いくつかの研究ではパワー不足となり、統計的に有意な差を検出できなかった可能性がある [31]。
我々のメタ回帰の結果から、性はレビューした研究において有意な修飾因子ではないことが示唆された。さらに、他の研究では、血清BDNFレベルは性で層別化しても有意差がないことが示されている [31]。したがって、我々は、性自体が血清 BDNF レベルに主で強い影響を及ぼすことはないと提案している。しかし、性とAPOE遺伝子型や薬剤などの他のモデレーターとの相互作用効果がある可能性があることが検討された[32]。さらに、ADバイオマーカーとしてのBDNFの診断有用性に対する性の影響は限定的であるが、大規模コホート研究での予後有用性を調査すべきであることが提案された[32]。
臨床的および統計的な考察とは別に、実験室での血液サンプルの取り扱いと測定プロセスも同様に重要である。臨床研究においてしばしば見落とされ、報告されていない重要な側面の1つは、検体の診断状態に対する検査室スタッフのマスキングである。当然のことながら、ここでレビューされた研究では、この変数を報告していないであった。さらに、レビューされた研究では、異なるメーカーによって製造されたいくつかの異なる血清BDNF測定法が採用されていた。Polacchiniらは、市販されている6つのアッセイをレビューし、6つのアッセイのうち2つだけが成熟BDNFを選択的に認識し、残りのアッセイはプロBDNFと成熟BDNFの両方のシグナルを組み合わせた測定値を与えていると結論付けている[33]。成熟型BDNFに特異的であることが報告されている2つのアッセイは、Aviscera-Bioscience社とR&D System-Quantikine社のものであった。ここでレビューされた研究の大部分は、R&D Systems社のアッセイを使用している。成熟型 BDNF のみを認識する際の抗体特異性の問題は、血清中には対照的な効果を持つ両方の型が含まれているため、非常に重要である。したがって、今後の研究にお勧めするのは、研究間の比較を容易にするために、成熟型のみに特異的なアッセイ法を使用して研究の不均一性を減らすことである。別の研究では、Promega-Emax 社製のアッセイが最も広く使用されている BDNF キットであることが確認されているが、これは一晩のプレートコーティングを必要とするため、研究の不均一性をさらに助長することになるであろう [33]。ヒトサンプルに対する本測定法の種特異性は、今後の研究においてもう一つの重要な考慮事項である。Biosensis と Millipore-Chemikine によって製造されたアッセイはげっ歯類との交差反応性を示したが、Promega-Emax アッセイはヒトの種特異性を宣言していないであった [33]。その他、実験室で考慮すべき点としては、バッチ効果、アッセイ内およびアッセイ間のばらつき、総処理時間、感度、検出範囲などがある。これらを総合すると、成熟した BDNF フォーム特異的アッセイとヒト特異的アッセイが今後の研究のために推奨される。Naegelinらは、BDNFが実際にヒト血清中で確実に測定できることを示している[31]。しかし、このレビューをもとに、上述のように測定法の標準化が必要とされる多くの問題点があることを確認した。測定方法が標準化されてこそ、将来の研究での異質性が少なくなり、研究間での比較が可能になる。これは、認知障害における血清 BDNF の臨床閾値の確立を促進し、最終的には臨床での血清 BDNF の使用を促進し、バイオマーカ ー研究の転換を可能にするための重要なステップである。
本研究は、アルツハイマー病患者およびMCI患者の血清BDNFレベルを健常対照者と比較した最初のシステマティックレビューおよびメタアナリシスの一つである。これは、疾患の軌跡の全スペクトルをカバーしている。4つの最も一般的なモデレーターが利用可能であることから、メタ回帰分析を行うことができた。その結果、検討した研究で観察された血清BDNFレベルの不均一性に寄与する重要な因子が同定され、今後の研究ではこれらの因子をコントロールする必要があることがわかった。さらに、血清 BDNF の所見を混乱させる可能性のある他の修飾因子についてもレビューし、今後の研究のための推奨事項を提示した。さらに、本レビューでは、先験的な検索戦略、包括的な文献レビュー、厳格な包含基準と除外基準を取り入れており、研究の頑健性を裏付けている。
本研究にはいくつかの限界がある。レビューされた研究のほとんどが欧米諸国で実施されたため、我々が調査できなかった要因の違いがあるかもしれない。その中には、文化や民族などの心理社会的要因や、末梢性BDNFレベルに差があることが示されているBDNF遺伝子の対立遺伝子の違いなどの遺伝的要因も含まれている。このような知見のギャップから、他の集団における末梢性BDNFレベルの調査が今後必要とされている。この点については、レビューされた研究で提示されたデータが少ないため、限られた数のモデレーターのみがメタ回帰に含まれていた。ほとんどの研究では、上記で検討したもの以外のモデレーターは報告されていなかった。そのため、共存疾患、心理社会的・生活習慣的因子、抗うつ薬の使用、多型など、BDNFレベルの交絡因子としてよく知られているいくつかの研究は、メタ回帰分析では考慮することができなかった。さらに、このメタ解析に含まれた研究のほとんどは、早期発症ADと後期発症ADの区別もなく、ADの重症度も区別していなかったため、これらのサブグループにおける末梢性BDNFレベルの区別は不可能であった。これらのサブグループを区別することで、アルツハイマー病患者のBDNFレベルの精度を高めることができるかもしれない。しかし、被験者をさらにサブグループに分離することで、各サブグループの研究数が少ないためにメタアナリシスの解析力が損なわれる可能性があることにも注意が必要である。
8. ADにおける血清BDNFレベルの低下の分子機構
BDNF のレベルを制御する分子機構はいくつか知られている。それらの中には、BDNFタンパク質のリソソーム分解の調節 [34]、BDNFのエピジェネティックな調節を介したタンパク質発現の調節 [35,36]、血小板によるBDNFの放出の調節 [37]、および成熟BDNFへのプロBDNFの選別と開裂の調節 [38]がある。以下にレビューするのは、アルツハイマー病患者における血清BDNFレベルの低下に寄与した可能性のあるもっともらしいメカニズムのいくつかである。
脳の老化とアルツハイマー病のグルココルチコイド(GC)仮説は、コルチコステロンなどのグルココルチコイドへの継続的な曝露が海馬の老化を促進し、ADを引き起こすと仮定している[39]。ある研究では、コルチコステロンはmRNAとタンパク質の両方のレベルでBDNFの発現を減少させることが明らかになった[40]。Connorらの研究では、コルチコステロンの投与により、BDNFのmRNAが70%も減少したと報告されている[41]。また、死後脳における BDNF の mRNA レベルの低下もいくつかの研究で示されている [37,38,39]。
アルツハイマー病患者における血清BDNFレベルの有意な低下に寄与するもう一つの分子機構は、アミロイドβ-42によって調節されている可能性がある。ある研究では、7つのヒトBDNF mRNA転写物のうち3つがADにおいて特異的にダウンレギュレートされていることが明らかになった。また、ヒト神経芽腫細胞株モデルにおいて、オリゴメリックAβ1-42がリン酸化されたCAMP応答性エレメント結合タンパク質(CREB)と主要なBDNF転写物である転写物IVとVを減少させることも明らかにした[42]。したがって、ADの死後の脳での研究では、総CREBとphospho-CREBのレベルで有意な減少を明らかにした。これらのリン酸-CREBおよびCREBレベルの低下は、同様にコルチコステロンレベルの増加に起因する可能性がある[43]。すべてにおいて、グルココルチコイドとアミロイドβ-42の両方が、総量とホスホ-CREBレベルの調節を介してBDNFのmRNA転写物を減少させ、結果としてアルツハイマー病患者における血清BDNFレベルの低下をもたらす可能性がある。
さらに、血小板はBDNFの貯蔵庫として機能し、血清中のBDNFレベルの調節において重要な役割を果たしている可能性がある [37]。これに対応して、Karegeらは、大うつ病性障害患者の血清中の血小板からのBDNF放出が減少したことを報告している[44]。今後、アルツハイマー病患者においても同様の現象が起こるかどうかを調べる価値があると考えられる。また、DNAメチル化やmiRNAによるBDNFレベルのエピジェネティックな制御 [45] もアルツハイマー病患者の血清BDNFレベルの低下に寄与している可能性があり、今後の臨床研究の必要性を示唆している。BDNFのエピジェネティックな調節については、Catteneoらが優れた徹底したレビューを行っている[46]。
9. BDNFの作用の証拠と保護機構
BDNFはCREBを介した転写を介して酸化ストレスからの保護を提供している[47]。CREB/CRE媒介転写の強力なネガティブレギュレーターであるA-CREBは、BDNFの神経保護効果を阻害し、培養細胞を興奮性ストレスに対して脆弱にした [47]。具体的には、細胞培養では、BDNFは過酸化水素に対する保護効果を示したが、生体内試験では、BDNFはCREBの発現を誘導し、これは酸化負荷の減少と関連していた[47]。CREB は遺伝子の転写を制御する因子であり、酸化ストレスからの保護に関わる遺伝子は、mRNA マイクロアレイやプロテオミクスを用いて同定されていない。興奮細胞毒であるグルタミン酸を投与した場合、BDNFは培養海馬ニューロンを神経細胞障害から保護した[48]。一方、BDNF 抗体を投与すると、BDNF の興奮保護作用は完全に消失した [48]。ラットモデルでは、BDNF ブロッキング抗体を投与したラットに興奮細胞毒素であるカイナートを投与したところ、BDNF の興奮保護作用は消失し、CA3 ニューロンが広範囲に消失したことが明らかになった [48]。
10. BDNFレベルを増加させるための介入
以下に、BDNFレベルを改善し、認知機能の改善をもたらすことが実証されている心理社会的介入戦略のいくつかを紹介する。
薬物療法はBDNFレベルにポジティブな影響を与えることが示されている。これに対応して、ADの症状を緩和するために使用される医薬品は、治療効果と副作用がよく特徴づけられているため、魅力的なターゲットとなっている。例えば、メマンチンは臨床的に関連した用量で大脳辺縁部のBDNFのmRNAレベルを著しく増加させ、この効果は広範囲で用量依存的であった。BDNFのmRNAレベルに対するメマンチンの効果は、BDNFのタンパク質レベルの変化にも反映されていた[49]。また、サルを用いた別の研究では、メマンチンが BDNF の mRNA とタンパク質発現を特異的にアップレギュレートすることが示された [50]。ヒトを対象とした研究では、アルツハイマー病患者にドネペジルを15ヶ月間投与した後、アルツハイマー病患者の血清BDNFレベルは健常者と同等のレベルまで有意に上昇した[23]。以上のことから、薬物によるBDNFレベルの修飾と認知機能の改善の可能性が示唆された。
薬物療法とは別に、生活習慣の変化がBDNFレベルの上昇に有効であることが証明された。生活習慣の変化の一つとして、食事制限や健康的な食生活が挙げられる。ラットモデルでは、食事制限はBDNFの遺伝子発現を誘導し、新たに発芽したニューロンの数を増加させることが明らかになっている[51]。また、Duanらの研究では、食事制限食と健康食を与えたラットの海馬、大脳皮質、線条体でBDNFレベルが有意に増加したことが示されている[48]。ヒトの参加者を対象とした別の研究では、体重のコントロールがBDNFレベルの循環に及ぼす影響の重要性が示されている[52]。また、ラットの実験モデルでは、慢性的な睡眠不足もBDNFレベルを低下させることが示されている[53]。さらに、ストレスレベルの上昇と睡眠不足は、臨床研究において血清 BDNF レベルの低下に関与していることが示唆されている [54]。これら2つの研究を合わせると、BDNFレベルの維持における睡眠の重要性が浮き彫りになった。
もう一つのもっともらしい戦略は運動である。Ferrisらは、運動後に血清BDNFレベルが有意に上昇し、運動の強度が高いほどBDNFレベルの上昇が高いことを明らかにした[55]。さらに、1年間にわたって毎日一貫して有酸素運動を行うと、血清BDNFレベルの上昇、海馬体積の増加、空間記憶の改善がもたらされることが示された[56]。Laskeらは、大うつ病性障害患者において、30分間の短時間の運動を行った後、BDNFレベルが健常対照者と同等のレベルまで有意に上昇したことを明らかにしている[57]。最後に、理学療法介入(PTI)が高齢女性のBDNFレベルを上昇させることも示された[58]。
さらに、瞑想もBDNFレベルを上昇させる可能性のあるもう一つの方法である。瞑想は、多くの異なるプラクティス [59] を包含する広い用語であり、そのうちのいくつかは、超越瞑想、ヨガ、およびマインドフルネスの練習である。超越的瞑想(TM)は、1日2回20分間目を閉じた状態で個別化されたマントラを唱えることを含む。この練習は、コントロール[60]よりも超越瞑想練習者の3倍低いコルチゾールレベルをもたらした。この減少したコルチゾールレベルは、BDNFのレベルに影響を与える可能性がある。Xiongらは、コルチゾールレベルを低下させることで、BDNFレベルが改善される可能性があることを提案した[59]。瞑想を実践している人は、特定の皮質領域の厚さの年齢に関連した低下が低いことが判明した[59]。同様に、ヨガは、薬物治療の有無にかかわらず、うつ病患者の両グループにおいて血清BDNFレベルを上昇させることが示されている[61]。
BDNFレベルを増加させるための他の実行可能な方法としては、知的刺激[62]、クルクミン[63]、ドコサヘキサエン酸(DHA)[64]、緑茶など、BDNFレベルを増加させることが実証されているポリフェノールを含む食品やサプリメントの消費量の増加[65]などが挙げられるが、上記では議論されていない認知機能の改善をもたらした。さらに、運動と食事の相乗効果があり、DHAと運動を組み合わせて投与すると、海馬の活性化された形態のAktとCa2+/カルモジュリン依存性プロテインキナーゼII(CaMKII)のレベルが増加したことが示された呉らの研究で証明されている[66]。
11. 今後の方向性
健康な対照群と比較して、アルツハイマー病患者の血清BDNFレベルに統計学的に有意な差があることを示す我々の分析で証明されているように、証拠は頑健である。この末梢性BDNFレベルの低下という現象は、主にアミロイドβとタウ蛋白質を標的としたAD試験が繰り返し失敗していることから、ADにおけるもう一つの病理学的プロセスを示唆しており、より大きな注意を払う必要があると考えられる。臨床研究、特にイメージング技術を用いた認知スコアや脳の解剖学的、機能的、代謝的変化とBDNFの時間的関係を明らかにする縦断的な追跡調査に焦点を当てた研究に力を入れていくことは、この領域をより深く理解する上で特に貴重なものとなるであろう。検討した研究で報告された限られた変数の限界に関連して、ここで検討されたBDNFレベルの様々な交絡因子については、今後提案されている縦断的な研究において検討する必要がある。これらの交絡因子の検討は、末梢性BDNFに対する個人的および/または相乗効果に関するものであるかどうかにかかわらず、BDNFと認知障害を検討する分野の「聖杯」となる可能性があることを提案する。また、MDDを併発している患者や向精神薬を服用している患者のサブグループにも注目すべきである。議論されているように、様々な人口統計学、研究デザイン、実験室のパラメータも同様に重要である。これらの提案された大規模で臨床的に十分に定義されたよく管理されたコホートを用いて、ADや認知症における認知とBDNFの関係における軌跡を明らかにすることができる。これらの前向き研究は、BDNFを他のバイオマーカーと組み合わせて、ADや認知症の予測、診断、治療反応のコンテキストで使用するための基盤を提供することができる。最後に、末梢性BDNFレベルを増加させ、それに伴って認知機能の改善をもたらす新しい心理社会的介入は、比較的未知の、しかし非常に有望なもう一つの道筋を表している。
12. 結論
ADの異なるステージにおける末梢性BDNFレベルについては相反するデータが存在している。したがって、HCからMCI、ADまでの認知機能障害のスペクトルにおける末梢BDNFレベルの変化の方向性を明らかにすることは非常に重要である。本研究では、アルツハイマー病患者の血清中に確かにBDNFが減少していると結論づけたパイロットデータを提供した。しかし、ADとMCI、MCIと健常対照の血清BDNFレベルには有意な差は認められなかった。年齢やMMSEスコアの違いが、対象となった研究の所見の不均一性に寄与していた。本研究の意味合いの一つは、ADにおける末梢性BDNFレベルの低下が、末梢性BDNFレベルの改善における試験の有効性を検討し、認知領域におけるそれに伴う改善を観察するための将来の試験のベースラインとして役立つ可能性があるということである。