Contents
d-amino Acids in Health and Disease: A Focus on Cancer
www.ncbi.nlm.nih.gov/pmc/articles/PMC6770864/
オンラインで2019年9月12日公開
Jacco J.A.J. Bastings,1,2 Hans M. van Eijk,1 Steven W. Olde Damink,1,3 and Sander S. Rensen1,*。
概要
l-アミノ酸のエナンチオマー対応物であるd-アミノ酸は、長い間、生体内では機能していないか、存在すらしていないと考えられていた。しかし今日では、d-アミノ酸は人体の様々な生理的プロセスにおいて重要な役割を果たしていることが認められている。
最もよく研究されているのは、神経伝達におけるd-セリンとd-アスパラギン酸の寄与である。また、これらのd-アミノ酸をはじめとするいくつかのd-アミノ酸は、自然免疫や腸管バリア機能の制御にも関与しているとされている。
重要なのは、体内の特定のd-アミノ酸の存在が、統合失調症、筋萎縮性側索硬化症、白内障や動脈硬化などの加齢性疾患を含むいくつかの疾患と関連しているということである。さらに、がんの発生、病態生理、治療におけるd-アミノ酸の役割を裏付ける証拠も増えている。
この総説では、d-アミノ酸のさまざまな供給源、その代謝、さらにはがんに焦点を当てた人間の生理的プロセスや疾患への貢献について概観することを目的としている。
キーワード:マイクロバイオータ、食品加工、ラセミ化、自然免疫、がん
1. はじめに
アミノ酸は、酵素、受容体、抗体、シグナル伝達分子、ホルモンなど、すべての生物に不可欠なタンパク質構造の基礎となっている。蛋白質生成能を持つアミノ酸は全部で20種類あると言われている。長い間、哺乳類の生理機能に関与していると考えられていたのは、l配置のアミノ酸だけであった。そのエナンチオマーであるd-アミノ酸は、生体内には存在しない、機能しないものと考えられていた。しかし、20世紀半ばに行われた研究により、乳毛虫の組織や細菌の細胞壁にd-アミノ酸が含まれていることが判明した[1,2]。1970年代には、植物、無脊椎動物、脊椎動物でもd-アミノ酸が確認された[3,4,5,6,7]。その後、ヒトの脳組織、歯、目の水晶体にもd-アミノ酸が存在することが判明した[8,9,10,11,12]。過去30年の間に、ヒトのd-アミノ酸に焦点を当てた研究がさらに進み、脳だけでなく、血漿、尿、唾液、脳脊髄液(脳脊髄液)羊水、動脈壁、皮膚、骨など、他の組織や体液にも豊富に含まれていることが確認された[13,14,15,16,17,18,19]。
体内のd-アミノ酸は、複数のソースから発生する可能性がある。まず、ラセマーゼ酵素によるl-アミノ酸のラセミ化により、d-アミノ酸の内因性生合成が行われる。現在、哺乳類では、セリンラセマーゼとアスパラギン酸ラセマーゼの2つのラセマーゼ酵素が見つかっている[20]。この2つの酵素のうち、ヒトの組織ではセリンラセマーゼのみが発見されている[21,22,23]。一方、アスパラギン酸ラセマーゼの存在は、マウス、両生類、軟体動物、および細菌類で検出されている[20,24]。最近の研究結果によると、マウスのアスパラギン酸ラセマーゼの発現に関与する遺伝子のヒトおよびラットのホモログ(すなわち、グルタミン酸-オキサロ酢酸トランスアミナーゼ1-ライク1、Got1l1)は、ヒトおよびラットのd-Asp合成には寄与していないことが明らかになった[25]。したがって、ヒトのアスパラギン酸ラセマーゼはこれまで検出されていない。第二に、d-アミノ酸は食事から体内に入る。過去数十年の間に、ある種の食品加工技術が、いくつかの種類の食品におけるl-アミノ酸のd-アミノ酸へのラセミ化に寄与していることが明らかになった[26]。さらに、d-アミノ酸は酢や乳製品などの発酵食品にも含まれている[27,28]。第三に、ヒトのd-アミノ酸プールの少なくとも3分の1は、微生物による合成に由来することが示唆されている[26]。最近の研究によると、ヒトの腸内細菌叢は、宿主の体内での全身的なd-アミノ酸の豊富さに大きく貢献している可能性がある[29,30]。
d-セリン(d-Ser)およびd-アスパラギン酸(d-Asp)は、組織内ラセミ化に由来する人体内唯一のd-アミノ酸であると示唆されている[31]。そのため、これらのd-アミノ酸は、カノニカルd-アミノ酸と呼ばれ、ヒトの生理との関連で最もよく研究されている2つのd-アミノ酸である。d-Serは、脳内のn-methyl-d-aspartate (NMDA)受容体の活性化に重要な役割を果たしている[33,34]。例えば、NMDA受容体を介したd-Serによる神経伝達は、学習や記憶の形成に関与している。そのため、d-Serのシグナル伝達や代謝の変化は、統合失調症、てんかん、アルツハイマー病などのNMDA受容体関連の神経生理学的疾患に関与することが示唆されている[35,36]。d-Aspもまた、NMDA受容体関連の神経伝達や関連疾患に関与することが示唆されている[37]。さらに、d-Aspは、中枢神経系の発達や、ゴナドトロピン放出ホルモン(GnRH)、成長ホルモン(GH)、テストステロンの分泌などの(神経)内分泌プロセスの調節にも重要な役割を果たしている可能性がある[38,39]。しかし、d-Aspのこれらの(神経)内分泌作用は、主にラットの研究で確立されたものであり、ヒトの研究は不足している。これらのカノニカルなd-アミノ酸に加えて、いわゆる非カノニカルなd-アミノ酸(微生物を介して、あるいは食事から摂取して得られる)も、例えば、腎機能、自然免疫、腸管バリアーの調節などに関連する(病態)生理学的プロセスに関与する可能性があるため、現在、ますます注目を集めている[30,40,41]。
本総説では、d-アミノ酸の供給源と、人体におけるd-アミノ酸の代謝過程を要約することを目的としている。さらに、がんに焦点を当てて、健康と病気における正規および非正規のd-アミノ酸の役割について概観する。
2. 起源と供給源
2.1. 微生物由来のd-アミノ酸
前述のように、推定では、ヒトの総d-アミノ酸プールの少なくとも3分の1は、微生物によるd-アミノ酸合成に由来するとされている[26]。これらは、細菌の細胞壁の基礎となるペプチドグリカンの主要成分である[42,43]。ペプチドグリカンは、細菌にとって不可欠な保護バリアーを形成し、浸透圧の調節や細胞の形状維持にも関与している[44]。ペプチドグリカンのペプチド部分に存在するd-アミノ酸は、通常2つのl-異性体の間を切断する細胞外プロテアーゼに対する微生物の防御に貢献している。さらに、d-Serとd-Aspは、幹ペプチドの末端位置に存在する場合、特定の殺菌性製品から保護することが示唆されている。これらの細胞性細菌のd-アミノ酸の次に、最近の文献では、細菌がd-アミノ酸を細胞外環境に放出できることが示されている[42,43]。これらの細胞外d-アミノ酸は、微生物群集におけるバイオフィルムの分解や細菌の胞子形成を制御していることが示唆されている[29,45,46,47]。
細菌のd-アミノ酸生産は、細菌に内在するアミノ酸ラセマーゼを介して行われる。一般に、今日では、ピリドキサール-5-リン酸(PLP)依存的に働くラセマーゼ酵素と、PLP非依存的なラセマーゼの2種類の細菌ラセマーゼが報告されている[48]。PLP依存性のラセマーゼの例としては、アラニンラセマーゼ、セリンラセマーゼ、リジンラセマーゼなどがある[48]。最近の研究では、このカテゴリーの中に新しいタイプのラセマーゼ、すなわちブロードスペクトラムラセマーゼの存在が示されている[49,50]。ブロードスペクトラムラセマーゼは、アミノ酸に特異的である代わりに、さまざまなアミノ酸を基質として用いることができる。現在までに、ブロードスペクトラムラセマーゼは限られたグラム陰性菌でしか報告されていないが、アラニンラセマーゼはほとんどすべてのペプチドグリカン産生菌に存在することが示唆されている[48]。アスパラギン酸ラセマーゼ、プロリンラセマーゼ、グルタミン酸ラセマーゼは、PLP非依存性のラセマーゼ酵素として最もよく知られている。グルタミン酸ラセマーゼは、このグループの中で最も豊富なラセマーゼであり、ほとんど全てのペプチドグリカン含有細菌に存在する。
2.2. 食餌性d-アミノ酸
過去数十年にわたり、Genchi[51]がまとめたように、様々な種類の食品や飲料にd-アミノ酸が含まれていることが多くの研究で報告されている。野菜、果物、ワイン、牛乳、ビール、そして特に発酵食品に含まれるd-アミノ酸の存在はよく知られている[52]。食物中のd-アミノ酸には、食品中に自然に存在するものと、食品加工技術によって生成されるものがある.食品中に天然に存在するd-アミノ酸は、主に微生物による合成に由来する。パンに含まれるd-アミノ酸(主にd-Alaとd-Glu)は、ベーキングプロセスの前にサワードウを発酵させる際に使用される乳酸菌と酵母に由来する[53]。もう一つの例は、酢に含まれるd-アミノ酸の存在である。酢は、穀物、野菜、果物などを発酵させて作られる。最近の研究結果によると、酢に含まれるd-アミノ酸は主に乳酸菌に由来するものであることがわかっている[27]。微生物による合成に加えて、天然由来のd-アミノ酸は他の供給源からも得られる。例えば、ある種の果物や野菜に含まれるd-アミノ酸は、部分的には高等植物に存在する固有のラセマーゼに由来すると考えられている[26,54]。
過去数十年にわたり、欧米諸国では加工食品や超加工食品の消費量が大幅に増加している[55,56]。アルカリ処理、高pH値、長時間の加熱などの食品加工技術は、l-アミノ酸のラセミ化を誘発し、そのd-ステレオ異性体を生成することが知られている[26]。複数の研究により、これらの食品加工技術を用いて製造された食品には、かなりの量のd-アミノ酸が含まれていることが示されている[57,58,59,60,61,62,63]。味覚の面では、20種類のプロテオゲンd-アミノ酸のうち19種類(d-グリシンを除く)は、そのl-異性体と比較して味が異なるようである [52]。さらに、Kawaiらの研究によると、d-Ala、d-Phe、d-Trpの味は、それぞれ砂糖の約3倍、5倍、35倍である[64]。ラセミ化率が高いと、食品中の特定のl-アミノ酸レベルが低下し、その結果、d-アミノ酸含量が増加して、食事性タンパク質の消化率が低下する [65]。加工食品や超加工食品を介したd-アミノ酸の消費は、肥満のパンデミックや癌の有病率の増加と並行して、過去数年間で急激に増加しているにもかかわらず、食事によるd-アミノ酸の消費がヒトの代謝や健康全般に対して有益なのか有害なのかは依然として不明である。
2.3. 内在的なレース化
人体には外因性に生成されたd-アミノ酸が豊富に存在するが、それに加えて、d-アミノ酸はいわゆる内因性ラセミ化に由来することもある。先に述べたように、d-Serとd-Aspは中枢神経系の複数のプロセスに寄与しており、組織内ラセミ化に由来する人体の唯一のd-アミノ酸であることも示唆されている[31]。セリンラセマーゼは、人間の体内で存在が確認されている唯一のラセマーゼである。例えば、ヒトの場合、セリンラセマーゼは、前脳の興奮性および抑制性の神経細胞、海馬、その他の様々な組織に発現している(図1)[66,67]。セリンラセマーゼは、アデノシン三リン酸、Ca++、およびMn++の存在下で、PLP依存的にl-Serをd-Serに変換する[68]。Woloskerらは、l-Serからd-Serへの変換は可逆的であり、したがって、セリンラセマーゼはd-Serをl-Serに変換することもできると報告している(親和性は低い)[69]。さらに、最近のネズミを用いた研究の結果から、セリンラセマーゼがd-Aspの生合成にも関与している可能性が示されている[70]。さらに、セリンラセマーゼは、l-Serとd-Serの両方からの水のα,β-脱離も触媒し、その結果、ピルビン酸とアンモニアが生成される[22,71]。
図1 ヒトのさまざまな組織におけるd-アミノ酸代謝に関与する酵素のタンパク質およびmRNAの発現プロファイルの概要
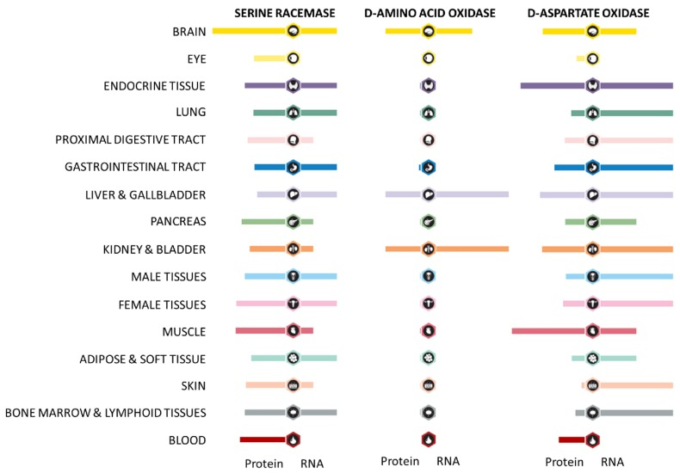
Human Protein Atlas [72] (Version 19, www.proteinatlas.org で入手可能)からの引用。
2.4. 分解
約85年前、クレブスは哺乳類にフラボ酵素であるd-アミノ酸オキシダーゼ(DAO)が存在することを初めて発見した[73]。このフラボ酵素には、d-アミノ酸を酸化的に脱アミノ化し、それによって分解する能力がある。フラビンアデニンヌクレオチド(FAD)に依存したプロセスで、DAOはd-アミノ酸を対応するイミノ酸とフラビンアデニンジヌクレオチド(FADH2)に変換する[74]。酸素の存在下では、FADH2が再酸化され、FADと抗菌剤である過酸化水素(H2O2)が生成される[74]。イミノ酸は、最終的に非酵素的に加水分解され、対応するα-ケト酸とアンモニア(NH3)になる。DAOは、微生物、昆虫、下等脊椎動物、哺乳類など、非常に多様な生物で発現している。DAOは、微生物、昆虫、下等脊椎動物、哺乳類など多様な生物で発現しており、それぞれの生物で異なる機能を持っている。例えば、真菌のDAO活性は、d-アミノ酸の毒性作用からこれらの生物を保護し、d-アミノ酸の異化を介して細胞の成長を促進する[75]。また、細菌では、DAOが細胞壁から放出される非正規のd-アミノ酸の異化を誘導することが示唆されている[76]。しかし、細菌の代謝におけるDAOの正確な役割は、まだ解明されていない。
哺乳類では、DAOは主に肝臓、腎臓、および中枢神経系に発現している(図1)[77]。細胞レベルでは、DAOは主にペルオキシソムに発現する酵素である[78,79,80,81]。しかし、DAOは、神経細胞の細胞質や腎近位尿細管上皮細胞の細胞質や核にも発現していることが示唆されている[82,83]。中枢神経系では、DAOはカノニカルなd-アミノ酸であるd-Serの分解に関与しており、したがって、d-Serに関連する神経伝達の調節にも関与している。肝および腎のDAOは、全身のd-アミノ酸のクリアランスおよび排泄に寄与することが示唆されている。神経系、肝系、腎系のDAOの発現に加えて、佐々部らの最近の研究では、ヒトの腸細胞や杯細胞の先端部にもDAOが発現していることが示されている[30]。さらに、この研究では、DAOが腸管内腔に排泄されることが示された[30]。本研究の一環として行われたDAOノックアウトモデルを用いた実験では、野生型マウスとDAOノックアウトモデルとの間で腸内細菌叢の組成に違いが見られ、DAOの腸内発現と腸内細菌叢の組成との間に関連性があることが示された。
3. d-アミノ酸の生理的役割
3.1. 神経系
前述したように、d-Aspとd-Serは人体に存在する唯一の正統なd-アミノ酸である。d-Aspとd-Serはともに、神経伝達や神経信号のプロセスに関与している。齧歯類の研究によると、d-Serは脳の前頭葉で主に発現していることが分かっている[84,85,86]。d-Serは、NR1サブユニットのグリシン部位に結合することで、NMDA受容体の活性化の基本的なコアゴニストとして機能する[87]。グリシンがこの受容体サブユニットに同様の親和性を有するにもかかわらず、酵素ノックダウン研究は、NMDA関連シグナル伝達にd-Serの存在が重要であることを示している[88]。中枢神経系におけるd-Serの生成と分解は、セリンラセマーゼとDAOの活性によってそれぞれ決定される。マウスの研究によると、セリンラセマーゼの欠損は、前脳のd-Serレベルを約90%低下させ、NMDA受容体に関連するシナプスの神経可塑性を阻害することが示されている[89,90].一方、DAOノックアウトでは、前脳のd-Serレベルの乱れは見られなかった。最近の総説で指摘されているように、セリンラセマーゼの発現低下や遺伝子の枯渇は、統合失調症や依存症などの認知障害と関連している[91]。機能レベルでは、セリンラセマーゼとそれに関連するd-Serの生成は、主に記憶と学習プロセスに関連している。海馬のd-Serの枯渇は、記憶の形成に大きく関与するプロセスであるNMDA受容体依存性の長期増強(LTP)の形成を低下させる[92]。ヒトでのデータは少ないものの、動物実験では、海馬のd-Ser濃度が高いと、ネズミの社会的記憶、作業記憶、認識が向上することが示されている[93,94]。そのため、セリンラセマ依存的なd-Serの生成は、脳の障害に対処するための潜在的な標的となるかもしれない。
d-Serに加えて、d-Aspは神経伝達や神経内分泌系においても基本的な役割を果たしていると考えられており、げっ歯類やヒトを対象とした研究で明らかになっている[95,96,97]。d-Aspは、ヒトの脳の複数の領域(海馬や前頭前野を含む)や、副腎、下垂体、精巣などの(神経)内分泌器官で検出されている[39]。d-Aspが神経伝達物質として特徴づけられているにもかかわらず、選択的なd-Asp受容体はまだ決定されていない[99]。d-AspはNMDA受容体のl-Glu結合部位に高い親和性を持つ[37]。さらに、d-Aspは2-アミノ-3-(5-メチル-3-オキソ-1,2-オキサゾール-4-イル)プロパン酸様受容体の神経調節物質として機能することが示唆されている[99]。内因性のd-Aspの生合成は、アスパラギン酸のラセミ化によって行われると考えられている[99]。しかし、アスパラギン酸ラセマーゼはげっ歯類や無脊椎動物に存在しているにもかかわらず、ヒトのアスパラギン酸ラセマーゼはまだ同定されていない[100,101]。さらに、ほとんどのd-アミノ酸がDAOによって分解されるのに対し、d-Aspの分解はd-アスパラギン酸オキシダーゼ(DDO)を介して行われる[102]。DDOは、d-Aspやd-Gluといった酸性のd-アミノ酸に特異的なフラボ酵素である。その活性は、d-Aspレベルと相関している[99]。広く発現しており、副腎、脳、肝臓、心臓で最も高い発現量を示する(図1)。生理学的には、d-Aspは学習と記憶に関わるプロセスに寄与することが示唆されている[103]。さらに、d-Aspは、下垂体でのステロイドホルモンの合成やテストステロンの放出調節など、複数の(神経)内分泌プロセスにも関与している[96,104,105]。
3.2. 老化
藤井による最近の優れたレビューで詳しく述べられているように、非酵素的または自発的なラセミ化は、加齢と関連しているようである[106]。この加齢に伴う自発的なラセミ化は、例えば、UV-β線照射や酸化ストレスの結果として起こることが示唆されている。高齢者の様々な組織で高いd-Aspレベルが検出されたことから、l-Aspからd-Aspへの自発的なラセミ化は、特に高年齢化と関連していることが示唆されている。例えば、骨組織、皮膚組織、動脈壁、眼球レンズなどでは、高年齢になるほどd-Aspの存在感が増すことが確認されている[16,17,18,107,108,109,110]。これらの組織におけるl-アミノ酸の自発的なラセミ化は、その構造タンパク質の機能低下を促進すると考えられるため、高いd-アミノ酸レベル(特にd-Asp)の存在は、皮膚の光老化、動脈硬化、黄斑変性症、白内障などの老化に関連する疾患と関連している[106,111]。
3.3. 自然免疫系の防御
中枢神経系におけるd-アミノ酸の生理的役割の次に、最近の研究では、自然免疫防御へのd-アミノ酸の関与が指摘されている。自然免疫におけるd-アミノ酸とDAOの新たな役割については、SasabeとSuzukiが見事にレビューしている[41]。簡単に説明すると、白血球におけるDAOの発現は、これらの細胞の殺菌活性と関連しているようである。DAOは白血球の表面に発現し、貪食の際に内包される[112,113,114]。先に説明したように、DAOによるd-アミノ酸の酸化的脱アミノ化は、抗菌産物であるH2O2を生成する。したがって、細菌のd-アミノ酸にさらされたときのDAOによるファゴソームでのH2O2生成は、d-アミノ酸と自然免疫系との間の重要なつながりであることが示唆されている。マウスを用いた生体内試験の研究では、自然免疫系のDAOの発現が黄色ブドウ球菌の感染防御に関連していることが示されている[115]。さらに、Tuinemaらの研究では、サルモネラ菌がDAOの基質を輸入することで、DAOの抗菌作用を回避できることが示されている[116]。白血球でのDAOの発現に加えて、DAOは最近、腸管粘膜の自然防御にも関係していることが明らかになった[30]。マウスとヒトの小腸サンプルを用いた研究では、DAOが杯細胞と腸細胞に存在することが示された[30]。ニワトリの小腸で既に発見されているように、佐々部らは、小腸の近位部ではより遠位部に比べてDAOの発現と活性が高いことを見出しており[30,117]、これは腸内細菌の存在と関係していた。ゴブレ細胞のDAOが腸管内腔に分泌されると、腸内のd-アミノ酸の酸化的脱アミノ化を介してH2O2の産生が増加した。これにより、小腸粘膜がコレラ病原体の感染から守られることが示されたのである。興味深いことに、マウスのDAO酵素を遺伝的に失活させると、腸内細菌叢の構成が大きく変化し、糞便中のIgA濃度が約2倍になった [30]。これは、DAO由来のH2O2による自然免疫防御の低下を補うためであると考えられる。これらのデータは、腸内細菌叢、d-アミノ酸、および腸内DAOの間のクロストークを明確に示している。さらに、2型糖尿病や非アルコール性脂肪性肝疾患などの代謝性疾患の発症に腸内細菌叢が影響を与えていることが次第に知られるようになってきたことを考えると[118]、d-アミノ酸とDAOがこれらの疾患の発症に一役買っているのではないかと推測したくなる。
4.疾患におけるd-アミノ酸
4.1. 神経系の疾患
Verrallらのレビューで示されているように、DAOはd-アミノ酸と統合失調症の間の重要なつながりであるかもしれない[119]。まず第一に、DAOに関連する遺伝子の関連は、最近の複数の研究において、統合失調症の発症と関連している[120,121,122]。第二に、げっ歯類モデルにおいてDAOを不活性化すると、抗精神分裂病効果が得られる可能性がある[119]。第3に、統合失調症患者では、DAO酵素の活性と発現の両方が亢進していることが示されている[123,124]。その結果、d-Serの放出率が低下し、NMDA依存性の神経伝達を変化させることで、統合失調症の発症と病態生理に関連していることが示唆されている[125,126]。複数のメタアナリシスにより、d-Serを含むNMDA受容体アゴニストは、臨床試験において抗精神分裂病効果を高めることが示されている[127,128,129]。さらに、最近の研究では、d-Asp放出の変化が統合失調症の発症と関連していることも示唆されている[130]。例えば、統合失調症患者の死後脳の前頭前野では、対照群に比べてd-Aspレベルの低下が認められている[131,132]。このように、d-Serおよびd-Aspレベルを標的とすることは、統合失調症の症状を(少なくとも部分的には)軽減するための有効な方法となる可能性がある。
さらに、統合失調症に加えて、d-アミノ酸は他の神経心理学的障害においても役割を果たしていることが示唆されている。例えば、側坐核におけるd-Serレベルの低下は、コカイン依存症の発症と関連しているとされている[87,133,134]。げっ歯類の研究では、セリンラセマーゼのノックアウトマウスは、野生型の対照マウスに比べて発作に対する抵抗性が高いことが示されており、これは、てんかんの病態生理におけるd-Serの役割の可能性を示唆する現象である[135]。最近の研究では、ヒトとげっ歯類の海馬組織を分析して、この概念を確認した[136]。神経心理学的障害に続いて、d-アミノ酸代謝の変化は、運動ニューロンの変性にも関与している。この概念は、特に筋萎縮性側索硬化症(ALS)の病態生理において検討されている。DAOの不活性化によりd-Serレベルが上昇すると、マウスの脊髄における運動ニューロンの変性や運動量の異常と関連することが報告されている[137]。神経病理学におけるd-アミノ酸の潜在的な役割を示す別の例が、Metcalfらによって最近報告された[138]。彼らは、β-N-メチルアミノ-L-アラニン(BMAA)のd-エナンチオマーが、ソテツを含む食品に含まれるシアノバクテリア由来の毒素であり、致死的ないわゆるALS/パーキンソン病認知症複合体の原因となることを、試験管内試験で示した。興味深いことに、BMAAのl形を経口投与すると、マウスの肝臓、特に中枢神経系にかなりの割合でD-BMAAが検出されたことから、BMAAのエナンチオマー間の相互変換のメカニズムが存在する可能性が示唆された。
他の神経変性疾患の病態生理にもd-アミノ酸が関与しているかどうかは不明である。例えば、アルツハイマー病患者と健常者の間のd-Serレベルの違いに焦点を当てた研究の結果は、依然として議論の的となっている[139]。
4.2.がんにおけるd-アミノ酸
癌におけるd-アミノ酸の潜在的な役割を示す最初の証拠は、1939年にKöglとErxlebenによって発表された[140]。彼らは、d-ロイシン(d-Leu)d-リジン(d-Lys)d-バリン(d-Val)そして特にd-グルタミン酸(d-Glu)が腫瘍タンパク質中に検出可能であることを報告し、腫瘍細胞の発生が細胞タンパク質中のd-アミノ酸の形成に依存していることを示唆していた。しかし、後年、彼らの発見は議論され、Millerら(1950)が「腫瘍タンパク質はd-アミノ酸を含んでいるのか」というタイトルのレビューにまとめている。A review of the controversy “というタイトルでMillerら(1950)がまとめている[141]。論争のほとんどは、当時、アミノ酸のd-エナンチオマーを特異的に分析するという技術的課題から生じたものであることに留意すべきである。1980年代に優れた分析法が利用できるようになると、さまざまな種から分離された数種類の腫瘍におけるd-アミノ酸の濃度は、l-アミノ酸の濃度に比べて低いことが示された[142]。その後、いくつかの腫瘍と健常対照組織を分析したところ、腫瘍と健常組織の間のd-Aspおよびd-Glu濃度の差は、統計的に有意ではないことが明らかになった[143]。それにもかかわらず、ヘリコバクター・ピロリ陽性の胃癌患者の胃液では、d-Alaの濃度が大幅に上昇していることが報告されている[144].これらの結果に基づいて、唾液サンプルを用いたd-アミノ酸ベースの診断テストが開発され、将来的に胃がんの早期診断を容易にすることが示唆された[145].しかし、これらの被験者におけるd-Alaレベルの上昇が、H. pyloriによる合成に関連しているかどうかをまず研究する必要がある。最近の研究では、肝細胞癌患者の血清中のd-Gluとd-Glnの濃度が低いことが明らかにされた[146]。さらに、膵臓癌患者の血清メタボロミクス研究では、d-Gluとd-Glnの代謝が制御されていることが示唆された[147]。このように、さまざまな種類のがんでは、d-アミノ酸の濃度が増加または減少している可能性があるが、これまでのところ、一貫した異常は確認されていない。
1970年代後半、14C標識したd-アミノ酸を担癌マウスに投与すると、対応するl-アミノ酸を投与した場合よりも、腫瘍細胞内に多く蓄積されることが示された[148]。さらに、d-Alaを投与すると、腫瘍細胞に発現したDAOがH2O2を産生するため、ラットの腫瘍の成長が抑制されることが報告されている[149]。笹村らによるいくつかの研究でも、d-アミノ酸の投与後に腫瘍細胞の増殖が抑えられることが示されている[150,151,152]。d-アミノ酸と発癌との間のもう一つの機能的関連性は、硫化水素(H2S)によって引き起こされる胃の損傷に対するd-Cysの影響に関する報告である[153]。d-CysがDAOによって代謝されると、3-メルカプトピルビン酸が生成され、さらに3-メルカプトピルビン酸硫酸基転移酵素によって代謝されてH2Sが生成される[154]。H2Sは、増殖、移動、浸潤に関与するシグナル伝達経路を活性化し、細胞の生体エネルギーを刺激し、血管新生を促進することで、いくつかのタイプの癌の病因に関与していると考えられている[155]。内因性のH2S生成量が少ないと腫瘍細胞の増殖が促進され、外因性のH2Sドナーから生成されたH2S濃度が高いと腫瘍細胞の増殖が抑制されるなど、H2Sの作用は多面的であると考えられる。エタノール誘発胃障害のマウスモデルでは、d-Cysの投与により、胃の病変が90%減少した[153].H2Sの生成を阻害するDAO阻害剤を同時に投与すると、d-Cysのこの保護効果が無効になったことから、このDAO依存性のH2S生成経路が胃がんの発生に寄与している可能性が示された。最近、ラット空腸においても、DAOによるd-CysからのH2Sの生成が確認されており[156]、同様のプロセスが腸の発癌に関与している可能性が示唆されている.DAO活性に関連したH2O2とH2Sが腫瘍細胞の増殖に影響を与えることを考慮すると、様々な癌の種類や段階におけるDAOの発現レベルや活性に関する研究が必要である。
Duらは最近、癌細胞の増殖におけるd-アミノ酸の蓄積の潜在的な機能的役割について、新たな実験データを提供した[157]。彼らはまず、ヒトMCF-7乳癌細胞は、非腫瘍性のMCF-10A乳房上皮細胞に比べて、d-Asp、d-Ser、g-Gluを最大22倍多く含んでいることを示した。d-アスパラギン、d-Ala、d-スレオニン、d-チロシンの濃度もMCF-7腫瘍細胞では高かったが、これらのd-アミノ酸の濃度の差はそれほど顕著ではなかった。一方、d-バリン、d-Leu、d-プロリン、d-リジン、d-トリプトファンの濃度はMCF-10A細胞で高かったことから、異なる細胞種において特定のd-アミノ酸が特異的に取り込まれたり放出されたりしている可能性がある。この疑問を解決するために、培養液中のd-アミノ酸濃度を経時的に測定した。その結果、MCF-7乳がん細胞は、d-Aspやd-Alaなどのいくつかのd-アミノ酸を取り込み、d-Serなどの他のd-アミノ酸は細胞外に放出されることがわかった。興味深いことに、MCF-7細胞を高グルコース培地の存在下で培養すると、d-イソロイシン、d-Glu、D-フェニルアラニン、d-リジンの正味の取り込みが観察されたが、通常のグルコースレベルで細胞を培養すると、これらのd-アミノ酸は培地中に放出された。また、高グルコース条件で培養したMCF-7細胞では、d-threonineとd-Serがより多く蓄積されることが示された。これは、がん細胞の代謝が、細胞外環境中のd-アミノ酸濃度に影響される可能性を示していると考えられる。このようなd-Aspの細胞内蓄積は、アスパラギン酸ラセマーゼの発現や、ある種のアミノ酸トランスポーターによる選択的な膜間輸送に関係しているのではないかと推測された。さらに、NMDA受容体の活性化が細胞の成長と生存に重要であることが示されていることから、d-Aspおよび/またはd-SerのNMDA受容体への結合が、腫瘍細胞の増殖に機能的な影響を与える可能性が提案された[158].以上のことから、乳がん細胞がd-Aspおよびd-Serを利用できないようにすることが、抗がん剤治療の戦略となる可能性があると考えられる。
また、d-アミノ酸は、抗がん剤の骨格に組み込まれると半減期が長くなることから、がん治療への有用性も示唆されている。例えば、血管内皮増殖因子受容体2に由来するd-アミノ酸を含む修飾ペプチドによって、強力な血管新生の抑制効果が認められた[159]。興味深いことに、l-アミノ酸をd-アミノ酸で置換することにより、血清安定性が向上するだけでなく、ペプチドの結合親和性が改善され、その効果が増強された。別の例として、上皮成長因子受容体のHER2を介した二量体化を標的としたペプチドミメティックがあり、d-アミノ酸を用いて安定化させると、がん細胞株での抗増殖活性が高まることがわかっている[160]。このアプローチと同様に、いわゆるd-アミノ酸を含む超分子ナノファイバーは、Wangらによって広範囲にレビューされているように、近い将来、がん治療薬の開発において重要な役割を果たすことが示唆されている[161]。簡単に説明すると、d-アミノ酸をバックボーンに持つ自己組織化ペプチドベースのナノファイバーは、従来のl-アミノ酸をバックボーンに持つものに比べて生物学的安定性が大幅に改善されており、腫瘍細胞を効率的に標的とすることができるようだ。同様に、抗がん剤を担持するペネトリンなどの細胞貫通ペプチドも、配列にd-アミノ酸を用いることで、生体安定性の面でメリットがあることが示されている[162]。また、細胞貫通ペプチドにd-アミノ酸を組み込むことで、半減期が延長され、がんを検出するための造影剤としての用途が向上する[163]。また、d-アミノ酸を配合することで薬剤の安定性を高めるという原理は、新しい抗生物質の開発など、他の分野でも応用されている[51]。
d-アミノ酸そのものの利用の次に、DAOは抗がん剤治療戦略にも応用されている。DAOによるH2O2の生成は、腫瘍細胞のDNA、タンパク質、脂質の酸化的損傷をもたらし、そのアポトーシスを促進する。酸化ストレスを引き起こす他の酵素に比べてDAOが優れている点は、内因性には存在しないd-アミノ酸を投与することでその活性を制御できることである。そのため、活性の高いDAOを発現するように設計された複数の腫瘍細胞株にd-Alaを投与すると、低酸素濃度下で顕著な細胞毒性を示すことが示されている[164]。さらに、DAOは、いわゆる酸化ストレス-エネルギー枯渇療法にも利用されており、DAOによる酸化ストレスと解糖系阻害剤を併用してATPレベルを低下させる。この方法では、試験管内試験で血管新生が阻害され、神経膠腫細胞の増殖が抑制された[165]。DAOを腫瘍にターゲティングするために、機能化した磁性ナノ粒子にDAOを結合させることが、Bavaらによって潜在的な戦略として提唱された[166]。このグループは、このナノ粒子がSKOV3卵巣腺癌細胞にエンドサイトーシスを介して取り込まれ、DAOの優先基質であるd-Alaの存在下で細胞毒性を誘導することを示した。興味深いことに、U87神経膠芽腫細胞では、両細胞株でd-Serの濃度が同程度であったにもかかわらず、粒子に対する感受性が低かった。これは、細胞の微小環境(pH、酸化還元力、代謝物の存在)の違いや、酸化ストレスに対する感受性の違いによるものと考えられた。
また、DAOは、骨がんの痛みの誘発にも関与しているとされている[167]。Huangらは、脊髄神経の結紮によってDAO活性が上昇し、神経障害性疼痛を引き起こすという知見に基づき、骨がんの動物においてsiRNAでDAOを阻害すると、痛覚が40〜50%低下することを示した[167]。これは、脊髄のH2O2レベルが低下し、アストロサイトの肥大が抑制されることと関係していることが示唆された。また、DAO活性を持たない変異ddY/DAO(-)マウスは、様々なストレステストで痛みを感じにくいことが示された[169]。これらを総合すると、DAOは慢性疼痛における前駆受容因子として働き、疼痛治療のターゲットになりうることが示唆される。重要なことは、これまでに、5-クロロ-ベンゾ[d]イソザゾール-3-オール、5-メチルピラゾール-3-カルボン酸、4H-チエノ[3,2-b]ピロール-5-カルボン酸、安息香酸ナトリウムなど、いくつかのDAO阻害剤が報告されており[170]、DAOを標的とした酸化ストレスの治療的調節が可能であることを示している。
以上のように、d-アミノ酸とDAOが、がんの発症、治療、発見に関与している可能性を示す証拠が蓄積されているが、ヒトでのデータはまだ少なく、この分野は発展途上にある。臨床サンプル中のd-アミノ酸を高感度かつ特異的に検出する改良された技術が開発されれば、この分野の進展が促進されるであろう[171]。
5. おわりに
d-アミノ酸は長い間、哺乳類の生物学には無関係と考えられていたが、蓄積されたデータによると、実際にはヒトの(病的な)生理学には不可欠な要素であることが示されている(図2)。また、d-アミノ酸濃度を調節する酵素の発現は広範囲にわたっており、その機能は現在考えられているよりも多様である可能性を示している。さらに、今日の欧米諸国では、加工食品の大量消費によりd-アミノ酸にさらされる機会が増えていることから、d-アミノ酸に依存するプロセスの調節が極端に難しくなっていると考えられる。これは、細胞増殖におけるd-アミノ酸の役割を示す最近の研究が示唆するように、がんの発生に重要な影響を与えるかもしれない。腸内細菌叢の構成を変化させる欧米の高脂肪・低繊維食は、腸内細菌が体内のd-アミノ酸プールに大きく寄与するため、この影響をさらに強める可能性がある。このように、d-アミノ酸とその代謝産物が細胞や組織の機能に及ぼす影響について、さらなる研究が望まれている。臨床サンプルのルーチン分析を可能にするd-アミノ酸検出法の改善は、この魅力的な研究分野における将来の研究を大いに促進するだろう。
図2 本総説で取り上げたd-アミノ酸の供給源と(d-アミノ酸オキシダーゼ(DAO)依存性の)生理や疾患との関連性を示す模式図
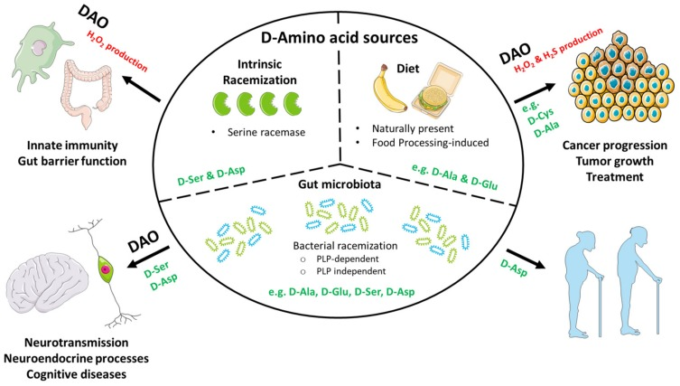
本レビューで取り上げたd-アミノ酸の供給源と(d-アミノ酸オキシダーゼ(DAO)依存性の)生理・疾患との関連性を模式的に示したもの。

