Contents
- 要旨
- 1. はじめに
- 2. 疫学
- 3. シェーグレン症候群の生理学
- 4. 臨床症状
- 5. 診断ワークアップ
- 6. 予後
- 6.1. 死
- 6.2. 疾患活動性
- 表4 原発性シェーグレン症候群患者の臨床モニタリングのための共通の損傷、負担、活動性スコア
- 6.3. ダメージの発生
- 6.4. 不快感と障害
- 7.1. シッカ症候群と非嚢胞性の発現
- 表5 ドライアイに関連する症状に対する現在の治療法
- 7.2. 全身性の症状
- 7.3. 原発性シェーグレン症候群関連リンパ腫
- 7.4. 産科的考察
- 7.5. 標的治療。革命か幻滅か?
- 図4 原発性シェーグレン症候群で研究されている(研究されている)標的薬の総覧
- 表 6 原発性シェーグレン症候群におけるB細胞標的薬パート1:B細胞特異的分化クラスター(CD)に対するモノクローナル抗体
- 表7 原発性シェーグレン症候群におけるB細胞標的薬パート2:BAFF/APRILシステム標的療法
- 表8 原発性シェーグレン症候群におけるB細胞標的薬パート3:他のB細胞の生存・機能経路を標的とした薬剤
- 表9 原発性シェーグレン症候群におけるT細胞標的薬:共刺激受容体またはリガンド阻害
- 表10 原発性シェーグレン症候群におけるT細胞標的薬:自己抗原提示を防ぐ治療法
- 表11 原発性シェーグレン症候群における抗サイトカイン標的薬の検討
- 表12 原発性シェーグレン症候群におけるその他の標的薬
- 8. 結論
- 略語
Current State of Knowledge on Primary Sjögren’s Syndrome, an Autoimmune Exocrinopathy
www.ncbi.nlm.nih.gov/pmc/articles/PMC7408693/
要旨
原発性シェーグレン症候群(pSS)は、唾液腺と涙腺のリンパ形成細胞の浸潤を特徴とする慢性の全身性自己免疫性リウマチ性疾患であり、それにより、特定の自己抗体プロファイルに関連したシェーグレン症候群および/または全身性の症状が臨床的な特徴となる。
女性は男性よりも原発性シェーグレン症候群を発症しやすく、男女比は9:1である。過去には自己免疫の無実の側副受動的な犠牲者と考えられていたが、現在では唾液腺の上皮細胞がこの病気の病因に積極的な役割を果たすことが知られている。
「自己免疫性上皮炎」の病因はまだ不明のままであるが、確かに遺伝的、環境的、ホルモン的要因が関与している。疾患が進行する過程で、後に続くB細胞の慢性的な活性化は、全身症状や非ホジキンリンパ腫の発症につながる可能性がある。
この包括的なレビューの目的は、原発性シェーグレン症候群に関する現在の知見を提供することである。本レビューでは、原発性シェーグレン症候群の臨床症状や合併症、診断検査、発症機序、治療アプローチなどを取り上げている。
キーワード
シェーグレン症候群、自己免疫疾患、生理、治療、診断、総説
1. はじめに
シェーグレン症候群(SS)は、外分泌腺(特に唾液腺および涙腺)のリンパ形成細胞の浸潤によって特徴づけられる慢性の全身性リウマチ性疾患であり、シックア症候群および全身症状の原因となっている。この調節障害およびリンパ球活性化の衰えのない恐ろしい合併症は、リンパ腫の発症である。シェーグレン症候群は、単独で発生する場合は「一次性」(原発性シェーグレン症候群)別の自己免疫疾患と関連している場合は「二次性」(sSS)となることがある [1]。
シェーグレン症候群の最初の医学的記述は、ドイツのテオドール・カール・グスタフ・フォン・レーバー(Theodor Karl Gustav von Leber, 1840-1917)が「角膜炎(keratitis filamentosa)」という名前で初めて眼球表面の乾燥した炎症を説明した1882年に遡る。その10年後には,ポーランドの外科医Jan Mikulicz-Radeckiが,唾液腺と涙腺の腫脹を呈した男性の症例を報告した。同時に,リウマチや痛風との関連性の有無にかかわらず,眼球と口腔の乾燥を呈した患者が数例報告されている。W. B. Hadden博士(1856-1893)は,これらの患者のうちの1人にピロカルピンというアルカロイドを使用して口腔乾燥症を改善したことを報告している[2].シェーグレン症候群の最初の医学的記述にこれらの医師が関与していたにもかかわらず、この疾患には2人の有名な名前しか残っていない。GougerotとSjögrenである。Henri Gougerot(1881-1955)はフランスの皮膚科医で、1925年に唾液腺(SG)の萎縮を伴う全身性粘液性乾燥症(目、口、鼻、気管、膣)を特徴とする3つの臨床例を報告した。彼は、口腔乾燥と眼乾燥が外分泌腺やその自律神経の機能不全に起因するより大きなsicca症候群の一部であることを最初に述べた。フランスでは、「Gougerot(-Sjögren)症候群」という用語は、しばしば原発性シェーグレン症候群を記述するために使用されている。ヘンリック・サミュエル・コンラッド・シェーグレン(Henrik Samuel Conrad Sjögren, 1899-1986)は、主に眼表面の乾燥に興味を持っていたスウェーデンの眼科医である。彼は、有名な眼科医の娘である妻のマリア・ヘルグレンとともに、ローズベンガル染色法とメチレンブルー染色法を用いて、ビタミン A 欠乏性口腔炎とは区別される角結膜炎(KCS)について説明した。1933年、彼は博士論文の中で、角結膜炎を持つ19人の女性の症例を説明し、そのうち13人は関節炎を患っていた。したがって、彼は、角結膜炎を眼科の分野を超えて全身疾患と結びつけた最初の人でした。残念ながら、彼の論文は成功しなかったため、彼は学術的なキャリアを停止したが、医学的、科学的なキャリアは停止しなかった。シェーグレンの研究が認められ、「シェーグレン症候群」という言葉が使われるようになったのは、1935年から 1943年にかけてのことでした。最後に、自己免疫性の起源が認められたのは1960年代初頭になってからである [2]。シェーグレンは1957年にヨーテボリ大学から「博士」の称号を授与され、1961年にはスウェーデン政府から「教授」の名誉称号を授与された。ヘンリック・シェーグレンは、脳卒中で倒れてから数年後の1986年9月17日に肺炎で亡くなった [3,4,5]。
2. 疫学
2.1. 有病率
原発性シェーグレン症候群は人口の0.1%から4.8%に影響を与え、研究したコホート、分類基準、および使用した方法にもよるが、男女比は9:1である[6,7]。原発性シェーグレン症候群は一般的な障害と考えられているが、いくつかの研究ではその有病率は過大評価されているようである。全体として、一般的には0.5~1%が一般的に認められている原発性シェーグレン症候群の有病率の推定値であると考えられている[7]。しかし、7件の研究の最近のメタアナリシスによると、有病率は0.043%、性比は10.72であった。ヨーロッパの原発性シェーグレン症候群有病率はアジアよりも高く,0.7122%,0.045%であった。性比は、調査した集団の地理的/民族的起源による差はない[8]。
2.2. 発生率
シェーグレン症候群の発生率にはいくつかの研究で明らかな不均一性がある。メタアナリシスでは、診断時の全平均年齢は56.2歳、男女間の発生率比は9.29と推定され、10万人年あたり6.92人の発生率が報告されている。アジアの6つの研究では、10万人年あたり6人と比較的高い発生率が報告されている。スロベニアとアメリカの研究では、いずれも10万人年あたり3.9人の発生率が報告されている。最後に、ギリシャの研究では、10万人年あたり5.3人で2つの間の発生率を推定している。アフリカ、オセアニア、南米における原発性シェーグレン症候群の発生率に関するデータは不足している[8]。
3. シェーグレン症候群の生理学
シェーグレン症候群は、特にTリンパ球およびBリンパ球によって媒介される異常な自己免疫反応を誘発することができる遺伝的因子と外因性および内因性の薬剤との相互作用に由来する多因子性のプロセスと考えられている[9]。炎症は組織損傷を維持し、永続させ、増幅させ、影響を受けた臓器の進行性機能障害と慢性的な炎症環境をもたらす。3つの再発イベントは一般的にシェーグレン症候群と関連している:(1)特定のエピジェネティック因子、遺伝的素因、ホルモン調節の下で環境因子によって誘発されるトリガー期;(2)正常な唾液腺上皮細胞(唾液腺上皮細胞)機能の調節障害;(3)リンパ球細胞からなるSG浸潤、リンパ球B多動、自己抗体産生によって特徴づけられる慢性炎症[10](図1)。
図1 シェーグレン症候群(SS)の基礎となる生理学的メカニズムの概要
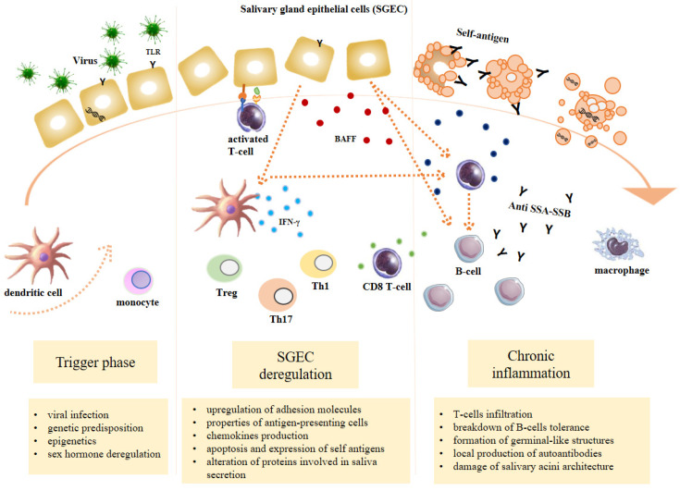
ウイルス感染、遺伝的素因、エピジェネティクス、性ホルモンの調節障害などの環境誘因は、唾液腺上皮細胞(SGEC)の障害、I型インターフェロン(IFN)の産生、腫瘍壊死因子(TNF)ファミリーのB細胞活性化因子(BAFF)[11]などの他のサイトカインの産生、および唾液分泌に関与するタンパク質の変化を引き起こす。樹状細胞および唾液腺上皮細胞は、ウイルスおよび自己抗原を処理できる抗原提示細胞の特性を獲得し、自己反応性T細胞およびB細胞の活性化につながる。自己反応性T細胞は、細胞障害性顆粒の放出により組織障害を誘発し、唾液腺上皮細胞の表面に自己抗原を曝露させる。さらに、活性化したB細胞は自己抗体を産生し、唾液腺上皮細胞のアポトーシスを誘導し、炎症性微小環境を作り出す。この複雑なメカニズムは、自己免疫の自己永続サイクルを誘発する。
3.1. 引き金となる段階
シェーグレン症候群の発症では、ウイルス感染などの環境因子と遺伝的素因、エピジェネティック因子、性ホルモンの調節が組み合わさってトリガー期が誘導される(図2)。
図2 シェーグレン症候群 トリガーフェーズに関わる要因
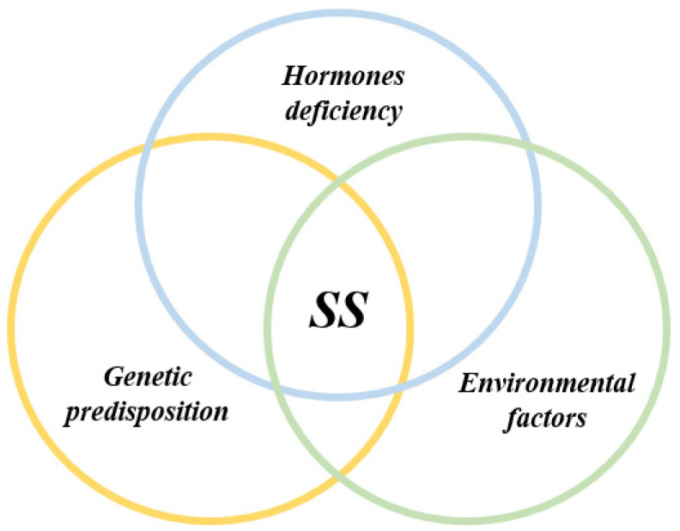
3.1.1. 環境要因
シェーグレン症候群の現在の生理的発症モデルによると、ウイルス感染を含む環境因子は唾液腺上皮細胞とToll Like Receptors(TLR)の活性化を導く [12,13]。シェーグレン症候群の誘導に関与する一次ウイルスには、エプスタインバー(EBV)ウイルス、ヒトTリンパ球症ウイルスI型(HTLVI)C型肝炎ウイルス(HCV)およびコックスサッキーウイルスが含まれる[13]。
EBVはヘルペスウイルス科に属する二本鎖DNAウイルスであり、B細胞に強いトロピズムを持つ。EBVは自己免疫過程や、関節リウマチ(RA)全身性エリテマトーデス(SLE)多発性硬化症(MS)などの疾患としばしば関連している[14,15]。さらに、シェーグレン症候群の唾液腺および涙腺生検では、対照群と比較して高いEBV負荷が認められており [16,17]、免疫系の活性化の引き金となる役割を示唆している。EBVは、B細胞受容体(BCR)とCD40シグナルを模倣するタンパク質の産生を刺激し、強力なB細胞の多動性を誘導することができる[18]。最近、過去のEBV感染とシェーグレン症候群における抗Ro/SSAおよび抗La/SSB自己抗体の存在との間に相関関係が確立された[19]。EBVによってコードされたRNAはTLR3に結合し、I型IFNとプロ炎症性サイトカインの分泌を誘導する[20]。もう一つのタンパク質である潜伏膜タンパク質1(LMP1)は、EBVによって誘導される細胞傷害性Tリンパ球応答の標的として作用し、シェーグレン症候群で観察されるアキニの萎縮とSG小葉構造破壊を引き起こす可能性がある[21]。
日本のような特定の地理的地域でパンデミックしているヒト固有のレトロウイルスであるHTLV-1が唾液腺上皮細胞に存在することが報告されている[22]。さらに、疫学的研究では、シェーグレン症候群の23%で抗HTLV-1抗体陽性であったのに対し、対照群では3%であったことが明らかにされている[23]。
コクサッキーウイルスは、ピコルナビル科に属する一本鎖RNAウイルスである。ある研究では、シェーグレン症候群においてRo60エピトープに対する抗体と2Bコクサッキー蛋白質との間に87%の配列相同性を有する交差反応性が確認されている[24]。しかし、これらのデータは依然として論争の的となっている[25]。
フラビウイルス科に属する一本鎖RNA小ウイルスであるHCVの、シェーグレン症候群の初期誘発期における役割が検討されている。臨床研究では、HCV感染症の患者は、シッカ症状、眼球検査陽性、SGリンパ球浸潤、自己抗体を呈することが示されている[26]。したがって、HCV関連SS(HCVがSS 2002分類基準を満たす患者)は、原発性シェーグレン症候群と区別がつかない。このことから、HCV感染は一部の患者ではシェーグレン症候群発症に関与する可能性があるため、HCV慢性感染は原発性シェーグレン症候群の除外基準として考慮されるべきである。
シェーグレン症候群にウイルス感染が関与している可能性があるにもかかわらず、最も一般的な抗ウイルス薬はシェーグレン症候群の治療に実質的な有益性を示していないようである [26]。実際、ウイルス感染が疾患の発症の引き金となる可能性が高いため、その後の抗ウイルス治療は、持続的な感染を管理することはできても、最初のウイルス感染の存在にもはや依存しないかもしれない進行中の疾患には効果がない。
3.1.2. 遺伝的素因
シェーグレン症候群に対する遺伝的素因は,疾患の引き金となる段階で役割を果たしている.主要組織適合性遺伝子(MHC)クラスII遺伝子群に属するヒト白血球抗原(HLA)-DRおよびHLA-DQ対立遺伝子とシェーグレン症候群との間には、白人、日本人および中国人を含むさまざまな集団において強い関連が観察された[27]。発見されたハプロタイプはすべて強い連鎖不平衡状態にあるため、どのハプロタイプにリスクをもたらす遺伝子が含まれているかを確定することが困難である。HLA-DQ1/HLA-DQ2対立遺伝子を持つシェーグレン症候群は、HLA-DQにおける他の対立遺伝子の組み合わせを持つ患者よりも重度の自己免疫疾患を示す[28]。HLA系に加えて、最近の研究では、FasやFasリガンド(FasL)などのアポトーシスに生理的に関与する分子をコードする多型遺伝子に注目している。MRL/lpr-murineモデルを用いて、Fas遺伝子に挿入されたレトロトランスポゾンが細胞のアポトーシスと進行性唾液腺炎の誘導に役割を果たしていることが明らかになった[29,30]。Fas/FasL遺伝子多型もシェーグレン症候群で発見されているが[31]、疾患決定因子として明確に同定されていない。52-kd Ro自己抗原をコードするRo52遺伝子は、エクソン4の上流13bpに位置する一塩基多型(SNP)を示し、シェーグレン症候群における抗Ro 52kD自己抗体の存在と有意に関連していることが確認された[32]。IL-10 [33]、TNF-α [34]、IL-4受容体のα鎖 [35]、IRF5,STAT4 [36]、およびCXCL13 [37]を含む多数の追加遺伝子もまた、シェーグレン症候群と関連している可能性のある遺伝子多型を示している。異なる民族性のいくつかのSSコホートで実施された最近の研究では、シェーグレン症候群のリンパ腫発症リスクに関連していると考えられる追加の候補遺伝子が明らかになっている。腫瘍壊死因子アルファ誘導タンパク質3(TNFAIP3)遺伝子の多型の存在は、シェーグレン症候群の白人コホートにおける非ホジキンリンパ腫発症リスクと関連している [38,39,40]。さらに、メチレンテトラホリン酸還元酵素(MTHFR)遺伝子の2つの多型がシェーグレン症候群におけるリンパ腫の危険因子と考えられている[41]。遺伝子多型はシェーグレン症候群の引き金となる段階では議論の余地のない役割を果たしているが、各遺伝因子の個々の寄与度はまだ評価されていない[42]。
3.1.3. エピジェネティック因子
いくつかの研究では、シェーグレン症候群および自己抗体産生に対するエピジェネティクスの寄与を分析している[43]。疾患とより密接に関連しているエピジェネティックなプロセスは、DNAメチル化、miRNA、円形mRNA、ロングノンコーディングRNAの機能である。
DNAメチル化とは、DNAメチル転移酵素(DNMT)によって触媒されるCpGジヌクレオチドの文脈で、メチル供与体であるS-アデノシルメチオニン(SAM)からのメチル基のシトシン残基への付加からなる機構である。一般に、DNAへのメチル基の付加は、クロマチンの構造変化による遺伝子サイレンシングと関連している。DNAメチル化は、ナイーブステディからエフェクターB細胞やT細胞への移行など、様々なタイプの細胞が遺伝子発現を変化させる最も重要なメカニズムの一つである。エピゲノムワイドな解析により、いくつかの遺伝子とエピジェネティックな修飾がシェーグレン症候群に関連していると考えられることが同定されている[44]。最も頻繁に観察される改変は、シェーグレン症候群のゲノムのいくつかの部位の脱メチル化である。シェーグレン症候群では、対照群と比較して陰唇唾液腺のDNAメチル化が有意に減少している。この欠損は、唾液腺上皮細胞を主に培養した場合に保存されていた。明らかに、シェーグレン症候群由来の唾液腺上皮細胞は、DNMT1の7倍の減少と、脱メチル化パートナーGadd45-αの発現の2倍の増加と関連していた。この脱メチル化プロセスはまた、B細胞による唾液腺の浸潤および病理学的重症度と一部関連していた[45]。また、異なる研究では、脱メチル化剤とシェーグレン症候群との関連も報告されている。実際、ヒドラジンまたはイソニアジド(脱メチル化剤)の経口投与を数週間受けたマウスは、免疫学的特徴および自己抗体産生の点でシェーグレン症候群に類似した病理を発症する。本剤の投与中止後はシェーグレン症候群病理の徴候は消失した[46]。シェーグレン症候群のCD19+B細胞およびマイナー唾液腺を用いて行われた最近の研究では、シェーグレン症候群疾患で通常観察されるIFN応答活性化の増加を誘導するインターフェロン(IFN)制御遺伝子上のハイメチル化部位も同定されている[47]。さらに、CD4 + T細胞におけるプロアポトーシス死関連プロテインキナーゼ(DAP-キナーゼ)遺伝子[48]およびラント関連転写因子(RUNX1)遺伝子[49]のDNA脱メチル化は、シェーグレン症候群における非ホジキンB細胞リンパ腫素因と関連している。結論として、ゲノムメチル化解析は、シェーグレン症候群に関連する様々な細胞型におけるエピジェネティックな修飾間の関連を同定するための有用なツールである。
miRNAは、転写および転写後の遺伝子発現を制御する内因性の小さなノンコーディングRNAである。興味深いことに、miR-17-92クラスターはダウンレギュレーションされており [50]、シェーグレン症候群の唾液腺ではリンパ増殖性疾患や自己免疫[51,52]と関連している。別の研究では、炎症反応を制御する miR-146a のレベルが上昇し、IRAK1 の抑制と TRAF6 発現の増加を誘導し、シェーグレン症候群 患者の末梢単核細胞における NF-κB 発現を促進することが示されている [53]。microRNA 発現異常は様々な自己免疫疾患でしばしば観察されており、そのため、診断や予後のバイオマーカーとして利用される可能性がある。さらに、成熟したmiRNAはサイズが小さいため、長期間保存されたパラフィン埋め込みサンプルを用いた疾患フォローアップに有用であると考えられている[54,55]。
環状RNA(circRNA)は、下流の5′ドナーが上流の3′アクセプターを3′→5′ホスホジエステル結合で連結する「バックスプライシング」と呼ばれるプレmRNAの代替スプライシングプロセスの後に生成されたRNAの一種である。最近の研究では、circRNAがRA、MS、SLE、SSなどの自己免疫疾患の発症に関与している可能性が指摘されている[57]。マイクロアレイ解析により、シェーグレン症候群と健常者の間で234個のcircRNAが発現しており、シェーグレン症候群では2個が有意に上昇し、3個が低下していることが明らかになった。また、機能解析により、これらのcircRNAは関節炎や自己抗体の存在と関連していることが示されている[58]。これらのデータをすべて考慮に入れると、circRNAはシェーグレン症候群疾患の診断ツールとして有用なバイオマーカーとして使用できると結論づけることができるが、どのcircRNAが最も病理学的に特異的であるかを評価するための補足的な調査が必要である。
ロングノンコーディングRNA(lncRNA)は、200ヌクレオチド以上の長さを持つ機能的な非翻訳RNAの新しいクラスである。いくつかの研究により、lncRNAと免疫応答との間に強い関連性があることが明らかにされている[59]。シェーグレン症候群におけるlncRNAの発現解析では、この疾患と潜在的に関連するlncRNAとしてLINC00657,LINC00511,およびCTD-2020K17.1が示されている。これら3つのlncRNAは、IL15,WDR5,GNAI2,LTßR、CBX8,BAK1,BAX extを含む、B細胞生理学および悪性腫瘍に関与する異なる遺伝子を標的とする[60]。IL15およびWDR5はB細胞の増殖および分化において重要な役割を果たし、GNAI2はリンパ節へのB細胞のトラフィッキングを調節している[61]、LTßRおよびCBX8は炎症組織におけるGC形成に関与している[62,63]、BAK1およびBAXはB細胞リンパ腫において過剰発現している[64]。これらの結果は、複数のプロセスにおけるlncRNAの重要な役割を示しており、それらの調節と機能を理解することで、シェーグレン症候群の病態についてのより深い洞察が得られ、新規な治療戦略の同定が容易になる可能性がある。
3.1.4. 性ホルモンの調節障害とX染色体関連因子
シェーグレン症候群の10人中9人は女性であり、一般的に閉経期である [65]。シェーグレン症候群を発症する女性の強い素因は、この疾患の危険因子としての性ホルモンの役割を明確に示している。最近の症例対照研究では、女性の原発性シェーグレン症候群はsicca対照と比較して、エストロゲン曝露量の低下および月経周期の累積時間の低下と関連していた。逆に、エストロゲンへの曝露量の増加は原発性シェーグレン症候群の発症と否定的に関連していた [66]。最後に、Klinefelter症候群の男性は、性ホルモンレベルが正常であるにもかかわらず、原発性シェーグレン症候群を発症するリスクが健康な男性の20倍と高いことから、X染色体自体の影響も示唆されている[67,68]。同様に、トリソミーXを有する16歳の日本人患者において、原発性シェーグレン症候群と混合性結合組織疾患との関連が報告されている[69]。
アンドロゲンは、雌のシェーグレン症候群マウスモデル(MRL/MpJ-Tnfrsf6lpr[MRL/lpr])において、炎症を抑制し、涙腺の機能を強化する[70]。アンドロゲンは健康な唾液腺ではアシニの構造を維持するのに役立つ可能性があるが、シェーグレン症候群で観察されたアンドロゲンの減少はインテグリン発現の低下を引き起こし、おそらくアシニの構造の調節障害を引き起こす可能性がある[71]。シェーグレン症候群では、血流と唾液腺の両方でアンドロゲンホルモンのレベルが低い [72]。クラインフェルター症候群に関連するシェーグレン症候群およびSLEでは、テストステロン療法による60日間の性腺機能低下の修正が、1件の症例報告で寛解につながっている[73]。
健康な卵巣摘出C57BL/6マウスは、SG巣状腺炎、涙腺病変、Ro/SSA、La/SSB、α-fodrin自己抗体を含むシェーグレン症候群に類似した自己免疫学的特徴を持つ外分泌症を示す[74]。卵巣摘出マウスと同様に、エストロゲンの生合成に重要な酵素であるアロマターゼを欠損させたマウス、およびアロマターゼ阻害剤を投与されたマウスは、シェーグレン症候群に類似したリンパ増殖性自己免疫疾患を発症する [75,76]。エストロゲン欠乏がどのように自己免疫病変を促進するのかは不明のままである。しかしながら、1つの仮説的な説明としては、エストロゲン欠乏が唾液腺上皮細胞を刺激してIFN-αおよびIL-8を分泌し、MHCクラスIIを発現させ、抗原提示細胞として活動できるようにすることが考えられる。エストロゲン欠乏は、外分泌腺においてp53を介したアポトーシスを誘導するRbAp48の過剰発現に関与している[77]。別の研究では、RbAp48を過剰発現させたトランスジェニックマウスは、アポトーシスへの傾向の増加と、IFN-γおよびIL-18を産生し、上皮細胞による積極的な免疫不全の役割を獲得することを特徴とするSS様外分泌症を発症した[78]。ヒトSG細胞の初代培養において、7β-エストラジオールによる前処理は、コントロール群ではIFNγ誘導性ICAM-1のアップレギュレーションを阻害したが、原発性シェーグレン症候群群では阻害しなかった。これらのデータは、上皮活性化に対するエストロゲンの保護的役割と原発性シェーグレン症候群におけるエストロゲン応答性の欠如の存在を示唆している[79]。驚くべきことではないが、乳癌の治療におけるアロマターゼ阻害剤の使用は、関節痛、あるいは本物のシェーグレン症候群とさえ関連している[80,81,82]。
人間と他の霊長類は、そのようなデヒドロエピアンドロステロン(DHEA)とDHEA硫酸前駆体、アンドロゲンとエストロゲンの生合成の代謝中間体などの性ステロイド前駆体を大量に分泌する。組織のニーズに応じて、プロホルモンは組織内で直接処理される。DHEAは、年齢を一致させた健常対照と比較して、シェーグレン症候群では低濃度で存在する[83]。いくつかの研究では、ヒトMSGが、その活性代謝物であるジヒドロテストステロン(DHT)および17β-オエストラジオール[84]にDHEA(-硫酸塩)プロホルモンを変換することができる組織化された頭蓋内メカニズムを持っていることが示されている(図3)。しかし、シェーグレン症候群からのMSGにおけるこの酵素機構の非機能性は、シェーグレン症候群におけるDHTとアンドロゲン制御バイオマーカーであるシステイン-リッチ分泌タンパク質3(CRISP-3)の局所濃度の低下を説明することができる[85]。
図3 健康なアキナ細胞における頭蓋内ステロイド発生機序
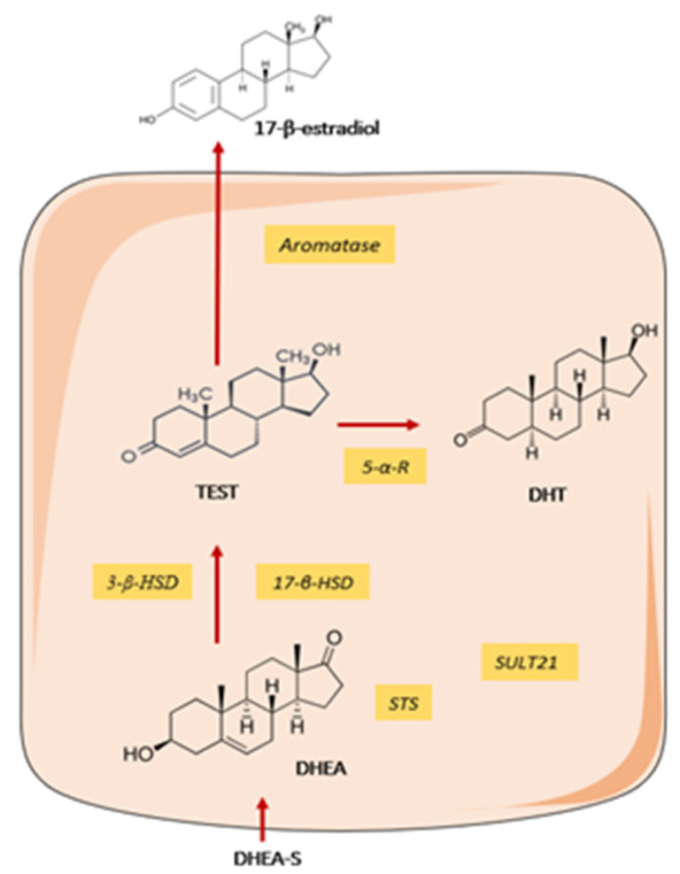
デヒドロエピアンドロステロン(DHEA)の活性性ステロイドへの変換を示す図。STS:ステロイドスルファターゼ、SULT2B1:スルホトランスフェラーゼ2B1,HSD:ヒドロキシステロイドデヒドロゲナーゼ、5-α-R:5αリダクターゼ、TEST:テストステロン、DHT:ジヒドロテストステロン。DHEA-S:DHEA-硫酸塩。
これらのデータをまとめると、卵巣で産生されるテストステロンのレベルがすでに低下している閉経時にシェーグレン症候群の影響を受けた女性は、唾液腺中のDHTの唯一の供給源がDHEAの局所変換に依存しているため、アンドロゲン欠乏症に特に脆弱である可能性があることが示唆される。一方、男性では、生殖腺によって生成される全身性アンドロゲンのレベルは、中間代謝物を必要としない、唾液腺の特定のニーズを満たす可能性がある。
3.2. 唾液腺上皮細胞の規制緩和
3.2.1. 接着分子のアップレギュレーション
最近の観察によると、いくつかのシェーグレン症候群の病原性モデルが腺損傷における唾液腺上皮細胞の役割を説明する可能性がある。現在のシェーグレン症候群の病原モデルは「自己免疫性上皮炎」である。このモデルでは、唾液腺上皮細胞は疾患の初期誘発段階で重要な役割を果たすと考えられている[86]。シェーグレン症候群の唾液腺上皮細胞は、対照の唾液腺上皮細胞と比較して、TLR-1,TLR-2,TLR-3,およびTLR-4を含むTLRs mRNAレベルが有意に高いレベルで発現している[87]。生理的条件下では、TLRは、微生物由来の病原体関連分子パターン(PAMP)および危険関連分子パターン(DAMP)として知られる炎症の内因性メディエーターの認識によって活性化される[88]。TLRシグナル伝達経路は、自己免疫疾患における自然免疫と適応免疫の間のリンクとして機能する。実際、活性化されると、TLRはアダプタータンパク質をリクルートし、炎症、免疫調節、細胞の生存と増殖に関与する遺伝子の転写、およびそれに続く免疫系の活性化をもたらす細胞内シグナルを伝播させる。唾液腺上皮細胞におけるTLRシグナル伝達は、MHCクラスIおよびクラスII、B7.1(CD80)およびB7.2(CD86)のような費用調節分子、および接着分子1(ICAM-1)などのいくつかの分子をアップレギュレートする [89]。
3.2.2. 抗原提示細胞の性質
唾液腺上皮細胞s上でのMHCクラスI、MHCクラスII、コスチマイモ、接着分子の発現は、唾液腺上皮細胞sがT細胞に抗原を提示する力を与える(非専門的な抗原提示細胞として機能する)。
3.2.3. ケモカインの産生
インターフェロン調節因子(IRF)および活性化B細胞の核内因子κ-光鎖-エンハンサー(NF-κB)経路の活性化は、I型IFN、腫瘍壊死因子-α(TNF-α)インターロイキン(IL)-1,IL-6およびBAFFを含む炎症性サイトカインの産生を増加させる[90]。
3.2.4. アポトーシスおよび自己抗原の発現
ケモカインの産生に加えて、通常は免疫系から隠されているリボ核タンパク質が細胞表面に露出する。特に、アポトーシス唾液腺上皮細胞上での抗原Ro/SSAおよびLa/SSBタンパク質の発現は、自己免疫の開始を促進する。
3.2.5. 唾液分泌に関与するタンパク質の変化
唾液分泌に関与する蛋白質の発現や分布が変化していることや,アキナー上皮細胞のアポトーシスなどが,シェーグレン症候群唾液腺の分泌機能障害の原因と考えられている.例えば、シェーグレン症候群由来唾液腺のアキナール細胞の先端膜ではAQP3の発現増加が観察されたが[91]、筋上皮細胞ではAQP1[92]とAQP4[93]の発現が低下していた。B細胞を枯渇させるためにシェーグレン症候群に用いられるリツキシマブ治療は、筋上皮細胞におけるAQP1タンパク質の発現を増加させ、唾液の流れを改善させた[94]。これらのデータは、唾液分泌におけるAQP1の重要な役割を示唆している可能性がある。しかし、AQP1ヌルマウスモデルでは、このタンパク質は唾液分泌に必須ではないことが示されている[95]。それにもかかわらず、1つは、他のAQPが代替的に使用される可能性があるそれによって、そのようなマウスモデルで代償効果を排除することはできない。対照的に、AQP5は、今日、唾液分泌に関与する最も重要なタンパク質と考えられている[96]。生理的条件下では、AQP5は、ムスカリンおよびアドレナリン受容体の活性化後、細胞内小胞コンパートメントから唾液腺尖頭膜に転座する[97]。シェーグレン症候群およびシェーグレン症候群マウスモデルでは、AQP5の異常な局在化が観察されており[98]、その局在化は先端側ではなく基底側に優勢である[99,100,101]。AQP5の局在が変化する理由はまだ不明であるが、いくつかの仮説が提案されている。
M3受容体に対する自己抗体の存在は、M3受容体の活性化を阻害し、AQP5に通常送られる転座シグナルをブロックする可能性がある[102]。もう一つ考えられるメカニズムは、AQP5とそのパートナータンパク質間のタンパク質-タンパク質相互作用の変化である可能性がある[103]。プロラクチン誘導性タンパク質(PIP)は、マウスモデルの涙腺におけるAQP5タンパク質のパートナーとして知られている。PIPのAQP5のc末端ドメインへの異常結合は、AQP5の上皮細胞の先端膜へのトラフィッキングを損なう[104]。最後に、シェーグレン症候群疾患を特徴づける炎症性環境もまた、直接的または間接的にこれらの修飾に関与している可能性がある[105,106]。例えば、IFN-γは、唾液腺のアポトーシスおよびいくつかの化学吸引性サイトカインの発現を誘導し、上皮細胞の抗原提示機能を増強するシェーグレン症候群の病因に寄与している[107,108,109]。IFN-γの投与は抗M3R抗体の産生増加をもたらし、適切な刺激に応答して唾液腺の分泌機能に影響を与える[110]。抗プログラム死リガンド1(PDL1)処理した非肥満糖尿病(NOD)/ShiLtJマウスにおけるIFN-γの中和は、AQP5発現と唾液分泌を改善する[111]。TNF-αは、シェーグレン症候群で増加する別のプロ炎症性サイトカインである[112]。血清および唾液腺の両方でTNF-αレベルの上昇が、対照と比較してシェーグレン症候群で観察されている[113]。ヒト唾液腺アシナー細胞では、TNF-α処置はAQP5の発現をダウンレギュレートする[114]。NODマウスにおけるTNF-αに対する抗体の注入は、唾液腺炎症性病巣を減少させ、AQP5タンパク質の発現を増加させる[115]。AQP5の正しい発現、トラフィッキング、局在化が唾液分泌障害の克服に不可欠であり、炎症、抗体産生、蛋白質相互作用、唾液上皮細胞の制御緩和の組み合わせがシェーグレン症候群の唾液腺の機能低下に関与していることは明らかであると思われる。
3.3. 慢性炎症
3.3.1. T細胞の浸潤
シェーグレン症候群の初期段階では、シェーグレン症候群の唾液中に存在するリンパ球浸潤は、大部分がCD4 T細胞であるTリンパ球の大多数(75%以上)によって構成されている [116]。しかしながら、シェーグレン症候群からの唾液は、IL-1β、IL-6,腫瘍壊死因子(TNF)-α、およびIFN-γを含む、コントロールからの唾液よりも大きなTh1サイトカインを含む[109,117]。IL-10およびIL-4などのTh2由来のサイトカインもまた、コントロールよりもシェーグレン症候群からの唾液腺組織より多くの量が認められた[119]。2つのT細胞応答はダイナミックなバランスを保っており、シェーグレン症候群ではTh1活性が優勢である [120]。シェーグレン症候群では、活性化されたT細胞は、アポトーシス細胞の出血に発現したRoおよびLa自己抗原の認識などの激しい抗原性刺激に反応し[121]、増殖反応を誘導する[122]。したがって、自己抗原のT細胞の認識およびそれに続く活性化は、シェーグレン症候群病理学の発症につながるイベントのカスケードにとって極めて重要である。T細胞は、唾液腺で局所的に増殖するか、または循環から腺へとケモカインによって再誘導されることがある。シェーグレン症候群唾液腺におけるT細胞の引き寄せに関与する2つのケモカインは、CXCL9とCXCL10である [123]。シェーグレン症候群唾液腺では、T細胞は、ペルフォリンの放出および/またはサイトカインの分泌を含む直接的な細胞毒性活性、およびB細胞の活性化によって、FasL経路によって媒介されるアポトーシスメカニズム[124]を通じて、腺構造の破壊に関与している可能性が高い[125]。Th17細胞は、シェーグレン症候群において強く活性化されるT細胞の別のサブ集団である[126]。一般に、Th17は健康な人の粘膜防御において重要な生理的役割を果たしている。シェーグレン症候群では、活性化されたTh17細胞はIL-6,IL-17,IL-21,IL-22およびIL-23を分泌することで炎症を促進する [127,128,129]。毛包ヘルパーT細胞は、シェーグレン症候群唾液腺におけるリンパ性卵胞形成および異所性胚中心形成において重要な役割を果たすことが示されている[130]。病理の間、唾液腺上皮細胞はIL-6の放出とICOSリガンドの発現により、Tヘルパーの活性化とT濾胞ヘルパーへの分化を誘導する。活性化された濾胞細胞は、B細胞の成熟と増殖を媒介するIL-21サイトカインを分泌する [131]。結論として、T細胞サブタイプの複合的な活性化は、有害なB細胞の活性化と耐性の破壊のための最適な環境を作り出す。
3.3.2. B細胞の耐性の破壊
生理的条件の下では、B細胞は造血幹細胞から骨髄に由来し、その発生中に自己反応性および多反応性B細胞の大部分が通常生成されるため、いくつかの段階の選択を受ける[132]。最初のチェックポイントは骨髄の多反応性B細胞を除去し(中央の寛容性チェックポイント)周辺部の第二のチェックポイントは少量の自己反応性、多反応性の成熟ナイーブB細胞だけが生き残ることを保証する。最後に、前胚中心チェックポイントと呼ばれる3番目の耐性チェックポイントは、自己反応性ナイーブB細胞がB細胞小胞に入るのを排除する。
最近の研究では、シェーグレン症候群における初期および後期のB細胞寛容チェックポイントの両方に欠乏が存在することが明らかになった。実際、シェーグレン症候群における循環中の自己反応性ナイーブB細胞の蓄積は、初期の末梢性耐性チェックポイントにおける自己反応性B細胞のクリアランスの障害を示唆しており、自己反応性の非スイッチ化およびスイッチ化されたメモリーB細胞の頻度の増加は、胚中心前および/または胚中心後の耐性チェックポイントにおいても障害がある可能性があることを明らかにしている[134]。これらの観察はSLE、RA、1型糖尿病患者でも行われている[135,136]。Id3ノックアウトマウスモデルにおける抗CD20抗体を用いたB細胞枯渇は、唾液分泌機能の回復に関連した組織学的な有意な改善をもたらし、B細胞がシェーグレン症候群疾患において重要な役割を果たす可能性があるという仮説を裏付ける[137]。
B細胞の多動はシェーグレン症候群の重要な特徴である。2つのサイトカインがB細胞の生存と増殖に基本的な役割を果たすことが示されている。TNFファミリーのB細胞活性化因子(BAFF)およびAPRIL(A増殖リガンド)である[138]。唾液腺組織浸潤が確立されると、樹状細胞、単球、マクロファージだけでなく、唾液腺上皮細胞およびTリンパ球などの多数の細胞がBAFFを分泌することができる。BAFFの過剰発現は、他の全身性自己免疫疾患と同様にシェーグレン症候群においても実際に報告されており、自己抗体と相関している[139]。
3.3.3. 胚様構造の形成
胚中心(GC)は、1884年にWalther Flemmingによって初めて記述された [140]。GCは、リンパ節や脾臓などの二次リンパ組織に存在する特異的な領域である。GCは、成熟B細胞の増殖、分化、体細胞超変異と呼ばれるプロセス中の免疫グロブリン可変領域遺伝子セグメントの変異のための環境を提供し、クローンの多様性を生成する。このプロセスの後、細胞は、ダークゾーンからリンパ組織の明るいゾーンに移動し、そこで、抗原を提示する濾胞樹状細胞(FDC)および濾胞ヘルパーT細胞(TFH)細胞上で免疫グロブリンの親和性がテストされる。非選択された細胞はアポトーシスを受け、選択された細胞はT細胞に刺激されてクラススイッチ組換えを受け、抗体産生プラズマ細胞またはメモリーB細胞へと分化する [141,142]。シェーグレン症候群からの唾液腺は、T細胞、B細胞、血漿細胞、マクロファージ、濾胞性樹状細胞からなる類似のGC構造を含むことができる[143]。唾液腺のGCとリンパ系臓器のGCとの強い類似性を考慮すると、シェーグレン症候群で観察された唾液腺のGCは異所性のGC様構造であり、「第三次リンパ系臓器」としても知られていると定義された[144]。いくつかの研究で、GCとシェーグレン症候群の免疫病理学的特徴との関連が報告されている[145]。他の重要な研究では、GCの存在が高いシェーグレン症候群で非ホジキンリンパ腫を発症するリスクが6.5~15.6倍に増加することが観察されている[146,147]。
3.3.4. 自己抗体の局所産生
シェーグレン症候群における最も一般的で研究されている抗体は、自己抗原であるRo/SSAおよびLa/SSBに対する抗体である[148]。抗Ro、抗La、抗SSAおよび抗SSBは、もともとシェーグレン症候群の唾液腺および涙腺組織によって発現された抗原に向けられた4つの抗体として記述されていた。その後、抗Roおよび抗Laは、それぞれ抗SSAおよび抗SSBと同じ抗体であることが示された[149,150]。
Ro抗原は、52および60 kDaの2つの異なるRoタンパク質で構成されており、後者はhY RNAとして知られる小さな細胞質RNAに結合している。TRIM21としても知られるRo52タンパク質は、シェーグレン症候群抗体によって頻繁に標的化されており、それが有用な診断マーカーとなっているが、その機能と、なぜ多くのリウマチ性疾患の標的タンパク質となるのかは完全には理解されていない。Ro52はTRIM(tripartite motif)タンパク質ファミリーの一員であり、タンパク質のユビキチン化に重要な役割を果たしている。Ro52の活性の基質として、IFN-regulatory factor (IRF)転写因子ファミリーの様々なメンバーを含むいくつかのターゲットが示唆されている。最も推測されている仮説は、Ro52がIFNネガティブレギュレーターの役割を果たしているというものである。実際、Ro52ヌルマウスでは、Ro52によって媒介されるユビキチン化の欠如は、IL-6,IL-12,IL-23,およびTNF-αなどのI型IFNおよび炎症性サイトカインの異常発現をもたらす[151]。La/SSB抗原は、核および細胞質に位置する48 kDaのリン酸化タンパク質である。La/SSBは、RNAポリメラーゼIIIによって新たに合成された多くのRNA分子に結合する[152]。これら2つの抗体は、原発性シェーグレン症候群の50%~70%に検出されるが、抗La/SSB単独では2%の患者にしか認められない[153,154]。
ほとんどの場合、抗Ro/SSAおよび抗La/SSBは、耳下腺肥大およびMSGにおける多数のリンパ球浸潤を伴う外分泌腺の重度の機能障害と相関している[155,156]。
シェーグレン症候群で病原性があると考えられている他の抗体は、抗セントロメア抗体(ACA)抗シトルリン化タンパク質抗体(ACPA)抗カルボニル無水酵素II抗体、抗アクアポリン-5,抗ムスカリン受容体3(抗M3R)および抗フォドリン抗体である。ACAは、セントロメア(キネトコアタンパク質の複合体)に関連する6つの抗原に対して指示される。ACA抗体の発生率は3.7%から4%の範囲である[157,158]。ACPAは、フィブリンおよびフィブリノーゲン、ビメンチンおよびα-エノラーゼ(CEP-1)に対して指示される。一般に、ACPA抗体は関節リウマチで最もよく観察されるマーカーであるが、通常、原発性シェーグレン症候群においても低濃度で存在し、症例の約3~22%である[159]。抗カルボニックアンヒドラーゼII抗体はシェーグレン症候群の12.5~20.8%に検出されており、腎尿細管アシドーシス(RTA)においても病原性の役割を果たしている[160,161]。実際、ヒト炭酸アンヒダーゼIIでマウスを免疫したところ、自己免疫性シアルアデンド炎、抗炭酸アンヒダーゼII抗体の産生、および尿酸性化欠損が認められた[162,163]。抗AQP5抗体はシェーグレン症候群の血清学的および病理組織学的特徴と関連していることが観察された[164]。抗M3R抗体はシェーグレン症候群の最大90%の血清中に存在する[165]。α-フォドリンに対する抗体は、原発性または続発性のシェーグレン症候群の血清サンプル中に検出され、特にsicca症状を有する患者において検出される。しかしながら、抗α-ホドリン抗体はシェーグレン症候群の感度の高いものでも特異的な血清学的マーカーでもない [166]。慢性疼痛を有する原発性シェーグレン症候群患者および非原発性シェーグレン症候群患者において、唾液タンパク質1(SP-1)耳下腺分泌タンパク質(PSP)および炭酸脱水酵素6に対する自己抗体が報告されており、これは将来、初期の原発性シェーグレン症候群および原発性シェーグレン症候群に関連した広汎性疼痛症候群の理解と診断に役立つかもしれない[167]。抗コフィリン-1抗体、抗α-エノラーゼ抗体、抗RGI2抗体は原発性シェーグレン症候群 MALTリンパ腫と関連している[168]。他の自己抗体もまた、原発性シェーグレン症候群患者においてより頻繁に発見され、疾患の臨床的および生物学的特徴と様々に関連していると記載されている[168]。表1は、原発性シェーグレン症候群患者で検出された新規自己抗体をまとめたものである。
表1 原発性シェーグレン症候群における新規自己抗体について記述された原著論文の概要を迅速に掲載している
| 自己抗体の標的となる自己抗原 | 患者数(N合計/プール) | 自己抗体の有病率(全体の%) | 臨床協会 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 原発性シェーグレン症候群 | 原発性シェーグレン症候群モルト | ドライアイ | FMシッカ | Crtl | 原発性シェーグレン症候群 | 原発性シェーグレン症候群モルト | ドライアイ | FMシッカ | Crtl | ||
| 唾液タンパク質1(SP1) | 270 | _ | 29 | 151 | 148 | 46.3 | _ | 75.9 | 45.7 | 27 | 早期疾患、低焦点スコア、SSA- / SSB- [ 169、170、171、172、173 ] |
| 炭酸脱水酵素6(CA6) | 13 | _ | _ | 151 | 23 | 53.8 | _ | _ | 7.3 | 4.3 | |
| 耳下腺分泌タンパク質(PSP) | 13 | _ | _ | 151 | 23 | 15.4 | _ | _ | 11.3 | 4.3 | |
| インターフェロン誘導性タンパク質-16 | 250 | _ | _ | _ | 255 | 37.2 | _ | _ | _ | 2.7 | 高フォーカススコアおよびGC、hyperγ、ANA> 1:320 [ 176 ] |
| マウス二重微小染色体2(MDM2) | 100 | _ | _ | _ | 74 | 21 | _ | _ | _ | 5.4 | ⇧疾患期間、ESSDAI、⇧フォーカススコア、貧血、血小板減少症、SSB + [ 177 ] |
| 核自己抗原14kDa(NA-14) | 204 | _ | _ | _ | 144 | 12.7 | _ | _ | _ | 0 | ⇧のIgAレベル、ANA <1:320、ANA-、短い疾患期間[ 178、179 ] |
| スタスミン-4 | 72 | _ | _ | _ | 128 | 15 | _ | _ | _ | 5 | 多発性神経障害、血管炎[ 180 ] |
| ポリ(U)結合スプライシングファクター60 kDa | 84 | _ | _ | _ | 38 | 30 | _ | _ | _ | 5.3 | アジア系またはアフリカ系、ANA +、RF +、hyperγ、SSA +、SSB + [ 181 ] |
| NR2 | 66 | _ | _ | _ | 99 | 20 | _ | _ | _ | 7.6 | ⇩記憶機能、⇧うつ病率[ 182 ]
⇩海馬灰白質[ 183 ] |
| 50 | _ | _ | _ | _ | 12 * | _ | _ | _ | _ | ||
| TRIM38 | 235 | _ | _ | _ | 50 | 10 | _ | _ | _ | 4 | ⇧眼の染みスコア、⇩シルマーテスト、フォーカススコア≥3、SSA +、RF +、hyperγ[ 184 ] |
| Saccharomyces cerevisiae | 104 | _ | _ | _ | _ | 5 | _ | _ | _ | _ | トリプルRo52 + / Ro60 + / La +、低補体血症、皮膚病変[ 185 ] |
| カルポニン-3 | 209 | _ | _ | _ | 46 | 11 | _ | _ | _ | 2.2 | 末梢神経障害[ 186 ] |
| 神経節アセチルコリン受容体 | 39 | _ | _ | _ | 39 | 23 | _ | _ | _ | 0 | 自律神経障害[ 187 ] |
| アクアポリン-4 | 109 | _ | _ | _ | _ | 10 | _ | _ | _ | _ | オーバーラップNMOSD [ 188 ] |
| アクアポリン-5 | 112 | _ | _ | _ | 53 | 73 | _ | _ | _ | 32 | 安静時の唾液の流れが少ない[ 164 ] |
| その他のアクアポリン(1、3、8、9) | 34 | _ | _ | _ | _ | 38 | _ | _ | _ | _ | ⇧眼の染みスコア[ 189 ] |
| P-セレクチン | 70 | _ | _ | _ | 35 | 21 | _ | _ | 0 | 血小板数が少ない[ 190 ] | |
| カルバミル化タンパク質 | 123 | _ | _ | _ | 172 | 28.5 | _ | _ | _ | 3.5 | ⇧総IgG、IgM抗体、RF +、β2ミクログロブリン、⇧焦点スコアおよびGC [ 191、192 ] |
| モエシン | 50 | _ | _ | _ | 50 | 42 | _ | _ | _ | 4 | [ 193 ] |
| コフィリン-1 | 50 | 20 | _ | _ | 50 | 76 | 80 | _ | _ | 18 | 原発性シェーグレン症候群リンパ腫との関連[ 194 ]
抗Ro / SSA ACPA +のIgAアイソタイプおよび抗アルファエノラーゼの高尿pH [ 195 ] |
| アルファエノラーゼ | 50 | 20 | _ | _ | 50 | 82 | 90 | _ | _ | 26 | |
| RhoGDP-解離阻害剤2 | 50 | 20 | _ | _ | 50 | 86 | 90 | _ | _ | 26 | |
*=脳脊髄液中の抗体陽性;Sicca=非原発性シェーグレン症候群シッカ症候群;FM=「シッカ無力症多痛症」症候群に類似した非原発性シェーグレン症候群シッカ症候群を伴う線維筋痛症;Crtl=健常対照者;hyperγ=高ガンマグロブリン血症;ANA=抗核抗体;GC=胚中心。
3.3.5. 唾液性アキニアーキテクチャーの損傷
シェーグレン症候群からの唾液腺の病理学的特徴の一つは、リンパ球細胞からなる焦点浸潤の存在である。焦点性浸潤を「焦点スコア」と定義し、「焦点スコア=1」とは、組織4mm2あたり50個以上のリンパ球の集団である[196]。唾液腺浸潤は、通常、腺組織の破壊および断片化、アキナー過形成、およびアキナー細胞の脂肪性または線維性浸潤への置換を伴う[197]。これらの事象は、腺組織の深い改変および機能障害につながる。原発性シェーグレン症候群では、基底膜の剥離、先端小絨毛の変化、先端極と基底極を隔てるタイトジャンクションの混乱など、上皮細胞の構造的な混乱が記述されている[198]。いくつかの研究では、シェーグレン症候群陰唾液腺(LSG)は、マトリックスメタロプロテアーゼ(MMP)のタンパク質分解活性の有意な増加を表示することが示されているとMMP-3とMMP-9の発現が高く、排他的に肛門と管腔細胞で[199]。SS L唾液腺の炎症性細胞、仙腸細胞、管腔細胞で合成されるサイトカインの一部は、MMPs発現の増加を誘導する可能性がある[108,200]。その結果、高MMPs発現は基底ラミナにおける高レベルのリモデリング活性を誘発し、細胞傷害性炎症細胞との直接接触に対する唾液腺上皮細胞の脆弱性を高める[201]。シェーグレン症候群から採取したL唾液腺のアキニおよび管の基底層の損傷は、腺内の炎症性細胞の数と正の相関を示す最も頻繁に観察される改変である。
4. 臨床症状
原発性シェーグレン症候群は、しばしば腺組織への寄生性のためにsicca症候群に縮小されるが、事実上すべての臓器に影響を及ぼす全身性疾患であることに変わりはない。これらの臨床症状は、様々な機序に起因する可能性がある:外分泌症に伴う乾燥、標的臓器への上皮周囲リンパ球浸潤を伴う自己免疫性上皮炎、特定の自己抗体を伴う臓器特異的自己免疫、免疫複合体またはクリオグロブリン血症の存在に関連した全身性症状、およびクローン性リンパ球の拡大。原発性シェーグレン症候群患者の4分の3は、軽度の炎症性関節痛から生命を脅かすような症状まで、少なくとも1つの腺外症状を呈する。臨床症状は診断時にも、10年以上経過しても経過観察中にも発現することがあり、患者の注意深いモニタリングが必要である。一般的に、標的臓器の上皮周辺のリンパ球浸潤による症状は、安定した不活発な経過をたどる(例:シッカ症候群、腎尿細管アシドーシス、肺病変)が、免疫複合体または自己抗体に関連した自己免疫疾患はより予測不可能な経過をたどるが、その際には再燃と寛解を伴う。
4.1. 一般的な症状
原発性シェーグレン症候群患者の半数以上が無力な疲労と不眠を報告している[202]が、その一部は乾燥、夜痛、閉塞性睡眠時無呼吸症候群の有病率の増加による睡眠の質の低下に関連している[203]。低悪性度の発熱は原発性シェーグレン症候群患者の6%~41%に認められるが[204]、周期的な発熱はより逸話的に認められる[204]。体重減少や寝汗もまた、疾患の全身活動、自律神経の病変、リンパ腫の進展によるものである可能性がある。リンパ腫に古典的に記載されている発熱、寝汗、および体重減少の3つのB症状は、原発性シェーグレン症候群に関連する低悪性度リンパ腫の15%にのみ認められる [205]。
4.2. 眼症状
ドライアイは原発性シェーグレン症候群の典型的な症状であり、原発性シェーグレン症候群患者の95%以上に影響を与えるsicca症候群の一部である。患者は、涙が出ない、異物感、結膜炎、眼精疲労、視力低下を訴えることがある。眼の乾燥は、鎌状角結膜炎、眼瞼炎、細菌性角膜炎または角膜潰瘍によって複雑化することがある [206]。ぶどう膜炎、上強膜炎および眼窩仮性腫瘍はまれであるが、全身性の症状である可能性がある[207]。
4.3. 口内炎の発現
唾液腺のリンパ球浸潤は、咽頭痛、粘膜への食物の付着、嚥下障害、発話または摂食の困難、う蝕、歯の喪失、歯周病の関与、唇の乾燥、および非特異的な潰瘍およびアフタエを原因とする低酸素症を伴う外分泌症を生じる[206,208]。口腔カンジダ症および角状口唇炎は、唾液の抗菌作用の喪失に関連した真菌性合併症である[209]。髄質の病変は、感染性、裂傷性、炎症性またはリンパ腫性の耳下腺肥大の再発によって複雑化することがある [210]。唾液腺は両側性多嚢胞性耳下腺腫瘤およびリンパ腫の部位である可能性がある。
4.4. 筋骨格系の症状
関節の炎症性症状は、sicca症候群に次いで原発性シェーグレン症候群の最も頻度の高い症状である(患者の50%) [211]。患者は炎症性の特徴を持つ関節痛(朝のこわばり>30分)を有する場合もあれば、関節リウマチ(RA)を模倣した真の対称性多関節炎を有する場合もある。原発性シェーグレン症候群の関節病変は一般的に中等度(患部数5関節未満)であり、手や上肢の小関節に好んで発症する [211,212]。関節病変は通常、RAと重複している場合を除き、びらん性ではないが、変形性関節症(Jaccoud arthropathy)を呈することがある [211]。よりまれに、原発性シェーグレン症候群が筋炎の原因となることもある。最後に、原発性シェーグレン症候群患者の50%近くが原発性線維筋痛症に類似した広範囲の疼痛が頻繁に起こる [213,214]。
4.5. 神経学的症状
原発性シェーグレン症候群の神経学的症状は比較的頻繁にみられ(患者の18~45%)中枢神経系と末梢神経系(感覚運動性および自律神経系を含む)の両方に影響を与え、末梢症状の有病率が高い [215]。
末梢症状は多型であり、筋電図検査により、混合性神経障害、軸索感覚性神経障害、感覚失調性神経障害、軸索感覚運動性神経障害、純粋感覚性神経障害、多発性単神経炎、またはまれに慢性脱髄性多発性神経障害に区別される。言及されているメカニズムは、主に背側根神経節のリンパ球浸潤(感覚神経節症の場合)神経翼の血管病変、および/または軸索特異的自己抗体の存在である。頭蓋神経も関与しうるが、基本的にはガッサー神経節の関与による三叉神経(より広範な神経節病変を伴うか否かにかかわらず)および顔面神経(一側性または両側性の麻痺)である。他の頭蓋神経は逸話的に影響を受けている。最後に、非髄質線維の損傷は、自律神経障害または小線維神経障害の原因となることがある。
中枢神経系では、原発性シェーグレン症候群は、脳血管炎の二次的な脳卒中様または多発性硬化症様の損傷と、脳や脊髄の症状を引き起こす可能性がある。脊髄炎と視神経炎を組み合わせた脱髄症状の中には、抗アクアポリン4自己抗体の存在に関連した状態である、関連性のある視神経脊髄炎スペクトラム障害(NMOSD)の一部であるものもある。神経原発性シェーグレン症候群は、再発性の無菌性リンパ球性髄膜炎として現れることもある。まれに、筋萎縮性側索硬化症様症候群をもたらす上下運動ニューロン疾患の関連性が原発性シェーグレン症候群の間に記述されている。
最後に、認知機能障害(「脳蛙」)レストレスレッグ症候群および精神医学的異常は古典的に原発性シェーグレン症候群と関連しているが、これらの症状が反応性であるのか、疾患の病態生理に直接関連しているのかは明らかではない。
4.6. 肺症状
原発性シェーグレン症候群の臨床的に有意な肺疾患の有病率は9~20%であるが、不顕性症状はCTスキャンや気管支肺胞ラバージ所見で50%以上の患者に認められる。原発性シェーグレン症候群外分泌症は下気道にも影響を及ぼし、咳、気管支炎、気管支過敏症(遅発性喘息を模倣したもの)円筒形気管支拡張症、気管支炎(主に濾胞性気管支炎)を引き起こす。小気道上皮のこのような病変は、閉塞性換気症候群(11~14%)の原因となることはまれであるが、再発性肺感染症や無気管支炎によって複雑化することがある[216,217]。
非特異的間質性肺炎(NSIP)と通常の間質性肺炎(UIP)は、原発性シェーグレン症候群時に最も頻度の高い間質性肺疾患(ILD)のパターンであり、それぞれ症例の45%と16%に対応している。リンパ球性間質性肺炎(LIP)は第3位(ILD症例の15%)であり、おそらく濾胞性気管支炎から始まる原発性シェーグレン症候群のより特異的な良性びまん性リンパ増殖性疾患と考えられる。原発性シェーグレン症候群-ILDの2%にみられる肺リンパ腫との鑑別が必要である。肺アミロイドーシス、肺胞出血、ランゲルハンス組織球症、空洞性肺疾患、肺線維症と肺気腫症候群の合併など、組織性肺炎などの他のパターンは11%と頻度が低いか、まれである。しかし、CTスキャン上の多巣性嚢胞の存在は、原発性シェーグレン症候群-ILDの臨床的疑いを高めるべきである[211,216,217]。
胸膜浸潤はまれである。実際、原発性シェーグレン症候群が胸膜炎を呈するのは1%未満の症例のみである[207]。肺縮小症候群は原発性シェーグレン症候群患者では極めてまれな症例である [218,219,220,221,222,223]。
4.7. 皮膚科的症状
原発性シェーグレン症候群における皮膚病変は比較的一般的であり、強皮症、眼瞼皮膚炎、環状紅斑/亜急性皮膚ループス様病変、血管性紫斑病(皮膚血管炎、蕁麻疹性血管炎、クリオグロブリン血症またはWaldenströmの高ガンマグロブリン血症性紫斑病が原因)などの複数の症状が報告されている[211]。よりまれに、原発性シェーグレン症候群は皮膚潰瘍、livedo、結節性紅斑、パンニクル炎、アミロイドーシスまたは環状肉芽腫の原因となることがある[209]。
4.8. 心血管系の症状
レイノー現象は最も頻度の高い血管症状であり、患者の15%に影響を与えている[207]。幸いなことに、心膜炎、肺高血圧、心筋症などの心臓症状は非常に稀で、それぞれ原発性シェーグレン症候群患者の1%未満に影響を与えている[207]。心臓リズム障害は、イオン障害、自律神経失調症、または心臓の電気伝導系の直接的な障害に続発していることが報告されている[224,225]。
4.9. 胃腸症状
嚥下障害は、一般的に原発性シェーグレン症候群患者において頻繁にみられる愁訴であり、上部気道の潤滑が不十分であることと、低サリボレーションの結果として生じる食物のボーラスに関連している。食道機能障害も特定の症例で言及されており、口腔乾燥と嚥下障害の間に相関関係がないことを説明している[226,227]。原発性シェーグレン症候群患者の23%に発生する嚥下障害は頻繁に発生し、しばしば慢性萎縮性胃炎と関連しており、組織学的検査の後に唾液腺と同様の炎症性浸潤が認められる。頭頂部細胞や内因性因子に対する抗体が見られることもあるが、悪性貧血は依然としてまれである [226]。びまん性腹痛、下痢、吸収不良などの症状は、タンパク質喪失性腸症の一部として、あるいはセリアック病と重複している場合に生じることがある [226,227]。興味深いことに、原発性胆汁性肝硬変(PBC)が重複している原発性シェーグレン症候群患者は、十二指腸潰瘍を発症するリスクが高い(症例の85%)[226]。消化管は、寒冷グロブリン血症性血管炎の文脈では、急性かつ重篤な合併症の部位となりうる。
4.10. 膵臓および肝胆道の症状
膵臓は外分泌腺であるため、急性膵炎、慢性膵炎、膵臓機能不全の症例が原発性シェーグレン症候群患者の0~7%に見られることは驚くべきことではない。さらに、慢性膵炎様の形態学的変化の25~33%の有病率は、無症状の症例が多いことを示唆している[226]。肝腫大は患者の10~20%に認められる。原発性シェーグレン症候群は、原発性胆汁性肝硬変(PBC)-他の自己免疫性上皮炎-または自己免疫性肝炎(AH)と関連している可能性がある。仮性リンパ腫は、唾液腺や涙腺に発生するように肝臓に発生することが記載されている[226,227]。
4.11. 泌尿器科的症状
模式的には、原発性シェーグレン症候群と関連した腎障害は3つのグループに分けられる。(1)腹膜リンパ球浸潤を特徴とする自己免疫性上皮炎と関連した尿細管間質性腎炎、(2)免疫複合体と関連した糸球体腎炎、(3)特定の自己抗体の存在と関連した障害である。異なるコホートによると、原発性シェーグレン症候群患者の約5%に腎障害があるとされている。しかし、潜血性尿細管病変を系統的に評価した場合、この数値は明らかに過小評価されているように思われる[211,228]。
尿細管病変は腎尿細管のどの部分の機能障害とも関連しており、多尿症症候群、低分子蛋白尿、アミノアシド尿、高血糖性糖尿、正常なアニオンギャップを伴うアシドーシスなどの原因となりうる。麻痺や心臓リズムの乱れを伴う低カリウム血症、骨軟化症、腎石灰化症、または再発性腎結石の形成を伴うリン酸塩排泄の増加に関連した低リン酸血症 [228,229]。より逸話的には、後天性のジテルマン症候群またはバルター症候群が報告されており、おそらくトランスポーターを標的とした特異的な自己抗体の存在と関連していると考えられている(ジテルマン症候群におけるNaCl共輸送体など)[228,230]。糸球体疾患は病歴の後期に発生し、最も多くの場合、免疫複合体の沈着によるメザンギ増殖性糸球体腎炎(MPGN)に対応しており、通常はクライオグロブリン血症を探すべきである[211,228]。
間質性膀胱炎は、原発性シェーグレン症候群患者に見られる膀胱の慢性炎症性疾患である。このまれな症状は、花粉症、下腹部痛、尿意切迫感、疼痛性の独り言、血尿、排尿困難などの訴えによって特徴づけられる[231]。間質性膀胱炎は、両側性の水腎症および閉塞性腎不全によって合併することがある[231]。
4.12. 血液学的症状
貧血は原発性シェーグレン症候群症例の20%に認められ、通常は様々な機序の正常色素性正常細胞性貧血である:慢性疾患性貧血や溶血性貧血、まれに再生不良性貧血や悪性貧血、骨髄異形成症候群に続発することがある[232,233]。白血球減少症は患者の15%に認められ、最も多くの場合はリンパ球減少症に対応する。無顆粒球症はまれである。血小板減少症は患者の15%に認められ、エバンス症候群に関与しているかどうかにかかわらず末梢性のものである[232,233]。まれに血栓性血小板減少性紫斑病(TTP)[234,235,236]および血球貪食性リンパ組織球症(HLH)[237]の症例が報告されている。
反応性多発性リンパ節症は可能であり、滑膜炎の存在と統計的に関連している[212]。B細胞の強烈な刺激は、高ガンマグロブリン血症、過粘膜症症候群、モノクローナル・ガンマパチー、クリオグロブリン血症およびアミロイドーシスの発生を説明している[232,238]。免疫複合体の形成は補体画分の消費につながる。
CD4リンパ球減少症は主に抗Ro-SSA陽性患者に見られ、非ホジキンリンパ腫(NHL)のリスク上昇と関連している[232]。NHLの有病率は原発性シェーグレン症候群患者で4.3%である[205]。模式的には、原発性シェーグレン症候群に関連する非ホジキンリンパ腫は2つの主要なカテゴリーに分けることができる:第1のカテゴリーは、不活発な経過をたどり、MALT型の節外縁帯(MZ)B細胞リンパ腫に支配され、第2のカテゴリーは、de novoまたは二次性びまん性大細胞リンパ腫(DLBCL)などの高悪性度リンパ腫に対応している。原発性シェーグレン症候群患者において、MALTリンパ腫は、良好なパフォーマンス状態、小さな腫瘍負担、およびまれなB症状によって特徴付けられる不定愁訴性疾患である。それらは好ましくは、唾液腺、胃、鼻咽頭、肺、肝臓、腎臓、眼窩、および皮膚などの1つ以上の体外部位に位置する[205]。これらの部位のほとんどすべてが自己免疫性上皮炎に関与する臓器であることに注意することは興味深い。骨髄浸潤はまれであるが、局所的な結節性病変が観察されることがある。DLBCLは侵攻性で予後不良である。そのうちの一定の割合は、おそらく低悪性度リンパ腫からの転化であると考えられる。NHLは主にクリオグロブリン血症、触知可能な紫斑病、およびC4画分の消費を伴う原発性シェーグレン症候群患者に発生する[205]。
4.13. 耳鼻咽喉(耳鼻咽喉科)の症状
原発性シェーグレン症候群患者では耳鼻咽喉の訴えは一般的(40~50%)であるが、客観的な線維学的異常の頻度は低い(20%) [239]。原発性シェーグレン症候群患者の約40%が報告している外分泌異常は、不快感、鼻汁、副鼻腔炎、鼻出血、または嗅覚・味覚障害の原因となるシック鼻炎を引き起こす可能性がある [240]。LPRは、咽頭炎に加えて、発声障害、のどの痛み、慢性的なのどの清掃、または耳管機能障害などの様々な耳鼻咽喉科の訴えによって現れる。
他の全身性血管炎と同様に、原発性シェーグレン症候群は感音性難聴や軟骨炎の原因となり[242]、コルチコステロイド治療に反応することがある。魅力的な方法では、原発性シェーグレン症候群はかなりの割合の患者で感音性難聴と関連しており、主に高周波数に影響を与えるが、その臨床的影響は明らかではない[243]。
4.14. 婦人科系および産科系の症状
原発性シェーグレン症候群は受胎可能性に悪影響を及ぼすことはないが、慢性的な痛みや膣の乾燥は、女性患者の性生活に悪影響を及ぼす性交疼痛障害の原因となることがある[244]。妊娠中、原発性シェーグレン症候群は、まれではあるが古典的な2つの症状、自己免疫性先天性心ブロックと新生児ループス[245,246,247]の原因となることがある。これら2つの症状は、抗Ro/SSA自己抗体の経胎盤通過と関連している。先天性心ブロックは抗Ro/SSA陽性妊娠の2%にみられるが、その後の妊娠で再発するリスクは10~20%である。さらにまれに、新生児ループスは心内膜線維弾性線維症、弁膜奇形、または中隔欠損を伴うことがある。新生児ループスは、抗Ro/SSA陽性妊娠の5分の1に発症し、発赤性発疹および光線過敏症を特徴とし、肝障害、血液学的障害、神経学的障害を伴うことがある。原発性シェーグレン症候群患者は健常な妊娠と比較して、妊娠喪失または新生児死亡の確率が有意に高かった。しかし、原発性シェーグレン症候群と早産、自然流産や人工流産、死産との間には有意な関連はなかった[248]。これらのデータは、限られた数の異種研究に基づくものであり、必ずしも最近の研究であるとは限らないため、注意が必要である。
5. 診断ワークアップ
5.1. 診断基準と分類基準
1つ以上の適合性のある症状に直面した場合、原発性シェーグレン症候群の診断を喚起し、調査しなければならない。診断を下すことは医療の基本である。患者にとって、診断は疑問と診断の迷走の終焉を意味する。医師にとっては、診断によって管理の明確化が可能となる。最後に、研究者にとっては、診断はコンセンサスのある定義の下に同質のグループを作ることを可能にする。残念ながら、原発性シェーグレン症候群の診断を確認するための単一の診断テストはない。そのプロテスタン的で進んで陰湿な症状のために、原発性シェーグレン症候群は時に認識が難しく、診断を10年以上遅らせる可能性がある。原発性シェーグレン症候群患者では、シッカ症候群、疲労、非特異的筋骨格系疼痛が、加齢、不安うつ病、更年期障害などの症状と誤って捉えられることがある。全身性の症状がsicca症候群に先行することがあり、結果として「オカルト原発性シェーグレン症候群」になることがある [249]。このような様々な理由から、原発性シェーグレン症候群の個別診断の基準は依然として専門の臨床医の意見に委ねられている。原発性シェーグレン症候群患者のグループでの研究を可能にするために、いくつかの学会が原発性シェーグレン症候群とは何かを共通に定義できるように分類基準を定義してきた。最新の3つの分類基準を表2に示する。定義によれば、分類基準は特異的であるが、感度が低い可能性があり、診断基準として盲目的に使用するのではなく、臨床での指針として使用すべきである。
表2 現代の原発性シェーグレン症候群分類基準・専門家の意見と比較した項目、定義、診断性能の比較
| AECG分類基準(2002)[ 250 ] | SICCA分類基準(2012)[ 251 ] | ACR・EULAR分類基準(2016)[ 252 ] | ||||
|---|---|---|---|---|---|---|
| ドメイン | アイテムの定義 | 値 | アイテムの定義 | 値 | アイテムの定義 | 値 |
| 主観的な
目の乾燥 |
≥1/ 3の特定の質問 | マイナー | / | _ | / | _ |
| 主観的な
経口乾燥 |
≥1/ 3の特定の質問 | マイナー | / | _ | / | _ |
| 眼の兆候 | Schirmer(≤5mm / 5分)
または VanBijsterveld≥4 |
マイナー | OSS≥3 | 1 | シルマー(<5 mm / 5分) | 1 |
| OSS≥5
OR ヴァンBijsterveld≥4 |
1 | |||||
| 唾液腺機能障害 | UWSF(≤1.5mL / 15分)
または 互換性のある耳下腺シアログラフィー または 異常な唾液シンチグラフィー |
マイナー | / | _ | UWSF(≤0.1mL/ min) | 1 |
| MSGB | フォーカススコア≥1 | メジャー | フォーカススコア≥1 | 1 | フォーカススコア≥1 | 3 |
| 自己
抗体 |
Anti・Ro / SSAまたは
Anti・La / SSB |
メジャー | ANA(+)≥1:320のAnti・Ro / SSAまたは
Anti・La / SSB または RF(+) |
1 | Anti・Ro / SSA | 3 |
| 原発性シェーグレン症候群の定義 | 6つのうち4つ、メジャーが1
つ以上(または4つの目標のうち3つ) |
2/3以上の
基準を持つ原発性シェーグレン症候群の兆候および/または症状 |
合計スコアが4以上のSiccaまたはESSDAIの症状 | |||
| 除外基準 |
|
|
|
|||
| 感度 | 93.5% | 92.5% | 96% | |||
| 特異性 | 94.0% | 95.4% | 95% | |||
AECG = American European Consensus Group、SICCA = シェーグレン国際共同臨床同盟、ACR-EULAR = American College of Rheumatology-European League Against Rheumatism、UWSF = unstimulated whole saliva flow、RF = rheumatoid factor、ANA = antinuclear antibodies、ESSDAI = EULAR シェーグレン症候群疾患活動指数。
5.2. シッカ症候群と腺の評価
唾液腺および涙腺の客観的機能不全の調査は、患者の診断および症状管理に有用である。解剖学的または機能的画像診断は、原発性シェーグレン症候群中の主要唾液腺の変化を評価するために使用することができる。
ドライアイの評価には、簡単な眼科検査が必要である。シルマーテストは、各眼の下眼窩の内側に濾紙の小片を配置することで構成されている。その後、5分間目を閉じる。この時間が経過した後、ろ紙を取り除き、毛細血管に吸収された涙の量を、眼球表面に接触したろ紙の端からミリ単位で測定する。≦5mm/5分であれば乾燥が有意である。その後、Break-up Time(BUT)による涙膜の安定性の評価と、乾燥と関連した結膜または角膜病変(keratoconjunctivitis sicca)の探索に続いて評価が行われる。これらの各種検査では、スリットランプや眼内に色素を注入する方法が用いられている。BUTは、各眼にフルオレセインを1滴ずつ入れ、色のついた涙膜が眼球表面を均一に覆っている時間を測定して、乾いた斑点が現れるまでの時間を測定する。10秒未満の涙のBUT検査(3回の検査で平均)は病的と考えられるが、原発性シェーグレン症候群の症状に特異的なものではない。最後に、結膜と角膜の損傷は、眼表面の染色技術(フルオレセインとリサミングリーン)[253]によって強調される。異常は、標準化されたスコア:van BijsterveldスケールまたはSICCA Ocular Staining Score(OSS)を用いて採点される。それぞれのカットオフ値≧4および≧5は、原発性シェーグレン症候群を示唆する病理学的状況に対応している。これらの検査は、Schirmer試験やBreak-up time試験よりも原発性シェーグレン症候群に特異的である。ローズベンガル色素は、その耐容性の低さと局所毒性のため、もはや使用されていない。
低サリベーションの評価は、サイアルメトリーによって簡単に行うことができる。その最も単純な形態では、サイアルメトリーは、刺激されていない全唾液流量(UWSF)と刺激された全唾液流量(SWSF)を測定することで構成されている。UWSF は、患者を求めることによって実行される最低 2 時間-受動的に 15 分間 tared ジャーで生成されたすべての唾液を排出する。ジャーは、重量を量り、唾液の量を推定する。0.1 mL/min 未満の UWSF は病理学的と見なされる (正常範囲 0.3-0.4 mL/min)。UWSFは軽度の分類基準を表す。SWSFは機械的刺激の存在下で測定される。SWSFは、サクソンテストまたはガムテストプロトコルを用いて測定することができる。サクソンテストは、患者さんに2分間、圧縮剤を噛んでもらい、それを計量してもらいます。ガムテストはUSWFと同様に行われるが、この場合、患者はガムを噛んで、容器に入れた唾液を吐く。SWSFが0.5~0.7mL/min以下(正常範囲1.5~2.0mL/min)であれば低唾液分泌と診断される。また、吸引やカニューレーションによって各主要唾液腺に特異的な唾液流量を測定することも可能である。しかし、これらの方法はリウマチ専門医にとってはほとんど役に立たず、特に患者にとっては不快なものである。
ラジオシアログラフィは、主要唾液腺の排泄管に造影剤を逆行性に注入することを必要とするX線画像化技術である。この技術は、排泄管の「木構造」の変化を研究することにより、間接的に腺損傷を強調するものである[254]。この手技の侵襲性と合併症を考慮すると、他の非侵襲的な手技が好まれて、この手技は放棄されている。
SGシンチグラフィ(SGS)は、Technethium-99 pertechnetateを注入した後の耳下腺と顎下腺による放射性トレーサーの取り込み、濃度、基底または刺激的な分泌を調査する。SGSの解釈は主にSchallの分類[255]に基づいており、グレード1(正常)からグレード4(取り込みと口内活動が全くない)までの4つのグレードに異常を分類した定性的なスコアである。3以上をカットオフとした場合、感度は54~87%、特異度は78~98%である [256]。唾液シンチグラフィは2002年の原発性シェーグレン症候群の分類基準の一つであるが 2016年の最新の分類基準からは消えている。異常なシンチグラフィは唾液腺の機能不全を客観化することは可能であるが、原発性シェーグレン症候群に特異的な画像がないため、病因診断を可能にするものではない。しかし、治療には興味があるかもしれない:検査で唾液腺の取り込みは正常であるが、排泄の大きな機能不全(自律神経障害によるものと思われる)が見られた場合、患者はシアラゴーグ治療の恩恵を受けられる可能性がある。シンチグラフィーでトレーサーの取り込みがないことを示した場合、実質はおそらく完全に破壊されており、サイアローグ治療は役に立たないであろう。
超音波検査は、原発性シェーグレン症候群の診断および予後の証拠として耳下腺および顎下腺の実質を評価するための簡単で非侵襲的な方法である。高周波リニアプローブを使用したモードB超音波は、サイズ、均一性、低/無響領域の存在、低脈波帯、および唾液腺境界の明瞭性を特徴付けることができる。これらの異なる項目は、いくつかの診断スコアに含まれていた[257]。OMERACTグループは、標準化の試みとして 2019年に耳下腺および顎下腺の実質内の低エコー/無エコー帯の存在に基づく半定量的なスコアリング(0~3)を開発した[258]。スコア≧2は異常であり、原発性シェーグレン症候群を示唆している。現在のところ、唾液腺超音波検査(SGUS)は分類基準の一部ではないが、将来的にはそうなるかもしれない [259]。残念ながら、組織学的異常(リンパ球浸潤、病変した実質または管路異所性/嚢胞)とSGUS病変との間の相関関係は裏付けられていない[254]。リツキシマブによる治療後にSGUSスコアが改善したことは、異常の一部が疾患活動性と相関していることを証明しており、損傷の発生だけではないことを証明している[260,261]。現在までのところ、SGUSを予後または治療反応因子として使用するためのエビデンスは不十分である。高い空間分解能とコントラスト分解能、低コスト、アクセスのしやすさのおかげで、SGUSは原発性シェーグレン症候群患者の診断においてMRIに取って代わりました。
5.3. 小陰唇唾液腺生検
マイナー唾液腺生検(MSGB)は、少ない機器で実施できる簡単な手順である。いくつかの生検手技が文献に記載されている[262,263]。消毒後、唾液の小滴が再び出現することで、下唇の側方3分の1のレベルにある付属腺を同定することが可能になる。これらの腺の上の粘膜は、リドカインの注射で麻酔される。その後、粘膜を5〜10mm以上のメスで切開し、鉗子で腺を摘出する。腺の個別化と摘出は、局所麻酔の際に行われるハイドロダイセクションと唇のエバーションによって容易になる。小葉は、唇の外側にデジタルまたは器具を用いて圧力を加えることで、傷口の表面に向かってヘルニアを形成する。品質上の問題から、4~6個の腺を除去し、最低8mm2の腺を研究することが推奨されている[264]。耳下腺生検は、技術的に複雑で顔面神経への損傷の理論的リスクがあるため、例外的にしか行われないが、フォーカススコアに基づくMSGBと同じ診断効果が得られる。一方で、リンパ上皮病変および早期リンパ腫の検出は、予後を予測する価値があるため、耳下腺生検での検出頻度が高く、検出が容易である[263]。
MSGB病理学の中心的な要素は、病巣と呼ばれる50個以上の単核細胞(主にリンパ球)のクラスターの存在である。正常なアキニに隣接する管周囲または血管周囲領域におけるこれらの病巣を計数し、調査した領域を報告し、チショルム-メーソンスコア[265]またはフォーカススコア[266]として表現する。これらのスコアの最初の記述と比較して、一部の専門家は、Focus-score[264]の変化を恐れて、線維化または萎縮の領域に関連するものを含むすべての病巣をカウントすることを推奨している。フォーカススコアは腺の4 mm2あたりの病巣の平均数に対応する。0から12まであり、12は慣習的に病巣の合体に対応する。グレード0は浸潤がない場合に対応し、グレード1は単核球の浸潤がわずかにあるが、焦点は形成されていない場合に対応し、グレード2は病巣を形成する単核球の浸潤があるが、その密度は4 mm2あたり1個未満である場合に対応し、グレード3および4はそれぞれ4 mm2あたり1個または1個以上の焦点がある場合に対応している。焦点スコア≧1(チショルムグレード≧3)で特徴づけられる焦点性唾液腺炎の存在は、原発性シェーグレン症候群の診断上の主要な論拠であり、さまざまな分類基準に含まれている。感度と特異度が80%を超え、有意な陽性予測値を示すため [267]、慢性の局所性唾液腺炎(Focus-score ≥1)の存在は、たとえ特異的な症状や自己抗体が陰性であっても、初期の原発性シェーグレン症候群の診断に特に有用である [249]。
分類基準には含まれていないが、他の異常も記載される:線維化、アキナール萎縮、排泄管の異形成またはメタプラズム、組織球性肉芽腫、胚性中心様構造の存在、リンパ上皮性または筋上皮性唾液腺炎(LESA/MESA)[268,269]。LESA/MESAは、管路のリンパ球浸潤および基底細胞過形成によって特徴づけられ、その結果、多層上皮が形成される。さらに、病理学的には、サルコイドーシス、IgG4関連疾患、アミロイドーシス、リンパ腫との鑑別診断が可能である。最後に、MSGBは患者の予後に関する情報を提供する:フォーカススコアが3以上で、胚中心様構造またはLESA/MESAの存在は、より重症な疾患とリンパ腫を含む局所および全身の症状の頻度の増加に関連している。このような理由から、客観的なシッカ症候群で抗Ro/SSA陽性に基づいて診断が可能な場合でも、MSGBを行うことを推奨する。
耳下腺生検は、軽度の唾液腺生検でも同等の診断性能を有していることから、やや敬遠されてきている。一方で、MSGB [270,271] との矛盾の可能性、予後不良に関連する病変の早期発見の可能性、疾患をモニターするために同じ腺を再度生検する可能性、SGUSの記号論との相関の可能性などから、耳下腺生検は将来的に再評価される必要があるツールとなっている [263]。
5.4. 抗核抗体(ANA)プロファイル
原発性シェーグレン症候群の診断における他の主要な要素は、抗Ro/SSAおよび/または抗La/SSB自己抗体の存在である。Ro/La系は、3つの異なるタンパク質(52kDa Ro、60kDa RoおよびLa)と4つの小RNA粒子によって構成される不均一な抗原性複合体である[272]。したがって、HEp-2/HeLa細胞の免疫蛍光(IF)による抗核抗体(ANA)の探索は、原発性シェーグレン症候群の診断において重要な要素である。原発性シェーグレン症候群患者の70%でANAは陽性であり、通常は微細な斑点状の蛍光を呈している[273]。抗Ro/SSAおよび/または抗La/SSB自己抗体は、それぞれ50-90%および25-60%の患者で確認されている[274]。Hep-2細胞はRo/SSA抗原を十分に発現していないことに留意すべきであり、ELISAで抗Ro/SSA陽性の患者の10%がHEp-2細胞のIFでANA陰性であるという事実を説明している[274]。したがって、原発性シェーグレン症候群が疑われる場合には、ELISAによる抗Ro/SSA抗体の同定を、たとえIFスクリーニングでANA陰性であっても依頼する必要がある。抗Ro/SSA自己抗体には、抗Ro52抗体と抗Ro60抗体の2種類の鑑別が可能である[272]。抗Ro52/SSAは、特異的なANA蛍光染色パターンを持たず(細胞質パターンを示すことさえあるかもしれない[274])沈殿陰性であり、天然SSA/Roに基づくELISAでは検出されない。Ro52+ Ro60+患者は原発性シェーグレン症候群を有する可能性が高いが、Ro52+ Ro60-患者はそうではない[275]。孤立した抗Ro52/SSA陽性は、原発性筋炎および全身性硬化症と統計的に関連している。一方、抗Ro52/SSAおよび抗La/SSBは、これら2つの抗原が第18週から第24週までの胎児の心臓組織で発現するため、抗Ro52/SSA陽性患者からの子孫における先天性心ブロックの相対的リスクが最も高い[272]。抗La/SSBは主に抗Ro/SSAの存在下で見られ、エピトープ拡散のメカニズムを想起させる。症例のわずか2-3%で、原発性シェーグレン症候群患者は単離された抗La/SSB抗体を呈する[276,277]。別のANAパターンの存在または「非定型」ANAの同定は、二次性SS、別の全身性疾患との重複、または特定の原発性シェーグレン症候群サブグループの同定を可能にし得る[159]。これらの抗体の予後的意味合いについては、予後のセクションで議論されている。
5.5. 血液検査
ANA検査に加えて、自己免疫性全身疾患が疑われる場合の初期の血液検査には、全血球数、抗リン脂質パネルを用いた凝固プロファイル、尿素/クレアチニン投与量、尿沈渣、24時間尿蛋白または尿蛋白/クレアチニンレベル、腎尿細管症を調べるためのNa+/K+/HCO3-/Cl-/尿酸レベル、肝酵素レベル、筋炎を調べるためのクレアチンホスホキナーゼ(CPK)が含まれる。C3/C4/CH50値、リウマチ因子(RF)環状シトルリン化ペプチド(CCP)抗体、クームステスト、血清蛋白電気泳動、総IgG、IgMおよびIgA値を測定して、ポリクローナル高ガンマグロブリン血症および/またはモノクローナル・ガンマパチーの有無を調べる。HCV血清検査;VDRL/TPHA;遊離T4値、TSH、抗甲状腺ペルオキシダーゼ、抗サイログロブリン、抗ミトコンドリア、抗平滑筋、抗胃頭頂細胞抗体(関連する自己免疫疾患の場合)。高ガンマグロブリン血症とリンパ球減少症は、古典的に原発性シェーグレン症候群の間に記述されている。それらの存在は付加的な論拠となる可能性があるが、その診断能力は不明である。
5.6. シェーグレン症候群の鑑別診断
古典的には、sicca症状、腺肥大および/またはリウマチ性/全身性の症状を臨床的に示すすべての障害が原発性シェーグレン症候群の鑑別診断に該当する(表3)。しかし、合理的で実用的なアプローチが正しい診断につながることが多い [278]。
表3 シェーグレン症候群の鑑別診断(非網羅的リスト)
| ドライアイ症状複合体 | 腺の関与 | 関節の関与 | 全身的関与 | |
|---|---|---|---|---|
| ゼロジェニック薬 | バツ | _ | _ | _ |
| アロマターゼ阻害剤 | (バツ) | _ | バツ | (X)原発性シェーグレン症候群のような |
| 加齢に伴う乾燥 | バツ | _ | _ | _ |
| 代謝性唾液腺症 | _ | バツ | _ | _ |
| 非SSドライアイ疾患 | バツ | _ | _ | _ |
| 頭頸部照射 | バツ | _ | _ | _ |
| サルコイドーシス | バツ | バツ | バツ | バツ |
| 高脂血症(II、IV、Vタイプ) | バツ | バツ | (バツ) | _ |
| 慢性移植片対宿主病 | バツ | バツ | バツ | バツ |
| 原発性リンパ腫 | バツ | バツ | _ | (バツ) |
| アミロイドーシス。 | バツ | バツ | (バツ) | (X)腎臓、紫斑 |
| ウイルス性慢性唾液腺炎(HCV、HIV、HTLV-1) | バツ | (バツ) | バツ | バツ |
| その他の慢性非特異的唾液腺炎 | バツ | X通常は一方的な | _ | _ |
| 糖尿病 | バツ | (X)唾液腺症 | (X)Cheiroarthropathy | (X)ニューロパシー |
| ヘモクロマトーシス | バツ | (バツ) | X CPPD | (バツ) |
| その他の結合組織病 | バツ | _ | バツ | バツ |
| 関節リウマチ | (バツ) | _ | バツ | (バツ) |
| 多発血管性肉芽腫症 | バツ | (バツ) | バツ | バツ |
| IgG4関連疾患(ミクリッツ症候群) | バツ | バツ | (バツ) | (バツ) |
| 不安、線維筋痛症 | バツ | _ | (バツ) | _ |
| チェックポイント阻害剤 | バツ | (バツ) | バツ | バツ |
5.7. 原発性シェーグレン症候群と二次性シェーグレン症候群
疾患の単離型および特発型を「一次性」と表現し、特定の原因または実体に関連した型を「二次性」として認定するのは、医学的鼻腔学では古典的なことである。SSも例外ではない。歴史的には、この二分法により、原発性シェーグレン症候群患者はsicca症候群を合併したRA患者と区別されてきた。その後、「二次性SS」(sSS)は、他の結合組織疾患(例:SLEおよび全身性硬化症(SScl))および自己免疫疾患(例:原発性胆汁性肝硬変、甲状腺炎および血管炎)にまで拡大した [279]。この命名法は2002年のAECG分類基準でも間接的に「批准」されており[250]、他の十分に定義された主要な結合組織疾患と、少なくとも1つの乾性症状(眼性または頬性)および3つの外分泌機能障害の徴候(表2のMSGB、SG徴候または眼性徴候)のうち2つを有する患者を「SSS」と分類している。
現在のデータに照らすと、この二分法は時代遅れのようであり、見直すべきである。多発性自己免疫症やオーバーラップ症候群は現在認められているが、なぜSSがいまだに二級障害とみなされているのか疑問に思うことがある。
シッカ症状を有する34人のRA患者の唾液腺生検の検査に基づいて、2つの表現型を区別することができる [280]。1群の患者は軽度の唾液腺病変と自己抗体陰性を特徴とする表現型を示した。組織学的に、小唾液腺生検では、抗原提示細胞およびCD8+ T細胞の有病率の増加、B細胞の存在の減少、および「非活性化」上皮細胞(HLA-DRおよびco-stimulation proteins D80/B7.1の発現に基づく)を示す。第2のグループの患者は、腺症状および/または自己抗体陽性を特徴とする表現型を呈した。彼らのマイナー唾液腺生検では、CD80/B7.1の過剰発現とS100+細胞の低頻度が示され、抗Ro/SSA自己抗体陽性および/またはフォーカススコア≧1と相関していた。両群ともに、それぞれRA-Sシェーグレン症候群の既往歴があり、RA-原発性シェーグレン症候群の重複があった。本研究では、RA-sicca患者は症候を伴わないRA患者と比較して、統計学的にレイノー現象、唾液腺肥大、触知性紫斑病、腎・肺・肝臓病変を多く呈していた。また、ANA、抗Ro/SSA自己抗体、RF陽性の頻度も高かった。発表されたデータでは、これらの症状が第2群で過剰に発現しているかどうかはわからない。
血清組織学的な観点からは、抗Ro/SSA陽性、抗La/SSB陽性、唾液腺浸潤については、原発性シェーグレン症候群単独とSLE[281]またはSScl[282]に関連したSシェーグレン症候群との間に違いはない。そのため、いわゆるsシェーグレン症候群というよりもオーバーラップしているように思われる。一方、RA患者については、シェーグレン症候群のオーバーラップは関連する臨床表現型を修飾する。SLE単独の患者と比較して、SLE-SS重複患者は高齢であり、レイノー現象、抗Ro/SSA陽性、抗La/SSB陽性、リウマチ因子の頻度が高かった。また、腎障害、リンパ節症、血小板減少症の頻度も有意に低かった[281]。SScl単独の患者と比較して、SScl-SSが重複する患者は、SSclによる重篤な合併症、すなわち肺線維症、肺動脈高血圧症、強皮症腎クリーゼのリスクが低いように思われる[282]。
要約すると、「二次性SS」は私たちの語彙から禁止されるべきであり[283]、あるいは、もしそのような実体が存在するならば、真のシェーグレン症候群に対応しない関節リウマチで発生する何らかの外分泌病変に対して非常に限定的に定義されるべきである。さらに、「二次性SS」は2012年と2016年の分類基準から消えている。患者は、共通の病因経路を反映して、他の自己免疫疾患と関連している場合もあれば、関連していない場合もある(p)シェーグレン症候群を有しているかどうかを判断する。このようにして、臨床医は3つの落とし穴を避けることができる。(1)患者のQOLを低下させるSS関連症状を最小限に抑えること、(2)オーバーラップによって臨床表現型が変化する可能性があることを忘れてしまうこと、(3)リンパ腫のリスクを忘れてしまうことである。残念ながら、原発性シェーグレン症候群重複症候群は、歴史的に「二次性SS」というレッテルを貼られ、大多数の臨床試験から除外されてきたため、過去には十分に認識されておらず、研究もされておらず、治療もされていない可能性がある[284]。したがって、それらの管理は、臨床医の専門知識、患者の選択、最善のエビデンス、および関連するすべての疾患の管理のための実践に基づいている。将来的に原発性シェーグレン症候群をより良く個別化するためには、臨床的な定義から分子的、あるいはエピジェネティックなシグネチャーへと移行できるようにする必要があるだろう。
6. 予後
原発性シェーグレン症候群の診断が下されると、予想される経過と患者さんの生活への影響をもとに治療や医療の決定が行われることになる。この負担を「5D」にまとめることができる。死亡(死亡率)疾患活動性、損害発生、不快感(痛みやsicca症状)障害。疾患の自然史や機能的反響に対する治療介入の効果を評価するために、臨床試験における臨床転帰として利用できるスコアが開発されている。
6.1. 死
原発性シェーグレン症候群の全死亡率は低く、一般集団と同様であるが [285]、一部の患者では生命予後が悪くなる。このような患者のサブグループで観察される過剰死亡率は、一般的にリンパ腫の発生や、まれではあるが重度の内臓病変に起因するものである。原発性シェーグレン症候群患者の死亡原因の第一位は心血管イベントであり、次いで固形臓器やリンパ系の悪性腫瘍、感染症である[285]。死亡率の増加に関連する危険因子は、診断時の高齢、男性性、耳下腺肥大、耳下腺シンチグラフィ異常、腺外病変、血管炎、抗SSB陽性、低C3および低C4,およびクリオグロブリン血症である[285]。
原発性シェーグレン症候群は、全がん(プールドRR 1.17~1.88)非ホジキンリンパ腫(NHL)(プールドRR 8.53~18.99)甲状腺がん(プールドRR 1.14~4.03)のリスクの増加と関連している[286,287]。リンパ腫の発生に関連するバイオマーカーは、主に高揚したB細胞増殖および免疫複合体産生に関連する徴候である[288,289,290]。耳下腺の腫脹、フォーカススコア≧3,胚性中心部様病変、皮膚血管炎または触知性紫斑病、補体消費量(低C3,C4またはCH50)クリオグロブリン血症またはモノクローナルパラプロテイン血症の存在、リウマチ因子、β-2ミクログロブリンの増加、リンパ球減少症、低グロブリン血症、リンパ節腫脹または脾臓腫脹、および頭頸部照射。
6.2. 疾患活動性
疾患活動性とは、疾患の炎症性負荷に関連した臓器の機能的または構造的変化であり、治療の下で可逆的であると定義されることがある。他の炎症性疾患と同様に、疾患活動性は時間の経過とともに変動し、再発と寛解の間で進行することがある。原発性シェーグレン症候群患者のかなりの割合(約50-70%)が、腺発症時または6ヶ月以内に全身性の症状を示し、主にリンパ節腫脹/脾腫、非びらん性関節炎および神経学的病変を呈している[291]。Antonius Nieuwegein Sjögren(ANS)コホートの長期研究では、診断から10年以内に、この研究に参加した140人の患者の30.7%が、多神経症、間質性肺疾患、関節炎、円板状または亜急性皮膚エリテマトーデス(LE)橋本病などの腺外症状または自己免疫症状を発症していたことが明らかになった[292]。クリオグロブリン血症の存在は、全身症状を発症するリスクの増加と関連している[211,292]。一方で、広範囲の疼痛を呈することは「保護的表現型」であるように思われる[292]。
現在、欧州リウマチ連盟(EULAR)のシェーグレン症候群疾患活動性指標(ESSDAI)スコアが、疾患の炎症性全身活動性を定量化するために使用されている。ESSDAIスコアでは、臨床的または生物学的症状を12の領域で「低」(1点)「中等度」(2点)「高活性」(3点)のいずれかに分類している。ESSDAIスコアを算出するには、各ドメインの最高レベルの活動性の値にドメインの重み(1~6点)を乗じて加算する。理論上の最大 ESSDAI スコアは 123 である。臨床的に重要な最小改善とは、3点以上の改善と定義された。さらに最近では、生物学的ドメインを含まないESSDAIスコアの亜種であるClinESSDAIスコアも使用されている[293](表4)。
表4 原発性シェーグレン症候群患者の臨床モニタリングのための共通の損傷、負担、活動性スコア
| EULARシェーグレン症候群疾患活動性指数 | EULARシェーグレン症候群患者報告指数 | シェーグレン症候群病害指数 | シェーグレン症候群損傷指数 | |
|---|---|---|---|---|
| 略語 | ESSDAI | ESSPRI | SSDDI | SSDI |
| 最初の説明 | Seror etal。[ 294 ] | Seror etal。[ 295 ] | Vitali etal。[ 296 ] | バリーら。[ 297 ] |
| 年 | 2010年 | 2011 | 2007年 | 2008年 |
| タイプ | 活動指数 | プロ | ダメージ指数 | ダメージ指数 |
| ドメイン(n) | 12 | 1 | 6 | 9 |
| アイテム(n) | 44 | 3 | 9 | 27 |
| アイテムのスコアリング | 0から3 | VAS(0–10) | 1、2または5 | 1 |
| ドメインの重み | 1から6 | 1 | 1 | 1 |
| 計算 | 和 | 平均 | 和 | 和 |
| スコア範囲 | 0〜123 | 0〜10 | 0〜16 | 0〜27 |
| 臨床的に重要な
閾値 |
<5低≥5、≤13中以上≥14高 | ≥5/ 10は不十分な症状状態です | – | – |
| 臨床的に重要な最小限の違い | 3ポイント以上の改善 | 1ポイント以上または15%以上の改善 | – | – |
VASはvisual analogue scale、PROはpatient reported outcomeである。
しかし、(clin) ESSDAIスコアは、原発性シェーグレン症候群に関連する可能性のあるすべてのイベントを調査しているわけではないことに留意すべきである。国際登録 “The Big Data Sjögren Project Consortium” [207]に登録された6331人の患者のうち、1641人の患者(26%)は、現在のところESSDAI分類には含まれていない26の臓器特異的特徴の事前定義済みリストに、少なくとも1つの非ESSDAI性全身症状を有していた。非ESSDAI顕在性を有する患者は、非ESSDAI顕在性を有する患者よりも全身活動性が高い患者である(平均ESSDAI 10.3 vs. 5.5,p<0.001)。
全身活性が著しい患者は、一般に、早期発症の患者であり、抗Ro/SSA(抗La/SSBを伴うか否かは問わない)低C3,低C4,およびクリオグロブリン血症の頻度が高い抗核抗体(ANA)陽性の患者である[154,276,277,298]。抗Ro/SSA陽性の母親の子供は、新生児ループスや先天性心ブロックなどの特定の新生児合併症のリスクがある[277]。逆説的に、疾患活動性が高い患者は、シッカ症候群または広汎性疼痛による障害が少ない[276,277]。逆に、遅発性の血清陰性疾患を有する患者は、主により障害性の高いシックカ症候群を呈するが、疾患の活動性に関連した全身症状は少ない[277]。最後に、孤立性抗La/SSB陽性は原発性シェーグレン症候群患者の3%にしか認められず、Ro/SSA陽性患者と血清陰性患者の間の中間的な表現型と関連している[277]。このように、全身性合併症は原発性シェーグレン症候群の初期診断から何年も経過してから現れる可能性があり、特にクリオグロブリン血症や「高リスク」表現型の患者では、長期的なサーベイランスが正当化される。
原発性シェーグレン症候群の免疫学的プロファイルは、非定型ANAの存在を強調している。抗セントロメア陽性の原発性シェーグレン症候群患者のサブセットは、年齢が高く、レイノー現象およびシックな角結節炎の頻度が高く、抗Ro/SSAおよび抗La/SSB、リウマチ因子、白血球減少症および高ガンマグロブリン血症の割合が低い、シェーグレン症候群と全身性硬化症の間で重なる臨床表現型を示す[159,299]。ほとんどの場合、これらの患者のうち少数派は真性の全身性硬化症に進行するようである。抗環状シトルリン化ペプチド(抗CCP)陽性(患者の3~10%にみられる)は、関節症状の頻度の増加または関節リウマチ(RA)との重複と関連している [159,277]。抗ミトコンドリア抗体(1.7-13%)および抗平滑筋/抗肝腎ミクロソーム抗体(30-62%)の存在は、原発性胆汁性肝硬変および自己免疫性肝炎との重複と関連している[159]。
6.3. ダメージの発生
疾患損傷は、疾患活動、異所性治療、または併存疾患に起因する不可逆的な機能的または構造的変化が経時的に付加されたものとして定義されることがある。
原発性シェーグレン症候群に関連する損傷を定量化するために2つのスコアが存在する:SS Disease Damage Index (SSDDI) [296]およびSS Damage Index (SSDI) [297]。SSDDIは、6つの臓器領域(口腔、眼球、神経、胸膜肺、腎、リンパ増殖性)に影響を及ぼす18の不可逆的損傷のリストで構成されており、重症度で加重した9つの項目に分けられている。SSDIは、27項目からなる非加重チェックリストで、眼の損傷、口腔の損傷、全身の損傷の3つのリストに分類されている。全身の損傷は、さらに神経、腎、肺、心血管、消化器、筋骨格系、悪性腫瘍の7つの領域に細分化されている(表4)。
UCLH Sjögren’s Clinicに通院している原発性シェーグレン症候群患者148人を10年間追跡調査したレトロスペクティブ研究では、Krylovaらは、患者の28.3%、36.7%、45%が、それぞれ1年後、5年後、10年後にSSDI損傷(この研究では評価されなかった口腔損傷を除く)を示したことを明らかにしている[300]。最も関与している項目は、眼領域、耳下腺腫脹、悪性腫瘍である。これらの結果から、原発性シェーグレン症候群患者は、炎症性の負担が大きく、免疫抑制剤を使用しているループス患者よりも、異なるスコアで計算された時間経過に伴うダメージの蓄積が少ないことが示唆された [300]。
155人の原発性シェーグレン症候群患者を用いた別のレトロスペクティブ研究では、損傷を受けた患者の総増加率は1年後に28%、3年後に44%、5年後に74%、10年後に83%であり、SSDDIとSSDIの間には良好な相関関係があることが示された[301]。より具体的には、歯の喪失および/またはカリエス、唾液流障害、角膜潰瘍、涙流障害がそれぞれ49.5%、34%、22.6%、11%の患者で報告された。当然のことながら、13.5%の患者で観察された全身的な損傷は、基底部のESSDAI、低C4およびリンパ球減少症と相関していた。同様に、14%の患者で検出された持続的な唾液腺腫脹は、全身活動およびB細胞増殖の(生物)マーカー(診断時年齢の低下、抗Ro/SSA陽性、クリオグロブリン血症、低C4,高ガンマグロブリン血症およびリンパ球減少症)と関連していた。診断後10年の時点でリンパ増殖性障害は4.5%、悪性腫瘍は9%で検出された[301]。
6.4. 不快感と障害
シッカ症候群は障害を起こし、口腔および/または眼球乾燥、全身活動、疼痛、疲労および日中の傾眠、不安および抑うつ症状に関連する著しい機能状態障害と関連している可能性がある [302,303,304]。シッカ症候群の客観的評価は症状との相関性が低く、時間の経過とともに一般的に安定している [305]。シッカ症候群は、関連する症状のほかに、嗅覚、味覚、そう痒症、声、嚥下および性機能にも悪影響を及ぼす [306,307]。疲労および疼痛はともに生活の質の低下および心理的苦痛と相関している[307]。83人の患者を含むオランダの研究では、広範な疼痛を有する患者の34.9%が抗La/SSB陰性であることが多く、すべての自己抗体(ANA/SSA/SSB/RF)で血清陰性であることが多く、腺外症状が統計的に少なかった[308]。イタリアの100人の原発性シェーグレン症候群患者を対象とした別の研究では、広汎性疼痛の有病率は22%であり、この表現型は全身性および免疫学的症状(高ガンマグロブリン血症、リウマチ因子、フォーカススコア≧1)の減少と統計的に関連していた [309]。したがって、原発性シェーグレン症候群患者のサブセットは、内臓病変は低いが、腺症状に関連した重大な罹患率および重大な心身症的負担を伴う臨床表現型を呈するようである [302,310]。診断時、患者の4人に1人は仕事ができない。この数字は1年後には3人に1人以上に増加する。2年後の就労障害は40%であり、線維筋痛症のパターン、診断時の年齢、就労不能と関連している[314]。
EULAR SS Patient Reported Index(ESSPRI)は、乾燥、(四肢)疼痛、疲労の自己評価である3つの視覚アナログ尺度(VAS)の平均値として算出されたコンセンサス指標であり、原発性シェーグレン症候群における患者の症状を簡単に測定することができる[295]。慣例では、患者が許容できる症状状態とは、ESSPRIが5/10未満であり、臨床的に重要な改善が少なくとも1ポイントまたは15%減少した場合の最小改善であると定義されている。ESSPRIスコアは、Patient Global Assessment [PGA] [295]や、Profile of Fatigue and Discomfort [PROFAD] [295]、Sicca Symptoms Inventory [SSI] [295]、Health Assessment Questionnaire [HAQ] [315]、Short Form 36 health survey [SF-36] [302]、time trad-off values [TTO]、EuroQol5D VAS [316,317]など、より複雑で時間のかかるスコアと相関している。非常に興味深いことに、TEARS研究に含まれる120人の患者からのベースラインデータを使用した研究では、たとえESSPRIとESSDAIの間にわずかな相関があったとしても、多変量モデルではESSPRIがQOLスコアSF-36に関連する唯一の決定因子であることが明らかにされている[318]。したがって、ESSPRIスコアは、良好な臨床スクリーニングおよびモニタリングツールであると同時に、原発性シェーグレン症候群に関連する “Sicca Asthenia Polyalgia” Syndrome(表4)に対する治療的介入の有効性を研究するための良好なサロゲートエンドポイントでもある。
したがって、活動性スコアは低いが障害性のあるシッカ症候群の軽症例では当然のことながら、気配りの行き届いた多面的な症状管理による患者のQOLの向上に焦点を当て、最も障害のある患者には集学的な管理プログラムを提供することが重要である。7. 治療法
シェーグレン症候群の病態生理の理解が進んでいるにもかかわらず、シェーグレン症候群の治療は依然として期待外れであり、本質的には緩和的である。全身性の活動性は、乏しいエビデンスに基づいて免疫抑制剤で治療されている。原発性シェーグレン症候群の局所または全身活動による障害と関連した症状は、定義上不可逆的であり、免疫抑制剤による治療では改善されないため、特定されるべきである。過去5年間で、原発性シェーグレン症候群の管理はEULAR [210]、英国リウマチ学会および国立医療・介護優良性研究所(NICE)[319]、ブラジルリウマチ学会[320]、自己免疫疾患研究チーム[321]およびシェーグレン症候群財団[322]のガイドラインで取り上げられていた。ケアのための主要な原則を以下にまとめる。
7.1. シッカ症候群と非嚢胞性の発現
この疾患は免疫不全に起因するものであるにもかかわらず、免疫抑制剤による治療は、シッカ症候群と非膵臓特異的症状(非炎症性の広範囲の慢性疼痛、疲労)の治療において、十分なリスクとベネフィットのバランスに関連した十分な有効性が示されていない。治療は主に対症療法と外分泌異常症に起因する合併症の予防または治療に重点が置かれている(表5)。
表5 ドライアイに関連する症状に対する現在の治療法
| 唾液腺の関与 | 涙腺の関与 | 皮膚および膣粘膜の関与 | |
|---|---|---|---|
| 自己治療 |
|
|
|
| 節約する |
|
||
| 交換 |
|
|
|
| 刺激する |
|
|
|
| 合併症の予防と管理 |
カンジダ感染症の場合
腺が腫れている場合
|
|
口腔乾燥に対する治療的アプローチは、ベースラインの客観的および主観的な唾液分泌低下症および口腔乾燥症の重症度によって推進されなければならない。この目的のために、現在のガイドラインでは、非刺激(UWSF)および刺激性唾液流量(SWSF)を測定するか、唾液シンチグラフィを使用してベースライン唾液腺機能を評価することを推奨している。主観的な口腔乾燥の影響は、ESSPRIスコアの一部として、単純なVisual Analogue Scaleで評価される。EULARガイドラインでは、ドライマウスの管理に対するアルゴリズム的アプローチを提案している:UWSF < 0.1 mL/minの患者は、SWSFに基づいて軽度(>0.7 mL/min)中等度(0.1~0.7 mL/min)または重度の機能障害(<0.1 mL/min)に分類されている。軽症例に対しては、セルフケアのアドバイスや非薬理学的刺激が第一選択療法として提案されている[210]。薬物学的刺激(ピロカルピン1回/osまたは洗口剤、セビメリン1回/os)は、中等度の症例(唾液腺機能が残存している)または基本的な推奨事項に反応しなかった軽度の機能障害患者には、ファーストライン治療に加えて選択される治療法である。唾液代替療法は、機能が残存していない患者、または反応しない患者の第3ライン治療として予約されている。
唾液腺に影響を及ぼすエクソクリノパシーの口内合併症としては、虫歯の形成、歯周病、カンジダ感染症、膿瘍やリチア症に関連した腺腫脹などが挙げられる。したがって、患者さんが非の打ちどころのない歯科衛生を採用し、歯科専門家による年2回以上の評価を受けることが強く推奨される。局所的なフッ化物をベースとした治療を行うことができる。カンジダ単純感染症(目に見える白いプラーク)には、ニスタチン洗口液を7日間投与する。再発した場合は、1週間の予防治療を8週間ごとに繰り返すこともある。舌または口腔内の紅斑感染症には、フルコナゾール50mgを10日間投与する。角状口唇炎には、ミコナゾールを口の両側に2週間、局所的に投与する。膿瘍や口唇炎の病変がある場合は、抗生物質による治療が可能であり、口内科医の関与が必要である。腺腫脹の場合、感染性または機械的原因が見つからない場合は、原発性新生物、疾患の全身活動性(ESSDAIでスコア化されたもの、サイアレンドスコピーによるグルココルチコイドin loco、肛門周囲または筋肉内での治療)リンパ腫性合併症の出現を区別しなければならない。
ドライアイの管理は、涙膜の破れの促進と涙の組成が過剰になることによる角膜および結膜上皮の損傷に起因する角結膜炎(角結膜炎)の客観的および主観的な重症度によっても判断されなければならない。EULARガイドラインでは、患者を非重症または重症の角結膜炎に分類するために、Ocular Staining Score(OSS)スコアとOcular Surface Disease Index(OSDI)質問票に基づいたアルゴリズムアプローチを提案している[210]。英国リウマチ学会は、Schirmer’s test、Break Up Time(BUT)および眼球染色に基づいて3つのカテゴリー(軽度、中等度、重度のドライアイ)に分類することを推奨している[319]。ドライアイのすべての患者に対する第一選択の治療法は、メチルセルロースまたはヒアルロン酸を含む防腐剤の入っていない人工涙液の点滴と、夜間の軟膏の点滴である。DREAMの研究では、12ヶ月以上の間、n-3脂肪酸のサプリメントを使用しても、ドライアイ患者のOSDI、染色スコア、BUTまたはSchirmerテストは、オリーブオイルと比較して改善されない[323,324]。これらの治療法は、客観的なパラメーターの改善とは関連していないが、両群での実質的な主観的な改善は、ドライアイの管理に毎日ティースプーン1杯のオリーブオイルを使用すべきであることを示唆している[325]。ドライアイの原因は涙の分泌量の減少であるが、メイボミア腺の機能不全も関連している可能性があり、涙膜の蒸発を防ぐ脂質層を再構成するために、ホットパッドやリポソームスプレーを用いた瞼のマッサージを毎日行うことで治療しなければならない。持続性のメイボーム性炎症と眼瞼炎の患者には、メタロマトリクスプロテイナーゼ阻害剤としてドキシサイクリン50mgを1日1回3ヶ月以上投与することが有効である。重症角結膜炎の難治例では、眼科医の厳重な管理のもと、NSAID-、グルココルチコイド-、シクロスポリン含有点眼薬による局所治療を行うことができる。血清性点眼薬、経口または局所的ムスカリン作動薬、ライフテグラスト含有点眼薬、涙栓挿入による救護療法は、専門的な環境で評価されなければならない。
疾患修飾抗リウマチ薬(DMARD)は2種類のみで、シッカ症候群に有意な効果があることが示されている。メトトレキサート(メトトレキサート)は小規模な非対照試験 [326] で、ミゾリビン(日本のDMARD)は2つのコホート研究 [327,328] である。生物学的治療に関しては、インフリキシマブ、エタネルセプト、ベリムマブ、トシリズマブは、それぞれのRCTで外分泌腺機能に対する好ましい効果を示すことができなかった。”Abatacept Sjögren Active Patients” (ASAP)のアバタセプトに関するプルーフ・オブ・コンセプト試験では、ESSPRIとBUTには有意な改善が認められたが、SWSFには効果が認められなかったが、別の試験ではESSPRIとSWSFには効果が認められなかった。すべてではないが、いくつかの無作為化試験では、リツキシマブで外分泌機能と乾燥の改善が認められている。120名の患者を対象としたTEARS試験では、6-16-24週の時点で4つのVAS(疲労、疼痛、乾燥、PGA)のうち少なくとも2つのVASが30%以上改善することを目標としているが、主要評価項目は6週目にのみ達成され、それ以降は効果が認められなくなっている。乾燥度VASは6週目から24週目まではプラセボ群と統計的に差があるが、臨床的に有意な低下を達成した群はなかった。他の大規模試験であるTRACTIシェーグレン症候群は、48週目に口腔乾燥と疲労VASを30%以上改善することを主要エンドポイントとした133人の患者を対象にリツキシマブの効果を検討したものであるが、刺激されていない唾液流量を除いて、どのアウトカム指標においても有意な改善は認められなかった。しかし、この介入は費用対効果が高いとは思えない。これらの違いの臨床的意義はまだ決定されておらず、様々なガイドラインに従って解釈されている。Sjögren’s Syndrome Foundationのみが、sicca症候群の救済療法としてリツキシマブを使用することを提案している[322]。
原発性シェーグレン症候群患者では、一般的な非特異的症状(非炎症性筋骨格系疼痛および疲労)に関する訴えは一般的であり、臨床医にとっては困難なものである。この文脈では、鑑別診断が重要である。他の疾患(例えば、甲状腺機能低下症、低コルチゾール症、変形性関節症、うつ病、新生物)の非特異的な症状、または疾患の全身活動に関連した誤解を招く症状(例えば、筋炎、炎症性関節痛または関節炎、尿細管病変による低カリウム血症または骨軟化症、小線維ニューロパチーまたはリンパ腫)を除外しなければならない。二次的な原因が特定されない場合、この線維筋痛症様の症状は、そのように 治療することができる[329]。これらは、ESSPRIスコアまたはProfile of FatigueやBrief Pain Inventoryなどの標準化されたスコアを用いて定量化し、モニタリングすることができる。慢性疼痛の生物心理社会モデルに基づく教育と管理、ライフスタイルの適応、睡眠管理戦略、および適度な身体活動の実践は、疲労と疼痛の管理の基礎である。多くの患者がSSサポートグループに参加することで利益を得ていると報告している。薬物治療が必要な場合は、従来の鎮痛剤(アセトアミノフェンまたはNSAID)を処方する。抗うつ薬や抗けいれん薬は、慢性の筋骨格系や神経障害性疼痛の場合、共鎮痛薬として検討されることがあるが、これらの薬剤の抗コリン作用を念頭に置いておくと、シックア症候群を悪化させる可能性がある。オピオイドは慢性疼痛患者には適した治療法ではない。DHEAの補給は推奨されない。
経験則として、エビデンスが乏しいため、非特異的な全身症状の治療には全身免疫調節薬を使用すべきではない。現在利用可能な生物療法では、アバタセプトとベリムマブは疲労および疼痛VASに対する効果を示すことができなかった。リツキシマブに関するデータは相反するものである。3つのRCTで疲労VASの改善が認められたが、大規模なTRACTISS試験では認められなかった。17人の患者を対象とした第2相RCTでは、24週間後の疲労VASの20%以上の改善、24週後の疲労VASの改善、または24週後の疲労VASの30%以上の改善を示すことができなかった。著者らは、治療群ではベースラインと比較して統計的に有意な疲労VASの改善のみを報告しているが、プラセボ群では統計的に有意な差に達しなかった[330]。他の2つの研究では、初期の原発性シェーグレン症候群と活動性疾患を有する患者がRTXで治療された場合、治療後の異なる時点でプラセボと比較して疲労VASの有意な改善が示された[331,332]。すべてのRCTで、リツキシマブは疼痛VASの改善とは関連していないことが示されている。アナキンラの疲労に対する効果を調査しているRCTでは、主要エンドポイントには達していないものの、VAS疲労の有意な改善が示されている[333]。救済療法としてのDMARDや生物学的治療の適応外使用は、現在のところ、この適応症では主流の推奨ではない。しかし、いくつかのガイドラインでは、主に「経験に基づく医療」に基づいて、筋骨格系の不定愁訴や疲労を再発している患者にヒドロキシクロロキンの臨床試験を推奨している。ブラジルリウマチ学会のシェーグレン症候群委員会は2015年のガイドラインで、疲労(ただし、シッカ症候群ではない)管理のためのレスキュー療法としてリツキシマブを使用する可能性を強調している[320]。
7.2. 全身性の症状
全身性疾患活動に関連した内臓症状の管理は、現在のところ、まれなランダム化比較試験、コホート研究または症例報告のみに基づいている [334]。治療レジメンは、しばしば全身性エリテマトーデス(SLE)関節リウマチ(RA)混合クリオグロブリン血症、または特発性臓器特異的自己免疫疾患の管理から借用される。
治療レジメンは、疾患の臓器特異的な病変と重症度に合わせて調整されなければならない。このアプローチでは、臓器ごとに疾患の活動性や既存の障害の有無を調べる必要がある。この目的のために、ESSDAIスコアは目安として使用されるかもしれないが、原発性シェーグレン症候群のすべての全身症状を考慮に入れているわけではない[210]。経験則として、中等度または重度の臓器活動(ESSDAIスコアで定義される)または中等度の全身活動(ESSDAI≧5)の患者にのみ、全身免疫抑制療法が行われる。軽度に分類される臓器症状は、通常、セルフケアのアドバイス、局所治療、または鎮痛薬(炎症性関節痛にはNSAID、神経障害性疼痛には共痛薬)のみを必要とする。治療に失敗した場合は、臨床症状に応じて低用量コルチコステロイド治療や従来のDMARDを検討する。
免疫抑制療法を必要とする症例では、臓器障害の迅速なコントロールと機能の温存のために、導入・寛解の二相性レジメンが推奨される[210]。コルチコステロイド療法は、中等度から重度の全身症状に対するほぼ必須の治療法である。現在までのところ、原発性シェーグレン症候群においてステロイドを含まないレジメンは研究されておらず、発表されているレジメンの95%は、単独または免疫抑制剤との併用によるコルチコステロイド療法を含んでいる[210]。免疫抑制療法が処方される場合、通常、コルチゾンを回避するか寛解誘導剤として、ヒドロキシクロロキン、メトトレキサート、その他の従来のDMARDs(レフルノミド、サラゾピリン)マイコフェノレートモフェチル、シクロスポリンなどの従来の広スペクトルの免疫抑制剤が使用されている。免疫抑制剤の選択は、正面からの比較がないため、主に臨床医の経験と特発性またはループス関連疾患で使用される治療レジメン(皮膚および関節病変では ヒドロキシクロロキンおよびMTX、肺病変または腎病変ではAZA、CyAまたはMMF)に基づいて行われる。重度の生命または臓器を脅かす症状(中枢神経系の病変、糸球体腎炎)の場合は、一般に、寛解誘導剤としてメチルプレドニゾロンパルス療法とアルキル化剤(通常はシクロホスファミドIVまたはPO、まれにクロラムブシル)の併用を含む積極的なレジメンが必要である。神経障害や筋炎では免疫調節剤としてIVIGが使用される。生物学的治療(主にリツキシマブ)は、一般的に第3ラインのレスキュー療法としてのみ行われる。この規則の例外は、クリオグロブリン血症に関連した症状の場合で、免疫抑制剤としてリツキシマブが選択され、コルチコステロイド療法との併用や、生命を脅かす症例ではプラスマフェレーシス療法が提案されている。他の自己免疫疾患と同様に、コルチコステロイド療法は、寛解を維持しつつ、できるだけ短い期間で超生理的線量を投与することを保証するテーパリングレジメンを用いて推論されるべきである。慢性的なコルチコステロイド療法の合併症には積極的に対処しなければならない。
ヒドロキシクロロキンは、主に皮膚や関節に影響を及ぼす中等度の全身症状に対する第一選択薬として一般的に使用されている。原発性シェーグレン症候群は「粘膜の狼瘡」と考えられることがあるため、原発性シェーグレン症候群とSLEの類似性に基づいて使用されている。SLEとは対照的に、原発性シェーグレン症候群の全身症状に対するエビデンスは実際には存在せず、完全に経験的なものである。24週間にわたるヒドロキシクロロキンの効果を実証しようとした最初のJOQUER試験では、主要評価項目(3つのVAS(乾燥、痛み、疲労)のうち2つのスコアが0週目から24週目までの間に30%以上減少した)を達成できなかった。[335]. さらに最近行われた2週間のRCTでは、BUTテスト、Schirmerテスト、角膜染色スコア、OSDIスコアにヒドロキシクロロキンの効果は認められなかった[336]。これらのRCTは、本疾患の全身症状に対する本剤の効果を調査するために設計されたものではなく、患者数も少ないのであるが、高ガンマグロブリン血症は統計的に有意に改善した[335,336]。
7.3. 原発性シェーグレン症候群関連リンパ腫
リンパ腫の発生は、臨床的にスクリーニングしなければならない合併症であり、特にリスクのある患者では(上記参照)。固くて痛みのない腺性の腫脹が出現した場合は、自然に消失しない場合は調査しなければならない。リンパ腫を発見するために選択される検査は、ステージングのための主要唾液腺のMRI、胸部、腹部、骨盤のCT、または1回の検査で全身を調べるPETスキャンである。リンパ腫を有する原発性シェーグレン症候群患者には、組織型、病変の程度、全身症状に応じた腫瘍専門医による個別化された治療が必要である。
7.4. 産科的考察
理想的には、出産可能年齢の原発性シェーグレン症候群患者は、治療法と血清学的プロフィール(抗Ro/SSA、抗La/SSB、抗リン脂質パネル)を見直すことを目的とした妊娠前の診察を受けるべきである。低用量アスピリンは、胎盤着床を促進するために検討することができる[319]。抗Ro/SSA陽性の母親は、専門のセンターで胎児超音波検査を定期的に受けるべきである[210,319]。新生児心房室ブロックの予防的治療として、ヒドロキシクロロキンを用いた治療が行われることがあるが、この薬剤は妊娠との相性が良いためである[210]。追跡超音波検査で伝導障害が認められた場合は、グルココルチコイド(IVIGを併用または併用せず)によるレスキュー療法を試みてもよい [210]。出生時の心房室ブロックの場合は、速やかにペースメーカーを留置しなければならない。
7.5. 標的治療。革命か幻滅か?
標的治療は近年、特にRAなどの慢性炎症性リウマチ、およびSLEや血管炎などの全身性疾患において、リウマチ学に革命をもたらしてきた。原発性シェーグレン症候群に関しては、多くの標的治療法が試験されているか、現在パイプラインに入っている。残念ながら、RAの分野で知られているような革命はまだ起きていない。これらの標的治療薬を図4に示し、表6,表7,表8,表9,表10,表11,表12にまとめた。
図4 原発性シェーグレン症候群で研究されている(研究されている)標的薬の総覧
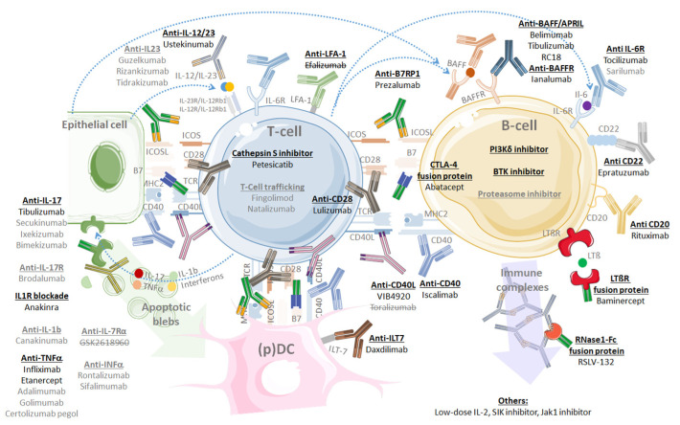
治療クラスは太字で示されている。バイオセラピ ーマや低分子は、原発性シェーグレン症候群で1つ以上の試験が行われている場合は黒で、存在するが原発性シェーグレン症候群での試験が行われていない場合はグレーで表示されている。打ち消し線で囲んだ名前は、許容できない副作用のため、またはポートフォリオの優先順位を決定したために開発が中止された医薬品である。
表 6 原発性シェーグレン症候群におけるB細胞標的薬パート1:B細胞特異的分化クラスター(CD)に対するモノクローナル抗体
| 薬 | トライアル(参考) | 包含基準 | 被験者数 | 年齢(年) | 病気の期間(年) | 平均ESSDAI | 主な結果 | 結果 | 効果(統計的に有意) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Drg | Ctrl | シェーグレン症候群 | 繊維のような | 全身 | ||||||||
| リツキシマブ抗CD20 | NCT00363350
フェーズI / II [ 343 ] |
AECG基準
RF +およびSSaおよび/またはSSb + SWS> 0.15 mL / min |
20 | 10 | 43
±11 |
5.25
±4.17 |
8
(4–13) |
SWS⇧48w | 会った | SWS /UWS⇧LG
テスト⇧ シルマー= しかし= |
SF36⇧
MFI⇩ |
血管炎⇩ |
| フェーズIII
[ 330 ] |
AECG基準
SSaおよび/またはSSb + F- VAS≥5 / 10 |
8 | 9 | 51
(22–64) |
7.25
(1–18) |
na | ⇩> 24wでF-VASの20%。
⇩24wでのF-VAS; ⇩24wでF-VASの> 30% |
会わ
なかった会わなかった会わ なかった |
UWS =
シルマー= |
F-VAS⇩
PROFAD⇩ P-VAS = SOC-SF36⇧ |
腺⇩ | |
| フェーズIII
[ 332 ] |
AECG基準
SSaおよび/またはSSb + 疾患期間≤2y2/ 5 [PhGA> 50mmまたはESSDAI≥6またはsubESSPRI≥5] |
19 | 22 | 40
(27–53) |
1
(1–2) |
20
(6–41) |
120WまでのΔESSDAI | 会った
24ワットから 120ワットまで |
D-VAS⇩
シルマー⇧ UWS⇧ |
P-VAS =
F-VAS⇩ |
ESSDAI⇩ | |
| NCT00740948フェーズIIIの
TEARS [ 331 ] |
PhGA
、痛み、倦怠感、乾燥、および生物学的に活性な、または1つの腺外症状または耳下腺肥大について2 / 4VAS≥5/ 10のAECG基準。 |
63 | 57 | 52.9
±13.3 |
4.6
±4.8 |
10
±6.9 |
⇩6-16-24wで少なくとも2 / 4VASの30% | 6ワットで会っ
満たされていない 16〜24ワットで |
D-VAS⇩Schirmer
= |
P-VAS =
F-VAS⇩ |
ESSDAI =
腺= 関節= |
|
| フェーズIII
トラクティス [ 344 ] |
SSa +
UWS> 0 mL / minF -VASおよびD-VAS> 5/10の原発性シェーグレン症候群 |
67 | 66 | 54
±11.5 |
5.7
±5.4 |
5.7
±4.5 |
⇩48wで30%のD-VASおよびF-VAS | 会わなかった | UWS⇧
ESSPRI = D-VAS = |
F-VAS =
SF36 = PROFAD = |
ESSDAI⇩ | |
| エプラツズマブ抗CD22 | 事後
フェーズI / II エンボディ [ 337 ] |
SSa +および
SS診断を伴うSLE |
31
+ 41 |
40 | 46.4
±12.3 |
5.1
(0–34) |
na | BICLA at 48w
ΔBILAG at 48w ΔSLEDAI at 48w ΔPhGA at 48w |
met
met not met not met |
na | na | BILAG ⇩ |
AECG=アメリカヨーロッパコンセンサスグループ、Drg=薬物/治療群、Ctrl=対照群、Fibro-like=疲労や広汎性疼痛などの線維筋痛症様症状、FR+=リウマチ因子の存在、SSa/SSb=抗Ro/SSa、抗La/SSb、SWS=刺激された唾液全体の流れ。UWS=無刺激全唾液流量、LGテスト=リサミングリーンテスト、BUT=ブレイクアップタイム、SF36=ショートフォーム36健康調査スコア、Soc-SF36=SF36スコアの社会的成分、Phys-SF36=SF36スコアの身体的成分、MFI=多次元疲労インベントリスコア、F-VAS=疲労視覚アナログスケール。Schirmer = Schirmer test、P-VAS = Pain visual analogue scale、PROFAD = Profile of Fatigue and Discomfort、DSST = Digit Symbol Substitution Test、ESSDAI = EULAR SS disease activity index、D-VAS = Dryness visual analogue scale、PhGA = physician global activity visual analogue scale、subESSPRI = P-VAS。D-VASまたはF-VAS、BILAG = British Isles Lupus Assessment Group index、BICLA = BILAG-based Combined Lupus Assessment、ESSPRI = EULAR SS Patient Reported Index、SAEs = 重篤な副作用、SGUS = 唾液腺超音波、Ig = 免疫グロブリン、⇩⇧ = 減少/増加、Δ = 差。
表7 原発性シェーグレン症候群におけるB細胞標的薬パート2:BAFF/APRILシステム標的療法
| 薬 | トライアル(参考文献) | 包含基準 | 被験者数 | 年齢(年) | 病気の期間(年) | 平均ESSDAI | 主な結果 | 結果 | 効果(統計的に有意) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Drg | Ctrl | シェーグレン症候群 | 繊維のような | 全身 | ||||||||
| ベリムマブ抗BAFF | NCT01160666
フェーズII BELISS |
AECG基準
SSaおよび/またはSSb + および全身合併症またはB細胞活性化または初期疾患(≤5年) |
30 | – | 49.5
±6.5 |
5.7
±5.6 |
8.8
±7.4 |
⇩28wで2 / 5VAS
|
60%の応答 | ESSPRI⇩D
-VAS⇩UWS = Schirmer = |
ESSPRI⇩P
-VAS= F-VAS = SF36 = |
ESSDAI⇩
腺⇩ |
| 以前の研究のフォローアップ | 15 | – | 40.2
±11.8 |
5.9
±5.7 |
3.8
±3.1 |
28〜52wのIdem | 86.7%
安定した応答 |
ESSPRI⇩D
-VAS⇩UWS = Schirmer = |
ESSPRI⇩P
-VAS= F-VAS = Phys-SF36⇧ |
ESSDAI⇩
腺⇩ 関節⇩ 生物学的⇩ |
||
| RC18TACI-
注入タンパク質 |
NCT04078386
フェーズII [ 345 ] |
AECG基準
SSa + ESSDAI≥5 |
30 | ? | ? | ? | 24wでのΔESSDAI | 2020年12月 | セカンダリエンドポイント | セカンダリエンドポイント | 主要評価項目 | |
| リツキシマブ
抗CD20 + ベリムマブ 抗BAFF |
NCT02631538
フェーズII [ 346 ] |
AECG基準
SSaおよび/またはSSb +ESSDAI≥5UWS > 0 mL / minD-VAS≥5 / 10 |
70 | ? | ? | ? | 104wでの
SAE104wでのAESI |
2020年6月に調査が完了しました | セカンダリエンドポイント | na | セカンダリエンドポイント | |
| チブリズマブ(LY3090106)
抗BAFF + 抗IL-17 |
NCT02614716
フェーズI [ 347 ] |
AECG基準
SSaおよび/またはSSb + |
32 | ? | ? | ? | 197dのSAE | 未
公開 |
na | na | na | |
| Ianalumab
(VAY736) Anti-BAFFR |
NCT02149420
フェーズII [ 348 ] |
AECG基準ANA≥1
: 160SSaおよび/またはSSb + ESSDAI≥6UWS > 0 mL / min |
6 + 12 | 9 | 50.5
±12.16 |
? | 12.5
(6、31 ) |
12wでのΔESSDAI | 会わなかった | D-VAS⇩ | SF-36 =
MFI⇩F -VAS⇩ |
ESSDAI =
関節⇩ |
| NCT02962895
フェーズII [ 349 ] |
AECG基準
SSa + ESSDAI≥6(7つのドメインからのみ) |
195 | ? | ? | ? | 24wでの多次元疾患活動性の変化 | 2020年6月に調査が完了しました | セカンダリエンドポイント | セカンダリエンドポイント | 主要評価項目 | ||
表8 原発性シェーグレン症候群におけるB細胞標的薬パート3:他のB細胞の生存・機能経路を標的とした薬剤
| 薬 | トライアル(参考) | 包含基準 | 被験者数 | 年齢
(年) |
病気の期間(年) | 平均ESSDAI | 主な結果 | 結果 | 効果(統計的に有意) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Drg | Ctrl | シェーグレン症候群 | 繊維のような | 全身 | ||||||||
| LOU064BTK
阻害剤 |
NCT04035668
フェーズII ルイス [ 350 ] |
2016 ACR / EULAR基準
SSaおよび/またはSSb + ESSDAI≥6UWS > 0 mL / min |
252 | ? | ? | ? | 24wでのΔESSDAI | 2023年1月の推定研究完了 | セカンダリエンドポイント | セカンダリエンドポイント | セカンダリエンドポイント | |
| チラブルチニブ
(GS-4059) BTK阻害剤 |
NCT03100942
フェーズII [ 342 ] |
AECG基準
SSaおよび/またはSSb + ESSDAI≥4 |
38 | 37 | 55.8
±10.06 |
? | 10.4
±5.36 |
12wでのプロトコル指定の応答基準 | 会わなかった | ESSPRI = | ESSPRI = | ESSDAI = |
| BMS-986142BTK
阻害剤 |
NCT02843659
フェーズII [ 351 ] |
2016 ACR / EULAR基準
SSaおよび/またはSSb + ESSDAI≥6UWS > 0 mL / min |
5 + 6 | 7 | 51.2
±11.41 |
? | ? | 12wでのΔESSDAI | 未
公開 |
セカンダリエンドポイント | セカンダリエンドポイント | セカンダリエンドポイント |
| ブルトン型
BTK阻害剤 |
NCT04186871
フェーズII [ 352 ] |
2016 ACR / EULAR基準
中程度から重度の原発性シェーグレン症候群 |
? | ? | ? | ? | ? | 24wでのプロトコル指定の応答基準 | 2022年6月の推定研究完了 | na | na | 主要評価項目 |
| Baminercept
LT β -Rの 融合タンパク質 |
NCT01552681
フェーズII [ 353 ] |
2016 ACR / EULAR基準
UWS> 0.1 mL /min≥1 生命を脅かさない全身症状 |
33 | 19 | 52.0
±11.0 |
? | 3.1
±3.4 |
24wでのΔSWS | 会わなかった | D-VAS =
Schirmer⇧UWS = |
F-VAS = | ESSDAI = |
| パルサクリシブ(INCB050465)
PI3Kδ阻害剤 |
NCT03627065
フェーズII [ 354 ] |
AECG基準
SGUSスコア> 2SSa および/またはSSb + ESSDAI≥6 経口乾燥スコア≥5 。 |
10 | ? | ? | ? | 12wでのΔSGUSスコア | 未公開 | na | na | na | |
| セレタリシブ
(UCB5857) PI3Kδ阻害剤 |
NCT02610543
フェーズII [ 355 ] |
AECG基準FAN≥1
: 160SSaおよび/またはSSb + ESSDAI≥6 |
13 | 14 | ? | ? | ? | 12wでのΔESSDAI | 会わなかった | ESSPRI =
SWSF = Schirmer = |
na | ESSDAI = |
| レニオリシブ
(CDZ173) PI3Kδ阻害剤 |
NCT02775916
フェーズII [ 356 ] |
原発性シェーグレン症候群診断
SSaおよび/またはSSb + ESSDAI≥6、ESSPRI≥5SWS > 0.1 mL / min |
20 | 10 | 47.3
±13.07 |
? | ? | 12wでのΔESSDAI12wでの
SAE |
会わなかった | ESSPRI = | SF-36 =
MFI = |
na |
表9 原発性シェーグレン症候群におけるT細胞標的薬:共刺激受容体またはリガンド阻害
| 薬 | トライアル | 包含基準 | 被験者数 | 年齢(年) | 病気の期間(年) | 平均ESSDAI | 主な結果 | 結果 | 効果(統計的に有意) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Drg | Ctrl | シェーグレン症候群 | 繊維のような | 全身 | ||||||||
| アバタセプト
CTLA- 4Ig 融合タンパク質 |
NCT02915159
フェーズIII [ 357 ] |
2016 ACR / EULAR基準
SSa + ESSDAI≥5 |
92 | 95 | 52
±12.9 |
? | 9.4
±4.3 |
169dでのΔESSDAI | 会わなかった | ESSPRI =
SWS = |
ESSPRI = | ESSDAI =
DAS28⇩ |
| フェーズI / II
ASAP [ 358 ] |
AECG基準とESSDAI≥6
罹患期間≤5年間 ≥0.10 mL /分SWS SSaを及び/又はSSbを+又はFR + 耳下腺生検により証明します。 |
15 | – | 43
(32–51) |
11
(7–36) |
11
(8–14) |
24-48wでのΔESSDAI | 会った | ESSPRI⇩SWS
/ UWS = Schirmer =しかし ⇧ |
ESSPRI⇩ | ESSDAI⇩ | |
| NCT02067910
フェーズ IIIASAPIII [ 359 ] |
AECG基準およびESSDAI≥5
診断からの時間≤7年 |
40 | 39 | 49
±16 |
8
(4–14) |
? | 24wでのΔESSDAI | 会わなかった | ESSPRI⇩
FSFI⇧ DVAS = UWS = シルマー= |
倦怠感= | ESSDAI =
関節⇩ |
|
| イスカリマブ(CFZ533)
抗CD40 |
NCT02291029
フェーズIIa [ 360 ] |
AECG基準およびESSDAI≥6SSA
+またはFR +およびFAN≥1:320SWS≥0mL / min |
8 + 21 | 4 + 11 | 51.3
±13.5 |
? | 10.7
±4.6 |
12wでのSAE | 安全 | ESSPRI⇩UWS
= Schirmer = |
MFI =
SF-36 = |
ESSDAI⇩
関節⇩ |
| NCT03905525フェーズII
ツインズ [ 361 ] |
2016 ACR / EULAR基準
SSa + SWS> 0.01 mL / min、 P1:ESSDAI≥5またはP2ESSPRI≥5。 |
260 | ? | ? | ? | P1で
24wのΔESSDAIP2で24wのΔESSPRI |
2022年6月の推定研究完了 | 含まれるエンドポイント | 含まれるエンドポイント | 含まれるエンドポイント | ||
| VIB4920
MEDI4920 アンチCD40L |
NCT04129164
フェーズII [ 362 ] |
P1:ESSDAI≥5P2
:ESSDAI <5etESSPRI≥5 |
174 | ? | ? | ? | P1の
169dでのΔESSDAIP2の169dでのΔESSPRI |
2022年4月の推定研究完了 | 含まれるエンドポイント | 含まれるエンドポイント | 含まれるエンドポイント | |
| プレザルマブ(AMG557)
(MEDI5872) 抗B7RP1 |
NCT02334306
フェーズIIa [ 363 ] |
AECG基準およびESSDAI≥5SSa
および/またはSSb + FR +、クリオグロブリン血症または高ガンマグロブリン血症 |
16 | 16 | 50.7
±13 |
? | ? | 99dでのΔESSDAI | 会わなかった | ESSPRI = | ESSPRI = | ESSDAI = |
| ルリズマブ(BMS-931699)
抗CD28 |
NCT02843659
フェーズII [ 351 ] |
2016 ACR / EULAR基準
SSaおよび/またはSSb + ESSDAI≥5USW > 0.01 mL / min |
5 + 6 | 7 | 51.2
±11.41 |
? | ? | 12wでのΔESSDAI | 未公開 | セカンダリエンドポイント | セカンダリエンドポイント | 主要評価項目 |
表10 原発性シェーグレン症候群におけるT細胞標的薬:自己抗原提示を防ぐ治療法
| 薬 | トライアル
(参考) |
包含基準 | 被験者数 | 年齢
(年) |
病気の期間(年) | 平均ESSDAI | 主な結果 | 結果 | 効果(統計的に有意) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Drg | Ctrl | シェーグレン症候群 | 繊維のような | 全身 | ||||||||
| Petesicatib
RO5459072 カテプシンS 阻害剤 |
NCT02701985
フェーズIIa [ 364 ] |
AECG基準
SSaおよび/またはSSb + ESSDAI≥5ESSPRI≥5USW > 0.0 mL / min経口D- VAS≥5 / 10 |
38 | 37 | 52.2
±12.5 |
? | ? | 12wでΔESSDAI≥3 | 会わなかった | ESSPRI = | ESSPRI =
SF36 = |
ESSDAI = |
| エファリズマブ
抗LFA-1 |
NCT00344448
フェーズII [ 365 ] |
AECG基準
SSaおよび/またはSSb + |
6 | 3 | 53
±11.2 |
? | ? | 12wでのプロトコル指定の複合スコア | 他の試験での重篤な副作用による早期終了 | |||
表11 原発性シェーグレン症候群における抗サイトカイン標的薬の検討
| 薬 | トライアル | 包含基準 | 被験者数 | 年齢
(年) |
病気の期間(年) | 平均ESSDAI | 主な結果 | 結果 | 効果(統計的に有意) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Drg | Ctrl | シェーグレン症候群 | 繊維のような | 全身 | ||||||||
| アナキンラ
IL1Rアンタゴニストタンパク質 |
NCT00683345
フェーズII [ 333 ] |
AECG基準18〜80
年 西ヨーロッパ系 うつ病または併存症なし |
13 | 13 | 55
(36–80) |
5
(1–17) |
? | 4wでの疲労スコアのグループごとの比較 | 会わなかった | na | F-VAS⇩ | na |
| トシリズマブ
抗IL-6R |
NCT01782235
フェーズI / II ETAP [ 366 ] |
AECG基準
ESSDAI≥5 |
55 | 55 | 50.9(26–76) | ? | 11.5
(5–25) |
12WでΔESSDAI≥3
新しいアイテム無し ⇧≥1/ 10 PGA無し |
会わなかった | ESSPRI =
Schirmer = |
ESSPRI = | ESSDAI =
関節⇩ |
| インフリキシマブ
抗TNF |
フェーズIII
トリップ [ 367 ] |
AECG基準
2 / 3D-VAS、F-VAS、P- VAS≥5 / 10 |
54 | 49 | 54.4
±10.4 |
4.0
±5.5 |
na | ⇧10–22wで2/3 D-VAS、F-VAS、P-VASで30% | 会わなかった | SWS =
シルマー= |
SF-36 = | SJC =
TJC = |
| エタネルセプト
TNFR-Ig融合タンパク質 |
NCT00001954
フェーズII [ 368 ] |
1986年およびAECG基準
ESRまたはIgGレベルの上昇 |
14 | 14 | 55.5
(46、59 ) |
? | na | ⇧2/ 3原発性シェーグレン症候群ドメインで20%(プロトコル指定) | 会わなかった | D-VAS =
Schirmer = VB = SWS = |
na | na |
| ウステキヌマブ
抗 IL-12 / IL-23 (p40サブユニット) |
NCT04093531
フェーズI [ 341 ] |
2016 ACR / EULAR基準 | 15 | – | ? | ? | ? | 24WでのΔESSDAI | 2021年12月の推定研究完了 | na | セカンダリエンドポイント | 主要評価項目 |
| GSK2618960
抗IL-7Rα |
NCT03239600
フェーズII [ 369 ] |
AECG基準
SWS> 0.1 mL / min⇧Ig またはFR +またはANA≥1:320D-VAS≥5 / 10またはSchirmer <10 mm |
0 | – | – | – | 27wでのSAE | 撤退
の研究では、ポートフォリオの優先順位付けのために停止しています |
||||
表12 原発性シェーグレン症候群におけるその他の標的薬
| 薬 | トライアル(参考) | 包含基準 | 被験者数 | 年齢(年) | 病気の期間(年) | 平均ESSDAI | 主な結果 | 結果 | 効果(統計的に有意) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Drg | Ctrl | シェーグレン症候群 | 繊維のような | 全身 | ||||||||
| Daxdilimab
VIB7734 Anti-ILT7 |
NCT03817424
フェーズI [ 370 ] |
詳細不明 | ? | ? | ? | ? | 169dの
SAE169dのAESI |
2020年6月 | na | na | na | na |
| フィルゴチニブ
Jak1阻害剤 |
NCT03100942
フェーズII [ 342 ] |
AECG基準
SSaおよび/またはSSb + ESSDAI≥4 |
38 | 37 | 52.2
±10.54 |
? | 10.2
±6.23 |
12wでのプロトコル指定の応答基準 | 会わなかった | ESSPRI = | ESSPRI = | ESSDAI = |
| ランラプレニブ
(GS-9876) SIK阻害剤 |
NCT03100942
フェーズII [ 342 ] |
AECG基準
SSaおよび/またはSSb + ESSDAI≥4 |
38 | 37 | 56.2
±9.72 |
? | 10.5
±4.89 |
12wでのプロトコル指定の応答基準 | 会わなかった | ESSPRI = | ESSPRI = | ESSDAI = |
| RSLV-
132RNase1-Fc融合タンパク質 |
NCT03247686
フェーズII [ 371 ] |
AECG基準
SSA + インターフェロン署名 |
22 | 8 | ? | ? | ? | 99日目のインターフェロン遺伝子発現 | 未公開 | ESSPRI = | mPRO-
F⇧DSST⇩FACIT -F= ESSPRI = |
ESSDAI = |
| 低用量
IL- 2T-reg誘導 |
NCT01988506
フェーズII トランスレグ [ 372 ] |
原発性シェーグレン症候群診断 | 84-132 | ? | ? | ? | T-regパーセンテージ | 2022年2月の推定研究完了 | na | na | na | |
自己抗体の産生、胚中心、およびリンパ腫への進化におけるそれらの優勢な役割を考えると、B細胞の枯渇は、原発性シェーグレン症候群で研究されている治療メカニズムの一つである(表6,表7,および表8)。抗CD20リツキシマブRCTの混合結果に加えて、他の標的薬も研究されている。SLE患者で研究されている抗CD22 B細胞減少療法であるエプラツズマブは、EMBODY試験の事後分析において、シェーグレン症候群を有するSLE患者の全身活性にポジティブな効果を示した[337]。しかし、原発性シェーグレン症候群患者におけるESSDAIとESSPRIの両方に対する本療法の効果を評価するためにRCTを設計する必要がある。BAFF経路を遮断することを目的とした他のB細胞枯渇療法は、28~52週目にESSDAIとESSPRIのスコアにプラスの効果を示した[338,339]。しかし、プラセボに対するこれらの有望な結果の確認が必要である。BAFF経路を標的とした他の戦略も研究中である:RC18と呼ばれるTACI抗体融合タンパク質、リツキシマブ+ベリムマブのコンボ療法、チブリズマブ-抗BAFF抗体(ベリムマブ)と抗IL-17抗体(イクセキズマブ)のデュアル抗BAFF抗体-とイアナルマブ(抗BAFF受容体)である。これらの異なる試験の結果は 2020年中に期待されている。ブルトンチロシンキナーゼ阻害剤(4分子)LTßR融合タンパク質、PI3Kδ阻害剤(3分子)カテプシンS阻害剤によるB細胞標的薬は、現在のところ結論の出ないまま評価が進められている。多発性骨髄腫の治療に使用されるプロテアソーム阻害薬であるボルテゾミブは、難治性の原発性シェーグレン症候群の2例の報告で成功しているが、より大規模な研究は行われていない[236,340]。
T細胞は、外分泌腺のリンパ球浸潤内の局所自己免疫反応の調節と分極に中心的な役割を果たしている。また、T細胞の共刺激を阻害するバイオセラピ-により治療標的として利用されている(表9)。現在までのところ、原発性シェーグレン症候群にこれらの治療法を推奨する説得力のある結果は得られていないが、CD40リガンド(CD154)/CD40経路を標的とした研究がほとんど進行している。FingolimodやNatalizumabのようなT細胞の輸送を標的とした治療法は原発性シェーグレン症候群では研究されていない。
抗サイトカイン標的治療に関しては、抗TNF(インフリキシマブ、エタネルセプト)と抗IL-6受容体(トシリズマブ)を用いたRCTは陰性である(表11)。アナキンラは、主要な臨床エンドポイントには到達していないものの、統計学的に有意な疲労VASの低下を示した。抗IL-7Rα抗体であるGSK2618960の開発は、ポートフォリオの優先順位を決定したために中止された。現在のところ、抗IL-12/IL-23抗体であるウステキヌマブの24週目のESSDAIスコアに対する効果を主要評価項目としたRCTは1件のみであり、2022年に結果が出る見込みである[341]。
第II相試験では、Jak1阻害剤であるフィルゴチニブとSIK阻害剤であるランラプレニブは、ESSDAIとESSPRIスコアに有意な効果を示さなかった[342]。最後に、形質細胞性樹状細胞、RNase1-Fc融合タンパク質による免疫複合体、または低用量IL-2注射によるT-reg細胞の誘導を標的とした革新的な治療法が評価されている。これらの様々な治療法については、表12を参照されたい。
8. 結論
原発性シェーグレン症候群は、多形性の全身性自己免疫症状、腺性症状、頻繁に追加される心身症的要素、そして非ホジキンリンパ腫への進行の可能性を併せ持つ多面的な疾患である。その管理には2つの補完的な側面がある:乾燥、疲労、慢性疼痛に集学的に取り組むことで患者の生活の質を向上させることと、全身性の症状を治療して損傷を防ぎ、生命的・機能的予後を悪化させないようにすることである。原発性シェーグレン症候群は、その病態生理の理解は進んでいるものの、多くの疑問が残っており、他の自己免疫疾患と比較しても、治療法は残念な結果に終わっていない。10個のメッセージをお伝えする。
- 原発性シェーグレン症候群は、外分泌腺のリンパ形成細胞の浸潤によって特徴づけられる。シェーグレン症候群の原因は複雑であり、遺伝的、エピジェネティック、ホルモン、環境因子の組み合わせの影響を受けている。
- 発症機序は不明のままである。しかし、免疫系が介在する腺機能の低下、特に唾液腺と涙腺の機能低下は、ドライマウスとドライアイの一般的な症状を確実に説明している。この炎症性の環境では、T細胞が腺組織の直接的な破壊とB細胞の活性化を媒介し、自己抗体の産生につながる。20種類以上の自己抗体がシェーグレン症候群に関与している可能性があるが、シェーグレン症候群の診断に最もよく用いられるのは抗Ro/SSA、抗La/SSBである。
- 原発性シェーグレン症候群は、その腺組織に対するトロピズムのために、しばしばそのsicca症候群に縮小されるが、事実上すべての臓器に影響を与えうる全身性の疾患であることに変わりはない。これらの臨床症状は、様々な機序によるものであり得る:外分泌症による二次的な乾燥、標的臓器の周囲上皮リンパ球浸潤を伴う自己免疫性上皮炎、自己免疫性およびクローン性リンパ球増殖。
- 原発性シェーグレン症候群は、その蛋白質的で進んで陰湿な症状のために、時に認識が難しく、診断が10年以上遅れることがある。分類基準は研究目的でコホートを作成するために使用されるものであり、診断基準として盲目的に使用するのではなく、臨床での指針として使用すべきである。このような様々な理由から、原発性シェーグレン症候群の個別診断のための金本位は、専門の臨床医の意見であることに変わりはない。
- 血清組織学的な観点からは、SLEやSScl患者におけるいわゆる「二次性シェーグレン症候群」は原発性シェーグレン症候群とは異ならない。したがって、この歴史的な二分法を忘れることが望ましい。このようにして、臨床医は3つの落とし穴を回避することができる。(1)患者のQOLを低下させるSS関連症状を最小限に抑えること、(2)重複することで臨床表現型が変化する可能性があることを忘れること、(3)リンパ腫のリスクを忘れることである。
- 全般的な原発性シェーグレン症候群死亡率は低く、一般集団と同様であるが、患者のサブグループは、心血管イベント、固形臓器およびリンパ系悪性腫瘍、感染症に関連したより低い生命予後を有することになる。MALTリンパ腫の発生に関連するバイオマーカーは、主に、高揚したB細胞増殖および免疫複合体の産生に関連する徴候である。
- 原発性シェーグレン症候群の影響は、3つの臨床的次元に従って評価することができる。”sicca asthenia polyalgia “複合体、炎症性疾患活動性および構造的損傷である。これらはそれぞれESSPRI、ESSDAIおよびSSD(D)Iスコアによって評価される。全身性の症状がない場合でも、原発性シェーグレン症候群は障害を起こし、口腔および/または眼球乾燥、全身活動性、疼痛、疲労および日中の傾眠、不安および抑うつ症状に関連した重要な機能状態の障害と関連している可能性がある。
- シッカ無力症多動痛症」複合体に関連する症状の治療は、主に対症療法とリハビリテーションが行われる。現在までのところ、この適応症において良好なリスクとベネフィットのバランスを示した免疫抑制剤はない。
- 炎症性疾患の活動性に関連した症状の治療は、現在のところ乏しいエビデンスに基づいている。治療レジメンは、臓器別の病変や障害の重症度に合わせて調整されなければならない。軽度の症状の場合はヒドロキシクロロキンまたは局所コルチコステロイドで治療されるが、中等度から重度の全身病変の場合は全身コルチコステロイド療法が必要となり、広範囲の免疫抑制剤を併用するかどうかは別として、リツキシマブの使用が必要となる。リツキシマブは、クライオグロブリン血症の場合を除き、サードラインとしてのみ使用される。
- 近年、標的治療はリウマチ学に革命をもたらし、原発性シェーグレン症候群でこれまでに試験された数多くの分子は驚くべきものであるにもかかわらず、RAの分野で知られているような革命はまだ起きていない。
略語
- ACA 抗セントロメア抗体
- ACPA 抗シトルリン化タンパク質抗体
- ACR アメリカリウマチ学会
- AECG アメリカヨーロッパコンセンサスグループ
- AH 自己免疫性肝炎
- ANA抗核抗体
- 抗M3R 抗ムスカリン受容体3
- APRIL 増殖誘導リガンド
- ASAP「アバタセプト・シェーグレンアクティブ患者」試験
- アザチオプリン
- BAFF B細胞活性化因子
- BCR B細胞受容体
- BUTブレイクアップタイム
- CCP 環状シトルリン化ペプチド
- circRNA サーキュラーRNA
- ciRNA イントロニックcircRNA
- ClinESSDAI クリニカルESSDAIバリアント
- CPK クレアチンホスホキナーゼ
- CRISP-3 システインリッチ分泌タンパク質3 ()
- CTスキャン コンピュータ断層撮影
- CyA シクロスポリンA
- DAMPS 危険関連分子パターン
- DAP-キナーゼ プロアポトーシス死関連プロテインキナーゼ
- DHEA デヒドロエピアンドロステロン
- DHT ジヒドロテストステロン
- DLBCL びまん性大細胞型B細胞リンパ腫
- DMARD 疾患修飾型抗リウマチ薬
- DNMTs DNAメチル化酵素
- DREAM「ドライアイの評価と管理」研究
- エプスタインバーウイルス
- ecircRNA エキソンcircRNA
- EIciRNA エクソンイントロンcircRNA
- ELISA法 酵素免疫吸着測定法
- 耳鼻咽喉科
- ESSDAI EULAR シェーグレン症候群疾患活動指数
- ESSPRI EULAR シェーグレン症候群患者報告インデックス
- EULAR 欧州リウマチ対策連盟
- FASl Fasリガンド
- FDC 毛包性樹状細胞
- GC発芽中心
- ヒドロキシクロロキン ヒドロキシクロロキン
- HCV C型肝炎ウイルス
- HLH 血球貪食細胞性リンパ組織球症
- HTLV1 ヒトTリンパ球症ウイルスI型
- ICAM-1 細胞間接着分子1
- IF免疫蛍光
- IFNインターフェロン
- IgG,A,M 免疫グロブリンG,A,M
- IL- インターロイキン
- ILD 間質性肺疾患
- IRF インターフェロン調節因子
- 静脈内療法
- IVIG 静脈内免疫グロブリン
- 角結膜炎 鎌状角結膜炎
- LEMA 筋上皮性唾液腺炎
- LESAリンパ上皮性唾液腺炎
- LIP リンパ球性間質性肺炎
- LMP1 潜在膜タンパク質1
- lncRNA ロングノンコーディングRNA
- LPR 喉頭咽頭逆流症
- LSGラビアルSG
- MALT 粘膜関連リンパ組織
- MHC 主要組織適合性遺伝子
- MMF マイコフェノレートモフェチル
- MMP マトリックスメタロプロテアーゼ
- MPGN 中血管増殖性糸球体腎炎
- MRI 磁気共鳴イメージング
- MS多発性硬化症
- MSGB マイナー唾液腺生検
- MTX メトトレキサート
- NAC N-アセチルシステイン
- NF-κB 活性化B細胞の核内因子κ-光鎖エンハンサー
- 非ホジキンリンパ腫
- NICE 国立医療・ケア・エクセレンス研究所
- NMOSD 視神経脊髄炎スペクトラム障害
- NOD 非肥満糖尿病患者
- NSAID 非ステロイド性抗炎症薬
- NSIP 非特異的間質性肺炎
- リウマチグループにおけるOMERACTアウトカム対策
- OSDI眼表面疾患インデックス
- OSS眼球染色スコア
- PAMPs 病原体関連分子パターン
- PBC原発性胆汁性肝硬変
- PDC 形質細胞樹状細胞
- PDL1 プログラムされた死のリガンド1
- PETスキャン 陽電子放射断層撮影
- PGA患者グローバルアセスメント
- PIP プロラクチン誘導性タンパク質
- OSごとのPO
- PSP 耳下腺分泌タンパク質
- 原発性シェーグレン症候群原発性シェーグレン症候群
- 原発性シェーグレン症候群-ILD 原発性シェーグレン症候群関連間質性肺疾患
- q6h, q8h 6時間ごと, 8時間ごと
- RA 関節リウマチ
- RCT ランダム化比較試験
- RFリウマチ因子
- RTA 腎尿細管アシドーシス
- RTX リツキシマブ
- RX1 ラント関連転写因子
- SAM メチル供与体 S-アデノシルメチオニン
- SAP Sicca Asthenia Polyalgia
- SF-36 ショートフォーム36健康調査
- 唾液腺
- SGS 唾液腺シンチグラフィー
- SGUS 唾液腺超音波検査
- SICCA シェーグレン国際共同臨床同盟
- SLE 全身性エリテマトーデス
- SNP 一塩基多型
- SP-1 唾液タンパク質1
- SSDDIシェーグレン症候群病害指数
- SSDIシェーグレン症候群損傷指数
- sSS 二次性シェーグレン症候群
- SWSF 刺激された全体の唾液の流れの率
- TACI膜貫通アクチベーターとCAMLインターアクター
- TEARS「原発性シェーグレン症候群におけるリツキシマブの忍容性と有効性」試験
- Tfh 毛包ヘルパーT細胞
- TLRはToll Like Receptor
- TNF-α 腫瘍壊死因子-α
- TPHA トレポネーマ・パリダム血球凝集アッセイ
- TRACTISS「TRial of Anti-B-Cell Therapy In patients with primary Sjögren’s Syndrome」試験
- TSH 甲状腺刺激ホルモン
- TTP 血栓性血小板減少性紫斑病
- UCLH ユニバーシティ・カレッジ・ロンドン病院
- UIP 通常の間質性肺炎
- UWSF 刺激されていない全唾液流量
- VAS ビジュアルアナログスケール
- VDRL 性病研究所
