www.ncbi.nlm.nih.gov/pmc/articles/PMC7050025/
Konstantina G Yiannopoulou1 and Sokratis G Papageorgiou2
要旨
アルツハイマー病(AD)の治療戦略は、まだ広範囲に及ぶ研究が行われている。現在では、この病気のための対症療法のみが存在し、そのすべてが神経伝達物質の障害を相殺しようとしている。3 コリンエステラーゼ阻害剤とメマンチン。疾患の進行を阻止するために、治療薬は臨床症状の原因となる病原性の段階を妨害することが想定されており、典型的には細胞外アミロイドβプラークの沈着や細胞内神経原線維のもつれの形成などが挙げられる。その他の根底にあるメカニズムは、神経保護、抗炎症、成長因子促進、代謝促進剤、幹細胞治療によって標的とされている。最近の治療法は、新しいバイオマーカー、新しい神経心理学的転帰、疾患経過の早い時期の患者の登録、革新的な試験デザインなど、複数の新しい特徴を統合したものである。近い将来には、患者ごとに異なる特異的な薬剤が「精密医療」の分野で使用されるようになるかもしれない。本レビューでは、現在研究が進められている疾患修飾療法の可能性と、アルツハイマー病患者にとって有益であることが証明される可能性のある個別化された治療の枠組みについて述べる。
キーワード アルツハイマー病、疾患修飾薬、抗アミロイド剤、抗タウ剤、個別化治療の枠組み
序論
アルツハイマー病(AD)は、今世紀最大の医療課題の一つであり、認知症の主な原因となっている。認知症の患者数は全世界で4,000万人と推定されており,2050年頃までには20年ごとに2倍になると言われている1。
認知症は60歳以上の高齢者に多く発症するため、寿命の拡大に伴い、ADを中心とした認知症患者2が急増しており、その治療に向けた研究が盛んに行われている。しかし、いくら研究が進んでも、有効な治療法はないのが現状です3,4。
現在の研究の原動力となっているADの基本的な病態生理と神経病理学は、ADの主要な病理組織学的病変は、細胞外アミロイド斑と細胞内タウ神経原線維絡み(NFTs)であることを示唆している5 。Aβ38、Aβ40、Aβ42を代表とするAβペプチドは、アミロイド前駆体タンパク質(APP)がβ-セクレターゼ(BACE1)とγ-セクレターゼの2つの酵素によって連続的に切断された後に生成される。6 「アミロイド仮説」によると、脳内でのAβ産生は、ADの臨床症候群につながるイベントのカスケードを開始する。アミロイド仮説」によると、脳内でのAβ産生は、ADの臨床症候群につながる事象のカスケードを開始する。アミロイドオリゴマーの形成が神経毒性の主な原因であり、アミロイドカスケードを開始する。カスケードの要素には、局所的な炎症、酸化、興奮性(過剰なグルタミン酸タウ過リン酸化が含まれている。また、微小管は、神経細胞の発達と機能に必要な成長した軸索を安定化させる。異常に高リン酸化されたタウは、不溶性のフィブリルを形成し、神経内のもつれを形成する。アミロイド仮説では、タウの高リン酸化はAβ沈着の下流イベントであると考えられていたが、タウとAβは並行した経路で作用し、ADを引き起こし、お互いの毒性効果を高める可能性が高い。進行性の神経細胞の破壊は、様々な神経伝達物質(例えば、アセチルコリン、ドーパミン、セロトニン)の不足と不均衡につながり、ADで見られる認知障害につながる。
5 今日使用されているすでに確立された治療法のすべては、病気の神経伝達物質のアンバランスをカウンターバランスにしようとしている。ADの治療に承認されているアセチルコリンエステラーゼ阻害剤(AChEI)は、ドネペジル、ガランタミン、リバスチグミンです4,5。さらに、前脳基底部の神経原線維変性は、おそらくこの領域のコリン作動性ニューロンの機能不全と死の主要な原因であり、広範なシナプス前コリン作動性神経変性を生じさせる。AChEIは、シナプスでのアセチルコリンの利用可能性を増加させ、ADの認知機能の低下を遅らせるのに臨床的に有用であることが証明されている。
中等度から重度のADに承認されている更なる治療薬は、低~中等度の親和性で非競合的なN-メチル-D-アスパラギン酸(NMDA)受容体拮抗薬であるメマンチンです4,5。
臨床試験では、Aβとタウの両方がADにおける疾患修飾治療(DMT)の主要なターゲットとなっている。この観点から、Aβとタウの産生を減少させること、これらの蛋白質の凝集や誤形成を防止すること、これらの蛋白質の有毒な凝集や誤形成を中和または除去すること、またはこれらの方法を組み合わせることで、ADの予防または効果的な治療が可能となる7。
炎症、酸化性障害、鉄の調節障害、コレステロール代謝、血液脳関門(BBB)機能障害、α-シヌクレイン毒性など、AβプラークやNFT形成と重複する、あるいはそれらによって誘発される可能性のある、多くの追加の病原性メカニズムが記述されている9-13。
この記事では、現在FDA(米国食品医薬品局)がADの認知機能障害の治療のために承認している薬剤に焦点を当てて、ADの認知・行動症状の現在の非薬理学的・薬理学的管理をレビューする10。
現在のADの管理
今日では、以下のような要素に基づいて、多面的に調整されたADの管理が試みられている。
- 開かれた医師、介護者、患者のコミュニケーション:両者の間で情報や感情を誠実にうまく伝えることで、症状の適切な把握、正確な評価と診断、適切な指導が可能となる。
- 行動的アプローチ。
- ・環境の一貫性と簡素化10。
- ・確立されたルーチン10。
- ・そのような穏やかな相互作用、楽しい活動の提供、簡単な言語を使用して、安全性が懸念される場合にのみ「ノーと言う」などのコミュニケーション戦略10。
- ・法的・医学的な決定やニーズに応じた適時の計画10;認知行動療法14,15
- ・認知行動療法14,15。
- ・運動療法、光療法、音楽療法14,15
- 介護者のサポート。
- ・介護者のための計画的な短時間の休息。
- ・認知症が認知、機能、行動に及ぼす影響、期待、症状を悪化させたり、安全と幸福のために危険を増大させるような状況を避けるための準備を含む精神教育
- ・介護者の支援ネットワークの構築を奨励する。
- 薬物学的介入
FDA承認のAD治療薬
AChEIsドネペジル、ガランタミン、リバスチグミン、およびNMDA拮抗薬メマンチンは、唯一のFDA承認のAD薬である。
10 AChEIは、シナプス裂け目の責任酵素アセチルコリンエステラーゼを阻害することにより、アルツハイマー病患者の脳内アセチルコリンレベルの破壊を減少させようとする。さらなる低下が起こるが、これらの薬剤を一時的に中止しても急速な低下をもたらし、介護施設入所のリスクが高くなることと関連している16。
17 3つのAChEIはすべて,52週間までの無作為化プラセボ対照試験で、認知機能の低下を遅らせ、安定させ、あるいは認知機能や日常生活動作を改善する治療効果が証明されている10,18。
10 AChEI間での有効性の有意差は報告されていない。ドネペジルとリバスチグミンは軽度、中等度、重度のADに対してFDAによって承認されているが、ガランタミンは軽度、中等度のADに対して承認されている。
最も一般的な副作用は、AChEIの消化管上でのコリノミメチック作用によって引き起こされ、しばしば下痢、吐き気、嘔吐を含む。また、一部の患者では急速眼球運動睡眠行動障害が認められている。朝の食後に投与することで、これらの副作用をすべて最小限に抑えることができる。リバスチグミンの経皮吸収型パッチは、適用部位に発疹を誘発する可能性がある。副作用は通常5~20%の患者に影響を与えるが、ほとんどが一過性で軽度である。AChEIはまた、徐脈を誘発し、失神のリスクを高める可能性がある。したがって、AChEIは重度の心臓不整脈、特に徐脈や失神を含む状態では禁忌である。また、活動性のある消化性潰瘍や消化管出血の既往歴があり、制御不能な発作がある場合も禁忌である。適応用量の最大耐容量まで数ヶ月から数年かけてゆっくりと漸増することが、患者の安全のために重要である17,18。
ドネペジルとガランタミンの主な排泄経路は肝代謝であるのに対し、リバスチグミンは肝・腸代謝である。ドネペジルとガランタミンはアセチルコリンエステラーゼを選択的かつ可逆的に阻害するのに対し、リバスチグミンはアセチルコリンエステラーゼとブチリルコリンエステラーゼを「擬似的に可逆的」に阻害する。ドネペジルの排泄半減期は70時間、ガランタミンは6~8時間と長い。リバスチグミンの排泄半減期は非常に短い(経口投与で1~2時間、経皮投与で3~4時間)が、アセチルコリンエステラーゼが約8.5時間、ブチリルコリンエステラーゼが約3.5時間阻害されるため、作用時間は長くなる10,17,18。
メマンチンは非競合的な低親和性NMDA受容体オープンチャネル遮断薬であり、グルタミン酸伝達に影響を与える。5 その主な排泄経路は,70時間の半減期で腎臓を介して変化しない。メマンチン単剤療法は、日常生活活動、認知、認知症の行動・心理症状(BPSD)を評価するさまざまな尺度で評価された中等度から重度のアルツハイマー病患者さんに対して、短期的・長期的な効果が実証されている。
メマンチンはAChEIと併用して投与することができるが、その作用機序は相補的である。メマンチンはAChEIと併用して投与することができるが、これらの併用により、副作用の増加はなく、通常は相加的な効果で患者に利益をもたらしている14,15。
中等度または進行性の認知症では、単剤療法や高用量の併用療法の持続期間と持続は、全体的な機能と転帰の改善と関連している。
BPSDに対する薬物療法
BPSDに対しては、抗精神病薬と抗うつ薬が依然として主な治療法である。うつ病や不安症の治療には、選択的セロトニン再取り込み阻害薬が好ましい。セルトラリン、シタロプラム、エスシタロプラムなど、抗コリン作用が低く、許容できる忍容性を有する薬物がより適切である。抗精神病薬は、攻撃的行動により患者または介護者にとって重大な安全上のリスクがあり、必要とされる場合にのみ投与すべきである。ベンゾジアゼピン系薬剤、抗痙攣性興奮薬、デキストロメトルファン/キニジンの使用は、議論の余地があり、限られたエビデンスでは十分に支持できない。BPSDを管理するための薬理学的アプローチは、患者の併存疾患、病期、症状の重症度に応じて、非常に個別化され、変更可能である21。
余分な薬物や劇薬の除去
22 抗コリン剤や鎮静剤は、一般的に不適切な薬として使用されている。エストロゲンもまた、閉経後の女性の認知機能低下の増加と関連しているという証拠があるにもかかわらず、一般的に処方される可能性のある不適切な薬の一つである。
高齢者に通常処方される潜在的に有害な薬物の具体例としては、ジフェンヒドラミン(不眠症や痛みのためにアセトアミノフェンと一緒に服用されることが多い不安のためのベンゾジアゼピン、尿失禁のための抗コリン薬(トルデロジン、オキシブチニン、タムスロシン錐体外路振戦のためのバイペリデン、プラミペキソール25、睡眠障害のための鎮静薬/催眠薬26などがある。
基礎疾患の治療
血管リスク因子(高脂血症、糖尿病、高血圧)の慎重な管理は、アルツハイマー病患者にとって最も重要である。水分補給、睡眠、栄養状態も注意深くモニターする必要がある。甲状腺機能や電解質の障害、ビタミンB12、葉酸、ビタミンDの欠乏、または認知に影響を及ぼす可能性のある全身状態や疾患(感染症、例えば、尿路感染症、痛み、便秘)を治療する必要がある27。
ADの治療研究の現状
実際のところ、過去10年間で200以上の研究プロジェクトが失敗したり、中止されたりしている10。それでも、AD治療薬のパイプラインには、疾患修飾または症状のいずれかを標的とする作用機序(MOA)を持つ薬剤がまだたくさんある4,10。早期、軽度、中等度のアルツハイマー病患者を対象とした第3相臨床試験における最近の抗アミロイド剤の失敗例としては、セマガセスタット29、バピヌズマブ30、ソランズマブ31、βセクレターゼ阻害剤(BACE)であるラナベセスタット32、ベルベセスタット33、アタベセスタット34が挙げられる。
ADに対するDMT薬の臨床試験の複数の失敗の最も一般的で広く受け入れられている説明には、疾患開発における治療の開始が遅すぎること、不適切な薬剤の投与量、治療の主なターゲットが間違っていること、そして主にADの病態生理の理解が不十分であることが含まれている35。この問題に対する新しいアプローチは、生物学的というよりも技術的、数学的と思われ、選択された臨床試験のエンドポイントが非常に時期尚早である可能性があり、さらに、診断マーカーやエンドポイントのばらつきは、患者の病状の不正確な診断につながり、最終的には間違いなくエラーの原因となることを示唆している28。これらのシミュレーターは数学的、計算的、統計的ツールを用いて構築されており、試験開始前に、与えられた試験の戦略と臨床エンドポイントの選択が適切であるかどうかの可能性を予測することができる36。最近の研究では臨床試験シミュレーターの使用は頻繁には行われていないが38 、特にADのような進行が遅く持続期間の長い疾患の治療法が評価されている場合には、この方法を放棄すべきではないであろうか。
一方で、現在の研究では、疾患の生物学、診断マーカー、個々人の病状の正確な診断と臨床試験のデザインなど、あらゆる新しい側面を考慮して、疾患の進行を遅らせたり、止めたりするための治療法の開発に焦点が当てられていることに変わりはない。さらに、前臨床試験や前駆期アルツハイマー病患者を現在の臨床試験に含める可能性があるだけでなく、従来からAD認知症の全臨床段階の患者を含める可能性があるため、ADのための創薬研究はより複雑になっている。さらに、臨床試験シミュレーター、ベイズ統計、修正可能な試験デザインの使用が強く提案されている4。
National Institute on Aging and the Alzheimer’s Association (NIA-AA)は、アミロイド、タウ、神経変性バイオマーカーを臨床試験に応用し、AD段階の患者を正確に分類することに成功し、臨床試験の設計に役立てることができる新しい研究の枠組み39を提案している。
タウポジトロン断層撮影法(タウPETニューロフィラメント光、ニューログラニンは、臨床試験で使用されることが増えている新しいバイオマーカーである40。
上記のような生物学的・統計学的な進歩が最近の臨床試験に統合されたことは、医薬品開発を成功させるための最終的な資産となる可能性がある。ここでは、現在行われている第 1 相、第 2 相、第 34,11-13 相の AD 臨床試験について簡単に説明する。これらの臨床試験で試験された薬剤は、疾患を修飾する可能性があるもの、認知機能の強化や神経精神症状の緩和を目的とした対症療法的なものに分類されている。また、新規MOAを有する薬剤、先進的な免疫療法、薬剤開発におけるバイオマーカーの関与、再利用薬剤など、AD臨床試験の新たな方向性が強調されている。
clinicaltrials.gov(2019年8月19日アクセス)でADの第1,2,3相「募集中」または「積極的だが募集していない」臨床試験を検索すると,165件のアウトカムが得られた。ADの医薬品開発パイプラインの最後の年次レビューは,2019年2月にclinicaltrials.govを調べており(156試験132剤その時点で入手可能な情報と結論を提供している:第3相臨床試験42試験28剤、第2相臨床試験83試験74剤、第1相臨床試験31試験30剤4。試験された薬剤は、DMT剤(73%症候性認知増強剤(13%BPSD治療薬(11%)に分類されている4。また、DMT薬は、アミロイド標的薬、タウ関連標的薬、抗炎症・代謝保護薬、神経保護薬、成長因子サポート薬などの潜在的なMOAに応じて分類された4。対症療法薬は、数週間から数ヶ月の間に認知機能の改善やBPSDの消失といった症状改善効果を示すと考えられている10。
本レビューでは、現在、DMTの候補として研究されている薬剤について議論する。さらに、バイオマーカープロファイル、遺伝子解析、神経心理学的評価、神経画像診断をベースに、リスク因子を制限した将来の「精密医療」多因子治療モデルへのアプローチを試みる2,3。
現在研究されているADに対するDMT
アミロイド関連メカニズム-DMT
ADの発症に重要なステップはアミロイド(Aβ)の産生であり、SP(不溶性でタンパク質分解抵抗性のフィブリル)を形成する。Aβは、細胞外ドメインのβ-セクレターゼ(BACE1)と膜貫通領域のγ-セクレターゼによる逐次的なタンパク質分解を経て、ADで過剰発現しているタンパク質、APPに由来する。全長APPは、まず、α-セクレターゼまたはβ-セクレターゼによって切断される。α-セクレターゼによるAPPの切断は非アミロイド原性経路を示し、β-セクレターゼ(BACE1)によるAPPの切断はアミロイド原性経路を示す。BACE1による細胞外でのAPPの切断と膜貫通部でのγ-セクレターゼによるAPPの切断が連続的に行われることで、Aβが生成されることがわかった。γ-セクレターゼの主な切断部位は、通常、Aβの40位と42位に存在するため、Aβ40とAβ42のオリゴマーは、BACE1がより豊富に存在するため、神経細胞ではアミロイド生成経路が有利であることから、APPの逐次切断の主な生成物となる。逆に、BACE1が優勢でない他の細胞では、非アミロイド原性処理がより有利である5。
「アミロイド仮説」は、脳内でのAβ産生が、ADの臨床発現につながる病態生理学的イベントのカスケードを誘発することを示唆している。Aβは3つの主要なアイソフォームからなるタンパク質である。Aβ38、Aβ40、およびAβ42。Aβ42は最も凝集しやすい形態であり、オリゴマーにクラスター化する傾向がある。オリゴマーは、最終的にアミロイド斑を形成するAβフィブリルを形成することができる。Aβ40はやや凝集しやすく、”脳アミロイド血管症 “の主成分として大部分が脳血管系に存在する。Aβ40は通常、検出されたAβの50%以上を占める。Aβ38は可溶性で、散発性および家族性アルツハイマー病患者の血管系に存在する。神経毒性は主にアミロイドオリゴマーの形成に起因し、最終的にアミロイドカスケードを開始する。
酸化、炎症、過剰なグルタミン酸、およびタウの高リン酸化は、カスケードの主な病態生理学的支柱であると考えられている。タウタンパク質は細胞内の微小管と結合し、神経細胞の輸送システムを促進する。また、微小管は成長する軸索を安定化させる。高リン酸化されたタウは不溶性フィブリルを形成し、神経内NFTに折り畳まれる。初期のアミロイド仮説では、タウの高リン酸化は、Aβ沈着の下流イベントであると考えられていたが、それは現在、タウとAβは、ADを引き起こし、お互いの毒性効果を高める並列経路で作用することが等しく可能性がある2大規模な神経細胞の破壊の結果は、アセチルコリン、ドーパミン、セロトニンなどの神経伝達物質の不足と不均衡であり、ADの認知と行動の症状に5
その結果、抗アミロイドDMTは3つの主要なMOAに焦点を当てていた。その結果、抗アミロイドDMTは、(1)Aβ42産生の抑制(γ-セクレターゼ阻害剤、β-セクレターゼ阻害剤、α-セクレターゼ増強剤(2)Aβプラーク負荷の抑制(凝集抑制剤、金属阻害剤(3)Aβクリアランスの促進(能動的または受動的免疫療法)の3つの主要なMOAに焦点を当てていた10。
Aβ42産生量の低減
γ-セクレターゼ阻害剤
アミロイド仮説によると、アミロイド生成経路はAPPがBACE1とγセクレターゼによって順次切断された後に促進されると考えられている。そのため、これらの酵素を阻害することが重要な治療標的とされている。残念なことに、γ-セクレターゼはAPP以外にも多くの物質に作用し、異なる膜貫通タンパク質を切断する。最近のγセクレターゼ阻害薬の臨床試験では、セマガセスタット29は日常生活動作の悪化、感染症や皮膚がんの発症率の増加、アバガセスタット41は認知機能の低下や用量制限作用(皮膚がん)の増加、タレンフルビルは脳への浸透性が低かった42。γセクレターゼ阻害剤の安全性に関する重大な懸念は、γセクレターゼを安全な方法で治療的に標的とするために、この重要な酵素の詳細な研究を行うまでは、γセクレターゼはAD43の治療に適切な標的としての役割から外されている44 。
BACE阻害剤
後者のBACE阻害剤は、AD発症リスクのある無症候性患者(APOE4ホモ接合体またはAPOE4ヘテロ接合体で、脳脊髄液(脳脊髄液)バイオマーカーまたはアミロイドPETによりアミロイドが上昇している)を対象とした研究が行われている。
本研究では、ADの病態や神経変性を示す流体バイオマーカーと神経画像バイオマーカーが統合されている。
しかし、BACE阻害薬であるlanabecestat,32,verubecestat,33,atabecestat34の臨床試験は、予期せぬ困難により最近中止された。ラナベセスタットの第3相試験は有効性の欠如により中止され、ベルベセスタットとアタベセスタットの試験は安全性の理由(発疹、転倒、肝毒性、神経精神症状)に加えて、効果がなかったため中止された10,32-34。これらの結果は、Aβの形成過程をブロックしても病気の進行を止めることができない可能性があるという示唆を支持するものである。
α-セクレターゼ調節薬
アミロイド仮説によれば、α-セクレターゼによるAPPの切断後、非アミロイド化経路が促進されると考えられている。そのため、α-セクレターゼの制御が重要な治療標的とされていた。しかし、α-セクレターゼによるAPPの切断を刺激する主要なシグナル伝達経路については、ほとんど知られていない。制限された、現在の知識では、α-セクレターゼ活性化はホスファチジルイノシトール3-キナーゼ(PI3K)/Akt経路を介して促進され、γ-アミノ酪酸(GABA)受容体シグナリングを介している可能性があると仮定している。
Etazolate(EHT0202)は、GABA受容体の選択的モジュレーターとして作用する非アミロイド性α-セクレターゼ経路を刺激する。以前に行われた第2相試験では、本剤は軽度から中等度のアルツハイマー病患者において安全で忍容性が高いことが示された。48 エタゾレートは現在、心的外傷後ストレス障害の予防効果について動物実験で評価されている。
PI3K/Akt経路を活性化する2種類のα-セクレターゼ調節薬が第2相臨床試験で研究されている。APH-1105とID1201である。APH-1105は経鼻的に投与され、軽度から中等度のADを対象に評価されている。軽度ADで評価されている。
Aβプラーク負担の軽減
凝集抑制剤(抗アミロイド凝集剤)
凝集阻害剤は、Aβペプチドと直接相互作用してAβ42繊維の形成を阻害し、したがって、それらはADの潜在的な治療法と考えられている。
ヒトで試験された最後のAβ42凝集阻害剤は、経口剤であるcyllo-inositol(ELND005)であった。アルツハイマー病患者を対象とした第2相臨床試験では、ELND005の臨床的有用性を支持する証拠は得られなかったが、重篤な毒性の問題(感染症)があったため、試験は中止された。低用量の薬剤のさらなる開発は、過去8年間進展していない。
現在では、Aβ42の凝集を阻害し、部分的に反転させるペプチドミメティクスの形をした特異的な薬剤が、透過型電子顕微鏡研究で試験されている。KLVFFは、Aβの疎水性中心部に類似したペプチド配列であり、天然ポリペプチドを徐々に置換していく。主にAβ42の凝集を防止し、オリゴメリックを限定的に溶解することもできるKLVFF化合物は、最終的な化合物18であり、これはタンパク質分解に弾力性がある51。
もう一つの新たに開発されたペプチドミメティクスは「γ-AAペプチド」52 であり、その一つである化合物γ-AA26 は、Aβ42 の凝集を抑制するという点で、KLVFF の化合物 18 のほぼ 100 倍の効果があると考えられている52。
ペプチドミメティクスの生物学的可能性を明らかにするために、今後、動物を用いた生体内試験試験が開発される予定である。
金属を阻害する薬剤によるAβプラーク負担の軽減
鉄、銅、亜鉛などの金属イオンの異常蓄積または異常恒常性障害は、ADの病態生理と関連している。
デフェリプロンは鉄キレート剤であり、軽度および進行性ADの参加者を対象に第2相試験が行われている。
金属蛋白質抑制化合物であるPBT2は、前臨床試験で有望な有効性を示したことから、最近、AD治療の第2相臨床試験が進展している54 。
Aβクリアランスの促進(能動的または受動的免疫療法)
Aβクリアランスの促進を目的とし、現在臨床試験や前臨床試験で試験されている主な2つの免疫療法的アプローチは、能動的免疫法と受動的免疫法である56。
能動的免疫化
Aβ、リン酸化タウ(ptau)ペプチド、または重合英国アミロイドーシス(ABri)関連ペプチド(pBri)57のような特異的な人工ペプチドが免疫原として使用される。ABriは、他のいかなるヒトタンパク質とも相同性を有しない特異的なカルボキシル末端を有する高度にアミロイド原性のタンパク質の産生をもたらす突然変異に関連するまれな遺伝性アミロイドーシスである。pBriペプチドはこの末端に対応し、Aβおよびptauを認識する免疫応答を誘導する。
抗原提示細胞は、免疫原をB細胞に提示する。Abペプチドまたはptauペプチドの使用は、それぞれAbエピトープまたはptauエピトープに対する抗体を産生する。pBriの使用は、Aβおよびptauエピトープの両方に対する抗体を産生する。
受動的免疫化
Ab、ptau、またはbシートエピトープに対するモノクローナルAbsは、全身的に、そしてBBB浸透のために十分に注入される。抗体がBBBを横断すると、抗体は、それらの標的をクリア、分解、または代替的に分解または中和するように作用する56
また、能動的または受動的な免疫化による自然免疫の刺激は、ミクログリアおよびマクロファージの機能を促進することにより、疾患の病態を改善する56。
全体として、Aβを標的とした戦略は、症状が現れる前の病気の進行の非常に早い段階で使用されれば有望であると思われる;したがって、前臨床ADの現在の臨床試験で開発されている。タウ病理を標的とした治療法は、有望ではあるが、現時点では毒性のリスクがある。それにもかかわらず、散発性の遅発性ADにおいては、ptau病態とAβ病態は、互いに相乗的に影響を与えうる別個の経路によって進化している可能性があるという仮説が立てられている58 。
免疫療法のアプローチは、過去15年間、否定的な結果を残して支配的なものとなっていた。しかし、これらの失敗から得られた教訓が、現在のADの免疫療法開発研究に変化をもたらしている56。
積極的なAβ免疫療法
現在,6種類の活性型免疫療法剤が第1,2,3相臨床試験を実施中である。
CAD106はアクティブなAβ免疫療法剤であり、アルツハイマー予防イニシアチブ世代プログラムの傘下で、前臨床ADを対象とした研究が行われており、AD発症リスクのある無症候性の患者(60~75歳、APOE4ホモ接合体、またはAPOE4ヘテロ接合体で、脳脊髄液またはアミロイドPETでアミロイドが上昇した患者)を対象に、CAD106とumibecestatの安全性と有効性を同時に評価する2つの第3相試験から構成されている45。
被験者は第1世代試験(コホート1:CAD106またはプラセボ、コホート2:umibecestatまたはプラセボ)または第2世代試験(umibecestat50および15mg、またはプラセボ)に登録される45。
ABvac40は、Aβ40のC末端に対する最初の活性ワクチンとして、第2相試験で評価されている。第1相試験は,50歳から85歳の軽度から中等度のアルツハイマー病患者を対象に実施された。その結果、血管原性浮腫や微小出血は認められないであった。ABvac40の注射を受けた患者の92%に特異的な抗Aβ40抗体が発現した。
GV1001ペプチド(tertomotide)は、以前に様々な癌に対するワクチンとして研究されていたが、現在はADを対象とした第2相試験で評価されている60。
AβワクチンであるACC-001(vanutide cridificar)は、軽度から中等度のアルツハイマー病患者を対象とした第2a相延長試験で試験された。ACC-001(vanutide cridificar)は、軽度・中等度のアルツハイマー病患者を対象とした第2a相延長試験で、QS-21アジュバントと併用投与された。この組み合わせによる長期治療は非常に忍容性が高く、他のレジメンと比較して最も高い抗AβIgG価が得られた。
Aβワクチンとして使用される合成ペプチドであるUB-311は、軽度および中等度のアルツハイマー病患者を対象とした進行中の第2相試験に移行している。第1相試験では、アルツハイマー病患者において100%の反応率を示した。通常の副作用は注射部位の腫れと動揺であった。軽度アルツハイマー病患者では、認知機能の低下率が緩やかになることが観察された。
Lu AF20513エピトープワクチンは軽度アルツハイマー病患者を対象とした第1相試験での効果が推定されている。
先行研究(AN-1792)64で脳炎が発生したことから、T細胞を活性化させる可能性の低いAβ部位により特異的な改良型抗Aβ活性免疫療法剤の開発が進められており、現在臨床試験が行われている5,6。
受動的Aβ免疫療法-mAbsを用いた免疫療法
mAbsを用いた受動的Ab免疫療法は、最も積極的で有望な治療法である。5 このクラスの最初の薬剤であるbapineuzumab65とsolanezumab66の過去の第3相試験で失敗したことから得られた貴重な教訓がmAbsの研究に活かされた。アミロイド陽性であることをバイオマーカーで証明することや、前臨床段階の患者を登録することなど、厳格な包含基準が適用された。さらに、アミロイド関連画像異常の特徴を抗体の投与量やAPOε4遺伝子型と関連させ、より高い投与量が必要とされ、アミロイドPET上のAβプラーク負担の軽減など、特定のターゲットに対する正確な測定が求められるようになった10。
現在進行中の多くのmAbs試験は第3相試験中であり、前臨床試験やリスクの高い集団を対象とした試験では、前臨床試験ではducanumab,67 gantenerumab,68、BAN240169、前臨床試験ではcrenenezumab,70 gantenerumab、solanezumab71などがある。aducanumabとBAN2401試験の最初の結果は、最初に、進行性および非常に軽度のアルツハイマー病患者における認知機能の低下の減速と一致する脳アミロイド負荷の減少という治療関連の結果を示唆していた71,72。一方、進行性ADに対するガンテルマブの初期試験は、有効性の欠如を理由に早々に中止されたが、探索的分析によると、臨床効果を得るためにはガンテルマブの高用量投与が必要であることが示唆されており、軽度アルツハイマー病患者を対象とした二重盲検プラセボ対照試験と同時に、軽度アルツハイマー病患者を対象とした非盲検延長試験が継続されている4,68。
LY3002813(ドナネマブ)及び LY3372993 の静脈内投与が、軽度認知障害(MCI)及び軽度から中等度の AD 患者を対象とした第 1 相臨床試験で実施されている。
受動的Aβ免疫療法-免疫グロブリンを用いた免疫療法
抗Aβ抗体は、天然に存在する自己抗体に含まれる。mAbsとは対照的に、血液由来のヒト抗Aβ免疫グロブリンG(IgG)Absはポリクローナルであり、単一のAβ分子に対しては低い活性を有し、より広い範囲のエピトープ、特にAβオリゴマーおよびフィブリルに対してはより高い活性を有する。Aβに対する抗体の自然な存在は、静脈内免疫グロブリン(IVIg)で報告されている;したがって、IVIgは、可能性のあるAD治療薬として考えられている。静脈内免疫グロブリンは健康なドナーの血漿から得られるもので、主にIgG型のヒトAbsから構成されている。
それにもかかわらず、AD治療薬としてのIVIgの最初の完了した第3相試験では、良好な忍容性が示されたが、軽度および中等度のアルツハイマー病患者の臨床安定性や認知機能または機能低下の遅延に対する本剤の有効性は示されないであった。
脳内のAβの蓄積を減少させることを目的とした別の戦略は、BBBを介したAβの輸送を変化させることに基づいている。最近の治療法としては、アルブミン交換による血漿交換(PE)を行い、血漿と脳のAβの間に存在する動的平衡を変化させることが挙げられる。この治療法は以下のような考慮に基づいている。(1)アルツハイマー病患者では脳内のAβ凝集が高く、脳脊髄液中のAβが低いこと、(2)アルブミンはヒトの主要なタンパク質トランスポーターであること、(3)アルブミンは循環中のAβの約90%を結合していること、(4)アルブミンはAβ結合能が証明されていること、などを考慮している。したがって、アルブミンと結合したAβをPEが介在することで、遊離Aβの脳脊髄液から血漿への移行が促進され、脳と血中のAβ濃度のアンバランスが是正されることが示唆されている75。
軽度および中等度のアルツハイマー病患者を対象とした第3相試験であるAlzheimer’s Management by Albumin Replacement (AMBAR)では、免疫グロブリンの静脈内投与の有無にかかわらず、アルブミンの数種類の置換量を用いてPEを評価している76。
さらに、現在進行中の第2相試験では、軽度および中等度のADにおいてIVIgオクタグラム10%が評価されている。
Aβとタウを同時に標的とする新しい免疫療法戦略は、NPT088剤に代表される。NPT088は、バクテリオファージM13(g3p)のカプシドタンパク質とヒトIgG1-Fcの混合物である。NPT088は、高齢化したTg2576マウスにおいて、Aβとptauの凝集体を減少させ、認知機能を改善した。現在、第1相臨床試験が実施されている。
タウ関連メカニズム-DMT
抗リン酸化タウ薬は、第3相試験で進展したこの特定のMOAを有する薬剤がまだ存在しないにもかかわらず、主要な潜在的な治療戦略となっている。
第2/3相試験では、タウに関連するメカニズムを有する薬剤が1剤のみ評価されているのに対し、第2相試験ではタウをメカニズムの一つとして標的とする10剤が評価されており、第1相試験ではさらに5剤が評価されている4。
ptau形成の予防
タウの過リン酸化はキナーゼによって誘導される78 。グリコーゲン合成酵素キナーゼ3(GSK3β)が治療標的として注目されている。最も研究されているGSK3阻害薬は、情動障害の治療薬である塩化リチウムであり、マウスモデルではタウのリン酸化を抑制すると考えられている。リチウムは現在、創薬研究の新しい枠組みの中で再評価されている。
もう一つのGSK-3阻害薬であるチデグルシブは、軽度および中等度のアルツハイマー病患者を対象とした第2相臨床試験のエンドポイントを満たさなかった80。
ANAVEX 2-73もGSK-3b阻害剤であるが、高親和性シグマ1受容体アゴニストと低親和性ムスカリンアゴニストの2つのアゴニストである。2019年アルツハイマー病協会国際会議(AAIC)で発表された結果では、ANAVEX 2-73で治療された患者さんは、ルミノコッカス科とポルフィロモナス科の2つの腸内微生物叢のレベルが高く、日常生活動作の改善と関連していたことが明らかになった。この効果は、微生物叢のアンバランスを逆転させる可能性があり、脳-腸-微生物叢軸にホメオスタティックな効果をもたらす可能性があると考えられる81。
タウ凝集の阻害剤
フェノチアジンとして知られるメチレンブルー(MB)は、タウ凝集阻害薬としてAD試験で評価されている。この薬剤の問題点は、尿が青色に着色されるため、盲検化ができないことである。軽度・中等度ADを対象としたMBの単剤療法試験(NCT00515333)では、中等度ではあるが軽度ADではない臨床的有用性が示されている82。
第3相試験で検討されたメチレンブルーの誘導体TRx0237(LMTX)は、最終的に有効性を示すことができず、その結果の解析をもとに、軽度アルツハイマー病患者を対象とした新たな第2/3相試験(LUCIDITY)が1年前に低用量で開始されている。
微小管安定化剤
微小管安定化剤ダブネチドは第2相試験で試験されたが、臨床エンドポイントを満たさなかった85。
TPI-287(アベオタキサン)は、タキソール由来の低分子化合物であり、微小管タンパク質モジュレーターである。TPI-287(アベオタキサン)は微小管蛋白質モジュレーターであり、軽度から中等度のアルツハイマー病患者を対象とした第1/2相試験(NCT019666666)で静脈内投与された。最初に発表された結果では、本剤は参加者の忍容性が低かったことが報告されている。
アンチセンスオリゴヌクレオチドである微小管関連タンパク質タウ RNA 阻害剤である IONIS MAPTRx(BIIB080)は、軽度 AD 患者様を対象に募集中の第 2 相臨床試験(NCT02623699)で評価されている。
タウの翻訳後修飾を標的とする
リン酸化以外に凝集を促進するもう一つのタウ修飾は、リジンアセチル化による翻訳後修飾である。したがって、タウのアセチル化を阻害する薬剤の使用は、ADの治療法として提案されている。
ニロチニブはc-Ablチロシンキナーゼ阻害剤であり、白血病患者に使用されている。また、ニロチニブは脳内オートファジーを誘発してタウを消去すると考えられている。ニロチニブは現在、軽度から中等度のアルツハイマー病患者を対象とした第2相試験(NCT02947893)で研究されている4,83。
タウクリアランスの促進-免疫療法
最近、様々な動物モデルにおけるエビデンスが出てきており、ptauエピトープを標的とすることが、タウクリアランスを促進することができる抗体反応を誘導する実用的なアプローチであることを強く示唆している81 。
能動的免疫療法
AADvac1は合成タウペプチドを含み、現在、軽度から中等度のADを対象とした第2相臨床試験(NCT02579252)で研究されている。
受動的免疫療法
ABBV-8E12は、早期アルツハイマー病患者を対象とした第2相臨床試験(NCT02880956)で評価されたヒト化抗タウ剤である。
BIIB092 は、家族性 AD 患者の幹細胞由来のタウフラグメントに対するヒト化 IgG4 MAb であり、第 2 相臨床試験で AD MCI および軽度 AD 患者を対象に本剤の安全性と有効性が評価されている。
RO7105705(MTAU9937 A)は、進行期の軽度アルツハイマー病患者を対象とした第2相臨床試験(NCT03289143)で評価されている抗タウMAbである。
他の3つの抗tau mAbs(BIIB076、JNJ-63733657、LY3303560)が現在第1相臨床試験で評価されている。
他のメカニズムを有するDMT
神経保護
AGB101(低用量徐放性レベチラセタム)は、SV2Aモジュレーターであり、第3相臨床試験ではリパーパス(てんかんではなくADによるMCIの別の適応での使用が承認されている)として評価されている。Aβ(NCT03486938)により誘発される神経細胞の多動を抑制するとされている(図1)。
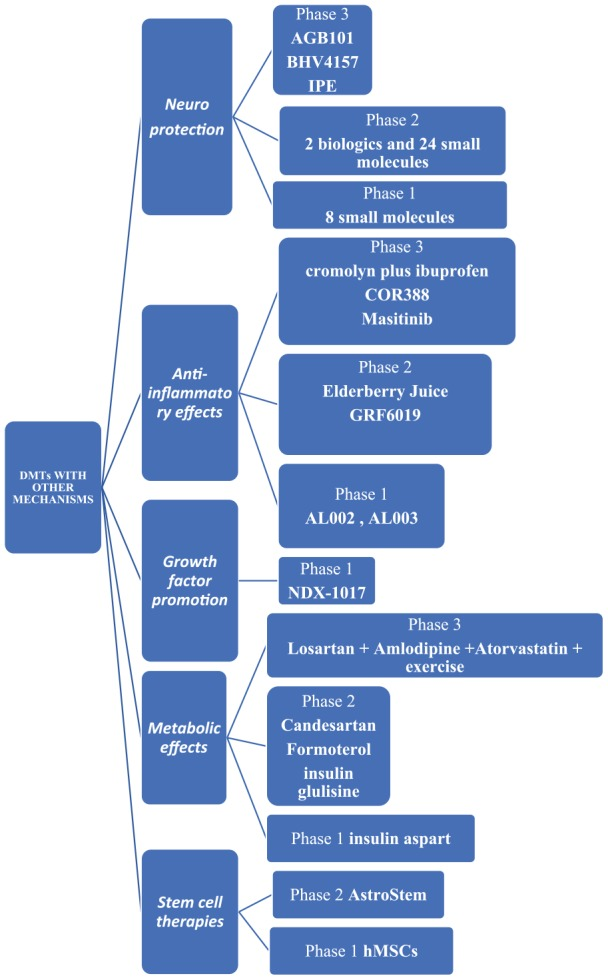
図1. 他のメカニズムを持つDMT。
DMTsは疾患修飾療法を示し、hMSCsはヒト間葉系幹細胞を示す。
BHV4157(troriluzole)は、シナプスのグルタミン酸レベルを低下させるグルタミン酸モジュレーターであり、第3相臨床試験(NCT03605667)で評価されている4。
イコサペントエチルは、精製された形のエイコサペンタエン酸(EPA)オメガ3脂肪酸である。疾患の病態から神経細胞を保護することが期待され、第3相臨床試験(NCT02719327)で評価されている4。
また、第2相臨床試験で評価されている神経保護作用をメカニズムの一つとする生物製剤2と24の低分子4、第1相臨床試験で評価されている8の低分子4がある。
抗炎症作用
神経炎症は 30 年以上前に AD の病態形成の可能性のある機序として提案されていたが、最近にな って神経炎症の研究に拍車がかかったのは、おそらく 2 つの啓発的な発見によるものであろう:第 1 に、活性化されたグリア細胞が AD の脳病変の形成に関与しているという証拠があり、第 2 に、疫学的研究により、何十年も抗炎症薬で治療されている関節リウマチ患者は AD を免れていることが明らかになった。この疾患における炎症機序のさらなる研究により、グリア細胞、ミクログリア、アストロサイトの活性化が炎症性サイトカイン、主にインターロイキン1β(IL-1β)と腫瘍壊死因子α(TNF-α)の産生を誘導することが示された。より具体的には、TNF-αシグナルは生体内試験でAβ凝集とタウリン酸化の両方を悪化させることが証明されている90 。
前述の神経炎症機序によれば、非ステロイド性抗炎症薬、補体活性化ブロッカー、その他の抗炎症剤は、関節リウマチのように適時かつ長期的に使用すれば、ADの臨床発症を遅らせることができることが、脳脊髄液や脳内のAβレベルの複数のバイオマーカーや疫学研究によって確立されている89。
さらに、関節リウマチ、クローン病、乾癬性関節炎、その他の末梢性炎症性疾患の治療薬としてFDAに承認されている生物学的製剤(mAbs)である既存のTNF-α阻害薬(TNFI)は、ADの潜在的な治療戦略として研究されている。TNF-α特異的mAbsはinfliximab、adalimumab、golimumab、およびcerolizumabであり、エタネルセプトは組換え融合タンパク質であり、これもTNFIである91 。91 これらの薬剤の開発は、BBBへの浸透が限られていることが主な欠点である。TNF-α活性の末梢標的化がこの問題に取り組むために提案されている1つの方法であり、BBB浸透を可能にするためのTNFIのリエンジニアリングがもう1つの方法である91。
現在、第3相臨床試験で評価されている抗炎症剤は以下の通りである。
ALZT-OP1a+ALZT-OP1b(クロモリン+イブプロフェン)は、肥満細胞安定剤と抗炎症剤の併用で、それぞれ第3相臨床試験(NCT02547818)で評価されている4。
COR388は、細菌性プロテアーゼ阻害剤として作用する歯周病原体を標的とし、神経炎症を抑制し、その結果として海馬の変性を抑制するもので、現在、第3相臨床試験(NCT03823404)で評価されている4。
マスチニブは、選択的チロシンキナーゼ阻害剤として肥満細胞に作用し、神経炎症を抑制する。第3相臨床試験(NCT01872598)で評価されている。
第2相臨床試験で検討されている抗炎症剤は以下の通りである。
エルダーベリージュースはアントシアニンを豊富に含む強力な抗酸化剤としてミトコンドリア機能を改善する(NCT02414607若年性血液パラビオシスにより脳の神経炎症が抑制されるという仮説に基づき、ヒト血漿タンパク質画分であるGRF6019を輸液で投与する(NCT03520998、NCT03765762)4。
第1相で検討されている抗炎症剤は、mAbs AL002、AL003(NCT03635047、NCT03822208)である。
成長因子の促進
NDX-1017は、神経細胞を再生する役割を持つ肝細胞増殖因子であり、第1相臨床試験(NCT03298672)で研究されている。
代謝作用
ロサルタン+アムロジピン+アトルバスタチン+運動療法は、認知機能を維持しながら血管リスクを有意に軽減することが示唆されている。第3相臨床試験(NCT02913664)で評価されている。
アンジオテンシン受容体拮抗薬カンデサルタン、β2受容体作動薬フォルモテロール、脳内インスリンシグナルを上昇させる経鼻インスリングルリシンは第2相臨床試験(それぞれNCT02646982、NCT02500784、NCT02503501経鼻インスリンアスパルトは第1相臨床試験で評価されている4。
幹細胞治療
AstroStemは、自家脂肪組織由来の幹細胞からなる幹細胞を用いた治療法で,10回静脈内投与される。AstroStemは第2相試験(NCT03117738)で評価されており、hMSCs(ヒト間葉系幹細胞)治療は第1相試験(NCT02600130)で評価されている4。
対症療法剤
対症療法とは、認知的またはBPSDのいずれかの疾患の臨床症状を標的にして改善する薬剤であり、DMTが行うとされているように、ADにつながる病理学的ステップを修正したり、疾患の進行に作用したりすることなく、疾患の臨床症状を改善するものである。
全体として、現在の臨床試験では33の対症療法薬がある。19の薬剤は認知機能の改善を目的としており,14の薬剤はBPSDを標的としている。
そのうち11剤が第3相試験中であり,3剤が認知強化薬,8剤がBPSDを対象としている。
20種類の対症療法薬が第2相試験にあり,14種類の認知強化薬と6種類のBPSDを対象としている。
また、第1相では認知機能強化薬が2剤、第2相ではBPSDに作用するものが6剤、第3相では認知機能強化薬が3剤、BPSDに作用するものが8剤となっている。
議論
ADに効果的なDMTや対症療法薬を開発するために、精力的な研究努力が続けられている。ADにおける様々な治療標的に焦点を当てた第1相、第2相、第3相のヒト臨床試験が継続して行われている。治療薬に関するADの臨床試験で成功しなかった割合が高いという最近の経験を考えると、最近の試験は、ADのバイオマーカーの開発の統合、特にADの進行期の試験での単一の主要な転帰の標的化、より早い時期の集団の登録、革新的な試験デザインによって、強力な力を得ているように見える91-93。
同時に、革新的な研究では、より洗練された診断ツール(神経画像、体液、プロテオミクス、ゲ ノミックADバイオマーカー)の開発を目標としており、この疾患の予防研究も進行中である10。
これらの研究努力がすべて実を結べば、近い将来、効果的な「精密医療」がすべてのアルツハイマー病患者に適用される可能性がある:危険因子の排除、併存疾患の治療、ライフスタイルの改善のための個別化されたアドバイスが提供されるであろう。ADのバイオマーカーと神経心理学的評価プロファイルが概説される。その後、患者は遺伝的、神経画像学的、生化学的、神経心理学的要件を満たすように調整されたDMTの組み合わせを開始することができる。
さらに、DMTの観点を超えて、臨床家は常に患者・介護者をターゲットにしたADへの対応を維持しなければならない。精神教育、行動、環境技術を含む全人的かつ現実的なアプローチ、将来のケアニーズのための高度な計画、適切な薬物治療を含む患者とその介護者との間の強力な治療的提携を確立することは、ADにおける効率的なだけでなく、倫理的なケアでもある。
