Contents
Current and emerging therapeutic targets of alzheimer’s disease for the design of multi-target directed ligands
オンラインで公開2019年10月16日
Laura Blaikie,a,* Graeme Kay,a,* and Paul Kong Thoo Lincorresponding authora,*.
要旨
アルツハイマー病(AD)は、世界で最も多くの人が罹患している神経変性疾患であり、世界的な死因の主なものである。この衰弱性疾患に苦しむ人々の数は前例のない速さで増加しており、それに伴い医療費も急増している。
AD症状の治療薬は、臨床的には4種類しかないが、疾患を改善するものではない。そのため、治療法の確立が急務となっている。この衰弱性疾患の原因はまだ十分に解明されていないが、健康やライフスタイル、環境、遺伝的要因など、いくつかの要因が複合的に関与している可能性があると考えられている。
近年では、この病気の特徴的な症状もいくつか発見されており、これらの要因がADの発症に重要な役割を果たしている可能性があると考えられている。コリンエステラーゼ酵素やタウ凝集に加えて、アミロイド凝集もその一つであり、研究が盛んに行われていた。この10年間で、マルチターゲット薬のAD治療への応用がますます研究されるようになってきた。
1つの化合物に2つ以上のファーマコフォアを組み合わせることで、AD発症に関与する複数の因子を標的とすることができる薬剤を合成することが可能になる。これは、併用療法の使用を避けることができるので、特に魅力的なアプローチである。その結果、介護者や家族の負担を軽減し、医療費やソーシャルケアコストを削減できる可能性がある。現在、ADに関与していると広く認識されている因子を阻害する能力があることから、ハイブリッド医薬品の開発には多くの活性型ファーマコフォアが採用されている。
これらの化合物は有望な結果を示しているが、薬効に加えて薬理学的プロファイルを最適化するための研究がまだ必要とされている。一方で、AD治療のための他の潜在的なターゲットについても、継続的に広範な研究が行われている。これまでに得られた結果から、今後もマルチターゲット化合物はAD治療薬としてますます研究が進んでいくものと思われる。
1. はじめに
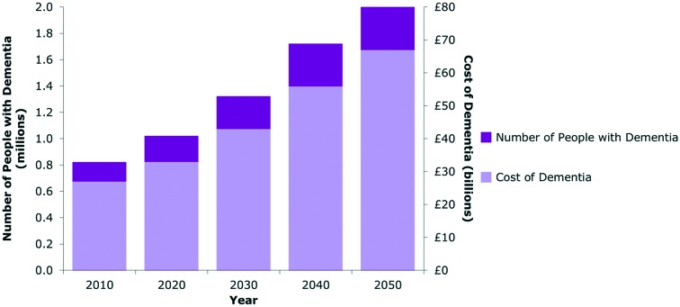
アルツハイマー病(AD)は、最も一般的な神経変性疾患であり、世界的な死因となっている。このゆっくりと進行する病気は、認知症の主な原因であり、記憶や方向感覚の喪失、判断力の低下、言語障害、行動の変化(過敏性、抑うつなど)が特徴である1。ほとんどの場合、ADは、遺伝的要因、生活習慣、環境要因が組み合わさって、時間の経過とともに脳に影響を与えることで引き起こされると考えられている。大多数の神経変性疾患と同様に、ADは年齢に関係しており、主に65歳以上の人が発症する。2015年には全世界で推定4,680万人がADを患っており、この数字は2050年には1億3,150万人に増加し、その後の社会的・経済的負担の増加が予想されている(図1参照)2 英国における認知症の経済的コストは年間260億ポンドと推定されており3,2050年には660億ポンドに増加すると予測されている。
図1 2010年から 2050年の間の英国における認知症患者数の増加と認知症の総費用の増加予測3
この病気には治療法がない。現在、AD治療薬として承認されているのは4つの薬のみで、これらは症状の治療にのみ使用されている。これらの薬は患者の生活の質の向上を目的としているが、病気の進行を止めることはできない5 。その結果、薬の候補は間違ったターゲットに向けて設計されているかもしれないし、少なくともこの病気に関与する唯一のターゲットではない。
2. ADの原因
7 ADの診断は臨床所見に基づいて行われ、記憶喪失、言語障害、見慣れた物や人、場所の認識能力の低下などが見られる。現在の技術では、臨床検査や神経画像検査だけでは診断できない。
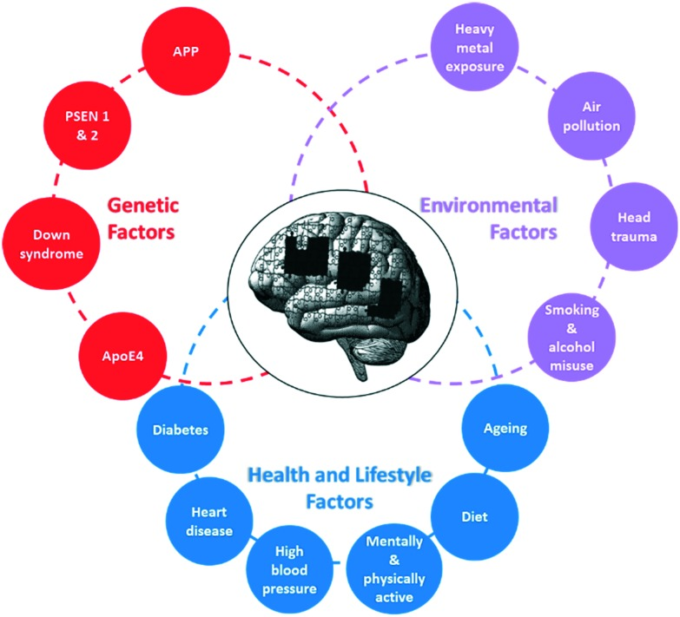
ADは最も一般的な慢性神経変性疾患であるが、この疾患の病因はまだ十分に理解されていない。ADは最も一般的な慢性神経変性疾患であるにもかかわらず、その病因はまだ十分に解明されていない。そのため、現在では、いくつかの因子の組み合わせが疾患の進行に関与しているのではないかと理論化されているが、正確な初期原因は不明であり、様々な起源があるかもしれない。また、近年、遺伝的要因や生活習慣など、本疾患の発症リスクに影響を与える要因も明らかになってきている(図2参照)。しかし、主な危険因子は年齢であり、年齢が上がるにつれて発症の可能性が高くなっている8 。しかし、発症に影響を与える要因(健康的な食生活や生活習慣の維持など)を考慮することで、リスクを低減できると報告されている。
図2 AD発症リスクに影響を与える因子
2.1. 健康と生活習慣の要因
9 心血管疾患とアルツハイマー病との正確な関係は明らかになっていないが、血管疾患が認知症の発症を誘発する可能性があるとの仮説が立てられている。これらの危険因子を回避するためには、健康的なライフスタイル(例:禁煙、アルコール摂取量の減少、健康的な食事の維持、心身ともに活動的な状態を維持すること)と定期的な健康診断を受けることが推奨されている。
2.2. 環境要因
また、鉛やアルミニウムなどの重金属や農薬への慢性的な低レベルの暴露は、精神機能の漸進的な低下を引き起こし、神経変性疾患の発生率を増加させることが報告されている。空気中の鉄分を多く含む強磁性の燃焼由来のナノ粒子が研究され、高度に酸化的であり、ミトコンドリア機能不全、未展開タンパク質の蓄積、カルシウムのホメオスタシス、アポトーシス・シグナリングと関連していることが判明しているが、これらはすべてADとパーキンソン病の既知の特徴です10。
2.3. 遺伝的要因
特定の条件に苦しんでいる患者は、ADを発症するリスクが高いことが判明している。例えば、ダウン症の人に見られる遺伝的欠陥は、時間の経過とともに脳内にアミロイドプラークの蓄積を引き起こし、それがADにつながる可能性がある9。
家族性AD(FAD)は、症状の早期発症(30~40代の患者さん)と関連しており、AD症例の約2~3%を占めている。21番染色体上のアミロイド前駆体タンパク質(APP)をコードする遺伝子の変異は、βアミロイドの産生を増加させたり、短い方のβアミロイド(40アミノ酸)に比べて凝集レベルが高い長い方のβアミロイド(42アミノ酸)の発生率を増加させたりする可能性がある11。この酵素は、APPを切断し、Aβペプチドを形成する役割を担っている。ホモ接合性を有するアポリポ蛋白E4(ApoE4)は、AD発症のリスクが約8倍に増加する主要なリスク対立遺伝子であることが確立されている8 。
3. ADの多因子性
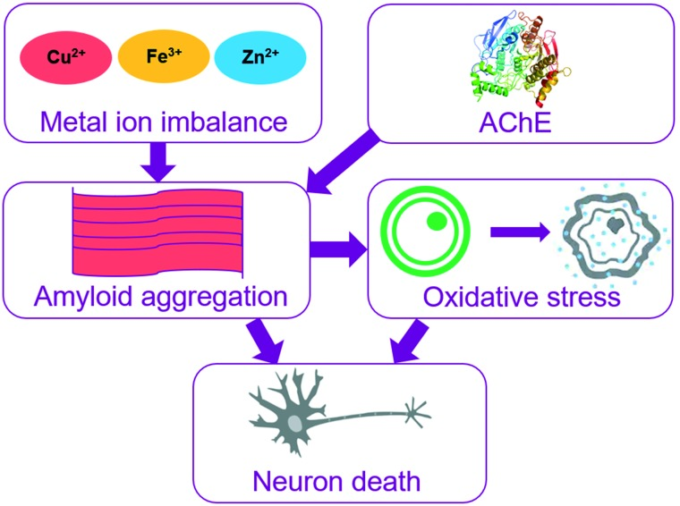
ADの正確な原因は明らかにされていないが、アセチルコリンエステラーゼ、タウタンパク質、活性酸素、金属イオン、βアミロイドなど、いくつかの特徴が病態の進行に関連していることが報告されている(図3参照)12。
図3 ADの病態に関与する因子と主要な治療標的となる可能性のある因子
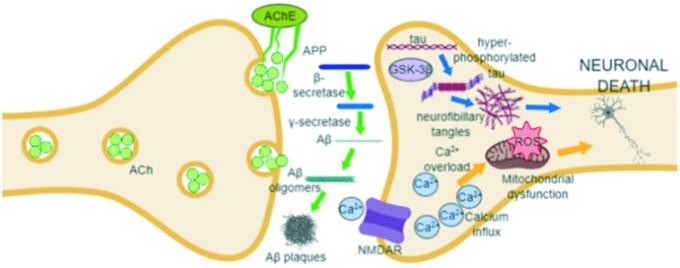
AChE、NMDAR、β-セクレターゼ、γ-セクレターゼ、Aβオリゴマー、Aβプラーク、GSK-3β、神経原線維のもつれ、Ca2+イオン、活性酸素。
3.1. アミロイド凝集
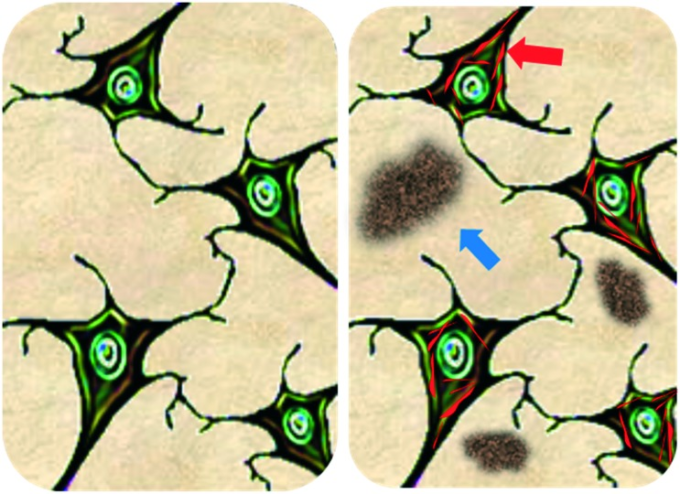
アミロイドβ(Aβ)ペプチドは、典型的には39-42残基の長さのタンパク質であり、アミロイド斑の主成分である:ADのよく認識された特徴。13 Aβ1-42は、Aβの最も豊富なアイソフォームの一つであり、非常に有毒であり、この病気の鍵となる神経毒であると考えられているオリゴマーを生成する傾向がある。過剰なAβモノマーの蓄積とAPP遺伝子内の突然変異が、これらのペプチドの自己組織化に続いて、不溶性のAβ凝集体の産生をもたらし、これが細胞外に堆積して神経細胞の周囲にアミロイド斑を形成する(図4参照)。このプロセスはアミロイドカスケード仮説と呼ばれ、アミロイド蛋白質の凝集がAD発症の刺激であることを示唆している14 。アミロイド斑とAD発症との関連はまだ十分に理解されていないが、Aβ凝集体(オリゴマーなど)は不溶性フィブリルよりも高い神経毒性を誘発することが明らかになっており、これは初期の研究に反している15。
図4 左側の正常な神経細胞と、神経細胞内に神経原線維のもつれ(赤矢印)と細胞外にアミロイド斑(青矢印)が存在するアルツハイマー病患者の神経細胞の図
3.2. 酸化ストレス
酸化ストレスは、癌、神経疾患、糖尿病、喘息などの多くの病理学的状態と関連している16 。その結果、活性酸素種(ROS)やその他のフリーラジカルが蓄積され、細胞の構成要素(例えば、脂質、タンパク質、DNAなど)にダメージを与える可能性がある。酸化ストレスは、化学物質、紫外線、感染性生物などの環境要因によって引き起こされることがある。あるいは、酸化ストレスは、例えば、ミトコンドリアの電子輸送鎖、いくつかの酵素活性(例えば、NADHオキシダーゼ)および炎症性細胞からの呼吸バーストによって、内在的に誘導されることもある16。
活性酸素の例としては、過酸化水素、一酸化窒素、スーパーオキサイドアニオン、およびヒドロキシルおよび一酸化ラジカルが挙げられる。体内の高活性酸素レベルは、DNA構造の変化、タンパク質や脂質の修飾、いくつかのストレス誘発性転写因子の活性化、およびプロ炎症性および抗炎症性サイトカインの産生をもたらす可能性がある17。
脳は、フリーラジカル攻撃や脂質過酸化に弱い不飽和脂肪酸を多く含むため、特に酸化ストレスの影響を受けやすい。さらに、脳は他の組織に比べて抗酸化活性が低下している。
脳は非常に多くの酸素を含んでおり、エネルギー代謝はミトコンドリアでの好気性酸化に支配されている。17 神経細胞死のメカニズムを図5に示する。
図5 ADにおける神経細胞の衰退は、エネルギー代謝に影響を与える酸化ストレスと、遷移金属の相互作用とAβ凝集を誘導するAChEレベルの上昇によって引き起こされる可能性がある。
脂質過酸化は、活性酸素によって生成することができ、神経変性疾患の大部分と関連している。脂質過酸化は、細胞膜の二重層にある脂質に対するフリーラジカル攻撃を伴い、その結果、膜結合型受容体や酵素が不活性化され、生物学的タンパク質やDNAを損傷する可能性のある高反応性化合物が生成される。
3.3. 金属イオンの不均衡
ADは金属イオンの不均衡にも関連している。特に、銅、鉄、亜鉛、アルミニウムなどの金属の過剰な蓄積は、神経細胞に有害な影響を引き起こす可能性がある。銅はAβと強く結合して有毒な複合体を形成し、アミロイドオリゴマーの形成を促進することが知られている。19 金属とAβの間のこの相互作用は、炎症反応を活性化し、活性酸素の産生を増加させる可能性がある。
3.4. タウの凝集
アミロイドプラークの細胞外蓄積に加えて、ADは神経細胞内に神経原線維性のもつれ(NFT)の存在にも関連している(図4参照)。これらは高リン酸化されたタウタンパク質の凝集によって引き起こされる20 。しかし、アルツハイマー病患者のタウのレベルは健常脳に比べて4~5倍も高く、これらのタンパク質は異常にリン酸化されたタウの形をしていることが報告されている21。
3.5. コリンエステラーゼ酵素
コリンエステラーゼは、主に中枢神経系と末梢神経筋接合部に存在する細胞外酵素である。このメカニズムは、正常な細胞のシグナル伝達やニューロンの過剰刺激を防ぐために重要だ。コリン作動性神経系の2つの酵素は、アセチルコリンエステラーゼ(AChE)とブチリルコリンエステラーゼ(BuChE)である。ADは、コリン作動性ニューロンを含む多くの異なるタイプのニューロンの深刻な悪化と関連している23。
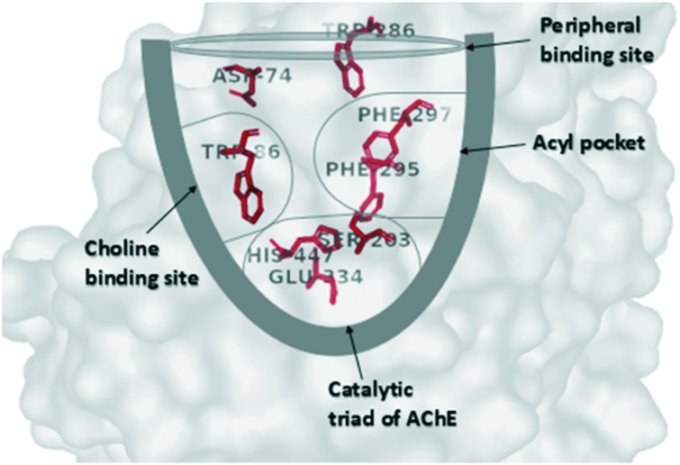
疾患の各段階を通してアミロイドプラークとNFTの周りにAChEのレベルが有意に増加していることはよく知られており、AChEがAβと直接相互作用してプラークの形成を促進する可能性が示唆されている22。現在市販されている臨床薬はすべてAChE阻害薬(ドネペジル、リバスチグミン、ガランタミン)であるが、N-メチル-d-アスパラギン酸(NMDA)拮抗薬であるメマンチンを除いては、5 AChEは酵素峡谷内に2つの明確な結合部位を持っている(図6参照):峡谷の入り口にある末梢アニオン性部位(PAS)と下部にある触媒部位(CAS)である。
図6 AChE結合部位
AChE阻害薬は、酵素の活性を阻害し、アセチルコリンの分解速度を低下させるために、酵素上の1つ以上の部位に結合し、コリン作動性神経伝達を増加させることが知られている。
現在利用可能な臨床的なAChE阻害薬は認知機能を改善することが示されているが、これらの治療法のどれもADの進行を遅らせたり、食い止めたりすることはできない。
3.6. セクレターゼ
APPの処理異常は、神経毒性を持つAβのプラークへの蓄積を引き起こし、アルツハイマー病患者の脳に特徴的な神経細胞の機能障害や死に寄与している24 。
図7 APP の処理におけるシークレターゼ酵素の役割
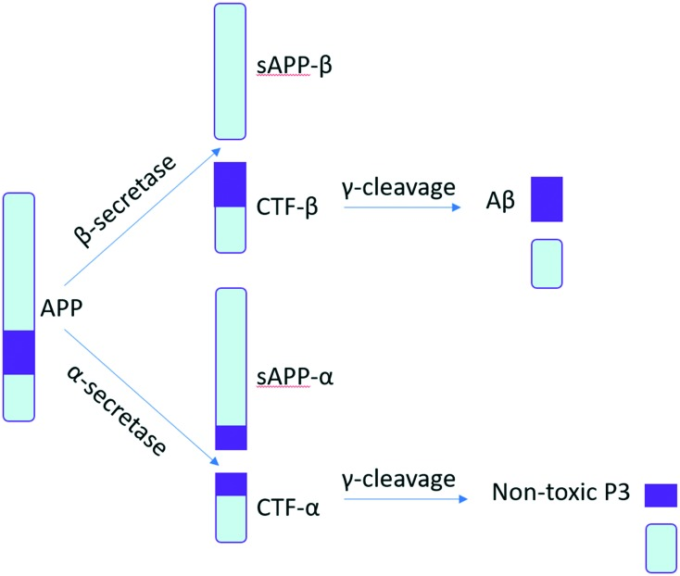
α-セクレターゼ酵素は、アミロイドを生成しない経路でAPPを処理する役割を担っており、APPは切断されて無毒の可溶性ペプチド断片を生成する25 。26 β-セクレターゼ、またはβサイトAPP- cleaving enzyme 1(BACE-1)は、Aβペプチドの形成の第一段階でAPPを切断するアスパラギン酸プロテアーゼである27 。BACE-1の活性はアルツハイマー病患者の脳内で増加しているため、この酵素の阻害剤が研究されていた。しかし、試験管内試験で高い効力を示した阻害剤は、分子量が大きいため、バイオアベイラビリティーや血液脳関門を通過する移動性に制限がある傾向がある28 。最後に、γセクレターゼ酵素は、APPの翻訳後修飾とAβの産生に関与している。 プレセニリン/γセクレターゼ阻害剤はAβの産生を低下させる可能性があるが、プレセニリンはNotchシグナル伝達タンパク質の処理にも重要な役割を果たしているため、致命的な副作用を引き起こす可能性があることも示されている。Notchは細胞の成長と機能において重要な役割を果たしているため、その阻害は忍容性と毒性につながる28 。
3.7. サーチュイン
25 SIRT1 は最も広く研究されているサーチュインであり、その活性は AD に関連するいくつかのプロセスと関連している29 。30 興味深いことに、SIRT1 は、試験管内試験 と 生体内試験 の両方の AD モデルにおいて、アミロイド凝集を減少させることにより、ポジティブな効果があることが示唆されている。30 対照的な仮説では、アルツハイマー病患者ではSIRT1がダウンレギュレートされており、過剰発現はAPPの非アミロイド生成処理の促進を通じたアミロイド沈着の減少だけでなく、神経保護を提供できることが示唆されている。レスベラトロールは、抗酸化特性とAβ毒性に対する保護効果を示し、ADモデルにおいて有益であることが示されている32。しかしながら、他のいくつかのポリフェノール化合物(クルクミン、安息香酸、ケルセチンなど)も同様の効果を有することが示されている33。したがって、レスベラトロールによる SIRT1 の活性化が、観察された神経保護効果の基本的なプロセスであるという仮説が立てられている34 。しかしながら、レスベラトロールの神経保護活性は、その化学的特性に関連しており、SIRT1 の活性化とは無関係であるという証拠がある34 。SIRT1 の役割について有益な効果が報告されている研究では、そのポジティブな効果にはレスベラトロールも含まれている。
3.8. カスパーゼ
カスパーゼは、アポトーシスにおいて重要な役割を果たすシステインプロテアーゼ酵素のファミリーである。アポトーシスの不適切な活性化は、いくつかの神経変性疾患や他の状態(癌など)に寄与する可能性がある。カスパーゼの活性化は、特徴的なアポトーシスの細胞変化の実施をもたらすシグナル伝達イベントのカスケードを開始し、細胞死を加速させる35 。最近のエビデンスは、後の段階で病気の進行に寄与するだけでなく、カスパーゼが病気に関連する初期過程の促進に関与している可能性を示唆している。
3.9. グリコーゲン合成酵素キナーゼ-3
グリコーゲン合成酵素キナーゼ-3(GSK-3)は、セリン/スレオニンキナーゼであり、グリコーゲン合成やグルコース代謝を含むいくつかの重要な細胞プロセスを制御している。また、GSK-3 の過剰発現は神経変性疾患を引き起こす可能性がある。GSK-3 はコリン作動性ニューロンの喪失、炎症、アポトーシス、シナプスの喪失に加えて、タウの過剰リン酸化や有毒 Aβの生成に関与していることが報告されている36 。
3.10. モノアミン酸化酵素B
MAO-Bは、酵素であるモノアミン酸化酵素(MAO)の2つのアイソザイムのうちの1つであり、生体アミンの酸化的脱アミ ン化とその後の過酸化水素の生成に重要な役割を果たしている。MAO-B活性は、アルツハイマー病患者の脳内で増加することが判明している。しかし、ADの病因におけるその役割は、現在のところ不明である。第二のMAOアイソフォームであるMAO-Aもまた、最近、AD脳の皮質で活性が増加し、ADにおける役割を持つことが示された。MAO-A免疫反応性ニューロンのレベルは、重度のアルツハイマー病患者では減少していた39。
3.11. セロトニン
セロトニン、または5-ヒドロキシトリプタミン(5-HT)は、モノアミン神経伝達物質である。一般的に「幸せの化学物質」と呼ばれるセロトニン は、幸福感と気分の調節に重要な役割を果たしている40 。40 セロトニン系の正確な機能は、その複雑さのために十分に理解されていないままである。しかしながら、認知、学習、記憶の調節に関与していることが知られている。SSRIは、シナプス前受容体へのセロトニンの再取り込みを制限することでこれを達成する。最近の研究では、セロトニン-6受容体の中枢神経系での発現量が高いことから、セロトニン-6受容体のアンタゴニストの開発に焦点が当てられている。初期の臨床試験では、短期記憶や認知の改善が期待された。42 この失敗は過少投与によるものかもしれないが、併用療法の試験も失敗しており(アセチルコリンエステラーゼ阻害剤やメマンチンとの併用)認知機能の改善が見られなかった。
3.12. N-メチル-d-アスパラギン酸受容体
N-メチル-d-アスパラギン酸受容体(NMDAR)は、記憶と学習で役割を果たし、グルタミン酸(アゴニスト)がそれに結合している間、正イオン(Ca2+)が細胞膜を通過することを可能にすることによって機能する43。NMDAR の過剰な活性化は、Ca2+イオンの流入とフリーラジカルの発生をもたらし、最終的にシナプス機能障害と神経細胞死を誘導する。多くの NMDAR アンタゴニストは、衰弱する副作用のために効果がないことが証明されている。NMDARの過剰活性化の抑制が望まれる一方で、受容体の正常な機能は維持されなければならないことが判明した。メマンチンはADの進行を遅らせることが報告されているが、これについては弱い証拠しか存在しない。メマンチンはNMDARのチャネルを遮断することで作用するが、脳機能の本質的な活性化に必要な生理的活性化を可能にし続ける。多くの仮説があるにもかかわらず、メマンチンがどのようにしてこの効果を得ることができるのかはまだわかっていない。したがって、本薬とそのターゲットのさらなる研究が進めば、ADだけでなく、多発性硬化症や緑内障など、NMDARの過剰活性化に関連する他の多くの疾患の理解に役立つ重要な情報が得られる可能性がある。
3.13. ムスカリン受容体とニコチン性アセチルコリン受容体
アセチルコリン受容体(AChR)は、アセチルコリンの結合によって刺激されるシグナル伝達性のインテグラル膜タンパク質である。これらの受容体は、それぞれのアゴニストであるムスカリンとニコチンによって特徴づけられる。AChRのこのサブタイプの中には、さらにいくつかのサブタイプがある;すなわち、M1-M5である。M1 型はタウの脱リン酸化を誘導することが報告されており、M2 はアセチルコリンの放出を阻害する45 。M2受容体はβ-セクレターゼ活性の低下と関連していると報告されており、M3の刺激はγ-セクレターゼ活性を増加させ、脳内アミロイドプラークの形成を減少させると考えられている。しかし、アゴニストは特異的ではなく、他の受容体サブタイプを活性化することが判明した。
nAChRは認知機能にも関連しており、α-セクレターゼ活性を促進することでアミロイドプラークの形成を阻害することが示されている26。その結果、mAChRsとnAChRsの両方を活性化することがAD治療の有望なルートとなっている。
3.14. 核因子エリスロイド2関連因子2
Nrf2は細胞防御遺伝子の活性化に関与する転写経路であり、抗酸化酵素や抗炎症酵素の遺伝子や、損傷を受けたタンパク質の排除に関与する遺伝子などが含まれている46 。さらに、GSK-3βはNrf2をダウンレギュレートし、GSK-3βのレベルがアルツハイマー病患者で増加することを考えると、Nrf2の大幅な減少は、酸化ストレスに対する神経細胞の感受性を高めるために重要であると考えられる47。
4. AD治療のための現在の臨床薬
臨床的に入手可能な薬剤は、AChE(N-メチル-D-アスパラギン酸(NMDA)受容体)の作用を阻害することを目的としている2 。メマンチンはNMDA受容体拮抗薬であり、重症のAD治療に用いられる。
図8 承認されたAD治療薬の化学構造
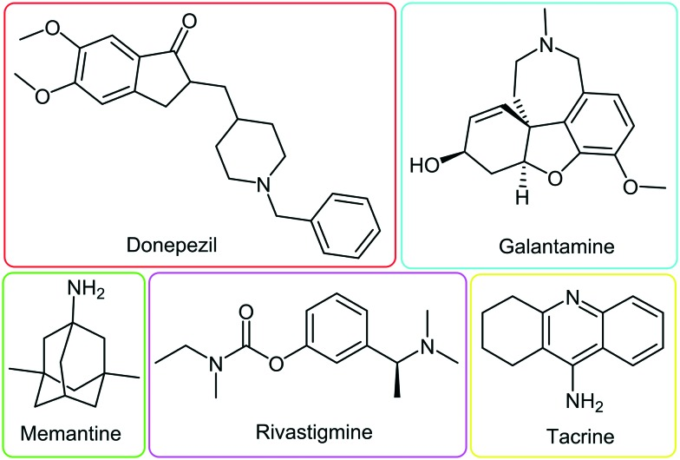
4.1. 作用機序
ADのコリン作動性仮説(前脳基底部のアセチルコリンニューロンの喪失、アセチルコリン合成のための酵素活性の低下が認知機能の低下に起因する)に基づき、コリンエステラーゼを不活性化してAChの分解を阻害するためにAChE阻害剤を使用することが提案されていた1。リバスチグミンはAChEを阻害し、プラーク沈着の原因となる活性部位の一部をブロックする。
ガランタミンはシナプス前後のニコチン受容体を刺激し、AChのレベルを上昇させる。
図9 コリンエステラーゼ阻害剤(タクリン、ドネペジル、リバスチグミン、ガランタミン)とNMDA拮抗剤(メマンチン)の作用機序
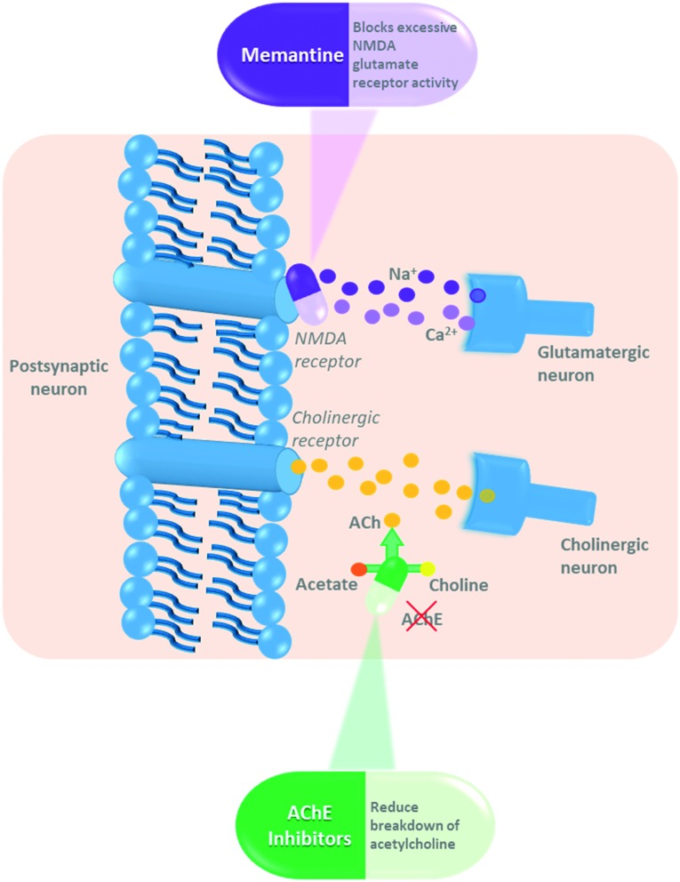
4.2. 薬剤の効果
作用機序の違いにもかかわらず、これらのAD治療薬の臨床効果は類似している。一般的に、AChE阻害薬は認知機能の低下率を低下させるという点では中程度の効果がある。AChE阻害薬は通常、疾患の初期段階で処方され、患者が中等度から重度のADに進行した場合にはメマンチンが推奨される。しかし、ドネペジルとメマンチンの相乗効果が報告されたことから、ドネペジルとメマンチンの併用療法が行われるようになってきている1。
4.3. 副作用
タクリンは1993年に初めてAChE阻害剤として臨床導入された。コリンエステラーゼ阻害剤の使用に伴い、悪心、嘔吐、下痢などの消化管障害が頻繁に報告されているが、これは末梢神経系のアセチルコリン濃度の上昇に起因していると考えられる。リバスチグミンは他のコリンエステラーゼ阻害剤と比較して副作用の発現率が最も高かったことが報告されており、同等の有効性を維持しながら副作用の少ない経皮投与の導入が進められている48。
4.4.コスト
コリンエステラーゼ阻害剤に関連する有望な知見にもかかわらず、英国では製造コストのためにその開発が妨げられてきた。2005,イギリスのNHS(英国保健医療局)は、薬の利点は費用を補うものではないという事実を理由に、コリンエステラーゼ阻害薬とメマンチンの大多数のアルツハイマー病患者への配布を停止することを提案した。この見解は広範な論争に会ったので、NHS(英国保健医療局) は中等度から重度の AD 患者にコリンエステラーゼ阻害剤の提供を継続することが 2006 年に発表された。しかし、メマンチンへのアクセスは依然として限られている。2016/17年のNHS(英国保健医療局)の総支出は1,440億ポンドで、認知症の投薬費は4,000万ポンドであった49。また、臨床的に最も安価な薬であり、患者一人当たり年間わずか21ポンドである50。
5. AD治療のための新薬の開発
新規AD治療薬の開発が急務であるにもかかわらず、創薬から承認までの期間は10~15年と推定され、全体の失敗率は95%を超えるなど、開発プロセスは大規模かつ複雑である(図10参照)。
図10 2019年のAD治療のための臨床試験中の化合物で、所望の標的によって特徴づけられる
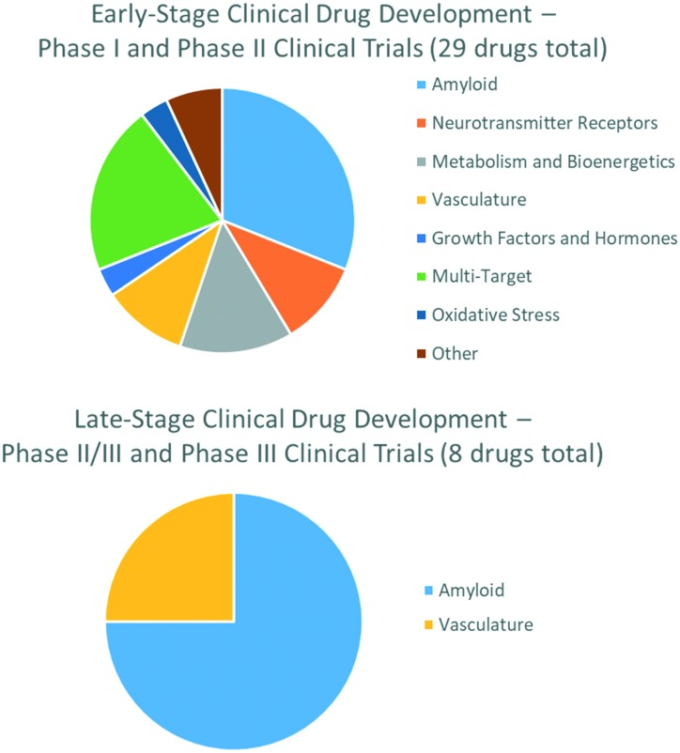
各相の目的は、第I相-安全性と用量、第II相-有効性と副作用、第III相-有効性と副作用のモニタリング、第IV相-安全性と有効性を試験することである。各フェーズでは、試験参加者数や試験期間が増加している52。
このような高い不成功率は、ADの正確な原因が十分に理解されておらず、疾患の各段階に様々な要因が関与している可能性があるという事実の結果である可能性が高いと考えられる。その結果、治療目標を正確に特定することができない。臨床的な失敗の主な理由は毒性であり、これは、標的およびその標的を含むあらゆる生理機能に対する薬剤の影響に関連している可能性がある。アミロイド仮説はADの主要な病理学的特徴の一つと考えられているにもかかわらず、この標的に対して開発された薬剤が有意な有効性を示すことができないのは、効果的な標的の検証ができていないためであると考えられている。そのため、薬剤とプラセボを比較する試験は、患者さんごとに病気の影響を受け方が異なるため、信頼性が低いと言えるであろう。
近年、AD発症に関与すると考えられるいくつかの因子が発見されたことにより、新薬のターゲットに大きな影響を与えている。その結果、ADの進行に関与する様々な因子を標的とした様々な治療法が研究開発されている。
6. AD治療のためのマルチターゲット化合物
歴史的に、医薬品開発は、1つの分子を1つの標的に使用して1つの疾患を治療するという考え方に基づいて行われてきた。しかし、神経変性疾患、がん、糖尿病を含むほとんどの疾患の病態は多因子性であるため、単一の標的に対する薬剤では不十分である可能性があるという認識が広まってきている54 。
単一の薬剤では不十分であることが明らかになった場合には、様々な病態の経路を治療するために、異なる標的を持つ複数の薬剤を処方することが一般的になっている55 。また、併用療法は、潜在的な薬物間相互作用による毒性や副作用のリスクが高まり、患者の介護者や家族の負担も大きくなる。
その結果、疾患に関与する異なる標的に作用する複数の異なるファーマコフォアからなるハイブリッド分子を開発し、様々な標的と相互作用し、複雑な多因子疾患を治療する能力を持つマルチターゲット指向性リガンド(MTDL)を1つにすることで、薬物設計のための新しい戦略が提案されている57。最近、MTDL開発のために採用された様々な化学的足場を含む、AD治療のためのマルチターゲット戦略の新たな進歩をカバーする数多くの注目すべきレビューが発表されている58-60。
しかし、マルチターゲットアプローチは、2つ以上のファーマコフォアを組み合わせた結果、ハイブリッド分子が大きくなる傾向があるという事実を含め、医薬化学者に新たな課題をもたらす61 。62 ADの正確な病因が不明のままであることを考えると、適切な生物学的標的を特定することも困難である。62 ADの正確な病因が不明であることから、適切な生物学的標的の特定も困難であり、その結果、主要な標的を選択できる確率が低いにもかかわらず、利用可能な情報のみに基づいたハイブリッド医薬品の開発が行われている。以下の表1は、マルチターゲット創薬戦略に伴うメリットと課題を示したものである。
表1 MTDL開発のメリットと課題

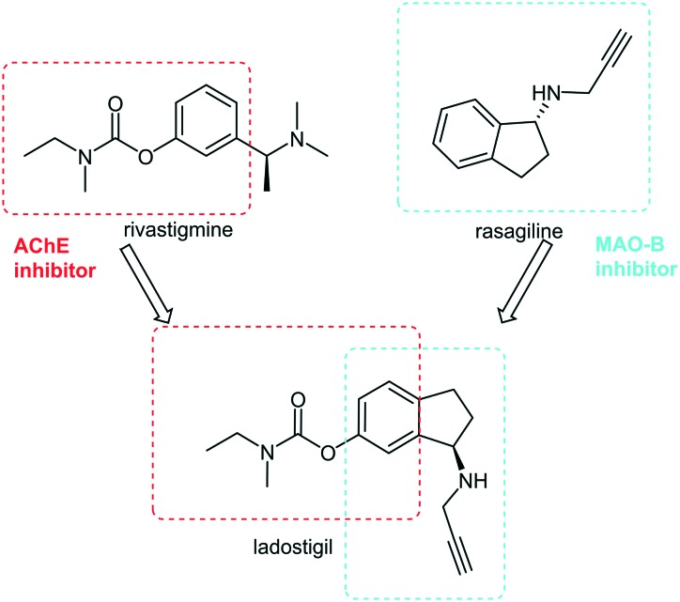
ラドスチギルは、リバスチグミン(AChE阻害剤)とラサギリン(MAO-B阻害剤)のファルマコフォアを組み合わせたハイブリッド医薬品(図11参照)であり、軽度認知障害を有する患者さんの神経変性低下を遅らせる作用を示し、第Ⅲ相臨床試験に移行している。63 ラドスチギルは、各標的に対する阻害活性は親化合物と同程度であり、齧歯類においてAChEの活性を25~40%、MAO-Bの活性を70~90%低下させることが報告されている。このことは、異なる作用モードを持つ複数の活性部位を単一のハイブリッド薬剤に結合させることで、ADに関与する複数の因子を標的とし、相加的な効果と副作用のリスクを低減することができる可能性を示している。
図11 リバスチグミンとラサギリンの活性部位を持つラドスチギルの開発メカニズム64
AD治療薬としての天然物の使用もまた、過去10年間で徹底的に研究されていた。65 天然物由来の化合物の多くのクラスは、神経保護を提供することが示されている;例えば、Aβ凝集、BACE-1,および酸化ストレスを阻害することによって。天然化合物のそのような構造クラスは、アルカロイド、ポリフェノール、フラボノイド(例えばヘスピリジン)66.66研究はまた、この分野での最近の進歩は、AChE阻害剤、抗酸化剤、およびAβ凝集阻害剤としての可能性を持つ真菌代謝物、テヌアゾン酸を含む、このような紅藻類、および多価不飽和脂肪酸などのAD治療薬として海洋源から得られた化合物の可能性を報告している67.65。さらに、Pseudis platensisの両生類の皮膚から抽出した抽出物は、AChE、BuChE、MAO-B、酸化ストレスに対してバランスのとれた効力を示した68。
7. AD治療薬として開発中のマルチターゲット化合物
過去10年の間に、ADにおいて役割を果たす明確な標的を持つ異なるファーマコフォアを組み合わせることにより、マルチターゲット薬が開発されていた。これらのファーマコフォアは、疾患に関与する因子と相互作用する能力が報告されている先行研究に基づいて一般的に選択されている。表2は、MTDLの開発に最近採用された例示的なリガンドを示している。
表2 AD治療のための共通リガンドとその標的
| 目標 | リガンド
|
参照。 | |
| コリンエステラーゼ酵素 | タクリン |  |
69 |
| ドネペジル |  |
70 | |
| リバスチグミン |  |
64 | |
| アミロイド凝集 | メモキン |  |
71 |
| クルクミン |  |
72 | |
| ベンジルアミン |  |
73 | |
| 酸化ストレス | バニリン |  |
74 |
| リグストラジン |  |
75 | |
| ケルセチン |  |
76 | |
| 金属キレート化 | イミダゾール |  |
69 |
| クリオキノール |  |
77 | |
| アミノピリジン |  |
78 | |
| MAO-B | ラサギリン |  |
63 |
| セレギリン |  |
79 | |
| クマリン |  |
80 | |
| BACE-1 | アミノヒダトイン |  |
81 |
| ヒドロキシエチレン |  |
82 | |
| アミノキノリン |  |
83 | |
| タウ | ロダニン |  |
84 |
| ニトロカテコール |  |
85 | |
| フェノチアジン |  |
84 | |
| サーチュイン | インドール |  |
86 |
| レスベラトロール |  |
32 | |
| カルボキサミド |  |
86 | |
| カスパーゼ | スルホンアミン |  |
87 |
| イサチン |  |
88 | |
| ホモフタルイミド |  |
88 | |
| GSK-3β | 環状アミド |  |
89 |
| マレイミド |  |
90 | |
| キノロン |  |
90 | |
| セロトニン | ベンズイミダゾール |  |
91 |
| インドール |  |
92 | |
| スルホンアミド |  |
92 | |
| NMDAR | メマンチン |  |
93 |
| キノキサリン |  |
94 | |
| ベンゾキノリジウム |  |
95 | |
| mAChRおよびnAChR | アレコリン |  |
26 |
| チアジアゾール |  |
26 | |
| メチルピペリジン |  |
26 | |
| Nrf2 | シンナムアルデヒド |  |
96 |
| メラトニン |  |
97 | |
| スルフォラファン |  |
47 | |
図12 タクリン-ビフェンド酸抱合体の構造設計.98

ビフェン酸塩は,タクリ ン誘発毒性から肝細胞のミトコンドリアを保護することが報告されていることから,薬剤の肝毒性を軽減するために採用された。また、AChE阻害活性を高めるためにジアミンリンカー鎖が用いられた。Cenら.98は、リンカー鎖の長さがAChE阻害活性に最大の効果を有するというHiremathadら.69の知見を支持した。逆に、Cenら.98は、炭素数8の鎖長が最も高い効力を示したと報告している。これは、ビフェンダート部位がヒドロキシフェニルベンズイミダゾールとは異なる大きさであること、または共役部位がAChE酵素の活性部位内の異なる部位と相互作用していることに起因すると考えられる。合成されたすべての化合物は、ナノモル濃度範囲(27〜944 nM)で阻害活性を有し、試験管内試験ではタクリンおよびクルクミンよりも高い効力でAβ凝集を阻害することがわかった(65〜90%の阻害、タクリンは5%、クルクミンは53%)。最も強力な阻害剤は、ヒト肝細胞においてタクリンに比べて肝毒性が低いことが報告されているが、同濃度での細胞生存率の差は有意ではなかった。
Atanasovaら(99)は、AChEとのデュアルサイト結合を実現し、その結果として活性を高めるために、ガランタミンとインドール部位との組み合わせを提案している。最も活性の高い誘導体(図13を参照)は、AChEに対してガランタミン自体よりも95倍以上の活性があることが判明した(IC50は、ガランタミンの1.07μMに対して、Ellman’s assayで決定された0.011μMのIC50)。さらに、より長い連結鎖を有する誘導体は、AβのΩループが酵素と相互作用することも示されたPASの近位にある同じ領域に結合することによって、AChE上のAβ沈着をブロックすることができることが示唆された。
図13 インドール部位を有する最も強力なガランタミン誘導体の構造.99

7.2. Aβ凝集抑制作用と抗酸化作用
Orteca et al 100は、Aβ凝集に対する阻害活性を研究するために、一連のクルクミン誘導体を開発した。その結果、バニリンのような芳香族構造を持つ誘導体は、ThTアッセイにおいてアミロイド線維を有意に破壊することが観察された(図14のDC50はそれぞれ0.78μM,0.31μM)。
図14 バニリン芳香族部位を含む最も活性の高いクルクミン誘導体の構造.100

著者らは,化合物の阻害活性には,剛直なリンカーと極性置換基に加えて,高度に共役化された構造が重要であることを指摘している。そのため,バニリン部位を有する誘導体が最も活性が高いことが判明した(例えば,バニリン誘導体のDC50は0.73μMであったが,芳香族置換基を有しない同じ一般構造の化合物では活性が観察されなかった)。誘導体は、神経細胞に対してグルタミン酸毒性からの保護効果を示した(グルタミン酸単独投与時には35%であったのに対し、クルクミン誘導体を投与した場合には細胞増殖が70〜90%に増加した)。したがって、クルクミン誘導体中のバニリン芳香族構造がAβフィブリルや酸化ストレスに対する活性に重要であることが報告された。
7.3. AChE阻害と抗酸化
Liら75は、フェノール酸とリガスタジンを共役にした一連のタクリン誘導体を合成した。後者は酸化ストレスや炎症から細胞を保護する能力に基づいて選択され、フェノール酸は神経保護と肝臓保護の能力に基づいて採用された。神経保護剤として最も可能性を示した化合物を図15に示す。
図15 タクリン-フェノール酸-リグスタジンハイブリッド化合物の一般構造(神経保護剤として最も高い効力を示した化合物はn=6)75

本剤の AChE 阻害活性には使用するフェノール酸の種類が大きく影響し、例えばシナピン酸部位を有する化合物はクマリン酸を含有する化合物よりも高い活性を示すことが報告されている。しかし、どの構造的特徴が化合物の活性に影響を与えるかを決定するために、他の研究論文のデータを使用した。この方法では、結果が複数の試験の平均値としてではなく、使用した研究論文のタクリン当量として報告されているため、信頼性が低い可能性がある。さらに、著者らによって使用された方法は、参照された論文で使用された方法と同じではないかもしれない。最も強力なAChE阻害剤は、IC50が65.2 nMであり、試験管内試験でアミロイド凝集を防ぐことができたと報告されている。しかし、試験した濃度は20〜100μMの範囲内であった。細胞内での化合物の細胞毒性を決定するために再び異なる濃度範囲を使用したが、これはかなり低かった(1.25-10μM)。したがって、化合物が非毒性の濃度で活性であったかどうかは不明である。
Lamieら.101はまた、一連のフタルイミド誘導体を開発し、それらの抗酸化活性およびその他の特性を研究した。抗酸化活性の点で最も活性の高い化合物(図16参照)は、Troloxの18倍の値を示した。なお、抗酸化活性の測定にはORACアッセイのみを用いた。したがって、今後の研究では、化合物の抗酸化活性をさらに調査するために、他のアッセイ(DPPH、FRAPなど)を含む可能性がある。一方、他のフタルイミド誘導体は無視できるほどの抗酸化活性を示したが、そのため、フタルイミド部位が抗酸化活性に関与していない可能性がある。また、これらの化合物を様々な細胞株で試験したところ、細胞毒性は報告されなかった。
図16 最大の抗酸化活性を持つフタルイミド誘導体の構造 101

7.4. AChE阻害、Aβ凝集阻害、抗酸化物質
Scipioni et al 102は、バニリンとタクリンを組み合わせたマルチターゲット指向性リガンドを開発した(図17)。この化合物は、酸化ストレス、AChE、Aβ凝集に対して試験管内試験で有望な活性を示した。
図17 バニリン-タクリンマルチターゲットハイブリッドの構造設計.102

この化合物の抗酸化活性(DPPH IC50 = 20.5 μM)は、バニリンの構造的特徴(電子の非局在化、第三級アミン、フェノール基を含む)に起因すると報告されている。この示唆は、短い鎖(例えば、2個のメチレン基)では末端部位がコリン結合部位と相互作用しないことが報告されているLi et al 103によって確認されている。しかし、著者らは、鎖の柔軟性の重要性という点でScipioni et al 102と意見が一致しない。しかし、著者らは、鎖の柔軟性の重要性という点でScipioniら.102に反対しており、その代わりに、鎖が長すぎると柔軟性が増し、活性部位が結合部位と相互作用できないような分子構造の乱れが生じる可能性があると述べている。さらに、Liら.103は、大きな末端基があると剛性が高まり、その結果、酵素への結合能が高まることを示唆している。また、Scipioniら.102が開発した化合物のAβ凝集抑制活性は、リンカー鎖の柔軟性が低く、リンカーの長さが長いことに起因することが示唆された。一方、Siposovaら.104は、リガンドのコンフォメーションの柔軟性は、分子が適合するように容易にコンフォメーションを調整できるため、アミロイド原性タンパク質の結合部位との最適な相互作用を可能にするために重要であることを報告している。(Tu er al)。105はまた、十分な長さと柔軟性のリンカー鎖が効果的なAβ阻害剤に必要であることを支持した(プロピルリンカーはAβ凝集に対する最大の阻害活性を示すことが判明した)。
7.5. AChE阻害、Aβ凝集阻害、金属キレート化
高知 et al 106は、ADの発症に関与するいくつかの因子を標的とすることを目的として、一連の多機能金属キレート剤を開発した。アミノピリジン誘導体は、試験管内試験でのAChE阻害作用に加えて、金属キレート作用を有することが報告されている。合成された化合物の一つ(図18参照)は、分子構造中にベンザゾール足場が存在することにより、Cu(ii)とZn(ii)の結合を可能にし、Aβペプチドと相互作用することが示された。有意なAChE阻害活性が報告され、IC50は52.4 nMであった。これは、酵素活性部位との二重結合によるものと考えられ、AChEの触媒アニオン性部位(CAS)と周辺アニオン性部位(PAS)の両方との相互作用が関与していると考えられた。AChE酵素のPASは、Aβペプチドのフィブリルへの凝集に関連している。
図18 β-アミノピリジンキレート誘導体の化学構造.106

タクリン-ヒドロキシフェニルベンズイミダゾールハイブリッドを合成し(図19)ナノモル濃度範囲でAChEを阻害し、試験管内試験でラジカル消去能と金属キレート能を示すことが示された69。
図19 タクリン-ヒドロキシフェニルベンズイミダゾールハイブリッドの構造設計.69

Hiremathadら69は、リンカー鎖が短い化合物が最大のAChE阻害活性を示し、クロロ置換も活性にプラスの影響を与えることを報告している。リンカー鎖にヒドロキシル置換基を有する化合物は、AChE 阻害活性を高めるとともに、ラジカル消去能を高めた。しかし,本化合物のラジカル消去能は,ヒドロキシフェニルベンズイミダゾール酸に比べて有意に低かった(EC50は160μMではなく500μM程度)。この適度なラジカル消去活性は、フリーラジカルに対して有意な活性を示さないタクリンとの併用によるものと考えられる(EC50が1000μM以上)。これらの化合物は、誘導された酸化ストレスおよびAβオリゴマー化から神経芽腫細胞を適度に保護した。しかし、AChEに対して最大の阻害活性を示した化合物は、Aβ誘導細胞毒性に対して最も低い活性を示した。この試験にはポジティブコントロールも含まれていなかったため、ハイブリッド化合物について得られた値は、この細胞株における酸化ストレスまたはAβオリゴマー化の既知の阻害剤と比較することはできなかった。各化合物が細胞毒性を誘導する濃度も報告されていない。
7.6. AChE阻害およびGSK-3β阻害
Jiang et al 107は、AChE阻害剤であるタクリンとGSK-3β阻害部位であるピリドチアゾールからなる一連のハイブリッド化合物を開発した(図20参照)。
図20 最も活性の高いAChE/GSK-3β阻害剤の構造解析.107

最も活性の高い化合物は、AChEを6.5 nMのIC50で阻害し、GSK-3βを66 nMのIC50で阻害することが試験管内試験で報告された。また、ハイブリッドは20μMでAβの凝集を46%阻害することがわかった。一方、いずれの化合物もタクリン部位の存在により毒性に問題があることが予想された。最も活性の高い化合物の毒性は、ヒト肝細胞で試験され、35μMのIC50を与えた。しかし、対照は試験されなかった。その結果、タクリンに比べて毒性が改善されたかどうかは不明である。著者らは、これらの化合物はマウスにおいて肝毒性を示さなかったと報告しているが、タクリンについても有意な肝毒性は報告されていない。これは、本剤が1回のみ投与され、合計36時間の測定値が記録されたことに起因すると考えられる。
7.7. AChE及びMAO-B阻害
また、フェノール誘導体は、マルチターゲット医薬品としての可能性があることから、近年関心が高まっている。Sang et al 108は、2-アセチル-5-O-(アミノアルキル)フェノールの誘導体が、試験管内試験でコリンエステラーゼやMAOに対する阻害活性、抗酸化作用や神経保護作用、金属キレート作用を示したことを報告している。最も活性の高い化合物(図21参照)は、AChEを0.96μMのIC50で、MAO-Bを6.8μMのIC50で阻害することができた。
図21 最も活性の高い2-アセチル-5-O-(アミノアルキル)フェノール誘導体の化学構造

また、これらの化合物がMAO-Aを阻害する可能性も示唆されていたが、これらの薬剤を組換えヒトMAO-Aで試験したところ、活性は報告されなかった。図21の化合物の酸素ラジカル吸光能(ORAC)は、トロロックス換算で1.5μMであることが示された。さらに、本化合物は血液脳関門を効率よく通過し、CASとPASの両方と同時に相互作用することが報告されており、高いAChE阻害活性を有していると考えられた。本化合物は、10μMで73.3%の生存率を示し、過酸化物による傷害から細胞を保護することが確認された。CuCl2の存在下では、フェノール誘導体の314nmのUVピークは356nmにシフトした。研究した他のバイオメタルについては変化はなかった。したがって、この化合物は、Cu(ii)のための選択的なキレート剤であることを示している。Cu(ii)は主にアミロイドプラークの形成に関連しているため、この選択性は重要である。
7.8. AChE阻害とNMDAR拮抗
93 メマンチンは、臨床的に利用可能な唯一のNMDA受容体拮抗薬であり、中等度から重度の認知症の治療に処方されている。メマンチンは、中等度・重度の認知症治療薬として処方されている唯一の臨床用 NMDA 受容体拮抗薬である。この化合物(図22)は、試験管内試験でAChEとNMDARに対して、それぞれIC50が0.695μM、Kiが2.32μMと、バランスのとれた効力を示すことがわかった。
図22 ガランタミンとメマンチンのハイブリッドの構造 93

ガランタミン誘導体は、齧歯類においてAβ誘発性神経毒性を回復させ、行動障害を抑制することが報告されている。しかし、本剤がAβと同時に投与されたことは極めて重要である。したがって、著者らは、この化合物が疾患のごく初期段階での治療に適しているだろうと示唆したが、Aβが十分に凝集し、ADの初期段階でも観察される特徴的な毒性効果を誘発するのに十分な時間が与えられなかった可能性がある。それにもかかわらず、本化合物の投与は理想的なものではなかった(7日間の慢性的な脳への直接注入)。したがって、本化合物をADの潜在的な治療薬として提案する前に、薬物動態プロファイルの改善や代替的な投与方法の研究を継続することが重要であると考えている。
7.9. AChE 阻害と Nrf2 誘導
Benchekroun ら(97)は、タクリン部位とメラトニンを組み合わせることで、AChE を阻害し、Nrf2 の転写経路を活性化する多機能性化合物を開発した。また、化学構造にフェルラ酸を添加することで、タクリン部位に起因する肝毒性を低減し、抗酸化活性を高めることができた。図23は、最も活性なマルチターゲットハイブリッドの構造を示しており、AChEに対するIC50は1290 nMであり、試験管内試験では3 μMでNrf2を有意に誘導する能力がある。しかし、タクリンによる AChE 阻害について報告されている値は 420 nM であり、通常は 230 nM 程度であるのに対し、103,107 この化合物は抗酸化活性を有することも報告されており、ORAC アッセイでは 9.11 TE を示し、神経細胞株における Aβ 毒性に対する神経保護効果も報告されている(1 μM で 70.6%)。
図23 タクリン-メラトニン-フェルラ酸ハイブリッドの化学構造.97

7.10. BACE-1阻害とGSK-3β阻害
グアニジン部位と環状アミド基を組み合わせた化合物を BACE-1 阻害剤、GSK-3β 阻害剤として開発したのは Prati ら(89)である。このハイブリッド化合物の試験管内試験における BACE-1 阻害効果は 18.03 μM、GSK-3β阻害効果は 14.67 μM であった。
図24 最も活性なBACE-1/GSK-3β阻害剤の構造設計89

中程度のBACE-1阻害レベルは、フッ素置換基が極性および疎水性結合を介して酵素活性部位の残基と相互作用しているためであると著者らは推測している。この化合物は最も活性が高くないにもかかわらず、著者らは、2つの標的に対して適度なバランスのとれた活性と低分子量を有していることから、この化合物が最も有望なマルチターゲット化合物であると提案した。この提案は、複数の標的を部分的に阻害する方が、単一の標的を完全に阻害するよりも効率的で、副作用が少ないことを報告しているZheng et al 109によって支持された。
7.11. 金属キレートとタウ凝集
Silvaら.110は、タウ凝集の多機能阻害剤および銅キレート剤として、カルボキサミド基を有するニトロカテコール誘導体を採用した。著者らは、ニトロカテコールが抗凝集活性に不可欠であり、カルボキサミド基の存在がこの活性を有意に増強することを報告している。また、シアノ基を化学構造に組み込むことで、タウ凝集抑制活性が向上するように思われ、この部位を含むすべての化合物において、50μMで70%以上の凝集抑制効果が得られた。また、この部位を含む化合物のみが有意な活性を示すことが報告されているため、シアノ基は銅キレート活性と関連している可能性がある。最も活性の高いハイブリッドは銅をキレートし、50μMで89.2%のタウ凝集を試験管内試験で阻害した(図25に示す)。どの化合物も鉄をキレートすることはできなかったが、Bagheri et al 111は、銅がプラーク形成やAD発症に関与する主要な生体金属であることを報告している。
図25 カルボキサミドを有する最も活性の高いニトロカテコール誘導体の構造解析.110

8.マルチターゲット薬開発に向けたADの新たなターゲット
研究者は、ADの治療のための新規ターゲットの可能性を継続的に特定している。多くの場合、他の神経変性疾患やがんなどの類似疾患の発症に寄与することが知られている因子が、ADにおいても同様の機能不全を有することが明らかになっている。その結果、これらの特定のターゲットをターゲットとした治療薬が、すでにAD以外の疾患の治療のために開発されている可能性がある。これらの治療法がAD治療にも有効であることが判明したことから、薬剤の再利用が一般的になってきている。代替疾患のための治療薬の再利用は、彼らが目指していた特定の疾患のための高度な臨床試験では成功しなかったが、初期の試験では有望性を示した化合物で行われることが多い。そのため、別の疾患が同様の方法で発症することが判明した場合には、その薬剤がその疾患の治療薬として試されることになる。リパーポージングは、すでに承認され、確立された薬を使用するため、創薬の革新的な戦略として人気が高まっている。そのため、従来の医薬品開発アプローチに伴うコストや高い失敗率を回避することができる。
より成功したAD治療薬を生み出すことを目的として近年採用されているもう一つの技術は、in silico薬物設計である。113 試験管内試験データは、定量的構造活性関係(QSAR)データマイニング、分子モデリング、機械学習などの予測モデルを形成するために使用される。これらのモデルは、薬物標的との相互作用を強化し、薬物動態プロファイルを改善することで、新規リガンドを最適化するためにも使用できる。
8.1. ユビキチン
ミスフォールドされたタンパク質の蓄積は、毒性効果と関連しており、最終的にはADを含む神経変性疾患の発症につながる。一般的に、ミスフォールドされたタンパク質は、ユビキチンプロテアソームシステム(UPS)を介して細胞によって分解される。このシステムは、オートファジーや分子シャペロンとともに、誤って折り畳まれたタンパク質の毒性レベルの蓄積を防ぐために機能している。シナプスタンパク質は主にユビキチンプロテアソーム経路によって分解される。ユビキチン化は、ユビキチン蛋白質が標的蛋白質に結合することで起こる。脱ユビキチン化酵素(DUB)は、標的タンパク質とユビキチンの間の特定の連結を認識し、ユビキチンを除去して再利用する一方で、基質はプロテアソームによって分解される。UPPはAβとタウレベルの調節に関与しており、AD脳ではプロテアソーム活性の低下が観察されることが報告されている。したがって、UPPは、特にシステムに関与する酵素の活性化を介して、AD治療の有望なターゲットを提供する。例えば、ユビキチンヒドロラーゼの活性を高めることは、ユビキチンのレベルを高めることが提案されており、トランスジェニックADマウスモデルにおいて認知機能を改善することが示されている。
8.2. AMP活性化プロテインキナーゼ
AMP(アデノシン一リン酸)活性化プロテインキナーゼ(またはAMPK)は、細胞の代謝を調節する上で重要な役割を果たしており、グルコースの取り込みや脂質の酸化にも関与している。最近の研究では、AD発症におけるAMPKの関与を示唆しているにもかかわらず、AMPKがどのような役割を果たしているのかは明らかにされていない。AMPKの活性化は、神経細胞におけるタウのリン酸化とアミロイド凝集を抑制することが提案されてきた。しかし、これは、AMPKがタウのリン酸化に関与し、タウと微小管の正常な結合を阻害するという反対の提案によって反論されてきた。また、AMPKはシナプス可塑性の維持に必要なmTORシグナルを減少させることが報告されており、Aβの分解を促進する可能性がある。
8.3. C-Jun N末端キナーゼ
C-Jun N末端キナーゼ(JNK)はストレス活性化シグナル伝達タンパク質である。さらに、JNK の活性を阻害することで、AD モデルの細胞損失を防ぐことができたとの報告もある。
8.4. ミトコンドリア
117 ミトコンドリアの機能はADで低下すると報告されており、形態や融合・分裂の変化が観察されている。117 ミトコンドリア機能の低下が報告されており、形態や融合・分裂の変化が観察されている。117 現在も研究が続いているが、この標的に対する治療薬は臨床試験に入っていない。しかし、ミトコンドリア機能障害の潜在的な阻害剤として、ミトコンドリア伝染性細孔の過剰な開放を防ぐ能力を持つことが報告されている118 。
9. 結論
今後のAD治療薬の開発では、これらの薬剤のヒトにおける有効性と安全性に関する研究がさらに進められていくことになる。臨床試験の成功率を高めるためには、これらの薬剤とそのターゲットを効果的に検証することが不可欠である。
用法・用量の最適化と副作用の軽減もまた、これらの薬剤を臨床に導入する前に取り組むべき重要な要素である。財政的な問題は、AD治療薬開発の成功を阻害する可能性がある。最近では、慈善団体や政府の取り組みにより、AD研究への資金提供が増加している。
ADの病態は複雑であるため、今後の研究では、この疾患に寄与するいくつかの因子を同時に標的とし、その結果、ADの発症における役割を限定することを目的としたマルチターゲット薬が注目される可能性が高い。単一標的薬の組み合わせではなく、1種類の多機能薬のみを使用することで、患者さんのコンプライアンスやQOLの向上に加え、医療費や社会的ケアコストの削減にもつながると考えられる。ADの進行を食い止めることができ、早期介入が可能な薬剤が急務となっている。現在開発中の薬剤は有望な結果を示しており、生体内試験を含む更なる研究が提案されている。
