Contents
COVID-19 Vaccine Safety Considerations
smartech.gatech.edu/handle/1853/63710
COVID-19 VACCINEの安全性に関する考察
- ジョージア工科大学公共政策学部研究員 ロナルド・N・コストフ博士
ゲインズビル、バージニア州、20155 - ダルヤ・カンデュク博士、東京大学生物科学・バイオテクノロジー・バイオファーマシューティカル学科バーリ, 70125 バーリ, イタリア
- アラン・L・ポーター博士 ジョージア工科大学公共政策学部名誉教授
アトランタ、ジョージア州、30332 - Yehuda Shoenfeld医学博士、自己免疫疾患のためのZabludowiczセンター、シェバ医療センター、テルハショマー5265601、イスラエル、とI.M. Sechenov第一モスクワ国立医科大学
共著者
ロナルド・N・コストフ博士
ジョージア工科大学公共政策学部研究員
概要
SARS-CoV-2のパンデミックは、世界的に健康と経済に悪影響を及ぼしている。SARS-CoV-2およびウイルス関連疾患(COVID-19)の蔓延を抑制するために行われている主な対策は 2002-2003年のコロナウイルス主導のパンデミックでSARS-CoVの蔓延を抑制するために行われたものと概念的には同じである。違いは、SARS-CoV-2の場合、これらの対策の規模が大きくなっていることである。
免疫系の劣化・機能不全が、ウイルス感染に対する重篤・致死的反応の主な決定要因であると考えられている(COVID-19,SARS、インフルエンザを問わず)。ウイルス曝露の悪影響を軽減するために、免疫系を増強または強化するために、現在採用または検討されている4つの主要なアプローチがある。主に免疫系の強化に焦点を当てた3つのアプローチは、世界人口の多くが免疫力を低下させているライフスタイルを維持しながら、パンデミックを制御・予防することができるというコンセプトに基づいている。第四のアプローチは、将来のパンデミックを最小限に抑えるために、免疫システムを本質的に強化することを目的とした対策を特定し、導入することに基づいている。
具体的には、以下の4つの対策が挙げられる。具体的には、
- 1) ウイルスへの曝露を制限する
- 2) ウイルス負荷を低減するための反応的・戦術的治療を行う
- 3) 感染を予防する、あるいは少なくとも感染を減衰させるためのワクチンを開発する
- 4) 免疫システムを本質的に強化する
- a) 免疫システムを低下させる要因を特定し、それらを可能な限り包括的、徹底的、迅速に排除・低減する
- b) 排除された要因を免疫強化要因に置き換える
というものである。
以前のモノグラフ[1]では、主に内在的な免疫系の強化に焦点を当て、二次的にワクチン関連の問題に焦点を当てていた。そのモノグラフでは、免疫系の弱体化に寄与する数百もの要因と、免疫系を強化するための対策が挙げられていた。
今回のモノグラフでは、ワクチンの安全性に焦点を当てている。将来のCOVID-19ワクチンは、世界的に国家・国際レベルで選択される治療法であると思われる。この目標を達成するために、比較的短期的にワクチン開発が加速されているが、開発期間の短縮化のためにワクチンの安全性が損なわれていないか、あるいは損なわれていないか、あるいは損なわれていないか、という疑問が生じている。
本モノグラフでは、短期的なワクチン副作用の特定に加えて、ワクチン有効性試験の特徴である短期試験では特定できない中長期的なワクチン副作用の可能性を特定している。ワクチンの安全性を確保するためには、実生活条件下での長期試験(複数の毒性刺激への暴露)が必要である。政府や産業界が進めているワクチン開発の加速化と、ワクチンの安全性を検証するために必要とされる長い時間との間には相容れないものがある。
要約すると、現在提案されているように、安全なCOVID-19ワクチンがどのように開発され、1~2年の開発期間で安全性を完全に検証できるのかを理解することは困難である。将来のCOVID-19パンデミックやその他のウイルスパンデミックに対する唯一の真の防御は、SARS、MERS、COVID-19パンデミックや毎年のインフルエンザパンデミックで実証されたものである:自然が意図した通りに入ってくるウイルスを中和することができる健康な免疫システム。
免責事項
本文書に記載されている見解は著者の見解であり、ジョージア工科大学、バーリ大学、シェバ医療センターの見解を代表するものではない。
第1章 序論
1A. 背景
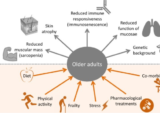
過去20年間で、少なくとも3つの主要なコロナウイルスベースの感染症アウトブレイク/エピデミック/パンデミックが発生している。2002年~2003年の重症急性呼吸器症候群(SARS)2012年から始まる中東呼吸器症候群(MERS)2019年12月から始まるCOVID-19である。これら3つの感染症の間には、選択されたバイオマーカー(例えば、好中球、リンパ球、アルブミン、CRP、TNF-αなど)の異常値、肺の炎症、肺の損傷など、多くの類似点がある。これらの感染症の間で最も重要な類似性は、最も重篤な影響を受ける人口統計学である。この人口動態は、併存疾患を有し、免疫系が劣化/機能低下している高齢者や、免疫系が劣化/機能低下している人が多い傾向にある[2-12]。加齢に伴う免疫系の低下はあるが、併存疾患は、高齢者における免疫系障害の予測因子として、年代的な年齢よりも強い [13-14]。
COVID-19とインフルエンザにも類似点がある。”COVID-19とインフルエンザの両方(COVID-19とインフルエンザ)は、発熱、咳、体の痛み、疲労を引き起こし、時には嘔吐と下痢を起こす;軽度または重度の場合もあれば、まれに致死的な場合もある;肺炎を引き起こすこともある」[15]。さらに、「どちらのウイルスも細菌感染にしか作用しない抗生物質では治療できない;どちらも熱を下げるなどの症状に対処することで治療される;重症の場合は入院と機械的換気などのサポートが必要になることがある」[15]。COVID-19もインフルエンザも、同様に最も深刻な影響を受ける人口統計学を共有している。
SARS-CoV-2コロナウイルス(COVID-19と主に関連するウイルス)の感染拡大を抑制するために行われている主な対策は 2002-2003年にSARS-CoVコロナウイルスの感染拡大を抑制するために行われたものと概念的には同じであり、良好な衛生状態と検疫(ロックダウン)が行われている。違いは、これらの対策の規模である。現在、多くの国がロックダウン(重症度の差はあるが)を実施しており、多数の人が近接して集まる活動や事業が制限されている。2020年9月中旬時点では、これらの制限がいつまで続くかは不明である。
1B. 措置
COVID-19の治療法や予防法を開発するために、数え切れないほどの努力がなされている。これらのうちのいくつかを今、概説する。
治療が健康を改善する一連の行動として定義されるならば、(少なくとも)2つのタイプの治療が可能である。最初のタイプは、ポジティブ治療と定義することができる。これらの治療は、ハイテク治療とローテク治療に細分化することができる。
ハイテク治療とは、薬物(またはサプリメント)や放射線、手術などの治療を行い、症状を緩和させる古典的な治療法のことである。これらのハイテクな陽性治療は、基本的には健康の異常なマーカーに対する反応的な戦術的な反応である。それらは、短期的な治療(例えば、細菌感染症のための抗生物質、ウイルス感染症のための抗ウイルス剤など)または長期的な治療(例えば、スタチン、血液薄め薬、抗高血圧薬など)に適用することができる。
ローテク治療には、食事、睡眠、および免疫系に積極的に影響を与えることが示されているその他の行動の変化が含まれる(ローテク免疫系強化因子の参考文献については、前回のCOVID-19モノグラフ[1]のセクションA4-Cを参照のこと)。長期的な効果を得るためには、これらのローテク治療を無期限に維持する必要がある。平均すると、ハイテク治療の方がローテク治療よりもリスクが大きい。
第二のタイプは、ネガティブネガティブ治療と定義することができ、ここではまず病気に寄与する因子を特定し、それを除去する。名前の由来は数学の世界で、マイナスのマイナスがプラスになることに由来している。これらのネガティブネガティブ治療は、基本的には、健康の異常なマーカーに対する積極的な戦略的対応であり、典型的には、健康の改善のために、ライフスタイルの長期的な変更や有害な暴露の除去を伴う。
1B1. 戦術的治療
この時点で最も脆弱なCOVID-19の人々を助けるための努力の多くは、他の(主に)ウイルス性疾患と戦うために使用されていた/使用されている治療法(別名、再利用された治療法)を探し、実験していた。これらの治療法には以下のものが含まれるが、これらに限定されない。
Actemra/Tocilizumab; Avigan/Favipiravir; Azithromycin; Baricitinib/Olumiant; Bevacizumab/Avastin; Calquence/Acalabrutinib; Chloroquine; Colcrys/Colchicine; Convalescent Plasma; EIDD-2801; Fingolimod/Gilenya; Galidesivir; Hydroxychloroquine; Ilaris/Canakinumab。イベルメクチン;Jakafi/Ruxolitinib;Kaletra/Lopinavir/Ritonavir;Kevzara/Sarilumab;Kineret/Anakinra;Leronlimab;Mavrilimumab;Methylprednisolone;Olumiant/Baricitinib;Otezla/Apremilast;Remdesivir;Tamiflu/Oseltamivir;Umifenovir/Arbidol;Xeljanz/Tofacitinib [16-18]。
その他の新規治療法は、当社の文献関連発見と革新(LRDI)に基づく治療法の再利用方法を用いて特定することができる[19]。
1B2. 戦略的治療法
戦略的治療は、我々の以前のCOVID-19モノグラフ[1]の焦点であった。戦略的治療法の同定は2段階のプロセスで行われる。
第一に、免疫系の健康のマーカー(特異的なバイオマーカーからより一般的な記述子まで)が選択される。
次に、これらのマーカーのレベルを低下させる(すなわち、免疫機能障害、免疫毒性、免疫抑制などにつながる)物質(喫煙、過度のアルコール、農薬など)行動、およびその他の毒性刺激を同定し、排除を推奨する。前回のモノグラフで確認された戦略的治療法は、免疫系のコア文献に含まれているものである。また、LRDIに基づいた治療法の再利用方法[19]を用いて、新たな戦略的治療法を特定することも可能である。
1B3. 反応的戦術的治療と積極的戦略的治療
ウイルス曝露による感染症に対抗するための反応的戦術的治療法は、バイオマーカーレベルを改善し、(成功すれば)症状を軽減するが、通常、病気に対する身体の抵抗力を向上させることはほとんどない。ウイルス感染に対しては、戦術的治療は、劣化した/機能不全の免疫系(およびその他の)を強化することにはほとんど役立たない。一度のウイルス感染に対する戦術的治療の後、劣化/機能不全の免疫系を持つ人々は、遭遇した次の有害なウイルスにさらされることで、再び重篤な感染症の影響を受けやすくなるだろう。
先を見越した戦略的治療法では、病気や免疫系の劣化・機能不全の原因となる重要な因子を取り除くことで、免疫系(およびその他の)を強化する(免疫系に不可逆的な損傷が生じている場合や、免疫系に先天的な損傷やその他の遺伝的な損傷がある場合を除く)。これらの戦略的治療法は、その受け手に長期的なアドヒアランスを必要とする傾向がある。その結果、戦略的治療を受けた患者は、次に遭遇する病原性ウイルス(SARS-CoV-2など)への曝露による感染に対して脆弱性が低くなる。SARS-CoVおよびSARS-CoV-2に曝露された多くの健康な人々と同様に、(典型的には)長期的なプロアクティブ戦略的治療レジメンに成功したこれらの人々は、自分がコロナウイルスに曝露されていること、またはコロナウイルスに感染していることにさえ気づかないかもしれない。感染の兆候は血清中のコロナウイルス抗体のみである。
1C. モノグラフの構成
本モノグラフの残りの部分は以下のように構成されている。第2章では、COVID-19ワクチン開発の成功における潜在的な安全性の問題点を特定するために使用された方法論を概説する。第3章では、商用ワクチンが本質的に安全であるとみなされる前に対処する必要がある潜在的な安全性の問題を提示している。第4章では、本研究の参考文献を掲載している。付録1には、ワクチンの副作用に関する簡単な参考文献を掲載している。
第2章-方法論
ワクチンの長期的な副作用の可能性を示す文献と、これらの副作用に寄与する可能性のあるワクチン/感染症誘発メカニズムを示す文献を特定するために、ハイブリッドな方法論を用いた。無数のワクチン副作用レビュー論文を読み、メカニズムを示す用語(抗体依存性亢進、ウイルス干渉、感染経路、元々の抗原性の罪など)を抽出し、関連性のある可能性のある論文を検索するためのMedlineクエリとして使用した。これらの論文を読み、最も関連性の高いものを抽出した。タイトルはWeb of Scienceに入力され、引用ネットワークを探索した(引用論文、被引用論文、共通参照文献を共有している論文など)。これらの記録を読み、本モノグラフのために最も関連性の高いものを抽出した。
第 3 章 結果と結論
3A. 概要
前回のCOVID-19モノグラフ[1]では、最初のタイプの戦略的治療を取り上げた。1)免疫系の弱体化に寄与する因子の特定と除去(これらの寄与因子の表については、前回のモノグラフ[1]のA4-A節を参照)および2)免疫系の強化に寄与する因子の特定と追加(ローテクな免疫系強化因子の参考文献については、前回のモノグラフ[1]のA4-C節を参照)である。本章では、第二のタイプの戦略的治療、すなわちCOVID-19ワクチンの開発と実施に取り組む。このようなワクチンの展望については、開発期間、有効性、安全性という3つの基準の観点から検討する。
Calinaらは、COVID-19ワクチン開発の進行中のアプローチを評価し、次のように述べている。「通常、ワクチンの開発期間は12~15年である」と述べている[20]。このような背景から、SARS-CoV-2ワクチンは、開発、安全性試験、製造、流通を桁違いに加速することが目標とされている[21-22]。本参考文献に記載されている加速化の各ステップは、通常の開発からの期間を大幅に短縮している。
3B. 過去のコロナウイルスワクチン開発の歴史
21世紀には2つのコロナウイルスパンデミックが発生している。2002年~2003年のSARSと2012年に始まったMERSである。それぞれのパンデミックの最盛期には、それぞれのワクチン開発が開始/加速された。これらの先行するコロナウイルスワクチン開発の成果はどのようなものだったのであろうか?
MERSワクチン開発に関する2019年の包括的な記事[23]によると、「現在までのところ、このウイルス性疾患に対して有効であることが証明された特定の治療法はない。さらに、これまでのところ、MERS-CoV感染を予防するワクチンは認可されていない … 」一般的に、潜在的なワクチン候補は、ウイルスベクターベースのワクチン、DNAワクチン、サブユニットワクチン、ナノ粒子ベースのワクチン、不活化ホールウイルスワクチン、ライブアッテネーターワクチンの6つのタイプに分類される。
SARSとMERSのワクチン開発に関する2020年の包括的な記事[24]によると、「2020年4月現在、これらのコロナウイルス株に対して市販されているワクチンはない」とされている。ワクチンがない理由については、以下のような根拠が示されている。”SARSとMERSについて、市販されている有効なワクチンがない理由は様々である。MERSの場合は、前臨床実験中に適切で費用対効果の高い小動物モデルが不足していたため、ワクチン開発が遅れた可能性が高い。さらに、(インフルエンザ、HIV、結核などの他の世界的で持続性のある感染症と比較して)比較的症例数が少なく、地理的に集中している疾患のワクチンへの投資に対する関心が低いために、ワクチンが提供されなかった可能性が高い。2004年に症例が報告されなくなったSARSのワクチンへの投資を続けることは無意味であると考えられたという意味で、この最後の要因もSARSのワクチンがないことに寄与しているかもしれない」と述べている。
SARSのパンデミックが終息したかに見えた後、ワクチンへの関心は薄れたかもしれないが、そのようなワクチンの研究は続いてた。上記の記事の参考文献によると、SARSワクチンの研究は、パンデミックが終わった後も10年以上も続いていることが示されている[25-26]。
SARSやMERSの経験からすると、約10年、あるいはそれ以上の研究期間を経ても、ワクチン開発の成功には至らなかった。このことは、COVID-19コロナウイルスワクチンの開発、安全性試験、配布について、予測されている1年間のタイムスケールでは良い兆候とは言えない。
3C. ワクチン開発成功のための課題
3C1.概要
成功したコロナウイルスワクチン開発が直面している主な課題は、開発までの時間、ワクチンの有効性、そして最も重要なことは、ワクチンの安全性である。20]に記載されている問題点のいくつかについての補足的な視点は、以下のように述べることができる。
“第一に、ウイルスのスパイクタンパク質は保護のための有望な免疫原であるが、最適な免疫応答を確実にするためには、抗原設計の最適化が重要である。最良のアプローチをめぐって議論が続いている
- 例えば、全長タンパク質を標的とした場合や、受容体結合ドメインのみを標的とした場合などである。
第二に、SARSおよび中東呼吸器症候群(MERS)に対するワクチン候補の前臨床経験は、直接または抗体依存性増強の結果として、肺疾患を悪化させることについての懸念を提起している。このような悪影響は、2型ヘルパーT細胞(Th2)反応と関連している可能性がある。したがって、適切な動物モデルを用いた試験と臨床試験における厳格な安全性モニタリングが重要である」[27]。
ワクチンによる中期的および長期的な潜在的な副作用は数多く確認されている。それらのテーマを最初に要約し、続いて特定の引用文献からの抜粋を紹介する。
- 1) 抗体依存性増強(抗体によって、多くの細胞型でのウイルスの侵入と複製が促進される)。
- -1a) 本質的抗体依存性増強(あるウイルスへの自然感染によって生じた非中和抗体が、別のウイルスへの感染を促進することがある場合
- -1b) 免疫強化(免疫相互作用による二次感染の強化
- -1c) 交差反応的(ある特定の抗原に対して上昇した抗体が、異なる抗原に対して競合的に高い親和性を持つこと)
- -1d) クロスインフェクションエンハンスメント(別のウイルスの抗体による、あるウイルスの感染亢進
- 2) ワクチン関連ウイルス干渉(自然感染に関連した非特異的免疫が得られないため、ワクチン接種を受けた人が他の呼吸器ウイルスに感染するリスクが高まる可能性がある場合)。
- 3) ワクチンに関連したインプリンティングの減少(ここでは、ワクチンを接種することで「インプリンティング」とは、幼少期に感染症を経験した子どもたちに与えられる保護のことである)。)
- 4) 免疫系に対する非特異的ワクチンの影響(過去の感染により、無関係な疾患に対する感受性が変化する可能性がある場合
- 5)感染経路の免疫系への影響(曝露/投与経路によって免疫防御が影響を受ける可能性がある場合)。
- 6) 有害刺激の組み合わせの影響(人々は生涯にわたって無数の有害刺激にさらされるため、あらゆるワクチンの影響に影響を与える可能性がある)。
- 7) 抗原性距離仮説(抗原性距離がv1とv2の間では小さい(v1≒v2)が、v1と現在のパンデミック(e)株(v1≠e)の間では大きい場合に、前シーズンのインフルエンザワクチン(v1)から今シーズンのワクチン(v2)の保護への負の干渉が起こる可能性がある)
- 8)バイスタンダー活性化(抗原Yに対する免疫反応中の抗原Xに特異的なT細胞の活性化)
- 9)腸内細菌叢(腸内微生物組成がワクチン反応に与える影響
- 10) 同種チャレンジ感染強化(試験法で使用したチャレンジウイルス株は、被験者が受けたワクチンの製造に使用したシードウイルス株と密接に関連している。
- 11)免疫回避(ウイルス感染に対する宿主の反応回避
- 12) 免疫干渉(ワクチンウイルスに対する循環抗体からの干渉
- -12a) 抗原原罪(ウイルスや細菌などのわずかに異なるバージョンの異物に遭遇したときに、体の免疫系が以前の感染に基づく免疫学的記憶を優先的に利用する傾向)
- 13) 先行インフルエンザ感染(先行インフルエンザ感染が将来の疾患症状の重症度に及ぼす影響
- 14)ウイルス曝露間のタイミング(ウイルス曝露間の経過時間
- 15) ワクチン関連強化型呼吸器疾患(ワクチン接種により呼吸器疾患が強化された場合
- 16)慢性免疫活性化(継続的な自然免疫反応
これらの効果のそれぞれについては、ここでより詳細に説明する。
3C2. ワクチンによる潜在的な機序的副作用
3c2a. 抗体依存性強化(多くの細胞型におけるウイルスの侵入および複製が抗体によって強化されている場合
“SARSおよび中東呼吸器症候群(MERS)に対するワクチン候補の前臨床経験から、直接または抗体依存性亢進の結果として、肺疾患を悪化させることが懸念されている。このような悪影響は、2型ヘルパーT細胞(Th2)反応と関連している可能性がある。したがって、適切な動物モデルでの試験と臨床試験での厳格な安全性モニタリングが重要となる」[27]。
“ワクチンによってウイルス感染に対する感受性が増強された例や、ウイルスの病原性が異常になった例は、さまざまなウイルスファミリーのメンバーによる感染について文書化されている。いくつかのメカニズムが、その多くがまだ十分に理解されていないが、この現象の基礎となっている。.ある種の実験的レンチウイルスワクチンは逆効果であることさえ証明した。ワクチンによって誘発されるネココロナウイルス、デングウイルス、ネコ免疫不全ウイルスなどの特定のウイルスへの感染に対する感受性の増強については、抗体依存性増強(ADE)が重要な役割を果たしていることが示されている。.その結果、ワクチンによって誘発される感受性の増強は、特定のフラビ、コロナ、パラミクソ、レンチウイルスワクチンの開発において大きな障害となっていた。また、最近のHIVに対するワクチン開発の失敗は、少なくとも部分的には、感染に対する感受性の増強の誘導に起因しているかもしれない。
“多くのウイルス性病原体にとって、特定の条件下では、抗体は多くの細胞型においてウイルスの侵入と複製を促進する魅力的な手段を提供する。感染の抗体依存性増強(ADE)として知られているこの現象は、ウイルス-抗体免疫複合体が補体またはFc受容体を持つ細胞と相互作用し、ウイルスの内部化を促進して感染を増加させるときに起こる。ウイルス性疾患の増悪と頻繁に関連しており、感染のADEはワクチン接種によるウイルス性疾患の予防に大きな障害となり、静脈内免疫グロブリンなどの新規抗ウイルス治療薬の副作用の一端を担っていると考えられている”。[29].
“これまでの研究では、不活化された全SARS-CoVでのマウスの免疫化、MVA-コードされたSタンパク質でのアカゲザルの免疫化、および全長Sタンパク質をコードするDNAワクチンでのマウスの免疫化は、おそらく抗体産生の質と量が低いために、ADEまたは好酸球媒介のmmunopathologyをある程度誘導する可能性があることが示されている。さらに、ワクチンが高齢の宿主に対して安全で有効であるかどうかを考慮する必要がある。
例えば、二重不活化SARS-CoVワクチンは、高齢マウスでは中和抗体反応を誘導することができなかった。さらに、ミョウバンをアジュバントした二重不活化SARS-CoVワクチンは、高齢マウスにおいてより高い抗体価を示したが、IgGサブクラスがIgG2ではなくIgG1に偏っており、これはTヘルパー2(TH2)タイプの免疫応答、好酸球増多、および肺病理と関連していた”。[30]. また、[31-33]を参照のこと。
“特定の状況下では、ウイルス感染またはワクチン接種は、免疫系の機能を低下させ、病気を増悪させる可能性がある。ワクチン接種、感染、または母体の受動免疫による既存の抗体による病気の増強の臨床的証拠は、いくつかのウイルスについて利用可能であり、他のウイルスについても推定的に提案されている。…特定の感染症および/またはワクチン誘発免疫は、Fc受容体または補体担持細胞が媒介するメカニズムでウイルス感染性を悪化させる可能性があることが確認されている”。[34].
3C2a1. 本質的抗体依存性増強(あるウイルスへの自然感染によって上昇した非中和抗体が、別のウイルスへの感染を増強する場合がある)。
“既存の抗体がウイルス感染を増強する可能性がある。デング熱では、4種類のデングウイルス(DENV)のうちの1つに自然感染することで生じる非中和抗体が、我々が「内在性抗体依存性増強」(iADE)と呼んでいるプロセスによって、別のウイルスへの感染を増強する可能性がある。さらに、ホルマリン不活化呼吸器合胞体ウイルス(RSV)や麻疹ウイルスワクチンによって上昇した非保護抗体は、画期的な感染の際に疾患を増強させることにつながっている。iADE条件下での感染は、単球およびマクロファージへのウイルス侵入のプロセスを促進するだけでなく、生得的および適応的な細胞内抗ウイルス機構を改変し、1型インターフェロン(IFN)産生を抑制し、DENV複製の増強をもたらした”。[35].
“アジュバントおよび未アジュバント二重不活化SARS-CoV(DIV)ワクチンを使用して、我々は、SARS核カプシドタンパク質で免疫化されたマウスで見られるものに匹敵する高齢マウスの好酸球性免疫病理学、および非致死的な異種株チャレンジに対する貧しい保護を示している。…ミョウバンの非存在下では、DIVワクチンは致死的な相同株または異種株で挑戦した若い動物では不良なパフォーマンスを示している。対照的に、DIVワクチン(アジュバントおよび未アジュバントの両方)は、高齢動物モデルでは不良な成績を示した。重要なことは、高齢動物は肺に好酸球性免疫病理学的な増加を示し、有意なウイルス複製から保護されなかった。これらのデータは、DIVワクチンの安全性に関する重大な懸念を提起し、DIV誘発性好酸球性とワクチンの失敗を支配する分子機構の追加研究の必要性を強調している、特にヒト疾患のより脆弱な高齢動物モデルで” [36].
“デング熱は、ヒト医学において最も豊富な例であり、内在性抗体依存性感染亢進(iADE)という現象によって引き起こされる最大のヒト疾患負担を提供している。この免疫病理学的現象では、感染性免疫複合体を用いて単球やマクロファージに感染すると、自然抗ウイルスシステムが抑制され、デングウイルスの対数的な細胞内増殖が可能となる。4種類のデングウイルスは共通の祖先から進化したが、生態や病原性は類似している。しかし、あるウイルスに感染すると、別のウイルスへの感染に対する短期的な相互防御が得られるものの、毎年数百万人の二次感染が世界中で発生している。相互防御的なデング抗体が仮想的に存在しない状態で感染すると、デング血管透過性症候群(DVPS)が発生する可能性がある。[37].
“これらの症状は、制御されていない免疫活性化の結果である。マクロファージおよび樹状細胞は、デングウイルス(DENV)の主な標的であり、この免疫活性化に関連するサイトカインの細胞源である。マクロファージおよび樹状細胞は、DENV免疫活性化に関与しているいくつかの自然免疫受容体を発現しており、その中でもCLEC5A、RIG-IおよびMDA5が最も重要である。
これらの受容体の活性化はDENVに対する適応免疫応答に大きな影響を与える。このレビューでは、自然免疫受容体が炎症性サイトカインを誘導し、適応免疫応答を活性化することによって、どのようにDENV免疫活性化を促進するかに焦点を当てる。[38].
“デングウイルス感染の抗体依存性増強(ADE)は、DHF/DSSの基礎となる初期のメカニズムとして提案されてきた。最初のデング感染後に上昇したデングウイルス交差反応的抗体は、2番目の感染ウイルスと結合して感染性免疫複合体を形成し、Fc受容体を持つ細胞に侵入する。この結果、感染細胞の数が増加し、細胞あたりのウイルス産生量が増加する。発病後期になると、高レベルのサイトカイン(おそらく感染細胞のT細胞排除の結果)が、血管の透過性をもたらし、ショックと死に至る。[39].
“疫学的および観察的研究から、重症のデング熱、デング出血熱およびデングショック症候群(DHF/DSS)の大部分は、二次異種感染後の交差反応的免疫を持つ個体、またはデング免疫を持つ母親から生まれた原発性DENV感染症の乳児のいずれかで発生することが示されており、B細胞を媒介とした抗体反応が疾患の進行に影響を与えることが示唆されている。我々はここで、マウスの原発性DENV感染に対する宿主応答においてB細胞が重要な役割を果たしていることを示している。…。さらに、ポリおよびモノクローナル抗DENV特異的抗体が、初期の自然抗ウイルス応答の抑制を通じてウイルス複製を十分に増加させ、疾患の発現を増強することで、ほとんど致死的でない疾患がヒトDHF/DSSに類似した致死的疾患になることを示している。最後に、抗DENV抗体を含む免疫グロブリンを静脈内に投与することで、DENV感染マウスのウイルス感染と複製を媒介し、重篤な疾患発現を誘導する亜中和抗体の潜在的な能力が確認された。このように、我々の結果は、DENV感染時に放出された体液性反応が防御的または病理学的な結果をもたらすことを示しており、この重要なヒト病原体の病態についての洞察を提供している」[40]。[40].
“2.抗SARS-CoVスパイク免疫血清を用いたSARS-CoV感染の抗体介在性増強が試験管内試験で観察された。3. SARS-CoV の抗体感染は、FcgammaR 依存性、ACE2-、pH、システインプロテアーゼ非依存性の経路を介してヒト造血細胞への侵入を誘発する。4. 抗体介在性増強現象は、純粋な中和抗体しか得られなかったため、SARSワクチンによって誘発される体液性免疫応答の必須要素ではない。5. 5. SARS-CoV感染の免疫介在性亢進現象の発生は、ヒトにおけるSARS-CoVワクチンの使用に関する安全性の懸念を提起し、SARSの病原性を調査するための新たな方法(トロピズムおよび免疫応答の調節解除)を可能にする” [41].
3C2a2. 免疫増強(免疫相互作用を介した二次感染の増強
“この戦略が他の動物モデルに移植できるかどうかを判断するために、我々は、エイズの自然モデルであるネコ免疫不全ウイルス(FIV)によるネコの感染におけるアデノウイルスベクターの有効性を評価している …..回目の投与から6週間後、ネコを同種株で腹腔内ルートで挑戦し、血漿中のウイルス負荷を定量的RT-PCRで追跡した。FIV抗原による免疫では保護は得られなかった。むしろ、無関係な抗原を発現するベクターで免疫した猫よりも、Gagに対して免疫した猫の方が早い時期にウイルスRNAが検出された。このような免疫介在性の増強は、ウイルスのセットポイントやCD4(+)/CD8(+)比の逆転に長期的な影響を持っているようには見えなかった。このように、ネコのAIDSモデルでは、ウイルス抗原に対する既存の免疫が急性期の感染を悪化させた。[42].
“デングウイルスは4つの抗原的に異なる血清型として存在している。これら4つの血清型は共循環し、複数の免疫介在メカニズムを介して相互に作用している。デングウイルスの感染動態を理解するためのこれまでの研究の大部分は、これら4つの血清型について同一の特徴を仮定していたが、経験的なデータによると、これらの血清型は互いに重要な点で異なることが示唆されている。ここでは、デングウイルス間の対称性を仮定しないモデルを用いて、その動態と持続性を調べた。その結果、血清型の感染率がわずかに非対称である場合、免疫増強による二次感染の伝播性の増加は、対称モデルでの知見とは逆に、すべてのデングウイルスの持続性を増加させることがわかった。我々は、4つの血清型すべての持続性の確率を最大化する免疫増強の最適な大きさを特定した。透過性の血清型間の不均一性が競合的排除を促進する他の病原体システムとは対照的に、….. ここでは、抗体依存性強化(ADE)の存在下では、不均一性がデング熱の複数の血清型の持続性を増加させることができることを発見した”。[43].
“増加する証拠は、コロナウイルスによる下気道感染症の重篤な肺病理および死亡率に寄与するものとして、宿主のTh17炎症反応を指摘している。これには、SARS-2コロナウイルス(SARS CoV2)によるCOVID-19に対する宿主の炎症性およびサイトカイン反応が含まれる。実験動物で行われた研究から、免疫増強および実験的ヒトCOVID-19ワクチンに起因する潜在的な宿主免疫病理学の役割についてのさらなる懸念がある。
ここでは、コロナウイルス感染とワクチン接種の両方に関連する基礎となる免疫病理学的プロセスと、免疫増強と好酸球性肺免疫病理におけるTh17の役割の間に部分的な重複がある可能性を示唆する証拠をまとめた。このような知見は、ウイルスベクター化されたコロナウイルスワクチンと免疫増強とミョウバンアジュバントによる免疫増強の減少との関連性を説明するのに役立つ。さらなる研究により、COVID-19肺免疫病理学と心臓病との関連も明らかになるかもしれない。” [44].
“ここでは、アフリカミドリザル(AGM)モデルを用いて、ウイルスクリアランスを促進するだけでなく、SARS-CoV感染後の持続的な肺炎症に寄与する可能性のある免疫機構を解明した。一次感染時には、SARS-CoVは最大10日間、AGMの肺で複製された。興味深いことに、白血球数は感染後14日目(dpi)にピークを迎え、28日目(dpi)には模擬感染した対照群と比較して上昇したままであった。肺マクロファージは急速に活性化されたが、樹状細胞は活性化されなかった。….. SARS-CoVの相同再チャレンジ試験では、再チャレンジ後5日目には12匹中11匹がウイルスを複製していなかった。しかし、再チャレンジ時にウイルスの複製が制限されたにもかかわらず、肺炎の発生率および重症度は低下しなかった。免疫防御または免疫増強における抗体の役割を評価すると、肺および血清中の抗SARS-CoV抗体の漸進的な増加が明らかになったが、時間的または空間的にはウイルス複製の増強とは相関しなかった。この研究は、白血球集団、肺特異的サイトカイン、およびAGMsにおけるSARS-CoV再チャレンジ後の抗体反応の変化を含む肺免疫の最初の包括的な解析の1つである”。[45].
3C2a3. 交差反応的(1つの特異的抗原に対して上昇した抗体は、異なる抗原に対して競合する高い親和性を有する)。
交差反応的がコロナウイルス環境に悪影響を及ぼす可能性は、3C5節でより詳細に議論するに値するほど深刻である。
“50の組織抗原のうち21の組織抗原がSARS-CoV-2抗体と中等度から強い反応を示したという我々自身の知見は、SARS-CoV-2タンパク質と肺組織だけでなく、様々な組織抗原との交差反応を十分に強く示しており、これは結合組織および心血管系、消化管系、神経系に対する自己免疫性につながる可能性がある” [46].
懸念されているのは、(無数のワクチンのために行われているように)ワクチン抗原として完全なSARS-CoV-2タンパク質を使用すると、交差反応誘発性の自己免疫疾患につながる可能性がある。”ワクチン抗原としてタンパク質を検討する前に、将来起こりうる副作用を回避するために、組織の交差反応的エピトープの配列を解析する際に特別な注意を払う必要がある。… 我々は、50の組織抗原のうち21がSARS-CoV-2抗体と中等度から強い反応を持っていたという我々自身の知見は、SARS-CoV-2タンパク質と肺組織だけでなく、様々な組織抗原との間の交差反応の十分に強力な兆候であると感じている、それは結合組織や心血管系、消化管、神経系に対する自己免疫につながる可能性がある“[47]。分子模倣と自己免疫疾患との関係についてのより詳細な議論については、3C5節を参照のこと。
3C2a4. クロスインフェクション・エンハンスメント(別のウイルスからの抗体による、あるウイルスの感染エンハンスメント
“抗DENV抗体は、特定のクラスの免疫細胞に対するDENVの感染性を高め、重篤な疾患転帰と相関するウイルス産生の増加を引き起こす可能性がある。同様に、ZIKVは、他のフラビウイルスによって生成された抗体に応答してADEを受けることが示されている。我々は、中和および ADE アッセイを用いて、よく特徴づけられた広範に中和するヒト抗 DENV モノクローナル抗体(HMAbbs)およびヒト DENV 免疫血清の ZIKV に対する中和および増強の可能性を試験した。我々は、抗DENVモノクローナル抗体(HMAbs)は交差反応を起こし、中和せず、試験管内試験でのZIKV感染を大幅に増強することを示した。DENV免疫血清はZIKVに対して様々な程度の中和を示し、同様にZIKV感染を増強した。我々の結果は、既存のDENV免疫が生体内試験でのZIKV感染を増強し、疾患の重症化につながる可能性があることを示唆している。ZIKVとDENVの間の相互作用を理解することは、公衆衛生上の対応を知らせる上で非常に重要であり、ZIKVとDENVワクチンの設計と実施にとって特に価値のあるものとなるであろう。” [48]。
“抗フラビウイルス抗体は高度に交差反応的であり、抗体依存性増強(ADE)機構を介してジカウイルス(ZIKV)感染を促進する可能性がある。我々は、デングエ特異的抗体が、FcガンマRIIを発現するK562細胞株において、ブラジルの一次ZIKV分離株の感染を増強することを実証している。さらに、デング免疫を持つ妊婦の血清サンプルがZIKV感染を促進することを示した。これらの知見は、ZIKV感染に関連する先天性および神経学的合併症の発生におけるADEの役割をさらに確認するための疫学的研究および動物モデルの必要性を強調している”。[49].
3C2b. ワクチン関連ウイルス増強(自然感染に関連した非特異的免疫を受けていないため、ワクチン接種を受けた個体が他の呼吸器ウイルスに対するリスクが増加する可能性がある場合
“非インフルエンザウイルスを具体的に調べると、ワクチン接種を受けた人のコロナウイルスとヒトメタニューモウイルスの両方のオッズは、ワクチン接種を受けていない人と比較して有意に高かった(OR = 1.36 と 1.51,それぞれ)…我々の研究における実験室のデータは、インフルエンザワクチン接種を受けた人のコロナウイルスとヒトメタニューモウイルスのオッズが増加したことを示した。… インフルエンザワクチン接種はインフルエンザに対する保護を提供しているが、自然なインフルエンザ感染は、これらのウイルスに対する一時的な非特異的免疫を提供することで、非インフルエンザ呼吸器ウイルスのリスクを減少させる可能性がある … 一方、最近発表された研究では、ワクチンと関連したウイルス干渉の現象が記述されている;つまり、ワクチン接種を受けた人は、自然感染に関連した非特異的な免疫を受けていないため、他の呼吸器ウイルスのリスクが高まる可能性がある」[50]。
“我々は、TIV{三価不活化インフルエンザワクチン}を受けた人の間で、ライノウイルスおよびコクサッキー/エコーウイルス感染のリスクの有意な増加を含む、非インフルエンザ呼吸器ウイルス感染のリスクが統計的に有意に増加していることを確認した。.. TIVの受領は、非インフルエンザ呼吸器ウイルスに対する免疫力の低下を犠牲にしてインフルエンザ免疫力を高める可能性がある」[51]。
“2008-09年のTIVを事前に受けていたことは 2009年春夏の間に医療機関に通院したpH1N1疾患のリスク増加と関連しており、推定リスクまたはオッズ比は1.4~2.5の範囲であった” [52]。
“子供の間では、非インフルエンザ呼吸器病原体によるARI{急性呼吸器疾患}のハザードの増加が、同時期にワクチンを接種していない子供と比較して、インフルエンザワクチン接種後に見られた” [53]。[53].
“インフルエンザ A 型が早期にパンデミックした場合、RSV {respiratory syncytial virus} アウトブレイクは遅れる傾向にあり、コロナウイルスアウトブレイクは激化する傾向にあった” [54]。
“ここでは、OECD加盟国29カ国のインフルエンザワクチン接種率の報告が、これらの国で最近観察されたSARS-CoV-2感染率と有意に関連していることを示している。この初期の結果は、さらなる調査に値するものであり、現在のコロナウイルス大発生時には、インフルエンザワクチン接種の背景がSARS-CoV-2感染に関連する因子である可能性を示唆している。
3C2c. ワクチンに関連したインプリンティングの減少(ワクチン接種は、幼少期に感染を経験した子供たちに与えられる保護である「インプリンティング」の利点も減少させる可能性がある)。
“小児初感染によるインプリンティングは、プライミングエピトープに焦点を当てた長期的な免疫を付与することが知られている。我々の知見は、ワクチンのミスマッチがインプリンティング免疫と負の相互作用をする可能性を示唆している。ワクチンのインプリンティング制御効果(I-REV)の免疫学的メカニズムは調査の対象となる” [56].
“我々は、現在のワクチン接種の結果に対する遠隔インフルエンザ免疫のインプリンティングの潜在的な影響を、次世代またはユニバーサルワクチン候補の設計において考慮すべきであることを示唆している” [57]。
3C2d. 免疫系に対する非特異的ワクチンの影響(過去の感染が個人の無関係な疾患への感受性を変化させる場合
“感染症に対するワクチンは、免疫系が他の病原体を処理する能力に非特異的な影響を与える。例えば、無作為化試験では、結核と麻疹ワクチンは、対象疾患の予防では説明できない、小児の全死亡率の大幅な減少と関連している。新しい研究では、ワクチンの非特異的効果は、無関係な病原体との適応免疫系の交差反応的と、エピジェネティックなリプログラミングを介した自然免疫系の訓練に関連していることを示唆している。.ジフテリア-破傷風-百日咳(DTP)ワクチンは、3つの標的疾患に対して保護されているものの、他の感染症による女性の死亡率を増加させる。 …そしてそれは、麻疹ワクチンの後に投与されたDTPワクチンが、高力価麻疹ワクチン試験で観察された女性死亡率の増加の説明であることが判明した。..免疫系に対するワクチンの効果は、他の免疫調節因子によって調節される可能性がある。ワクチンと高用量ビタミンAの補給との間には相互作用が見られる。.そして、2つのワクチンを同時に投与すると全く異なる効果があるかもしれない…。我々は、我々の効果的な介入が他のワクチン、薬物、または微量栄養素と同時に投与され、異なる順序で投与された場合に何が起こるかを体系的に調べる必要がある。[58].
“疫学的データは、過去の感染が個人の無関係な疾患に対する感受性を変化させることを示唆している。….大規模な研究努力により、免疫記憶の古典的な概念が拡大され、長期にわたる自然免疫の変化や抗原に依存しない適応免疫の再活性化も含まれるようになった。これらのプロセスを総合すると、急性感染症が長期的な変化を引き起こし、それが無関係な病気に対する免疫力にも影響を与えるという説明が可能になる。.このように警戒心が高まった状態は、無関係な感染症にも対抗する免疫系の能力を高めるだけでなく、自己免疫の感受性を高める可能性がある。同時に、感染によって引き起こされた調節コンパートメントの変化は、その後の免疫応答を弱め、病原体の持続性を促進する可能性がある」[59]。[59].
3C2e. 感染経路の免疫系への影響(免疫防御が曝露/送達経路によって影響を受け得る場合
ワクチンを用いた感染症は、自然暴露とは異なる暴露経路を有しており、これが免疫系に異なる影響を与える可能性がある。典型的なワクチンは血液中に直接注入されるため、自然免疫系の多くをバイパスしているのに対し、自然に獲得した感染症は、自然免疫系による遅延と抵抗という時間のかかるプロセスを経て進化していく。さまざまな経路での曝露の効果を調べる研究が行われている。例えば
“我々の研究では、動物モデルにおける候補 LAV {live attenuated viruses}および免疫保護マーカーの同定が、使用される感染経路によって強く影響を受けることを実証している」[60]。
“ワクチンの処方と送達経路は、我々の研究で示唆されているように、結果に影響を与える可能性がある。. ワクチン接種のための非経口的な方法に依存するのではなく、代替的な方法を検討することは、改善された有効性と長期的な記憶反応をもたらすワクチン接種戦略につながる可能性がある” [61]。[61].
“我々は、結核感受性DBA/2マウス株を用いて、非経口的に投与されたBCGワクチンが結核から保護されないモデルである結核感受性DBA/2マウス株を用いて、BCGワクチンの肺送達と皮下送達を比較した。我々のデータは、BCGを経鼻的に投与しても、皮下投与しても肺結核に対する強固な保護が得られないことを示している」[62]。[62].
3C2f. 毒性刺激の組み合わせの影響(ここで、人々は生涯にわたって、任意のワクチンの影響に影響を与える可能性のある無数の毒性刺激に曝される
“毒性刺激(ストレッサー)の暴露限界は、典型的には単一の毒性刺激実験に基づいているが、現在では、単独での毒性刺激と他の毒性刺激との組み合わせ(同時共暴露または時間的に分離された暴露)の両方に使用されている。組み合わせの場合、典型的には、単一のストレッサー実験から決定された量と比較して、組み合わせの各構成要素が損傷を引き起こすために必要とされる量が少ない。[63]. また、[64]を参照のこと。
“免疫系に対するワクチンの効果は、他の免疫調節因子によって調節され得る。ワクチンと高用量ビタミンA補給との間には相互作用が見られる。.そして2つのワクチンを同時に投与すると全く異なる効果があるかもしれない…。我々は、我々の効果的な介入が他のワクチン、薬物、または微量栄養素と同時に投与され、異なる順序で投与された場合に何が起こるかを体系的に調べる必要がある。[58].
3C2g. 抗原性距離仮説(抗原性距離がv1とv2の間では小さいが(v1≒v2)、v1と現在のパンデミック(e)株(v1≠e)の間では大きい場合に、前シーズンのインフルエンザワクチン(v1)から現在のパンデミック(e)株(v2)の保護に対する負の干渉が起こる可能性がある。)
“繰り返しワクチン効果のばらつきは、ワクチン株間の抗原性距離の違い、および各アウトブレイクにおけるワクチン株とパンデミック株との間の抗原性距離の違いに起因する”…..これらの結果は、インフルエンザワクチン株の選択、および繰り返しワクチン接種を必要とする可能性のある他の抗原性変動性病原体のワクチン接種戦略にも意味を持つ。” [65].
“事前のワクチン接種効果は季節によって有意に変化し、ADHと一致した。v2単独またはv2 + v1のための同等のVEを持つ2010-2011年にv1による干渉はなかった:34%(95%信頼区間[CI]= -51%〜71%)対34%(95%CI = -5%〜58%)。v1による負の干渉は 2012-2013年にv2とv1 eの時のVEの有意でない減少が示唆された:49%(95%信頼区間[CI]= -47%~83%)対28%(95%CI = -12%~54%)。前の予防接種の負の効果は顕著であり 2014-2015年に統計的に有意であったときにv1 = v2とv1 e:65%(95%CI = 25%〜83%)対-33%(95%CI = -78%〜1%)…..Effects of repeat influenza vaccination was consistent with the ADH and have contributed to findings across recent A(H3N2) epidemic since 2010 in Canada “であった。[66].
“1970年代と1980年代の研究では、インフルエンザワクチン接種の繰り返しがワクチン保護に影響を与える可能性があるという懸念がシグナルされていた。抗原性距離仮説は、連続するワクチン成分とパンデミック株との間の抗原性類似性に基づいて、繰り返し接種効果の変動を説明するための理論的枠組みを提供した。….-11年から 2014-15年までのワクチン有効性研究のメタアナリシスでは、季節や亜型間での繰り返し接種効果に実質的な不均一性があることが示されている。負の効果が観察された場合、その効果はH3N2で最も顕著であり、特にワクチン成分が変化せず、パンデミック株と抗原的に異なる2014-15年に顕著であった。複数のシーズンにわたる反復接種の研究では、ワクチンの有効性は1つ以上の前のシーズンに影響を受ける可能性があることが示唆されている。免疫原性の研究では、反復接種はヘマグルチニン抗体反応を鈍らせ、特にH3N2については” [67].
3C2h. バイスタンダー活性化(抗原Yに対する免疫応答中の抗原Xに特異的なT細胞の活性化
“ここ10年で、ワクチン接種後の特発性血小板減少性紫斑病、筋膜炎、原発性卵巣不全、全身性エリテマトーデス(SLE)など、様々な自己免疫疾患に関する報告が蓄積されてきた。このレビューでは、ワクチン接種後の自己免疫反応の基礎となる可能性のあるメカニズムについて議論し、ワクチン接種と相関関係にあった自己免疫疾患の症例をレビューする。ワクチンが自己免疫反応を引き起こす可能性のあるメカニズムとして、分子模倣およびバイスタンダー活性化が報告されている。” [68].
“ワクチン接種に対する自己免疫反応は、分子模倣やバイスタンダー活性化のメカニズムによって、素因を持った個人にはまれに誘発されることがある。ワクチンに関連すると確実に考えられる自己免疫反応には、1976年の豚インフルエンザワクチン接種後のギラン・バレー症候群、麻疹・おたふく・ルベラワクチン接種後の免疫性血小板減少性紫斑病、天然痘ワクチン接種後の筋膜炎などがある” [69]。
“自己免疫の発生を説明するために、3つの主要なメカニズムが提示されている:分子模倣、エピトープ拡散、バイスタンダー活性化。後者は、抗原に依存しない方法で活性化を受ける自己反応的B細胞およびT細胞によって特徴づけられ、自己免疫の発生と経過に影響を与える。活性化は、炎症性環境、共シグナリングリガンド、および隣接細胞との相互作用の組み合わせによって起こる。本レビューでは、全身性および臓器特異的ADにおけるバイスタンダー活性化の役割を定義するために行われた研究について論じる。[70].
3C2i. 腸内細菌叢(腸内微生物組成物のワクチン応答への影響
- 化学品
“DEHP曝露は細菌群集の組成と多様性の両方を変化させ、特にDEHP群ではRothia sp.とBifidobacterium longumの減少が見られた。さらに、DEHP曝露はDEHP群で抗HBsAg-IgM反応を有意に増加させた(p = 0.013)。早期のDEHP曝露は新生児の腸内細菌叢を変化させ、後の人生で免疫応答を変化させる可能性がある。” [71].
“新興のエビデンスは、免疫におけるマイクロバイオームの中心的役割を示している。しかし、ヒトにおける因果関係の証拠はまばらである。…しかしながら、既存の抗体価が低い被験者を対象とした第2の試験では、H1N1特異的な中和と結合性IgG1およびIgA応答に有意な障害が認められた。さらに、両試験において、抗生物質治療は、(1)高齢者で以前に観察された炎症性シグネチャー(AP-1/NR4A発現を含む)の増強、および樹状細胞の活性化の増加をもたらした;(2)代謝経路の分岐、血清二次胆汁酸の1,000倍の減少を伴う、AP-1/NR4Aシグナリングおよび炎症ソームの活性化と高度に相関した代謝経路をもたらした”。[72].
- 栄養学
“低所得国や中所得国に住む子どもたちでは、栄養不足や反復的な消化管感染が経口ワクチンの失敗と関連している。これらの環境的影響と関連した腸内環境異常は、いくつかの宿主関連因子と同様に、免疫応答を低下させ、ワクチンの有効性に悪影響を与える。[73].
“タンパク質欠乏症の豚に経口 AttHRV ワクチンを接種した場合、VirHRV チャージ後の下痢に対する保護率が低下し、タンパク質不足の豚と比較して糞便ウイルス脱落力価が有意に上昇した(HIFM 移植されたが GF 豚ではない)。タンパク質欠損ブタにおけるワクチン効果の低下は、経口 AttHRV ワクチンに対する血清 IFN-α、TNF-α、IL-12,および IFN-γ反応の変化と一致しており、複数の自然免疫パラメータおよび HRV 固有の IFN-γ産生 T 細胞がチャレンジ後に抑制されていた。タンパク質不足の HIFM 移植ブタでは、実験期間中、血清 KYN レベルの低下が観察されたが、TRP レベルの低下は観察されなかったことから、TRP 代謝の変化と免疫応答との関連が示唆された。….our の知見は、タンパク質不足が HRV に対する自然免疫応答、T 細胞およびサイトカイン免疫応答、ワクチンの有効性、ならびに TRP-KYN 代謝に及ぼす負の影響を確認した。[74].
“経口ワクチン接種の効果は、地理的な場所や社会経済的地位の違いによって大きく異なることがわかっている。特に、資源の乏しい国に住む子どもたちでは、栄養不足と慢性消化管(GI)感染がOVsの失敗と関連している。…栄養不足と消化管感染は、マイクロバイオータに大きな影響を与え、細菌の多様性の狭まりと炎症の誘発に関連した細菌群の頻度の増加を特徴とする「腸内細菌叢の異常」を誘発することが示されている。最近の研究では、微生物相が粘膜免疫応答の発現に大きな影響を与えることが明らかになっている。したがって、資源の乏しい地域における一村一品の失敗は、微生物相への異生物学的変化によって駆動される免疫応答の変化に影響されている可能性が高いと思われる。[75].
3C2j. 同種チャレンジ(試験アッセイで使用されるチャレンジウイルスの株は、被験者が受けたワクチンを製造するために使用されるシードウイルス株と非常に密接に関連している)感染強化
「猫は、MHCにマッチした方法で個々の猫の免疫系にウイルスタンパク質を提示するために、固定された自家ネコ免疫不全ウイルス(FIV)に感染した細胞でワクチンを接種した。….ワクチンを接種した猫は保護されなかった。その代わりに、ウイルスの複製が促進されることが見出されたが、これは他のワクチン候補を用いた以前の実験で示されたものと同様の観察であった。ここでは、レンチウイルスワクチン開発を複雑にする要因としてのレンチウイルス感染の亢進の観点から、本研究の結果を論じている” [76].
“自己リンパ芽球を用いて調製した4種類の細胞ベースのネコ免疫不全ウイルス(FIV)ワクチンの免疫原性と保護活性を調査した。….試験の1つの条件として、いくつかのワクチン血清は試験管内試験でFIVの複製を増強した。さらに限界として、このワクチンは動物の無麻酔免疫反応のためのプライミングには非効率的であることが証明された。一次免疫終了後2ヶ月後、動物に低用量のex vivo同種FIVを投与した。合わせて、20匹のワクチン接種者のうち8匹が感染症を発症し、9匹のうち1匹が未感染の自己リンパ芽球を固定して模擬免疫を受けたのに対し、1匹が感染症を発症した。より高いウイルス量でブーストして再チャレンジした後、残りのすべての動物が感染したため、保護の欠如が確認された」[77]。[77].
“免疫化は、試験管内試験でのFIV感染を有意に阻害する抗CD134抗体および抗SU抗体の産生を誘導した。しかし、どのワクチンの組み合わせでも猫をFIV感染から保護することはできず、ワクチンを接種した猫からのニート血清は試験管内試験でFIVの増殖を増強した。CD134+SUワクチンを接種した猫は、挑戦の直前にCD4:CD8の比率が増加し、抗体はワクチン副産物と標的抗原との比較ではるかに効率的に生成された。この結果は、ウイルスおよびクリプティックレセプターエピトープに対するワクチン接種により、試験管内試験でのFIV感染を相乗的に阻害する中和抗体が得られることを示唆している。ワクチンの失敗の要因としては、以下のようなものが考えられる。(1) ウイルス複製を促進する熱溶性血清因子、(2) ワクチン接種によって誘導される循環標的細胞集団の変化、(3) 中和エピトープの免疫原性がオフターゲットワクチン成分と比較して弱いこと、などである。結果は、ワクチン調製成分をモニターし、ワクチン接種中に非特異的な免疫刺激を避ける必要性を補強する” [78].
3C2k. 免疫回避(ウイルス感染に対する宿主応答の回避
“インフルエンザウイルスは宿主の自然免疫応答を回避するために多数の戦略を進化させてきた。….ウイルス非構造体(NS)1タンパク質は、IFN産生を阻止するために複数のレベルで作用する。NS1はPAMPの検出を制限し、必須レチノイン酸誘導性遺伝子-Iの翻訳後修飾をブロックし、IFN mRNAの処理および輸出をブロックすることができる。…NS1はまた、抗ウイルスタンパク質の発現を阻止することにより、またはその活性を直接阻害することにより、IFN応答を制限することができる。..。 .インフルエンザウイルスがIFNの効果を回避するために使用する他の戦略には、次のものが含まれる:PAMP形成の制限、宿主細胞タンパク質合成の一般的な阻害、複製コンパートメント、複製速度、アポトーシスの誘導/阻害、および宿主抗ウイルスタンパク質に対する感受性の低下” [79].
“PRRSVによって使用される免疫回避および変調の戦略は、自然免疫応答および適応免疫応答の両方に影響を与える。感染した細胞では、PRRSVは、PRRsの検出を制限するためにそれ自身を隔離し、タイプIFN産生およびシグナル伝達を抑制し、サイトカイン応答を操作し、アポトーシスを調節する。PRRSVの構造タンパク質(N)および非構造タンパク質(nsp1,nsp2,nsp4およびnsp11)は、IFN誘導およびJAK/STAT経路を介したシグナル伝達を減衰させる上で重要な役割を果たしている。さらに、PRRSVは、抗原提示の過程を阻害し、Tregsの増殖と活性化を誘導する機構を進化させ、その後の適応免疫応答の欠乏を引き起こす。ADEの効果もまた、PRRSVの侵入と伝播を促進する。” [80].
“補体によってウイルスに及ぼされるこの選択圧力は、ウイルスに多数の対策を進化させた。これらには、検出を回避するための認識分子の標的化、C3コンバーゼやC5b-9形成のような補体経路の主要な酵素や複合体の標的化-補体調節因子をコードするか、または膜結合型および可溶性宿主補体調節因子をリクルートすることによって-、プロテアーゼをコードすることによって補体タンパク質を切断すること、補体タンパク質の合成を阻害することなどが含まれる。さらに、ウイルスは、自身の利益のために補体システムを利用する。例えば、ウイルスは補体受容体だけでなく、膜調節因子を細胞内への侵入や拡散のために利用している。[81].
“MERS-CoVの免疫回避戦略の主要なメカニズム 我々は、MERS-CoVのM、4a、4bタンパク質およびPlpproが、I型インターフェロン(IFN)および核因子-κBシグナル伝達経路を阻害し、したがって自然免疫回避を促進することを実証した。さらに、非構造タンパク質4a(NSP4a)NSP4b、およびNSP15は、二重鎖RNAセンサーを阻害する。したがって、上記のタンパク質は、IFNの早期誘導を制限し、マクロファージの急速なアポトーシスを引き起こす。MERS-CoVは、抗原提示のダウンレギュレーションを伴うT細胞の活性化を強く阻害する。さらに、インターフェロン अLl_263 酵素誘導タンパク質10および単球化学吸引タンパク質-1の制御されない分泌は、ヒト骨髄系前駆細胞の増殖を抑制することができる。” [82].
3C2l. 免疫干渉(ワクチンウイルスに対する循環抗体からの干渉
“哺乳類細胞での効率的な発現のために最適化された遺伝子配列(コドン最適化)からレンチウイルスEnvとGagを発現させたDNAワクチンを用いて、共接種時の免疫干渉を調べた。しかし、HIV-1 Env(gp120)とHIV-1 Gag(p55)のDNAプラスミドを共接種すると、HIV-1 Gag(p55)に対する免疫応答が減少した。…..したがって、抗HIV-1 Gag免疫干渉は、HIV-1 Env(gp120)との共免疫化に特異的であり、まだ定義されていない免疫学的メカニズムが関与している可能性がある。[83].
“我々は、中和抗体応答に対する調査用アルファウイルスワクチンの投与順序の効果を比較した。生ワクチン(VEE)の前に不活化東部・西部馬脳炎(EEEおよびWEE)ワクチンを接種したボランティアは、EEおよびWEEワクチンの前にVEEワクチンを接種したボランティアよりも抗体反応率が有意に低かった(66.7% vs. 80.6%; p=0.026)。EEEおよびWEEワクチンを最初に受けた人のVEE抗体非反応のオッズは、性別で調整した場合、有意でした(オッズ比[OR]=2.20; 95% CI=1.2-4.1 [p=0.0145]) また、グループで調整した場合の女性の非反応のオッズも有意でした(OR=1.81; 95% CI=1.2-2.7 [p=0.0037])。抗体の干渉と性別効果は、複数のアルファウイルスワクチンを受けている人や、これらの脅威に対する次世代ワクチンを開発している人の間で、ワクチン戦略に大きな意味を持つ。” [84].
3C2l1. 元々の抗原性の罪(その異物(例えば、ウイルスや細菌)の2番目のわずかに異なるバージョンに遭遇したときに、以前の感染に基づく免疫学的記憶を優先的に利用する身体の免疫システムの傾向)。
“すべてのフラビウイルスは抗原的に関連しているため、免疫学的記憶の現象(「元の抗原性の罪」)が起こりやすく、これは連続感染やワクチン接種の過程で免疫反応を変調させる可能性がある。本研究では、YFワクチン由来の既存免疫がTBEワクチン接種に対する抗体反応に及ぼす影響を解析した。YFワクチン接種前とフラビウイルス未接種者のサンプルを比較することにより、YF免疫はTBEワクチン接種に対する中和抗体反応に有意な障害を与えるだけでなく、特異的なTBEウイルス中和活性(NT/ELISA-力価比)の低下をもたらしたことを示した。我々の結果は、既存の交差反応的免疫がフラビウイルスワクチン接種の結果に及ぼす負の効果の可能性を指摘しており、これはフラビウイルスの逐次感染および/またはワクチン接種の他の組み合わせにも関係しているかもしれない。[85].
“我々は、単一のクレードA、B、Cワクチンを単独で接種しても、限られたクロスクレード反応的しか誘導されず、エピトープ階層は免疫化するクレードに応じて変化することを発見した。しかし、シングルクレードのHIV-1ワクチンをマルチクレード製剤に組み合わせると、元々の抗原性の罪やアンタゴニズムなど、生体内で複数の形態の免疫干渉が生じ、エピトープバリアントに対する反応の誘導を弱めたり、あるいは阻害したり、誘導されるT細胞反応の幅を狭めたりすることがわかった。体内の解剖学的に分離された部位への個々のクラッド特異的ワクチンの同時投与は、拮抗作用を緩和し、検出可能なエピトープ応答の数を増加させた”。[86].
“保存されているが、非保護的なエピトープに対する記憶応答のブーストが、保護的な、しかし抗原的に漂流したエピトープに対する新しい応答を生成することを犠牲にして来るときに、OASはまた、有害であることは明らかであるように思われる” [87].
“抗原性の罪は、ヒトのインフルエンザ感染やデング熱を含む、動物とヒトの両方におけるいくつかの感染症で起こることが実証されている。…ウイルス感染の文脈では、病原体の固有株に曝露された場合、同じ病原体へのその後の曝露で二次的な免疫応答をマウントすることができるはずであることが期待されている。”抗原原罪 “は、後続の感染抗原が原初のものと同一である限り、この確立された免疫学的プロセスに矛盾することはない。しかし、”元々の抗原性の罪 “は、エピトープがわずかに変化すると、免疫システムは、より速く、より強力な応答を可能にするであろう新しいエピトープに対する別の一次または二次応答をマウントするのではなく、以前の感染の記憶に依存することを意味している。その結果、免疫系が適応せず、代わりに記憶に頼って反応を起こすため、新しい株に対して免疫学的な反応が不十分になることがある。ワクチンの場合、単一の株またはエピトープにのみ免疫し、その株/エピトープが時間の経過とともに変化する場合、免疫系は正確な二次応答をマウントすることができない。さらに、最初のウイルス曝露によっては、二次免疫応答は抗体依存性の疾患の増強をもたらしたり、逆にアレルギーを誘発したりする可能性がある。どちらも病原体の制御が失われ、異常な臨床結果を誘発する。[88].
3C2m. 先行インフルエンザ感染(先行インフルエンザ感染が将来の疾患症状の重症度に及ぼす影響
“70人の患者が選択基準を満たした。平均年齢は66歳であった。64人(91%)の患者は少なくとも1つの併存疾患を有していた;これらの併存疾患にはCOPD、うっ血性心不全、糖尿病、癌が含まれていた。60/70例(85%)がインフルエンザA陽性、43例がH1N1陽性であった。
オセルタミビルは55例(78%)で開始された。44%の患者はワクチン接種を受けていた。ワクチン接種の有無で分けると、ワクチン接種を受けていた患者では、ICUへの入院、機械的または非侵襲的人工呼吸の必要性、および死亡率が高かった。死亡率以外はすべて統計学的有意差に達した。….このデータは、インフルエンザで入院した高齢男性のこの集団では、入院、呼吸不全、および死亡率を予防する上で、事前のワクチン接種による保護効果はなかったことを示唆している”。[89].
“マウスは、最初にA/プエルトリコ/8/34(PR8)ウイルスの感染または免疫化のいずれかによってプライミングされ、その後、全不活化A/フォートモンマス/1/47(FM1)ウイルスで免疫化された。その後のワクチン反応とFM1の保護効果は、PR8感染を免疫化したマウスでは、PR8免疫化したマウスや免疫化していないマウスと比較して優れていた。また,PR8感染プライミングマウスのFM1特異的Ab反応の増加は,同時代の株や抗原的にドリフトした株に対する交差反応的を拡大させた。さらに、A/ブリスベン/59/2006に感染した後にパンデミックH1N1ワクチンを接種した場合(カリフォルニア/07/2009)など、抗原的に離れた株に対しても、先行感染により防御効果が向上した。したがって、インフルエンザ感染は、ドリフト株に対する将来のワクチン反応を激化させる重要なプライミングイベントである” [90].
“3回のインフルエンザシーズンの間に、5838回のILI[インフルエンザ様疾患]エピソード(4127人の被験者)が分析された。前シーズンにMA-fluA[医学的に出席したインフルエンザA]のエピソードを持っていた被験者は、今シーズンのMA-fluAのリスクが有意に低かった(調整オッズ比:0.38,95%CI:0.30-0.50)。全体の修正VEは28%(95%CI、14~40%)であった。VEは、前シーズンにワクチンを接種した被験者では、前シーズンにワクチンを接種していない被験者に比べて実質的に低かった(19%;95%CI:0-35 vs 46%;95%CI:26-60,相互作用の検定、P値<0.05)。前シーズンにMA-fluAを接種していない被験者では、反復接種によるVEの減衰が認められた(13%;95%CI:-7~30 vs 44%;95%CI:24~59,相互作用の検定、P値<0.05)。しかし、この効果は前シーズンにMA-fluAに感染した被験者では検出されなかった。….反復接種の負の効果は、前シーズンにMA-fluAの既往歴のない被験者で有意であった”。[91].
“季節性インフルエンザワクチン効果(VE)の低下は、毎年のワクチン接種を繰り返し受けた個人で観察された。また、既往のインフルエンザ抗体レベルはワクチン接種後の力価と逆相関していることが判明した。これらの報告は、既存の免疫が現代の季節性ワクチンの性能に影響を与える可能性を示唆している” [92].
“現在および前シーズンのワクチン接種は同程度の保護をもたらし、ワクチン誘発性の保護は、過去5年間にワクチンを接種していない人で最大であった。[93].
“過去2年間のいずれかの期間にワクチン接種を受けたと報告した参加者は、受けなかった人よりも全株に対する平均フォールド上昇が低かった。A(H3N2)およびB/山形の平均倍数上昇は、同じワクチン株での反復接種後に特に弱かったが、ワクチン接種後の力価≧40および≧160…..全体として、反復接種者における抗体反応の低下は、過去数年間に同じ株のワクチン接種を受けていた高齢者の間で特に減少していたことがわかった”。[94].
“死亡率に対する長期的な影響は、これまで直接的な証拠によって裏付けられたことはなかった。本研究では、ベースラインとしてインフルエンザワクチン接種の有効性に関するRCTを25年間追跡調査し、高齢者の死亡率に対するインフルエンザワクチン接種の長期的アウトカムを評価した。….アウトカムには、全死因死亡率、インフルエンザ関連死亡率、季節性死亡率が含まれていた。….インフルエンザワクチン単独接種は、プラセボと比較して全死因死亡率を減少させなかった(調整後HR 0.95,95%CI 0.85-1.05)。また、基礎となる死因または季節性死亡率についても、ワクチン接種群とプラセボ群の間に差は示されなかった。….結論として、本研究では、インフルエンザ単独ワクチン接種後の、一般的な地域居住高齢者の長期死亡率に対する統計学的に有意な効果は示されなかった”。[95].
“インフルエンザは78世帯(24%)125人(9%)で確認された;感染リスクはワクチン接種者で8.5%、ワクチン未接種者で8.9%であった(P = 0.83)。市中感染インフルエンザ予防における調整後のワクチン効果は 31%(95%信頼区間[CI]、-7%~55%)であった。前シーズンのワクチン接種の証拠がないワクチン接種済みの被験者では、市中インフルエンザに対する有意な保護(62%[95%信頼区間[CI]、17%~82%])が示された。現在の季節と前の季節の両方にワクチンを接種した被験者では、有効性が大幅に低下したことが指摘された。ワクチン接種がインフルエンザが導入された後の家庭内感染を予防するという証拠はなく、成人はワクチン接種にもかかわらず特にリスクを負っていた。….V ワクチンの有効性の推定値は、同じシーズンに実施された他の観察研究で示された値よりも低かった。ワクチン接種を繰り返しても有効性が低く、家庭での曝露では保護されないという予想外の所見は、さらなる研究が必要である”。[96].
3C2n. ウイルス曝露間のタイミング(ウイルス曝露間の経過時間
“ワクチンレジメンが免疫に与える影響の背後にあるメカニズムを理解することは、ワクチンの改良に不可欠である。実際、免疫接種の間隔は、B細胞やT細胞だけでなく、自然免疫反応にも影響を与える可能性がある。私たちは、減衰したワクシニアウイルスで免疫されたシノモルグスザルを用いて、2つのワクチンスケジュールを比較した。2週間間隔で2回の皮下注射を行ったところ、2次抗体反応が損なわれ、どちらの免疫化に対しても同様の自然骨髄反応が得られた。対照的に、遅延ブースト(2ヶ月)では、抗体応答の質が改善され、より多くの活性化/成熟した自然免疫細胞が関与し、プライム後に遅く誘導され、リコールに応答した。二次抗体応答の大きさと質は、2ヶ月で再接種前に表現型的に修飾され、濃縮された好中球、単球、および樹状細胞の豊富さと相関していたが、2週間ではそうではなかった。これらの後期の表現型の変化は、2回目の接種後間もなく、PBMCsによる生体外サイトカイン産生(IL-12/23およびIL-1betaを含む)の亢進と関連しており、表現型と機能を結びつけていた。この総合的な解析により、免疫接種の間のタイミングが深く影響していることが明らかになり、体液性免疫を形成する上で、表現型の変化を含む初期だけでなく、後期の自然免疫応答の重要性が強調されている。[97].
“本研究では 2012年の第7週までピークが遅れた2011/12シーズンのスペイン・ナバラでの実験室確認症例の予防におけるインフルエンザワクチンの有効性(VE)を評価している。…。[98].
“3つのインフルエンザシーズン中に、1668回のインフルエンザ様疾患エピソードが分析され、その中にはMA-fluAの421回とMA-fluBの358回が含まれていた。…..複数シーズンにわたる過去のワクチン接種の繰り返しは、MA-fluAとMA-fluBの両方に対するVEに有意な用量依存性の負の影響を与えていた。” [99].
“小児における MAI に対する有効性を評価した 6 つの研究では、循環株がワクチン株と不一致の場合のリスク比(RR)は 2.04(95% CI 1.29-3.22)循環株がワクチン株と一致の場合は 0.64(0.33-1.22)であった。ワクチンの種類で層別化すると、有効性の低下は生ワクチンのみの場合に有意であった。….インフルエンザワクチンのミスマッチ株に対する有効性は、繰り返しワクチンを接種した小児では、今シーズンのみワクチンを接種した小児と比較して低かった。” [100].
3C2o. ワクチンに関連した呼吸器疾患の増強(ワクチン接種により呼吸器疾患が増強される場合
“ワクチン誘発性疾患増強は、いくつかのウイルスワクチンに関連して、動物モデルおよびヒトで記述されている。我々は、pH1N1感染後のミスマッチインフルエンザワクチン関連強化呼吸器疾患(VAERD)を評価するために、豚モデルを調査した。豚に全不活化H1N2(ヒト様)ウイルスワクチン(WIV-H1N2)を接種したところ、pH1N1感染後に肺炎と疾患が増強された。….交差反応的抗HA2抗体は、ウイルス膜の融合活性を促進することで、マディン・ダービー犬腎臓細胞のpH1N1感染を増強した。強化された融合活性は、ブタの肺病理と相関していた” [101].
“ワクチン関連強化呼吸器疾患(VAERD)は、全不活化ウイルス(WIV)ワクチンによって誘発される非中和性だが交差反応的の抗体の存在下で、豚が異種ウイルスで挑戦された場合に発生する可能性がある。この研究の目的は 2009年パンデミック H1N1 ウイルス(H1N1pdm09)組換えヘマグルチニン(HA)サブユニットワクチン(HA-SV)または温度感受性ライブ減衰型インフルエンザウイルス(LAIV)ワクチンを接種した後の豚の異種ウイルス delta1-H1N2 インフルエンザ A ウイルス(IAV)チャレンジの効果を比較し、VAERD の発症における HA に対する免疫の役割を評価することであった。HA-SVおよびLAIVワクチンは、相同HAを持つウイルス(H1N1pdm09)に対して高い中和抗体を誘導したが、異種チャレンジウイルス(delta1-H1N2)に対しては誘導しなかった。LAIVはブタを部分的に保護し、その結果、感染後5日目(dpi)までに肺にウイルスが検出されなかったため、ウイルスの脱落が減少し、ウイルスのクリアランスが速くなった。HA-SVワクチンを接種した豚は、チャレンジ後にVAERDと一致する重度の肺病変と気管病変を発症した。これらの結果は、HAタンパク質に対する免疫応答だけで、異種挑戦後のVAERDを引き起こすのに十分であることを示している。[102].
“豚におけるインフルエンザAウイルス(IAV)の制御は、初乳を介して母体由来抗体(MDA)を提供するための雌のワクチン接種によって行われる。我々の目的は、MDAがワクチンを接種していない子豚のIAV感染、臨床疾患、および感染に干渉するかどうかを評価することであった。最初の研究では、ナイーブな母豚に H1N2-delta1 全身不活化ウイルス(WIV)ワクチンを接種した。追跡研究では 2009 年パンデミック H1N1(H1N1pdm09)に対する血清陽性の母豚に H1N1pdm09 WIV または二次実験感染(EXP)を接種した。MDA陽性豚を同種または異種ウイルスで挑戦し、MDA陰性対照群を含めた。WIV-MDAの子豚は同種感染から保護された。しかし、WIV 由来の MDA を持つ子豚は、母豚の自然暴露の履歴にかかわらず、その後異種ウイルスに挑戦した場合、ワクチンに関連した呼吸器疾患(VAERD)を発症した。我々のデータは、高力価のワクチン由来 MDA が同種ウイルス感染、感染、および疾患を減少させたものの、MDA だけでは異種ウイルス感染時に VAERD を誘発するのに十分であったことを示している” [103]。[103].
3C2p. 慢性免疫活性化
“Sharilyn Stanley博士らは、無症状のHIV感染者13人と未感染のボランティア10人に破傷風ブースター注射を接種し、免疫系を刺激した。注射の当日と3日後、7日後、14日後、21日後、28日後、42日後に採血を行った。その結果、HIV感染者の血液中のHIVの量は、予防接種後に2倍から36倍に増加した。特に、9人のHIV感染者の血球からは、免疫接種後にウイルスがより容易に増殖した。さらに、感染していないボランティアの免疫系細胞を調べたところ、10人中7人の細胞が免疫前よりも免疫後の試験管内でHIVに感染しやすかったことがわかった。全体的に、継続的な免疫活性化がHIVの発症に関与している可能性があり、また、未感染者のHIVへの感受性を高める可能性があることを示唆するデータである。” [104].
“HIVの共感染は、潜在性結核(TB)感染(LTBI)の再活性化の最も重要な危険因子である。CD4(+) T細胞の枯渇がHIVによるLTBIの再活性化の主な原因と考えられてきたが、結核菌(Mtb)/シミアン免疫不全ウイルス(SIV)に感染したマカクを対象とした最近の研究では、慢性的な免疫活性化とT細胞の恒常性の調節障害をもたらすSIVの細胞病原性効果がLTBIの再活性化と相関していることが示唆されている。このレビューは、HIV感染中のLTBIの再活性化はHIVの複製イベントによって引き起こされる可能性が高いという説得力のあるデータを基に構築されており、したがって、共感染による再活性化を対象とした最適なトランスレーショナル介入の必要性を強調している」[105]。[105].
“全身性慢性免疫活性化は、今日、CD4+ T細胞枯渇と後天性免疫不全症候群(AIDS)の原動力と考えられている。抗レトロウイルス療法によってウイルス複製の抑制に成功したHIV感染者でも、残存する慢性免疫活性化は持続し、この残存免疫活性化の程度はCD4+ T細胞の減少と関連している” [106].
3C3. ワクチンに起因する短期および長期の潜在的な疾患
3C3a. ワクチンの副作用に関する欠陥の追跡
COVID-19ワクチンの有効性の問題は、最近のレビュー[29, 34]で広範囲に列挙されているが、中長期的な安全性を確保するためには、より重視する必要がある。ワクチンは、多くの医薬品と同じ安全性要件を持っているようには見えない。例えば、安全性に関連した選択されたワクチンの挿入物からの以下の抜粋を考えてみよう[107]。
M-M-Rワクチン「M-M-R IIは、発がん性や突然変異原性、生殖能力を損なう可能性については評価されていない。M-M-R II を用いた動物の生殖試験は実施されていない。
- インフルエンザワクチン「FLUARIX QUADRIVALENT」は、動物における発がん性や変異原性、男性不妊の可能性について評価されていない。
- DTAP ワクチン「INFANRIX」は、発がん性、変異原性、男性不妊症の可能性は評価されていない」、HPV ワクチン「GARDASIL 9」は、発がん性、遺伝毒性、男性不妊症の可能性は評価されていない」。
ワクチンの長期安全性試験は稀である。典型的なワクチン試験は有効性を目的としている。このような試験は数ヶ月に及ぶ傾向があり、主な評価基準は血清中の抗体価である。
ワクチン、特に小児ワクチンはスケジュールに従って投与され、現在では約16種のワクチンをカバーする約70回以上の投与量で構成されている。この70回以上のワクチン接種によるスケジュールに基づく組み合わせ効果は実験されておらず、したがって、実際のワクチンの相乗効果による副作用は不明である。このようなワクチンの組み合わせ実験は、実験室の原始的な環境に限定することはできないが、ワクチンの組み合わせの相乗効果に影響を与える可能性のある無数の毒性刺激にさらされているヒトでの実験が必要である。
ワクチン有害事象に関する公表データの多くは(少なくとも米国では)ワクチン有害事象報告システム(VAERS)データベースに由来している。VAERSは受動的なモニタリングシステムであり、他の同様のシステムと同様に、有害事象の報告が大幅に不足している[108]。ハーバード・ピルグリム・ヘルスケア社が実施した画期的な研究[109]では、「ワクチン有害事象の1%未満が報告されている」と報告されている。つまり、ワクチンの有害事象の実数は、VAERSで報告されているものよりも1~2桁も多いのです!
この結果を得るためにHarvard Pilgrim Healthcare. Inc.がこの結果を得るために用いた方法論は以下の通りである。”ワクチンを受けているすべての患者が自動的に識別され、次の30日間、彼らのヘルスケア診断コード、臨床検査、薬の処方が、ワクチンの有害事象を示唆する値で評価される。有害事象の可能性が検出されると、それが記録され、適切な臨床医に電子的に通知されるようになっている。
このように、確認されたこれらの有害事象は、1回限りの短期的な有害事象(ワクチン接種後30日以内)である。これらは、30日以上の期間に実施されたワクチンの組み合わせの結果を反映したものではなく、また、中長期的なワクチン接種の結果を反映したものでもない[109]。
ワクチン有害事象の1%未満が報告されている場合、このサンプルは実際に経験した有害事象の総数をどの程度反映しているのであろうか?これは、統計的に妥当な結果を得るために必要とされるような、無作為に選択されたサンプルではない。このように、VAERSのデータに基づく短期的な有害事象の分析でさえ、重大な欠陥がある。また、短期的な有害事象の1%未満が報告されたとして、長期的な有害事象(有害事象とワクチン接種との関連性が時間の経過とともに曖昧になっていく)のうち、どの程度の割合が報告されるのであろうか?VAERSのような受動的なモニタリングシステムでは、長期的な有害事象の報告はごくわずかであると結論づけることができる。
3C3b. ワクチンが引き金となった疾患
ワクチンの生物医学的文献を簡単に分析し、ワクチン接種によって誘発される可能性のある疾患、特に長期的に誘発される可能性のある疾患を特定した。生物医学的文献は、長期的なワクチン効果、特に長期的な副作用に関する研究が非常に少ないことに注意すべきである。このような有害事象を特定し、ワクチン接種と疾病との間の統計的に妥当な関連性を導き出すためには、多くの人数と長期間の研究が必要となる。これらの努力は非常に資源を必要とし、ワクチン製造者や規制当局はこのような研究のために資源を利用しようとは考えていないようである。このように、以下の例は、長期的なワクチンの悪影響という非常に大きな氷山の一角を反映している。
ワクチン接種によって引き起こされた生物医学的文献で報告されている2つの主要な疾患は、
自己免疫疾患(例:全身性エリテマトーデス、乾癬、関節炎、多発性硬化症、肝炎、ぶどう膜炎、偽性リンパ腫、ギラン・バレー症候群、血小板減少性紫斑病など)と
神経学的疾患(例:自閉症、中枢性脱髄性疾患、中枢性脱髄性疾患など)である。自閉症、中枢性脱髄疾患、発達障害、発熱性発作、ナルコレプシー、脳脊髄炎、自律神経失調症など)。)
その他には、糖尿病、消化器疾患、関節関連疾患、ネクロバイオティック肉芽腫、好中球減少症、肺線維症などがある。
以下にいくつかの具体例を示し、ワクチンの副作用のより大きな参考文献を付録1に示する。
“アジュバントワクチンの全身毒性に関連する主な症候群…..急性期反応(APR). .過敏症反応. 自己免疫疾患の誘発または悪化。. . . . ワクチン接種後の経口免疫抑制または耐性” [110].
“予防接種はまた、自己免疫のモザイクに寄与する可能性がある。ワクチン接種とこれらの疾患の発症との関連性についての証拠が、このレビューで提示されている。頻繁に報告されるワクチン接種後の自己免疫疾患には、全身性エリテマトーデス、関節リウマチ、炎症性ミオパチー、多発性硬化症、ギラン・バレー症候群、血管炎などがある。” [111].
“(Toplak er al)。….reported the selfantibody(抗核抗体や抗リン脂質抗体など)の産生を、インフルエンザワクチン接種後6ヶ月までの健康な医療従事者92名で報告している。他の研究では、HiBワクチン接種と糖尿病の間、およびHBVワクチン接種と脱髄イベントの間に数年の潜伏期間があることが示されている。…結論として、潜伏期間は感染後およびワクチン接種後の自己免疫について数日から数年の範囲である。” [112].
“HBVを受けた成人は、
- 多発性硬化症(OR=5.2,p<0.0003,95%信頼区間(CI)=1.9~20)
- 視神経炎(OR=14,p<0.0002,95%CI=2.3~560)
- 血管炎(OR=2.6,p<0.04,95%CI=1.03~8.7)
- 関節炎(OR=2.01,p<0.0003,95%CI=1.03~8.7)
で有意にオッズ比(OR)が増加していた。 0003,95%CI = 1.3 – 3.1)
- 脱毛症(OR = 7.2,p < 0.0001,95%CI = 3.2 – 20)
- エリテマトーデス(OR = 9.1,p < 0.0001,95%CI = 2.3 – 76)
- リウマチ(OR = 2.6,p < 0.04,95%CI = 1.03 – 8.7)。 3~76)
- 関節リウマチ(OR = 18,p < 0.0001,95% CI = 3.1~740)
- 血小板減少症(OR = 2.3,p < 0.04,95% CI = 1.02~6.2)
をTCV群と比較して示した。交絡因子または系統的誤差は最小限であった” [113].
“4回投与群と0回投与群の累積罹患率の差は、7年後のIDDM/100,000例で54例(P = 0.026)である(相対リスク=1.26)。余分なIDDMの症例のほとんどは、予防接種後約38ヵ月から約6~8ヵ月の間に統計学的に有意なクラスターを形成していた。小児ワクチンの接種はNODマウスにおけるインスリン糖尿病のリスクを増加させた。….HiBワクチンの接種はIDDMのリスク増加と関連している。NODマウスは、ワクチン誘発糖尿病の動物モデルとして使用することができる” [114].
3C4. 信頼できるCOVID-19ワクチン安全性試験に必要な時間
上記の結果が示すように、ワクチンは免疫系への長期的な影響(陽性と陰性)と、他の疾患への短期的な影響と長期的な影響があり得る。ワクチンの効果は、感染経路、予防接種の既往歴、および上記のBennらが述べているように、”他のワクチン、薬剤、または微量栄養素との投与、および異なる順序での投与によって異なることがある。” [58]. 長期的な安全性を実証するために必要な時間を短縮するために、実験室での実験は通常、無数の毒性刺激に対する反応が人間と類似している比較的寿命の短い動物を用いて行われる。
これらの動物実験とヒトモデルとの大きな違いの一つは、ヒトモデルが有毒刺激の海の中で生活しているのに対し、実験室実験は通常、単一の有毒刺激剤の投与で行われるか、たぶん2つの有毒刺激剤の投与で行われるということだ。また、どちらの動物モデルがワクチン接種に対する反応を最もよくシミュレートするかは、必ずしも明確ではない。
有毒刺激への複合暴露が有害な影響を示した生物医学的文献には多くの例があるが、単独で(同じ用量で)同じ刺激への暴露は有害な影響を示さなかったのに対し、[63-64]。このように、これらの実験室での実験は、関連する免疫調節剤の組み合わせの範囲で行われない限り、安全性評価の目的では信頼性がないだろう。このような実験には膨大な資金と時間のリソースが必要となる。
もう一つの選択肢は、ヒトを用いて安全性試験を実施することである。長期的な安全性研究(例えば、癌やアルツハイマー病の発症に対するワクチンの潜在的な効果など)では、信頼できる結果を得るためには数十年かかる可能性がある。このように、COVID-19ワクチンの信頼できる安全性研究に必要な時間と、今日の意思決定者やメディアによって提唱されている1年以内のワクチンの商業化との間には大きな隔たりがある。
3C5. ワクチン前臨床試験の分子模倣と無効な遺伝学的根拠:安全で効果的なワクチンを設計するための新しいワクチン学のシナリオ。
上記で分析したCOVID-19ワクチンの安全性に関する考察は、交差反応的がコロナウイルス感染に関連した免疫病理学と疾患の多様性の根底にあるメカニズムを表しているかもしれないという事実を考えると、さらに説得力が増する[115]。その理論的根拠は、SARS-CoV-2とヒトタンパク質の間でペプチドが共有されていることで、ウイルスだけでなくヒトタンパク質にも免疫反応が起こり、結果としてヒト宿主の自己免疫疾患を引き起こす可能性があるということである[116]。したがって 2000年以降に記述された大規模なウイルス対ヒトペプチドの共通性[117-118]は、保護的な抗ウイルス抗体免疫応答がヒト生物に対する病原性自己免疫攻撃になる方法を明確に説明し、それによって、なぜSARS-CoV-2が呼吸器系を激しく攻撃するのかという問題に対処している[119]。科学的な交差反応的の文脈と、SARS-CoV抗原による免疫化が重症肺炎を引き起こすことを示す臨床データ[120]は、Covidにおける抗SARS-CoV抗体の顕著な病原性の役割を示唆している。実際、新たな報告では、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染は、小児炎症性多系統症候群または小児多系統炎症性症候群を含む様々な自己免疫疾患および自己炎症性疾患の出現に先行していることが示されている[121-122]。簡単に言えば、現在の免疫原性の高い抗SARS-CoV-2ワクチンの獲得競争は、アジュバントされた抗SARS-CoV-2がSARS-CoV-2感染症と比較してより高い免疫原性と自己免疫病原性を有するという事実を考慮すると、実際には致死性の高いワクチンの生産競争に等しいかもしれない。
この交差反応的のリスクは、現在のワクチン前臨床試験では推定できないことを考慮すると、さらに増大する[123-124]。実際、病原体とヒト、マウス、ラットのプロテオーム間ではペプチドの共有レベルが最も高く、ゴリラ、チンパンジー、アカゲザルなどの非ヒト霊長類のプロテオーム間では最小(または存在しない)である。つまり、霊長類は、遺伝学的な観点から、免疫療法の前臨床試験において、自己免疫の交差反応の可能性を明らかにするための動物モデルとしては信頼性が低いのである。
全体として、上記のデータは 2000年に最初に述べられた基本的な概念を確認することによって、ワクチン学の新たなシナリオを切り開くものである[117]。
第4章 参考文献
[1] Kostoff RN, Briggs MB, Porter AL. COVID-19: Preventing Future Pandemics. Georgia Institute of Technology. 2020. PDF. smartech.gatech.edu/handle/1853/62907
[2] Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet (London, England). 2020;395(10223):497-506.
[3] 92. Liu Y, Yang Y, Zhang C, Huang F, Wang F, Yuan J, et al. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Science China Life sciences. 2020;63(3):364-74.
[4] Mo P, Xing Y, Xiao Y, Deng L, Zhao Q, Wang H, et al. Clinical characteristics of refractory COVID-19 pneumonia in Wuhan, China. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2020.
[5] Qian GQ, Yang NB, Ding F, Ma AHY, Wang ZY, Shen YF, et al. Epidemiologic and clinical characteristics of 91 hospitalized patients with COVID-19 in Zhejiang, China: a retrospective, multi-centre case series. QJM : monthly journal of the Association of Physicians. 2020;113(7):474-81.
[6] Qin C, Zhou L, Hu Z, Zhang S, Yang S, Tao Y, et al. Dysregulation of Immune Response in Patients With Coronavirus 2019 (COVID-19) in Wuhan, China. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2020;71(15):762-8.
[7] Tian S, Hu N, Lou J, Chen K, Kang X, Xiang Z, et al. Characteristics of COVID-19 infection in Beijing. The Journal of infection. 2020;80(4):401-6.
[8] Han H, Ma Q, Li C, Liu R, Zhao L, Wang W, et al. Profiling serum cytokines in COVID-19 patients reveals IL-6 and IL-10 are disease severity predictors. Emerging microbes & infections. 2020;9(1):1123-30.
[9] Yun H, Sun Z, Wu J, Tang A, Hu M, Xiang Z. Laboratory data analysis of novel coronavirus (COVID-19) screening in 2510 patients. Clinica chimica acta; international journal of clinical chemistry. 2020;507:94-7.
[10] Medetalibeyoglu A, Senkal N, Capar G, Kose M, Tukek T. Characteristics of the initial patients hospitalized for COVID-19: a single-center report. Turkish journal of medical sciences. 2020;50(5):1436-9.
[11] Guo T, Shen Q, Guo W, He W, Li J, Zhang Y, et al. Clinical Characteristics of Elderly Patients with COVID-19 in Hunan Province, China: A Multicenter, Retrospective Study. Gerontology. 2020:1-9.
[12] Docea AO, Tsatsakis A, Albulescu D, Cristea O, Zlatian O, Vinceti M, et al. A new threat from an old enemy: Re‑emergence of coronavirus (Review). International journal of molecular medicine. 2020;45(6):1631-43.
[13] Castle SC, Uyemura K, Rafi A, Akande O, Makinodan T. Comorbidity is a better predictor of impaired immunity than chronological age in older adults. Journal of the American Geriatrics Society. 2005;53(9):1565-9.
[14] Castle SC, Uyemura K, Fulop T, Makinodan T. Host resistance and immune responses in advanced age. Clinics in geriatric medicine. 2007;23(3):463-79, v.
[15] Coronavirus Disease 2019 vs. the Flu. Johns Hopkins Medicine. www.hopkinsmedicine.org/health/conditions-and-diseases/coronavirus/coronavirus-disease-2019-vs-the-flu
[16] Covid-19 Treatment and Vaccine Tracker. Milken Institute. milkeninstitute.org/covid-19-tracker
[17] COVID-19: Prevention & Investigational Treatments. Drugs.com. www.drugs.com/condition/covid-19.html
[18] The Latest Research on COVID-19 Treatments and Medications in the Pipeline. GoodRx. www.goodrx.com/blog/coronavirus-treatments-on-the-way/
[19] Kostoff RN. Treatment Repurposing using Literature-related Discovery. Journal of Scientometric Research. 2019;8(2):S74-S84.
[20] Calina D, Docea AO, Petrakis D, Egorov AM, Ishmukhametov AA, Gabibov AG, et al. Towards effective COVID‑19 vaccines: Updates, perspectives and challenges (Review). International journal of molecular medicine. 2020;46(1):3-16.
[21] HHS. Fact Sheet: Explaining Operation Warp Speed. www.hhs.gov/about/news/2020/06/16/fact-sheet-explaining-operation-warp-speed.html.
[22] Craven J. COVID-19 Vaccine Tracker. www.raps.org/news-and-articles/news-articles/2020/3/covid-19-vaccine-tracker
[23] Yong CY, Ong HK, Yeap SK, Ho KL, Tan WS. Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus. Frontiers in microbiology. 2019;10:1781.
[24] Padron-Regalado E. Vaccines for SARS-CoV-2: Lessons from Other Coronavirus Strains. Infectious diseases and therapy. 2020:1-20.
[25] Fett C, DeDiego ML, Regla-Nava JA, Enjuanes L, Perlman S. Complete protection against severe acute respiratory syndrome coronavirus-mediated lethal respiratory disease in aged mice by immunization with a mouse-adapted virus lacking E protein. Journal of virology. 2013;87(12):6551-9.
[26] Regla-Nava JA, Nieto-Torres JL, Jimenez-Guardeno JM, Fernandez-Delgado R, Fett C, Castano-Rodriguez C, et al. Severe acute respiratory syndrome coronaviruses with mutations in the E protein are attenuated and promising vaccine candidates. Journal of virology. 2015;89(7):3870-87.
[27] Lurie N, Saville M, Hatchett R, Halton J. Developing Covid-19 Vaccines at Pandemic Speed. The New England journal of medicine. 2020;382(21):1969-73.
[28] Huisman W, Martina BEE, Rimmelzwaan GF, Gruters RA, Osterhaus ADME. Vaccine-induced enhancement of viral infections. Vaccine. 2009;27(4):505-12.
[29] Taylor A, Foo S-S, Bruzzone R, Dinh LV, King NJC, Mahalingam S. Fc receptors in antibody-dependent enhancement of viral infections. Immunological reviews. 2015;268(1):340-64.
[30] Iwasaki A, Yang Y. The potential danger of suboptimal antibody responses in COVID-19. Nature reviews Immunology. 2020;20(6):339-41.
[31] Tirado SMC, Yoon K-J. Antibody-dependent enhancement of virus infection and disease. Viral immunology. 2003;16(1):69-86.
[32] Shmelkov E, Nadas A, Cardozo T. Could vaccination with AIDSVAX immunogens have resulted in antibody-dependent enhancement of HIV infection in human subjects? Human vaccines & immunotherapeutics. 2014;10(10):3013-6.
[33] Gu W, Guo L, Yu H, Niu J, Huang M, Luo X, et al. Involvement of CD16 in antibody-dependent enhancement of porcine reproductive and respiratory syndrome virus infection. The Journal of general virology. 2015;96(Pt 7):1712-22.
[34] Smatti MK, Al Thani AA, Yassine HM. Viral-Induced Enhanced Disease Illness. Frontiers in microbiology. 2018;9:2991.
[35] Ubol S, Halstead SB. How innate immune mechanisms contribute to antibody-enhanced viral infections. Clinical and vaccine immunology: CVI. 2010;17(12):1829-35.
[36] Bolles M, Deming D, Long K, Agnihothram S, Whitmore A, Ferris M, et al. A double-inactivated severe acute respiratory syndrome coronavirus vaccine provides incomplete protection in mice and induces increased eosinophilic proinflammatory pulmonary response upon challenge. Journal of virology. 2011;85(23):12201-15.
[37] Halstead SB. Dengue Antibody-Dependent Enhancement: Knowns and Unknowns. Microbiology spectrum. 2014;2(6).
[38] Sprokholt J, Helgers LC, Geijtenbeek TB. Innate immune receptors drive dengue virus immune activation and disease. Future virology. 2017;13(4):287-305.
[39] Guzman MG, Alvarez M, Halstead SB. Secondary infection as a risk factor for dengue hemorrhagic fever/dengue shock syndrome: an historical perspective and role of antibody-dependent enhancement of infection. Archives of virology. 2013;158(7):1445-59.
[40] Costa VV, Fagundes CT, Valadao DF, Avila TV, Cisalpino D, Rocha RF, et al. Subversion of early innate antiviral responses during antibody-dependent enhancement of Dengue virus infection induces severe disease in immunocompetent mice. Medical microbiology and immunology. 2014;203(4):231-50.
[41] Jaume M, Yip MS, Kam YW, Cheung CY, Kien F, Roberts A, et al. SARS CoV subunit vaccine: antibody-mediated neutralisation and enhancement. Hong Kong medical journal = Xianggang yi xue za zhi. 2012;18 Suppl 2:31-6.
[42] Klonjkowski B, Klein D, Galea S, Gavard F, Monteil M, Duarte L, et al. Gag-specific immune enhancement of lentiviral infection after vaccination with an adenoviral vector in an animal model of AIDS. Vaccine. 2009;27(6):928-39.
[43] Mier-y-Teran-Romero L, Schwartz IB, Cummings DAT. Breaking the symmetry: immune enhancement increases persistence of dengue viruses in the presence of asymmetric transmission rates. Journal of theoretical biology. 2013;332:203-10.
33
[44] Hotez PJ, Bottazzi ME, Corry DB. The potential role of Th17 immune responses in coronavirus immunopathology and vaccine-induced immune enhancement. Microbes and infection. 2020;22(4-5):165-7.
[45] Clay C, Donart N, Fomukong N, Knight JB, Lei W, Price L, et al. Primary severe acute respiratory syndrome coronavirus infection limits replication but not lung inflammation upon homologous rechallenge. Journal of virology. 2012;86(8):4234-44.
[46] Vojdani A, Kharrazian D. Potential antigenic cross-reactivity between SARS-CoV-2 and human tissue with a possible link to an increase in autoimmune diseases. Clinical immunology (Orlando, Fla). 2020;217:108480.
[47] Vojdani A, Kharrazian D. Potential antigenic cross-reactivity between SARS-CoV-2 and human tissue with a possible link to an increase in autoimmune diseases. Clinical immunology (Orlando, Fla). 2020;217:108480.
[48] Paul LM, Carlin ER, Jenkins MM, Tan AL, Barcellona CM, Nicholson CO, et al. Dengue virus antibodies enhance Zika virus infection. Clinical & translational immunology. 2016;5(12):e117.
[49] Castanha PMS, Nascimento EJM, Braga C, Cordeiro MT, de Carvalho OV, de Mendonca LR, et al. Dengue Virus-Specific Antibodies Enhance Brazilian Zika Virus Infection. The Journal of infectious diseases. 2017;215(5):781-5.
[50] Wolff GG. Influenza vaccination and respiratory virus interference among Department of Defense personnel during the 2017-2018 influenza season. Vaccine. 2020;38(2):350-4.
[51] Cowling BJ, Fang VJ, Nishiura H, Chan K-H, Ng S, Ip DKM, et al. Increased risk of noninfluenza
respiratory virus infections associated with receipt of inactivated influenza vaccine. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2012;54(12):1778-83.
[52] Skowronski DM, De Serres G, Crowcroft NS, Janjua NZ, Boulianne N, Hottes TS, et al. Association between the 2008-09 seasonal influenza vaccine and pandemic H1N1 illness during Spring-Summer 2009: four observational studies from Canada. PLoS medicine. 2010;7(4):e1000258.
[53] Rikin S, Jia H, Vargas CY, Castellanos de Belliard Y, Reed C, LaRussa P, et al. Assessment of temporally-related acute respiratory illness following influenza vaccination. Vaccine. 2018;36(15):1958-64.
[54] van Asten L, Bijkerk P, Fanoy E, van Ginkel A, Suijkerbuijk A, van der Hoek W, et al. Early occurrence of influenza A epidemics coincided with changes in occurrence of other respiratory virus infections. Influenza and other respiratory viruses. 2016;10(1):14-26.
[55] Lisewski AM. Association between Influenza Vaccination Rates and SARS-CoV-2 Outbreak Infection Rates in OECD Countries. 2020. (papers.ssrn.com/sol3/papers.cfm?abstract_id=3558270)
[56] Skowronski DM, Sabaiduc S, Leir S, Rose C, Zou M, Murti M, et al. Paradoxical clade- and age-specific vaccine effectiveness during the 2018/19 influenza A(H3N2) epidemic in Canada: potential imprint-regulated effect of vaccine (I-REV). Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin. 2019;24(46).
[57] Kelvin AA, Zambon M. Influenza imprinting in childhood and the influence on vaccine response later in life. Euro surveillance: bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin. 2019;24(48).
[58] Benn CS, Netea MG, Selin LK, Aaby P. A small jab – a big effect: nonspecific immunomodulation by vaccines. Trends in immunology. 2013;34(9):431-9.
[59] Rakebrandt N, Joller N. Infection History Determines Susceptibility to Unrelated Diseases. BioEssays
: news and reviews in molecular, cellular and developmental biology. 2019;41(6):e1800191.
[60] Demars A, Lison A, Machelart A, Van Vyve M, Potemberg G, Vanderwinden J-M, et al. Route of Infection Strongly Impacts the Host-Pathogen Relationship. Frontiers in immunology. 2019;10:1589.
[61] Pascual DW, Yang X, Wang H, Goodwin Z, Hoffman C, Clapp B. Alternative strategies for vaccination to brucellosis. Microbes and infection. 2018;20(9-10):599-605.
[62] Aguilo N, Alvarez-Arguedas S, Uranga S, Marinova D, Monzon M, Badiola J, et al. Pulmonary but Not Subcutaneous Delivery of BCG Vaccine Confers Protection to Tuberculosis-Susceptible Mice by an Interleukin 17-Dependent Mechanism. The Journal of infectious diseases. 2016;213(5):831-9.
[63] Kostoff RN, Aschner M, Goumenou M, Tsatsakis A. Setting safer exposure limits for toxic substance combinations. Food and chemical toxicology: an international journal published for the British Industrial Biological Research Association. 2020;140:111346.
[64] Kostoff RN, Goumenou M, Tsatsakis A. The role of toxic stimuli combinations in determining safe exposure limits. Toxicology reports. 2018;5:1169-72.
[65] Smith DJ, Forrest S, Ackley DH, Perelson AS. Variable efficacy of repeated annual influenza vaccination. Proceedings of the National Academy of Sciences of the United States of America. 1999;96(24):14001-6.
[66] Skowronski DM, Chambers C, De Serres G, Sabaiduc S, Winter A-L, Dickinson JA, et al. Serial Vaccination and the Antigenic Distance Hypothesis: Effects on Influenza Vaccine Effectiveness During A(H3N2) Epidemics in Canada, 2010-2011 to 2014-2015. The Journal of infectious diseases. 2017;215(7):1059-99.
[67] Belongia EA, Skowronski DM, McLean HQ, Chambers C, Sundaram ME, De Serres G. Repeated annual influenza vaccination and vaccine effectiveness: review of evidence. Expert review of vaccines. 2017;16(7):1-14.
[68] Vadala M, Poddighe D, Laurino C, Palmieri B. Vaccination and autoimmune diseases: is prevention of adverse health effects on the horizon? The EPMA journal. 2017;8(3):295-311.
[69] Salemi S, D’Amelio R. Could autoimmunity be induced by vaccination? International reviews of immunology. 2010;29(3):247-69.
[70] Pacheco Y, Acosta-Ampudia Y, Monsalve DM, Chang C, Gershwin ME, Anaya J-M. Bystander activation and autoimmunity. Journal of autoimmunity. 2019;103:102301.
[71] Yang Y-N, Yang Y-CSH, Lin IH, Chen Y-Y, Lin H-Y, Wu C-Y, et al. Phthalate exposure alters gut microbiota composition and IgM vaccine response in human newborns. Food and chemical toxicology:an international journal published for the British Industrial Biological Research Association.
[72] Hagan T, Cortese M, Rouphael N, Boudreau C, Linde C, Maddur MS, et al. Antibiotics-Driven Gut Microbiome Perturbation Alters Immunity to Vaccines in Humans. Cell. 2019;178(6):1313-28.e13.
[73] Vlasova AN, Takanashi S, Miyazaki A, Rajashekara G, Saif LJ. How the gut microbiome regulates host immune responses to viral vaccines. Current opinion in virology. 2019;37:16-25.
[74] Miyazaki A, Kandasamy S, Michael H, Langel SN, Paim FC, Chepngeno J, et al. Protein deficiency reduces efficacy of oral attenuated human rotavirus vaccine in a human infant fecal microbiota transplanted gnotobiotic pig model. Vaccine. 2018;36(42):6270-81.
[75] Bhattacharjee A, Hand TW. Role of nutrition, infection, and the microbiota in the efficacy of oral vaccines. Clinical science (London, England: 1979). 2018;132(11):1169-77.
[76] Karlas JA, Siebelink KH, Peer MA, Huisman W, Cuisinier AM, Rimmelzwaan GF, et al. Vaccination with experimental feline immunodeficiency virus vaccines, based on autologous infected cells, elicits enhancement of homologous challenge infection. The Journal of general virology. 1999;80 ( Pt 3):761-5.
[77] Giannecchini S, Isola P, Sichi O, Matteucci D, Pistello M, Zaccaro L, et al. AIDS vaccination studies using an ex vivo feline immunodeficiency virus model: failure to protect and possible enhancement of challenge infection by four cell-based vaccines prepared with autologous lymphoblasts. Journal of virology. 2002;76(14):6882-92.
[78] Miller C, Emanuelli M, Fink E, Musselman E, Mackie R, Troyer R, et al. FIV vaccine with receptor epitopes results in neutralizing antibodies but does not confer resistance to challenge. NPJ vaccines. 2018;3:16.
[79] Hale BG, Albrecht RA, Garcia-Sastre A. Innate immune evasion strategies of influenza viruses. Future microbiology. 2010;5(1):23-41.
[80] Huang C, Zhang Q, Feng W-h. Regulation and evasion of antiviral immune responses by porcine reproductive and respiratory syndrome virus. Virus research. 2015;202:101-11.
[81] Agrawal P, Nawadkar R, Ojha H, Kumar J, Sahu A. Complement Evasion Strategies of Viruses: An Overview. Frontiers in microbiology. 2017;8:1117.
[82] Shokri S, Mahmoudvand S, Taherkhani R, Farshadpour F. Modulation of the immune response by Middle East respiratory syndrome coronavirus. Journal of cellular physiology. 2019;234(3):2143-51.
[83] Toapanta FR, Craigo JK, Montelaro RC, Ross TM. Reduction of anti-HIV-1 Gag immune responses during co-immunization: immune interference by the HIV-1 envelope. Current HIV research. 2007;5(2):199-209.
[84] Pittman PR, Liu C-T, Cannon TL, Mangiafico JA, Gibbs PH. Immune interference after sequential alphavirus vaccine vaccinations. Vaccine. 2009;27(36):4879-82.
[85] Bradt V, Malafa S, von Braun A, Jarmer J, Tsouchnikas G, Medits I, et al. Pre-existing yellow fever immunity impairs and modulates the antibody response to tick-borne encephalitis vaccination. NPJ vaccines. 2019;4:38.
[86] Larke N, Im E-J, Wagner R, Williamson C, Williamson A-L, McMichael AJ, et al. Combined single-clade candidate HIV-1 vaccines induce T cell responses limited by multiple forms of in vivo immune interference. European journal of immunology. 2007;37(2):566-77.
[87] Zhang A, Stacey HD, Mullarkey CE, Miller MS. Original Antigenic Sin: How First Exposure Shapes Lifelong Anti-Influenza Virus Immune Responses. Journal of immunology (Baltimore, Md : 1950). 2019;202(2):335-40.
[88] Vatti A, Monsalve DM, Pacheco Y, Chang C, Anaya J-M, Gershwin ME. Original antigenic sin: A comprehensive review. Journal of autoimmunity. 2017;83:12-21.
[89] Joshi M, Chandra D, Mittadodla P, Bartter T. The impact of vaccination on influenza-related respiratory failure and mortality in hospitalized elderly patients over the 2013-2014 season. The open respiratory medicine journal. 2015;9:9-14.
[90] Kim JH, Liepkalns J, Reber AJ, Lu X, Music N, Jacob J, et al. Prior infection with influenza virus but not vaccination leaves a long-term immunological imprint that intensifies the protective efficacy of antigenically drifted vaccine strains. Vaccine. 2016;34(4):495-502.
[91] Saito N, Komori K, Suzuki M, Morimoto K, Kishikawa T, Yasaka T, et al. Negative impact of prior influenza vaccination on current influenza vaccination among people infected and not infected in prior season: A test-negative case-control study in Japan. Vaccine. 2017;35(4):687-93.
[92] Kosikova M, Li L, Radvak P, Ye Z, Wan X-F, Xie H. Imprinting of Repeated Influenza A/H3 Exposures on Antibody Quantity and Antibody Quality: Implications for Seasonal Vaccine Strain Selection and Vaccine Performance. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2018;67(10):1523-32.
[93] McLean HQ, Thompson MG, Sundaram ME, Meece JK, McClure DL, Friedrich TC, et al. Impact of repeated vaccination on vaccine effectiveness against influenza A(H3N2) and B during 8 seasons. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2014;59(10):1375-85.
[94] Ng TWY, Perera RAPM, Fang VJ, Yau EM, Peiris JSM, Tam YH, et al. The Effect of Influenza Vaccination History on Changes in Hemagglutination Inhibition Titers After Receipt of the 2015-2016 Influenza Vaccine in Older Adults in Hong Kong. The Journal of infectious diseases. 2020;221(1):33-41.
[95] Verhees RAF, Thijs C, Ambergen T, Dinant GJ, Knottnerus JA. Influenza vaccination in the elderly: 25 years follow-up of a randomized controlled trial. No impact on long-term mortality. PloS one. 2019;14(5):e0216983.
[96] Ohmit SE, Petrie JG, Malosh RE, Cowling BJ, Thompson MG, Shay DK, et al. Influenza vaccine effectiveness in the community and the household. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2013;56(10):1363-9.
[97] Palgen J-L, Tchitchek N, Rodriguez-Pozo A, Jouhault Q, Abdelhouahab H, Dereuddre-Bosquet N, et al. Innate and secondary humoral responses are improved by increasing the time between MVA vaccine immunizations. NPJ vaccines. 2020;5:24.
[98] Castilla J, Martinez-Baz I, Martinez-Artola V, Reina G, Pozo F, Garcia Cenoz M, et al. Decline in influenza vaccine effectiveness with time after vaccination, Navarre, Spain, season 2011/12. Euro surveillance: bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin. 2013;18(5).
[99] Saito N, Komori K, Suzuki M, Kishikawa T, Yasaka T, Ariyoshi K. Dose-Dependent Negative Effects of Prior Multiple Vaccinations Against Influenza A and Influenza B Among Schoolchildren: A Study of Kamigoto Island in Japan During the 2011-2012, 2012-2013, and 2013-2014 Influenza Seasons. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2018;67(6):897-904.
[100] Morimoto N, Takeishi K. Change in the efficacy of influenza vaccination after repeated inoculation under antigenic mismatch: A systematic review and meta-analysis. Vaccine. 2018;36(7):949-57.
[101] Khurana S, Loving CL, Manischewitz J, King LR, Gauger PC, Henningson J, et al. Vaccine-induced anti-HA2 antibodies promote virus fusion and enhance influenza virus respiratory disease. Science translational medicine. 2013;5(200):200ra114.
[102] Rajao DS, Loving CL, Gauger PC, Kitikoon P, Vincent AL. Influenza A virus hemagglutinin protein subunit vaccine elicits vaccine-associated enhanced respiratory disease in pigs. Vaccine. 2014;32(40):5170-6.
[103] Rajao DS, Sandbulte MR, Gauger PC, Kitikoon P, Platt R, Roth JA, et al. Heterologous challenge in the presence of maternally-derived antibodies results in vaccine-associated enhanced respiratory disease in weaned piglets. Virology. 2016;491:79-88.
[104] United States. National Institutes of Health NIHNIoAaID. Immune system activation boosts HIV replication in HIV-infected people. Tb & Hiv. 1996(11):14.
[105] Sharan R, Bucsan AN, Ganatra S, Paiardini M, Mohan M, Mehra S, et al. Chronic Immune Activation in TB/HIV Co-infection. Trends in microbiology. 2020;28(8):619-32.
[106] Paiardini M, Muller-Trutwin M. HIV-associated chronic immune activation. Immunological reviews. 2013;254(1):78-101.
[107] Package Inserts and Manufacturers for some US Licensed Vaccines and Immunoglobulins. Institute for . Johns Hopkins University. www.vaccinesafety.edu/package_inserts.htm.
[108] Goldman GS, Miller NZ. Relative trends in hospitalizations and mortality among infants by the number of vaccine doses and age, based on the Vaccine Adverse Event Reporting System (VAERS), 1990-2010. Human & experimental toxicology. 2012;31(10):1012-21.
[109] Electronic Support for Public Health–Vaccine Adverse Event Reporting System (ESP:VAERS). digital.ahrq.gov/ahrq-funded-projects/electronic-support-public-health-vaccine-adverse-event-reporting-system.
[110] Batista-Duharte A, Portuondo D, Perez O, Carlos IZ. Systemic immunotoxicity reactions induced by adjuvanted vaccines. International immunopharmacology. 2014;20(1):170-80.
[111] Orbach H, Agmon-Levin N, Zandman-Goddard G. Vaccines and autoimmune diseases of the adult. Discovery medicine. 2010;9(45):90-7.
[112] Agmon-Levin N, Paz Z, Israeli E, Shoenfeld Y. Vaccines and autoimmunity. Nature reviews Rheumatology. 2009;5(11):648-52.
[113] Geier DA, Geier MR. A case-control study of serious autoimmune adverse events following hepatitis B immunization. Autoimmunity. 2005;38(4):295-301.
[114] Classen JB, Classen DC. Clustering of cases of insulin dependent diabetes (IDDM) occurring three years after hemophilus influenza B (HiB) immunization support causal relationship between immunization and IDDM. Autoimmunity. 2002;35(4):247-53.
[115] Kanduc D. From Anti-SARS-CoV-2 Immune Responses to COVID-19 via Molecular Mimicry. Antibodies (Basel, Switzerland). 2020;9(3).
[116] Kanduc D. Peptide cross-reactivity: the original sin of vaccines. Frontiers in bioscience (Scholar edition). 2012;4:1393-401.
[117] Natale C, Giannini T, Lucchese A, Kanduc D. Computer assisted analysis of molecular mimicry between human papillomavirus 16 E7 oncoprotein and human protein sequences. Immunol Cell Biol 2000;78:580-585.
[118] Kanduc D, Stufano A, Lucchese G, Kusalik A. Massive peptide sharing between viral and human proteomes. Peptides. 2008;29(10):1755-66.
[119] Kanduc D, Shoenfeld Y. On the molecular determinants of the SARS-CoV-2 attack. Clinical immunology (Orlando, Fla). 2020;215:108426.
[120] Agrawal AS, Tao X, Algaissi A, Garron T, Narayanan K, Peng B-H, et al. Immunization with inactivated Middle East Respiratory Syndrome coronavirus vaccine leads to lung immunopathology on challenge with live virus. Human vaccines & immunotherapeutics. 2016;12(9):2351-6.
[121] Galeotti C, Bayry J. Autoimmune and inflammatory diseases following COVID-19. Nature reviews Rheumatology. 2020;16(8):413-4.
[122] Ehrenfeld M, Tincani A, Andreoli L, Cattalini M, Greenbaum A, Kanduc D, et al. Covid-19 and autoimmunity. Autoimmunity reviews. 2020;19(8):102597.
[123] Kanduc D, Shoenfeld Y. Molecular mimicry between SARS-CoV-2 spike glycoprotein and mammalian proteomes. Implications for the vaccine. Immunol Res. 2020. DOI: 10.1007/s12026-020-09152-6
[124] Kanduc D, Shoenfeld Y. Medical, genomic, and evolutionary aspects of the peptide sharing between pathogens, primates, and humans. Global Med Genet 2020; 07(02): 064-067.
[125] Kanduc D. “Self-nonself” peptides in the design of vaccines. Current pharmaceutical design. 2009;15(28):3283-9.
[126] Kanduc D. The self/nonself issue: A confrontation between proteomes. Self Nonself 2010;1(3):255-8. doi.org/10.4161/self.1.3.11897
[127] Kanduc D. Immunogenicity, Immunopathogenicity, and Immunotolerance in One Graph. Anti-cancer agents in medicinal chemistry. 2015;15(10):1264-8.
[128] Kanduc D, Shoenfeld Y. From HBV to HPV: Designing vaccines for extensive and intensive vaccination campaigns worldwide. Autoimmunity reviews. 2016;15(11):1054-61.
Appendix 1 – Vaccine Bibliography – Short and Long-Term Vaccine Impacts
The following is a short sampling of records showing potential adverse short and long-term vaccine effects.
Agmon-Levin N, Arango M-T, Kivity S, Katzav A, Gilburd B, Blank M, et al. Immunization with hepatitis B vaccine accelerates SLE-like disease in a murine model. Journal of Autoimmunity. 2014;54:21-32.
Agmon-Levin N, Paz Z, Israeli E, Shoenfeld Y. Vaccines and autoimmunity. Nature Reviews Rheumatology. 2009;5(11):648-52.
Agmon-Levin N, Zafrir Y, Paz Z, Shilton T, Zandman-Goddard G, Shoenfeld Y. Ten cases of systemic lupus erythematosus related to hepatitis B vaccine. Lupus. 2009;18(13):1192-7.
Ajithkumar K, Anand U, Pulimood S, Chandi SM, George S, Jacob CK, et al. Vaccine-induced necrobiotic granuloma. Clinical and Experimental Dermatology. 1998;23(5):222-4.
Bassi N, Luisetto R, Del Prete D, Ghirardello A, Ceol M, Rizzo S, et al. Induction of the ‘ASIA’ syndrome in NZB/NZWF1 mice after injection of complete Freund’s adjuvant (CFA). Lupus. 2012;21(2):203-9.
Batista-Duharte A, Portuondo D, Perez O, Carlos IZ. Systemic immunotoxicity reactions induced by adjuvanted vaccines. International Immunopharmacology. 2014;20(1):170-80.
Batista-Duharte A. Vaccines and autoimmunity: a strange association under debate. Revista peruana de medicina experimental y salud publica. 2012;29(2):265-71.
Blitshteyn S, Brinth L, Hendrickson JE, Martinez-Lavin M. Autonomic dysfunction and HPV immunization:
an overview. Immunologic Research. 2018;66(6):744-54.
Bot A. The Landmark Approval of Provenge (R), What It Means to Immunology and “In This Issue”: The Complex Relation Between Vaccines and Autoimmunity. International Reviews of Immunology. 2010;29(3):235-8.
Bragazzi NL, Watad A, Amital H, Shoenfeld Y. Debate on vaccines and autoimmunity: Do not attack the author, yet discuss it methodologically. Vaccine. 2017;35(42):5522-6.
Classen JB, Classen DC. Public should be told that vaccines may have long term adverse effects. British Medical Journal. 1999;318(7177):193-.
Classen JB, Classen DC. Vaccines and the risk of insulin-dependent diabetes (IDDM): potential mechanism of action. Medical Hypotheses. 2001;57(5):532-8.
Classen JB. The timing of immunization affects the development of diabetes in rodents. Autoimmunity.
1996;24(3):137-45.
Cohen AD, Shoenfeld Y. Vaccine-induced autoimmunity. Journal of Autoimmunity. 1996;9(6):699-703.
Cohen C, Houdeau A, Khromava A. Comment on “Central Demyelinating Diseases After Vaccination Against Hepatitis B Virus: A Disproportionality Analysis Within the VAERS Database”. Drug Safety. 2018;41(12):1425-7.
de Martino M, Chiappini E, Galli L. VACCINES AND AUTOIMMUNITY. International Journal of Immunopathology and Pharmacology. 2013;26(2):283-90.
DeLong G. A Positive Association found between Autism Prevalence and Childhood Vaccination uptake across the US Population. Journal of Toxicology and Environmental Health-Part a-Current Issues. 2011;74(14):903-16.
Dorea JG. Low-dose Thimerosal (ethyl-mercury) is still used in infants’ vaccines: Should we be concerned with this form of exposure? Journal of Trace Elements in Medicine and Biology. 2018;49:134-9.
Esteghamati A, Keshtkar A, Heshmat R, Gouya MM, Amoli MS, Armin S, et al. Adverse Reactions Following Immunization with MMR Vaccine in Children at Selected Provinces of Iran. Archives of Iranian Medicine. 2011;14(2):91-5.
Fernandez-Canga P, Lamoca-Martin M, Prada-Garcia C. ASIA (Autoimmune/Inflammatory Syndrome Induced by Adjuvants): A new case? Revista Clinica Espanola. 2020;220(1):73-4.
Fraunfelder FW, Suhler EB, Fraunfelder FT. Hepatitis B vaccine and uveitis: an emerging hypothesis suggested by review of 32 case reports. Cutaneous and Ocular Toxicology. 2010;29(1):26-9.
Gallagher C, Goodman M. Hepatitis B triple series vaccine and developmental disability in US children aged 1-9 years. Toxicological and Environmental Chemistry. 2008;90(5):997-1008.
Geier DA, Geier MR. A case-control study of serious autoimmune adverse events following hepatitis B immunization. Autoimmunity. 2005;38(4):295-301.
Geier DA, Geier MR. An analysis of the reactivity of vaccines administered in Texas from 1991 through 1999. Texas medicine. 2002;98(7):50-4.
Geier DA, Geier MR. Anthrax vaccination and joint related adverse reactions in light of biological warfare scenarios. Clinical and Experimental Rheumatology. 2002;20(2):217-20.
Geier DA, Geier MR. Chronic adverse reactions associated with hepatitis B vaccination. Annals of Pharmacotherapy. 2002;36(12):1970-1.
Geier DA, Geier MR. Hepatitis B vaccination and adult associated gastrointestinal reactions: A follow-up analysis. Hepato-Gastroenterology. 2002;49(48):1571-5.
Geier DA, Geier MR. Hepatitis B vaccination and arthritic adverse reactions: A followup analysis of the vaccine adverse events reporting system (VAERS) database. Clinical and Experimental Rheumatology. 2002;20(1):119-.
Geier DA, Geier MR. Rubella vaccine and arthritic adverse reactions: An analysis of the Vaccine Adverse Events Reporting System (VAERS) database from 1991 through 1998. Clinical and Experimental Rheumatology. 2001;19(6):724-6.
Geier DA, Hooker BS, Kern JK, King PG, Sykes LK, Geier MR. A Dose-Response Relationship between Organic Mercury Exposure from Thimerosal-Containing Vaccines and Neurodevelopmental Disorders. International Journal of Environmental Research and Public Health. 2014;11(9):9156-70.
Geier DA, Kern JK, Geier MR. Increased risk for an atypical autism diagnosis following Thimerosal-containing vaccine exposure in the United States: A prospective longitudinal case-control study in the Datalink. Journal of Trace Elements in Medicine and Biology. 2017;42:18-24.
Girard M. Autoimmune hazards of hepatitis B vaccine. Autoimmunity Reviews. 2005;4(2):96-100.
Griffin M, Makris M. Vaccination induced neutropenia. International Journal of Laboratory Hematology.
2013;35(5):E33-E.
Gunes AT, Fetil E, Akarsu S, Ozbagcivan O, Babayeva L. Possible Triggering Effect of Influenza Vaccination on Psoriasis. Journal of Immunology Research. 2015.
Hallbook T, Azakacs A, Bialek F, Feltelius N, Landtblom A-M, Malmgren K. Narcolepsy–rare disease that has received increased attention. Pandemrix vaccination caused a higher incidence among children and adolescents. Lakartidningen. 2014;111(41):1770-3.
Hernan MA, Jick SS, Olek MJ, Jick H. Recombinant hepatitis B vaccine and the risk of multiple sclerosis – A prospective study. Neurology. 2004;63(5):838-42.
Hogenesch H, Azcona-Olivera J, Scott-Moncrieff C, Snyder PW, Glickman LT. Vaccine-induced autoimmunity in the dog. Schultz RD, editor1999. 733-47 p.
Hooker B, Kern J, Geier D, Haley B, Sykes L, King P, et al. Methodological Issues and Evidence of Malfeasance in Research Purporting to Show Thimerosal in Vaccines Is Safe. Biomed Research International. 2014.
Hornos Carneiro MF, Morais C, Barbosa F, Jr., Gobe GC. Thimerosal in childhood vaccines contributes to accumulating mercury toxicity in the kidney. Toxicological and Environmental Chemistry. 2013;95(8):1424-47.
Huisman W, Martina BEE, Rimmelzwaan GF, Gruters RA, Osterhaus ADME. Vaccine-induced enhancement of viral infections. Vaccine. 2009;27(4):505-12.
Jakimovski D, Weinstock-Guttman B, Ramanathan M, Dwyer MG, Zivadinov R. Infections, Vaccines and Autoimmunity: A Multiple Sclerosis Perspective. Vaccines. 2020;8(1).
Lane C, Leitch J, Tan XH, Hadjati J, Bramson JL, Wan YH. Vaccination-induced autoimmune vitiligo is a consequence of secondary trauma to the skin. Cancer Research. 2004;64(4):1509-14.
Leroy Z, Broder K, Menschik D, Shimabukuro T, Martin D. Febrile seizures after 2010-2011 influenza vaccine in young children, United States: A vaccine safety signal from the vaccine adverse event reporting system. Vaccine. 2012;30(11):2020-3.
Lopalco PL. Vaccines and autoimmunity: real association or false myth? European Journal of Clinical Investigation. 2017;47:71-.
Lyons-Weiler J, Ricketson R. Reconsideration of the immunotherapeutic pediatric safe dose levels of aluminum. Journal of Trace Elements in Medicine and Biology. 2018;48:67-73.
MacIntyre CR, Kelly H, Jolley D, Butzkueven H, Salmon D, Halsey N, et al. Recombinant hepatitis B vaccine and the risk of multiple sclerosis: A prospective study. Neurology. 2005;64(7):1317-.
Maeda K, Idehara R. Acute Disseminated Encephalomyelitis Following 2009 H1N1 Influenza Vaccination.
Internal Medicine. 2012;51(14):1931-3.
Maubec E, Pinquier L, Viguier M, Caux F, Amsler E, Aractingi S, et al. Vaccination-induced cutaneous pseudolymphoma. Journal of the American Academy of Dermatology. 2005;52(4):623-9.
Moise L, Beseme S, Tassone R, Liu R, Kibria F, Terry F, et al. T cell epitope redundancy: cross-conservation of the TCR face between pathogens and self and its implications for vaccines and autoimmunity. Expert Review of Vaccines. 2016;15(5):607-17.
Mouchet J, Begaud B. Central Demyelinating Diseases after Vaccination Against Hepatitis B Virus: A Disproportionality Analysis within the VAERS Database. Drug Safety. 2018;41(8):767-74.
Olczak M, Duszczyk M, Mierzejewski P, Meyza K, Majewska MD. Persistent behavioral impairments and alterations of brain dopamine system after early postnatal administration of thimerosal in rats. Behavioural Brain Research. 2011;223(1):107-18.
Orbach H, Agmon-Levin N, Zandman-Goddard G. Vaccines and Autoimmune Diseases of the Adult.
Discovery Medicine. 2010;9(45):90-7.
Payne DC, Rose CE, Jr., Kerrison J, Aranas A, Duderstadt S, McNeil MM. Adverse reactions to anthrax vaccine (eg, optic neuritis) may be more complex or delayed than reported initially by Payne et al (2006) – In reply. Archives of Neurology. 2007;64(3):458-.
Perricone C, Alessandri C, Valesini G. ‘ASIA’ – Autoimmune/inflammatory syndrome induced by adjuvants: even and odd. Reumatismo. 2011;63(2):63-6.
Perricone C, Ceccarelli F, Nesher G, Borella E, Odeh Q, Conti F, et al. Immune thrombocytopenic purpura (ITP) associated with vaccinations: a review of reported cases. Immunologic Research. 2014;60(2-3):226-35.
Prestel J, Volkers P, Mentzer D, Lehmann HC, Hartung H-P, Keller-Stanislawski B, et al. Risk of Guillain-Barre syndrome following pandemic influenza A (H1N1) 2009 vaccination in Germany. Pharmacoepidemiology and Drug Safety. 2014;23(11):1192-204.
Ravel G, Christ M, Horand F, Descotes J. Autoimmunity, environmental exposure and vaccination: is there a link? Toxicology. 2004;196(3):211-6.
Ruiz JT, Lujan L, Blank M, Shoenfeld Y. Adjuvants- and vaccines-induced autoimmunity: animal models.
Immunologic Research. 2017;65(1):55-65.
Sarkanen T, Alakuijala A, Julkunen I, Partinen M. Narcolepsy Associated with Pandemrix Vaccine. Current Neurology and Neuroscience Reports. 2018;18(7).
Sato N, Watanabe K, Ohta K, Tanaka H. Acute Transverse Myelitis and Acute Motor Axonal Neuropathy Developed after Vaccinations against Seasonal and 2009 A/H1N1 Influenza. Internal Medicine. 2011;50(5):503-7.
Schumm WR. Adverse reactions to anthrax vaccine (eg, optic neuritis) may be more complex or delayed than reported initially by Payne et al (2006). Archives of Neurology. 2007;64(3):457-8.
Segal Y, Shoenfeld Y. Vaccine-induced autoimmunity: the role of molecular mimicry and immune crossreaction. Cellular & Molecular Immunology. 2018;15(6):586-94.
Shaw CA, Li Y, Tomljenovic L. Administration of aluminium to neonatal mice in vaccine-relevant amounts is associated with adverse long term neurological outcomes. Journal of Inorganic Biochemistry. 2013;128:237-44.
Shoenfeld Y, Agmon-Levin N. ‘ASIA’ – Autoimmune/inflammatory syndrome induced by adjuvants.
Journal of Autoimmunity. 2011;36(1):4-8.
Shoenfeld Y, Aron-Maor A. Vaccination and autoimmunity – ‘Vaccinosis’: A dangerous liasion? Journal of Autoimmunity. 2000;14(1):1-10.
Shoenfeld Y. Infections, vaccines and autoimmunity. Lupus. 2009;18(13):1127-8.
Singh VK, Lin SX, Newell E, Nelson C. Abnormal measles-mumps-rubella antibodies and CNS autoimmunity in children with autism. Journal of Biomedical Science. 2002;9(4):359-64.
Singh VK, Lin SX, Yang VC. Serological association of measles virus and human herpesvirus-6 with brain autoantibodies in autism. Clinical Immunology and Immunopathology. 1998;89(1):105-8.
Soriano A. The Paradigm of ASIA (Autoimmune/Inflammatory Syndrome Induced by Adjuvants): A Concept in Evolution. Israel Medical Association Journal. 2014;16(2):113-4.
Tishler M, Shoenfeld Y. Vaccines and Autoimmunity. Rose NR, Mackay IR, editors2006. 309-16 p.
Tomljenovic L, Shaw CA. Mechanisms of aluminum adjuvant toxicity and autoimmunity in pediatric populations. Lupus. 2012;21(2):223-30.
Umeda Y, Morikawa M, Anzai M, Sumida Y, Kadowaki M, Ameshima S, et al. Acute Exacerbation of Idiopathic Pulmonary Fibrosis after Pandemic Influenza A (H1N1) Vaccination. Internal Medicine. 2010;49(21):2333-6.
Vadala M, Poddighe D, Laurino C, Palmieri B. Vaccination and autoimmune diseases: is prevention of adverse health effects on the horizon? Epma Journal. 2017;8(3):295-311.
Veerappan GR, Mulhall BP, Holtzmuller KC. Vaccination-induced autoimmune hepatitis. Digestive Diseases and Sciences. 2005;50(1):212-3.
Vera-Lastra O, Medina G, Del Pilar Cruz-Dominguez M, Jara LJ, Shoenfeld Y. Autoimmune/inflammatory syndrome induced by adjuvants (Shoenfeld’s syndrome): clinical and immunological spectrum. Expert Review of Clinical Immunology. 2013;9(4):361-73.
Vial T, Descotes J. Autoimmune diseases and vaccinations. European Journal of Dermatology.
2004;14(2):86-90.
Vlachopoulos C, Xaplanteris P, Sambatakou H, Mariolis E, Bratsas A, Christoforatou E, et al. Acute systemic inflammation induced by influenza A (H1N1) vaccination causes a deterioration in endothelial function in HIV-infected patients. Hiv Medicine. 2011;12(10):594-601.
Wahlberg J, Fredriksson J, Vaarala O, Ludvigsson J, Grp AS. Vaccinations may induce diabetes-related autoantibodies in one-year-old children. In: Sanjeevi CB, Eisenbarth GS, editors. Immunology of Diabetes Ii: Pathogenesis from Mouse to Man. Annals of the New York Academy of Sciences. 10052003. p. 404-8.
Wang B, Shao X, Wang D, Xu D, Zhang J-a. Vaccinations and risk of systemic lupus erythematosus and rheumatoid arthritis: A systematic review and meta-analysis. Autoimmunity Reviews. 2017;16(7):756-65.
Young HA, Geier DA, Geier MR. Thimerosal exposure in infants and neurodevelopmental disorders: An assessment of computerized medical records in the Datalink. Journal of the Neurological Sciences. 2008;271(1-2):110-8.
