Contents
COVID-19 SARS-CoV-2感染に伴う肺線維症の治療法の可能性
pubmed.ncbi.nlm.nih.gov/32575380/
要旨
2019年12月には、新型コロナウイルス「SARS-CoV-2」が登場し、呼吸器感染を中心とした幅広い症状を引き起こした。2020年3月、世界保健機関(WHO)は、コロナウイルス病2019(COVID-19)をパンデミックと宣言したため、世界中の科学者の努力は、この新型コロナウイルス病のための適切な治療法とワクチンを見つけることに集中している。
COVID-19は、すべての年齢層および地理的な領域にわたって患者に影響を与え、数ヶ月間に急速に広がっている。COVID-19は多様な経過をたどっており、無症状のものから急性呼吸窮迫症候群(ARDS)を合併した呼吸不全を伴うものまで、患者は多岐にわたる。
COVID-19における肺病変の合併症として考えられるのは肺線維症であり、これは慢性的な呼吸困難、長期的な障害をもたらし、患者のQOLに影響を与える。COVID-19のこの現象につながる特定のメカニズムはないが、以前の重症急性呼吸器症候群(SARS)または中東呼吸器症候群(MERS)のパンデミックからいくつかの情報が浮かび上がる。
このナラティブレビューの目的は、免疫応答のメカニズムからCOVID-19に関連した肺線維症の原因と病態生理を提示し、可能性のある予防と治療法を示唆することである。
2. COVID-19の臨床的特徴
SARS-CoV-2感染症の患者は、無症状キャリアから重症急性呼吸器感染症(SARI)[11]に罹患した患者まで幅広く、急性呼吸窮迫症候群(ARDS)を引き起こし、敗血症を合併して死亡することもある[5,9,10,12,13,14]。
症状の範囲には、発熱、乾いた咳、筋肉痛、脱力感、息切れなどがあるが、その他の初期症状として、消化器症状(水様便、食欲不振、上腹部不快感など)または神経症状(せん妄など)が時間の経過とともに確認されている[6,7,15,16]。症状の経過は通常、下気道の炎症を伴う [5,9,12,13,14]。
感染者に発生する肺症状は、軽症、中等症、重症に分けられる[12]。
SARIと呼ばれるCOVID-19の肺炎の重症経過は、息切れ、呼吸数>30/分、飽和度<93%、SpO2/FiO2<300を特徴とし、集中治療室(ICU)への入院を必要とする。通常、症状は感染後24~48時間以内に発症し、時間の経過とともに生命を脅かす状態になることもある[12]。
SARS-CoV-2感染症の診断では、白血球およびリンパ球減少症、血小板減少症、乳酸脱水素酵素、肝酵素およびd-ダイマーのレベルの上昇を示す臨床検査値の異常に注意を払う価値がある[17]。プロカルシトニンレベルは通常、正常範囲内である[9,10,18]。
放射線画像診断は、肺の損傷と肺実質の関与の程度を評価する上で非常に有用であり、時には診断における臨床検査に代わるものである。提示された画像は多様であり、その進行は速い [19,20,21,22]。
ある研究では、COVID-19患者63人のコンピュータ断層撮影(CT)画像を解析した[21]。罹患した肺葉の平均数は3.3±1.8で、最も一般的な変化はパッチ状の地被膜の不透明度で、17.5%の患者には線維状の縞模様、12.7%の患者には不規則な固形結節が認められた[23]。患者の大多数(85%)は進行したが、結節や筋は拡大した[19,21,22]。肺線維症はCOVID-19患者における主要な合併症の1つである可能性がある[19]。
CoV感染症患者で行われる臨床検査は、診断を助けるため、または研究目的のために疾患の進行を特定するために日常的に行われている。Huangらは、COVID-19患者のサイトカインのレベルを評価し、ICUの重症患者とICU以外の患者のレベルを比較した。
ICU患者は非ICU患者と比較して、IL-2、IL-7、IL-10、GSCF、IP-10、MCP1、MIP1A、およびTNF-αの血漿レベルが高かった[14]。SARS-CoV患者における炎症性サイトカイン(例えば、IL-1B、IL-6、IL-12、IFN-γ、IP-10およびMCP1)の増加は、肺炎および広範な肺損傷と関連していた[24]。
ある科学的研究では、Susannaらは、8つのサイトカイン遺伝子のmRNA発現レベルを測定することにより、SARS-CoV感染と比較してMERS-CoV感染に関連するサイトカイン応答を調査した。研究は、MERS-CoVおよびSARS-CoVに感染したCalu-3株(極性気道上皮Calu-3)の細胞を用いて、4、12、24、30時間で行われた。
これら6つのサイトカインのうち、MERS-CoVによって誘導された炎症性サイトカインであるIL-1b、IL-6およびIL-8は、30時間後にSARS-CoVによって誘導されたサイトカインよりも有意に高い発現を示した。
しかし、自然抗ウイルス免疫応答に重要なTNF-α、IFN-βおよびIP-10のレベルは、24時間および30時間後にSARS-CoVで誘導された細胞では、MERS-CoVで誘導された細胞よりも有意に高かった。
表2に示した要約は、COVID-19試験と重症急性呼吸器症候群(SARS)または中東呼吸器症候群(MERS)試験におけるサイトカインレベルを示している。この類似性は、COVID-19感染時のSARIの経過がSARSやMERSと類似していることを示唆しており、これまでの経験に基づいたプロトコールを提案することができる。
表2. COVID-19および重症急性呼吸器症候群(SARS)/中東呼吸器症候群(MERS)試験における線維化レベルでのサイトカインの過剰発現。
3. SARS/MERSの発生と肺線維症
重症コロナウイルス疾患のアウトブレイクの脅威を考えると、現在のCOVID-19に先行するSARSおよびMERSの以前のパンデミックに関連した肺合併症を分析することが重要である。前述のアウトブレイクは悲惨な結果をもたらした。
SARSは8098人の症例と774人の死亡 [26] 、MERSは2206人の症例と787人以上の死亡 [27] であった。SARSとMERSの治療では、効果的な特異的抗ウイルス治療やワクチンが不足していたため、支持療法のみが行われていた [26,27]。
現在、十分に理解されておらず、十分に治療されていないCOVID-19期の肺線維症の原因となるメカニズムを明らかにすることは、治療上の対策を改善する可能性がある[28]。研究目的のためには、再現性のある動物モデルを構築することが、新興のコロナウイルス疾患の影響を軽減する上で重要であるかもしれない[29]。
SARSの感染は主に呼吸器飛沫の吸入を介して広がり、まれに糞便から口腔内への感染を介して広がる[26]。大腿骨頭壊死とは別に、肺の治癒中に起こる肺線維症[28]は、SARSの最も重篤な遠因である[30]。
SARSの間、肺では様々な形態学的病変が観察された。これらの病変は3つの段階に分類される。
(1)急性滲出性炎症(局所的な線維形成と網状線維形成が既に存在する)
(2)線維性増殖(増殖性間質性肺炎に似ている;間葉系細胞は筋線維芽細胞と線維芽細胞に分化する)
(3)多数のI型およびIV型コラーゲン線維を有する最終線維化期である[31]。
原始間葉系細胞、過形成性肺胞上皮細胞、上皮成長因子受容体(EGFR)およびマクロファージは、SARS時の線維化の病態形成に重要である[28,31,32]。
患者は最初に非定型肺炎を発症し、次いで急性肺障害(ALI)および急性呼吸窮迫症候群(ARDS)を発症し、線維化へと進展する [33]。線維化は、高齢者 [28,32] や重度の経過をたどる患者でより頻繁に起こる [34]。
線維化は疾患期間と相関している [35];しかしながら、自然に消失することもある [36,37,38]。
80人のSARS患者の15年間の追跡調査を報告したZhangらによると、71人のうち71人が追跡調査を完了したが、肺病変は感染後1年目にのみ減少した(p < 0.001)。研究開始時には9.4%(1.57%~17.23%)、1年後には3.2%±4.78%、15年後には4.60%±6.37%の患者がCTスキャンで肺病変を認めた[30]。
Zhangらの報告によると、SARSによる肺間質損傷はほとんど回復している[30]。MERSについても同様の知見がDasらによって報告されている[39]。
SARSと診断された36人の患者のデータを解析したところ、32~230日(中央値43日)の追跡調査では、かなりの数の回復期患者で肺線維症が発症しており、ICUに入院している重篤な状態の高齢者ほどこの合併症と診断されるリスクが高いことが示された[39]。
それにもかかわらず、MERSとSARSの病変の間にはいくつかの違いが報告されている[25,40]。ある科学的研究では、Lauらは、8つのサイトカイン遺伝子のmRNA発現レベルを測定することにより、SARS-CoV感染と比較してMERS-CoV感染に関連したサイトカイン応答を調査した。
研究は、MERS-CoVおよびSARS-CoVに感染したCalu-3株(極性気道上皮Calu-3)の細胞を用いて4時間、12時間、24時間、30時間で行った。これら6つのサイトカインのうち、MERS-CoVによって誘導された炎症性サイトカインであるIL-1b、IL-6およびIL-8は、30時間後にSARS-CoVによって誘導されたサイトカインよりも有意に高い発現を示した。
しかし、自然抗ウイルス免疫応答に重要なTNF-α、IFN-βおよびIP-10のレベルは、24時間および30時間後にSARS-CoVで誘導された細胞ではMERS-CoVで誘導された細胞よりも有意に高かった。
他の2つのサイトカイン、MCP-1(ケモカイン)およびTGF-β(抗炎症性サイトカイン)は、MERS-CoVまたはSARS-CoV感染後に明らかな増加を示さなかった[25]。
肺線維化の程度は、SARS-CoV-1病の罹患期間と正の相関がある[35]。臨床データによると、線維組織は早期または中期の患者よりも後期の患者に多く見られることが示されている。
重要なことに、肺線維化は、回復して退院したSARS患者にさえ認められた。また、退院後9ヵ月後に回復したSARS患者では、肺線維症の発症率は約21.5%(67/311)であった[37,38]。
4. COVID-19と肺線維症
SARS-CoV-2は、ヒトではアンジオテンシン-2変換酵素(ACE2)を細胞受容体とし、最初は間質性肺障害を起こし、その後、実質性肺障害を起こすことが報告されている[41]。Vero-E6細胞株を用いた実験結果から、可溶性のACE2を供給することがウイルス感染の減少と関連しているのではないかという仮説がある[42,43]。
コロナウイルス感染症の肺合併症を早期に抑制できる可能性が示唆されている[21]。同様の効果は、TMPRSS2宿主タンパク質の薬理学的干渉によって達成されるかもしれない[44,45,46]。
一貫して、ACE2の組織分布の研究から、ウイルス受容体は消化管、腎臓、精巣、その他の臓器を含むヒト組織に広く発現していることが示唆されている[47]。
肺線維症は、急性および慢性の間質性肺疾患の病理学的帰結である。
損傷した肺胞上皮の再構築がうまくいかないこと、線維芽細胞の持続、およびコラーゲンおよび他の細胞外マトリックス(ECM)成分(例えば、ECM)の過剰沈着、ならびに正常な肺の建築物の破壊によって特徴づけられる[48]。
肺線維症の進行は、間質マトリックスの拡大、正常な肺実質の最終的な圧迫および破壊、したがって呼吸不全につながる毛細血管の損傷をもたらす[49]。
肺線維症の病因は多因子性であり、年齢、喫煙、ウイルス感染、薬物曝露および遺伝的素因を含む[35,50]。
さらなる機序として、過剰な活性酸素種(ROS)産生に関連した酸化ストレスが考えられる。これは、活性酸素の不適切な除去(老化)に起因するか、または高い割合の酸素の過剰供給、例えばCOVID-19感染による息切れに関連している可能性がある。
酸化ストレスに関連した毛包細胞のアポトーシスの増加が、特発性肺線維症(IPF)において観察されている。
TGF-β1は線維化の進展と活性酸素の産生に寄与している[51,52]。さらに、線維芽細胞増殖因子(FGF)や血小板由来増殖因子(PDGF)を介したチロシンキナーゼシグナル伝達も肺線維症の発症に重要である。肺線維芽細胞増殖因子(FGF)と血小板由来増殖因子(PDGF)の過剰発現は肺線維芽細胞の増殖を増加させることが報告されている。さらに、FGFはTGF-β1の線維芽細胞増殖作用を増強することが報告されている[53]。
慢性炎症は肺線維症の主な原因と考えられており、上皮の損傷や線維芽細胞の活性化につながる可能性がある。他の研究では、肺胞上皮の損傷および活性化した筋線維芽細胞病巣の形成が、ほとんどの肺線維化過程の主な原因であることが示唆されている[35]。
ウイルス感染は、特発性肺線維症(IPF)の開始の引き金として、または既存の線維化を悪化させる薬剤として作用することがある。特に高齢者では、免疫産生のために、またウイルス感染が補因子として作用するために、ウイルス誘発性線維化が起こりやすい[50]。
肺線維症は以下の症状を呈する
乾いた咳、疲労および呼吸困難。患者は体重が減少し、体調が悪化することがある。
そのため、この疾患に罹患した人は、収入源を失い、生活の質がシステミックに低下する可能性がある。
COVID-19および他のコロナウイルス疾患の治療は、十分な遠隔予後を提供するために、肺線維症の予防または治療を除外することはできない。
肺組織に損傷が生じると、単球-1化学吸引性タンパク質(MCP-1)、トランスフォーミング成長因子β1(TGF-β1)を含む一連の成長因子およびサイトカインが作用する。腫瘍壊死因子a(TNF-α)、線維芽細胞増殖因子(FGF)、血小板由来増殖因子(PDGF)、インターロイキン-1b(IL-1b)およびインターロイキン-6(IL-6)が過剰に発現し、細胞から放出されることが報告されている[49,53]。
最近の報告では、COVID-19患者においても前述のサイトカインおよび成長因子の血清レベルが高値であることが示されている[54,55,56]。
マトリックスメタロプロテアーゼの放出異常は、上皮および内皮の損傷を引き起こす[57]と制御されない線維増殖を引き起こすが、ARDSの炎症期の最も重要なメディエーターの一つである[58]。
TGF-βは線維化を調節し[59]、VEGF、IL-6、TNF-α、血管機能障害とともに線維化への進行に関与している[58,60,61]。この過程は、すべての患者の間で起こるわけではない[2]。
高齢者における炎症性サイトカインのレベルの上昇が、このグループの患者における疾患のより重篤な経過の原因となっている可能性がある。
特発性肺線維症(IPF)とCOVID-19のサイトカインプロファイルが類似していることから、これらの疾患における肺線維症の病態メカニズムが類似していることが示唆され、特発性肺線維症(IPF)の治療に有用な薬剤はCOVID-19患者にとっても有益であると考えられる。
II型小胞性内皮細胞は、これらの線維性因子の主な供給源の一つである。これらの因子は、II型濾胞細胞の過剰増殖を刺激し、線維芽細胞を線維化座にリクルートし、線維芽細胞の筋線維芽細胞への分化および活性化を誘導する。
筋線維芽細胞は、基底膜や間質組織におけるECMの過剰な蓄積を引き起こし、最終的には肺胞機能、特に肺胞と毛細血管の間のガス交換の喪失につながる[49]。
図1に線維化形成のメカニズムを示す。
肺線維症の発症機序。
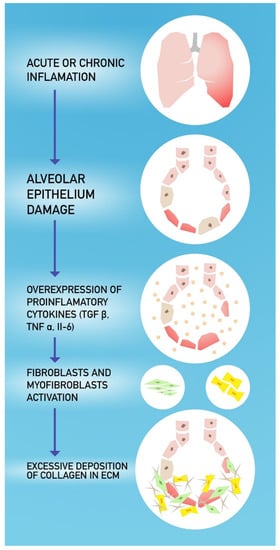
5. COVID-19患者における潜在的な治療選択肢
COVID-19ではARDSが肺線維症の主な原因であるように思われるが、SARS-CoV-2によるARDSは典型的なARDSとは異なることがいくつか報告されている[62]。COVID-19によるARDSは、低酸素の重症度と一致しない高いコンプライアンスが観察されることが多く、他の要因によるARDSとは大きく異なるようである。
いくつかの報告では、COVID-19 ARDSの発症は8日から12日の間であることが示唆されており、1週間の発症制限は不適切である[13,63]。さらに、多くの症例のCT所見は「典型的な」ARDSを示唆するものではない[64]。さらに、異常な凝固障害は明らかであり、多くの患者でプロコアグロパントパターンが認められる[65]。
したがって、COVID-19の肺線維化のメカニズムは特発性肺線維症(IPF)や他の線維性肺疾患とは異なると考えられ、特に病理学的所見では内皮細胞ではなく肺胞上皮細胞が傷害部位であることが指摘されている[63,66]。
これらの事実は、COVID-19では他の特異的な治療法の選択肢が考慮されるべきであることを示している。
現在、コロナウイルス感染後の炎症後肺線維症の治療において、完全に文書化された治療法は存在しない。しかしながら、いくつかの治療法が検討される可能性がある。
5.1. ステロイド
ウイルス性肺炎におけるコルチコステロイドの使用の理論的根拠は、肺における宿主の炎症反応を減少させることであり、これが急性肺障害やARDSの発症につながる可能性があるからである。COVID-19におけるコルチコステロイドの使用に関する直接的な証拠は非常に限られているが、他のウイルス性肺炎の転帰に関する以前のレビューは重要な臨床情報を提供している[67,68]。
SARSおよびMERSの発生に関する研究では、血液および呼吸器からのウイルスクリアランスの遅延が報告されている[67,69]。
著者らは、大腿骨頭壊死を引き起こす血管壊死、ステロイド治療中に典型的に起こる高血糖症、精神病などのステロイドに関連した有害事象を併発しながら、コルチコステロイドが生存期間の改善に影響を及ぼさないという2つの重要な臨床観察を報告している[67,69]。
インフルエンザ肺炎患者を含むメタアナリシスでは、コルチコステロイドの使用は死亡率および二次感染のリスクの増加と関連していることが報告されている[70]。
Wuらは、ARDSを発症したCOVID-19患者において、メチルプレドニゾロンによる治療は死亡リスクの低下と関連していると報告した[71]。
現在の研究では、難治性ショックや慢性閉塞性肺疾患などの他の理由がなければ、CoV感染中に全身性ステロイドを投与しないことが示唆されている[69,72]。このような特異的な治療は、感染が線維化の進展に決定的な役割を果たしている場合、この状態の経過を修正するであろう。
5.2. スピロノラクトン
スピロノラクトンの使用が線維化予防において重要であるとする報告がいくつかある[74,75,76]。ミネラルコルチコイド受容体(MR)の活性化は、多くの疾患の病態生理に寄与する因子である。
副腎皮質ホルモンであり、生理学的なMR活性化因子であるアルドステロンは、肺、心臓、および腎臓の線維化で観察され、主に肺上皮にその効果を発揮する細胞外マトリックスターンオーバーの増加の一端を担っている[74]。
アルドステロンのレベルが上昇すると高血圧を誘発し、炎症と線維化を変化させ、心血管疾患を悪化させることが知られている[75]。これらの研究のいくつかの限界は、それらがラットまたは他のげっ歯類などの動物モデルで実施されたという事実に関連している。
また、ウイルス後の線維化におけるミネラルコルチコイド受容体アンタゴニストの有益な効果を示す直接的な研究はないが、このような重篤な下気道合併症に対する潜在的な治療法として役立つ可能性がある。
様々な動物モデルにおいて、スピロノラクトンは抗酸化剤として作用し、フリーラジカルの産生を抑制しながら抗酸化防御システムを強化することで、酸化ストレスに関連する損傷から臓器を保護することが示されている[77]。スピロノラクトンで処理した肺組織は、スピロノラクトンを使用しない場合と比較して、肺胞内のリンパ球、好中球、マクロファージ、好酸球などの細胞数の減少を示した。
Lieberらは、スピロノラクトンによる治療が、ブレオマイシンだけでなく、リポ多糖類によって引き起こされる急性肺炎を緩和することを示した[77]。
ある前臨床研究において、Barutらは、腸虚血および再灌流による肺損傷に対するスピロノラクトンの効果を分析した。その結果、スピロノラクトンによる初期治療により、好中球浸潤、一酸化窒素合成酵素誘導、酸化ストレス、病理組織学的損傷が減少したことが示唆された。
同様に、Atalayらは急性肺損傷の治療におけるスピロノラクトンの有効性を実証しており[78]、一方、Jiらは、ブレオマイシンによる肺の炎症反応を有意に減少させるスピロノラクトンの治療可能性を示している[79,80]。
5.3. 線維溶解剤
ARDSはCOVID-19の最も一般的な肺合併症である。支持療法以外に有効な治療法はない[81]。ARDSの病態生理における新たな発見は、肺血管内の血小板血栓性マイクロクロットとともに、気道空間および肺実質にフィブリンが沈着し、進行性の呼吸不全および右心不全の発症に寄与していることである[82]。
同様の病理学的結果は現在、COVID-19に感染した患者の肺サンプルで観察されている[83]。ARDSにおける凝固系のこの破壊的な活性化は、線溶プロセスの阻害とともに血栓形成の活性化と動員の増加につながり、インフルエンザAの場合には肺内皮機能障害を媒介すると考えられている[84]。
2003年以降、ARDS治療を改善するために、凝固系と線溶系をターゲットにすることが提案されている[85]。
特に、ARDSの進行を抑制し、本病理学的に誘導される死亡を減少させるためのプラスミノーゲンアクチベーターの使用は、動物モデルおよびヒトにおける第1相臨床試験から有望なエビデンスを提供している[86,87]。
2001年、Hardawayらは、末期ARDS患者にウロキナーゼまたはストレプトキナーゼを投与すると、望ましくない出血を伴わずに予想される死亡率が100%から70%に減少することを示した。
重要なことに、最終的に死亡した患者の大多数は、肺不全ではなく腎不全または肝不全を含む多臓器不全が二次的に原因であった[87]。
広く利用可能でありながら製品特性の要約に適応症として含まれていない治療法や、線溶剤のような伝統的に「高リスク治療」と考えられてきた治療法を含めることは、SARS-CoV-2感染に関連したこの前例のない公衆衛生上の脅威において正当化されている。
血栓溶解療法のより近代的なアプローチには、他の線溶化因子と同等の出血リスクを伴う血栓溶解効率の高さから、組織プラスミノーゲンアクチベーター(tPA)の使用が含まれている。
さらに、動物実験の包括的なメタ解析では、tPA治療は、ウロキナーゼ・プラスミノーゲンアクチベーター(uPA)またはプラスミンよりも、未治療のコントロールと比較して、死亡率が低く、動脈血中酸素濃度の上昇が大きく、動脈血中酸素濃度の低下が大きいことが明らかになった。これらの研究は急性肺損傷を対象としているが、いずれの研究もウイルス誘発性ARDSは含まれていない [88]。
治療の用量、投与経路、および期間はまだ決定されておらず、この方向での研究は現在進行中である [89]。
急性肺損傷の動物モデルでは、線溶剤の気管内および静脈内投与は、エアゾールによる投与よりも効果的であった。脳卒中や心臓発作などの急性状態でのtPAの使用に関する豊富な経験に基づいて、静脈内投与が最も実施しやすいかもしれない[90]。
ある論文では、ARDSの初期状態では、2時間以内に25mgのtPAを投与し、その後22時間後に25mgのtPAを0.9mg/kgを超えない量で点滴することを推奨している。
脳卒中および心筋梗塞の治療に現在使用されている除外基準と同じ除外基準を使用することができ、奏効者はtPAによる治療を中止した後、しばらくの間ヘパリンの点滴を受けることになる [89]。
COVID-19により誘発されたARDSの患者で、臥位での体位と最適な機械的換気のサポートにもかかわらず、PO2/FiO2比が50未満、pCO2が60mmHg以上である患者は、特にECMOが広く利用できない環境では、tPA治療の候補となるように思われる。
さらに、それ以上の機械的換気が不可能な場合には、肺機能の悪化が進行している人の救護療法として適切な場合もある [89]。COVID-19の患者では血小板減少症が起こる可能性があることを覚えておくことが重要である[18]ので、この治療法を使用する可能性は低くなる。
5.4. 抗ウイルス剤
線維化を予防するためには、ウイルス負荷を軽減し、ウイルス性肺炎の持続期間を短縮することが重要である。
有効な治療法を開発するためには、現在知られている抗ウイルス剤の臨床試験 [91,92]、分子ライブラリやデータベースの利用 [92,93]、ウイルスの働きを阻害する標的治療 [92,94] の3つのコンセプトのうち少なくとも1つを追求することが必要である。
これらの方法により治療薬の研究が進められていたが,その中でもヒドロキシクロロキンとレムデシビルが最も有望視されている.
クロロキンとヒドロキシクロロキンはコロナウイルス細胞の受容体のグリコシル化を阻害し、免疫系を調節する[95]。
後者はSARS-CoVに対して試験管内試験(in vitro)で効果的であることが証明された[96]。
もう一つの経験は、多剤耐性グラム陽性細菌の治療から得られたもので、テイコプラニンの使用は、ヒト細胞におけるコロナウイルスのサイクルの最初の段階を阻害する[97]。
現在知られているレムデシビル、ロピナビル/リトナビルなどの抗ウイルス剤は、ウイルス酵素との親和性が高いためにRNA複製を阻害したり、逆転写やタンパク質生合成を阻害したり、窒素塩基合成を阻害したりする可能性がある[92,98]。
レムデシビルは、MERS感染の動物モデルにおいて、肺損傷の抑制、病状の改善、ウイルス複製の抑制に有効であったことが報告されている[99,100,101]。Greinらは、2020年1月25日に開始し、3月7日に終了したレムデシビルを用いた臨床試験の結果を報告している[102]。
SARS-CoV-2感染が確認され、酸素飽和度≦94%の患者にレムデシビルを投与した。中央値18日間の追跡期間中、36人の患者(68%)が酸素維持クラスを改善した。
さらに,機械的人工呼吸を補助した患者30例中17例(57%)が気管切開された.合計25例(47%)が退院し、7例(13%)が死亡した。
死亡率は、侵襲的人工呼吸を受けた患者では18%(34人中6人)、侵襲的人工呼吸を受けていない患者では5%(19人中1人)であった。死亡リスクは70歳以上の患者で高く(70歳未満の患者と比較したリスク比、11.34;95%CI、1.36~94.17)、ベースライン時の血清クレアチニン値が高い患者で高かった(1デシリットル当たりのリスク比、1.91;95%CI、1.22~2.99)[102]。
ヒトに対して安全であり、臨床試験に導入された[92,103]。ロピナビル/リトナビルは、インターフェロン-1βまたはリバビリンと併用すれば、コロナウイルスに対して有効である可能性がある [98,104,105,106]。ユミフェノビルは、ウイルスの細胞膜への結合を阻害する可能性がある [92,107,108]。
ファビピラビル(FPV)は、COVID-19に対する可能性のある治療選択肢の1つであるかもしれない[109]。FPVは試験管内試験(in vitro)でウイルスの繁殖を阻害することができることが示されている。
ファビピラビル治療とロピナビル/リトナビルを比較した予備的研究では、FPV群ではウイルスクリアランスが短く(4日 vs. 11日)、放射線画像が改善されたことが報告されている[110]。
入江らは、COVID-19治療との関連でFPVの薬物動態を調査し、重症患者では健常者に比べて薬物濃度が低く、高用量を使用する必要があることを示した[111]。
より正確なデータが不足しているため、この分野での綿密な研究が必要である。
抗寄生虫剤イベルメクチンは、さらなる研究に値するもう一つの治療法であるかもしれない。試験管内試験(in vitro)での研究では、3つのサンプルにおいて、48時間の治療後に99.98%のウイルス負荷の減少が示されている[112]。
トシリズマブは標準的な用量で毒性がなく、妊婦にも安全であることから、臨床試験での評価の有力な候補となっている[112]。トシリズマブは、インターロイキン-6に対するヒト化モノクローナル抗体であり、主に関節リウマチの治療を目的とした免疫抑制剤である[113]。
中国では、重度の肺損傷とインターロイキン6レベルの上昇を有するコロナウイルス患者に対して有益な効果が期待されていた[113,114]。
重症または重症のCOVID-19患者21人を対象とした非ランダム化非盲検臨床試験では、トシリズマブを静脈内投与した20人中15人(75%)の患者において、トシリズマブ投与後5日目から酸素要求量が統計学的に有意に減少したことが示されている。さらに、19例(90.5%)の患者では、CTスキャンで放射線学的異常の消失が認められた[115]。
SARS-CoV-2を含むウイルス感染症患者に対する血漿療法も多くの国で実施されている[116,117]。SARS-CoV-1の患者の治療にも用いられている[118]。
例えば、SARS患者(n = 50)を対象とした初期の研究の1つでは、ステロイド治療群(n = 21)と比較して、回復期血漿治療群(n = 19)では、発症後22日目までの退院率が有意に高く(73.4% vs. 19.0%;p < 0.001)、症例死亡率が低かった(0% vs. 23.8%;p = 0.049)ことが報告されている[119]。
さらに最近の論文では、COVID-19およびARDSを有する重症患者の5例が記載されている。血漿輸血後、5人中4人の患者で3日以内に体温が正常化し、SOFAスコアが低下し、12日以内にPaO2/FiO2が上昇した。
ウイルス負荷も減少し、輸血後12日以内に陰性になった [120]。
ステロイドの使用に関連した初期の研究の一つに、シクレソニドが試験管内試験(in vitro)でSARS-CoV-2のリボ核酸複製をブロックし、SARS-CoV-2の細胞病原性活性を阻害することが示唆されている。
このことは、SARS-CoV-2感染に反応してCOVID-19を発症するリスクを減少させること、または疾患の重症度を減少させることに大きく関連している可能性がある。
SARS-CoV-2(COVID-19の原因)の複製を阻害するためのシクレソニドの有効濃度(EC90)は6.3μMであった[121,122]。
5.5. 潜在的な新規戦略
前述の治療薬のいずれかが、コロナウイルス感染症治療に有用になる可能性が高い。研究報告によると、免疫系の活性を改善するためのもう一つのあまり一般的ではないアプローチも有望であると思われる。
GM-脳脊髄液のようなコロニー刺激因子は、感染に対する反応を悪化させ[123]、ウイルスの排除を加速させる可能性がある[124]。それにもかかわらず、このアプローチは危篤状態にある患者には適切ではないように思われることを覚えておくことが重要である。
非重症患者の治療初日におけるその有用性は、ウイルスクリアランスの改善と治療成績の有効性を検証する臨床データが不足しているため、まだ予測が困難である[124]。
特発性肺線維症はCOVID-19関連肺線維症とは異なるが、これらの薬剤群や治療法の選択肢の中でこの問題の解決策を模索する価値がある。
現在進行中の臨床試験では、COVID-19に関連する肺線維症の予防および治療のための広範囲の潜在的に有益な戦略が評価されており、表3にまとめられている。
研究者らは、特発性肺線維症治療のために食品医薬品局(FDA)に承認されているような、チロシンキナーゼ阻害剤であるニンテダニブ[125]や作用機序が不明確なピルフェニドン[126]のようなよく知られた薬剤の使用だけでなく、他の治療法の選択肢も検討している。
2020年3月24日、OncoArendi Therapeuticsは、COVID-19を生存している患者の肺線維症の治療に役立つ薬剤、すなわちキトトリオシダーゼ1(CHIT1)を阻害するOATD-01を研究していると発表した。
この作用は抗炎症活性を示し、肺線維症の発症を遅らせる可能性がある[127,128]。
COVID-19で死亡した患者の肺組織におけるCHIT1発現が増加しているかどうかを決定するための研究が現在進行中であり、このことは、この疾患における肺線維症の発症に対する本剤のポジティブな効果をもたらす可能性がある[127,128]。
別の薬剤であるテトラジンは、多方向の作用機序を持つアルカロイドであり、活性酸素種、カルシウムチャネルおよびカスパーゼ経路に影響を与え、炎症または肺癌の治療に有効であることが確認されている[129,130]。
6種類の漢方薬を配合した福正華湯製剤と安露華散の抗線維化作用は、肝線維症治療において確立され、現在試験中である[131,132]。
最近の臨床試験では、間葉系幹細胞やヒト精製羊水の投与などの他の治療法も評価されており、これらはいずれも抗炎症、抗線維化、再生能力があることが知られている[133,134,135]。
高気圧酸素を用いた試験を目的とした別の臨床試験が2020年4月25日に開始される予定である。IL-1β、IL-6、TNF-αの発現低下を含む抗炎症作用[136,137]は、COVID-19に伴うARDSの緩和や線維化の進展に有益である可能性がある。
近年、COVID-19 は高山性肺水腫(HAPE)と同様の低酸素性肺血管収縮を引き起こすことが示唆されており、HAPE に有効な薬剤としてアセタゾラミド、ニフェジピン、ホスホジエステラーゼ阻害剤などの肺血管収縮を減少させる薬剤の使用が示唆されている[138]。COVID-19に関する新たなデータが出てきており、このアプローチにはまだ議論の余地があることを強調しておく必要がある[139]。
Jing-Yu Chenらは、COVID-19と診断されたことのある患者の線維化に対する新しい治療法を提案した。3人の患者は以前に陰性ウイルス症が確認された後、肺移植を受けた。2人の患者は生存し、リハビリテーションプログラムへの参加を開始した。これはこの状態に対する型破りなアプローチであるが、COVID-19の経過中に肺線維症の臨界期にある患者では検討する価値がある[140]。
線維症治療の最も重要なタイプを図3に示す。
COVID-19の肺線維症に対する示唆された治療法の選択肢
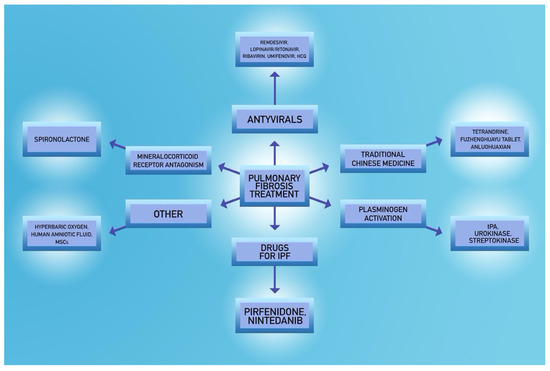
6. 結論
COVID-19を呈するSARIは非常に深刻な疾患である。急速な発展と患者数の大幅な増加は,科学者たちに新しい治療法の選択肢を模索することを余儀なくさせている.このナラティブレビューでは、コロナウイルス(SARS、MERS)の以前の形態と、肺症状とその形成メカニズムが類似していることが示されている。
このため、以前のパンデミック時に得られた知識に頼るべきである。呼吸器系感染症の合併症の一つは、永久的な障害につながる肺線維症である。その治療に利用できる選択肢はほとんどない。
肺線維症を制限するために最も重要なことは、タイムリーな抗ウイルス治療と原因菌の排除であり、適切な治療が行われていない現在では不可能である。線維症の発症を制限する試みに関する研究は乏しい。
スピロノラクトンを用いた試験が動物モデルで実施され、良好な結果が得られている。作用機序を分析すると、この薬物の線維化に対する効果が肯定的であることが示されており、リスクの高い患者への使用を検討する価値がある。
第二の比較的有望な治療法は、禁忌のない患者にtPAを使用することで、呼吸器死亡率を減少させることである。これまでのところ、何年もの試行にもかかわらず、適切な肺線維症の治療法についての回答は得られていない。
これらの治療法は有望な治療法であるが,前向き無作為化試験での精査が必要である。

