Contents
コロナウイルス 新しい医療システム
まとめ
さまざまなCOVID-19感染治療アプローチの安全性、有効性、メカニズムの概説
COVID-19 ローカル、ナショナル、グローバルヘルス間のネクサスにおけるパラダイムシフトの時期

早期介入のための暫定臨床ガイドライン(仮説)
病院の早期介入(参考)

免疫パスポート

組み合わせ療法
魔法の弾丸は存在しない
www.bmj.com/content/369/bmj.m2221.long
「COVID-19の治療薬の世界最大の臨床試験であるRECOVERY試験の共同共同研究者であるMartin Landray氏は、「コロナウイルスを突然ノックアウトしてすべてが正常に戻るような一つの薬があるとは考えにくい」と述べた。
「しかし、病院で死亡する患者数をわずか5分の1に減らすなどの中程度の効果であっても、大きな改善である」とも述べている。
多臓器不全・宿主の炎症反応を引き起こすCOVID-19
www.thelancet.com/pdfs/journals/laninf/PIIS1473-3099(20)30312-1.pdf
重度のコロナウイルス(COVID-19)は、インフルエンザがそうであるように、単なる深刻な呼吸器ウイルス性疾患ではなく、むしろ全身性多臓器ウイルス侵入によるものである。これは、T細胞の過剰活性化を伴う圧倒的な免疫反応によってしばしば複雑になり、免疫病理学的プロセスを続発させ、急性呼吸窮迫症候群および多臓器不全を引き起こす。
重症急性呼吸器症候群のコロナウイルスのウイルス量は症状の悪化と相関していないが、肺の損傷とそれに続く死亡率の主な原因は宿主の炎症反応である。
現在、臨床試験では、抗ウイルス剤、免疫調節剤、ステロイド、IL-6またはIL-1拮抗薬を含む標的薬、免疫療法または免疫抑制薬、セリネクソールなど、さまざまな戦略が評価されている。これら単一の薬剤を評価したところ、一部はウイルス量や免疫応答に対して臨床的に意味のある影響を与える可能性がある。
抗ウイルス+炎症経路の遮断
しかし、応答を最適化するには、抗ウイルス剤と炎症経路の遮断の両方が必要である可能性がある。例えば、抗ウイルス治療と組み合わせて、またはそれに続くステロイドの役割を理解することは重要である。
単剤療法の有害性と限られた有用性
組み合わせ、およびそれらの潜在的な相乗効果または相加効果の研究を行わない場合、潜在的に有用な薬剤は無視されてしまう可能性がある。さらに、相乗的な組み合わせが存在しない場合、単一の薬物がより多くの害を引き起こす可能性があり炎症反応を増強するかもしれない。
現在の状況の緊急性と、これまでのところ、単一療法戦略の臨床的に意味のある効果の明確な証拠がない。
研究者は、単一の戦略の適応的または逐次的研究ではなく、多元計画アプローチにより、併用療法と単剤療法のリスクと利点の決定が可能になる。
予防戦略の組み合わせ
science.sciencemag.org/content/368/6491/551
HIVから学んだこと
HIVへの取り組みから学んだ最も重要な教訓は、予防戦略を組み合わせて使用すること。
SARS-CoV-2ワクチンの入手時期や有効性の程度を正確に予測することはできないが、開発中の試験のほとんどは、60%または70%の予防効果を示すように設計されており、100%の防御効果を示すものではない。
HIVは、複数の併用予防戦略が不可欠であることを教えてくれた。
ニューノーマルの必要性
SARS-CoV-2の広がりを抑えるための行動変容は、”ニューノーマル “として受け入れていく必要がある。われわれは、単純に一発必中の「魔法の弾丸」に頼ることはできない。
コロナウイルス感染症の免疫学的標的化19:同期化がシンフォニーを生み出す
link.springer.com/article/10.1007%2Fs00296-020-04624-2
現在、コロナウイルス疾患2019(COVID-19)に関するデータが氾濫している。抗ウイルス薬、抗炎症薬、免疫療法を含むCOVID-19を標的とする様々な治療法の提唱者がいる[1,2,3]。
疾患の病態形成における血栓症の新たな役割が明らかになってきている[4]。現在では、BCG、肺炎球菌、インフルエンザの大量ワクチン接種の推進、回復期血漿またはモノクローナル抗体によるウイルスの中和、インターフェロンをベースとした治療法の試験など、免疫学に基づいた戦略に重点が移っているようである [2]。
リウマチ専門医は、抗炎症療法、免疫療法、さらには抗血栓療法を得意としているため、この状況では特別な発言力を持っている[5]。我々は、COVID-19に対する戦略化された同期化された攻撃を様々な面から行うことが今必要であると感じている。したがって、リウマチ専門医や免疫学者がCOVID-19との戦いにおける様々な多様な戦略を知り、統合することは適切なことである。
感染症の結果は、免疫系との陰陽関係に左右される。免疫系が過剰に活性化していると、毒性のあるウイルスと同じくらい危険な状態になることがある。SARS-CoV-2は、免疫回避、高い繁殖率、無症候性の個体を介した伝播、および細胞質効果と過活動性免疫応答を誘導することによる病原性の両方の側面を習得したため、パンデミックへと進化してきた。
そのため、多方面からの攻撃戦略が必要となる(図1)。
1.社会的距離
第一に、社会的な距離感を介した感染拡大を制限することである[6]。韓国の経験は、早期にロックダウンに入るという模範的なものである[7]。
2.大規模検査
第二に、異なる大規模なテスト戦略を用いて陽性例を特定し、隔離することである[8]。これらの最初の2つの戦略は、より病原性の高い株が新しい個体に移行するのを防ぐことになる。このような株を排除することは、毒性の低い株の選択に役立ち、長期的には、他の流行しているコロナウイルス株と同様に、軽度の毒性を持つ株が蔓延したままであることが期待される。
図1
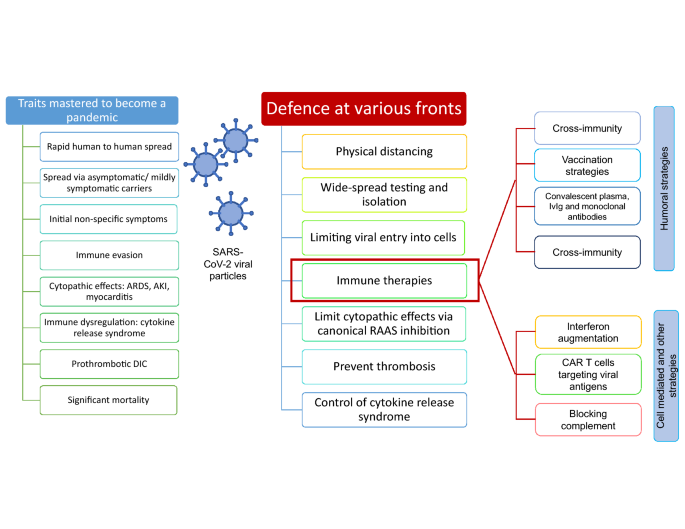
図1
コロナウイルス疾患2019(COVID-19)の様々な特徴とその対策に必要なマルチモーダル戦略 ARDS 急性呼吸窮迫症候群、AKI 急性腎障害、DIC 播種性血管内凝固、RAAS レニン-アンジオテンシン-アルドステロン系、IvIg 静注免疫グロブリン、CAR-T細胞 キメラ抗原受容体-T細胞
3.ウイルス侵入の阻害
第三の戦略はウイルスの侵入を制限することであり、カモスタット、ヒドロキシクロロキン、あるいはヘパリンなどの薬剤が提案されている [9,10,11]。
4.ウイルス複製の阻害
第4の戦略は、レメディシビル(エボラ)、ロピナビル/リトナビル(ヒト免疫不全ウイルス)、ファビピラビル(インフルエンザ)など、他のウイルス用に開発された様々な薬剤を再利用することで、ウイルスの複製を制限することである。
5.ウイルスによる障害の影響を緩和
第五は、アンジオテンシンI変換酵素(ACE)阻害薬によるレニン-アンジオテンシン-アルドステロン(RAAS)経路の阻害[12]やヘパリンによる原血栓性播種性血管内凝固療法[13]で試みられているウイルスの細胞病的効果を制限することである。
6.免疫調節
第六は、以下に提案するように、ウイルスに対する免疫調節であり、図1にも詳しく述べられている。
他のウイルスとの交差反応抗体による自然防御、BCGワクチン接種、静脈内免疫グロブリン(IvIg)、回復期血清、モノクローナル抗体などの免疫調節の体液性(抗体関連)の側面に焦点を当てている[2]。
免疫療法の補完的な側面として、SARS-CoV-2に対する細胞媒介免疫(CMI)を強化することが挙げられる。重度のCOVID-19は低インターフェロン(IFN)と関連しており[14]、これはCMIの抑制を示唆している可能性がある。COVID-19では1型IFN療法が有益であるかもしれないという予備的な証拠がいくつかある[15, 16]。
初期のin silico研究では、COVID-19におけるバリシチニブの使用が提案されている[17]。しかし、バリシチニブはインターフェロン経路をブロックするため、このアプローチは論争がないわけではない。もう一つの最先端のコンセプトは、患者のCMIを増強するために、SARS-CoV-2ウイルス抗原に対するキメラ抗原受容体(CAR)T細胞を使用することである。
このような概念実証研究は、HIVとサイトメガロウイルスに対して実施されている[18]。COVID-19に登録されたCAR-NK(ナチュラルキラー)細胞の試験がある[NCT04324996]。しかし、再び、パンデミックと戦うのに十分な数のCAR-T細胞を生産することは、現時点では実行可能な選択肢ではない。
補体系は免疫系の不可欠な部分を形成している。COVID-19の全身性血栓症をアブログするために補体系を標的とする提案もある[19]。補体成分C5aの遮断は、インフルエンザAウイルスH5N1、H7N9、および重症急性呼吸器症候群(SARS)コロナウイルスのマウスモデルにおいて、急性肺損傷の治療に有効であることが示されている[20]。
治療戦略を組み合わせることについてのエビデンスが出てきている[21]。しかし、治療法を組み合わせた場合の真の課題は、それぞれの最適なタイミングと順序を見つけることである。
これは、世界保健機関(WHO)のSOLIDARITY試験[22]のような大規模なマルチセラピー試験の範囲内で検討することができる。我々の仮説は、各治療戦略から得られる小さな効果の大きさを相乗的に追加して、重度のCOVID-19病に対する最大の利益を得ることができるということである。
コロナウイルスへの精密医療アプローチ
www.ncbi.nlm.nih.gov/pmc/articles/PMC7205603/
四つの基本前提
予測
危険因子、生活習慣、社会的決定要因に基づいて病気の出現を予測する。
予防
最初の症状が現れる前に病態の進展を遅らせ、病気が落ち着いたら二次的な予防を行うための行動を提案する。
パーソナライゼーション
各個人と病原体の遺伝的、分子的、特殊な要因を分析し、その状態に適応した最良の治療戦略を提案する。
参加
生物医学研究、学術機関、医療専門家、そして何よりも患者自身の関与を必要とする。
三位一体の組み合わせ薬
パンデミック緩和薬候補の三位一体の組み合わせ。ビタミンD、ケルセチン、エストラジオール
ヒト細胞内のSARS-CoV-2ターゲットのゲノミクス誘導トレースによって定義されたCOVID-19パンデミックの標的緩和のための薬効薬の多様な特性
www.mdpi.com/2227-9059/8/5/129/htm
ゲンナディV.グリンスキー カリフォルニア大学サンディエゴ校医学工学研究所、カリフォルニア大学サンディエゴ校、9500ギルマン博士、MC 0435、ラホヤ、カリフォルニア州、カリフォルニア州、92093-0435、米国
抄訳
SARS-CoV-2のヒト細胞への侵入に必要な遺伝子であるACE2とFURINをベイトとして用いて、上流の制御要素、ヒト体内での発現と機能、および病態生理学的に関連する細胞型のゲノムガイド付き分子マップを構築した。
ビタミンDおよびケルセチンが、2019年コロナウイルス感染症(COVID-19)の潜在的な緩和剤として同定された。
ケルセチン
ケルセチンは、スーパーコンピュータSUMMITドラッグドッキングスクリーンおよび発現プロファイリング実験(EPE)のGene Set Enrichment Analyses(GSEA)において、トップスコアの候補治療薬の1つとして同定されており、構造的に非常に類似したケルセチン、ルテオリン、およびエリオジチオールが、SARS-CoV-2感染の効率的な阻害剤の開発のための足場として役立つ可能性があることを示している。
この考えに一致して、ケルセチンは、SARS-CoV-2のタンパク質標的をコードするヒト遺伝子のうち332個中98個(30%)の発現を変化させ、その結果、ヒト細胞内のSARS-CoV-2ウイルスタンパク質のうち27個中23個(85%)の機能を阻害する可能性がある。
ビタミンD
同様に、ビタミンDは、SARS-CoV-2のタンパク質標的をコードするヒト遺伝子の332個中84個(25%)の発現を変化させることにより、SARS-CoV-2タンパク質の27個中19個(70%)の機能を妨害する可能性があり、これにより、ヒト細胞におけるSARS-CoV-2ウイルスタンパク質の27個中23個(85%)の機能を妨害する可能性がある。
ケルセチンとビタミンDの両方の潜在的な効果を考慮すると、ヒト細胞内のSARS-CoV-2タンパク質の27個中25個(93%)の機能が変化している可能性があると推測される。
エストラジオール
GSEAとEPEは、コロナウイルス感染促進因子として作用すると考えられる複数の薬物、喫煙、および多くの疾患状態を特定している。SARS-CoV-2標的に対するテストステロンとエストラジオールの影響の不一致パターンは、コロナウイルスパンデミック時に男性の死亡率が明らかに高くなったことについて、もっともらしい分子的説明を示唆している。
エストラジオールはテストステロンとは対照的に、SARS-CoV-2標的をコードするヒト遺伝子の大部分(332個中203個、61%)の発現に影響を与え、27個中26個のSARS-CoV-2ウイルスタンパク質の機能を阻害する可能性がある。
三位一体の組み合わせ
ケルセチン/ビタミンD/エストラジオールの仮説的な三位一体の組み合わせは、SARS-CoV-2標的をコードするヒト遺伝子332個中244個(73%)の発現に影響を与える可能性がある。
フーリン
特に懸念されるのは、免疫細胞を含む多くのヒト細胞および組織におけるACE2およびFURINの発現であり、SARS-CoV-2はヒトの体内の広範な細胞標的に感染する可能性があることを示唆している。免疫細胞への感染は、免疫抑制、ウイルスの長期持続、二次標的へのウイルスの拡散を引き起こす可能性がある。
現在の分析および多数の観察研究は、年齢に関連したビタミンD欠乏が、高齢者および高齢者の高い死亡率に寄与する可能性があることを示している。潜在的なCOVID-19パンデミック緩和剤、すなわちビタミンDとケルセチン、および本質的に特異的なFURIN阻害剤(a1-アンチトリプシンポートランド(a1-PDX)と同様に、非常に選択的(Ki、600 pm)の標的となる実験的および臨床的な尋問のための即時の利用可能性は、心強い要因と考えられている。
本寄稿で報告された観察は、COVID-19パンデミックと闘うための治療的に実行可能な介入を同定し、検証するためのフォローアップ標的実験研究、および、必要に応じて無作為化臨床試験を促進することを意図している。
具体的には、ビタミンDとケルセチンの遺伝子発現プロファイル、および市販薬としての安全性が確立されていることから、これらはCOVID-19パンデミック緩和剤としての潜在的な有用性をさらに検討するための実行可能な候補となり得ることが強く主張されている。
今回の解析結果に基づき、COVID19+およびCOVID19+と推定される患者におけるコロナウイルス感染の重症度に対するエストラジオールの効果を評価した無作為化介入臨床試験と、COVID-19の予防および治療に対するビタミンDの効果を評価した2つの無作為化介入臨床試験がClinicalTrials.govのウェブサイトに掲載された。
結論
世界で最も強力なスーパーコンピューターSUMMITを使用したスーパーコンピューターモデリング研究では、宿主受容体領域で単離されたSARS-CoV-2ウイルスSタンパク質、またはSタンパク質-ヒトACE2インターフェースのいずれかに結合するいくつかの候補低分子薬剤が同定された[42]。興味深いことに、この研究では、ケルセチンは、ウイルスSタンパク質-ヒトACE2受容体インターフェースのスコアリングリガンドのトップ5の中に同定された。
このことから、ケルセチンは、SARS-CoV-2 のヒト細胞への結合を直接阻害する可能性のある有望な治療分子であると考えられる。以前に報告された実験では、ケルセチンが宿主細胞へのSARS-CoVの侵入を阻害することが示されている[43]。
SARS-CoV-2は、ヒト細胞への侵入にSARS-CoVコロナウイルスと同じ受容体(ACE2)および付属プロテアーゼFURINを利用するので、これらの観察は、ケルセチンが実際にSARS-CoV-2に対しても抗ウイルス活性を有している可能性を示唆している[3]。
ケルセチンとルテオリン
重要なことに、ケルセチンとルテオリンの両方が、ウイルスのSタンパク質-ヒトACE2受容体界面-リガンド結合複合体[42]のトップ5リガンドの間で同定されており、これらの非常に構造的に類似した化合物(図7)は、SARS-CoV-2感染の効率的な阻害剤として機能する可能性があることを示唆している。この仮説に沿って、ケルセチンとルテオリンの両方がSARS-CoVウイルス感染を有意に阻害することが報告されている[43]。
Biomedicines 08 00129 g007 550図7。ルテオリン、ケルセチン、およびエリオジチオールの化学構造の類似性。ルテオリン、ケルセチン、エリオジキチオールは、最近のスーパーコンピュータSUMMITドラッグドッキングスクリーンにおいて、SARS-CoV-2スパイク-タンパク質-ヒトACE2受容体界面-リガンド結合複合体の最上位阻害剤候補として同定されています[42]が、ルテオリンとケルセチンはSARS-CoV感染症の強力な阻害剤として同定されている[43]。
テストステロン
テストステロンの投与は遺伝子発現の変化の明確に定義されたパターンを示すように見えることが観察されており、テストステロンが潜在的なコロナウイルス感染促進剤として同定されていることと一致している、特にヒトの体内および呼吸器系へのウイルスの侵入に役割を果たしている可能性のあるいくつかの細胞型において(補足図S11)。
これはエストラジオールとは対照的であり、エストラジオールは遺伝子発現に複雑な細胞型特異的効果を示し、遺伝子発現変化の感染阻害パターンまたは感染促進パターンのいずれかに一致するようである。
ヒト遺伝子332個のうち244個(73%)の発現への影響
興味深いことに、ビタミンD/クエルセチン/エストラジオールからなるパンデミック緩和剤の仮説的な三位一体の組み合わせは、SARS-CoV-2標的をコードするヒト遺伝子332個のうち244個(73%)の発現に影響を与える可能性がある(表1および表2)。
緩和薬候補の二部作(ビタミン D とケルセチン)と三部作(ビタミン D/ケルセチン/エストラジオール)の組み合わせは、単剤療法と比較して SARS-CoV-2 標的遺伝子の発現に対して統計学的に頑健な効果を示すことが観察されている(表 1 および表 2)。
これらの違いは、SARS-CoV-2標的遺伝子をコードするヒトの影響を受けた遺伝子の数(表1)、または将来の治療薬によって機能的にブロックされると推定されるSARS-CoV-2ウイルスタンパク質の数(表2)のいずれかを比較した場合に証明された。
今回の分析は、ヒトの体内ではACE2およびFURIN遺伝子がほぼユビキタスに発現しているため、遺伝的に脆弱な宿主細胞へのアクセスに基づいて、SARS-CoV-2が細胞性トロピズム[3]を拡大させる可能性に関連して、現在のパンデミックの結果に関する大きな不確実性を浮き彫りにしている。
免疫細胞への感染の可能性
この記述で特に注意しなければならない危険な要因は、SARS-CoV-2が免疫細胞に感染する可能性があることであり、免疫細胞への感染は、免疫抑制を引き起こし、ウイルスが体内に長期的に残存し、二次標的へのウイルスの拡散を引き起こす可能性がある。
SARS-CoV、SARS-CoV-2ともにACE2を侵入受容体として利用してヒト細胞に感染することが報告されている[3]。コロナウイルス SARS-CoV と SARS-CoV-2 は、ACE2 受容体との相互作用のエネルギーとダイナミクスのバランスをとることで、同等の結合親和性を有している[44]。
しかしながら、SARS-CoV-2-ACE2複合体は、SARS-CoV-ACE2複合体と比較して、より多くの接触数、より大きな界面面積、および界面残基揺らぎの減少を含んでいる[44]。このレベルの適応は、ヒト以外の宿主におけるコロナウイルスの自然進化の探究における、非常に効率的なヒト受容体認識に起因していると考えられる。
フーリン阻害剤
ACE2およびFURIN発現の遺伝子リプレッサーおよびアクチベーターの発現パターンが細胞型特異的であることから、普遍的に有効な治療薬の開発を複雑にする可能性がある。
多くの遺伝学的に関連したトランスジェニックマウスモデル、特にFURINヌルマウスが利用可能であることは、コロナウイルス感染症を標的とした薬剤候補の前臨床開発にとって大きな利点であると考えるべきである。
具体的には、高選択性(Ki, 600pm)で本質的に特異的なFURIN阻害剤(a1-antitrypsin Portland (a1-PDX); [45])の潜在的な治療効果が、近い将来に試験されるべきである。
本研究で同定された3つのパンデミック緩和薬候補のすべてについて臨床試験が発表されたことは、非常に心強い要素であると考えられる。
新しい医療
遠隔医療
遠隔医療によるCOVID-19患者管理プロトコル
pubmed.ncbi.nlm.nih.gov/32345359/
2019年1月24日には、妊婦を含む脆弱な人々を対象とした遠隔教育が開始された。
この流行中、山東省では1人の妊婦だけが重症化し、非常に良好な結果が得られた。
遠隔医療プラットフォームにはCOVID-19の情報ページが含まれており、自宅での検疫プロセスの指示、個人の保護申請、診察を求める時間などの最新情報がリアルタイムで更新された。
遠隔医療プラットフォームにはオンラインコンサルティングクリニックも含まれており、専門家が1日24時間利用できるようになっていた。
専門家は遠隔相談を通じて予備検査を行うことができ、病院での交差感染のリスクを回避し、病院でのストレスを軽減することができた。
地域住民や医療従事者からは、早期発見・診断・予防への好ましい支持が得られたのこと。
ccforum.biomedcentral.com/articles/10.1186/s13054-020-02884-9
医療研究投資
多数の研究手段への支援によるイノベーション
science.sciencemag.org/content/368/6491/553
COVID-19と戦うために、研究投資を1万の案件に資金提供することを考えてみよう。 それぞれの取り組みが予防、治療、感染制御の分野で進歩をもたらす確率が0.1%しかなかったとしても、少なくとも5つの進歩をもたらす確率は97%になる。
COVID-19の3つの新しい予防、診断、治療法の選択肢は、コントロールされた無作為化試験を緊急に必要とする
pubmed.ncbi.nlm.nih.gov/32534175/
要旨
仮説
COVID-19について、最新の科学的文献レビューに基づいた仮説的な予防・診断・治療の3つのアプローチの提案。
診断
診断に関しては、COVID-19の有効性が確認されたスクリーニング質問票とデジタルアプリを用いることで、本疾患の感染リスクのある個人、および臨床的転帰が不良となるリスクの高い個人を特定するのに役立つであろう。
世界規模での実施と、統計的に検証されたバイタルサインとスコア付き質問票のオンライン追跡は、保健当局が感染のリスクが最も高く、予後が悪い人を検査し、隔離するために必要な医療資源を適切に配分するのに役立つであろう。
予防
第二に、予防に関しては、物理的距離、手洗い、隔離以外の有効なプロトコルは存在せず、最近ではイベルメクチンがCOVID-19に対して抗ウイルス特性を持つことが発表されている。イベルメクチンの無作為化試験、および/またはグルタチオン、ビタミンC、亜鉛、免疫調節サプリメント(3,6ベータグルカン)を含む免疫機能をサポートするために発表されている栄養補助食品の無作為化試験は、感染の予防または症状の軽減に有益である可能性があるが、統計的な検証が必要である。
治療
第三に、治療に関しては、COVID-19による炎症や血球貪食性リンパ組織球症(HLH)/マクロファージ活性化症候群(マクロファージ活性化症候群)を伴う「サイトカインストーム症候群」が、特定の合併症を持つ患者において、「急性呼吸窮迫症候群」(ARDS)や播種性血管内凝固( DIC(播種性血管内凝固症))を伴う多臓器不全に続発し、極度の罹患率と死亡率をもたらしている。
赤血球、血清および肺胞グルタチオンの欠乏は、フリーラジカル/酸化ストレスの増加レベルに起因するウイルス性および細菌性肺炎と同様に、ARDSの医学文献で発表されている。グルタチオン前駆体(N-アセチルシステイン[NAC]とαリポ酸)と PO/IV グルタチオンを用いて NF-κB とサイトカイン形成を阻害する無作為化比較試験を、炎症を低下させることが科学的に証明されている
Nrf2 活性化剤(クルクミン、スルフォラファングルコシノレート)の評価とともに実施する必要がある。COVID-19感染による敗血症誘発 DIC(播種性血管内凝固症)による死亡率の高さは、血栓性イベントやD-ダイマーの上昇にも関連しているため、ヘパリンを併用した抗凝固療法の無作為化比較試験が急務となっている。
これは、特定の敗血症誘発性凝固障害(SIC)基準を満たす人工呼吸器を使用している患者において特に重要である。アセタゾラミドとシルデナフィルの併用も、ヘパリンの有無にかかわらず検討する必要がある。なぜなら、血栓症や肺塞栓症を予防し、炭酸無水酵素阻害を行うことで重要臓器への酸素供給量を増加させることで、酸素供給量を増加させ、有害な臨床転帰を防ぐことができるからである。
結論と示唆
COVID-19の重篤な合併症に対処するために、予防、診断、治療の3つの部分からなる計画が提案されている。症状のデジタルモニタリングによる早期曝露と治療への反応を臨床的に診断すること、イベルメクチンや健康的な免疫反応をサポートする栄養療法による予防、NF-κB をブロックし Nrf2 経路を活性化する抗炎症療法による治療、抗凝固療法やアセタゾラミドやシルデナフィルの有無にかかわらず抗凝固療法や新規呼吸器療法を含む COVID-19 肺炎や DIC(播種性血管内凝固症) を伴う ARDS に対処する新規治療。これら3つの広範な介入は、早急に無作為化比較試験の対象とする必要がある。
仮説・理論
COVID-19へのウイルス曝露後の上記の臨床的および生化学的異常、および高レベルの感染性、罹患率および死亡率に基づいて、我々は、曲線を平坦にし、臨床転帰を改善するための新しい3つの部分からなる予防、診断、および治療計画を提案する。
症状のデジタルモニタリングによる早期曝露と治療への反応を臨床的に診断し、感染を予防し、免疫をサポートし、健康的な炎症反応をサポートする治療法の無作為化比較試験を実施し、COVID-19誘発 DIC(播種性血管内凝固症)とARDSの合併症に関連する高い死亡率に対処するために、異なる生理学的および呼吸療法の評価を行う。
仮説・アイデアの評価
1. 診断
現在までのところ、感染拡大を防ぐためには、集団的な隔離(曝露陽性者を含む)、距離を置くこと、手洗いが義務づけられている。しかし、緊急隔離を必要とする曝露の可能性が高いことを示唆するいくつかの重要な臨床症状がある。これには、発熱、喉の痛み、咳、息切れに加えて、無神経症、低神経症、味覚障害などの初期の前駆症状が含まれる。嗅覚および/または味覚が急激に失われたり、低下したりする病気はほとんどない。
医学的文献によると、約5%の人が主に老年期に起因する機能性嗅覚障害を呈しており[36]、50歳以上の人の25%が嗅覚障害を呈している[37], [38]。嗅覚の健康状態は、服用されている薬の数[39]の指標となり、また、人の全体的な健康状態を直接反映することもでき、嗅覚能力の低下は寿命および死亡リスクの増加と負の関係があるようである[40]。これは主に、神経変性疾患、特にパーキンソン病、アルツハイマー病、レビー小体型認知症などの患者では、障害の経過の早い段階で嗅覚の低下が見られるため、運動障害や認知障害が生じる何年も前に暫定的な診断が可能であることに起因している[41]。
神経変性疾患とは別に、嗅覚喪失の3大原因は、外傷、鼻副鼻腔炎・鼻ポリープ、およびウイルス感染である[41]。鼻閉/鼻づまりや鼻汁(前・後鼻点滴)、顔面痛/顔面圧迫を伴う急性鼻副鼻腔炎の有病率は、欧米人では6~15%、アジア人では2.7~8%であるが[42]、COVID-19感染に関連した嗅覚機能障害は、急性鼻副鼻腔炎の症状複合体の一部である鼻出血[43]とは通常関連していないため、特別なものであると考えられている。
アジアでの臨床研究では、当初、発熱、咽頭痛、咳、呼吸困難、喀痰、筋肉痛、関節痛、頭痛、下痢などの主症状とともに鼻漏が報告されていたが [44], [45]、ヨーロッパのCOVID-19患者357人の最近の症例シリーズでは、85.6%が嗅覚障害を有し、88.6%が嗅覚障害を有していた。 6%に嗅覚機能障害があり、88%の患者が感染に関連した味覚機能障害を報告したが、鼻漏とは関連していなかった[43]。また、無嗅覚と味覚障害の両方の障害との間にも有意な関連があった(p<0.001)。
したがって、国民健康・栄養調査の嗅覚および味覚の構成要素に基づく嗅覚および味覚の質問票、および嗅覚障害否定的記述の短文質問票(sQOD-NS)を使用することは、特にCOVID-19の最も有病率の高い症状を評価する質問票とリンクしている場合には、初期のスクリーニングツールとして有用である [43]。今回のパンデミック中に嗅覚や味覚に急激な変化があった場合、特に他の危険因子や医学的疾患が除外されている場合には、COVID-19に曝露する可能性は高いと考えられる。
味覚の急激な消失や低下については、上気道ウイルス感染症、口腔内感染症、ウイルス性肝炎などの感染症では、炎症による味覚異常を呈することが多く[46]、例えば、自己免疫疾患、口腔内感染症、ウイルス性肝炎などの感染症では、炎症による味覚異常を呈することが明らかになっている。
例えば、自己免疫疾患、例えばシェーグレン症候群および全身性エリテマトーデス(SLE)は、味覚機能に影響を及ぼすことが知られており、炎症性サイトカインであるインターロイキン(IL)-6およびインターフェロン(IFN)-γのレベルの上昇と関連している。 これらはCOVID-19感染で見られる炎症性サイトカインの一部であり[20]、炎症と味覚障害との間に強い関連性があることから、ウイルス性パンデミックの状況下でこの症状が新たに突然発症したことは、炎症が味覚障害の病態形成に役割を果たしているコロナウイルスへの曝露を再び暗示していることを示唆している。
これらの症状の最初の発症時には、たとえ無症状であったとしても、直ちに隔離することは、治癒を平坦にし、広範な曝露を減少させるのに役立つであろう。これらの症状が、疲労、頭痛、筋痛および/または下痢を伴うか否かにかかわらず、発熱、喉の痛み、咳および/または息切れのコンスタレーションの設定で考慮される場合、無感覚、低感覚および/または味覚障害の新たな発症は、高い確率で曝露を確認するために臨床的に役立つであろう。
臨床症状を評価することは医学的診断戦略の特徴であるため、これらの症状はオンラインアンケートやデジタルアプリを介して収集することができる。これまでの研究では、自己申告した症状が健康転帰の信頼できる予測因子となりうることが実証されており、自己申告した健康状態の悪化は、COVID-19で見つかったのと同じ炎症性マーカーであるC反応性タンパク質やIL-6などの高齢者の炎症性マーカーの上昇と関連している [49]。
不安や臨床的うつ病、胃食道逆流症や嚥下障害を含む消化器疾患、末梢動脈疾患、がんのケア提供、ライム病などの診断の確立を含むがこれに限定されない、医療における医学的および精神的健康状態およびQOLの問題の検出/診断に有効な自己報告質問票を使用してきた長い歴史がある[50]、[51]、[51]。[50], [51], [52], [53].
最近では、イスラエルの研究者によって臨床用のアプリが開発され、カナダではCOVID-19のスクリーニングツールとして導入されている[54]。このアプリは、スマートフォンの画面を見て人々のバイタルサインをモニターする機能を持っており、「トリアージ看護師は患者に触れることなくバイタルサイン(心拍数、呼吸数、血液の酸素飽和度)をチェックすることができ、特定の入院患者の状態をベッドからモニターすることができる。
同様に、Adaptive Biotechnologies Corp.とMicrosoftは最近、機械学習機能を使用して、血液中の抗原に反応して生成される体内のT細胞受容体配列のデータをふるいにかけることで、COVID-19に対する免疫系の反応をマッピングすることで共同研究を行っている。検証済みのスクリーニング質問票、アプリ、機械学習を組み合わせることで、早期の曝露を特定し、離れた場所からバイタルサインをモニターすることができる。
COVID-19感染のための新しい実験プロトコルのいくつかが、最近、潜在的な利益[56]であることが発表されているヒドロキシクロロキンとアジスロマイシンの使用を含む場合、しかし、潜在的な害[95]の心臓動悸のモニタリングも可能であり、また、FDA認定の臨床グレードの個人用心電図モニター[57]であるKardiaMobileを介して自宅でデジタル的に行うことができる。
クロロキンやヒドロキシクロロキンをマクロライドとともに服用している人、マクロライドを服用していない人は、脱ノボ心室性不整脈[95]のリスクが高かったので、これは心臓の危険因子を持つ人にとって重要であり、心電図はその後スマートフォンに保存し、医師に電子メールで送信して確認することができる。
2. 予防
科学的に評価される必要がある予防法は、試験管内試験(in vitro)でCOVID-19に対する抗ウイルス効果があることが示されているイベルメクチン(週1~2回)を毎日またはパルス療法で使用すること [58] 、および亜鉛、ビタミンC、βグルカンおよびグルタチオン(GSH)を含む栄養補助食品の使用である。亜鉛の欠乏は様々な病原体に対する感受性の増加につながる可能性があり[59]、健康なヒトを対象とした亜鉛の補給は、酸化ストレスに関連した副産物を低下させ[60]、TNF-αおよびインターロイキン1βの誘導を抑制し[61]、単核球におけるTNF-α誘導核因子κβ活性化から保護し[61]、マクロファージによる細胞内殺傷およびサイトカイン産生を調節することが示されている[61]。
免疫系では、ビタミンCの主な役割は抗酸化物質として、感染症による酸化ストレスから肺や宿主細胞を保護することにあると考えられている[62]。ある研究では、ビタミンCはICUでの滞在期間を短縮し、人工呼吸器を使用している重症患者の機械換気の期間を短縮することが示されている[65]。
最後に、ベータグルカンは、重要な免疫調節特性を有するものとして医学文献に広く発表されている[66]と二重盲検、プラセボ対照試験では、上気道感染症の重症度を低下させ、単球化学戦術タンパク質-1を低下させることに利益が示されている[67]、[68]。
最後に、グルタチオン(GSH)が抗ウイルス性を有することが示されており、自然免疫や抗ウイルス活性の遺伝子マッピングにはグルタチオン(GSH)が必要とされていることから、グルタチオン(GSH)がウイルス感染症の予防に役立つかどうかについても研究する必要がある。
そのため、イベルメクチンの対照臨床試験は、亜鉛、ビタミンCおよびベータグルカンを含む栄養補助食品の有無にかかわらず、予防および暴露後の臨床症状の重症度の軽減の両方の効果を評価するために必要である。安全で効果的なワクチンの開発は数ヶ月から数年先になるかもしれないので、これは非常に重要であり、効果的な抗ウイルスアプローチは、その曲線を平坦にし、感染を予防するのに役立つ可能性がある。
イベルメクチンの無作為化比較試験は、栄養補助食品である亜鉛、ビタミンC、ベータグルカン、グルタチオン(GSH)の有無にかかわらず、スクリーニングの質問票/アプリと関連して行われ、潜在的に初期症状を検出し、貴重な病院のリソースを使用せずに離れた場所から臨床経過をモニターし、治療データをクラウドにアップロードして大規模なデータコンピューティングを行い、結果を迅速化することができる。
3. 治療法
COVID-19の治療における抗ウイルス療法の有効性を評価した無作為化比較試験は現在までに報告されてわない。リン酸クロロキンは、中国での臨床研究でCOVID-19に関連した肺炎の治療に明らかな有効性を示しているが[69]、ヒドロキシクロロキンは試験管内試験(in vitro)でクロロキンよりも強力であり[70]、潜在的な副作用も少ないことがわかった[70]。
Raoultらがフランスで行った最初の非ランダム化小規模研究では、ヒドロキシクロロキンとアジスロマイシンを用いた有益性が示されたが[56]、最近の大規模観察研究では、クロロキン、ヒドロキシクロロキンおよび/またはマクロライドを用いた場合、生存期間の有益性は認められず、不整脈および死亡のリスクが増加することが示された[98]。
その他にも、イベルメクチン[58]、ニタゾキサニド[71]、レムデシビル[72]、トリプルコンビネーションインターフェロンβ-1b、ロピナビル・リトナビル、リバビリン[97]、およびメラトニン、メルカプトプリン、シロリムス[73]を含むがこれらに限定されない再利用薬や栄養補助剤が検討されている。
COVID-19患者1,408人(うち半数がイベルメクチンを投与されていた)を対象とした国際多施設共同観察症例対照研究では、治療群では院内死亡率(1.4%)が低かったのに対し、非治療群では8.5%の死亡率であったことが示された)[98]。レムデシビルを除くこれらのいずれも、無作為化プラセボ対照臨床試験[99]を実施しておらず、COVID-19に対するFDAの治療薬はまだないので、これらの薬剤の組み合わせや栄養補助食品の「ラベル外」を使用したことのある患者のアプリやオンラインアンケートを介したデータ収集は、臨床研究の方向付けに有用であるかもしれない。
「サイトカインストーム症候群」とマクロファージ活性化症候群の治療法
血球貪食性リンパ組織球症(HLH)/マクロファージ活性化症候群(マクロファージ活性化症候群)を伴う炎症および「サイトカインストーム症候群」は、極度の罹患率および死亡率につながる可能性がある。
これは、ARDSや播種性血管内凝固( DIC(播種性血管内凝固症))を伴う多臓器不全を含む特定の併存疾患を有する患者では特にそうである。しかしながら、ARDSはCOVID-19の主な死亡原因であり[9]、上記の合併症の多くの根底にある根本的な病態生理は「サイトカインストーム症候群」である[74]、[19]。高レベルのフリーラジカル/酸化ストレスに二次的に肺組織および必須臓器を損傷させるサイトカイン産生および抑制されていない炎症の制御が不可欠である。
炎症を低下させるのに役立ついくつかの潜在的なメカニズムがあり、抗ウイルス剤(ヒドロキシクロロキン、クロロキン、レムデシビル、ニタゾキサニド、イベルメクチン)の効果とは別に、以前に説明した栄養サポート(亜鉛、ビタミンC、3,6ベータグルカン)を研究する必要がある。赤血球、血清および肺胞グルタチオンの欠乏は、フリーラジカル/酸化ストレスの増加レベルに起因するARDS、ウイルス性および細菌性肺炎で発表されている[35]、[75]。
酸化ストレス・NF-κB
酸化ストレスは、炎症性応答を調節するための主要な標的であるNF-κBを含むいくつかの生化学的経路を誘発し得る[76]。転写因子 NF-κB は、自然免疫および適応免疫機能の様々な側面を制御し、炎症反応の重要なメディエーターであり、サイトカインやケモカインをコードするものを含む様々な炎症性プロ遺伝子の発現を誘導し、また、炎症性ソームの制御にも関与している[77]。
さらに、NF-κBは、ウイルス感染と戦うために必要な自然免疫細胞および炎症性T細胞の生存、活性化および分化を調節する上で重要な役割を果たしている[77]。また、NF-κBのプロ炎症性機能は、マクロファージ活性化症候群に関与する感染症に対する免疫応答の最前線にいるマクロファージ[78]においても広範囲に研究されている。
したがって、COVID-19 の効果から保護するための NF-κB ブロッキングの役割を評価するためには、プロスペクティブな無作為化比較試験が必要とされている。
グルタチオン・NAC
NF-κBシグナル伝達を阻害する阻害剤としては、N-アセチルシステイン(NAC)[79]、αリポ酸[80]、グルタチオン[81]などの抗酸化剤が挙げられる。N-アセチルシステインおよびαリポ酸は、グルタチオンの産生および再生を増加させるのを助けることができ[82], [83]、赤血球、血清および肺胞グルタチオンの欠乏は、フリーラジカル/酸化ストレスの増加レベルに起因するウイルス性および細菌性肺炎[84]だけでなく、ARDS[35]でも発見されている[85]。
グルタチオン(GSH)のもう一つの利点は、NK細胞およびT細胞の機能活性を高める能力の一部に起因する抗ウイルス特性を有することである[2]、[106]、[107]、マクロファージの抗ウイルス活性をサポートする[108]、ジスルフィド結合を形成し、細胞表面上のACE2受容体へのウイルスの結合を減少させる可能性がある[109]、[110]、[111]。データはまた、外因性グルタチオン(GSH)がウイルスのライフサイクルの非常に後期の段階を妨害することによって、HSV-1のようなウイルスの複製を阻害しうることを示唆している[100]。
グルタチオン前駆体(N-アセチルシステイン[NAC]およびαリポ酸)および関連する抗ウイルス効果を有する PO/IV グルタチオンを用いて NF-κB およびサイトカイン形成を阻害する無作為化比較試験を、炎症を低下させることが科学的に証明されている Nrf2 活性化剤(クルクミン、スルフォラファングルコシノレート)の評価とともに実施する必要がある [86], [87]。
COVID-19肺炎に伴う呼吸困難を迅速に緩和するグルタチオン療法の有効性は、最近、HorowitzとFreemanによって査読付きジャーナルで報告された[101]。Nrf2経路はNF-κB経路やグルタチオンの欠乏と同様に炎症[88]において極めて重要な役割を果たしているため、COVID-19の効果的な治療法を見つけるための多面的なアプローチの一環として、これらを探索する必要がある。これは、介護施設の高齢者や COVID-19 の危険因子が確立されている人々を含む最も脆弱な集団において特に重要であろう。
敗血症誘発性 DIC(播種性血管内凝固症)および呼吸不全の治療
COVID-19感染による死亡率の高さは、凝固パラメーターの異常、血栓性イベント、敗血症誘発性 DIC(播種性血管内凝固症)を伴うDダイマーの上昇と関連している[33], [34]。抗凝固療法はCOVID-19による死亡率を減少させることが発表されているため、特に特定の敗血症誘発性凝固症(SIC)基準を満たす人工呼吸器使用患者において、ヘパリンと抗凝固療法を併用する無作為化比較試験が緊急に必要である[89], [102], [103]。
抗凝固療法は、インフルエンザウイルスA H1N1による二次性ARDS患者の生存率を高めることが以前に示されており、Dダイマー値が正常値の2倍以上の高値であれば、病院での静脈血栓塞栓症のリスクを予測できる [104], [105].アセタゾラミドの使用も、ヘパリンの有無にかかわらず検討する必要がある。
アセタゾラミドは換気を増加させることで動脈性酸素飽和度(SaO2)を改善することができるが、それは呼吸の仕事とコストの増加と関連している。したがって、シルデナフィルはアセタゾラミドと併用することで、肺高血圧と間質性浮腫を減少させ、換気と灌流のマッチングを改善することでSaO2を増加させることも可能である [91]。
仮説の結果/結論と意味合い
COVID-19への曝露は、世界各国で高い症例死亡率を示している[92]。米国疾病対策予防センター(CDC)は、世界で数十万人の死亡者が発生すると推定しており[93]、WHOは世界の死亡率を5%以上と推定している[12]ので、予防は特に重要である。そのため、低リスクで高い可能性を持つ革新的な解決策には、科学的な検証が必要である。COVID-19の重篤な合併症に対処するために、予防、診断、治療の3つの部分からなる計画が提案されている。
有効性が確認された症状質問票を用いた症状のデジタルモニタリングによる早期曝露と治療への反応を臨床的に診断すること
イベルメクチンの日局投与またはパルス投与、その他の薬物療法および健康的な免疫反応をサポートする栄養療法による予防
NF-κBをブロックし、Nrf2経路を活性化する抗炎症療法による治療、およびCOVID-19肺炎および DIC(播種性血管内凝固症)を伴うARDSに対処する新規治療(呼吸器サポートを必要とする患者に対するアセタゾラミドおよびシルデナフィルの有無にかかわらず抗凝固療法を含む)が挙げられる。
これら3つの仮説的な広範な臨床介入は、ウイルス性肺炎およびARDSを有する患者に有益であるとする医学文献で発表されているが、COVID-19に対する効果については限られたデータしか得られていない。これらの仮説を一連の無作為化比較試験で検証し、COVID-19に関連する曲線を平坦化し、現在のところ高いレベルの罹患率と死亡率を減少させる能力を評価することが急務であると考えている。