COVID-19: The Emerging Immunopathological Determinants for Recovery or Death
www.ncbi.nlm.nih.gov/pmc/articles/PMC7736111/
Tanveer Ahmad,1,* Rituparna Chaudhuri,2 Mohan C. Joshi,1 Ahmad Almatroudi,3 Arshad Husain Rahmani,3 and Syed Mansoor Ali4
要旨
SARS-CoV-2感染時の宿主免疫系の高活性化は、COVID-19患者の死因の第一位である。また、軽度・中等度の症状を呈し、回復に成功した患者は、機能的でよく制御された免疫応答を示すことが明らかになっている。
一方、初期のインターフェロン反応の遅れは重篤な病状と関連しており、免疫病理学的な悪化への転換点となり、COVID-19患者ではしばしば死に先行することがある。さらに、COVID-19の適応免疫応答は不均一であり、十分に理解されていない。同時に、いくつかの研究では、重症患者および重症患者における活性化されたT細胞およびB細胞応答、およびSARS-CoV2特異的抗体の存在が示唆されている。
したがって、この問題と宿主の免疫機能/機能不全に関与する分子経路を理解することは、効果的な治療法を考案するために不可欠である。この包括的なレビューでは、新たな免疫病理学的決定要因と宿主細胞免疫系によるウイルス回避のメカニズムについて論じている。過去の呼吸器ウイルスから得られた知見と、SARS-CoV-2に関する新たな臨床的・分子的知見を用いて、疾患の転帰を決定する可能性のある宿主の自然免疫応答と適応免疫応答の全体的な理解を提供しようとしている。
本研究では、COVID-19の様々な段階でのT細胞の機能低下・機能低下に関与していると考えられる機序を分子レベルで明らかにした。
キーワード
COVID-19,SARS-CoV-2,リンパ球減少症、T細胞応答、ウイルス回避、インターフェロン応答
序論
中国・武漢からの原因不明の重症肺炎症例の報告を受けて、複数のグループは、現在のCOVID-19パンデミックの原因となった病原体をSARS-CoV-2ウイルスと同定した(Chan et al 2020;Huang C. et al 2020;Zhu et al 2020)。ここ数ヶ月間、SARS-CoV-2の感染性、免疫原性、および病原性に関連する基礎となる分子機構を理解するための研究努力が前例のないほど急増している。SARS-CoV-2が以前にSARS-CoVが利用していた受容体と宿主細胞のセットを利用していることが明らかになったため、ウイルスの回避、宿主免疫応答、および免疫原性発症に関与する分子ネットワークを理解するために、様々な疾患モデルが開発された。複数の因子および経路は、治療標的として有望な可能性を示している他のコロナウイルスからの以前の知見に基づいて既に知られている(Tay et al 2020)。しかし、非常に効果的な治療法を開発するためのより包括的な理解はまだ出現しておらず、それは、宿主細胞におけるウイルスの伝播および疾患の進行の様々な段階でのより良い分子の詳細を要求している。
感染の初期の軽度な段階(第1段階)では、ウイルスは上気道(鼻細胞、咽頭と喉頭の一部の領域)に限定されたままで、自然免疫反応(もしあれば)が低レベルで誘発される。この無症状の状態は、ウイルスが伝導性気道や末期気道に伝播するまでの数日間(一般的には1~2日)続く(第2期)。
この段階では、最適ではあるが制御された適応免疫応答および自然免疫応答が感染との戦いに役立つ。回復した患者からのウイルスクリアランスの成功は、免疫調節分子および中和抗体とともに、適切な適応免疫細胞の存在を示している(Cao, 2020; Tay er al)。) しかしながら、この段階での適応免疫応答の障害は、自然免疫系(炎症性マクロファージおよび好中球)の過剰活性化に伴い、COVID-19患者の約20%において重篤な疾患症状を引き起こす可能性がある(Wu and McGoogan, 2020)。
死亡した患者からの最近の臨床および病理組織学的データは、肺への炎症性細胞の浸潤を伴う適応免疫機能不全および前炎症反応の亢進を示唆している(ステージIII)。さらに、疾患の重症度は、プロ炎症性IL-6のレベルの上昇および好中球/リンパ球比の上昇と正の相関を示した(Liu T. et al 2020;Tan L. et al 2020b;Tan M. et al 2020c)。COVID-19患者の3〜17%の間で、過炎症(活性化された自然免疫細胞の過剰な浸潤およびサイトカイン放出症候群)およびリンパ球減少症(CD4+、CD8+およびB細胞のレベルの低下)の結果として、急性呼吸窮迫症候群(ARDS)を発症した(Gibson et al 2020)。これらの変化は、細胞死および組織破壊に続き、最終的には、これまでの利用可能なデータに基づいて、ICU患者の67〜85%において、気道崩壊、多臓器不全および死に至る(Wu and McGoogan, 2020; Xu Z. et al 2020; Zhang H. et al 2020)。
ここでは、宿主細胞によって生成された免疫応答の様々な段階を通して、回復の成否に関与する分子決定因子について議論する。我々は、重篤な症状を発症した患者に対するCOVID-19患者の免疫学的軌跡を、ウイルス感知および回避機構、および自然免疫系および適応免疫系の時空間的な役割に重点を置いて構築した。さらに、COVID-19患者におけるサイトカインストームとARDSの細胞・分子レベルでの詳細を明らかにした。
自然免疫核酸センシングとウイルス回避機構
抗ウイルスシグナル伝達における核酸センサー
SARS-CoV-2は、前身のSARS-CoVと同様にスパイク(S)タンパク質を用いて、表面に発現するACE2受容体と結合して真核細胞内に侵入する。結合に伴い、Sタンパク質のプライミングは、膜発現プロテアーゼTMPRSS2またはカテプシン、エラスターゼ、およびフーリン(これはSARS-CoV-2に特異的である)などのエンドソームプロテアーゼによって行われ、ウイルスと宿主細胞膜との間の融合を誘導する(Hoffmann et al 2020; Shang et al 2020; Walls et al 2020; Wang Q. et al 2020)。これらのよく調整された事象に続いて、ウイルス遺伝物質は、二相性の方法で放出される、すなわち、形質膜との直接融合によって、またはSARS-CoVについて以前に示されたように、内分泌経路をたどることによって放出される(Belouzard et al 2012;Shang et al 2020;図1)。SARS-CoV-2に直接感染する細胞型のリストが増加しており、その中には、主要な標的としての肺胞上皮II型細胞(ATII)および肺の気管支上皮細胞、鼻腔の杯細胞、マクロファージ、食道細胞、膵β細胞、および消化管上皮細胞などの様々な組織を覆う他の細胞型が含まれる(Li M.Y. et al 2020;Sungnak et al 2020)。これらの細胞型はすべて、より低い発現量ではあるが、Sタンパク質標的受容体ACE2を発現する。しかしながら、ATII細胞は、様々なウイルスタンパク質の感知に関与するSARS-CoV-2と同様に、SARS-CoV-2の優勢な標的であり続けている。
図1 SARS-CoV-2の宿主細胞への侵入モデルの提案
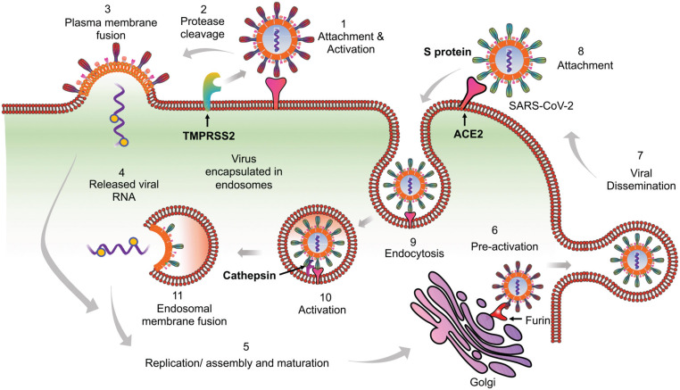
SARS-CoVに関する文献や最近のSARS-CoV-2に関する知見をもとに、SARS-CoV-2がACE2発現細胞に侵入するための2つの異なるメカニズムを提案する。
- (1) 最初にウイルスは細胞膜を利用して侵入する可能性がある。最初のステップは、ウイルスのスパイクタンパク質と宿主細胞の形質膜上に発現するACE2受容体との結合である。
- (2) ACE2との結合は、TMPRSS2のような膜結合型プロテアーゼによるSタンパク質の切断に続いて行われる。TMPRSS2は、膜結合したウイルスをS1/S2境界およびS2’サイトで切断する。
- (3) これにより融合機構が活性化され、ウイルス膜は宿主細胞の細胞膜と融合する。
- (4) これにより、ウイルス核カプシドが細胞質に放出される。
- (5) ウイルスの複製・集合・成熟は細胞質内で行われる。
- (6) SARS-CoV-2は、播種前には、ゴルジ装置内でフーリンプロテアーゼによる予備活性化を受けることもある。
- (7) 完全に成熟し、予備活性化されたSARS-CoV-2は、最終的にエキソサイトーシスによって宿主細胞から播種される。その後の感染サイクルの間に、ウイルスは、細胞膜または(8-11)より可能性の高い内細胞性の侵入経路のいずれかを利用することができる。細胞内侵入モードでは、
- (8)ACE2との接着後、
- (9)ウイルスはエンドサイトーシスされ、
- (10)カテプシンのようなエンドソームプロテアーゼによってS2’領域で処理され、膜融合が活性化される。
- (11) 最後に、ウイルス膜とエンドソーム膜の融合によりウイルス成分が細胞質に放出され、このサイクルが繰り返される。
ヒト感染コロナウイルス(CoV)を対象とした先行研究では、これらのウイルスの様々な成分を認識して初期の抗ウイルス反応を開始するために、核酸感知(NAS)経路が重要な役割を果たしていることが明らかになっている。一方、初期の抗ウイルス応答を阻止または遅延させるために、強力な阻害機構がCoVによって開発されている(Rose et al 2010; Adedeji et al 2013)。これらの阻害シグナルは、CoVsの伝播を可能にするために、様々な宿主防御経路に影響を与える。いくつかの阻害性シグナルは、細胞死経路を活性化して、強固な炎症前駆状態を誘導することさえある。試験管内試験細胞培養、動物モデル、およびSARS-CoV感染からの回復に成功した患者の研究から、ウイルス-宿主相互作用に関与するシグナル伝達分子に関する詳細な分子的知見が得られており、SARS-CoV-2における同様のプロセスを理解するためのモデルとなる可能性もある(Totura and Baric, 2012)。
細胞質への放出後、SARS-CoVおよびSARS-CoV-2のssRNAウイルスゲノムは、二本鎖RNA(dsRNA)の中間状態を介して複製に進む(Adedeji et al 2012;Cascella et al 2020)。ssRNAおよびdsRNAの両方が、病原体認識受容体(PRRs; Leiva-Juárez et al 2018)によって認識される病原体関連分子パターン(PAMPs)として作用する。ATII細胞は、Toll様受容体(TLR)サイクリックGMP-AMP合成酵素(cGAS);およびレチノイン酸誘導性遺伝子I(RIG-I)様受容体(RLR)のような重要な内因性PRRを発現することが知られている。これらのうち、細胞質RLRおよびエンドソームTLR(TLR3,TLR7,TLR8,TLR9)は、SARS-CoVsからのRNAを感知して抗ウイルス応答を開始する際に顕著な役割を有する(Lester and Li, 2014; Chan and Gack, 2016)。
RLRは、RIG-I、メラノーマ分化関連遺伝子5(MDA5)および最近発見された可能性の高いATP依存性RNAヘリカーゼDHX58(LPP2としても知られている)を含むセンサータンパク質の複合体である(Jiang et al 2011; Leiva-Juárez et al 2018)。RIG-Iは、5′-PPP RNAおよび短いdsRNAに結合し、一方、MDA5は、より長いRNA断片に結合する(Huang et al 2014)。病原性RNAの結合は、RIG-IおよびMDA5のコンフォメーション変化を誘導し、その後、翻訳後修飾がこれらのタンパク質を活性化する。重要なことに、RIG-Iは、K172残基でのポリユビキチン化を介してE3リガーゼ三叉型モチーフタンパク質25(TRIM25)によって活性化される(Sanchez et al 2016);MDA5は、AIP4/ITCH(Atrophin 1 Interacting Protein 4;ITCHとも呼ばれる)の助けを借りて、ポリ(rC)結合タンパク質2(PCBP2)によって媒介されるポリユビキチン化によってタンパク質分解的に不活性化される(You et al 2009)。LGP2は、RIG-1およびMDA5によるウイルスセンシングを強化するためのファシリテーターとして作用する(Satoh et al 2010)。活性化されたRIG-1とMDA5は、中央に配置されたミトコンドリア抗ウイルスシグナル伝達タンパク質(MAVS)を介して下流のシグナル伝達カスケードに乗り込み、最終的にはIRF3/IRF7転写因子の協調的な活性化につながる(図2)。活性化されたIRF3/7は、核に転座し、West et al 2011)およびRehwinkelおよびGack(2020)によってレビューされたIFN刺激応答エレメント(ISRE)を介してIFNの発現を誘導する。したがって、中央に配置されたMAVSの活性化は、主にNF κBシグナリングを介して分泌されるプロ炎症性分子によって、IRF3およびIRF7経路を介したIFN遺伝子の発現および他の自然免疫細胞のリクルートを誘導する(図2)。同様に、内因性TLR経路の活性化は、NF κB経路を介したIFNタイプI、タイプIII、およびより具体的にはプロ炎症性分子の発現を誘導する(Gong et al 2020)。IRF3/7またはNF κB経路のいずれかをブロックすることは、宿主細胞に有害な影響を与え、それはウイルスの伝播を不変に可能にする(Lazear et al 2013; Schmitz et al 2014; Totura et al 2015; ChiangおよびLiu 2019)。動物実験では、TLRシグナル伝達を欠損したマウスは、SARS-CoV感染中にロバストな感染および重篤な病理学的状態を示す。TLR3およびTLR4ノックアウトマウスは、肺損傷に関連するウイルス力価の増加およびより高い死亡率を示した(Totura et al 2015)。TLRシグナル伝達の下流で作用する骨髄分化一次応答88(MYD88)をノックアウトしたマウスは、90%の死亡率で肺実質の損傷の増加を示した(Sheahan et al 2008)。逆に、TLR7,TLR8,およびTLR9による内因性TLRシグナル伝達の活性化、または細胞表面に発現するTLR4シグナル伝達の活性化は、SARS-CoV感染動物におけるウイルス伝播の有意な減少、肺損傷の減衰、および生存率の増加と関連していた(Zhao er al)。 このように、これらの知見は、初期の防御的抗ウイルス反応を実装し、ウイルスクリアランスを助ける上で、これらの分子センサーが不可欠な役割を果たしていることを示唆している。
図2 宿主細胞の抗ウイルス応答に関与する分子およびシグナル伝達経路
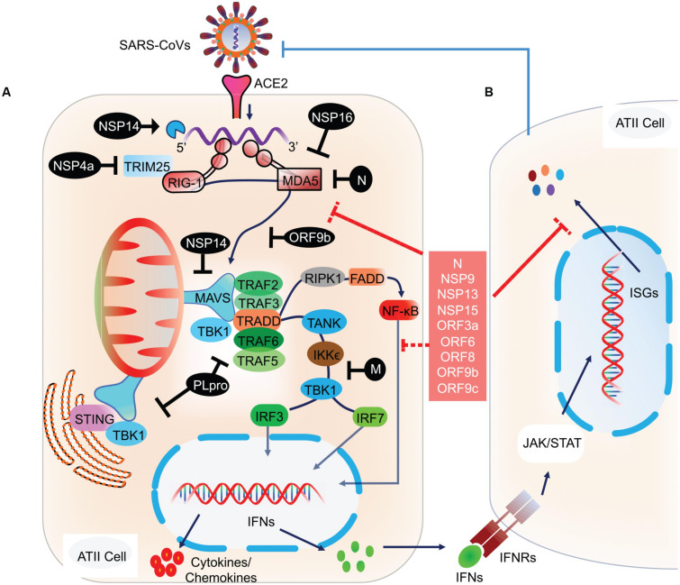
(A) ウイルス内容物が細胞質に放出された後、ウイルスRNAはRIG-IやMDA5などの宿主細胞NASによって認識される。対抗防御は、NASによる感知からウイルスRNAを遮蔽するために、ウイルスタンパク質、NSP14およびNSP16によって提供されるかもしれない。しかし、正常に認識された場合、RIG-IおよびMDA5は活性化され、その後、ミトコンドリア上に位置する中央に配置されたMAVSを活性化する。MAVSは、TRAF2/3/5/6をさらにリクルートする分子アダプターとして機能する。TRAFのタイプとMAVSとの関連付けは、下流シグナル伝達のタイプ、すなわちIRF3/7および/またはNF-κBを決定するために示唆される。MAVS接合部では、TRAF5/6とTRADD、FADD、およびRIPK1との関連付けはNF-κBを活性化する。一方、MAVSとSTINGとの結合は、TRAF2/3との相互作用によりTBK1およびIKKεを活性化し、最終的にはIRF3およびIRF7の活性化をもたらす(Chen et al 2014)。活性化されたIRF3,IRF7,およびNF-κBは、核に転座し、IFN遺伝子の発現を誘導する。
B)転写されたIFNは、宿主細胞だけでなく、他の自然免疫細胞上に存在するそれぞれのIFN受容体(IFNR)に作用し、このようにして、自己分泌およびパラクリンの両方の方法でシグナリングする。IFNRを介したシグナル伝達は、JAK/STATシグナル伝達経路を活性化し、その後、ISGの発現を誘導する。これらの分子イベントは、最近レビューされた(RehwinkelおよびGack 2020)。転写されたISGは、最終的にはウイルスの伝播を阻害する。しかしながら、SARS-CoVおよびおそらくSARS-CoV-2は、NASシグナル伝達経路の様々な段階で干渉するための対防御機構を開発した。NSP4aは、RIG-I活性化に必要なTRIM25を阻害する。Nタンパク質はMDA5を阻害し、NSP14はMAVSを阻害し、ORF9bはRIG-I/MDA5活性化複合体を阻害し、Mタンパク質はTANK、IKKε、TBK1シグナルを阻害し、PLproは様々なRIG-I、MDA5,MAVs下流のシグナル伝達ステップを阻害する。NASおよびIFNシグナル伝達を阻害する様々なステップで作用するSARS-CoV-2タンパク質を赤枠で示す。
NAS、核酸センサー;RIG-I、レチノイン酸誘導性遺伝子I;MDA5,メラノーマ分化関連タンパク質5;TRAF、TNF受容体関連因子;STING、インターフェロン遺伝子のER関連刺激因子;FADDD、FAS関連死ドメインタンパク質;IRF、インターフェロン調節因子(IRF3/7)。TRADDD、TNFR1-関連死ドメイン蛋白質;IKKε、IKκBキナーゼ-ε;RIPK1,受容体相互作用蛋白質1;TANK、TRAFファミリーメンバー関連NF-κBアクチベーター;TBK1,TANK結合キナーゼ1;ISG、インターフェロン刺激遺伝子;TRIM25,三叉神経モチーフ含有蛋白質25。
これらの分子センサーの役割は、SARS-CoV-2ではまだ包括的に研究されていないが、最近のいくつかの報告から、これらのセンサーが感染時の初期抗ウイルス反応にも同様に関与していることが示唆されている。免疫インフォマティクスの手法により、内因性TLR7/8経路を介したシグナル伝達を媒介する可能性のある分子PAMPとして、ssRNAであるSARS-CoV-2ゲノム断片が広範囲に存在することが明らかになった。さらに、SARS-CoV-2ゲノムでは、SARS-CoVと比較してPAMP(ゲノム断片)の数が多いことが明らかになっており、SARS-CoV-2が比較的頑健な免疫応答を駆動する可能性が示唆されている(Moreno-Eutimio et al 2020)。ICU患者由来のPBMCsにおける単一細胞RNA-sequencing(scRNA-seq)研究は、RIG-I、MDA5,およびLPP2を含むNAS経路遺伝子の広範なアップレギュレーションを明らかにし、これらの細胞におけるSARS-CoV-2の浸潤を示唆している(Wei er al)。 しかしながら、これらの細胞において、ウイルスRNAの有無を調べるための直接的なアッセイは行われなかった。これらの知見は、SARS-CoV-2が、PBMCに直接感染しないことを示唆しているかもしれず、したがって、NAS遺伝子のこのアップレギュレーションは、後述するように、ほとんどの場合、抗体依存性増強(ADE)によるウイルスの受動的な取り込みを介しているかもしれない。同様に、内因性TLR7およびTLR8は、MAVS、IRF3およびIRF7の発現の増加とともにアップレギュレートする。このようなNAS経路遺伝子の発現亢進の機能的重要性は不明であり、今後の研究により、SARS-CoV-2に対する抗ウイルス反応におけるこれらの分子センサーの具体的な役割が明らかになると考えられる。
SARS-CoVsが採用する回避機構
ヒトに感染するすべての SARS-CoV は、宿主細胞による認識を回避するために複数のメカニズムを進化させていることが知られている。新たな証拠は、宿主細胞の免疫応答を阻害または遅延させるために、SARS-CoV-2にも同様のメカニズムが採用されていることを示唆している。これらのメカニズムのいくつかを以下に述べる。
核酸センシングおよびダウンストリームシグナル伝達への干渉
SARS-CoVに関するこれまでの研究は、NAS経路および下流のシグナル伝達における複数のステップを阻害するスマートな戦略を明らかにした(Rose et al 2010; Adedeji et al 2013; ChanおよびGack 2016)。前述したように、TRIM25媒介のユビキチン化はRIG-Iを活性化する。一方、SARS-CoVのNタンパク質は、TRIM25と結合し、それによってRIG-Iとの関連を阻止し、したがって活性化する。ユビキチンが簒奪したRIG-Iは抗ウイルス応答をマウントすることができず、それによってIFN-β産生を無効にする(Hu et al 2017)。Nタンパク質はまた、IRF3と直接相互作用することによってIFNシグナル伝達に拮抗し、それによってそのリン酸化およびそれに続く核内移動を阻害する(Kopecky-Bromberg et al 2006; Kopecky-Bromberg et al 2007)。同様に、Mタンパク質は、RIG-I、TBK1,IKKε、およびTRAF3活性化複合体の形成を阻害することにより、IRF3/IRF7シグナル伝達を阻害する(Siu et al 2009)。宿主細胞上の複数の経路で作用し、Nsp1は、IFN-βプロモーター活性およびSTAT1リン酸化を阻害し、これにより、様々な抗ウイルスインターフェロン刺激遺伝子(ISGs; Wathelet et al 2007)の発現の減少をもたらした。Chen et al 2014)は、パパイン様プロテアーゼ(PLpro)がTRAF3,TBK1,IKKε、STING、およびIRF3と直接結合し、それ故に下流のIRF3/IRF7シグナル伝達を阻害することを示した。別の研究では、Devaraj et al 2007)は、PLproがIRF3のリン酸化とそれに続く核内移動を阻害することを示した。ORF3b、ORF6,ORF8a、およびORF8bもまた、IRF3リン酸化およびそれに続く核内転座の阻害において顕著な役割を果たす(Kopecky-Bromberg et al 2006;Freundt et al 2010;Wong et al 2018)。ORF9bは、ミトコンドリアと関連し、ダイナミン関連タンパク質1(Drp1)の分解を誘導し、それによりミトコンドリア機能を変化させ、MAVSを小さなパンクタに隔離することが示された。さらに、ORF9bはユビキチンリガーゼPCBP2およびAIP4 E3のリクルートと関連しており、これはMAVSのユビキチン化および最終的にはその分解を引き起こし、その結果、IFN-β産生を阻害していた(Shi et al 2014)。このように、NASシグナル伝達に関与する複数のタンパク質と結合することにより、SARS-CoVはIFNシグナル伝達およびISGのような保護分子の合成に拮抗する。
最近の研究では、SARS-CoV-2タンパク質と複数の宿主細胞NASシグナル伝達分子および下流のIFNシグナル伝達との相互作用も実証されている。Gordon et al 2020)による広範なプロテオーム研究では、複数のSARS-CoV-2タンパク質と宿主細胞タンパク質の相互作用が示された。26個のSARS-CoV-2タンパク質のプロテオームマップは、332個のウイルスタンパク質が宿主細胞と相互作用することを予測した。その中で、Nsp9,Nsp13,Nsp15,ORF3a、ORF9b、ORF9cは、下流のNASシグナル伝達、IFN応答、NF-κB経路のタンパク質と相互作用していた。同様に、Nsp5はHDAC2と相互作用し、これは、したがって、IFNシグナル伝達および炎症性応答の制限に関与している可能性があるが、これらのタンパク質の具体的な機能的役割は決定されなかった(Gordon et al 2020)。2つの最近の研究では、これらのタンパク質のいくつかの機能的関連性が試験管内試験で試験された。最初の研究では、Li J.Y. et al 2020)は、HEK293細胞における抗ウイルス応答に対するORF6,ORF8およびNタンパク質の効果を試験し、これらのタンパク質がIFN-βおよびNF-κBシグナリングを阻害することを見出した。同様に、Yuen et al 2020)は、ORF6のIFN拮抗効果が、インターフェロン誘導性核輸出複合体(NUP98-RAE1)との関連によるものであることを示した。さらに、Nsp13,Nsp14,およびNsp15もまたIFN応答に拮抗し得ることが示されたが、そのメカニズムは探索されなかった(Yuen et al 2020)。
IFN産生経路への干渉に加えて、SARS-CoVは、宿主細胞応答を修飾する他の複数のメカニズムを進化させた。ウイルスRNAは保護されておらず、細胞の分解に開放されている;しかしながら、いくつかのRNAウイルスは、宿主による認識を回避するためにキャッピングプロセスを進化させた。SARS-CoVでは、Nsp16は、RNAの分解を保護し、MDA5による感知を防ぐために、RNAの5′末端でリボース2′-O-メチル化を提供する(Züst et al 2011)。同様に、Nsp14は、N7メチルトランスフェラーゼ活性を有し、RNAの5′末端をメチル化した(Chen et al 2009)。関与する他のSARS-CoVタンパク質には、-Nsp4aは、PKR媒介抗ウイルスシグナル伝達を阻害することにより、ストレス顆粒形成を防止する(Rabouw et al 2016)。SARS-CoV-2のNタンパク質は、ストレス顆粒の調節に関与するタンパク質と相互作用することも知られている(Gordon et al 2020)。SARS-CoV感染細胞における電子線トモグラフィー研究は、ウイルスの複製を組織化するためのERに由来するユニークな複製ネットワークを明らかにすると同時に、ウイルスRNAを宿主NASによる認識から隠すことを明らかにした(Knoops et al 2008)。他のRNAウイルスもまた、二重膜小胞(DMV)と複製オルガネラを形成してNASへのアクセスを阻止することで、センシングを回避する同様の戦略を開発している(Blanchard and Roingeard, 2015)。
宿主細胞生合成経路の阻害と細胞死の変調
SARS-CoVおよびSARS-CoV-2はともに、宿主細胞の認識を回避するために複数の阻害機構を進化させてきた。宿主の転写・翻訳機構を阻害することにより、保護IFNの生合成が阻害され、宿主細胞のアポトーシスの早期活性化が遅延する。SARS-CoVのNsp1は、リボソーム40sサブユニットの負荷を阻害し、宿主細胞のタンパク質翻訳を阻害する。さらに、Nsp1は、ウイルスRNAを温存しながら宿主細胞のRNAを特異的に分解する(Huang et al 2011; Tanaka et al 2012; Lokugamage et al 2015)。SARS-CoV-2のNタンパク質はまた、宿主生合成タンパク質であるLa関連タンパク質1(LARP1)と相互作用する。この相互作用は、SARS-CoV-2の伝播のために宿主細胞のタンパク質合成を停止するために必要なシグナルとして機能する可能性がある(Gordon et al 2020)。
SARS-CoVのパパイン様プロテアーゼは、p53と直接相互作用し、その分解を誘導し、それにより、翻訳を妨害し、感染細胞の早期アポトーシスを遅らせる可能性がある(Yuan et al 2015; Ma-Lauer et al 2016)。SARS-CoV Sタンパク質はまた、翻訳開始因子eIF3fと相互作用し、その核輸入を阻害することにより宿主細胞の翻訳を阻害する(Xiao et al 2008)。他の呼吸器ウイルスからの研究では、初期のアポトーシスを活性化する細胞がウイルスのさらなる拡散を防ぐのに対し、この経路をうまく阻害するウイルスは強力な感染性を示すことが示されている(OrzalliおよびKagan 2017)。サイトメガロウイルス(CMV)は、BaxやBcl-2などのアポトーシス調節タンパク質を阻害することにより、宿主細胞内での複製に成功するために、このメカニズムに明確に依存している(Çam er al)。 しかし、SARS-CoVやSARS-CoV-2が初期のアポトーシス抑制に直接関与しているかどうかはまだ検証されていないが、これらのウイルスが増殖・伝播に成功した後に宿主細胞死を誘導していることは明らかである。
SARS-CoVのNsp7aは、試験管内試験では細胞内で生存タンパク質Bcl-Xと相互作用してアポトーシスを誘導することが示されている(Tan et al 2007)。同様に、ORF3aはゴルジ体の断片化を引き起こし、アポトーシスを誘導する(Waye et al 2005; Freundt et al 2010)。これに加えて、ORF3aはまた、主要なネクロプトーシスタンパク質RIPK3と相互作用し、活性化することにより、ネクロプトーシス細胞死を暗示している(Yue et al 2018)。細胞死経路におけるその役割のために、SARS-CoV-2のORF3aもまた、この文脈で探索された。このタンパク質は、同様に、カスパーゼ8依存性経路を活性化することにより、HEK293細胞においてアポトーシスを誘導した(Ren et al 2020)。
興味深いことに、SARS-CoV-2のORF3aは、SARS-CoVと比較して、いくつかの細胞株において比較的低いアポトーシスを誘導するという結果は、このメカニズムがSARS-CoV-2の伝播に早期の優位性を提供し得ることを示唆している。さらに、SARS-CoV-2のプロテオームマップは、Nsp12とRIPK1との相互作用を予測し、このウイルスタンパク質が宿主細胞のアポトーシスおよび壊死性細胞死の調節にも関与している可能性を示唆している(Gordon et al 2020)。しかしなが et al 25の細胞株を培養した研究では、SARS-CoV-2は2つの細胞のみに細胞病的効果を示すことが示されており、これらの2つの関連ウイルスの間には、宿主細胞死の経路に干渉する性質の違いが存在する可能性があることを示している(Chu et al 2020)。したがって、SARS-CoV-2が宿主細胞死経路を修飾することによるより良い分子的洞察を提供するために、より包括的な研究が必要であり、それはまた、治療のための新たな機会を開く可能性がある。
これらの初期の観察に基づいて、SARS-CoV-2が宿主のNAS、IFN、生合成、および細胞死経路に干渉して初期の免疫応答を阻害し、その結果、後述するように、基礎となる免疫疾患の発症に寄与していることが明らかになりつつある。これらの詳細を簡単にするために、ここでは、様々なSARS-CoVおよびSARS-CoV-2タンパク質とその宿主細胞相互作用タンパク質の役割をまとめ、表形式で示した(補足表1)。
COVID-19における自然免疫応答
機能的な自然免疫応答
宿主細胞の感知経路からのウイルスの成功した回避と、これらの阻害効果を克服するために宿主細胞が開発したカウンターメカニズムとの間のバランスが、初期の免疫応答が発生し得るかどうかを決定する(Liang et al 2020)。ほとんどの研究では、CoVsが採用した回避機構が成功していることが指摘されているが、新たなエビデンスは、適切な初期抗ウイルス反応が起こりうることを示唆している(Park and Iwasaki, 2020)。早期の抗ウイルス反応は、無症状または軽度の症状を呈してウイルスを除去することに成功したCOVID-19患者の大多数(約80%)におけるウイルスの伝播を制限する鍵を握っているかもしれない。COVID-19に関する最近の研究を考慮して、ここでは自然免疫応答の詳細な分子的・臨床的理解を提供する。特に、これらの免疫応答がどのようにして疾患からの回復や免疫病理学的状態の発現を決定づけるのかについて議論している。
インターフェロン応答
初期の抗ウイルス反応を開始することにより、IFNsおよびISGを介したシグナル伝達は、ウイルスクリアランスに不可欠であり、病理学的状態の発生の障害となる。いくつかの試験管内試験および動物実験により、SARS-CoV感染におけるこれらのシグナル伝達経路の中心的役割が確立されている。STAT1ノックアウトマウスをSARS-CoVに感染させたマウスは、ウイルスの複製および伝播の増加によってもたらされる重篤な疾患症状を示し、さらに生存率の低下と関連していた(Hogan et al 2004;Frieman et al 2010)。同様に、SARS-CoVの伝播は、IFNR1-/-およびILFNLR1/-ダブルノックアウトマウスにおいて増加し、抗ウイルス応答の緩和におけるこれらのシグナル伝達経路の本質的な役割を示唆している(Mahlakõiv et al 2012)。
最近の試験管内試験での研究では、SARS-CoV-2によって生成されたIFN応答が、その前身と比較してより強固なものであることが指摘されている。SARS-CoV-2に感染した上皮細胞は、SARS-CoVに感染した細胞よりも優れたIFN応答を示した。このIFN応答は、その後の抗ウイルスISGの発現を伴うSTAT1リン酸化依存性であった(Lokugamage et al 2020)。これらの試験管内試験での知見に沿って、8人のCOVID-19患者から採取された気管支肺胞ラバージ液(BALF)からのトランスクリプトームデータは、約83個のISGの広範なアップレギュレーションを明らかにし、SARS-CoV-2に対して生成されたロバストなIFN応答を示唆している(Zhou Z. er al)。 さらに、Ziegler et al 2020)による研究は、ACE2がまた、いくつかの呼吸器上皮細胞においてISGの一種として作用し得ることを示唆した;これは、SARS-CoV-2に対する実行可能な治療オプションとしてACE2モジュレーターを使用することを示唆しているかもしれない。
COVID-19患者の最近の臨床データに基づいて、軽・中等症患者は最適な初期IFN反応を有するべきであると推察できる。一方、IFN反応が弱かったり遅かったりすると、炎症亢進状態を誘発し、広範囲のウイルス伝播を可能にする転換点となる可能性がある。動物モデルを用いた以前の研究では、早期IFN応答がウイルスの伝播を抑制し、病状を減衰させる決定因子であることが示されている(Channappanavar et al 2016)。これに伴い、最近の研究では、軽症/中等症のCOVID-19患者が機能的なI型およびIII型のIFN応答を有することが示されている。具体的には、軽度/中等度の症状を有する患者は、血漿中のIFNA転写物およびタンパク質の十分なレベルを有する。これらの患者のサブセットにおける検出可能なIFNレベルの存在はまた、下流のシグナル伝達受容体およびIFNAR1,JAK1,TYK2のような分子の発現と関連しており、機能的なIFN応答を示唆していた。しかしながら、IFNBのmRNAおよびタンパク質は検出されなかったが、IFN-λの最適レベルはmRNAおよびタンパク質レベルの両方で検出された。予想通り、I型およびIIII型IFNのレベルは、ウイルス負荷および疾患の重症度と正の相関を示した(Hadjadj et al 2020)。
感染状態の減衰における初期IFN応答の重要な役割と一致して、別の研究は、IFN-βまたはIFN-λで前処理した細胞が、ウイルスコピー数を有意に減少させることにより、SARS-CoV-2感染に対する抵抗性を示すことを見いだしている。同様に、IFN-βまたはIFN-λのいずれかで前処理した3D培養オルガノイドは、ウイルス感染の減少をもたらした。IFNAR1またはIFNLR1のいずれかについて枯渇した細胞は、SARS-CoV-2感染細胞数の全体的な増加を有し、ウイルス伝播の減衰におけるIFNシグナル伝達の不可欠な役割を示唆した(Stanifer et al 2020)。さらに、IFN応答は、高齢者と比較して若年者では十分であり、これは、高齢者の感染リスクが高いことを部分的に説明する可能性がある(Wei et al 2020)。さらに、糖尿病のような併存疾患(IFN応答の障害と関連する疾患)を有する人々は、SARS-CoV-2の感染を受けやすく、これは、ウイルスの早期クリアランスにおけるIFNシグナル伝達の重要な役割をさらに示唆している(Erener, 2020)。しかしながら、軽度/中等度患者におけるIFN応答の包括的かつ縦断的な分析は、疾患および回復を通してこの免疫応答の機能的帰結を理解するために必要である。全体として、SARS-CoV-2によって誘導された比較的良好なIFN反応およびISG発現を考慮すると、この機能的な免疫反応が、以前のSARS-CoVおよびMERS感染と比較してCOVID-19で見られた死亡率が比較的低い理由であると主張することができる(Meo et al 2020)。しかしながら、これらの初期の所見はさらなる証明を保証するものである。
肺胞上皮細胞(ATII)による初期免疫応答
活性化された肺胞マクロファージ(AM)とリクルートされた炎症性単球/マクロファージは、感染初期のサイトカインとケモカインの分泌に主に関与しており、感染したATII細胞も同様にかなりの貢献をしている。この初期反応は、適応免疫系をリクルートして活性化させ、免疫病理学的状態を引き起こすことなくウイルスのクリアランスを促進するために必要である。感染のこの段階では、サイトカインやケモカインのレベルは十分に制御されているが、活性化プロファイルのチェックと感染部位へのこれらの自然免疫のリクルートは非常に重要である。したがって、感染の初期段階におけるサイトカインおよびケモカインの調節された制御された放出は、必ずしもプロ炎症性ではなく、ウイルスクリアランスの成功を駆動し、軽度の症状を示すCOVID-19症例の大部分に見られるような感染の限定的な伝播の背後にある蓋然性の高い理由である(Song et al 2020;Tay et al 2020)。
ウイルス感染気道上皮細胞によって分泌されるサイトカインの中で、IL-6は、対応するIL-6受容体(IL-6R)を発現する単球、好中球、およびリンパ球の初期の勧誘および分化において顕著な役割を果たす。IL-6は主に肺のマクロファージ(活性化AMや炎症性マクロファージ)から分泌されるが、ATIIによるIL-6の分泌も重要である。SARS-CoVを用いた試験管内試験研究では、NF κB経路の活性化を介して、RIG-IおよびTLRシグナルに応答してATIIによるIL-6の放出が示されている(Ndlovu et al 2009; Tanaka et al 2012)。さらに、マクロファージから分泌されるプロ炎症性サイトカインTNF-αおよびIL-1βは、ATII細胞に作用してIL-6の放出を引き起こす(Crestani et al 1994; Schwingshackl et al 2013)。
SARS-CoV-2に感染した正常なヒト気管支上皮(NHBE)における転写プロファイリングは、IL-6のアップレギュレーションを示し、これらの肺上皮細胞が、非重症COVID-19患者に見られる初期のIL-6応答に寄与する可能性を示唆している(Blanco-Melo et al 2020)。しかしながら、組織免疫組織化学または肺上皮細胞の単細胞免疫プロファイリングのようなより決定的な研究は、生体内でのIL-6分泌におけるそれらの寄与を明らかにするであろう。
肺胞マクロファージによる初期免疫応答
AMのような肺常駐型マクロファージは、一般に末期気道に存在し、正常な細胞恒常性を維持するための調節機能を果たしている。これまでの研究では、成功したウイルスクリアランスにおけるこれらの細胞の重要な役割が定義されている(Hartwigh et al 2014)。マウス肝炎ウイルス1型(MHV-1)に感染した動物におけるこれらの細胞の枯渇は、抗ウイルス応答の著しい低下をもたらした。AMはまた、SARS-CoV感染時に必須であることが示されている。これらの細胞の枯渇は、SARS-CoVのマウスモデルにおいて、病状の悪化と関連していた(Page et al 2012)。
さらに、SARS-CoV感染患者のBALF液分析では、AM集団の増加が明らかになり、これは2ヶ月間持続し、ウイルスクリアランスと有意に相関していた(Wang et al 2005)。ウイルス感染時の二次反応による活性化に加えて、これらの細胞がSARS-CoVによって直接標的化され得ることを示す試験管内試験研究は少ないが(Mossel et al 2008;Joel Funk et al 2012)矛盾する報告がある(Yip et al 2014)。全体的に、AMs細胞による抗ウイルス応答を支持するデータは、主にインフルエンザウイルスやMERSのような他の呼吸器感染症に基づいており、SARS-CoVに関する報告はわずかである(Mossel et al 2008; Joel Funk et al 2012)。
COVID-19患者におけるこれらの反応を研究することは、技術的な制限(肺から最適な数の細胞を得ることの難しさや、細胞培養中の急速な機能的および表現型の変化など)のために困難であるかもしれない。しかしながら、他の細胞型から推論を導き、肺組織から直接得られた細胞から特定のマーカーを相関させることができる。scRNA-seqとクラスター分析を用いたそのような最近のエレガントな研究の一つは、COVID-19患者に由来するBALF液中のAMの活性化状態を明らかにした。この分析は、これらの細胞によって発現されるシグネチャー遺伝子に基づいており、これらの細胞は、リクルートされた炎症性マクロファージとは著しく異なる(Liao er al)。 驚くべきことに、これらの細胞の数は、重篤な疾患症状を有する患者において減少し、プロ炎症性マクロファージの存在がその場所を取ることができる(Liao et al 2020)。
最近の研究(プレプリント、未査読)では、リンパ節および脾臓に存在するマクロファージにおけるSARS-CoV-2の感染および伝播が示されている(Chen Y. et al 2020)。しかし、ウイルスの直接感染および複製については、特に試験管内試験環境下での詳細な検討は行われていなかった。SARS-CoVに関するこれまでの研究では、これらの細胞での低い複製は、おそらくファゴサイトーシスによるものであることが示唆されている(Yilla et al 2005)。したがって、これらの結果は、SARS-CoV-2に対するAMの応答が複雑ではあるが、単球、樹状細胞、好中球、ナチュラルキラー(NK)細胞のような他の自然免疫細胞の活性化およびリクルートに必要であり、適応免疫系の調節に不可欠であることを示唆している(Soroosh et al 2013; Hartwig et al 2014; Meischel et al 2020)。
機能不全の自然免疫応答
平均して、COVID-19患者の約15%が重症化し、5%が重症化しているが、症例数の増加が続いているため、この数値は変化する可能性がある(Berlin et al 2020)。これらの患者の免疫学的軌跡を見ることにより、初期のIFN応答の障害に続いて、活性化された自然免疫応答および機能不全の適応免疫応答が、COVID-19患者における疾患の重症化に寄与する重要な病理学的要因であることが明らかになってきた(Blanco-Melo et al 2020; Mathew et al 2020)。しかしながら、これらの免疫応答におけるより複雑な相互作用を示唆する報告もあり、効果的な免疫療法に基づく介入を開発し、ワクチン開発を成功させるためには徹底した理解が必要である。
インターフェロン応答の障害
SARS-CoVに関するこれまでの分子・臨床研究やSARS-CoV-2に関する最近のデータから、一次IFN反応の遅れは、(1)高齢者のように適応反応が低下している患者の全体的な免疫機能の低下など、複数の要因による可能性があることが明らかになりつつある。(2) 合併症を有する患者、(3) IFNシグナル伝達に関与する重要な遺伝子および転写因子に関連する遺伝的因子またはエピジェネティックな変化、および(4) 患者の年齢および性別、おそらく高齢者および男性はCOVID-19に感受性が高いと思われる(Bastard er al)。 , 2020; Li M.Y. et al 2020; Nguyen et al 2020; Verdecchia et al 2020; Zhou F. et al 2020)。) したがって、全体的に、これらの因子は、宿主細胞免疫系を損ない、初期の抗ウイルス応答を遅らせる可能性がある。特にRNAウイルスの場合、宿主免疫応答の回避は、PRRR、PLRR、TLR、およびIFNシグナル伝達を妨害することによって管理される(Kikkkert 2020)。さらに、阻害は、上述したように、宿主細胞生合成機械をハイジャックし、最終的には宿主細胞のアポトーシスを誘導することによっても付与される。
これまでの研究では、重症感染時のSARS-CoVに対するIFN応答の貧弱さが明確に示されており、これは明らかにSARS-CoV-2の場合でも同様であり、最近ParkおよびIwasaki(2020)によってレビューされている。初代肺の試験管内試験培養では、SARS-CoV-2に感染した上皮細胞は不十分なIFN応答を生成した(Blanco-Melo et al 2020)。臨床サンプルを見ることにより、大規模なデータの体は、重症で重篤なCOVID-19患者におけるIFNシグナル伝達の障害を示唆している。研究全体からの血液分析は、重篤な疾患症状を呈する患者または重篤な状態でICUに入院した患者において、IFN-βおよびIFN-λのレベルが低いかまたは検出不能であることを明らかにする(Hadjadj et al 2020)。注目すべきは、COVID-19疾患重症度の様々な段階におけるIFNシグナル伝達の機能的役割を探るために、エレガントな研究が実施されたことである。この研究は、軽度/中等度および健康な個体と比較して、重症患者および重症患者において、IFNシグナル伝達のロバストな障害を発見した。IFN-βのmRNAとタンパク質はすべての患者で検出不能であったが、重症および重症患者の血漿中にはIFN-α2タンパク質が高度に減少しており、これはIFN活性の低下を裏付けるものであった。障害されたIFNシグナル伝達と一致して、重症および重症患者において観察されたいくつかのISG(MX1,IFITM1,IFIT2)の頑健なダウンレギュレーションは、全体的に低下したIFN応答を示唆している(Hadjadj et al 2020)。
IFNの低い循環レベルと一致し、死後肺サンプルの転写分析は、これらの観察をさらに確認し、検出可能なI型またはIII型のIFNを明らかにしなかった。IFN応答を直接阻害するSARS-CoV-2タンパク質のうち、ORF6,ORF8,およびNタンパク質は、IFN-βおよびNF-κBシグナル伝達を阻害する(Li J.Y. et al 2020)。さらに、Konno et al 2020)は、おそらくより活発な抗IFN活性を有するORF3bのより拡張されたバリアントを同定した。したがって、これらの初期の観察は、SARS-CoV-2に対する宿主細胞による初期のIFN応答の障害を示唆している可能性がある。
初期の抗ウイルス応答におけるIFNの本質的な役割に加えて、2つの最近の研究では、遺伝的変化が不十分なIFN応答と関連していることが示されている。最初の研究では、IFN中和自己抗体の存在が、より重篤な病状を示す患者で見出された(Bastard et al 2020)。これらの自己抗体は女性よりも男性に多く見られ、それが男性のCOVID-19に対する感受性を部分的に説明している。無症状または軽症例のいずれも検出可能な自己抗体を有していなかった。他の研究では、TLR3-およびIRF7依存性に関与する13の主要遺伝子の変異は、機能喪失を示す(Zhang Q. et al 2020)。これらの遺伝子の機能喪失を有する患者またはこれらの患者に由来する細胞は、不十分なIFN応答を有し、SARS-CoV-2感染に対して脆弱であった。重篤な疾患症状を有する4人の患者を対象とした同様の研究では、全エクソーム配列決定により、IFNシグナル伝達に本質的に関与するTLR7の機能喪失が明らかになった。これらの患者は、IFN-γの産生の減少とともに、IRF7,IFNB1,およびISG15の発現の減少を示した(Vander Made et al 2020)。したがって、IFNシグナル伝達の様々な段階で干渉することによってウイルスによって直接媒介される、障害されたIFNシグナル伝達、または不十分なIFN応答およびIFN中和自己抗体の存在に対する一部の個体の遺伝的素因は、COVID-19疾患の重症度を決定する重要な因子のいくつかである。他の自然免疫応答および適応免疫応答と組み合わせた機能不全IFN応答は、したがって、回復またはより重篤な形態の疾患への進行への道筋を決定し得る(Hadjadj et al 2020)。重度のCOVID-19患者におけるI型インターフェロン活性の障害および炎症性応答の悪化(Hadjadj et al 2020; Park and Iwasaki 2020)。SARS-CoV-2が障害されたIFN応答を引き起こす分子機構の包括的な理解はまだ不足しており、今後の研究がこれを理解するのに役立つかもしれない。
それにもかかわらず、これらの初期報告は、SARS-CoVに関するこれまでの知見とともに、COVID-19患者に対するIFN治療の治療効果を探るための基礎となっている。現在、COVID-19の治療のためのIFN-β1a(NCT04350671)とIFN-l(NCT04388709)の第II相臨床試験が進行中である。これらの薬剤による予備的な結果は、現在のところ有望である(Davoudi-Monfared et al 2020)。
ダメージ関連分子パターンおよびプロ炎症性分子の放出
初期のIFN応答の障害は、その後、堅牢な炎症性応答の誘導につながる高いウイルスの伝播をもたらす(Davidson et al 2015)。これらのウイルスの細胞病原性は、感染したATII細胞の実質的な死(壊死だけでなくアポトーシス)を誘導し、それは広範囲の損傷関連分子パターン(DAMP)および細胞障害性分子の放出につながる。同様に、活性化されたAMもまた、放出されたDAMPに反応し、PAMPと同時に作用して炎症性反応を増幅させる。潜在的なPAMP、DAMP、およびそれらのそれぞれのPRRのリストおよび役割は、以前にレビューされている(Leiva-Juárez et al 2018)。
循環核およびミトコンドリアDNA、およびヒストンは、ウイルス感染の間、潜在的なDAMPとして機能する。これらの分子は、TLR経路を介してシグナルを送り、プロ炎症性分子の頑健な発現を誘導する。ウイルス感染上皮細胞および損傷上皮細胞によって分泌されるDAMPのうち、高移動性グループボックスワンタンパク質(HMGB1)およびS100の役割はよく知られている(Leiva-Juares et al 2018;Gong et al 2020)。TLR4に結合した後のHMGB1は、NF-κBシグナル伝達の活性化およびプロ炎症性分子の放出を誘導する。さらに、HMGB1はまた、TREM1/2のような受容体、およびNF-κB活性化にも関与している高度糖化末端産物(RAGE)の受容体を活性化する(Yang and Tracey, 2010)。S100は、TLR4およびRAGE受容体と結合した後、同様の下流シグナル伝達を開始する(Ma et al 2017)これらの研究は、最近Gong et al 2020)によってレビューされた。他の呼吸器ウイルスを用いた以前の動物研究では、血清HMGB1レベルの上昇と肺損傷および疾患重症度との密接な相関が示されている(Patel et al 2018)。同様に、S100A9の上昇した発現は、呼吸器同期ウイルス(RSV;Foronjy et al 2016)によって媒介される急性肺損傷の間の患者において存在した。現在のところ、HMGB1の存在は、COVID-19患者において報告されていないが、死後生検における肺実質の損傷は、このタンパク質が疾患の病因および高炎症に関与する可能性が高いことを示唆している(Andersson et al 2020;Zhang Q. et al 2020)。
COVID-19患者からのBALF液中に見出されたS100A8,S100A9,およびS100A12カルグラヌリンの増加した発現は、前炎症応答の生成におけるそれらの潜在的な役割を示している(Zhou Z. et al 2020)。さらに、Zou et al 2020)は、50人のCOVID-19患者から得られた血液サンプル中の無細胞DNAおよびシトルリン化ヒストンの増加した存在を示した。他の炎症性疾患に関する研究は、これらの分子の存在と疾患の重症度との間の密接な相関を示している(Resman Rus et al 2016)。しかしながら、それらの機能的役割はまだ解明されていないが、COVID-19患者におけるこれらのDAMPのいくつかの発現の増加は、疾患発症におけるそれらの潜在的な含意を示唆している。今後の研究では、炎症状態の永続化における他の様々なDAMPの関与、特にHMGB1の役割を明らかにしていく予定である。
DAMPの分泌に加えて、AMおよびウイルス感染ATII細胞は、一連のプロ炎症性分子を分泌する(HussellおよびBell 2014;Glaser et al 2019)。これらの中でも、増加したIL-6レベルは、SARS-CoVおよびSARS-CoV-2に感染した培養細胞において一貫して検出される(Ye et al 2018;Herold et al 2020;Liu J. et al 2020;Liu T. et al 2020)。特筆すべきことに、感染したATIIおよび活性化されたAMによって分泌されるTNF-α、IL-8,IL-10,GM-脳脊髄液、CXCL10,およびCCL5のレベルもまた、SARS-CoVおよびSARS-CoV-2感染の間に増加することが一貫して示された(Ward et al 2005; Huang C. et al 2020; Patterson et al 2020)。SARS-CoV-2に感染した正常ヒト肺上皮細胞(NHBE)におけるサイトカインおよびケモカインの転写プロファイリングは、SARS-CoV-2感染に応答して、初代肺上皮細胞によるCCL20,CXCL1,IL-1B、IL-6,CXCL3,CXCL5,CXCL6,CXCL2,CXCL16,およびTNF-αのレベルの増加を明らかにした(Blanco-Melo et al 2020)。このように、抗ウイルス応答に不可欠であることに加えて、肺の常駐ATIIおよびAM細胞はまた、深遠なプロ炎症状態を生成することに参加している。
骨髄質細胞を浸潤させることによって放出される抗炎症性分子
循環性炎症性単球/マクロファージ
SARS-CoVの発症における炎症性マクロファージの役割についての詳細な説明は、He et al 2007)によって報告されている。動物研究では、肺におけるこれらの細胞の広範なリクルートおよび蓄積が実証されており、これは、TNF-α、IL-1β、およびIL-6の放出およびARDSの発症と相関しており、GralinskiおよびBaric(2015)によってレビューされている。興味深いことに、SARS-CoVに感染した動物におけるこれらの炎症性マクロファージの枯渇は、高い回復率と関連しており、したがって、疾患の病態形成におけるそれらの重要な役割を示唆している(Channappanavar et al 2016)。同様に、交互に活性化されたマクロファージのSTAT1ノックアウト動物におけるSARS-CoV感染は、肺損傷の減衰および疾患からの保護を示した(Page et al 2012)。さらに、多数の臨床研究が、SARS-CoV感染患者におけるIMMの不可欠な役割を支持している(Wong et al 2004;Tisoncik et al 2012;Liu et al 2019)。COVID-19患者からのBALFからの最近の研究はまた、頑健な炎症性反応の誘導における循環単球由来マクロファージの重要な役割を実証している(Liao et al 2020)。18人のCOVID-19患者の血球分析は、炎症性マクロファージの活性化した状態を明らかにした(Zhang D. et al 2020)。これらの知見に沿って、scRNA-seqに続いて血球の免疫細胞プロファイリングを行ったところ、CD14++単球の増加が明らかになった(Wen et al 2020)。重症および重症患者はまた、いくつかのケースでマクロファージ活性化症候群(MAS)を示す(Giamarellos-Bourboulis et al 2020)。したがって、すべての証拠は、COVID-19の間の疾患重症度における炎症性マクロファージの重要な役割、および潜在的な治療標的に向けて指示している。IL-6およびIL-1βに対して指示された抗体のようなMASを誘導する衝動を減少させる介入は、大塚および清野(2020)によってレビューされた有望な臨床転帰を示している。
炎症性好中球
他の自然免疫細胞と同様に、好中球は感染の初期段階ではウイルス粒子を中和し、保護分子を放出してウイルスの伝播を妨害することで防御的な役割を果たしている(Drescher and Bai, 2013)。しかし、重症化すると、感染部位ではこれらの細胞が増加し、ダメージを与える主要な細胞となる。肺におけるこれらの細胞の過剰な浸潤は、TNF-α、IL-6,IL-1β、IL-7,IL-23,およびIL-36の分泌と関連しており、他の広範なサイトカインおよび損傷を引き起こす好中球の細胞外トラップ(NETs; Tecchio et al 2014)とも関連している。さらに、これらの好中球はまた、循環からより多くの好中球および単球を引き付けるために、CCL2/3/4,CXCL1-13のようなケモカインの範囲を分泌する(SokolおよびLuster 2015)。
新たなエビデンスは、COVID-19の病因における好中球の極めて重要な役割を示唆している。免疫細胞プロファイリングは、これらの細胞の活性化された状態を明らかにし、それはNETのレベルの増加と関連し、急性期反応と相関していた(Chen G. et al 2020;Qin et al 2020;Zuo et al 2020)。同様に、活性化好中球数の増加は、COVID-19患者のBALFに存在した(Liao et al 2020; Xiong et al 2020)。したがって、最近発表されたこれらの研究に基づいて、血液中の好中球数は、疾患重症度の予測マーカーとして使用することができる(Zhang et al 2020a)。
ナチュラルキラー細胞
ナチュラルキラー細胞は、感染細胞上に発現した死受容体と相互作用してウイルスのクリアランスを助けるため、ウイルス感染の初期段階では不可欠である(Vidal et al 2011)。以前の臨床研究では、SARS-CoV患者におけるNK細胞数の減少が示されており、重症患者ではより顕著であった(Wang and Xia, 2004)。COVID-19患者の最近の血液プロファイルは、疲弊マーカーの発現の増加とともに、重症症例におけるNK細胞数の同様の減少を示唆した(Chen X. et al 2020;Tan L. et al 2020b;Zheng H.Y. et al 2020)。反対に、非ICU対10 ICU入院患者では、総NK細胞数に有意な差は見られなかった(Zhou et al 2020a)。このような数の不一致は、時間的な免疫応答の違いや、一部の患者では基礎となる病状の違いによるものであると考えられる。COVID-19患者の早期回復期(ERS)と後期回復期(LRS)の免疫細胞プロファイリングデータからは、早期回復期のERSではNK細胞が少なく、LRSでは回復するという二相性の効果が明らかになった(Wen er al)。 このように、基礎疾患状態の他に、NK細胞数はまた、サンプル採取の時間に敏感である可能性があり、したがって、潜在的な疾患マーカーとして機能しない可能性がある。さらに、これらの研究はまた、研究対象となった患者の年齢のばらつきという限界に悩まされる可能性があり、これはCOVID-19の重症度に関するNK細胞の明確な役割を提供することを困難にするかもしれない(Nikolich-Zugich et al 2020年)ので、より決定的な研究が必要である。
肺常駐型および単球由来樹状細胞
肺常駐型樹状細胞は、適応免疫細胞応答を活性化することにより、疾患の初期発症時に主に防御的役割を果たしている。PAMPs、DAMPs、および炎症性サイトカインシグナルの影響下で、肺常在樹状細胞は、CCR7の影響下で条件付けされ、排液リンパ節に移動し、そこでナイーブCD4+およびCD8+ T細胞をプライムする(Braun et al 2011; Thaiss et al 2011)。対照的に、単球由来の樹状細胞は、GM-脳脊髄液、IFN-γ、およびIL-4の影響下で、他の炎症性シグナルとともに生成する(Qu et al 2014)。これまでの研究では、SARS-CoVに応答して活性化炎症性樹状細胞(DC)によるCCL3,CCL5,MCP-1,IP-10,TNF-α、およびIL-6の分泌物の上昇が示されている(Law et al 2005)。最近の報告では、COVID-19患者における活性化樹状細胞の存在も示唆している。注目すべきことに、8人のCOVID-19患者から得られたBALFのメタトランスクリプトーム配列決定は、他の自然免疫細胞および適応免疫細胞と比較して、好中球とともにこれらの細胞の活性化された状態を明らかにした(Yang A.P. et al 2020;Zhou Z. et al 2020)。したがって、SARS-CoV感染に関する以前の臨床研究およびSARS-CoV-2に関する最近の新興研究に基づいて、重症で重症のCOVID-19患者における高炎症性免疫応答は、機能不全の適応免疫応答の項で後述するように、主に感染部位に浸潤した自然免疫細胞によってマウントされ、適応免疫細胞によってかなりの貢献を受けていることが明らかである。
COVID-19における適応免疫応答
機能的適応免疫応答
ウイルス感染を克服するためには、機能的ではあるがよく制御された適応免疫応答が必要である。具体的には、感染部位にリクルートされたときのT細胞は、感染細胞の排除に関与し、ウイルス特異的中和抗体と一致して作用し、持続的な免疫を提供する(Hor et al 2015; De Biasi et al 2020)。COVID-19の間の機能的な初期免疫応答の理解における最近の広範な研究を考慮すると、以下のセクションで議論されるように、患者特有の基礎となる健康状態および遺伝的要因とともに、T細胞およびB細胞免疫応答の間の複雑な相互作用が回復を決定するように思われる。
T細胞応答
初期の適応免疫応答の生成は、それによって基礎となる肺実質への損傷を防ぐために、ウイルスに感染した細胞の選択的な排除とウイルス抗原の中和のために重要である。肺の感染したATIIと活性化されたAMによって放出されるサイトカイン、ケモカイン、PAMP、およびDAMPは、肺の常駐DCをプライミングすることによって、うまく調整された調節された適応免疫応答をマウントするために十分である。抗原提示DCに遭遇した後、ナイーブCD4+ T細胞は、エフェクターおよびメモリCD4+ T細胞に分化する。少なくとも5つの異なるCD4+ T細胞の系統(TH1,TH2,TH17,TFH、およびTREG細胞)が知られており、SARS-CoV感染中の抗ウイルス応答のマウントにおけるTH1およびTFH細胞の顕著な役割を有する(Channappanavar et al 2014)。さらに、いくつかの研究では、COVID-19患者由来のPBMCsにおける機能的なTH2応答も示されている。IL-4およびIL-5のようなTH2特異的サイトカインの放出は、これらの細胞が刺激された後、試験管内試験で観察された(Weiskopf et al 2020)。同様に、これらの患者は、他のTH17細胞特異的サイトカインと共にIL-17の増強された産生を示す(Liu J. et al 2020; Wu and Yang, 2020)。これらの知見は、COVID-19患者におけるTH細胞応答が他の感染症に関して複雑であることを示唆しており、この複雑さは患者の優勢な病態生理学的状態に部分的に依存している可能性がある。
SARS-CoVのようなウイルス感染症では、TH1の分化は、B7-1/2およびCD28を介した共刺激性シグナル伝達とともに、DCから分泌されるIL-12およびIFN-γによって影響を受ける。一方、DCから分泌されるIL-6は、B細胞による抗体分泌を助けるためにTFHの分化に影響を与える(Tang et al 2008; Lau et al 2012)。ケモカイン(CCL3,CCL4,CCL5,CCL8)の影響下で、TH1細胞は感染部位に勧誘され、SARS-CoV感染時の主なエフェクターサイトカインとしてIL-2,IFN-γ、IL-12,およびTNF-αの分泌によって区別される(Li er al)。 同様に、ナイーブCD8+ T細胞は、CD28-B7共刺激シグナルおよびCD4+ T細胞によって放出されるサイトカインとともに、MHC-IおよびTCR受容体に関与することにより、DCによって活性化される。CD4+ T細胞によって主に分泌されるIL-2もまた、それらの長期的な維持および増殖に関与している(Eickhoff et al 2015; Hor et al 2015)。注目すべきことに、CD8+ T細胞はまた、頑健なIFNタイプI応答が存在する条件下で、CD4+ T細胞からの助けとは無関係に活性化され得る(WieselおよびOxenius 2012)。これらの活性化されたCD8+ T細胞[細胞傷害性Tリンパ球(CTL)とも呼ばれる]は、その後、ケモカイン(CCL3,CCL4,CCL5,CXCL9,およびCXCL10)の影響下でエフェクター器官にリクルートされる(Nolz 2015)。感染部位では、CTLは顆粒、パーフォリン、グラニュライシンなどの細胞傷害性顆粒の分泌を介して感染細胞を直接殺すことで抗ウイルス応答をマウントする。非常に最近の研究では、CTLが283種類以上の他のタンパク質(IFN-γやTNF-αなどのサイトカインを含む)とともに糖タンパク質複合体の超分子攻撃粒子(SMAP)として顆粒酵素やパーフォリンを分泌することが示されている(Bálint et al 2020)。CoVsによる感染がCTLによるSMAPの放出にも影響を及ぼすかどうかを知ることは興味深いことであろう。
動物研究は、SARS-CoVクリアランスおよび病理学的状態の減衰におけるCD4+細胞の重要な分子的洞察を明らかにしてきた。CD4+細胞の枯渇は、ウイルスクリアランスの減少および間質性肺炎と関連していた(Jin et al 2005;Wang et al 2006)。対照的に、ウイルス特異的CD4+およびCD8+ T細胞の養子移植は、ウイルスクリアランスをもたらした(Zhao et al 2010)。同様に、臨床データは、回復した患者における抗原特異的CD4+およびCD8+T細胞の存在を一貫して示しており、これは、免疫化された動物において見出されたものに類似しており、Channappanavar et al 2014)でレビューされている。一方、SARS-CoV感染の重症例は、後述するように、T細胞の減少と関連していた。したがって、これらの動物および臨床データに基づいて、CD4+ TおよびCD8+ T細胞は、SARS-CoV感染中の抗ウイルス応答の中心であった(Peng et al 2006; Oh et al 2012)。
プライミングされたCD4+およびCD8+ T細胞のサブセットは、感染が治まった後、長時間作用する記憶細胞に分化する。TCR-p.MHCIIシグナリングは、IL-2,IL-21,およびCD40R-CD40Lを介した相互作用のようなサイトカインの存在とともにCD4+ T記憶細胞の形成を助ける(JaigirdarおよびMacLeod 2015)。同様に、このCD8+ T細胞の記憶細胞への移行は、分泌されたIL-10を介したCD8+ TREG細胞の影響下で行われる(Laidlaw et al 2015)。長期間持続するCD4+およびCD8+ Tメモリー細胞は、回復したSARS-CoV感染患者において検出された(Peng et al 2006; Li et al 2008)。
さらに、抗ウイルス応答に関与する他のT細胞サブセットには、従来型ではないNKT細胞(CD56+)とMAIT(粘膜関連不変性T)細胞が含まれている。NKT細胞は、自然免疫応答と適応免疫応答の間のインターフェースで作用し、サイトカインの影響下で感染部位へのトラフィックを行う(Tsay and Zouali, 2018)。MAIT細胞は、免疫調節機能を果たす肺などの粘膜内膜に存在する。これらの細胞型はいずれも、他のT細胞サブセットとともに、SARS-CoV-2の早期クリアランスにおいて重要な役割を果たす(Grifoni et al 2020)。これらの機能を強化するための戦略は、COVID-19の間のウイルスクリアランスを強化するために提案されている(Cao, 2020)。これらの細胞の役割は、”マイルド/中等度および回復したCOVID-19患者におけるTおよびB細胞応答 “の項の機能不全免疫応答の下でさらに議論されるであろう。
B細胞応答
B細胞は、T細胞とともに、ウイルス感染時の中心的な適応応答を形成している。B細胞の反応は非常に特異的で、これらの細胞から分泌されるウイルス特異的抗体やその他のエフェクターサイトカインによってマウントされている。B細胞の活性化は、濾胞ヘルパーT(TFH)細胞依存性であり得るか、またはいくつかの実施形態では、ヘルパー細胞とは独立したものであり得る;両方の実施形態は、COVID-19においてパンデミックしている(Mathew et al 2020)。抗原提示樹状細胞の影響下で、ナイーブCD4+ T細胞は、CXCR5およびIL-21の高発現、およびCCR7,IFN-γ、IL-4およびIL-17の低発現によって特徴づけられるTFH細胞へと分化する(Rasheed et al 2006; Nurieva et al 2008; Morita et al 2011)。活性化されたTFH細胞は、CD40R-CD40Lおよび他の関連する受容体を介してB細胞と相互作用し、よく調整された調節されたプロセスで抗原特異的抗体の産生を誘導する。このCD40R-CD40R-CD40L相互作用は、IL-21の分泌と共に、長寿命のメモリーB細胞の形成を可能にし、一方、B細胞由来のIL-6およびIL-27は、TFH細胞の相互維持に役立つ(Nurieva et al 2008,2009)。以前の動物実験では、SARS-CoV感染に対する適切な抗体応答をマウントするために、これらのヘルパー細胞の本質的な役割が示されている(Chen er al)。 これらの細胞の枯渇は、抗体応答の低下およびウイルスクリアランスの減少と関連していた。このように、B細胞が産生するウイルス特異的抗体は、宿主による効果的な免疫応答に不可欠である。これらの抗体は、ファゴサイトーシス、オプソン化、またはエフェクターNK細胞を介した抗体依存性細胞毒性(ADCC)の活性化のいずれかを直接活性化することにより、ウイルスのクリアランスを促進する。自然免疫系および適応免疫系の活性化によって放出されるサイトカインもまた、補体系を活性化する。血漿細胞から分泌された抗体でコーティングされたウイルスは、最終的に補体系によって排除されるようになるが、Risitano et al 2020)によってレビューされている。
軽度/中等度および回復したCOVID-19患者におけるT細胞およびB細胞応答
T細胞応答は、SARS-CoV-2感染を抑制する上で重要な決定因子として浮上してきている(Huang C. et al 2020;Liu J. et al 2020)。研究を横断して、これらの細胞数の減少は、不良な臨床転帰および免疫病理学的発症と正の相関を示し、一方、適切なT細胞数および適切なエフェクター機能は、軽度の疾患症状を呈する患者または回復に成功した患者で優勢である(Chen G. et al 2020;Li H. et al 2020;Sekine et al 2020;Tan L. et al 2020b)。1人の患者(47歳女性)を疾患を通して追跡したThevarajan et al 2020)は、感染後7日目からCD4+、CD8+、TFH細胞、抗体分泌B細胞の増加が同時に見られ、これは症状の消失とともに1週間持続することを示した。他の研究では、ウイルスを正常にクリアした患者におけるT細胞応答の復活の同様の傾向を明らかにした(Anft et al 2020;Braun et al 2020;Chen X. et al 2020;Chen N. et al 2020)。
SARS-CoV-2特異的反応性CD4+およびCD8+ T細胞は、機械的換気を必要とする患者(n = 10)の100および80%において見出された。これらの患者に由来するPBMCは、SARS-CoV-2のSタンパク質に対する反応性を示した。さらに、CD4+ T細胞の試験管内試験刺激は、対応するサイトカインの発現によって明らかにされるように、それらのTH1,TH2,およびTH17サブセットへの分化をもたらした(Weiskopf et al 2020)。興味深いことに、感染していない健康なコントロールの20%もまた、反応性T細胞を示した。この研究の主な制限は、T反応が重症患者のみで研究され、提供するサンプルサイズが小さかったことであった。
18人のCOVID-19患者および64人の健康なドナーのコホートを研究することにより、Braun et al 2020)は、回復期のCOVID-19患者から得られた血液中に反応性CD4+細胞(83%)を発見した。これらの反応性T細胞は、Sタンパク質に対して特異的に検出された。興味深いことに、SARS-CoV-2血清陰性の健康なドナーの約35%にもSタンパク質反応性CD4+ T細胞が認められ、これは関連するコロナウイルス感染症に過去に曝されていたことを示している。同時に、別の研究では、回復期の患者(n = 20)において、SARS-CoV-2特異的CD4+ T(100%)およびCD8+ T(70%)細胞の存在が確認されている(Grifoni et al 2020)。Sタンパク質に対して主に反応性であることに加えて、この研究は、M、N、およびORF8タンパク質およびNSP3,NSP4,ORF3aのような他の非構造タンパク質の形で、これらのT細胞の追加の標的を発見した。さらに、Braun et al 2020)の研究に沿って、T細胞はSARS-CoV-2未感染患者の40〜60%に対して反応性を示し、以前のウイルス感染に反応してこれらの反応性細胞が存在することを示唆していた。
まだ査読付きの論文では、Schulien et al 2020)は、COVID-19におけるCD8+ T細胞のSARS-CoV-2エピトープ特異的役割を広範囲に研究している(Schulien et al 2020)。この研究では、新たに生成されたSARS-CoV-2特異的細胞および既存のSARS-CoV-2特異的細胞の存在が認められ、軽度の疾患症状を有する患者の88.4%(n = 26)に見られる陽性反応が認められた。最も実質的な反応は、Nタンパク質とORF3aに対するものであった。さらに、CD8+ T細胞の反応は、血清陰性になった患者でも持続していた。ある患者では、長期的(70日)に調査したところ、CD8+ T細胞の反応は延長したが、抗体は持続しなかった。これら3つの研究を合わせると、回復期の患者における機能的で長期的な反応性T細胞の存在を示唆しているが、他の研究では重症患者における反応性T細胞の存在も示唆している(Weiskopf et al 2020年)。したがって、これらの研究に基づいて、軽度の疾患症状を示し、回復に成功したCOVID-19患者は、機能的で長期的なT細胞応答を示すように思われる。しかしながら、これらの知見は、これらの研究のいずれも疾患重症度に対するT細胞応答を比較していないため、回復期におけるこれらの細胞の首尾一貫した機能的見解を提供する決定的なものではないかもしれない。また、サンプル採取時期の違いも知見を複雑にしている可能性がある。Grifoni et al 2020)の研究では、サンプルは症状発現後20~35日を通して収集されたのに対し、Weiskopf et al 2020)はICU入院14日後に収集されたサンプルを使用している。したがって、コントロールされた臨床環境下でのより多くの研究と大規模なコホートサイズが必要である。
これらの懸念のいくつかに対処する一方で、最近の研究では、疾患の重症度に関する回復期COVID-19患者におけるT細胞応答を調査した(Peng et al 2020)。この研究では、軽症(n = 28)よりも重症(n = 14)の症例では、堅牢なCD4+およびCD8+記憶T細胞応答が認められ、感染を抑制するためのこれらの細胞の長期にわたる記憶が示唆された。ここでも限界があるのは、サンプルサイズが小さいことである。したがって、T細胞応答の影響とその長期持続性を十分に理解するためには、大規模なサンプルサイズのこのような研究が必要である。
B細胞応答は、ヒトに感染するCoVに対して時間的にダイナミックであり、SARS-CoVの検出時間の中央値は14日であり、Huang A.T. et al 2020)によってレビューされている。IgGおよびIgMのピーク抗体価、および中和抗体の検出時間は、IgG、IgM、およびIgAの血清転換の低いタイムポイントが15日であり、研究によって異なっていた(Hsueh et al 2004;Mo et al 2006;Cao et al 2007;Yang et al 2009)。よりダイナミックな血清転換の範囲は、COVID-19患者の血清で観察された。疾患の重症度が異なる32人の患者を対象としたLiu X. et al 2020)の研究では、検出可能なIgM抗体が4日目から検出され、症状の発症から 20日目にピークを迎えた。同時に、IgG抗体は7日目以降に出現し、25日目にピークを迎えた。疾患の重症度で比較すると、軽症例は重症例に比べてIgM反応のピークが早かった(17日目対21日目)。症状発症後の抗体反応については、重症度に関係なく、SARS-CoV-2感染者では3日目から6日目までの間にIgM抗体が検出され、症状発症8日目以降にIgG抗体が検出されたLiu X. et al 2020)も同様の傾向を示した。
Zhou P. et al 2020)の研究でも、IgM抗体、IgG抗体、中和抗体の平均時間はそれぞれ12日、14日、11日であった。これらの報告は、中和抗体が10日目から検出されたWu et al 2020)の報告と一致していた。COVID-19患者285人の精巧な抗体プロファイルは、症状発症後3週目および4週目頃にそれぞれピークを持つ100%IgGおよび94.1%IgM抗体反応を明らかにした(Long et al 2020a)。このように、ウイルスクリアランスを成功させるためには、適切な適応免疫応答が、症状発症後2週目頃に生成され、IgMでは3週目頃に、IgGでは4週目の初めにピークを持つ(Ni et al 2020; Thevarajan et al 2020; Wu et al 2020; Zhao et al 2020)。これらおよびいくつかの他の研究に基づいて、抗体応答は、年齢、性別、遺伝的因子、基礎疾患の状態、および最も重要なことに、血清学的検査に使用されるアッセイの種類に依存する可能性があるCOVID-19において非常に動的であることが明らかである(Guan et al 2020; Hou et al 2020)。全体として、これらの初期報告は、軽度・中等度の症状を示す患者のほぼ80%において、ウイルスの早期クリアランスとそれによる病状の軽減において、調節された適応免疫反応が不可欠な役割を果たしていることを明確に示唆している。一方、残りの20%の重症・重症患者では、セクションCで後述するように、病気の症状はリンパ球減少の程度と正の相関を示している。
図3 適応免疫細胞の関与によるウイルス感染細胞のクリアランス
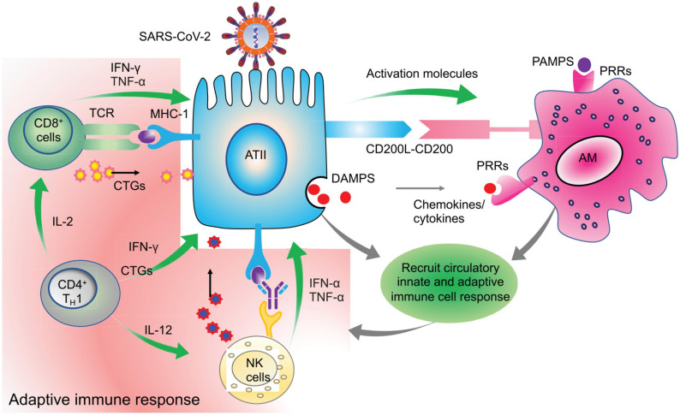
ウイルス感染したATII細胞は、CD200-200L相互作用を最小化することにより、隣接する肺常駐AMを活性化する。追加の必要な活性化シグナルは、DAMP、ウイルス由来のPAMP、およびIFN-γのようなサイトカインによって提供される。活性化されたAMは、感染したATII由来の分子とともに、循環単球、樹状細胞、NK細胞、好中球などの他の自然免疫細胞を活性化してリクルートし、これらの細胞は協調して行動し、最終的にはCTLやCD4+T細胞のような適応性エフェクター免疫細胞をリクルートする。これらの適応免疫細胞は、ウイルスに感染した細胞を特異的に排除しながら、近くの感染していない細胞へのダメージを最小限に抑える。このように、自然免疫細胞の助けを借りて調整された適応免疫応答は、ウイルスのさらなる拡散を制限するための初期の抗ウイルス応答に不可欠である。緑の矢印は、肺上皮細胞に作用して抗ウイルス反応を起こすだけでなく、他の免疫細胞を活性化するそれぞれの活性化免疫細胞から放出されるサイトカインを示している。
免疫学的な謎は、世界中の研究者がいまだに解明できていないのは、COVID-19患者の大多数がどのようにして無症状のままであり、さらには高ウイルス負荷を有するものもあるということである(Lee S. et al 2020)。このジレンマは、T細胞およびB細胞によって生成される効果的に機能的な初期免疫応答に基づいて部分的に説明することができる。Mathew et al 2020)は、多次元免疫プローブ研究を用いて、免疫学的特徴を有する臨床的特徴を機能的に特徴付けた。この研究では、50の臨床パラメータと200の免疫パラメータに基づいて3つの免疫型を定義した。免疫型1は、疾患の重症度と正の関連があり、高活性化CD4+およびCD8+ T細胞を有し、同時に疲憊マーカーを発現し、これらの細胞の頑健な活性化に続いて疲憊することを示唆していた。この免疫型は、後述の “COVID-19患者におけるサイトカインストーム “の項で述べるように、サイトカインストームに対して脆弱である可能性がある。免疫型2は、CD4+およびCD8+T細胞の最適な活性化状態を有する増殖メモリーB細胞の存在と関連していた。この免疫型は疾患の重症度とは関連しなかった。免疫型3はCD4+およびCD8+ T細胞の活性化状態を示さず、重症度とは逆の相関を示した。全体的に、この研究は、調節された機能的な適応免疫応答の存在が免疫病理学を予防する鍵であることを示唆する上記のいくつかの疑問に対処するものであった。同様の研究では、疾患重症度(急性、中等度、および重症)と関連するT細胞の活性化状態が示された(Sekine et al 2020)。これらのT細胞の活性化状態は、これらの患者におけるSARS-CoV-2特異的IgG抗体の存在と相関していた。
興味深いことに、回復期の軽症および無症状患者に由来するT細胞は、試験管内試験でSARS-CoV-2特異的抗原で刺激されたときに機能的な状態を示し、軽症および無症状の回復期患者における十分に制御された機能的なT細胞応答の存在を示唆している。このように、高ウイルス負荷の患者では、適切なインターフェロン応答と関連して適切に調節された適応免疫応答が存在すれば、免疫病理学的状態を予防することができる。一方、免疫応答が低下している患者では、併存疾患のように、低ウイルス負荷であっても、後のセクションで議論するように、効果のない免疫応答または制御されていない過剰活性化応答のいずれかのために、免疫病理学的変化を誘発するのに十分である。
機能不全の適応免疫応答
COVID-19患者のサブセットは、T細胞およびB細胞の頑健な活性化を示す。これらの誇張されたT細胞応答は、重篤な病状を発現し、機械的換気を必要とする患者において特異的に存在する(Herold et al 2020)。さらに、死亡した患者の末梢血、BALF、および死後肺サンプルの分析は、これらの細胞数の減少に伴うTおよびB細胞のロバストな活性化を明らかにする(Kaneko et al 2020;Liao et al 2020)。このように、COVID-19患者のサブセットは、活性化された適応免疫応答を示し、それによって炎症の亢進が増強され、それによって疾患の悪化につながることが明らかになりつつある。では、免疫病理学的状態の形成に寄与するT細胞とB細胞の複雑な役割と、この重要な抗ウイルス免疫応答がCOVID-19の間にどのように破綻するのかについて、具体的に議論する。
COVID-19の間にT細胞によって分泌される炎症性サイトカイン
高炎症状態は、自然免疫細胞と適応免疫細胞の両方から分泌されるサイトカイン、ケモカイン、および関連する炎症性分子によって媒介される。しかし、COVID-19では、適応免疫細胞の炎症性分子に対する相対的な寄与度はまだ明らかになっていないが、発表された研究では複雑な相互作用が示唆されている。39人の患者および24人の健常対照者における21種類のサイトカインおよびケモカインのプロファイリングにより、末梢血中のIFN-γ、IL-2,IL-12などのTH1特異的サイトカインおよびTH17特異的IL-17のレベルが増加していることが明らかになった。軽症例(n=19)と比較して、重症患者(n=10)ではこれらのサイトカインのレベルが上昇していた。この研究の限界は、重症患者の年齢中央値が軽症患者よりも高かったことであった(Song et al 2020)。
同様に、(Zhou et al 2020b)は、IFN-γ、GM-脳脊髄液、IL-6の分泌量が増加し、ICU症例では非ICU症例よりもロバストな発現を示し、ICU症例ではTH1細胞応答が亢進したことを報告している。年齢、性別および他の関連因子を考慮すると、現在、多くの他の研究で、COVID-19患者はTH1特異的サイトカインのレベルが増加し、軽症例よりも重症例でより頑健なレベルが見られることが確認されている(Huang C. et al 2020; Xu Z. et al 2020; Zhou et al 2020b)。同様に、CD8+ T細胞特異的サイトカインは、COVID-19患者において増加し、軽症よりも重症で顕著であった(Zhou et al 2020b)。GM-脳脊髄液の発現の増加は、非ICU患者よりもICU患者由来のCD8+ T細胞で認められたが、IL-6およびTNF-αレベルでは差は観察されなかった。COVID-19患者に由来し、試験管内試験で刺激されたPBMCは、CCL2,CXCL10,Eotaxin、およびIL-1RAの発現の増加を示し、CD8+ T細胞の刺激はIFN-γレベルの増加と関連しており、これらの細胞の機能的応答性を示していた(Mathew et al 2020)。したがって、これらの研究は、COVID-19患者におけるTH1特異的およびCD8+ T細胞の頑健な活性化を示唆している。
逆に、重度のCOVID-19症例においてT細胞によるサイトカイン発現の減少を示す研究がある。Zheng H.Y. et al 2020)による研究は、重症症例由来のCD4+ T細胞におけるIFN-γ、IL-2,およびTNF-αの発現の低下を示した。同様に、IL-2+ CD8+およびIFN-γ+ CD8+細胞の減少も観察された(Diao et al 2020)。ほとんどの研究は、CD4+およびCD8+ T細胞による強力な活性化およびproinflammatory cytokinesの放出を指摘しているが、後者の研究における不一致は、これらの細胞の機能的疲弊に起因している可能性があり、これについては “COVID-19の間のリンパ球減少症 “の項で議論することにする。
TH1サイトカインの存在に加えて、IL-4およびIL-5のようなTH2サイトカイン、およびTH17特異的IL-17のようなTH2サイトカインが、いくつかの研究で報告された(Han et al 2020; Huang C. et al 2020; Song et al 2020; Tan L. et al 2020b; Xu Z. et al 2020)。軽症例で通常見られるTH2サイトカインの存在は、TH2特異的応答を有する他の呼吸器疾患の存在によって説明され得る(Laing et al 2020)。全体的に、これらの研究はすべて、COVID-19のTリンパ球による炎症性分子の分泌が増加していることを示唆しているが、これは、不均一な反応を有するとはいえ、研究された患者の年齢のばらつき、異なるサンプリング時間、および併存疾患の存在に起因している可能性があり、さらなる調査が必要である。
COVID-19感染時のT細胞の活性化と枯渇状態
T細胞およびB細胞の活性化、枯渇および増殖反応は、疾患の重症度を決定する不可欠な要素と考えられている。疑いなく、研究は、COVID-19患者における疾患重症度も決定しうる予測マーカーとしてのリンパ球減少を示している(Liu J. et al 2020; Tan L. et al 2020b; Wang et al 2020b; Yang A.P. et al 2020; Yang X. et al 2020; Zhang et al 2020a)。しかしながら、COVID-19の間のこれらの細胞の機能的および枯渇状態に関する矛盾した報告が存在する。さらに、疾患全体を通してこれらの変化を理解することは、基礎となる免疫応答、共存状態、および感染症への以前の曝露の複雑さを考慮すると、課題として残されている。
単一の患者(50歳男性)の末梢血研究は、HLA-DR発現によってマークされたCD4+およびCD8+ T細胞の頑健な活性化を明らかにした(Xu Z. et al 2020)。しかし、この研究の大きな制限は、単一の患者のみを研究したことであった。マルチパラメータフローサイトメトリーアプローチを用いて、Kuri-Cervantes et al 2020)は、35人のCOVID-19患者(n = 7中等度、n = 28重度)を研究した。この研究により、重症患者のサブセットは、CD4+およびCD8+ T細胞の両方においてCD38およびHLA-DR発現によって明らかにされるようなT細胞活性化を示したことが明らかになった(Kuri-Cervantes et al 2020)。解析することにより、健常者(n = 5)および重症症例(n = 16)に由来するPBMCを解析したところ、著者らは、ペルフォリンおよびグランザイムBによって明らかにされたように、細胞傷害性CD8+記憶細胞の割合の増加を見いだした。
同様に、重症例のサブセットでは、CD4+およびCD8+ T細胞を発現するKi-67が増加し、増殖を示した。同時に、これらの所見から、T細胞の反応は不均一であることが明らかになったが、全体的には、重症症例のサブセットでは、これらの細胞の活性化と増殖の状態に偏りがあることが示唆された。この所見の限界は、サンプル数が少ないことであり、これが疾患の重症度に関するT細胞の状態に関する決定的な所見が得られなかった理由と考えられる。
(De Biasi et al 2020)は、健常者(n = 12)とCOVID-19患者(n = 21)のT細胞応答を研究するために、同様のマルチパラメータフローサイトメトリー法を用いた。この研究では、CD38+HLA-D集団の増加によって明らかになったように、CD4+およびCD8+ T細胞の活性化された状態が見出された。CD4+ TおよびCD8+ T細胞の活性化状態は、試験管内試験で刺激した場合のIFN-γ、TNF-α、IL-17およびIL-2の産生によってさらに確認された。この研究の主な制限は、サンプルサイズが小さく、様々な疾患重症度の患者におけるT細胞応答の比較が制限されたことであった。別の研究では、Song et al 2020)は、軽度(n = 20)よりも重度(n = 9)の患者において、CD8+ Tの活性化された状態を示したが、CD4+ T細胞の活性化された状態は示さなかった。CD8+ T細胞の活性化された状態は、CD38+HLA-DR+、HLA-DR+、およびCD38+HLA-DR+マーカー発現の集団の増加によって反映された(Song et al 2020)。さらに、CD8+ T細胞は、軽度よりも重度の方がより顕著な活性化を伴う、グランザイムB、ペルフォリン、およびグランリジンのような細胞溶解マーカーの増加と関連していた。
研究を横断した結果、軽度・中等度よりも重度の方がT細胞の活性化が強いことが明らかになっていた。また、これらの細胞は、活性化状態と並行して疲弊状態を示す可能性がある。Mathew et al 2020)による125人の患者のディープ免疫プロファイリングでは、CD4+およびCD8+ T細胞の両方が、疾患の重症度に対応するCD38およびHLA-DRの共発現によって明らかにされるような活性化状態を示すことが示された。さらに、これらの細胞は、増殖(Ki-67)および枯渇(PD-1)マーカーの発現にも関連していた。このように、本研究は、T細胞の高活性化状態が最終的に疲弊につながる可能性を示唆しており、T細胞の機能的特徴と疲弊の特徴が疾患の重症度を反映している可能性を示唆している。
68人のCOVID-19患者のコホートにおけるZheng M. et al 2020)の研究では、NKG2Aの発現の増加によって示されるように、広範なCD8+ T細胞の疲弊が明らかにされた。細胞内サイトカイン染色(IFN-γ、IL-2,およびグランザイムB)は、これらの細胞の活性化プロファイルの減少をさらに確認し、これは軽度(n = 13)の症例よりも重度(n = 55)の症例でより顕著であった(Zheng M. et al 2020)。Song et al 2020)およびDe Biasi et al 2020)の研究で述べたように、T細胞は、CD8+ T細胞上の疲弊マーカーPD-1およびTIM-3の発現、およびCD4+細胞上のTIM-3の発現と同時に見られる活性化状態を示した。疲弊は軽度(n=20)よりも重度(n=9)で顕著であった。しかし、これらの研究はいずれも重症度を比較する際に患者の年齢を考慮していなかった。さらに、これらの研究では、これらの細胞の機能的特性を測定しながら、これらの細胞の時間的ダイナミクスを考慮していなかった。
同意して、Zheng H.Y. et al 2020)は、IFN-γおよびIL-2発現CD4+ T細胞の低い割合によって明らかにされるように、軽度(n = 10)群よりも重度(n = 6)群の方がCD4+ T細胞の機能的活性化が低下していることを示した。一方、IL-2を発現するCD4+ T細胞の集団も健常者群と軽度群では有意に低かった。さらに、CD8+ T細胞は枯渇状態を示し、CTLA-4は軽度者よりも重度者で、TGITは健常者よりも重度者で増加したが、PD-1は健常者よりも軽度者で増加していた。CD4+およびCD8+ T細胞の両方の枯渇状態は、ICUを必要とする患者においても認められた(Diao et al 2020)。枯渇状態は、PD-1およびTim-3発現の増加によって明らかであり、CD4+ T細胞よりもCD8+ T細胞でより顕著であった。これらの研究は、他の研究とともに、このように、堅牢な活性化に続いてCD4+およびCD8+ T細胞の枯渇が疾患の進行に関与している可能性があり、一方で、T細胞の枯渇を防ぎ、それらの機能的な状態を回復させるチェックポイント阻害剤(抗PD-1抗体;NCT04268537)のような治療法は、一部の患者に利益をもたらす可能性があることを示唆している。このようなアプローチを治療的介入に用いる前に、さらなる研究が必要である。
死亡したCOVID-19患者の死後調査を行い、感染部位におけるT細胞の状態を調べた。肺におけるT細胞プロファイリングおよびそれらの活性化状態は、活性化状態を示すCD4+およびCD8+T細胞の存在の増加を明らかにした(Song et al 2020)。これらの細胞の浸潤のこの増加は、末梢血の減少と同時に関連していた。他のものは、CD8+ T細胞の同様の活性化プロフィールを示した(Kuri-Cervantes et al 2020;Mathew et al 2020)。CD8+ T細胞のこの活性化状態は、研究を横断して一貫して存在しており、COVID-19患者のBALFサンプルにおける免疫プロファイリングの報告では、GZMAおよびGZMKのようなCD8+ T細胞細胞分裂遺伝子の発現の増加とともに、軽症例および重症例の両方において肺におけるCD4+およびCD8+ T細胞の増加が示された(Liao et al 2020)。このように、これらの研究は、末梢血中のT細胞の活性化と枯渇状態が不均一である一方で、感染部位(肺)ではより一貫した活性化状態であることを示唆している(図4)。
図4 SARS-CoV-2感染時のTおよびB細胞免疫応答
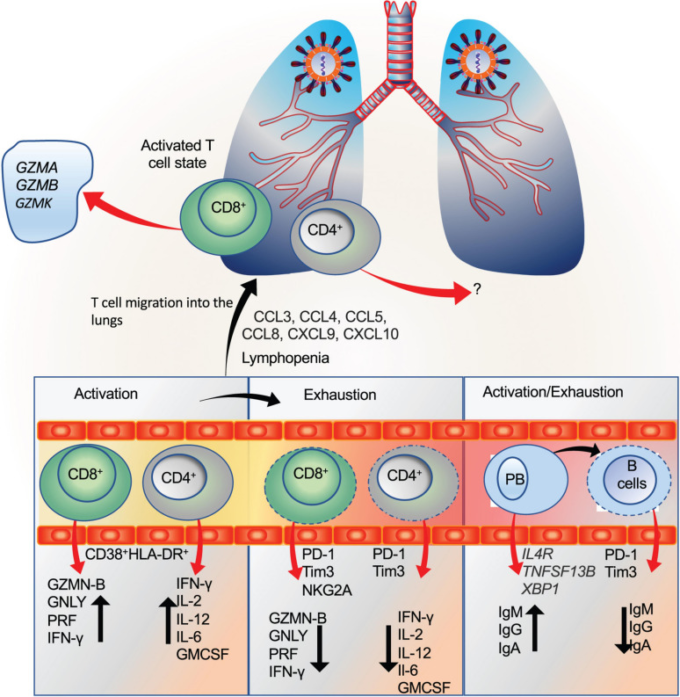
A)循環中のCD4+およびCD8+ Tの活性化状態は、CD38+ HLA-DR+で示される。これらの活性化されたT細胞は、それぞれのケモカインの存在下で感染部位(最初は肺)でさらにリクルートされる。活性化CD4+ T細胞は、IFN-γ、IL-2,IL-12,IL-6,およびGM-脳脊髄液のようなサイトカインの存在によって示され、一方、活性化CD8+T(細胞傷害性T細胞)は、顆粒酵素、ペルフォリン、およびIFN-γの分泌によって示される。SARS-CoV-2感染時には、肺でグランザイムA、B、K(GZM-B、GZM-A、GZM-K)の増加発現を示す活性化CD8+T細胞が認められた(Liao et al 2020;Song et al 2020;Zheng M. et al 2020)。
B)T細胞もまた、PD-1,Tim3,NKG2Aの発現によって示されるように疲弊した状態を示すことがわかった。しかしながら、疲弊したT細胞を示す研究のほとんどは末梢血に限定されており、一方、肺は活性化されたT細胞を示すことがほとんどであったが、いくつかの疲弊マーカーの発現を伴うことから、活性化状態に続いて疲弊が生じることが示唆された。疲弊したT細胞は、それぞれのケモカインや細胞溶解性顆粒の発現が低下していることが示されている。
C)同様に、抗体産生B細胞(プラスマブラスト;PB)は、IL4R、TNFSF13B、およびXBP1の発現によって反映されるように活性化状態を示すことが示されたが、同時に、これらの細胞の排尽状態も末梢血で報告された。B細胞の枯渇状態は、抗体産生の減少に反映される。
さらに、CD4+ T細胞とは異なり、CD8+ T細胞の活性化状態はより顕著であり、これが比較的早く枯渇状態になることを説明していると考えられる(Wherry er al)。 興味深いことに、回復期患者におけるCD8+T細胞応答を研究することにより、Habel et al 2020)は、これらの細胞がナイーブ、幹細胞および中枢記憶の表現型に偏っており、エフェクターT細胞が低いことを発見した。インフルエンザAウイルスと比較しながら、SARS-CoV-2誘導CD8+ Tは比較的低い応答を示す。他の研究者はまた、COVID-19患者におけるCD8+ T細胞サブセット(ナイーブ、エフェクター、および記憶)の有意な低下を示しており、重症(n = 5)および軽症(n = 4)よりも重症(n = 3)の方が顕著な低下を示しており、初期疾患中のロバストな活性化に続いて重症状態中に枯渇することを示唆している(Wang W. et al 2020)。逆に、CD4+ T細胞は、重症例および健常対照(n = 12)よりも軽症例および重症例の方が高かった。これらの結果は、全体的なT細胞応答が不均一であることを示唆しているが、CD8+応答は、感染時には頑健であり、重症度と相関しているが、少なくともいくつかのケースでは、応答が長続きしない可能性があることを示唆している。
CD4+およびCD8+ T細胞もまた、調節障害された応答を示す(Qin et al 2020)。CD3+ CD4+ CD25+ CD127low+集団によってマークされるようなCD4+調節細胞のレベルの低下が重症例で見られた。同様に、本研究では、重症症例においてCD8+サプレッサーT細胞(CD3+、CD8+、CD28+)の減少が認められた。全体的には、より大規模なコホート規模で、局所と全身のT細胞応答と持続性を同時にプロファイルし、年齢をマッチさせた患者におけるこれらの応答と疾患の重症度とを相関させる、より包括的な研究が必要であると考えられる。
COVID-19投与中のB細胞反応障害
上述したように、制御された制御されたB細胞応答は、CoVに対する効果的な免疫応答に不可欠である。しかし、特定の条件下では、B細胞応答は有害であり、基礎疾患の状態を悪化させる可能性がある。COVID-19患者では、B細胞の数は減少しているが、B細胞の活性化は疾患の重症度と相関しているケースもあるという考えが浮上してきた。
計算機を用いたディープ免疫プロファイリングにより、COVID-19の重症度の様々な段階でのB細胞応答と臨床パラメータとの複雑な関係が明らかになった。B細胞は増殖(Ki67+)分化(CD27+ CD38+)枯渇マーカー(PD-1+)を発現している。これらのマーカーのより強固な発現は、軽度の中等度と比較して重症例で観察され、記憶B細胞数の全体的な減少を伴う(Mathew et al 2020)。さらに、報告された患者の70%がIgGおよびIgM Sタンパク質特異的抗体を有しており、抗体分泌プラスマブラストの活性化状態を示唆している。このように、本研究は、軽症例または健常対照では正常な応答を示しているのに対し、重症例では、B細胞が随伴的な活性化および枯渇マーカーを示すことを示している。しかし、このようなB細胞の活性化状態が重症度にどのような影響を与えるのかは研究されなかった。Woodruff et al 2020)は、活性化されたB細胞と疾患重症度との関連性の疑惑を調べることで、自己免疫状態での振る舞いに類似した濾胞外B細胞の頑健な活性化状態を示した。これらの細胞の活性化状態は、重症患者(n=10)において、非重症患者(n=7)および健常対照(n=17)よりも顕著であり、これは、SARS-CoV-2特異的抗体産生および疾患進行と相関していた。さらに、重症患者では、非重症患者に比べて抗体分泌細胞(ASC)の増加が認められ、Sタンパク質特異的な抗体が増加していた。本研究は、重症患者の中には、B細胞応答が強く、SARS-CoV-2抗原特異的抗体の存在が病態の悪化と関連している可能性があることを示している。ASCは、CD138+およびCD21low発現を有する細胞の集団として同定された。しかし、疾患の重症度に関する様々な年齢層間の比較は行われなかった。重症化した症例ではB細胞の活性化が見られたが、その後、その数は急激に減少していることが明らかになった。この減少には様々なメカニズムが関与していると考えられるが、中でもB細胞の枯渇は未だによくわかっていない(Yi et al 2010)。
最近の研究は、COVID-19のいくつかの症例がどのようにして低B細胞数を示すかについての機序的洞察を提供している。金子 et al 2020)は、胸部リンパ節および脾臓の死後サンプル(n = 11)を調査し、これらの患者では、非COVID-19対照(n = 6)と比較して、Bcl-6+胚中心(GC)B細胞が高度に減少していることを明らかにした。このGCの減少は、TFH細胞の分化の低下とTH1細胞数の増加にも関連していた(Kaneko er al)。 さらに、TNF-αレベルの発現の増加が卵胞で認められた。TNF-αがリンパ性卵胞の発生を阻害し、この多能性サイトカインの高レベルがCOVID-19の特徴であるという先行研究に基づき、著者らはGCの減少をこのサイトカインの高レベルに起因するとした。死後の研究に加えて、著者らはCOVID-19患者の末梢血を用いたB細胞解析を行った。その結果、重症患者(n = 25)では、健常対照者(n = 4)回復期患者(n = 39)中等症患者(n = 4)と比較して、ナイーブB細胞、CD19+ B細胞、濾胞性B細胞サブセットの数が有意に減少していた。このように、本研究は、COVID-19の重症症例におけるB細胞の低下の可能性の高い原因を提供している。しかし、重症患者の平均年齢(58~60歳の間で高い)は、対照群、回復期群、中等度群(30~45歳)と比較して有意な差があった。このように、本研究ではB細胞の減少に対する年齢の影響を否定することはできない。これらの細胞の役割を明確に理解するためには、COVID-19 患者の B 細胞数と活性化の状態を疾患の重症度に応じて具体的に調べるために、より多くの研究が必要である。
COVID-19 における抗体の動態
抗体ベースの治療は、CPTによる予備的な結果の成功により、COVID-19に対する潜在的な介入として検討されている。しかしながら、この治療アプローチは、以前のウイルス感染症からの経験に基づいて、COVID-19の重症度を悪化させるリスクと関連している可能性がある(Salazar et al 2017)。さらに、以前のSARS-CoV感染症と同様に、抗体反応は、いくつかの場合には基礎となる免疫病理学的状態に寄与するのではなく、常にウイルスクリアランスを有利にするとは限らない(Zhang et al 2006;Newton et al 2016)。したがって、この免疫病理学的状態は、B細胞の頑健で制御されていない活性化、ADE、交差反応性ではあるが非中和性の抗体の存在、および制御されたB細胞応答の失敗などの要因に起因している可能性がある。研究を横断して、重症および重症患者において、非重症患者と比較して、より高い抗体価が検出された(Long et al 2020a; Gudbjartsson et al 2020; Zhao et al 2020)。適切な抗ウイルス応答を提供するためには、より高い抗体価が有益であるべきであると主張することができるが、より高い抗体価が、多数の重症例および人工呼吸を必要とする患者で見出されたという知見によって反論することができる(Kaneko et al 2020)。この矛盾はまだ解消されておらず、新興のデータは、より高い抗体応答が、過剰な活性化と制御されていないB細胞応答を反映している可能性を示唆している。(Zheng M. et al 2020)は、重度の病状の患者におけるRBD特異的IgGおよびIgA抗体の存在を示した。この研究には、様々な年齢層の重症患者13例と非重症患者41例が含まれてた。
重症例では、IgGおよびIgAレベルの上昇とともに、抗体産生を助ける抗体分泌細胞およびTFH細胞の数も増加していた。さらに、IL-6,CXCL10,補体活性化マーカーC5aなどの炎症性サイトカインやケモカインと重症患者との間には密接な相関が見られた。この研究は、炎症反応と体液性免疫反応との直接的な関係を疾患の重症度と関連づけたものである。しかし、これらのSARS-CoV-2特異的抗体の抗原中和性は不明であった。さらに、重症症例のサンプル数が少なかったことも、頑健な抗体反応が重症度と正の相関を示す可能性があるという決定的な結論を出すには限界があった。
同様に、(Zhao et al 2020)は、臨床的にCOVID-19と診断された173名の患者(年齢中央値48歳)の抗体反応を調査した。この中で、抗体反応と重症度との関係を縦断的に調べたのは、9名の患者(3名が重症、6名が非重症)でした。重症患者では、非重症患者に比べて抗体価が高かった。この高い抗体価はウイルスのクリアランスには反映されておらず、重症患者の抗体反応は保護効果よりもむしろ病状の悪化と関連している可能性が示唆された。しかし、他の研究と同様に、この研究もまた、サンプル数が少ないという制限に悩まされている。重症患者ほど抗体反応が高いという考え方に沿って、アイスランドで実施された大規模集団研究(アイスランドのn=30,576人)(Gudbjartsson et al 2020)でも同様の観察結果が得られている。この研究では、年齢、性別、体格指数、喫煙などの薬物習慣、抗炎症薬の使用に関する抗体反応の関係を包括的に説明している。その結果、喫煙習慣があり、抗炎症薬を服用している患者では抗体レベルが低く、体重指数は正の関係を示した。このことから、抗体反応が必ずしもウイルスのクリアランスに有利に働くとは限らないが、場合によっては抗体レベルが高くなることで、患者は病気にかかりやすくなる可能性があることが示唆された。
このような抗体反応と疾患予後の悪さの関係は、以前のSARS-CoV感染症でもよく見られた(Zhang et al 2006)。SARS-CoV感染者の血清サンプルを用いた研究では、Sタンパク質特異的な抗体反応は、回復した患者(20日)に比べて、生存しなかった患者(14.7日)ではより速いことが明らかになった。さらに、抗体価は回復した患者よりも産生の早い死亡患者の方が有意に高かった。抗体応答が保護的な効果よりも有害な効果を持つ理由を機械的に理解するために、Liu et al 2019)は動物モデル(中国アカゲザル)におけるウイルス抗体応答を研究した。SARS-CoVに感染し、抗Sタンパク質IgGで養子移植された動物は、感染を防ぐことができなかったが、代わりに重篤な疾患症状を示した。Sタンパク質抗体の存在は、創傷治癒を阻害し、マクロファージ/単球の肺への浸潤を誘導し、炎症性サイトカインの放出を引き起こし、急性肺障害を引き起こした。このように、Sタンパク質特異的抗体の存在は、ウイルス負荷の有無にかかわらず、肺損傷の誘発に悪影響を及ぼす可能性があることが明らかになった。しかし、臨床試験ではそのメカニズムの詳細を明らかにすることは困難であるため、動物モデルを用いた研究が必要である。さらに、臨床サンプルにおける抗体応答の動態は、基礎疾患の状態、年齢、遺伝的要因に関係しているため、動物モデルは、疾患の重症度に応じた抗体の動態を明らかにするためのより明確なシステムを提供することになるであろう(Guan et al 2020; Hou er al)。
B細胞の活性化とは逆に、いくつかの研究では、軽症および重症の両方の症例において、より低い抗体耐久性が示されている(Yu et al 2020)。中等度の病状を有する26歳の女性を対象とした縦断的研究では、抗体反応は3ヶ月以内に消失した(Liu A. er al)。 サンプルのサイズの大きいコホートにおいて、無症候性患者(n = 37,年齢中央値41歳)は、症候性患者(n = 37)と比較して、IgG抗体およびIgM抗体の耐久性が相対的に低かった。さらに、無症候性群のウイルス脱落は、症候性群よりも高かった(Long et al 2020b)。同様に、Ibarrondoらは、最大4ヶ月までの期間を縦断的に調査した場合、平均年齢43歳のCOVID-19患者34人において、同様の抗体耐久性を示した(Ibarrondo et al 2020)。著者らは、ほとんどが軽度の症状を持つ回復期患者の血清中のIgG抗体の有意な低下を見いだした。縦断的解析では、IgG N、IgM、IgG S1,およびIgA S1のような複数のSARS-CoV-2抗体の減少傾向が見られた(n = 487)(Gudbjartsson et al 2020)。別の縦断的研究では、回復後3ヶ月以内にSおよびNタンパク質特異的抗体の消失が観察された(Liu A. er al)。 これらの報告から、一部のCOVID-19患者における抗体反応は長続きしない可能性があり、抗体を用いた治療やワクチン研究に課題を投げかけていることが推察される。しかし、COVID-19における抗体反応の持続性を調べるためには、より大きなコホートサイズとより長い時間枠での縦断的研究が必要である。
さらに、対応する抗体応答を有する様々な疾患状態を比較することにより、この応答がどのように調節されているかについての明確な洞察が得られるであろう。重篤な疾患症状を有する患者では、TNF-αがGC、ひいてはB細胞数に影響を及ぼす可能性があると考えられる(Kaneko er al)。 重症または重症患者に対する回復期血漿療法(CPT)を検討する際には、このダイナミックな抗体反応が重要である。患者が既に十分な抗体を有している場合、CPTは実行可能な治療オプションではないかもしれない(Anderson et al 2020;Duan et al 2020)。多くの研究がCPTでの成功を報告しているが、いくつかの研究では、このアプローチによる付加的な有益な効果がないことが示されている(Li L. et al 2020)。したがって、このアプローチを使用する際には、事前に注意を払うべきである、すなわち、患者が既に十分なウイルス特異的抗体を有しているか、または交差反応性抗体および自己抗体が存在する場合には、血漿療法は有益な効果よりも有害な効果をもたらす可能性があり、これが一部の患者におけるCPTの非反応性の理由であるかもしれない(Nagoba et al 2020)。
SARS-CoV-2抗体の交差反応性と中和特性
一連のSARS-CoV特異的抗体は、SARS-CoV-2との交差反応性を示している。これらの抗体は、Sタンパク質および大部分がRBD領域を標的とする(Hoffmann et al 2020)。CR3022およびS309のようなSARS-CoVに対するモノクローナル抗体は、SARS-CoV-2との交差反応性を示している(Pinto et al 2020; Wang et al 2020a)。同様に、285人の患者を対象とした研究において、SARS-CoVからのSタンパク質特異的抗体は、患者のサブセット(n = 5)においてCoV-2 Nタンパク質との交差反応性を示したが、SARS-CoV-2のS1サブユニットに対しては交差反応性は検出されなかった(Long et al 2020a)。したがって、これらの抗体のいくつかの交差反応性は、複数のコロナウイルスに対するそれらの有効性を保証するかもしれない。
しかし、同時に、これらの交差反応性抗体は中和性を有するべきであり、そうでなければ、有害な効果を有することになる。最近の研究では、これらの抗体の交差反応性と中和性を同時に探った(Lv et al 2020)。この研究は、15人のSARS-CoV-2および7人のSARS-CoV患者からの血漿を使用し、これらのサンプルからの抗体反応間の交差反応性は高いが、抗体の中和性は非常に低いことを発見した。これらの結果は、SARS-CoV-2およびSARS-CoVの動物モデルでさらに確認された。S309抗体はSARS-CoV-2に対してより良好な中和特性を示したが、CR3022に対する中和特性はまだ知られていない(Pinto et al 2020; Wang et al 2020a)。したがって、SARS-CoV-2からの抗体応答の高度な交差反応性は、他の関連するCoVとの間で見出され得るが、これらの抗体の中和特性はエピトープ特異的である可能性がある。このような交差反応性の弱い抗体の中和性は、抗体依存性増強(ADE)による合併症を防ぐために、治療介入として使用する前に十分な検査を行う必要がある。これらの要因は、回復期血漿療法を検討する際にも不可欠である。
最近のエレガントな研究では、Cao et al 2020)は、60人の回復期COVID-19患者からのB細胞のsc-RNA-seqを行った。この研究により、14の中和抗体が同定され、そのうちの1つ(BD-368-2)が最も強力な効果を示した。BD-368-2はさらに動物モデルでの有効性を検討し、SARS-CoV-2トランスジェニック動物での治療効果を示した。さらに、異なるエピトープを標的とした 2 種類のモノクローナル抗体の使用は、単一の抗体よりも有効な治療介入であることが示唆された。このように、本疾患の負担を軽減するための標的治療のために、強力な中和性を有する抗体を見つけるためには、この方向でのさらなる研究が必要である。
COVID-19における抗体依存性の増強
非中和性であるが交差反応性の抗体は、ADEを引き起こし、それゆえに免疫病理学的状態を増強することがある。ADEは、様々な経路を介して起こり得るが、その中でも最も重要なものは、食細胞による抗体共役ウイルスのエンドサイトーシス(Fcγ受容体IIa(FcγRIIa)を介して)および強化された抗体免疫複合体の形成を含む(Kulkarni, 2020)。食細胞によるウイルスの取り込みは、頑健な伝播を誘導し、それゆえに病状をさらに悪化させる可能性があり、一方、抗体免疫複合体形成は、高い親炎症性応答を生成する可能性がある。以前のウイルス感染からの経験は、非中和抗体の存在下では、ADEが一部の患者において疾患転帰の悪化につながる可能性があることを示しており、(Lee W.S. et al 2020)によってレビューされている。単球およびマクロファージを対象とした試験管内試験研究では、SARS-CoVにおけるADEが示されている(Flipse et al 2016)。しかしながら、SARS-CoVまたはSARS-CoV-2感染中のADEの発生を示す決定的な臨床データは得られていない。それにもかかわらず、CoVの様々なエピトープ領域間の実質的な交差反応性に基づいて、一部の患者は、以前の感染からの交差反応性ではあるが中和しない抗体の存在のためにADEを示す可能性がある。
COVID-19における型破りなT細胞
3人のCOVID-19患者の気管支肺胞洗浄液分析では、感染の急性期にNKT細胞の数が多いことが明らかになった(Kim et al 2020)。このNKT細胞の増加は、末梢血にも同様に反映されていた。逆に、回復期にはこれらの細胞数の減少が認められた。従って、これらの結果は、COVID-19におけるNKT細胞活性の密接な相関を示唆し、これらの細胞の存在は、感染の初期段階におけるウイルスのクリアランスに必要とされる可能性がある。それと同時に、これらの細胞の浸潤および活性の増加は、ある研究で示されたように、好酸球性肺炎に関連したより重篤な転帰をもたらす可能性がある。しかし、サンプル数が少ない(n = 3)ためか、これらの細胞タイプと重症度との直接的な相関は見られなかった。さらに、この研究で使用されたサンプルは、症状発症後の異なる時点で採取されており、結果の解釈を複雑にしている可能性がある。
軽度、中等度から重度まで様々な疾患重症度の範囲のCOVID-19患者30人を対象とした別の研究では、末梢血総NKT細胞の減少が群を超えて見られ、ICU患者(n = 10)とICU以外の患者(n = 11)の間では全体の数に差はなかった(Mazzoni et al 2020)。同様に、Jouan et al 2020)による研究では、COVID-19患者(n = 30,疾患重症度にばらつきがある)の末梢血中のNKTおよびMAIT細胞が、健康な対照(n = 20)と比較して減少していることが示された。循環MAIT細胞の減少は、機械的換気を必要とする重症患者(n = 12)から得られた気管内吸引液(ETA)中のこれらの細胞の増加と同時に関連していたが、ETA中のNKT細胞数の変化は検出されなかった。循環中のIL-18の存在はこれらの細胞の活性化を反映しており、PD-1の発現は感染を通してその後の消耗を示唆していた。このように、この研究は、これらの型破りなT細胞の活性化状態の存在が、疾患重症度の予測評価として役立つ可能性を示している。COVID-19におけるこれらの細胞の寄与を完全に理解するためには、疾患重症度および局所対全身効果に対するこれらの細胞の活性化、増殖および分化状態についてのより多くの研究が必要である(Chen and John Wherry, 2020)。
COVID-19の間のリンパ球減少症
重症および重症のCOVID-19患者における循環リンパ球数の劇的な減少(リンパ球減少症)は、現在、十分に評価されている(Huang C. et al 2020; Liao et al 2020; Liu et al 2020a; Mathew et al 2020; Zhou F. et al 2020; Zhou P. et al 2020)。興味深いことに、リンパ球数の回復もまた、回復期に一貫して見られる(Chen Y. et al 2020)。これらの初期の知見に基づき、リンパ球減少症は、COVID-19疾患重症度の予測指標と考えられている(Tan L. et al 2020b)。SARS-CoV-2の間のリンパ球減少に関連する分子機構は明らかにされていないが、出現した証拠は、以前のウイルス感染から引き出された相関関係に基づいて、複数の因子の役割を示唆している。循環中のリンパ球数の減少は、これらの細胞のリクルートおよび活性化/抑制、感染部位への浸潤の増加、およびアポトーシスおよび/または壊死による細胞死に責任を持つ、改変されたケモカインおよびサイトカインシグナリングに起因し得る(WherryおよびKurachi 2015;WallingおよびKim 2018)。
COVID-19患者の免疫プロファイルは、TおよびB細胞表現型の維持に関与するケモカインおよびサイトカインの適切なレベルを示す(Yang X. et al 2020;Yang Y. et al 2020)。CD8+ T細胞のプライミングおよび化学走性に関与するケモカインおよびサイトカインもまた、患者において検出された。同様に、B細胞の活性化および増殖シグナルに責任のあるサイトカインも十分に存在していたため、リンパ球減少症が、障害された活性化シグナルまたはケモカインシグナリングの結果である可能性を排除した。興味深いことに、最近の研究では、重症COVID-19患者は、活性化された(CD11a+)末梢血CD4+およびCD8+ T細胞(これもSタンパク質反応性である)および末梢血CD4+およびCD8+ T細胞のレベルが低かったことが示唆されている。これらの細胞の数の減少は、炎症反応下での感染部位への移動が同時に行われていることに起因すると考えられる。
同様に、別の研究では、肺における活性化プロファイルおよびこれらの細胞数の増加に伴う末梢血のリンパ球減少が示されている(Song et al 2020)。したがって、これらの活性化されたT細胞の感染部位へのホーミングは、親炎症状態を増幅させることによって疾患の悪化と関連している可能性がある。単一患者の分析では、BALFにおけるCD4+およびCD8+ T細胞の増加が明らかになった(Voiriot et al 2020)。BALFのScRNA-seqとクラスター分析を行ったところ、重症例では増殖性の表現型を持つCD8+ T細胞の存在が明らかになったが、中等症例ではクローン拡大の表現型を示した(Liao et al 2020)。これらの説明から、活性化されたT細胞の感染部位への移動の増加がリンパ球減少症(血中)の原因の一つである可能性があり、後述するように血中に残ったT細胞が最終的に機能不全(疲弊)に陥る可能性があることが示唆されている。
COVID-19患者における循環リンパ球数の減少は、これらの細胞の「疲弊した」状態にも起因する可能性がある(Chen and John Wherry, 2020)。ウイルス負荷の上昇と特異的な抑制シグナルの存在は、協調的な方法でT細胞の転写およびエフェクタープロファイルの変化をもたらす。最初は、それらはエフェクターサイトカインを分泌する性質を失い、そして次第に本質的な維持および活性化表面受容体の発現の減少に進む(WherryおよびKurachi 2015)。その後の抑制性受容体の発現の増加および関連する形態学的変化は、循環からのこれらの細胞の排泄をもたらす(Wherry and Kurachi, 2015)。CD4+ T細胞の排泄は、PD-1,CTLA-4,LAG-3,CD244(2B4)およびTIM-3による抑制性分子シグナル伝達の付随的な増加とともに、IL-2,IL-10,IL-21,IFN-γおよびTNF-αのようなエフェクター分子のそれらの不十分な分泌を決定する(Blank et al 2019; Dong et al 2019)。同様に、CD8+ T細胞の枯渇は、IL-2,IFN-γ、TNF-α、および細胞溶解顆粒の発現の減少によって決定される。加えて、T細胞維持受容体CD122およびCD127の発現の減少、およびPD-1,CTLA-4,NKG2A、TIGIT、LAG-3,CD244(2B4)およびCD160を介した抑制性受容体シグナリングの増加もまた、それらの疲弊を示す(WherryおよびKurachi 2015;Blank et al 2019)。B細胞の疲弊もまた、抑制性受容体PD-1,CD22,およびLAIR-1の発現を伴うT細胞の疲弊と同様に示されているが、これらの細胞の疲弊プロファイルは比較的未解明である(MoirおよびFauchi 2014)。
多くの証拠の体は、COVID-19患者の末梢血中のCD8+ TおよびCD4+ T細胞の機能的な枯渇を示唆している。いくつかの実施形態では、排尽マーカーは、上述のように、活性化マーカーおよび増殖マーカーとともに同時に発現される(Diao et al 2020;Mathew et al 2020;Mazzoni et al 2020)。さらに、BATF、IRF4,およびCD274のような枯渇関連遺伝子の発現の増加もまた、疾患の重症度と相関していた(Hadjadj et al 2020)。興味深いことに、T細胞のアポトーシスの増加は、軽度/中等度と比較して重症化した場合に明らかになった。したがって、COVID-19患者におけるリンパ球減少を説明する1つの方法は、症状の発症後、T細胞が感染に打ち勝つためにプライミングされているということである。しかしながら、ウイルス感染が持続する場合には、これらの細胞は頑健な活性化を獲得し、これは、ChenおよびJohn Wherry(2020)によってレビューされた重症および重篤な患者に見られるように、良いことよりも悪いことをする可能性がある。したがって、これらの細胞の疲弊は、ロバスト活性化応答に先行し、最終的には、以前のウイルス感染で見られたように、循環から排除されるようになる(Wherry, 2011; Blank et al 2019)。例えば、リンパ球性絨毛膜炎ウイルス(LCMV)による急性感染の間、CD8+ T細胞は、機能的な活性化状態を示し、記憶T細胞に発達することが示された。
対照的に、慢性感染時には、CD8+ T細胞は、エフェクター機能が損なわれ、深遠な消耗を示し、その後アポトーシスが起こることが示された(Barber et al 2006; Wherry et al 2007)。同様に、CD8+ T細胞の疲弊は、持続的なヒト免疫不全ウイルス(HIV)感染中によく知られており、PD-1のような疲弊マーカーの強力な発現によって特徴づけられる(Day et al 2006;Petrovas et al 2006)。消耗に続いて、これらの細胞は循環から排除され、これは長期感染に伴う細胞数の減少の原因となる(Petrovas et al 2009)。慢性ウイルス感染中の疲弊につながる転写変化に加えて、分泌抑制分子の存在が、CD8+ T細胞の疲弊におけるIL-10およびTGF-βの顕著な役割とともに、リンパ球の疲弊に関与していることが示唆されている(Wherry, 2011; Blank et al 2019)。COVID-19患者におけるこれらのサイトカインのレベルの増加はまた、CD8+ T細胞枯渇におけるそれらの潜在的な役割を示唆しているかもしれない(Chen, 2020; Liu A. et al 2020)。さらに、重度のCOVID-19患者は、T細胞機能の阻害剤として知られている乳酸レベルの上昇を有していた(Fischer et al 2007; Tan L. et al 2020b)。
リンパ球減少症のもう一つの重要な側面は、感染中のウイルスによる直接的な細胞死である。HIVは、CD4+T細胞がウイルスによる活性化誘導細胞死を受けるよく知られた例である(Day et al 2006;Petrovas et al 2009)。呼吸器ウイルスが直接T細胞のアポトーシスを誘導することは知られていないが、ウイルスによって活性化された二次的な因子が関与している可能性がある。例えば、T細胞のアポトーシスは、インフルエンザウイルス(H5N1)の感染中に死受容体の発現が増強されることによって見られた(Boonnak et al 2014)。MERS感染はまた、ウイルス媒介による細胞死の内因性および外因性経路の活性化によるT細胞のアポトーシスと関連しており、その結果、循環からの枯渇をもたらした(Chu et al 2014)。MERS感染は、これらの細胞では失活しており、細胞死経路の間接的な活性化を示唆していた。いくつかの試験管内試験研究では、T細胞におけるSARS-CoVの低複製および有意な細胞死の欠如が示されている(Chan and Chen, 2008; Wang X. et al 2020)。SARS-CoV-2がT細胞に感染するかどうかは現在のところ不明であるが、COVID-19の間のT細胞の減少は、ウイルスによる直接的な細胞死に起因するものではなく、枯渇機構に起因するものであるように思われる。
リンパ球減少に関連する上記のメカニズムに加えて、死受容体の関与を介して媒介される二次的なシグナリング、ROSの増加、HMGB1および感染および損傷したATII細胞によって放出される他の死誘導剤もまた、T細胞の減少に関与している可能性がある(KaminskyyおよびZhivotovsky 2010; Juno et al 2017; Zhan et al 2017)。したがって、これらの初期の知見に基づいて、リンパ球の枯渇は、これらの細胞を効果がない状態にすることに積極的に関与し、その後にそれらの細胞が排除される(リンパ球減少症)という複数の因子によって駆動されている可能性がある。全体的に明らかになってきたことは、リンパ球減少症がCOVID-19の重症度を予測するマーカーであることを強く示唆している。好中球数の増加とともに、血液リンパ球数は、より優れた予後マーカーとして機能し、患者の免疫病理学的状態を反映する(Giamarellos-Bourboulis et al 2020;Liu et al 2020b)。さらに、これらの新たな研究に基づいて、COVID-19感染中にT細胞応答が不均一であることが明らかになりつつある。末梢血はリンパ球減少症を示し、これらの細胞の大部分が枯渇した状態を示すかもしれないが、感染部位は細胞の活性化されたプロファイルと関連しており、それゆえに疾患の重症度を決定する。したがって、COVID-19に対する治療的介入を設計する際には注意が必要である。治療法を検討する際には、基礎となる免疫学的状態に留意すべきである。リンパ球減少症やT細胞の機能状態や活性化状態が上昇している患者では、現在臨床試験中である間葉系幹細胞のような免疫調節アプローチが有効であるかもしれない(NCT04377334)。T細胞およびB細胞応答が不完全な患者は、回復期血漿療法の恩恵を受けることができ、一方、インターフェロン応答が損なわれた患者はインターフェロン療法により良好な反応を示す可能性がある(NCT04350671; NCT04388709)。したがって、ワクチンが利用可能になる前に、COVID-19の重症例に対する治療を推奨する合理的な方法は、患者の基礎となる免疫学的状態に基づくべきである。しかしながら、患者がサイトカインストームおよび関連するARDSを示す場合、治療の選択肢は困難になる。
さらに、患者の年齢、併存疾患、重症度スコア、サンプル採取時期、分析に使用した方法などを考慮して、T細胞およびB細胞応答を分析することが不可欠である。なぜなら、適応免疫応答は、これらの要因に対して非常に敏感であり、これらの要因を損なうと、COVID-19の間の免疫病理学的状態の発達の理解をさらに複雑にする可能性があるからである。
COVID-19患者におけるサイトカインストーム
重症で重篤なCOVID-19患者は、上述のように、肺に常駐し、浸潤した炎症性免疫細胞によって媒介される免疫賦活の亢進の反映として、サイトカインストーム(CS)を示す。CSは、強力な炎症性サイトカイン、ケモカイン、およびいくつかのインスタンスでは、初期の肺損傷の指標として機能する循環へのインターフェロン(後期応答として)の放出によって明らかになる。CSという用語は、一般的にCAR-T細胞免疫療法中のサイトカイン放出症候群(CRS)と一緒に使用されているが、異なる病理学的状態を反映している可能性がある。IL-6,TNF-α、およびIL1-βが主にCRSを表すが、CSは様々な炎症性細胞によって取り付けられたより複雑な反応である。さらに、最近のレビュー(Vardhana and Wolchok, 2020)で議論されているように、キネティクス、および放出されるサイトカインの濃度にも違いが明らかである。中等症、重症、重症、重症、および回復した患者からのデータは、プロ炎症性サイトカインの存在と疾患の重症度との間の密接な相関を明らかにしている(Huang C. et al 2020;Liao et al 2020;Liu J. et al 2020;Zhao et al 2020)。
COVID-19患者41人(非ICU:28人、ICU:13人)の26種類以上のケモカインおよびサイトカインについての臨床評価では、IL-1β、IL-1RA、IL-17,IL-8,IL-9,IL-10,基礎FGF、G-脳脊髄液、GM-脳脊髄液、IFN-γ、CXCL10,CCL2,CCL3,CCL4,PDGF、TNF-αなどの16種類のレベルの上昇が認められた。非ICU症例と比較して、ICUに入院した患者は、IL1-β、IFN-γ、およびIL-6の増加レベルを示し、SARS-CoVに関して以前に報告されたようなTH1免疫細胞応答を示唆した(Huang C. et al 2020)。さらに、G-脳脊髄液、CXCL10,CCL2,CCL3,およびTNF-αのより高いレベルは、単球およびマクロファージの活性化および肺上皮細胞の損傷を示し、これはICU症例と強く相関していた。この研究の強みは、COVID-19患者を対象とした最初の包括的なサイトカインプロファイリング研究であり、疾患の重症度とサイトカイン反応を比較したことである。この研究の主な制限は、グループ間の比較のためのサンプルサイズが小さいことと、検査に鼻咽頭スワブサンプルではなく下気道の検体を使用していることである – これは感度の高い検体であり、COVID-19検査に一般的に使用される。
比較的類似したサンプルサイズ(n = 40)を用いて、Liu J. et al 2020)は、疾患の重症度に対応するIL-2,IL-6,IL-10およびIFN-γの血清レベルの上昇を発見した。縦断的な解析を行うことで、IL-6,IL-10レベルは重症症例(n = 13)で一貫して上昇していた。サンプル数が少ないことに加えて、本研究の主な限界は、患者のほとんどが糖尿病、高血圧、真菌感染症、その他の慢性疾患を併発していることであり、データの解釈やグループ間の比較を複雑にしている可能性がある。比較的大きなコホート(n = 799)に取り組むことで、Chen T. et al 2020)は、回復した患者(n = 161)と比較して、病気に屈しなければならなかった患者(n = 113)では、IL-2R、IL-6,IL-8,IL-10,TNF-αのレベルが増加していることを発見した。しかし、Huangらの研究とは異なり、死亡した患者ではIL-1βの有意な増加は認められなかった。この不一致は、Huang C. et al 2020)が使用したサンプルが重症患者(13人中5人が死亡)からのものであったのに対し、Chenらは死亡患者を分析したためである可能性がある。したがって、サイトカインのレベルの観察された違いは、疾患の重症度および基礎となる併存疾患を反映している可能性がある。
末梢血プロファイルに加えて、BALFの転写プロファイリングでは、IL-10,CCL2,CXCL10,CCL3,およびCCL4の発現が高く、これは肺の免疫病理を表していることが明らかになった(Xiong er al)。 Xiong et al 2020)。同様に、別の研究において、IL-1β、IL-2,IL-4,IL-5,IL-6,IL-8,IL-10,IL-12p70,IL-17,IFN-α、IFN-γ、およびTNF-αの測定をBALF中で実施し、その結果、中等度の状態と比較して、重症患者においてIL-1β、IL-6,およびIL-8のレベルが有意に増加することを明らかにした(Liao et al 2020)。Zhou Z. et al 2020)による8人のCOVID-19患者のBALF液分析もまた、炎症性細胞のリクルートに関与する主要なケモカイン転写物(IL1RN、IL1β、CXCL17,CXCL8,CXCL1,CXCL2,CCL2,およびCCL7)のアップレギュレーションを示した(Zhou Z. et al 2020)。
BALFのScRNA-seq分析もまた、試験されたすべてのCOVID-19患者において、CXCL9,CXCL10,CXCL11,およびCXCL16の増加した発現を明らかにした(Liao et al 2020)。肺マクロファージは、重症例ではCCL2,CCL3,CCL4,およびCCL7のようなケモカインとともに、IL-1β、IL-6,TNF-αの転写物の増加を示した。肺常在細胞の寄与については、組織免疫組織化学のデータから、死亡した患者から得られた生検サンプルの肺常在細胞において、IL-6,TNF-a、およびIL-10のレベルが増加していることが明らかになった(Wang et al 2020b)。これらの研究を合わせると、重症患者や重症患者の感染部位だけでなく、循環中の炎症性サイトカインおよびケモカイン反応の亢進を明確に示している。これらの最初の報告以来、その後のすべての研究で、IL-6およびある程度のTNF-αの一貫した増加が明らかになった(Chen G. et al 2020;Diao et al 2020;Luo et al 2020;Qin et al 2020;Tan M. et al 2020c;Zheng M. et al 2020)。重症/死亡患者における研究全体にわたる臨床サイトカインプロファイルに基づいて、血清IL-6レベルは、COVID-19重症度の信頼できる予測マーカーとして、および好中球/リンパ球比の増加とともにARDSの潜在的マーカーとして十分に確立されている。したがって、重症COVID-19患者の大部分においてIL-6レベルが確実に上昇していることを考慮すると、現在、この多能性サイトカインのレベルを低下させるための治療が進行中である。例えば、IL-6Rに対して向けられた抗体(トシリズマブなど)は、有望な臨床転帰を示している(Capra et al 2020;Luo et al 2020;Xu X. et al 2020)。同様に、GM-脳脊髄液(NCT04351243)およびIL-β(NCT0434848)に対して指示された抗体もまた、COVID-19患者におけるCSを減衰させるためのそれらの有効性について探索されている。COVID-19患者におけるこれらの炎症性分子の臨床プロファイルを報告した最近の論文の詳細なリストを表1に示す。
表1 2019年12月~2020年5月にCOVID-19患者のリンパ球減少症とサイトカインストームを確立した研究論文の一部をリストアップした
| S.いいえ | 患者数 | 調査結果 | サンプル | 参考文献 |
| 1. | 合計:40軽度:27重度:13 | •CD8 +およびCD4 + T細胞数の減少が観察され、リンパ球減少症を示唆してい ます•重症例ではIL-2,IL-6,IL-10,およびIFN-γレベルの増加 •IL-4およびTNFに有意な変化は観察されなかった-αレベル •T細胞の数は、軽度の症例に匹敵するサイトカインレベルの減少とともに、疾患から回復した患者で増加した |
末梢血/血清 | (Liu J. et al。 2020) |
| 2. | 合計:147健康管理:45軽度/中程度:42重度:43重大:17 | •TNF-α、IFN-γ、IL-2,IL-4,IL-6,IL-10などの血清サイトカインレベルの上昇がすべてのCOVID-19患者で見られた •同様に、CRPレベルはすべてのCOVID-19で上昇したIL-10と正の相関を示した患者 • IL-6およびIL-10レベルが予測疾患重症度バイオマーカーとして提案された |
血清 | (Han et al。 2020) |
| 3. | 合計:138非ICU:102 ICU:32 | •両方のグループの97人の患者がリンパ球減少症を示した。 •好中球数はICU患者で有意に高かった。 •ICU患者は、D-ダイマー、クレアチンキナーゼ-MB、LD、ALT、AST、およびプロカルシトニンのレベルが有意に上昇していることを示し、ICU症例における多臓器不全を示唆している。 |
末梢血/血清 | (Wang D. et al。 2020) |
| 4. | 合計:191回復:137死亡:58 | •死亡した患者は、リンパ球と血小板の数が少なかった。I、血清フェリチン、およびDダイマーが死亡した患者の試料で観察されたトロポニンALT、LDH、クレアチニン、クレアチニンキナーゼ、より高いレベルの一方 • D –ダイマーCOVID-19重症度の潜在的なマーカーとして提案された •高いIL-6レベルは死亡した患者で発見された |
末梢血/血清 | (Zhou F. et al。 2020) |
| 5. | 合計:41非ICU:28 ICU:13 | •ICU患者では好中球数の増加が観察された一方で、総リンパ球数の減少。 •非ICUと比較して、ICU患者では、IL-2,IL-7,IL-10,G脳脊髄液、IP-10(CXCL10)CCL2,CCL3,およびTNF-αの血漿レベルが高いことが観察された。 •Tのレベルの増加H 2サイトカインIL-4が報告されたが。 •ICU患者におけるD-ダイマー、ALT、およびASTのレベルの上昇。 |
末梢血/血清 | (Huang C. et al。 2020) |
| 6. | 合計:150回復:82死亡:68 | •リンパ球の絶対数のレベルの増加。 •死亡した患者では、IL-6,血中クレアチニン、ミオグロビン、心臓トロポニン、CRP、総ビリルビン、および血中尿素窒素のレベルの大幅な上昇が観察された。さらに、より高いレベルのALT、AST、LDH、クレアチニン、およびクレアチニンキナーゼが観察された。 |
末梢血/血清 | (Ruan et al。 2020) |
| 7 | 合計:50中程度:14重度:25重病:11 | •CD4 + T細胞とCD8 + T細胞の合計パーセンテージは、好中球の合計パーセンテージの増加とともに重症例で有意に低く、全体的な免疫応答の機能不全を示している。 •IFN-γ、IL-1ra、IL-2ra、IL-6,IL-10,IL-18,HGF、CCL7,MIG、M-脳脊髄液、G-脳脊髄液、MIG-1a、CTACK、およびIPのレベルの上昇-10。 •IP-10,CCL7,およびIL-1RAは、中等度と比較して重症の場合に高かった。 •リンパ球減少症と好中球数の増加は、重度の疾患と相関することが示唆された。 |
末梢血/血清 | (Yang Y. et al。 2020) |
| 8. | 合計:21中程度:10重度:11 | •リンパ球の絶対数が減少し、特にCD4 + TおよびCD8 + Tのレベルが重症例で低かった。 •重症の場合、より高いレベルのIL-2R、IL-6,IL-10,およびTNF-αが観察された。 •重症の場合、より高いレベルのALT、LDH、CRP、フェリチン、およびD-ダイマーが検出された。 •さらに、CD4 + T細胞で特異的に測定されたIFN-γレベルは、重症の場合に低かった。 |
末梢血/血清 | (Chen G. et al。 2020) |
| 9. | 合計:1人が死亡 | •CD4 + TおよびCD8 + T細胞は減少したが、活性化状態を示した。CD8 + T細胞におけるより高い細胞傷害性顆粒は、過剰活性化を示した。 Tの•増加したレベルH 17細胞。 •肺組織に炎症性単核浸潤が観察された。 |
末梢血/血清 | (Xu Z. et al。 2020) |
| 10. | 合計:452非重度:166重度:286 | •重症の場合、T細胞の総数は減少した。重症例では、さらに低レベルのCD4 +制御性T細胞とCD8 +サプレッサーT細胞が観察された。 •重症例では、好中球数が多く、NLR比が増加した。一方、血中単球と好酸球数は低かった。 •炎症誘発性マーカーの中で、TNF-α、IL-2R、IL-6,IL-8,IL-10,CRP、血清フェリチン、プロカルシトニンのレベルの上昇が観察された。IL-1βに有意差は見られなかった。 |
末梢血/血清 | (Qin et al。 2020) |
| 11. | 合計:56軽度/中程度:31サーバー:25 | •CD4 +、CD8 + T細胞、NK細胞、およびB細胞のレベルは、重症の場合に低かった。一方、T REG細胞は、軽度の症例では中程度に増加することがわかった。 •重症の場合、IL-2,IL-6,IL-10,およびTNF-αのレベルが高くなった。IL-4の増加は、軽度ではあるが重度ではない症例で観察された。さらに、IL-2およびIL-6は疾患の重症度の信頼できる指標として提案された。 •COVID-19患者では、血清レベルが低レベルと一致していないか、変化していなかった。 |
末梢血/血清 | (Tan M. et al。 2020c) |
| 12. | 合計:222非重度:81重度:67 | •重症の場合、CD4 +、CD8 + T細胞のレベルが低い高NLR 。 •IFN-γ、IL-2,IL-6,およびIL-10のサイトカインレベルが高いことが、NLRが高い患者で見られた。重症例と非重症例の間でIL-4レベルに有意差は観察されなかった。 • NLRは予測疾患マーカーとして提案された |
末梢血/血清 | (Zhang et al。 2020a) |
| 13. | 合計:25回復済み:14回復なし:11 | • COVID-19患者では、CD3 + T細胞、CD4 + T細胞、CD8 + T、NK細胞、およびB細胞のレベルが低くなっている。ウイルスのクリアランスを示した治療を受けた患者は、CD3 + T細胞、CD4 + T細胞、CD8 + T細胞のレベルの回復を示したが、NK細胞数は一貫していなかった。 •リンパ球減少症は、この疾患の予測バイオマーカーと見なされていた。 |
末梢血 | (Chen X. et al。 2020) |
| 14. | 合計:22健康:10軽度/中程度:10重度:6 | • IFN-γの減少、および軽度よりも重症のグループでこれらの細胞によって産生されたTNF-αによって明らかにされたように、機能的なCD4 + T細胞の顕著な減少が観察された。CD8 + T細胞は、軽度の症例よりも重症の場合に、グランザイムBとパーフォリンのレベルの上昇によって特徴づけられる活性化プロファイルを明らかにした。 •CD8 +細胞は、軽度より重度のグループで倦怠感マーカーCTLA-4の発現が増加し、健康なグループより軽度のグループでPD-1が増加した。 •重症、軽度、健康な対照群の間で、IL-6とTNF-αに有意差は観察されなかった。ただし、増加傾向が見られた。 |
末梢血/血清 | (Zheng HY et al。 2020) |
| 15.15。 | 合計:68軽度/中程度:55重度:13 | •重度の症状を示している患者のCD8 + TおよびNK細胞の数の減少。 •CD8 + TによるIFN-γ、IL-2,グランザイムBの発現の減少、およびNK細胞によるTNF-α発現の減少が観察され、CD8 + TおよびNK細胞の枯渇を示している。 |
末梢血/血清 | (Zheng M. et al。 2020) |
| 16. | 合計:軽度から重度の症状のある99人の患者 | •正常範囲と比較した場合、リンパ球数の減少と好中球の増加が観察された。 •IL-6,D-ダイマー、ALT、AST、LDH、ミオグロビン、プロカルシトニン、血清フェリチン、赤血球沈降速度、およびCRPの血清レベルの上昇がすべての研究対象患者で観察された。血清クレアチニンとクレアチニンキナーゼは一貫性のない傾向を示した。 |
末梢血/血清 | (Chen N. et al。 2020) |
| 17 | 合計:522軽度/中程度:151重度:53 | •CD4 +およびCD8 + T細胞の総数の減少がほとんどの患者で観察され、ICUに入院した患者でさらに減少が報告された。 •PD1やTIM3などのT細胞枯渇マーカーは、重症患者で高かった。 •TNF-α、IL-6,IL-10の血清レベルは症状のある患者で高かった。しかし、IFN-γ、IL-2,およびIL-4のレベルに有意な変化はグループ間で観察されなかった。 •T細胞数が回復し、IFN-γ、IL-10,IL-6,およびTNF-αのレベルは、患者のサブセットで疾患が解消するにつれて減少した。 |
末梢血/血清 | (Diao et al。 2020) |
| 18 | 合計:710生存者:20非生存者:32 | •非生存者の血液分析により、総リンパ球数の減少と血小板数の増加が明らかになった。血清分析は、総ビリルビン、クレアチニン、および乳酸濃度の増加を明らかにした。 | 末梢血/血清 | (Yang X. et al。 2020) |
| 19 | 合計:さまざまな疾患の重症度を持つ34人の患者 | •IL-10,IL-6,TNF-αなどの炎症性サイトカインを分泌することがわかった、血中の炎症性単球のレベルの上昇の存在。 | 末梢血/血清 | (Zhang D. et al。 2020) |
| 20 | 合計:80非重度:11重度:69 | •CRP、フェリチン、IL-6,LDHのレベルは、より長い治療法と関連していることが示された。 • IL-6レベルは、疾患の重症度と正の相関があることが示され、予測バイオマーカーとして示唆された。 |
血清 | (Liu T. et al。 2020) |
| 21 | 合計:36健康:10非ICU:16 ICU:10 | •非ICUと比較して、ICU患者ではCD4 +およびCD8 + T細胞を含む総リンパ球の有意な減少が観察された。CD4 +およびCD8 + T細胞の両方が活性化された表現型を示した。しかし、ICU患者と非ICU患者の間でB細胞とNK細胞に変化は観察されなかった。 •COVID-19患者では炎症性単球の割合が高く、ICU患者ではさらに増加している。これらの単球は、より高レベルのGM-脳脊髄液およびIL-6を分泌することが示された。 |
末梢血 | (Zhou et al。 2020a) |
| 22 | 合計:799回復:161死亡:113 | •白血球増加症は、この病気で死亡した56人の患者で観察された。死亡した患者はリンパ球が大幅に減少し、リンパ球減少症を示した。 •IL-2,IL-6,IL-8,IL-10,およびTNF-αのレベルは、回復した患者と比較して、死亡した患者の方が高かった。 •D-ダイマー、フェリチン、ALT、AST、プロカルシトニン、クレアチニンクレアチンキナーゼ、総ビリルビン、ALP、およびGGTの血清レベルは、死亡した患者で著しく増加した。 |
末梢血/血清 | (Chen T. et al。 2020) |
| 23 | 合計:70中程度-治癒:40重度-治癒:15死亡:15 | •病気のために死亡した患者の血液中のリンパ球の割合の急激な低下。一方、血中リンパ球の割合の実質的な回復は、病気から回復した患者で見られた。 •この研究は、COVID-19の予測的予後マーカーとしてリンパ球減少症を示唆している。 |
末梢血 | (Tan L. et al。 2020b) |
| 24 | 合計:70軽度/中程度:8クリティカル:10コントロール:10 | •CCL5の血清レベルは、軽度/中等度の健康な対照と比較して、重症患者で非常に増加した。 •IL-1β、IL-6,IL-8,およびその他のケモカインCXCL8,CCL4,CCL3のレベルも増加した。 |
血清 | (Patterson et al。 2020) |
| 25 | 合計:54軽度/中程度:26重度:28 | •単球の過剰活性化を伴うマクロファージ活性化症候群が重症例で発見された。 •リンパ球数(CD4 + TおよびB細胞)の減少とNK細胞の減少が観察された。 •重症の場合、血中IL-6およびCRPレベルが上昇した。さらに、重症例では、フィブリノーゲン、D-ダイマー、クレアチニンのレベルの上昇が見られた。 |
末梢血/血清 | (Giamarellos-Bourboulis et al。 2020) |
| 26 | 合計:48 SARS-CoV-2陽性:24 SARS-CoV-2陰性:24 | •IFN-IおよびIFN-III応答の低下は、患者サンプルおよび初代呼吸器上皮細胞のinvitro細胞培養モデルで観察された。 •IL-6,IL1RA、CCL2,CCL8,CXCL2,CXCL8,CXCL9,CXCL16の血清レベルの上昇が |
血清 | (Blanco-Melo et al。 2020) |
| 27 | COVID-19:1484健康:9その他:272 | •COVID-19患者の血清では、健康な対照または多発性骨髄腫の患者と比較して、有意に高いレベルのIL-6,IL-8,およびTNF-αが観察された。 • IL-6,IL-8,およびTNF-αは、最悪の疾患転帰と関連しており、疾患の予測指標として示唆された。 |
血清 | (Del Valle et al。 2020) |
| 28 | 合計:102 COVID-19:27インフルエンザ:75 | •COVID-19患者は、疾患の進行に関連する血清CRPレベルの上昇を示した。 • CRPレベルは、初期段階のCOVID-19の予測マーカーとして提案された。 |
血清 | (Tan C. et al。 2020) |
| 29 | 合計:132軽度/中程度:60重度:56重大:16 | •リンパ球数の減少は、重症で重症の患者で観察された。同様に、血清CRPおよびSAAのレベルの上昇が観察された。 •リンパ球減少症を伴うSAAは、述語的疾患マーカーとして提案された。 |
末梢血/血清 | (Li H. et al。 2020) |
| 30 | 合計:377軽度/中程度:260重度:117 | •重度の疾患症状のある患者では、血清CRPおよびd-ダイマーのレベルの上昇とともに、NLRの上昇が観察された。 • NLT、CRP、およびd – dimerが予測疾患マーカーとして提案された。 |
末梢血/血清 | (Zhou et al。 2020b) |
| 31 | 合計:377軽度/中程度:69重度:24 | •重症例では、有意に高いNLR、PLR、LMR、および総好中球数が観察された。一方、リンパ球の数は減少した。 •血清CRPレベルは重症例で高かった。 • NLRは、予測疾患バイオマーカーとして提案された。 |
末梢血 | (Yang AP et al。 2020) |
| 32 | 合計:18重大:16重大:2 | •CD4 +、CD8 +、および形質芽細胞の活性化プロファイルの増加がCOVID-19患者で見られた。 •興味深いことに、重症の場合は、CD4 + T細胞の活性化プロファイル、Tの下側番号に関連付けられたFHの細胞、網羅CD8 + T細胞。 •血清AST、CRP、およびクレアチニンキナーゼのレベルの上昇が観察された。 • CRPは予測疾患マーカーとして提案された。 |
末梢血/血清 | (Wang G. et al。 2020) |
| 33 | 合計:221通常:36回復:60 COVID-19:125 | •CD4 +およびCD8 + T細胞は、活性化マーカー(CD38およびHLA-DR)増殖マーカー(Ki-67)および消耗マーカー(PD-1)の発現に関連していた。 •この精巧な研究は、200の免疫パラメーターを特徴とし、臨床的特徴および疾患の重症度と相関していた。 •CXCL10,CXCL9,CCL2,IL-1RAなどのケモカインの増加がCOVID-19患者の半数で観察された。 •COVID-19患者では、健康な対照または回復した患者と比較して、フェリチン、D-ダイマー、およびCRPのレベルの上昇が観察された。 |
(Mathew et al。 2020) | |
| 34 | 合計:41軽度:29重度:12 | •CD4 +、CD8 +、およびNK細胞数の減少から明らかなように、軽度の患者ではわずかなリンパ球減少症が観察され、重度のCOVID-19患者では有意に高かった。 •末梢血はCD8 + Tの活性化状態の増加を示し、軽度の症例よりも重症の場合にCD38 + CD8 +、CD38 + HLA-DR、およびCD38 + HLA-DR + CD8 +細胞の割合が高くなった。CD4 +には有意な変化は見られなかったが、 •CD8 +では消耗マーカーPD-1およびTIM-3の発現の増加が観察され、軽度よりも重症の場合はCD4 + T細胞でPD-1が観察された。 •COVID-19患者では、IL-6,TNF-α、IL-17A、IFN-γ、MCP-1,IL-10,IL-4,およびIL-5のレベルの上昇が観察された。 |
末梢血 | (Song et al。 2020) |
| 35 | 合計:82(故人) | •リンパ球減少症、好中球増加症、および血小板減少症が観察された。 •CRP、LDH、ALT、およびD-ダイマーのレベルの上昇が見られた。 •IL-6レベルの上昇 |
末梢血 | (Zhang et al。 2020b) |
| 36 | 合計:24軽度:4重度:5重大:3 | •単球、NK細胞、骨髄由来サプレッサー細胞などの自然免疫細胞は、重症患者で減少するよりも軽度から重度の症例に増加した。 •CD8 + T細胞サブセットは、すべての疾患グループで減少した。ただし、CD4 + T、ナイーブCD4 + T、およびTGF-β+ CD28-ナイーブCD4 + T細胞は増加した。それどころか、記憶CD4 + T細胞は減少した。 •CXCR3,CD28,TGF-βなどの機能性分子のレベルは、健康管理と比較して患者で増加した。 |
PBMC | (Wang W. et al。 2020) |
| 37 | 合計:53中程度:21重度:18重大:14 | •CD11aを発現するリンパ球(CD4 +およびCD8 +)およびB細胞は、重症患者で減少した。興味深いことに、循環におけるT細胞の減少は、感染部位へのこれらの細胞の浸潤の増加に関連している可能性があることが示唆された。一方、回復した患者はCD11aT細胞の減少の減少を示した。したがって、CD11a陽性T細胞はCOVID-19の可能性のある予後マーカーとして示唆された。 •興味深いことに、好酸球数は重症患者の増加でした。 |
PBMC | (Anft et al。 2020) |
| 38 | BALF健康:3人の患者:2人のPBMC健康:3人の患者:3人 | •RNA-seq分析が実行された。 •BALFにおけるIL-10,CCL2 / MCP-1,CXCL10 / IP-10,CCL3 / MIP-1A、およびCCL4 / MIP1Bの転写レベルの増加。 •PBMCにおけるCXCL10,TNFSF10,TIMP1,C5,IL18,AREG、NRG1,IL-10の転写レベルの増加。 |
PBMCとBALF | (Xiong et al。 2020) |
| 39 | 合計:12健康:3中程度:3重度/重大:6 | •免疫細胞の種類を決定するために、シングルセルRNA-seq分析とそれに続くクラスター分析を実施した。 •増殖性で増殖性の低いCD8 + Tリンパ球は、重症/重症患者のBALFサンプルに存在したが、中等度の症例では、増殖性が高く増殖性の低い表現型を示した。 •重度/重篤な疾患症状を示す患者のBALFで、マクロファージと好中球の増加が検出された。 •すべての患者で、より高いレベルのIL-1β、IL-6,およびIL-8が観察された。 •CXCL9,CXCL10,CXCL11のレベルの上昇は、すべての患者で一貫して見られた。 •肺マクロファージは、重症の場合、ケモカインCCL2,CCL3,CCL4,およびCCL7とともに、IL1B、IL-6,TNFAのより高い転写産物を示した。 |
BALF | (Liao et al。 2020) |
| 40 | 合計:174健康:20 COVID-19:8その他:146 | •IL1RN、IL1B、CXCL17,CXCL8,CXCL1,CXCL2,およびCCL2,CCL7の転写レベルは、健康な対照と比較してCOVID-19患者で増加した。 •カルグラヌリン遺伝子S100A8,S100A9およびS100A12のアップレギュレーションが観察された。 •COVID-19患者における約83のISGのアップレギュレーションによって示されるように、インターフェロン応答も観察された。 |
BALF | (Zhou Z. et al。 2020) |
ハイライトされた研究は、この研究で発見されたそれぞれの予測バイオマーカー(太字)を示している。
急性呼吸窮迫症候群
炎症性細胞浸潤の増加、サイトカインストーム、およびリンパ球減少症によって特徴づけられるような免疫応答の機能不全の結果は、COVID-19患者における根本的な懸念である。この免疫病理学的状態は、最終的にはARDSの発症につながる可能性があり、これはICU死亡の67〜85%に関連している(Ji et al 2020;Liu et al 2020b)。症状発症後8日から 12日の時間中央値で、ARDSはCOVID-19の間に階層的に進行する(Fan E. et al 2020)。
活性化リンパ球とともに、自然免疫細胞、プロ炎症性サイトカインの過剰な浸潤によって生成された後期の頑健な免疫応答は、肺に広範な損傷を引き起こす。この時までに、亢進した自然免疫系が被った損傷は、ウイルスによる損傷をはるかに迂回し、最終的には呼吸不全および多臓器不全に至る。動物モデルや死亡したSARS-CoV感染者の死後サンプルからヒントを得て、図5に示すように、肺の損傷の臨床的および分子的パターンの包括的な画像が出現した(Leung et al 2005)。これらのイベントは、シーケンシャルでよく協調した方法で進行する。過度の肺胞上皮細胞死、細胞外マトリックスの損失、細胞破片の沈着、およびヒアリン膜の形成は、びまん性肺胞損傷(DAD)と呼ばれる気管支と肺胞上皮細胞の変性と一緒に早期に開始される。これらの事象は、肺胞および気管支上皮内膜の脱皮、肺胞-血管障壁の透過性の変化、間質性肺水腫、血栓症、凝固、およびフィブリン沈着によって進行する(Gralinski et al 2013)。最後に、SARS-CoV病は、線維芽細胞増殖の増加、間質性線維化、コラーゲン沈着、気道の完全崩壊を伴う、より重度の線維化段階に進行する。内容物は、炎症性サイトカインとともに二次組織に放出され、多臓器不全を引き起こす可能性がある。これらの変化は、常に拡大し続ける分子イベントの協調的な作用によってオーケストレーションされる(Chong et al 2004; Jih, 2005; Yen et al 2006)。
図5 COVID-19の異なる段階における免疫病理学的変化
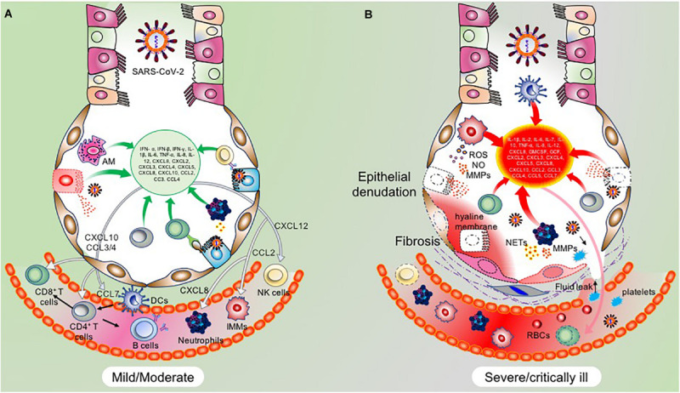
A)軽度/中等度のCOVID-19患者における免疫学的応答は、自然免疫系の助けを借りて、適応免疫細胞によってあからさまに与えられる。感染したATII細胞と活性化したAMは、サイトカインとケモカインのレパートリーを産生し、自然免疫細胞と適応免疫細胞をリクルートし、ウイルスの伝播を制限する。機能的な免疫系は、このようにして、ウイルス特異的なATII細胞を排除するために、うまく調整された方法で作用する。ATII細胞の比較的幹細胞のような性質のために、排除された細胞はその後再生され、したがって、損傷を受けた肺組織の回復を確実にする。B)しかしながら、重症・重症患者では、過剰に活性化された自然免疫細胞によって、そして程度の低い順応免疫細胞によって、誇張された炎症反応が起こる。肺では、単球/マクロファージ、樹状細胞、好中球などの炎症性細胞が強固に蓄積されることで特徴づけられる炎症亢進状態が形成される。これは、このように悪質な高炎症サイクルを誘導し、これらの細胞によるサイトカインやケモカインの過剰な放出につながる。肺実質への損傷は、MMPs、NETs、活性酸素とNOのような他の細胞傷害性分子と一緒に、この高炎症状態によって与えられる。後者の2つは、より多くの細胞傷害性ペルオキシナイトライトイオンを形成するために結合する。これらの複合作用により、上皮の変性、血管漏れ、血小板や赤血球の浸潤、血管浮腫、ヒアライン膜の形成が起こり、ARDSを発症する。
ARDSからの回復は可能であるが、疾患が重症化する前にのみ可能である。しかしながら、ARDS患者における35〜40%の死亡率は、組織線維化によって顕在化した不可逆的な組織損傷を実証している(Bellani et al 2016)。TGF-βは、ARDS中の線維化変化の後期発症において中心的な役割を果たしている。他の炎症性分子と作用して、TGF-βは、線維芽細胞の増殖および活性化、コラーゲンの合成および沈着、フィブロネクチンの合成およびα平滑筋アクチンを誘導し、これらはすべて一緒に線維化に寄与する(Fan E. et al 2020)。死亡したCOVID-19患者からの新たな組織学的研究は、肺および肝臓、腎臓、および心臓のような関連臓器における頑健な構造変化を明らかにしている(George et al 2020)。COVID-19に屈した50歳の患者からの肺生検サンプルは、ヒアライン膜形成、上皮細胞および内皮細胞の脱スクアメーション、単核浸潤、および強固なATII細胞損傷を明らかにし、ARDSを示唆している(Xu Z. er al)。
さらに、肝生検サンプルにおいて微小小胞性ステアトーシスが観察され、多臓器損傷を示唆していた(Xu Z. er al)。
同様に、SARS-CoV-2感染により死亡した72歳の患者の病理組織学的検査では、肺に炎症性浸潤と線維化が肺胞内組織化フィブリンとともに認められ、ARDSを示唆していた(Zhang H. er al)。 別の研究では、死亡したCOVID-19患者38人の肺サンプルを病理組織学的変化について評価した。肺胞上皮細胞の壊死およびDADは、すべての患者で観察された。一方、ほとんどの患者は、間質性および肺胞内浮腫、ATII細胞過形成、血栓症、フィブリン沈着、マクロファージおよびリンパ球の浸潤、ヒアライン膜形成および他の線維性変化を示した(Carsana et al 2020;Polak et al 2020)。同様の病理組織学的所見は、他の研究によって明らかにされた(Menter et al 2020)。
亡くなった113人の患者の臨床評価では、ARDSおよび多臓器機能障害が明らかになった(Chen T. et al 2020)。Dダイマー、心筋トロポニン・クレアチニン、クレアチンキナーゼ、アラニンアミノトランスフェラーゼ、アスパラギン酸アミノトランスフェラーゼ、総ビリルビン、アルカリホスファターゼ、γ-グルタミルトランスペプチダーゼなどの分子マーカーの血清中濃度の上昇が認められた。これらの分子の存在は、肝臓、腎臓、心臓の障害を示している。さらに、血栓症や線溶体化が血清D-ダイマーの上昇から明らかになった。さらに、重篤な患者や死亡した患者の臨床評価では、肺、肝臓、腎臓、心臓の損傷に関連する生体分子のレベルが上昇していることが示され、COVID-19期の多臓器機能障害を示唆している(Chen T. et al 2020;Huang C. et al 2020;Zhu et al 2020)。COVID-19患者におけるARDSは、ヒアリン膜、DAD、血栓症および線維性変化が一貫して存在し、これがARDS誘発死の主要な原因である可能性があることが浮上している(Fan E. et al 2020;Price et al 2020)。臨床的、分子的、および関連する病理組織学的パラメータに関するプロスペクティブな縦断的研究は、COVID-19におけるARDSの分子的基礎をさらに掘り下げるであろう。COVID-19患者においてDダイマーおよび関連する凝固因子を検出した研究のリストを表1に示す。
今後の展望
ここ数ヶ月の間に、多数の臨床研究および組織学的研究により、COVID-19の根底にある病態生理学的変化および組織損傷が明らかになってきた。しかし、我々は、この疾患の病態に関与する基本的な分子およびシグナル伝達経路を理解し始めたばかりである。SARS-CoVとの密接な配列類似性は、いくつかの共存する病理学的特徴を理解するのに役立つが、合理的なゲノムおよび構造的差異のために、それはSARS-CoV-2感染に特有の分子機構を解読するために不可欠である。SARS-CoVとSARS-CoV-2との間のSタンパク質、ORF3b、ORF6およびORF8の相違は、機能的に関連している(Chan et al 2020;Mantlo et al 2020)。同様に、これらの特異的分子ネットワークを調節するための標的治療法を開発するためには、2つのウイルスによって生成される差動免疫応答を十分に掘り下げる必要がある(Moreno-Eutimio et al 2020;Yao et al 2020)。重要なことに、COVID-19患者における不均一なT細胞応答は謎のままであり、一部の患者ではリンパ球減少および活性化T細胞の状態が、他の患者では疲弊したT細胞の存在が増加している。
さらに、重症例では感染部位(肺)におけるこれらのT細胞の活性化状態の増加は、COVID-19患者におけるT細胞免疫応答に複雑さを加え、それゆえに普遍的な治療介入を考案することを困難にしているかもしれない。同様に、健常者における反応性T細胞の存在も、主にワクチンを設計する際に、包括的な理解を必要とする分野である。これらの課題を念頭に置き、効果的なワクチンが開発されるまでは、間葉系幹細胞を用いた治療法(現在臨床試験中)サイトカインストームに対抗する抗IL-6剤や抗GM脳脊髄液剤、抗ウイルス剤などの既存の免疫調節アプローチが標準的な治療介入として残っている。抗ウイルス薬であるレムデシビルは、一部の患者では有望性を示しているが、他の患者では重篤な副作用も報告されている(Wang Y. et al 2020)。COVID-19の間の免疫応答の複雑さに影響を与える因子の数を考慮すると、単一のタイプの介入がすべての患者に有効ではない可能性があることを理解することが極めて重要である。したがって、現時点では、併用療法を探索することの方が説得力があるように思われる。しかし、最適な組み合わせ、投与量、治療期間の決定には十分な検討が必要である。再感染の可能性を考えると、これらの標的治療が重要になってくる。健康な10人を対象とした35年間の最近の研究では、4つの一般的な季節性コロナウイルスに対する免疫が短期間で持続し、感染後1年で再感染の可能性があることが明らかになった(Edridge et al 2020)。SARS-CoV-2も同じような再感染の傾向を示す可能性があり、これはワクチン研究のための懸念が高まっている可能性がある。したがって、免疫病理学的変化と防御免疫の持続性についてのより包括的な理解が必要である。本レビューでは、COVID-19患者の進行と転帰の中心となるこれらの免疫応答のいくつかを強調する。この方向での継続的な研究は、ワクチンと並んで、遅かれ早かれ効果的な治療法につながるはずである。
著者の寄稿
TAは構想、図の作成、原稿執筆を行った。RCは免疫学のセクションの執筆に協力した。SAはARDSセクションの設計と執筆に協力した。MJは微生物の核酸感知とシグナル伝達の部分の執筆に協力した。AAとARはSARS-CoV-2における自然免疫応答の執筆に協力した。すべての著者は論文に貢献し、提出されたバージョンを承認した。
利益相反
著者らは、利益相反の可能性があると解釈されるような商業的または経済的な関係がない状態で研究が行われたことを宣言している。
略語
ALPアルカリホスファターゼ
ALTアラニンアミノトランスフェラーゼ
AREGアンフィレグリン
ASTアスパラギン酸アミノトランスフェラーゼ
BALF気管支肺胞ラバージュ液
CCLケモカイン(C-Cモチーフ)リガンド
分化のCDクラスター
CRP CRP
CTACK
CXCLケモカイン(C-X-Cモチーフ)リガンド
G-脳脊髄液 顆粒球コロニー刺激因子
GGT γ -グルタミルトランスペプチダーゼ
GM-脳脊髄液 顆粒球マクロファージコロニー刺激因子
IFNインターフェロン
IL インターロイキン
ISG インターフェロン刺激遺伝子
にゅうさんデヒドロゲナーゼ
LDH 乳酸脱水素酵素
LMRリンパ球対単球比
MCP 単球ケモアクトラクタータンパク質
MIP マクロファージ炎症性タンパク質
NK ナチュラルキラー
NLR好中球/リンパ球比
NRGノイレグリン
末梢血単核球
PD1 プログラムされた細胞死タンパク質1
PLR血小板対リンパ球比
SP 界面活性剤タンパク質
SSA血清アミロイドA
TIM3 T細胞免疫グロブリンおよびムチンドメイン含有-3
TIMP1 メタロプロテアーゼの組織阻害剤
TNF 腫瘍壊死因子
TNFSF10(腫瘍壊死因子(リガンド)スーパーファミリー、メンバー10)。
