Contents
- COVID-19に対する免疫力は、おそらく試験で示されているよりも高い
- 無症候性・軽度COVID-19患者の回復期における堅牢なT細胞免疫
- CD4+およびCD8+ T細胞の発現の少なさは、COVID-19患者における感染の重症度を反映し、予後の悪化を予測する可能性がある プール解析からのエビデンス
- CD4+T CD8+T数と重症COVID-19 メタアナリシス
- COVID-19肺炎患者におけるT細胞の活性化、老化、枯渇、TH17へのスキューイングが認められた
- コロナウイルス病の免疫学的特徴2019:T細胞の機能的枯渇とサイトカインストーム
- SARS-CoV-2に対する既存免疫:知られていることと知られていないこと
COVID-19に対する免疫力は、おそらく試験で示されているよりも高い
news.ki.se/immunity-to-covid-19-is-probably-higher-than-tests-have-shown
カロリンスカ研究所とカロリンスカ大学病院の新しい研究によると、軽症または無症状のCOVID-19を持つ多くの人が、たとえ抗体検査で陽性と判定されていなくても、新しいコロナウイルスに対するいわゆるT細胞媒介免疫を示していることが明らかになった。研究者によると、このことは、おそらく抗体検査が示唆するよりも公衆免疫が高いことを意味しているという。
「T細胞は白血球の一種であり、ウイルスに感染した細胞を認識することに特化しており、免疫システムの重要な部分を担っている」と、カロリンスカ研究所感染症医学センターの助教授であり、論文の主な著者の一人であるマーカス・ブッガート氏は言う。
高度な解析により、COVID-19感染時と感染後のT細胞反応を詳細にマッピングすることが可能になった。我々の結果は、我々が抗体を検出できる人と比較して、約2倍の人がT細胞免疫を発現していることを示している。」
今回の研究では、研究者らは、COVID-19の症状が軽度であったり、症状がなかったりする200人以上の患者から採取した検体の免疫学的分析を行った。研究には、カロリンスカ大学病院の入院患者をはじめ、3月にアルプス山脈での休暇を終えてストックホルムに戻ってきた患者と、その被ばくした無症状の家族が含まれていた。2020年と2019年に献血した健康な献血者(対照群)も対象とした。
無症状者におけるT細胞免疫
カロリンスカ大学病院感染症診療所のコンサルタントSoo Aleman氏らは、発病期から患者とその家族をモニターし、検査を行ってきた。
「1つの興味深い観察は、T細胞免疫を示したのはCOVID-19が確認された個人だけではなく、無症状の家族の多くが感染していたということである。」とSoo Aleman氏は言う。」
さらに、2020年5月に献血した献血者の約30%がCOVID-19特異的T細胞を持っており、これは以前の抗体検査で示された数値よりもはるかに高い数値であった。
T細胞の反応は、他のウイルスに対する承認済みワクチン接種後の測定値と一致していた。重度のCOVID-19の患者では、しばしば強いT細胞反応と抗体反応を示した。
公衆衛生の観点から見て非常に良いニュース
「我々の結果は、COVID-19に対する公衆免疫がおそらく抗体検査で示唆されているよりも有意に高いことを示している。」とカロリンスカ研究所感染症医学センターのハンス-グスタフLjunggren教授は共同研究者として述べている。
「もしこれが事実であれば、もちろん公衆衛生の観点からは非常に良いニュースです」。
T細胞の分析は抗体検査よりも複雑であるため、現在のところカロリンスカ研究所の感染症医学センターのような専門の研究室でしか行われていない。
「免疫の持続性やCOVID-19免疫の異なる成分がどのように関連しているのかを理解するためには、T細胞と抗体の両方について、より大規模で長期的な研究を行う必要がある」とMarcus Buggertは言う。
この結果は非常に新しいものなので、科学雑誌に掲載される前に、まだピアレビューを受けていない。
無症候性・軽度COVID-19患者の回復期における堅牢なT細胞免疫
www.biorxiv.org/content/10.1101/2020.06.29.174888v1
概要
SARS-CoV-2特異的メモリーT細胞は、COVID-19に対する長期的な免疫防御に不可欠であると考えられる。
我々は、COVID-19の急性期または回復期のCOVID-19を発症した患者だけでなく、未感染者、家族感染者および患者の大規模コホートを対象に、SARS-CoV-2特異的T細胞応答の機能的および表現型を系統的にマッピングした。
急性期のSARS-CoV-2特異的T細胞は高度に活性化された細胞障害性表現型を示し、それは様々な重症度の臨床マーカーと相関していたが、回復期のSARS-CoV-2特異的T細胞は多機能であり、幹のような記憶表現型を示していた。
重要なことに、SARS-CoV2特異的T細胞は、抗体血清陰性の家族や、無症候性または軽度のCOVID-19の既往歴を持つ患者で検出可能であった。
我々のデータセットは、SARS-CoV-2が成功したワクチンの文脈で観察されたものと同様の強固なメモリーT細胞応答を誘発することを示しており、自然暴露または感染が血清陰性者でも重度のCOVID-19の再発エピソードを防ぐ可能性があることを示唆している。
序章
2019年12月、コロナウイルス疾患2019(COVID-19)と総称される様々な臨床症候群を引き起こす新しい人獣共通感染性病原体、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)の出現により、世界は一変した。現在のところ、SARS-CoV-2に対するワクチンはなく、重度のCOVID-19に伴う過剰な炎症は、呼吸不全、敗血症性ショック、および最終的には死に至る可能性がある。
全体の死亡率は0.5~3.5%である。しかしながら、ほとんどの人は影響を受けにくく、COVID-19の間は無症状のままであるか、または軽度の症状しか発症しないようである。
したがって、現在進行中のパンデミックに照らして、COVID-19の軽度の型を持つ人々がSARS-CoV-2に対する強固な免疫を発現するかどうかを決定することは重要である。現在、SARS-CoV-2に対する免疫防御の決定因子を明らかにするための世界的な取り組みが進められている。
最近のデータは、SARS-CoV-2感染がアカゲザルにおいて再チャレンジに対してほぼ完全な防御をもたらすことを示しており、同様に、以前に文書化されたCOVID-19を有するヒトにおける再感染の証拠は限られている。したがって、これらの観察の根底にあるメカニズムを定義し、SARSCoV-2への一次感染によって誘発される防御免疫応答の持続性を評価するために、さらなる研究が必要である。
SARS-CoV-2に対する免疫防御のほとんどの相関研究は、中和抗体の誘導に焦点を当ててきた。しかしながら、抗体応答は、すべての患者、特にCOVID-19の重症度の低い形態を有する患者において検出されない。
これまでの研究はまた、記憶B細胞応答は、SARS-CoV-1への感染後に短命である傾向があることを示している。対照的に、記憶T細胞応答は、何年も持続することができ、マウスにおいて、SARS-CoV-1による致死的な挑戦から保護される。ヒトにおいて、SARS-CoV-2特異的T細胞が同定されている。
それにもかかわらず、T細胞免疫応答の様々な特徴が、抗体応答および急性および回復期のCOVID-19の臨床経過とどの程度関連しているかは不明のままであった。この知識ギャップに対処するために、我々は、アウトカム定義された(ピアレビューで認定されなかった)SARS-CoV-2特異的CD4+およびCD8+ T細胞を特徴付けた。
結果
我々の予備的な分析は、急性中等度または重度のCOVID-19患者において、CD4+およびCD8+ T細胞の絶対数および相対頻度が生理的に低いことを示した。
サイトメガロウイルス(CMV)またはエプスタインバーウイルス(EBV)に特異的なCD8+ T細胞が増加した頻度を発現していることを確認した。CD38の7、単一のCD38発現がCOVID-19における炎症または他の特徴によって駆動され得ることを示している(図2A、Bおよび図S5C)。
しかし、注目すべきことに、CMVおよびEBV特異的CD8+ T細胞は、急性中等度または重度のCOVID-19の間、回復期の個人および健康な血液ドナーと比較して、HLA-DR、Ki-67、またはPD-1の上昇および/またはCD38との組み合わせを発現しておらず、SARS-CoV-2への感染の初期段階での限られたバイスタンダーの増殖および活性化を示している(図2A、B、および図S5C)。
Ki-67の発現によって定義される活性化増殖CD8+ T細胞は、代わりに、ワクチン接種および他のウイルス感染症の文脈で以前に報告されたように、急性中等度または重度のCOVID-19患者において優勢なCCR7-CD27+ CD28+ CD45RA- CD127-表現型を示した(図S5D)。
これらの知見に基づいて、我々は、SARS-CoV-2膜、ヌクレオカプシド、およびスパイクタンパク質の免疫原性ドメインにまたがるオーバーラップペプチドを使用して、急性中等度または重度のCOVID-19を有する患者から末梢血単核細胞(PBMCs)を刺激し、応答するCD4+およびCD8+ T細胞が活性化/循環(CD38+ HLA-DR+ Ki67+ PD-1+ )表現型を示したことを見出した(図2C)。
これらの結果は、CD69および4-1BB(CD137)のアップレギュレーションを測定するための活性化誘導マーカー(AIM)アッセイを用いて確認され、これは、ほとんどのCD38+ PD-1+ CD8+ T細胞がSARS-CoV-2に特異的であることを示唆している(図2D)。
さらなる実験では、SARS-CoV-2から予測された最適エピトープに特異的なCD8+T細胞を検出するために、プローブとしてHLAクラスIのテトラマーを使用した(表S2)。感染の急性期における大多数のテトラマー+ CD8+ T細胞は、回復期ではなかったが、活性化/循環型の表現型を示した(図2E)。
一般的に、初期のSARS-CoV-2特異的CD8+ T細胞集団は、免疫活性化分子(CD38、HLA-DR、Ki-67)、抑制性受容体(PD-1、TIM-3)、細胞障害性分子(グランザイムB、パーフォリン)の発現によって特徴づけられたが、回復期のSARS-CoV-2特異的CD8+ T細胞集団は、早期分化型記憶(CCR7+ CD127+ CD45RA+ TCF-1+)の表現型に偏っていた(図2F)。
重要なことに、SARS-CoV-2特異的CD8+ T細胞におけるCCR7およびCD45RAの発現頻度は感染後の無症状日数と正の相関を示したが、SARS-CoV-2特異的CD8+ T細胞におけるグランザイムBの発現頻度は感染後の無症状日数と逆相関を示した(図2G)。したがって、曝露からの時間は、幹様記憶SARS-CoV-2特異的CD8+ T細胞の出現と関連していた。
SARS-CoV-2特異的CD4+ T細胞応答は、対応するSARS-CoV-2特異的CD8+ T細胞応答よりも全体的に比例して大きかった(図4D)。さらに、ほとんどのIFN-g+ SARS-CoV-2特異的CD4+ T細胞はTNFを産生し、ほとんどのIFN-g+ SARS-CoV-2特異的CD8+ T細胞はグランザイムBおよびペルフォリンを産生した(図4E)。
分析の最終セットでは、SARS-CoV-2特異的抗体およびT細胞応答を、異なるグループ内およびグループ間で比較した。ヌクレオカプシド抗原およびスパイク抗原に対する抗SARS-CoV-2 IgG応答は、強く相関していた(図S8A)。
さらなる解析により、SARS-CoV-2特異的CD4+およびCD8+ T細胞応答は、血清陽性者と比較して低い頻度ではあるが、血清陰性者に存在していたことが明らかになった(図4F)。
これらの不一致した応答は、それにもかかわらず、無症候性/軽度のCOVID-19の既往歴を有する一部の回復期患者、被爆した家族、およびパンデミック中に献血した健康な人々において顕著であり(図4FおよびS8B、S8C)、しばしばSARS-CoV-2の内部抗原(ヌクレオカプシド)および表面抗原(膜および/またはスパイク)の両方を標的としていた(図4G)。
強力なメモリーT細胞応答は、したがって、循環抗体の非存在下または存在下で誘発され、COVID-19に対する免疫保護の重要な決定因子としての非冗長な役割と一致した。
考察
私たちは現在、ここ数十年で最大の世界的な健康危機、すなわちCOVID-19の壊滅的なアウトブレイクに直面している。保護ワクチンがない場合には、曝露および/または感染した人、特に無症候性または非常に軽症で、うっかり主要な感染者として作用する可能性の高い人が、SARS-CoV-2に対する強固な適応免疫を獲得するかどうかを判断することが重要となる。
本研究では、急性中等度または重度のCOVID-19患者、無症候性/軽度または重度のCOVID-19後の回復期にある個体、曝露された家族、およびパンデミック前に献血した健康な個体において、SARS-CoV-2に対する細胞性および体液性免疫応答をマッピングするための系統的なアプローチを用いた。
無症状/軽度COVID-19後の回復期の個人は、パンデミック地域(主に北イタリア)からスウェーデンに帰国した後に追跡した。これらのドナーは、SARS-CoV-2に特異的な検出可能な循環抗体が存在しない場合でも、感染から数ヵ月後に強固なメモリーT細胞反応を示し、COVID-19に対する集団レベルの免疫力がこれまでに予想されなかった程度であることを示した。
CD38の発現によって特徴づけられるT細胞の活性化は、急性COVID-19の特徴であることがわかった。同様の知見は、特異性データがない場合でも以前に報告されている。これらのT細胞の多くはまた、HLA-DR、Ki-67、およびPD-1を発現し、複合的な活性化/サイクル表現型を示し、特にCD38の発現レベルは、疾患の重症度と相関していたが、炎症性マーカーとは高い程度には相関していなかった。
また、急性期の多くの活性化/循環型T細胞は機能的に完全であり、SARS-CoV-2に特異的であることが示された。同等の機能プロファイルは、成功したワクチンによる免疫後早期に観察されている。
したがって、PD-1を含む複数の抑制性受容体の発現は、おそらく、枯渇ではなく早期の活性化を示す。ウイルス特異的メモリーT細胞は、SARS-CoV-1への感染後、何年にもわたって持続することが示されている。
これらの観察に沿って、我々は、他のウイルス感染の文脈で以前に報告されたように、SARS-CoV-2特異的T細胞が回復期に早期分化記憶(CCR7+ CD127+ CD45RA-/+ TCF-1+ )の表現型を獲得したことを発見し、この表現型は、茎様特性と関連している。
従って、我々は、SARS-CoV-2-特異的T細胞が、広範な増殖および多機能性を特徴とする回復期において、コグニテート抗原に対するアナムネスティック応答を生成することを見出した。
特に注目すべきは、SARS-CoV-2に特異的な検出可能な循環抗体を持たない一部の個体において、内部(ヌクレオカプシド)および表面タンパク質(膜および/またはスパイク)に対する同様のメモリーT細胞応答が検出されたことである。実際、パンデミック期間中に献血を受けた家族や健康な人のほぼ2倍の人が、抗体反応と比較してメモリーT細胞反応を示した。
検出可能な循環抗体が存在しない場合に、強固なメモリーT細胞応答がSARS-CoV-2に対する防御を可能にするかどうかは不明である。
このシナリオは、それにもかかわらず、MERSおよびSARS-CoV-1の先行研究から推測されており、これらの両方は、抗体応答が衰えている間に持続する強力なメモリーT細胞応答を誘発することが示されている。
さらに、検出可能な抗体が存在しない場合でも、ワクチン誘発性T細胞応答は、SARS-CoV-1による致死的な挑戦に対してマウスを保護することができる。これらの観察に沿って、以前に無症状/軽症であったものを含む、本研究の回復期の個体のいずれも、COVID-19のさらなるエピソードを経験していない。
我々のデータは、曝露、感染、および疾患の全領域にわたるSARS-CoV2特異的T細胞免疫の機能的および表現型マップを提供している。無症状または軽度のCOVID-19を有するほとんどの患者が、対応する体液性反応が相対的に存在しない中で、非常に機能的な耐久性記憶T細胞応答を生成していることが観察され、自然暴露または感染が重度のCOVID-19の再発エピソードを防ぐことができることがさらに示唆された。
CD4+およびCD8+ T細胞の発現の少なさは、COVID-19患者における感染の重症度を反映し、予後の悪化を予測する可能性がある プール解析からのエビデンス
www.ncbi.nlm.nih.gov/pmc/articles/PMC7319938/
抄録
本研究は、主に現在のCOVID-19の流行状況に焦点を当て、COVID-19患者の治療とモニタリングのための新たな知見を提供した。このメタ解析により、血中CD4+およびCD8+ T細胞数の発現が少ないことは、感染症の重症度を反映している可能性があり、予後不良を伴うことが多いという結論を導き出すことができた。その結果、血中CD4+およびCD8+ T細胞数は、COVID-19患者の疾患評価およびモニタリングのための有望なバイオマーカーであることが示唆された。
1. はじめに
CD4+およびCD8+T細胞数が免疫応答のプロセスに広く関与していることはよく知られており、ウイルス特異的CD4+およびCD8+T細胞は、しばしばウイルス感染細胞を排除してウイルスをクリアするために重要な役割を果たしている[7]。
コロナウイルスに感染したヒトと同様に、CD4+ T細胞は、IFN-γの発現およびCD8+ T細胞および抗体応答の増強を介して防御免疫応答を誘導することができる[8]。SARS-CoV抗原は、抗原提示細胞によって認識・処理され、T細胞を活性化する。
活性化されたウイルス特異的エフェクターT細胞は、炎症性サイトカイン(TNF-α、IL-6、IL-8など)やケモカイン(CXCL-1、CXCL-2、CCL-3、CCL-5など)の放出を誘導し、ウイルスの複製をさらに抑制し、抗ウイルス効果を発揮する[7]。
Guo Lらの報告によると、肺炎死亡群のCD3+T細胞数、CD3+CD4+T細胞数、CD3+CD8+T細胞数の絶対数が生存群に比べて有意に少ないことから、抗ウイルス過程で多くのT細胞が活性化・枯渇していることが示唆されており、本研究の結果と一致している[9]。
CD4+T CD8+T数と重症COVID-19 メタアナリシス
www.ncbi.nlm.nih.gov/pmc/articles/PMC7305716/
Liuらによるレトロスペクティブ研究で、リンパ球サブセット数と重症COVID-19との関連を調査したところ、CD4+TとCD8+Tの低カウントが重症COVID-19患者ではより一般的であることがわかった1。
また、CD4/CD8比は非重症群と重症群の間に有意な差は認められなかった。CD4+TとCD8+Tは、体内の免疫機能とウイルスクリアランスの維持に重要な役割を果たしている。
CD4+TおよびCD8+Tは、COVID-19患者では有意に減少することが報告されている2 。そこで本研究では,CD4+T数,CD8+T数,CD4/CD8比,COVID-19患者の重症度とCD4+T数,CD8+T数,CD4/CD8比との関係を調べるためにメタ解析を行った.
CD4+T、CD8+T 数、CD4/CD8 比のデータはそれぞれ 13、12、8 件の研究で提供されている。
CD4+T、CD8+Tともに重症COVID-19群では非重症群に比べて有意に減少した
CD4+T(MD:-0.22×109/L、95%CI:-0.27~-0.17×109/L、I 2=89%
CD8+T(MD:-0.14×109/L、95%CI:-0.18~-0.11×109/L、I 2=88%
CD4/CD8比は2群間で有意差は認められなかった(MD:0.17、95%CI:-0.12~0.46、I 2=91%)。
Wangらの報告によると、COVID-19投与1週間後、CD8+T数は症状が軽減した患者または放射線学的異常が改善した患者でのみ増加したが、CD4+T数には同様の変化は認められなかった10。
SARSとは異なり、COVID-19患者ではCD8+TがCD4+Tよりも臨床転帰のより敏感な予測因子である可能性があるようである。しかし、CD4+TとCD8+Tの両方のカウントは、COVID-19の重症度を予測するためのバイオマーカーとして機能する可能性がある。
COVID-19肺炎患者におけるT細胞の活性化、老化、枯渇、TH17へのスキューイングが認められた
Marked T cell activation, senescence, exhaustion and skewing towards TH17 in patients with COVID-19 pneumonia
www.nature.com/articles/s41467-020-17292-4
要旨
SARS-CoV-2に感染した患者の免疫系は著しく障害されている。COVID-19肺炎患者のT細胞とサイトカイン産生の詳細な調査が急務である。ここでは、COVID-19患者のT細胞コンパートメントが健常対照と比較して、ナイーブ細胞、中枢記憶細胞、エフェクター記憶細胞、末期分化細胞、調節性T細胞、PD1+CD57+排泄T細胞を含むいくつかの変化を示すことを示した。
また、いくつかの系統を規定する転写因子やケモカイン受容体にも有意な変化が見られる。末期分化した患者のT細胞の増殖は健常対照のT細胞よりも少ないが、ミトコンドリアの機能性は両群のCD4+ T細胞で類似している。
患者では、Tヘルパー1型および2型サイトカイン、ケモカイン、ガレクチンなどの炎症性または抗炎症性サイトカインが有意に増加し、リンパ球からは腫瘍壊死因子(TNF)、インターフェロン-γ、インターロイキン(IL)-2、IL-17の産生量が増加している。
序論
コロナウイルス病2019(COVID-19)1を引き起こす重症急性呼吸器症候群コロナウイルス(SARS-CoV-2)による劇的なパンデミックは、世界中で日常生活の習慣や社会行動を変えつつある私たちの種にとって劇的な脅威となっている。イタリアのロンバルディア州では、20202年2月21日までの最初の確認症例である原因不明の重症肺炎患者が初めて確認された。その瞬間から、予測不可能な数の重症肺炎患者を目の当たりにし、その治療には集中治療室への入院が必要となることが多かった。残念ながら、多くの患者はウイルスとの戦いに失敗し、6月18日現在、イタリアでは24万人以上の感染者のうち3万5000人以上の死亡者を数えている。
このようなウイルスの病態生理はまだ完全には解明されていない3,4。他のコロナウイルスによる重症疾患に関する先行研究では、肺の炎症が前炎症性サイトカインの血漿レベルの上昇と関連していることが示されている5,6。同様の現象は、いわゆる「サイトカインストーム7」を経験することができるCOVID-19患者においても記述されている。しかし、これらのメディエーターの産生に関与している細胞や、COVID-19患者の特異的な免疫応答については、ほとんど知られていない。
現在、我々や他の人たちは、COVID-19が高齢者患者、特に異なる併存疾患、糖尿病、肥満を持つ患者でははるかに重症であることを観察しているが、一方で、それは子供や妊婦でははるかに重症ではないように見える8,9,10。免疫学的老化は慢性的な不顕性炎症状態と関連しており、Tヘルパー(TH)1型リンパ球が重要な役割を果たしている「炎症」と定義されているが、子供や妊婦はTH2応答を発達させる傾向があるため、より少ない前駆性炎症分子11,12を産生する。免疫応答とサイトカイン産生がどのように協調して行われているかをよりよく理解するために、私たちはT細胞の特徴を深く理解し、TH1、TH2、またはTH17へのT細胞の機能的分化を研究していた。この目的のために、複雑なT細胞の表現型を教師なしで解析するための洗練された技術と組み合わせたフローサイトメトリーアプローチの配列を採用し、CD4+とCD8+の異なるCD4+ T細胞サブセットの増殖能力とCD4+ T細胞のミトコンドリア機能性を調査していた。最終的には31種類のサイトカインの血漿レベルとT細胞の多機能性を測定した。
我々のグループが実施したレトロスペクティブ研究では、トシリズマブのようなIL-6の生物学的活性をブロックすることができる薬剤は、重度のCOVID-19肺炎(呼吸数≧30回/分、血中酸素飽和度≦93%、室内空気中のPaO2/FiO2比<300mmHg、肺の50%以上の肺浸潤が24~48時間以内に併存していると定義されている)13において、侵襲的な機械換気や死亡を有意に減少させることができることが証明された。我々の結果を無作為化試験で確認する必要がある場合でも、対照群と比較して、トシリズマブで治療されたCOVID-19患者は重症感染症の有病率が高かったことに注意する必要がある。
ここでは、COVID-19患者ではCD4+およびCD8+ Tリンパ球の絶対数が減少しており、活性化や枯渇・発色に関連するマーカーを示すとともに、マスターレギュレーターやケモカイン受容体の発現が変化していることを示している。
一方、CD4+ Tリンパ球では、細胞増殖は変化しているが、ミトコンドリアの機能性は変化しておらず、ミトコンドリアの酸素消費量や細胞外酸性化率(ECAR)として測定される。
これらの患者では、血漿中で検出可能な大規模なサイトカインストームが、試験管内試験(in vitro)での腫瘍壊死因子(TNF)、インターフェロン(IFN)-γ、インターロイキン(IL)-2の産生の増加、およびTH17またはTc17の表現型への偏りを伴っている。
このことは、サイトカインストームと対照的な薬剤の有効性を強調するだけでなく、IL-17経路の阻害に基づく新規戦略の臨床評価を示唆している。
議論
本研究では、COVID-19肺炎患者のT細胞コンパートメントにおける主な変化を記述した。ほとんどの患者はリンパ球減少症であり、ほとんどの患者は非侵襲的人工呼吸を必要としなかったことから、採血時には重症ではあったが、挿管や機械的人工呼吸を必要とするほど進行していなかったことが示唆された。
このように、我々のデータは、感染症が臨床的に重要なものとなったときには、いくつかの免疫変化が存在することを示している。これらのデータはまた、入院を必要とした軽度から中等度のCOVID-19患者で最近報告された免疫学的変化と一致しており、活性化T細胞の有意な増加を示した20。無症状の感染者を対象とした研究は、COVID-19の免疫原性をよりよく理解するために極めて重要である。
COVID-19の肺炎患者では、CD4+またはCD8+ T細胞が試験管内試験(in vitro)でIL-17を産生し、炎症反応を強化し、好中球を活性化する能力が増加していることがわかった。
また、末梢血では、患者はCCR6を発現するCD4+およびCD8+ T細胞の割合が低く、TH17および粘膜関連不変性T(MAIT)細胞の典型的なCD161の高レベルを示した。循環CD4+CD161+CCR6+細胞の喪失は、シミアン免疫不全ウイルスに感染したマカクにおいて病気の進行に寄与し、これらの細胞が直腸粘膜に蓄積して炎症を促進することが示されている21。
同じ感染モデルでは、肺に存在するIL-17産生CD8+CD161+細胞の割合は、末梢血に比べて4倍以上になることが知られている22。さらに、肺に存在する細胞は末梢血の細胞よりも多くのIL-17を産生することができた。これらの知見は、COVID-19におけるIL-17の重要性を強調しており、既に利用可能な生物学的薬剤によるIL-17の遮断に基づく新規治療法への道を開く可能性がある。
SARS-CoV-2感染患者におけるT細胞コンパートメントの変化に関するデータはほとんど存在しない。これまでの研究では、疲弊の徴候23,24によって特徴づけられるT細胞ファミリーの変化が示されている。ほとんどのCOVID-19患者では、T細胞サブセットの割合は正常範囲内にとどまることができるが、CD4+およびCD8+ T細胞数の減少、またはCD4+/CD8+比25,26で存在することができる。
我々のデータはこれらの観察結果と一致しているが、CD4+とCD8+の両方のTリンパ球の異なるサブ集団の分析によって、さらに強化されている。実際、一方では、ナイーブ細胞、メモリー細胞、エフェクター細胞に関連するマーカーを用いただけでは、患者とコントロールの間に重大な変化が検出されないのに対し、他方では、我々のより洗練された詳細な分析では、有意な差が明らかになっている。
Tregは免疫の恒常性と自己耐性を調節するために重要である27,28。Tregはフォークヘッドボックス転写因子Foxp3を発現しているが、IL-2受容体α鎖(CD25)の高発現やIL-7受容体α鎖(CD127)29の低発現・ヌル発現、CD39やCD7330,31などの他の表面分子を検出することでも同定することができる。
それらは、自己免疫現象を抑制し、アレルギー反応を和らげ、または移植拒絶反応をブロックするが、侵入した病原体または腫瘍に対する防御免疫応答を阻害することもできる32。ここでは、COVID-19患者の末梢血中に異なるタイプのTregsの割合が増加しており、その血漿中には抑制性サイトカインIL-10が多量に含まれていることを示している。
COVID-19患者では、CD57を発現するCD8+T細胞の量が増加していた。CD57は試験管内試験(in vitro)複製性老化の重要なマーカーと考えられており、ヒトの老化または慢性感染症の長期化に関連している33。CD57は、自己免疫疾患、感染症、および癌患者の機能的な免疫不全を検出するために使用されていた。
CD57+細胞は活性化による細胞死に対して高い感受性を示し、活性化後もサイトカインを分泌する能力は維持されているにもかかわらず、細胞増殖を行うことができないことが示唆されている34。我々は、COVID-19患者のTE CD4+およびCD8+ Tリンパ球の間で増殖指数の低下を発見した。
T細胞は、PD1などの抑制性受容体の発現のアップレギュレーションを含む枯渇状態の表現型の特徴を示す。T細胞の疲弊は、大規模な免疫活性化および関連する自己免疫組織の損傷を防ぐ機能的無応答性を特徴とする。したがって、COVID-19患者において、これらの細胞の活性化は、(増殖の減少によって明らかにされるような)クローン拡大の欠如だけでなく、炎症を引き起こす分子の産生によっても続いている可能性がある。
さらに、末梢性耐性の誘導と維持、T細胞の安定性と完全性の維持に重要な分子であるPD1を発現している患者の細胞の割合が高いことが観察されている35。PD1/PD-L1軸はまた、Tエフェクター細胞の増殖と機能を阻害する強力な阻害シグナルを媒介し、抗ウイルス免疫に悪影響を及ぼす。
我々は、我々の患者において有意に高い血漿中PD-L1レベルを発見しており、感染が効率的な抗ウイルス免疫応答を阻害するためにこの経路を利用しているかどうか、またどのように利用しているかを理解するための研究が必要である。
炎症性サイトカインおよびケモカインのレベルの上昇によって証明される過剰な炎症反応は、200年のSARS-CoVパンデミックの影響を受けた患者で報告されている336,37。さらに、試験管内試験(in vitro)実験では、これらの患者からのいくつかの異なる細胞型が高量のサイトカイン38,39を産生することが明らかになった。
TH1/TH17反応を示す炎症性分子の血漿中濃度が高く、IFN-γ、TNF、IL-15、およびIL-1740の濃度が上昇していることもMERS-CoV感染症患者で報告されている。同様のデータは、T細胞による試験管内試験(in vitro)サイトカイン産生の偏りとともに、MERSコロナウイルス感染患者でも報告されている41。
我々のCOVID-19患者では、多くの炎症性サイトカインおよびケモカインの血漿中濃度が劇的に上昇したが、これはいわゆる「サイトカインストーム」42を記述した前述のすべての報告と一致している。
いくつかの細胞型によって産生され、自然免疫細胞に作用する分子が大量に存在することによる影響を考慮しなければならない。これらの分子の中でも特に重要なのは、血液中の好中球を感染や損傷を受けた組織に勧誘するIL-8であろう。IL-8の産生は、TNF、IL-1、細菌、ウイルス、細胞ストレスなどの幅広い刺激によって誘導され、単球、マクロファージ、内皮細胞および上皮細胞、線維芽細胞、Tリンパ球、肝細胞、滑膜細胞、およびケラチノサイトを含むいくつかの細胞タイプによって合成される43。
その受容体であるCXCR1とCXCR2は、好中球、単球、CD8+ TおよびNK細胞、マスト細胞、好塩基球、骨髄由来のサプレッサー細胞で発現している。好中球では、受容体の活性化は、脱顆粒および活性酸素種の産生を刺激する44。SARS-CoV-2などの呼吸器ウイルスが肺胞に侵入すると、まず肺胞上皮細胞と遭遇して感染し、肺胞上皮細胞はIL-8を産生し、それが好中球およびマクロファージを惹きつけ活性化する。
これらは臓器にダメージを与え始め、最終的には、特に内皮の損傷、血小板の活性化、血管内血栓症などを含む、より複雑な一連の病原性イベントを誘発する。IL-8の産生部位を正確に特定することはできないであったが、我々の肺炎患者においても、肺胞細胞がこの現象に密接に関与しているという仮説は妥当である。
驚くべきことに、IL-4、IL-10、IL-13を含む典型的なTH2サイトカインの血漿中での顕著な増加も観察された。これは、免疫系の活性化が本当に大規模で、すべての細胞を無差別に関与していることを示している可能性があり、細菌性敗血症の間に起こることと同様に、免疫麻痺の一形態を引き起こす可能性がある45。
ガレクチン-1、ガレクチン-3、およびガレクチン-9は、対照と比較して患者で増加した。ガレクチンは、炎症や感染の部位で広く発現する可溶性β-ガラクトシド結合タンパク質の一族であり、ダメージ関連分子パターン(DAMP)や分解能関連分子パターンの新しいクラスとして登場し、炎症反応を拡大したり、そうでなければ修正したりする役割を果たしている46,47。
特に、ガレクチン-1は、多くの自然免疫および適応免疫プログラムを抑制することにより、典型的には分解前メディエーターとして作用する。逆に、ガレクチン-3と-9は、敗血症やいくつかのタイプの感染症の間に炎症反応を増幅させるアラーミン(またはDAMP)として作用することが提案されている。
我々の知る限りでは、これらはCOVID-19患者におけるこれらのタイプの可溶性メディエーターの存在を記述した最初のデータであり、疾患の免疫原性におけるそれらの重要性、または潜在的な治療標的としてのそれらの可能性を検討するために、さらなる研究が必要である。
サイトカインの大量産生および放出は、ポリクローナル、スーパー抗原主導のT細胞活性化の間に起こるものと非常によく似ている48。IFN-γのようなTH1分子のレベルの4倍の増加は、対照と比較してCOVID-19患者の血漿中で実際に観察された。
IFN-γはマクロファージを活性化し、このマクロファージはプロ炎症性サイトカインを産生し、このサイトカインがシステムを圧倒する。患者由来の細胞を抗CD3/28で刺激すると、健康なコントロールと比較して、IFN-γ、TNF、IL-17、およびIL-2を産生するCD4+ T細胞の数の増加が観察された。
このことは、COVID-19患者のT細胞が、潜在的に危険な分子を産生する刺激に試験管内試験(in vitro)で反応する能力がコントロールよりも高いことを示している。特定のT細胞、すなわちSARS-CoV-2由来のペプチド抗原に反応するT細胞の機能的表現型を調べるための研究が進行中である。
血清中の炎症性サイトカインおよびケモカインのレベルの上昇は、サイトカインストームとして、コロナウイルスのいくつかの株によって引き起こされる疾患の重症度の増加に寄与することが知られている。
T細胞の枯渇とIL-10などの抑制性サイトカインによって媒介される特異的な免疫調節系は、過剰な炎症を制限する役割を果たし、肺の恒常性維持において重要な役割を果たしている。したがって、高病原性コロナウイルス感染に対する宿主の防御には、免疫活性化と免疫抑制のレベルのバランスが重要であると考えられる。
COVID-19の肺炎患者では、以下のようなことが明らかになっている。
(i) T細胞の枯渇、活性化、老化のマーカーの増加
(ii) 異なるT細胞サブタイプの分化の変化
(iii) 様々なサイトカインの血漿中濃度の高さ、炎症促進作用を持つものから免疫応答を抑制することができるものまで、TH1への偏りを示すものからTH2への偏りを明らかにするものまで、様々なサイトカインが存在する。
iv)いくつかのサイトカインの試験管内試験(in vitro)での大量生産、TH17表現型に向かって活性化された細胞の潜在的なスキューイング、および
(v)肺や他の組織に局在し、好中球を募集することが知られているそれらの循環細胞の減少。
結論として、COVID-19患者では、免疫抑制、活性化、枯渇、分化段階の異なる細胞内での複雑な変化が共存しており、多種多様なサイトカインが産生・放出されている。このように、SARS-CoV-2は、非常に短い期間で免疫反応の大規模な活性化を引き起こす能力を持っているが、幸いなことに、すべての感染者がそうではない。
しかし、科学界がCOVID-19の免疫原性の研究に多大な努力を払っているおかげで、ウイルス感染の進行には治療上重要な弱点が見られるようになってきている。例えば、IL-6経路を阻害する薬剤の投与に基づく治療法が存在し、現在では病気の経過を有意に改善している13,49。
IL-17は、好中球(肺に移動することができ、COVID-19の病態に大きく関与している細胞)のリクルートと活性化に重要である。我々は、COVID-19患者において、T細胞活性化のTH17機能表現型への著しい偏りが存在することをここで示しており、したがって、我々は、すでに利用可能であり、異なる病態の治療に使用されている生物学的製剤によってIL-17経路をブロックすることが、SARS-CoV-2に感染した患者を治療するための新たな追加の戦略であり得ることを示唆している。
コロナウイルス病の免疫学的特徴2019:T細胞の機能的枯渇とサイトカインストーム
link.springer.com/article/10.1007%2Fs10875-020-00824-4
2019年12月に重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス疾患2019(COVID-19)が出現して以来、SARS-CoV-2の重症型感染が急速に増加しており、世界中で多くの死亡者を出している。
2020年6月16日までに、COVID-19の実験室確認症例数は7,941,791人を突破し、世界では434,796人が死亡したと報告されている[1]。実際には、COVID-19が認識されていないことによる死亡や、他の疾患の日常的な診断や治療の低下による死亡が多いと考えられる[2]。
SARS-CoV-2感染症は、無症候性、非重症症状性、重症の呼吸器・全身症状を含む3つの主要なカテゴリーに分類される[3]。高齢、高レベルのDダイマー濃度、好中球対リンパ球比は、COVID-19入院患者の院内死亡の独立した危険因子予測因子として報告されている[4]。免疫応答はCOVID-19の制御と解決に重要な役割を果たしている。しかし、COVID-19患者のリンパ球サブセットおよび免疫応答についてはほとんど知られていない[5]。アンジオテンシン変換酵素2(ACE2)によるSARS-CoV-2のSタンパク質の宿主細胞への結合、膜への融合、およびウイルスRNAの放出に続いて、病原体に関連した分子パターンがパターン認識受容体によって検出される。その結果、複雑な動的シグナル伝達と下流のカスケード分子は、核内因子κB(NF-κB)とインターフェロン調節因子3(IRF3)からなる転写因子の活性化に寄与し、その結果、I型インターフェロン(IFN-α/β)と一連のプロ炎症性サイトカインの産生をもたらす[6]。
SARS-CoV-2感染は、自然免疫応答および適応免疫応答を引き起こし、その結果、多様なセットアップ免疫メディエーターが疾患の重症度および死亡に寄与している。本報告では、重症化したCOVID-19の症例における炎症性サイトカイン、ケモカイン、リンパ球サブセットの発現を含む免疫学的特徴について、現在知られていることをレビューする。
COVID-19患者では末梢白血球および免疫細胞の変化が認められる。総白血球数(WBC)と好中球数はともに重症患者で有意に高く、一方でリンパ球数は減少し続けていた [5,6,7,8]。リンパ球数減少は疾患の重症度と相関しており、これはT細胞のアポトーシスの増加とCD4+およびCD8+ T細胞の枯渇によって部分的に説明される可能性がある[7,9]。この免疫異常の2つの主要な側面は、単球による炎症性サイトカインの過剰産生と、CD4+ T細胞とその結果としてのB細胞リンパ減少症によって特徴づけられるリンパ球の異常である[10]。重症化した場合の肺組織の損傷は、過剰な炎症反応と、「サイトカインストーム」として知られるサイトカインやケモカインの肺への氾濫によるものである可能性が報告されている[3, 5, 9, 11]。炎症性サイトカインの過剰産生は、COVID-19の発症に大きな役割を果たし、血管過疎症および多臓器不全のリスクの増加につながる[12]。サイトカインストームは疾患の重症度と関連している可能性があり、主に適応免疫系の細胞介在性免疫アームによって媒介される[5, 9, 13]。さらに、高炎症反応症候群に続く二次性血球貪食細胞性リンパ組織球症(sHLH)は、多臓器不全およびCOVID-19疾患重症度と関連している[14]。SARS-CoV-2は感染細胞に直接的なダメージを与えないことが示唆されており、高炎症性応答が病態形成やT細胞の分化・活性の変化に果たす役割の可能性が提案されている[5, 7]。
プロ炎症性サイトカインやケモカインの血清レベルが高いことがいくつかの研究で報告されており、過剰な炎症反応と疾患の重症度や有害転帰との間に相関関係が認められている。Huangらは、重症COVID-19患者ではIL-2、IL-7、IL-10、G-脳脊髄液、IP-10、MCP-1、MIP-1A、およびTNF-αのレベルが有意に高いことを示した[13]。さらに、IL-6、IL-10、TNF-α、IL-2R、およびIL-8の濃度は、重症患者の大多数で上昇している[5、7、11](図1)。
図1に示すように、IL-6、IL-10、TNF-α、IL-2R、IL-8の濃度が上昇している。
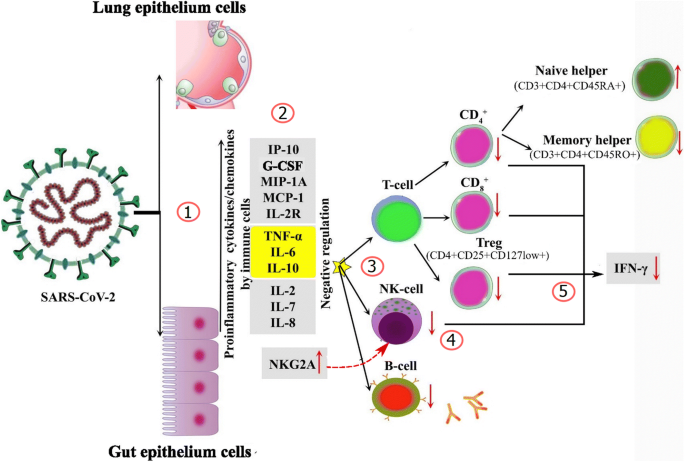
図1
SARS-CoV-2重症感染時の宿主免疫応答 (1) SARS-CoV-2ウイルスは、ウイルスのエンベロープ上の表在性S糖タンパク質とACE2との結合を介して細胞内に侵入し、ウイルスRNAゲノムはエンベロープから細胞質に移行し、単球-マクロファージや樹状細胞による強力な自然免疫応答を引き起こす。(2) 自然免疫応答は、最初に上皮細胞、マクロファージ、好中球によって、プロ炎症性サイトカインの走化性によって引き起こされる。また、高濃度のTNF-α、IL-6、IL-10はT細胞の生存や増殖にも悪影響を及す。(3) 次の段階では、TおよびBリンパ球を巻き込んだ適応免疫応答が誘発され、完全な免疫応答が完成する。免疫異常は、炎症性カスケード、サイトカイン産生、炎症亢進、T細胞の枯渇によって特徴づけられる。(4) NKG2Aの高発現はNK細胞の機能不全に寄与した。(5)疲弊したT細胞とNK細胞は、エフェクターサイトカイン(IFN-γなど)の産生が減少することを特徴としている。
IL-6はサイトカインストームの主要なプレーヤーであり、COVID-19の病因と重症度において重要な役割を果たしている[7]。また、TNF-αは、TNFFSF10を含むTNF経路関連遺伝子のアップレギュレーションによる炎症誘導に重要な役割を果たしている[7]。サイトカインストームは、肺の好中球および単球の輸送に続く自然免疫細胞の大量流入と関連している[15]。COVID-19患者で観察されたT細胞数の減少は、TNF-α、IL-6、IL-10の血清中濃度が高いことに加え、T細胞の生存や増殖に負の影響を与えることが原因であると考えられる。
Tリンパ球サブセット
CD4+ T細胞
循環免疫細胞サブセットの分析から、重症感染症患者の大多数でCD4+ T細胞が減少していることが示された[5, 7, 8, 9, 11]。総T細胞数およびCD4+ T細胞数は、それぞれTNF-α、IL-6およびIL-10のレベルと負の相関がある[11]。
CD8+ T細胞およびナチュラルキラー(NK)細胞
細胞傷害性Tリンパ球とナチュラルキラー(NK)細胞は、ウイルス感染の制御に不可欠である[8]。この文脈では、ウイルスに対する宿主防御に重要な細胞傷害性T細胞およびNK細胞の機能的疲弊は、予後不良と関連している。機能枯渇の状態は、CD8+ T細胞およびNK細胞におけるNKG2A発現の増加を伴う [5, 7, 8, 9]。
COVID-19患者における細胞傷害性T細胞およびサプレッサーT細胞(CD3+CD8+)の両方とも、重症例では正常レベル以下であり[5,9]、TNF-α、IL-6、およびIL-10のレベルと負の相関があった[11]。
Tregおよびその他のThサブセット
Tregs(CD4+CD25+CD127low+)とCD45RA+Tregの頻度は重症例で減少した[5, 7]。CD28陽性細胞傷害性抑制T細胞(CD3+CD8+CD28+)の頻度は重症例で減少したが、活性化された細胞傷害性抑制T細胞(CD3+CD8+HLA-DR+)と同様に活性化されたT細胞(CD3+HLA-DR+)では有意差は認められなかった[5]。
ナイーブCD4+ T細胞をエフェクターサブセットとメモリーサブセットに分化させ、ナイーブCD4+ T細胞とメモリーCD4+ T細胞のバランスを維持することは、T細胞介在性免疫の最も重要な特徴の一つと考えられている[16]。ナイーブヘルパーT細胞(CD3+CD4+CD45RA+)の量は増加しているが、メモリヘルパーT細胞(CD3+CD4+CD45RO+)の量は重症例では減少している。さらに、ナイーブと誘導性調節性T細胞の減少は、重症呈示の患者で見られた[5]。ナイーブ:メモリー比のアンバランスは、この患者群の免疫系の障害を示している。
COVID-19の患者では、CD8+、IFNγ+CD8+、IL-2+CD8+ T細胞、およびグランザイムB+CD8+ T細胞のMFIの割合が減少していた[8]。さらに、CD4+T、CD8+T、NK細胞によるIFN-γの発現は、重症例では低い傾向にあった[7,8]。
以上のことから、マクロファージ活性化症候群とサイトカインストームは、重症のSARS-CoV-2感染症患者におけるT細胞の減少を直接的に媒介している可能性がある。COVID-19の重症期における免疫異常は大きな関心事であり、このイベントの特徴的なパターンは、主に炎症性カスケード、サイトカイン産生、および過剰炎症によって特徴づけられる。最近では、COVID-19感染症の悪化を防ぐためのサイトカインストームの抑制や、抗IL-6(トシリズマブ)[17, 18]を含む抗炎症療法や、TNF-α、IL-1などのモノクローナル抗体などの治療法が提案されているが、これらの治療法を推奨する場合の主な問題点は、ウイルスの排除が遅れ、二次感染のリスクが高まることであり、さらなる検討が望まれる。
SARS-CoV-2に対する既存免疫:知られていることと知られていないこと
www.nature.com/articles/s41577-020-0389-z
SARS-CoV-2に対するT細胞の反応性は未感染者で観察されたが、その原因や臨床的な関連性は不明である。これは、循環する「一般的な風邪」コロナウイルスに対するT細胞の記憶を反映していると推測される。これらのT細胞の特異性を明らかにし、COVID-19の重症度やワクチン反応との関連性を評価することが重要である。
データが検出され、ヒトにおけるSARS-CoV-2 T細胞応答の特徴付けに蓄積され始めると、驚くべき発見が報告されている:未感染のドナーの20〜50%のリンパ球は、SARS-CoV-2抗原ペプチドプール1,2,3,4に有意な反応性を表示する。
Grifoniらの研究1では、SARS-CoV-2がヒト集団に出現する前の2015年から 2018年の間に米国で得られたドナー血液サンプルの50%で反応性が検出された。コロナウイルスのスパイクタンパク質以外のタンパク質に対するT細胞反応性が最も高かったが、スパイクに対してもT細胞反応性が検出された。SARS-CoV-2のT細胞反応性は、ほとんどがCD4+ T細胞と関連しており、CD8+ T細胞による寄与は少なかった1。同様に、オランダの献血者を対象とした研究では、Weiskopfら2が10人中1人の未感染者にSARS-CoV-2スパイクペプチドに対するCD4+ T細胞反応性を、10人中2人の未感染者にSARS-CoV-2非スパイクペプチドに対するCD8+ T細胞反応性を検出した。CD8+ T細胞反応性は、10人の未接種者のうち1人に認められた。3番目の研究では、ドイツのBraunら3が、SARS-CoV-2血清陰性の健常者ドナーの34%でスパイクペプチドに対するT細胞反応が陽性であったと報告している(CD4+とCD8+ T細胞は区別されていない)。最後に、シンガポールの個人を対象としたLe Bertらによる研究4では、SARSやCOVID-19の既往歴がなく、SARSやCOVID-19の患者と接触したこともない被験者の50%において、核酸カプシドタンパク質nsp7またはnsp13に対するT細胞応答が報告されている。英国のサンプルを使用した Meckiff による研究でも、未感染の被験者に反応性が検出された5。以上のように、5つの研究により、地理的に多様な場所に住む人々のかなりの割合でSARS-CoV-2を認識する既存のT細胞が存在するという証拠が報告されている。
これらの初期の報告は、多くの未被爆者に相当なT細胞の反応性が存在することを示しているが、それにもかかわらず、データはまだT細胞の発生源や記憶T細胞であるかどうかを明らかにしていない。未感染者のSARS-CoV-2特異的T細胞は、HCoV-OC43、HCoV-HKU1、HCoV-NL63、HCoV-229Eなどの「感冒」コロナウイルス(CCC)に曝露された記憶T細胞に由来するのではないかと推測されている。ヒト集団の90%以上が、少なくとも3つのCCCに対して血清陽性である6。Thielら3は、CCCとの相同性が高いSARS-CoV-2スパイクペプチドのプールに対してT細胞の反応性が最も高かったが、その差は有意ではなかったと報告している。
これらの観察結果はどのような意味を持つのだろうか?一部のヒト集団においてCOVID-19に対する交差反応性が存在する可能性があることから、広範な憶測を呼んでいる。SARS-CoV-2に対する既存のT細胞免疫は、COVID-19の重症度に影響を与える可能性があるため、関連している可能性がある。SARS-CoV-2を認識する既存のメモリーCD4+ T細胞が高いレベルで存在する人は、SARS-CoV-2に曝露された際に、より速く、より強力な免疫反応を起こし、それによって重症度を制限することが可能であると考えられる。メモリーT濾胞ヘルパー(TFH)CD4+ T細胞は、SARS-CoV-2に対する中和抗体反応をより迅速に促進する可能性がある。メモリーCD4+およびCD8+ T細胞はまた、SARS-CoV7に対する肺における抗ウイルスCD4+ T細胞の理解と、ウイルス感染からの保護におけるメモリーCD8+ T細胞の価値についての一般的な理解に沿って、曝露後早期に肺および鼻咽頭における直接的な抗ウイルス免疫を促進する可能性がある。既存の免疫力を測定し、将来の感染症や重症度と相関させた大規模な研究では、SARS-CoV-2に対する既存のT細胞のメモリーの役割を検討することができる。
もし既存のT細胞免疫がCCCへの曝露と関連しているとすれば、CCC曝露のパターンを空間的・時間的に理解することが重要になるだろう。4つの主要なCCCは、その有病率が複数年周期で周期的であり、地理的な場所によって異なることがあることはよく知られている8。このことは、CCCの地理的分布の違いがCOVID-19疾患の重症度の負担と相関しているのではないかという投機的な仮説につながる。さらに、COVID-19と年齢に関しては、既存の記憶T細胞に関連した非常に推測性の高い仮説が提案されている。子供はCOVID-19の臨床症状に影響を受けにくい。高齢者は致死的なCOVID-19にはるかに感受性が高い。両者の理由は明らかにされていない。CCC感染の年齢分布は十分に確立されておらず、CCC免疫をより詳細に調べる必要がある。これらの考察は、COVID-19に対する既存の部分免疫に複数の変数が関与している可能性があることを強調しており、複数の仮説はさらに調査する価値があるが、データがない場合の過剰な一般化や結論を避けるために注意が必要である。
既存のCD4+ T細胞メモリーもまた、ワクチン接種の結果に影響を与え、免疫反応の迅速化や改善、特にT細胞の助けに依存する中和抗体の発達につながる可能性がある。同時に、特に比較的小規模な第I相ワクチン試験では、既存のT細胞メモリーが交絡因子として作用する可能性もある。例えば、既往の反応性を持つ被験者が異なるワクチン投与群に不均等に分類された場合、誤った結論を導く可能性がある。明らかに、これは既存の免疫を試験デザインで考慮すべき変数として考慮することで回避できる。したがって、COVID-19ワクチンのすべての第I相臨床試験において、既存免疫を測定することを推奨する。このような実験は、既存のSARS-CoV-2反応性T細胞の潜在的な生物学的意義を確認するエキサイティングな機会となるであろう。
SARS-CoV-2に対する既存のT細胞の記憶は、有益なものであるか、無関係なものであるかのどちらかであると考えられがちであるが、その一方で、既存のT細胞がSARS-CoV-2に反応する可能性もある。しかし、既存の免疫が「元々の抗原性の罪」(関連する病原体に対する既存の免疫メモリーのために、潜在的に劣った免疫反応を誘発する傾向)や、抗体を介した疾患の増強などのメカニズムを介して、実際に有害なものになる可能性もある。これらの結果を支持する直接的な証拠はないが、考慮しなければならない。既存の免疫に関連した有害な影響は非常に検証可能であり、上記で提案したCOVID-19コホート研究やワクチン研究によって明らかになるであろう。
インフルエンザの文献には、既存の交差反応性T細胞免疫が有益であることを示すかなりのデータがある。2009年のH1N1インフルエンザのパンデミックでは、病気の重症度に異常な「V字型」の年齢分布曲線が存在し、高齢者の方が若年者よりも優れていることが指摘されている。このことは、数十年前にヒトの集団の中で別のH1N1株が循環していたことと相関しており、それにさらされていた年齢の人たちにはおそらく既存の免疫が発生していたと考えられる。このことは、H1N1に対する既存の免疫が一般のヒト集団に存在していたことを示すことによって検証された9,10。SARS-CoV-2に対するある程度の既存免疫が一般集団に存在する場合、これは疫学モデルにも影響を与える可能性があり、COVID-19感受性のスライディングスケールモデルを検討することを示唆していることに留意すべきである。
結論として、SARS-CoV-2の既存の免疫反応性は一般集団にある程度存在することが明らかになった。これはCCCに対する免疫に起因するのではないかという仮説が立てられているが、まだ証明されていない。このことは、COVID-19の重症度、集団免疫、ワクチン開発に影響を及ぼす可能性があるが、実際のデータを用いた検討が待たれている。

