コロナウイルス 脳卒中・微小血栓症
関連記事
脳卒中
コロナウイルスの新たな謎 若年者の脳卒中の増加
健康な人でも脳卒中を引き起こしている。
「血管が大きければ大きいほど、脳卒中も大きい」
「COVID-19についての最大の話題が浮上している 」と彼は付け加えた。
彼らが見た50歳未満の大血管脳卒中患者の割合は、パンデミック前の7倍だった。血栓はまた、COVID-19患者にとって予想外の問題を引き起こしている。例えば、ブロードウェイの俳優ニック・コルデロは、3月から重度のCOVID-19で入院しているが、医師が血栓をコントロールできなかったため、今月初めに右足を切断した。
多くの患者が肺に小さな血栓を形成し、体内に移動できる酸素の量を減らしていまる。他の人のために、彼らの血液は透析装置を詰まらせています(これは、この病気がまた引き起こしている腎不全の量のために問題となっています)。
「私は血液学者ですが、これは前例がありません。」、とウェイル・コーネル医科大学のジェフリー・ローレンス氏は言う。
「これは今までに見たことのある病気とは違う」
ここ1ヶ月半で血液疾患で受診したほぼ全ての患者は、COVID-19を経験しています。 「人生でこれほど多くの相談を受けたことはありません。この人たちは血が固まっていて、それを止めることができません。」
血液が固まる原因は何か?
私たちが怪我をすると、血液の流れを止めるために血液が固まる能力に頼ってしまいます。血液が固まるのは、血小板と呼ばれる小さな細胞片が集まって形を変えたり、さらに多くの細胞が結合するのを助けるタンパク質や、血液凝固因子と呼ばれる物質が分泌されたりと、複雑な過程をたどっている。
これらのプロセスのいずれかが破綻した場合、人々は過度の出血を経験することができ、命を脅かす可能性がある。
一方で、血管内(まれに動脈内)に血栓が形成されることもあります。このような場合、重篤な被害をもたらし、時には死に至ることもあります。喫煙、肥満、心臓病など、内臓血栓を発症する危険因子はたくさんあります。そして、今、COVID-19も危険因子になっているようだ。
血栓の中には、できた場所に血栓が残ってしまうものがあり、血栓症と呼ばれています。これは激しい痛みや腫れを引き起こす可能性がある。
これらの血栓はまた、主要な臓器に移動したり、形成されたりして、より深刻なダメージを与える可能性がある。例えば、足の血栓が肺に流れ込み、血流を遮断して肺塞栓症(死または肺の永久的な損傷につながる可能性があります)を引き起こす可能性がある。
また、血栓が心臓に流れ込み、心臓発作を引き起こすこともあります。また、頭の中や近くにある血栓は、脳の一部で血流を遮断し、脳卒中を引き起こす可能性がある。
血栓がCOVID-19の患者に何をしているのか
オランダのあるチームは、3つの異なる集中治療室で治療を受けていた184人の重度のCOVID-19患者を追跡調査した。彼らは、これらの患者の31%が何らかの血液凝固の問題を抱えていることを発見した。この割合は「非常に高い」と述べた。
他のデータも同様の意味合いを持つものが出てきている。”コロンビア大学医療センターの心臓病研究員であるBehnood Bikdeli氏は、「重症患者では、様々な形の血栓が15~35%の患者で発生すると推定されている」とVoxに語っている。
そして、これらの血栓、特に小さな血栓は、「病気の重症度や多くの臓器の関与に影響を与える可能性がある」と彼は言う。
ローレンスは何十年もの間、HIV/AIDS患者の小血栓を研究してきた。3月、ある皮膚科医が彼に、COVID-19で重症化した青年の驚くべき皮膚病変の写真を送ってきた。
ローレンスは唖然とした。”微小血管が固まっている写真で、血管が固まっている場所を正確に見ることができます」と彼は言う。彼は、同じようなことが肺で起こっているのではないかと考え始めた。
わずか数時間後、別の医師から電話があり、別のCovid-19患者の検死結果を入手することができた。この患者は皮膚に小さな血栓を持っていただけでなく、肺にも血栓を持っていたのである。
肺に小さな血栓があることは不穏であるが、医療スタッフがCovid-19の患者の中に気づいた不可解な傾向を説明するのに役立つかもしれない。人々がより進行した病気になると、肺が硬くなり、自力で呼吸することが非常に困難になる。これは、機械的換気をしていない場合、血中酸素の低下につながる。
しかし、医療従事者は、低酸素レベルの多くの患者を見てきたが、まだかなり柔軟な肺を持っている、とローレンスは説明する。
これは、「微小血管の塊が[肺の]彼らの血液中に酸素をもたらす人々の能力を遮断している」という存在を指摘している、と彼は言う。(彼はまた、人工呼吸器での持続的な時間は、それ自体が肺の硬直を増加させることができることを指摘し、それは病気の結果として見ていた臨床医を投げ出している可能性があり、おそらく途中で何か他の何かが起こっていたことの兆候を見落としている可能性があります)。
ローレンスはまた、病棟の透析装置を血栓で塞いでいるコビド19の病気の多くの人々についても説明している。看護師が採血をしている間にも、チューブの中で血栓ができていて、ヘパリンや他の血液をサラサラにする薬を大量に投与されている」と彼は言う。”誰もが同じようなことを見ている」と彼は言う。これらの観察結果は、検死でも実証されている。
中国の武漢でコビド19肺炎で入院した183人を調べた中国の研究者チームは、死亡した人の71%で凝固の証拠を発見したが、そうでない人の1%未満であった。
血栓の流行により、ここ数ヶ月の脳卒中や心臓発作による在宅死亡者の一部が実際には、COVID-19に関連していたのではないかという疑問が投げかけられている。これは、COVID-19による死亡者数が過小評価されているひとつの可能性である。
COVID-19が血栓を引き起こす可能性がある理由
科学者たちは、何がこの過剰な血液凝固の引き金となっているのかを正確に理解していない。(エボラウイルスのように極端な出血を引き起こすウイルスもあれば、HIVのように小さな血栓を誘発するウイルスもある)。
また、血液中のこれらの変化がウイルスそのものによるものなのか、感染に対する体の免疫反応によるものなのかはまだ明らかになっていない。
仮説の一つは、ウイルスがどのように私たちの細胞に侵入するかに関係しています。研究者は、このコロナウイルスは、ACE2として知られている特定のタイプの受容体を介して私たちの細胞に潜入することを発見しました。
これらの受容体は肺に顕著に見られるので、ウイルスの損傷の多くが肺に集中している理由を説明できるかもしれません。しかし、ACE2受容体は全身の血管壁に沿って非常に一般的である、とオックスレイ氏は説明する。つまり、その存在が血管の炎症をさらに加速させ、血栓の形成を促している可能性があるのだ。
ローレンスはまた、この炎症性の問題を指摘している。
「それは炎症のこの陰湿なフィードバックループだ」と彼は言う。
「一旦それが起こってしまうと、そのシステムに効果的に介入することはできない」
何ができるか
このウイルスの血液への潜在的な影響についての新しい証拠により、多くの主要な医療施設の医師は、COVID-19の患者に低用量の予防的血液抗凝固剤の投与を開始している。
しかし、あまりにも多くの抗凝固剤を投与すると、患者が内出血して死亡する可能性があるため、手際を要する難しい介入となる。
「患者は、症状が軽度であったり、何の症状もなく自宅で過ごしていたが、突然脳卒中の兆候を示した」とOxley氏は言う。
これらの若い患者の中には、かなり重度の脳卒中の症状が出た後であっても、治療を受けようとしない人もいた。このような重大な神経学的問題に注意を払わないのも無理はない。
「これらの人々 は統計的に脳卒中を持っている可能性が最も低い人々 の間であった」J Mocco、マウントサイナイ脳神経外科医と報告書の共著者、ワシントンポストに語った。
たとえば、最年少、33 歳の女性は、不鮮明なスピーチを開発し、弱さとしびれを感じた彼女の左側の 28 時間の助けを求める前に、彼女は「パンデミック中に病院に行くことを心配していた」と著者は指摘した。 彼女は 1 週間咳、頭痛、悪寒を持っていたにもかかわらず。
COVID-19関連の血栓の危険性はいつまで続くのか
ローレンスは、”私たちのケースの多くは、彼らの咳と熱を通過した後、突然、脳卒中や足に血栓がある “と指摘している。他の患者ではCOVID-19の症状が回復した後、「呼吸困難が再発し、肺に肺塞栓症があることを示唆している」と彼は言う。
「だから、人々は可能性のある徴候を探すために警戒しなければならない」 – 彼らは病気の最悪の状態を過ぎたと感じた後でさえも。
「血栓症リスクが高い人は特に警戒し、適切な水分補給を維持し、特に社会的な距離とロックダウン期間中は活動的であり続ける必要がある」と Bikdeli は言う。
警戒する人たちには、血栓や脳卒中、肥満、いくつかの癌治療や手術、妊娠、避妊メソッドを行った家族歴を持つ人々 が含まれる。
脳卒中はインフルエンザよりもCOVIDで8倍可能性が高い
medicalxpress.com/news/2020-07-covid-flu.html
jamanetwork.com/journals/jamaneurology/fullarticle/2768098
新しい研究では、インフルエンザとCOVID-19の両方が脳卒中のリスクを高める可能性があるが、コロナウイルスではそのオッズは8倍高いようである。
COVID-19が血管に並ぶ細胞を攻撃することが、脳卒中につながる血栓のリスクを高める一つの理由であると、ニューヨーク市のレノックスヒル病院の脳卒中部長のアジャール博士は説明した。
若くても年配でも、COVID患者は血栓を生じさせることがある。患者によっては、脳卒中がCOVID-19の最初の兆候となることもある。 この研究では、患者の4分の1以上が脳卒中のために救急室に行き、後にコロナウイルスと診断された。
幸いなことに、COVID-19患者のうち、脳卒中を発症する患者はごく一部である、とAzhar博士は述べた。 研究でウイルスを持っていた1,916人の患者のうち、31人が脳卒中を発症した。
ただし、脳卒中後の障害は、ウイルスの影響で永続的となる可能性がある、と彼は言った。
脳血管疾患との関連性
脳血管疾患の病歴がある患者では、約2.5倍のCOVID-19疾患の重症性と関連する。
pubmed.ncbi.nlm.nih.gov/32310015/
脳卒中
COVID-19の脳卒中に対する二つの懸念が増加している。ある人々は、軽い脳卒中を患っていて、感染を心配して病院へ行こうとしない。もう一方の人々は、重度の脳卒中があり、自宅で死んでいるのが発見されている。
血栓症(Macrothrombosis)
コロナウイルスの血栓の謎が激化
「これは重度の感染症の人に見られるものではない 」
これは「二重攻撃だ」とオドネル氏は言う。
肺炎は、肺の小さな嚢に液体や膿を詰まらせる。
そして、小さな血栓が酸素を含む血液の移動を制限する。
ウイルスの影響
なぜこの血栓ができるのかはまだ謎である。一つの可能性としては、SARS-CoV-2が血管を構成する内皮細胞を直接攻撃していることが考えられる。内皮細胞は、ウイルスが肺細胞に侵入する際に使用するのと同じACE2受容体を持っている。
スイスのチューリッヒ大学病院とマサチューセッツ州ボストンのブリガム・アンド・ウィメンズ病院の研究者は、腎臓組織内の内皮細胞でSARS-CoV-2を観察した6。カナダのオタワ大学心臓研究所の主任科学者ピーター・リュー氏は、健康な人の場合、血管は「非常に滑らかに裏打ちされたパイプ」であると言う。この内張りは、血栓の形成を積極的に阻止している。
しかし、ウイルスに感染すると、これらの細胞にダメージを与え、このプロセスを誘発するタンパク質の産生を促すことができる。
免疫系へのウイルスの影響もまた、血栓形成に影響を与える可能性がある。ある人では、COVID-19は免疫細胞に化学シグナルの奔流を促し、炎症を増大させ、それが様々な経路を介して凝固や凝血につながる。
ウイルスは補体システムを活性化するようで、血液凝固に拍車をかける防御機構である。ローレンスの研究グループは、COVID-19を発症した人の肺や皮膚組織の小さな血管が詰まっていることを発見した。
補体、炎症、凝固というこれらのシステムはすべて相互に関連していると、カナダのバンクーバーにあるブリティッシュコロンビア大学の血液学研究プログラムのディレクターであるアグネス・リー氏は言う。”COVID患者の中には、これらのシステムのすべてがハイパードライブ状態になっている患者もいる。”
COVID-19はどうやって殺すのか? 不確実性が治療法の選択を妨げている
しかし、Lee氏は、COVID-19に特異的ではない他の因子が関与している可能性があると付け加えている。入院した患者は、一般的に血栓症の危険因子を多く持っている。高齢者や太りすぎ、高血圧や糖尿病の可能性がある。
高熱を呈し、重症であるため、おそらく動けなくなっていると思われる。彼らは凝血への遺伝的素因を持っているか、またはリスクを増加させる薬を服用している可能性があります。「それは一種の完璧なサイトカインストームだ。」と彼は言う。
新しい治療法の競争
研究者たちはCOVID-19患者の血栓がどのようにして起こるのかを解明し始めているが、血栓を予防し、破壊することを目的とした新しい治療法の試験に全力で取り組んでいる。
血液をサラサラにする薬は、集中治療室の患者の標準治療であり、COVID-19患者も例外ではない。しかし、投与量については熱い議論が交わされている。
“現在の問題は、どのくらい積極的にすべきかということです “と、ボストンのベス・イスラエル・ディーコネス医療センターの血栓止血・血栓症部門のチーフRobert Flaumenhaftは言う。
ニューヨーク市のマウントサイナイ医科大学の研究者は、機械換気でCOVID-19を持つ入院者が血液シンナーを投与された場合、それらで治療されなかった人よりも低い死亡率を持っていたことを報告した。しかし、チームはこの観察のための他の説明を排除することができず、これらの薬の高用量はリスクを運ぶ。
ニューヨーク市のコロンビア大学では、COVID-19で重症化している人を対象に、血栓予防のための血液シンナーの標準用量と高用量を比較する臨床試験を開始している。カナダとスイスでも同様の試験が計画されている。
また、Beth Israel Deaconess Medical Centerの科学者たちは、組織プラスミノーゲンアクチベーター(tPA)と呼ばれるより強力な血栓破壊薬を評価する臨床試験の登録を開始した。この薬はより強力であるが、血液サラ-ナーよりも重篤な出血のリスクが高い。
コロナウイルス治療薬レムデシビルへの期待が高まる
科学者たちは、これらの試験などが、医師が困難な治療判断を下すのに必要なデータを提供してくれることを期待している。Lee氏は、「反動的な医療」が多発していることを憂慮している。
“人々は自分の地域や個人的な経験に反応して治療法を変えているのです」と彼女は言う。彼女は、「しかし、我々は主なことを覚えておかなければならないのは、まず害を及ぼさないということです」と、その衝動を理解している。
時間の問題:COVID-19と診断された患者における静脈血栓予防薬の期間と選択
COVID-19と診断された患者における有意な血栓塞栓状態のエビデンスの増加に鑑み(Klokら、2020年;Middeldorpら、2020年)、著者らは、Journal of the American College of Cardiology(JACC)ガイダンス(Bikdeliら、2020年)、および他の問題の中でも特に入院および退院後の血栓予防を網羅したAmerican Venous Forum白書(The COVID-19 Sub-Committee of the American Venous Forum、2020年)を興味を持って読んでいた。
著者のセンターでは、コンピュータ断層撮影による肺血管造影を受けたSARS-CoV-2感染が確認された患者119人中41人(34.5%)が肺血栓塞栓症と診断され(Barnet Hospital、未発表データ、2020年)、退院した患者が血栓症で再入院するケースが増加している。
多くの研究(Klokら、2020年;Middeldorpら、2020年)が入院患者の血栓予防を提唱しているが、これまでこれらの文献(The COVID-19 Sub-Committee of the American Venous Forum、2020年;Bikdeliら、2020年)を除けば、退院患者に対する推奨はなされていない。
16歳以上の静脈血栓塞栓症に対するNational Institute for Health and Care ExcellenceのガイダンスNG89(National Institute for Health and Care Excellence, 2018)では、リスク評価の後、急性期医療患者に対して少なくとも7日間の血栓予防を推奨している。
第一選択薬は低分子ヘパリン、第二選択薬はフォンダパリンである。この患者群では、抗凝固療法の最大期間は定義されていない。整形外科患者においては、下肢の固定化とそれに伴う可動性の低下があり、血栓症のリスクが出血のリスクを上回る場合には、最大42日(6週間)までの化学的血栓予防を検討することが推奨されている。
著者らの経験では、SARS-CoV-2感染症の治療後に退院した患者の回復までの時間は、当初の予想を大幅に上回ることが多い。さらに、これらの患者は安静にしていたため、入院中のかなりの期間、脱水症状のリスクがあり、回復とリハビリの両方の間に社会的な距離を置くことで、患者の運動能力が劇的に低下することになる。
National Institute for Health and Care Excellenceのガイダンスから外挿して、JACCのガイダンス(Bikdeli et al, 2020)、およびThe COVID-19 Sub-Committee of the American Venous Forumの白書(2020)の両方に沿って、著者の戦略は、リスク評価された患者に対して退院後2~6週間は化学的血栓予防薬を開始することである。
著者の病院では、静脈血栓塞栓症の予防のために血栓予防薬の投与期間を長く(6週間)することが好ましいとされているが、これは、適切な回復までに長期間を要する患者や静脈血栓塞栓症の再来院の経験を考慮したものである。
パンデミックの影響で、自己治療ができない患者や家族から低分子ヘパリン注射を受けている患者に対応できる地域の看護師がいなくなったこと、また、整形外科手術を選択した患者を対象とした血栓予防の臨床試験の結果(Erikkson et al, 2009; Lassen et al, 2010a, 2010b)から推測すると、患者には直接経口抗凝固薬を投与することが推奨されているが、著者らはこれがライセンス外であることを認識している。
主な選択薬はアピキサバン2.5mgを1日2回、またはリバロキサバン10mgを1日1回、プロトンポンプ阻害薬と併用し、臨床的に関連性のある非主要な消化管出血のリスクを軽減することである(Ray et al, 2018)。
直接経口抗凝固薬が適さない場合、または低分子ヘパリンの注射が好ましい場合は、血栓予防用量の低分子ヘパリンの投与が推奨される。出血の危険性が高い場合には、抗エンボリズムストッキングによる機械的血栓予防が推奨される。
本ガイドライン実施後、著者らはSARS-CoV-2感染症患者における退院後の静脈血栓症の発生率を検討する予定である。
ガイドラインのポイント
- SARS-CoV-2感染症は高凝固状態を引き起こす。
- 退院後のベースラインへの回復は長期化する。
- リスク評価を行った上で、高凝固状態に起因する静脈血栓塞栓症のリスクと、長期の回復期における可動性の低下を軽減するために、血栓予防薬の延長(2~6週間)を検討すべきである。
- 直接経口抗凝固薬(リバロキサバンやアピキサバンなど)を用いた化学的血栓予防は、免許外ではあるが、低分子ヘパリンを地域で注射するよりも投与が容易である。
- 化学的血栓予防が禁忌の場合は、抗エンボリズムストッキングによる機械的血栓予防を考慮すべきである。
軽度Covid-19感染症患者におけるマクロ血栓症(macrothrombosis)と脳卒中
2019 (COVID-19)は、現在世界中の数百万人に影響を与えているパンデミック疾患である。 その神経学的な意味合いは十分に理解されておらず、さらなる研究が急務となっている。 重症のCOVID-19患者では高凝固状態が報告されているが、軽症患者の凝固障害については何も知られていない。 ニューヨーク市で大血管血栓症を合併して脳卒中を発症した患者で,COVID-19が認められたが,呼吸器症状は軽度であることが判明した症例を報告する。
これは、重度のCOVID-19を有する患者で報告されている静脈血栓症や微小血管症とは対照的である。 我々の症例は、重症化していなくても、COVID-19患者は脳卒中につながる血栓形成のリスクが高いことを示唆している。 このことはCOVID-19患者における一次および二次脳卒中予防に意味を持つ可能性があるため、さらなる系統的な研究が必要である。
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染患者における凝固障害が報告されており1 、凝固障害の程度が呼吸器疾患の重症度と相関しているという証拠がある2 。この凝固障害の主な臨床的後遺症は、静脈血栓塞栓症イベント3 、および播種性血管内凝固と類似していると考えられる微小血管障害に続発する末梢臓器不全である4 。 5
COVID-19の重症度は大動脈虚血と凝固障害の両方と相関していることから、この2つの現象を関連付けるのはもっともらしいと思われる。ここでは,SARS-CoV-2感染者のうち,COVID-19が進行していないにもかかわらず,大動脈脳梗塞を呈した3人の患者について説明し,凝固障害の詳細を述べた。
これらの患者のうちの1例は、50歳以下の患者におけるCOVID関連脳卒中の最近の報告にまとめられている6)3人の患者は、脳卒中様症状を呈して救急外来に来院し、総頸動脈の亜閉塞性重症狭窄とその内の脳卒中が認められた。
2020年4月のSARS-CoV-2発生時に、3人とも2週間以内にニューヨーク市で発症した。 1人の患者は、以前は健康だった33歳の女性で、左手のしびれを発症し、すぐに片麻痺と左顔面、腕、下肢の感覚喪失に進行した。CT(コンピュータ断層撮影)血管造影では、右総頸動脈に非閉塞性の血栓が内頸動脈にまで達しており、ウイルス性肺炎を示唆する肺所見が認められた(図A)。
その後の磁気共鳴(MR)画像診断では右中大脳動脈の領域内に急性脳卒中が認められたが,MR血管造影では動脈解離の証拠は認められなかった.最近の咳を訴えていたが,発熱はなく,補助的な酸素補給も必要としなかった。
当初はアスピリンとクロピドグレルで治療したが,SARS-CoV-2感染時の静脈血栓塞栓症予防に関する当院のガイドラインに基づき,アピキサバン5mgを1日2回投与に変更した.診察から10日後に繰り返しCT造影を行ったところ,血栓症はほぼ完全に消失し,基礎となる血管異常の兆候は認められなかった(図B)。
2番目の患者は77歳の女性で,高血圧,高脂血症,両側の下肢深部静脈の血栓症が2ヵ月前に発見され,アスピリン,クロピドグレル,ワルファリンを処方された(ただし,診察時には治療中であった)が,突然失語症と左片麻痺を発症し,右末梢総頸動脈に非閉塞性血栓症を認めた(図C).診察時に咳をしており,SARS-CoV-2に感染していることが判明したが、発熱もなく,補助的な酸素補給も必要なかった.3番目の患者は55歳の糖尿病の男性であるが、他の既往歴はなく、左手の脱力感を呈し、左顔面、腕の脱力に進行した。
CT造影では、ウイルス性肺炎を示唆する肺実質の変化に加えて、閉塞性または閉塞に近い状態で内頸動脈まで伸びている右総頸動脈内の血栓症が示された(図E)。血栓症は非閉塞性であることが判明したため、緊急の通常の血管造影のために連れて行かれた。エプティフィバタイドが動脈内投与され,狭窄の程度は低下しいた(図F).
機械的な血管内治療は行われず,その後ヘパリンの点滴が行われた. 標準的な血清学的検査と、SARS-CoV-2陽性と診断されたすべての患者に対して当院から送られてきた凝固マーカーが、3人の患者全員に送られてきた。特筆すべきは、Dダイマー値が有意に上昇していたのは1人(患者2)のみで、3人ともC反応性蛋白質値が上昇していたことである。
3人のうち2人の患者は若く、明らかな血栓塞栓症の原因がなく、心エコー検査では目立った異常はなく、卵巣孔塞栓症の証拠もなかった。1人の患者には軽度の抗カルジオリピン抗体が認められたが、それ以外の患者には、動脈血栓症に関連することが知られている抗リン脂質症候群や高ホモシステイン血症の血清学的証拠は認められなかった7。これらの症例を総合すると、SARS-CoV-2感染に関連して以前に特徴づけられた静脈血栓症と微小血管症に加えて、以前のコロナウイルス株のSARS患者で報告された大血管性動脈血栓症の傾向がある可能性があることが示唆される8。
最近では、ウイルス粒子が炎症性細胞の蓄積とアポトーシス(内皮炎)とともに全身の内皮に存在することが確認されている9,10 。注目すべきことに、我々の患者3人はいずれも感染症状が軽度であり、重症患者と軽症患者では血栓症のパターンが異なる可能性があることを示唆している。
深部静脈血栓症
www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.047407
重症のCOVID-19患者では下肢深部静脈血栓症の発生率が非常に高いことがわかった。
2002年のSARS流行時には、深部静脈血栓症(DVT)が20.5%、肺塞栓症(PE)が11.4%であったが、COVID-19の高死亡率に血栓症が寄与しているかどうかは不明である
今回の調査では,COVID-19によりICU治療を受けた患者の全体的なDVT発症率は,これまでに示されていたものよりもはるかに高かった。Prophylaxis for Thromboembolism in Critical Care Randomized Trialでは、抗凝固療法としてダルテパリンとヘパリンを投与された患者の下肢VTE発症率は5.1%(96/1873)、5.8%(109/1873)であった。
H1N1感染の重症患者でも、下肢深部静脈血栓症(DVT)の発生率は12.7%(9/71)であった3。
凝固活性化もまた、持続的な炎症反応と関連している可能性がある。
感染そのもののほかに、完全な安静、機械的換気、静脈カテーテル治療も重症COVID-19患者で観察される血栓症のリスクの高さに寄与する可能性がある。
我々の研究では、血栓の大部分は下肢遠位部で検出されたが、近位下肢深部静脈ではわずか10.4%であった。近位部深部静脈血栓症(DVT)の発生率が低いのは、入院中に予防的な抗凝固療法として低分子ヘパリンを投与したことに起因すると考えられる。
また、遠位深部静脈血栓症(DVT)による肺塞栓症のリスクは近位深部静脈血栓症(DVT)に比べて低いが、ふくらはぎから発生した血栓の多くは上向きに広がる傾向があることが報告されている
COVID-19の機能不全凝固 細胞からベッドサイドへ
link.springer.com/article/10.1007%2Fs12325-020-01399-7
内皮細胞の機能不全はコロナウイルス感染による炎症と相互作用し、凝固異常や敗血症を引き起こす可能性があり、COVID-19患者の予後不良を示唆している[9]。血小板減少のプール頻度は11.1%であり[10]、COVID-19患者ではD-ダイマーの高値が46.4%から97.1%[11,12,13]と、特に重症例ではより一般的であるようである[14,15,16,17]。
COVID-19 感染症と凝固機能
凝固は、内皮細胞、血小板、凝固因子という3つの主要な構成要素の相互作用を伴う非常によく組織化されたプロセスである。重度の感染症では、凝固が活性化され、それに伴う播種性の血管内凝固を伴う凝固因子の過剰摂取が発生し、致死率を高めるリスクが増加する[23]。
COVID-19に感染した患者は、臨床症状と臨床検査の両方で異常な凝固を示すことが、かなりの証拠によって示されている[19、20]。具体的なメカニズムはまだ明らかにされていないが、SARS-CoV-2は明らかに止血・凝固および炎症に悪影響を及ぼす可能性のあるプロセスを含んでいる。
機能不全ACE2
ACE2は、ACEとは逆の作用を持つレニン-アンジオテンシン系(RAS)の重要な役割を担っている。RASは、ACE-アンジオテンシンII(Ang II)-アンジオテンシンII 1型受容体(AT1R)とACE2-Ang(1-7)-Mas受容体(MasR)の2つの軸で構成されている。
RASの第1軸は活性酸素とスーパーオキシドレベルを上昇させ、内皮機能と微小循環を障害する。ACE2-Ang(1-7)-MasR軸はACE-Ang II-AT1R軸の機能を打ち消し、炎症を減少させて血管拡張をもたらす[24]。ACE2の機能障害はACE-Ang II-AT1R軸の異常な活性化につながり、それに伴って血小板の癒着と凝集が促進され、肺、脳、心臓、腎臓などの多臓器における血栓塞栓症のリスクを高める。
自然免疫応答
凝固系は、ウイルスの侵入または傷害から人体を保護するための宿主防御反応として機能する。ウイルスの侵入によって誘導される止血プロセスの活性化は、血栓内の病因物質を排除するための免疫系として働くことがある[25]。実際、凝固と自然免疫の調節は、凝固、炎症、宿主免疫応答の開始における組織因子の機能など、ウイルスの侵入や傷害に応答して多くの共通経路を共有しているため、相関関係があり、絡み合っている[26]。
炎症性因子ストーム
これまでのデータは、COVID-19肺炎患者は、疾患経過のごく初期段階でサイトカインストームを示すことを示しており、COVID-19で死亡した患者の剖検から得られた最新の病理学的証拠もまた、この考えを支持している[18]。
インターロイキン-2(IL-2)、インターロイキン-6(IL-6)、インターロイキン-7、インターロイキン-8、インターロイキン-10、および腫瘍壊死因子(TNF)を含む炎症関連サイトカインのレベルの上昇がCOVID-19患者で認められ[18、27、28]、疾患の重症度と相関していた[29]。内皮細胞感染および内皮炎は、SARS-CoV-2の病態形成において重要な役割を果たしている。
ウイルス感染による炎症は、TNF-α、IL-1β、IL-6などの様々な炎症性サイトカインを悪化させ、これらのサイトカインは、内皮細胞および単球からの組織因子およびvon Willebrand因子の発現を増加させ、血小板凝集を促進し、凝固カスケードを開始する。さらに、炎症性サイトカインは、トロンボモジュリンと内皮プロテインC受容体をダウンレギュレートし、プラスミノーゲンアクチベーターインヒビター-1をアップレギュレートすることで、抗凝固剤の合成と線溶化を抑制することができる[30]。
全体として、現在の証拠は、SARS-CoV-2侵入後の炎症性疾患、高凝固および過剰な免疫との密接な相互関係が、機能不全の凝固における可能性を示している。免疫応答の刺激とプロ炎症が凝固カスケードを活性化し、血液凝固が過剰な炎症反応の経路をオーケストレーションする。
COVID-19 血栓溶解療法に反応するびまん性肺血栓と肺内皮機能障害が牽引する重篤な病態生理
onlinelibrary.wiley.com/doi/full/10.1002/ctm2.44
重症のCOVID-19患者は、急性呼吸窮迫症候群(ARDS)として特徴づけられてきた。重症のCOVID-19患者は、重度のガス交換異常にもかかわらず、比較的良好な肺機能を維持しており、これは古典的なARDSとは一致しないが、より肺血管疾患と一致する特徴である。また、重度のCOVID-19患者の多くは、d-ダイマーの上昇と静脈血栓塞栓症の発生率が高く、凝固異常が顕著である。
重症COVID-19肺炎で重度の呼吸不全とショックを呈し、死腔換気が著しく上昇していることを示す4例の患者にtPAを投与した。
すべての症例で治療後すぐにガス交換および/または血行動態の改善がみられた。重度のCOVID-19肺炎は肺微小血栓と内皮機能障害を介して呼吸不全を引き起こすと考えられる。COVID-19肺炎の治療は、軽症例では抗凝固療法、重症例では血栓溶解療法が必要であると考えられる。
COVID-19で生命を脅かす血栓を予防する方法を検索する
コロナウイルス病2019(COVID-19)のパンデミックに半年間、研究者はCOVID-19が人体に壊滅的な被害をもたらすことができる多くの方法について、まだ多くのことを学ばなければならない。多くの謎の中には、COVID-19の原因となる新型コロナウイルスであるSARS-CoV-2が、どのようにして脳卒中や他の生命を脅かす合併症につながる血栓の形成を誘発するのか、若年層であっても正確に分かっていないものがある。
最近、私は NIH の心臓、肺、血液研究所 (NHLBI) のディレクターのゲリー・ギボンズ博士と COVID-19 のこの不可解な合併症に取り組むためにどのような研究が行われているかについて話をする機会があった。私たちの会話はビデオ会議を介して行われ、彼はワシントンD.C.の彼の家から接続し、私はメリーランド州のちょうど道路上の私の家からリンクしていると、彼は、ワシントンD.C.の彼の家から接続する。
以下は私たちの会話の要約である。
コリンズ
肺だけでなく体の他の部分でも SARS-CoV-2による 血液凝固について質問する これを説明するためにウイルスについて何がわかっているか?
ギボンズ
数週間ごとにCOVID-19のページがめくられ、このウイルスがどのように体に影響を与えるかについて、さらに多くのことがわかってきた。血栓は、特にニューヨーク市で患者の世話をしているうちに、驚くべき、そして残念なことに、壊滅的な合併症として現れてきた。特定の患者には、体内に十分な酸素を供給するのが困難であることが明らかになった。その困難は、肺の酸素交換能力に影響を与える肺炎の程度によって完全に説明することができなかった。
それは、肺炎に加えて、肺の血栓が酸素化を損なっていることが判明した。しかし、何人かの患者はまた、体の他の部分の静脈や動脈に血栓、または血栓症の合併症を持っていた。非常に不可解ですね。脳への動脈循環に影響を与える血栓に関連した脳卒中を呈する30代と40代の比較的若い個人のエピソードがあった。
何が血栓を促進するのか、まだ理解しようとしているところだ。一つの手がかりは、血管の内張りを形成している内皮細胞に関係している。これらの細胞の表面には、アンジオテンシン変換酵素2(ACE2)受容体と呼ばれるタンパク質があり、この手がかりは2つの理由から重要である。一つは、ウイルスがACE2受容体に付着し、それを細胞に感染するための入り口として利用することである。
二つ目は、内皮が並んだ血管が全身のあらゆる臓器に伸びていること。これらを総合すると、COVID-19の合併症のいくつかは、ウイルスが肺だけでなく、心臓や複数の臓器の内皮細胞に付着することに関係しているように思われる。
コリンズ
呼吸器の木から始まって ウイルスは血管に侵入して 体内に広がっていく COVID-19に感染した人が、本当に病気になったわけではないのに、足の指が凍傷のように見えるという奇妙な報告がある。COVIDの足指も同じ症候群の一部なのであろうか?
ギボンズ
私たちはまだこのウイルスについて学んだばかりの初期の段階である。しかし、これはウイルスが大きな血管だけでなく、小さな血管にも影響を与えることを示す、さらなる手掛かりになると思う。実際、毛細血管レベルでの血栓が報告されているが、これはかなり珍しいことである。血小板と内皮表面の間で相互作用が起きていることを示唆している。
通常、血流の中では、血栓ができるのを防ぎ、血液の流れを維持するために、プロ凝固剤と抗凝固剤のタンパク質の間で、厳密にバランスが調整されている。しかし、例えば指を切ると、タンパク質の網目のような形で血栓のための活性化が起こる。これは、ケガを封じるのに役立つ釣り網のようなものである。さらに、血流中の血小板は、その漁網の穴を塞ぐのを助け、血管の本当のシールを作る。
想像してみてほしい、これらの小さな血管は、通常、テフロンのような非粘着性の内皮表面を持っていて、固まるのを防いでいる。そこにウイルスが入ってきて血栓形成を促進するようにバランスを崩すんだ 内皮のテフロンのような性質を乱して粘着性を持たせる。このウイルスが内皮内膜の分子の一つに結合することで得たトリックは信じられないほどである。
コリンズ
COVID-19の患者で血栓症のリスクが最も高いのは誰か?
ギボンズ
残念ながら 残念ながら、今のところ、高齢者は最も脆弱な状態にあるようである。彼らは血栓形成のリスクを多く持っている。特筆すべきは、これらの血栓性合併症は比較的若い成人や中高年にも起こっており、他の慢性疾患や併存疾患をあまり持っていないため、重症化のリスクが高いということである。繰り返しになるが、このウイルスが凝固系に特有の何かをしていることを示唆している。
コリンズ
血液凝固に問題を起こす可能性の高い人を事前に特定する方法がないだろうか。制御不能に陥っているという証拠が出る前に、介入を開始したいと思う人たちかもしれない。どの患者が早期介入の恩恵を受けるかを示すバイオマーカーのようなものはあるか?
ギボンズ
バイオマーカーは積極的に研究されている。初期の観察からわかっていることは、Dダイマーと呼ばれるバイオマーカーを測定することで、血液中の凝固因子と抗凝固因子のバランスを評価できるということである。これは基本的には、以前の血栓からのタンパク質断片、分解産物である。これは、血栓を形成したり溶解したりするシステムの活性について少し教えてくれる。
Dダイマーの活性が高ければ 凝固カスケードが活発になっていることを示している そのような患者では 凝固と血栓症の大きな引き金になっていることの 手がかりになるであろう したがって、Dダイマーのレベルは、どの患者が本当に積極的な完全抗凝固療法を必要としているのかを教えてくれるかもしれない。
コリンズ
この凝固の問題を抱えているように見える患者さんには、経験的に血液希釈剤を使ってみたことはあるか?
ギボンズ
ニューヨーク市のマウントサイナイからCOVID-19 [1]の治療を受けている何千人もの患者を調べた論文がある。臨床的な実践と判断に基づいて、印象的な所見の一つは、完全に抗凝固療法を受けていた患者の方がそうでない患者よりも生存率が高かったということである。さて、これは無作為化された対照臨床試験ではなく、完全抗凝固療法を受けた人と受けなかった人がいた。単なる観察研究であり、関連性を示しただけである。
しかし、この研究は間接的に、血液シンナーを投与して、血栓症のリスクを変えることで、罹患率と死亡率を減らすことができるかもしれないということを示している。だからこそ私たちは無作為化比較臨床試験を行い、これらの症例の致死率を下げることができるかどうかを確認する必要があるのである。
COVID-19と血栓性合併症
pubmed.ncbi.nlm.nih.gov/32534328/
塞栓症ではなく肺血栓症?
Demelo-Rodríguezらによる最近の論文を大変興味深く読み、COVID-19肺炎で入院した患者における(無症候性の)深部静脈血栓症(深部静脈血栓症)の発生率(14.7%)は、一般内科や整形外科病棟に入院したCOVID感染者以外の患者の他のシリーズで報告されたものよりも高くはなかったと報告している[1]。
最近の研究では、ICUや一般病棟に入院したSARSCoV2感染に関連した肺炎患者において、標準的な予防的抗凝固療法にもかかわらず、多くの静脈血栓性合併症が報告されている[2-4]。そのほとんどは肺イベント(推定肺塞栓症[推定肺塞栓症])[2,3]であり、COVID-19患者では他の病因による呼吸不全患者よりもはるかに一般的であった[2]。
興味深いことに、推定肺塞栓症患者の大多数は深部静脈血栓症を合併していなかった [2,4]。注目すべきは、最近の剖検研究[5]では、明らかな塞栓症がなくても、肺動脈循環内で血栓症が発生していることが示されている。
これらのデータは、COVID-19が静脈血栓塞栓症ではなく、肺血栓症(肺血栓症)の高い発生率と関連している可能性を示唆している。肺血栓症はCOVID19の新しい症状ではなく、COVID19の特徴的な特徴でもない;感染性と非感染性の両方の他の原因による呼吸不全の患者でも認められている[6]。
しかし、COVID-19ではより一般的であるように思われる [2-4]。肺内の炎症過程の強力な活性化の結果として、肺血管内に局所血栓が形成されることがあり、それに伴うサイトカインストームおよびその結果としての肺内皮機能障害または損傷が生じる。さらに、SARS-CoV-2は、II型肺炎球のACE-2受容体と結合し、カリクレイン/キニン系の調節を阻害することで、凝固経路を活性化する可能性がある[7]。
肺血栓症の発生率が高いのは、最近の研究で検査対象となった患者の約90%で検出されたループス抗凝固薬(LA)の存在に関連した血栓症状態の結果である可能性もある[2]。これらの推測が確認された場合、2つの実用的な結果をもたらす可能性がある。
第一に、COVID-19が肺塞栓症ではなく肺血栓症と関連している場合、一般的に使用されているWellsテスト前確率スコアは深部静脈血栓症の臨床徴候の有無に依存するため、有効ではないかもしれない。
第二に、肺塞栓症とは異なる肺血栓症の病因機序により、治療法の推奨度が変わる可能性がある。文献によると、標準的な低分子量ヘパリンによる予防的治療ではCOVID-19患者の肺血栓性合併症を予防できないことが示唆されている。この所見は、肺血栓症と推定肺塞栓症の背後にある異なる病原性メカニズムの結果である可能性がある。
もしこの結果が確認されれば、これらの患者における抗凝固薬の使用法を変更することが可能となる:入院時からより高用量の予防的または直接治療的な低分子量ヘパリン投与を開始し、退院後の抗凝固薬の長期投与を検討する。
COVID-19による危険な血栓を防ぐことは困難であることが証明されている。
www.sciencenews.org/article/covid-19-coronavirus-preventing-dangerous-blood-clots-lungs
抗凝固薬は過剰な血液凝固を止めるのに役立つかもしれないが、最高の用量は明らかではない。
重症のCOVID-19患者にとって、十分な空気を取り込むのに苦労するのは、体液が詰まった肺を持つことだけが原因ではない。酸素の探求もまた、大量の血栓によって妨げられている。
過度の血栓が重篤なコロナウイルス感染症の合併症であることが明らかになったため、血栓を管理するための最善の方法についての議論が行われてきた。現在、他の患者の血栓を予防したり、分解したりするためにすでに使用されている抗凝固薬の投与量を評価する臨床試験が進行中である。しかし、「多ければ多いほど良い」というような簡単なことではない。
凝固と出血の間の適切なバランスをとることは、身体自体が定期的に行っていることであり、怪我をした後だけではない。感染症は、血液凝固にも拍車をかける。これは、免疫システム、炎症、血液凝固が関連しているからである。
これらのシステムの調節がおかしくなると、スケールは、重度の炎症が過度の凝血につながる血栓性炎症に傾く可能性がある。COVID-19の患者にとって、それは驚くべき程度に起こっている。しかし、手術や他の処置の後にリスクがある他の患者の血栓を予防するために使用される抗凝固薬の用量は、コロナウイルス関連の血栓には効いていない。有効な用量と治療に最適な時期があるかどうかを見極めることは、COVID-19の患者を助けるための1つの要素になるかもしれない。
なぜ血栓が重篤な感染症の合併症として起こるのかというと、血栓は免疫システムの役割に根ざしているからである。切り傷の現場で壊滅的な出血を止めることはよく知られているが、血栓には水漏れを塞ぐだけではない。血栓は病原体をロックダウンすることもでき、病原体が組織に侵入して体内を移動するのを防ぐことができる。
自然免疫システム(病原体に対する体の最初の防御機能)が侵入者を警戒するようになると、体は炎症を高めるタンパク質の放出を開始し、特定の免疫細胞が血栓システムを活性化させる。病原体は、免疫細胞が殺傷のために入ってくるまでの間、クモの巣の中のハエのような血栓の中にロックダウンられてしまう。
しかし、COVID-19の患者の中には、血液凝固反応が過剰になり、血管が閉塞したときに命を危険にさらす者もいる。肺塞栓症は、血栓が静脈から抜けなくなって肺に詰まったときに起こるが、これらの患者では一般的である。血栓はまた、最小の血管のレベルで起こっており、酸素の供給を妨げ、臓器にダメージを与える。
COVID-19肺組織サンプル
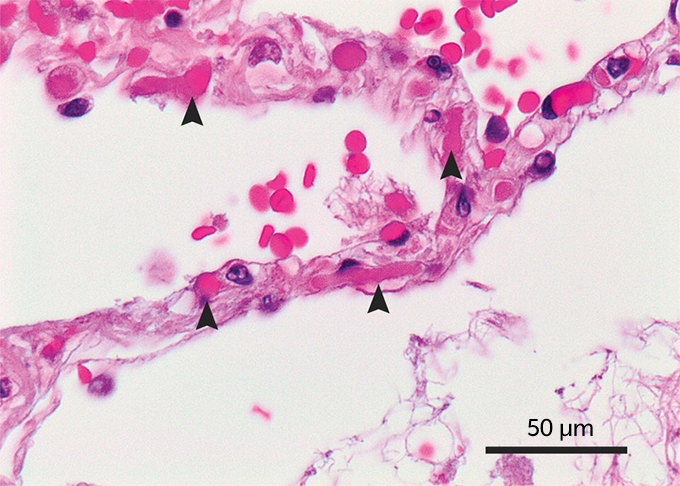
COVID-19で死亡した患者のこの肺組織サンプルでは 肺胞、酸素交換が起こる小さな空気嚢に関連する小さな血管に 小さな血栓(矢印)が形成されている
「ハーバード大学医学部とボストンのブリガム・アンド・ウィメンズ病院の臨床血液学者ジーン・コナーズは言う。これらの患者の中には「劇的な免疫反応」を起こして炎症を高め、それが重度の血栓につながるとコナーズは言う。
そして、凝血は、異なる疾患を持つが、同じような重症度の患者が経験したものよりも悪化しているようである。2009年にCOVID-19またはインフルエンザA(H1N1)のいずれかで死亡した患者の肺を比較した小さな剖検研究は、血栓がコロナウイルスの大きな問題であったことを示唆している。
肺胞、肺と血液の間の酸素の交換を可能にする小さな空気嚢に関連する小さな血管の血栓は、7つのインフルエンザ患者の肺と比較して、7つのCOVID-19患者の肺で広まっていた、研究者たちは5月21日にニューイングランドジャーナルオブメディシンで報告した。
剖検調査のCOVID-19患者の肺では、血管に並ぶ内皮細胞が重度の損傷を受けていることも明らかになった。これらの細胞は通常、血液がスムーズに流れるように血栓を寄せ付けないようにしている。しかし、「ウイルスは血管内皮細胞に損傷を与えるようである」と、ワイル・コーネル医科大学の血液学者マリア・デサンチョ氏は言う。損傷を受けると、細胞は血栓を活性化させる。
COVID-19への体の反応の他の部分は、同様に凝固を煽っている可能性があり、それぞれが過剰に追加している。「悪循環だ」とデサンチョ氏は言う。
COVID-19の患者で広範囲の血栓が発生すると、死亡する可能性が高くなる。オランダの3つの病院の集中治療室に入院した184人の患者を対象とした研究では、75人に血栓、つまり血管を部分的または完全に塞ぐ血栓があったことが判明した。4月22日の時点で41人の患者が死亡していた。血栓症と診断された患者は、血栓症のない患者に比べて死亡のリスクがはるかに高いと研究者らは『Thrombosis Research』7月号で報告している。
血栓を治療したり予防したりするための薬は広く出回っているが、問題はCOVID-19の劇的な量の血栓に効く用量があるかどうかだ。米国、カナダ、ヨーロッパで行われている試験では、その答えを見つけるために患者の募集が開始されており、さらに多くの試験が計画段階に入っている。
RAPID COVID COAGと呼ばれる試験の一つは、COVID-19が確認され、血液検査で血液凝固の副産物であるDダイマーと呼ばれる物質のレベルが上昇している入院患者を登録している。(D-ダイマーは、人が血栓を持っていたことを意味したり、体が炎症を起こして血栓のリスクがあることを意味する場合がある)。
参加者は無作為に2つのグループに分けられる。1群には低用量の抗凝固薬が投与されるが、これは通常、手術などでリスクのある人の血栓形成を防ぐために使用されるものである。もう一つのグループは、診断された血栓を分解するために通常使用される量の高用量を取得する。
「我々 の試験の背後にあるアイデアは、早期に高用量で抗凝固療法を開始し、それが病気や死亡のリスクを悪化させるのに有効かどうかを判断することである」とトロント大学とトロントのセント マイケルズ病院の血液学者ミシェル Sholzberg は言う。この試験は今年末までに終了する予定である。
重度の炎症が血栓のリスクを高めることができることは驚くべきことではないが、COVID-19 で見られる「血栓または本格的な血栓への素因」が明確に見える、と Sholzberg は言う。「これは……これまで見たことのないレベルの血栓性炎症であり、これほど大規模なものはない。」

