Contents
コロナウイルス 一酸化窒素の保護効果
www.sciencedirect.com/science/article/pii/S1286457920300800
概要
一酸化窒素の免疫調節作用と抗ウイルス作用/SARS-CoV-2活性の可能性
pubmed.ncbi.nlm.nih.gov/32454510/
一酸化窒素(NO)は、血管系、代謝系、免疫系、神経系の各機能を制御する複数のシグナル伝達経路において重要な分子である。ここでは、自然免疫機能を媒介する様々な細胞型における基礎生理学的な準備状態の維持や、ウイルス感染症に伴う炎症を媒介する適応免疫応答の促進におけるNOシグナル伝達経路の複数の役割に焦点を当てて議論する。
先行研究では、血管内皮の恒常性維持には構成的なNOシグナル伝達経路が重要であることが明らかにされており、自然免疫応答の状態依存的な変化は、NOを介した抑制トーンの機能的なオーバーライドと関連している。
したがって、一連の証拠は、NOシグナル伝達経路の調節障害、および誘導性NOの通常の酸化的効果が、ウイルスの侵入および複製のための寛容な細胞環境を提供している可能性を示唆している。
免疫学的に低下した個体では、抑制性NOシグナル伝達系の機能的なオーバーライドや慢性的なダウンは、制御されていない炎症性経路の異常発現を促進し、その結果、広範な代謝不全や自律的な細胞や器官の構造的な損傷を引き起こすことになる。
我々は、医薬品、食事療法、複雑な行動療法を組み合わせた介入により、正常なNOトーンを回復させることで、制御されていない適応免疫応答にリンクしたウイルス感染によってもたらされた有害な生理的状態を部分的に逆転させる可能性があると考えている。
COVID-19予防・治療法として検討中の一酸化窒素
一酸化窒素(NO)ガスの吸入は、COVID-19に対する予防および治療法として現在検討されている.
臨床試験NCT04306393、NCT04312243、NCT04338828、NCT04305457
吸入一酸化窒素療法は、COVID-19の主要な合併症である急性呼吸窮迫症候群(ARDS)に対する動脈酸素化を改善するためのレスキュー治療として使用されてきた[4]。
SARS患者への一酸化窒素(NO)吸入試験
2002-2003年にコロナウイルスによって引き起こされた重症急性呼吸器症候群(SARS)の流行の間、6人のSARS患者を対象に一酸化窒素吸入試験が行われ、肺高血圧の低下、動脈酸素化の改善、肺浸潤の広がりと密度の低下などの有益な効果が得られた[5]。
portlandpress.com/clinsci/article-lookup/doi/10.1042/CS20050188
吸入された一酸化窒素はSARSに有益な効果があることが報告されている。
重度の呼吸不全に対する一酸化窒素(n=6)と支持療法(n=8)の使用を比較した対照試験では、一酸化窒素吸入投与後に酸素濃度の改善が認められ、これにより人工呼吸支援を中止することができた
興味深いことに、一酸化窒素吸入を中止した後も有益な効果は持続した。
ウイルスの不活性化
SARS-Covの複製阻害
一酸化窒素はin vitroでSARS-CoVの複製サイクルを阻害することが示されている。
一酸化窒素(NO)は、ウイルスの複製に不可欠なタンパク質や核酸を修飾することでウイルスを不活性化し、ヘルペスウイルス、ライノウイルス、ハンタウイルス、コクサッキーウイルス、日本脳炎ウイルス、レトロウイルス、ワクシニアウイルス、SARSコロナウイルスを含むin vitroでのウイルスの複製を減少させることができる。また、豚の実験動物モデルでは、一酸化窒素(NO)は肺ウイルスの複製を抑制する。
ヒトでは、呼気された一酸化窒素(NO)の基底レベルが高いほど、風邪の症状が少ないことが示唆されている。ヒトでは、呼気された一酸化窒素(NO)の基底レベルが高いほど、風邪の症状が少ないことが示唆されている。
それにもかかわらず、ある研究では、致死量のインフルエンザウイルスを経鼻的に感染させたマウスにおいて、80または160ppmの一酸化窒素(NO)を吸入しても生存率またはウイルス負荷を改善することができなかったことが示されている。
さらに、急性ウイルス感染症や喘息を持つ被験者では、これらの条件下での経口呼気一酸化窒素(NO)レベルの上昇が見られるように、高レベルの一酸化窒素(NO)が上皮細胞や白血球によって産生されている。
高い呼気一酸化窒素レベルは現在、喘息患者における好酸球性気道炎症のマーカーとして使用されており、一部の著者は一酸化窒素(NO)が気道炎症中の組織損傷に寄与する可能性があると提案している。
したがって、吸入による一酸化窒素レベルの増加または一酸化窒素ドナーを用いた処置がCOVID-19被験者において抗ウイルス効果をもたらすかどうかは依然として不明である。
吸入された一酸化窒素(NO)が気管支拡張および酸素化に及ぼす可能性のある効果は、特に現在の人工呼吸器の不足を考慮すると有望であるように思われる。
逆に、気道中の低い一酸化窒素レベルは、SARS-CoV-2感染および一部の個体におけるCOVID-19の発症を促進する可能性がある。したがって、Kartagener症候群[および嚢胞性線維症[を含む鼻腔内一酸化窒素産生の低下に関連する状態は、再発性呼吸器感染症および炎症と関連している。
同様に、一酸化窒素NOSが欠損しているマウスやNOS阻害剤で治療されたマウスもまた、ウイルス感染症に罹患しやすい。
一酸化窒素を低下させる要因
喫煙者、アルコール、カフェイン、コルチコステロイドによる一酸化窒素(NO)低下
一般集団では、白人(アジア人と比較して)および喫煙者、アルコール、カフェイン、またはコルチコステロイドを摂取している人では、口から吐く一酸化窒素レベルおよび鼻から吐く一酸化窒素レベルが低下している。

図 1. SARS-CoV-2ウイルス負荷および酸素化に対する鼻呼吸および一酸化窒素の潜在的な効果。鼻呼吸は、空気をろ過し、気道内の一酸化窒素レベルを増加させることにより、COVID-19被験者におけるウイルス負荷を減少させ、酸素化を改善する可能性がある。いくつかの要因が、それぞれピンクの矩形および緑色の矩形に示されるように、一酸化窒素のレベルを減少させたり、増加させたりする可能性がある。
口呼吸による一酸化窒素低下
気道内の一酸化窒素レベルを低下させるもう一つの現象として、鼻から吸い込んだ空気をろ過したり、温めたり、加湿したりする効果と同様に、口呼吸がある。測定結果によると、口呼吸者は鼻呼吸者に比べて気道内の一酸化窒素レベルが低いことが示されている。
口呼吸は、顔面や歯の発育異常、心血管疾患、疲労、口臭、頭痛、高血圧、炎症、睡眠時無呼吸、いびき、ストレス、虫歯など、多くの健康問題と関連している。
ほとんどの人が自発的に鼻で呼吸することを報告しているが、口呼吸は会話中、運動中、睡眠中、またはアレルギー、鼻づまり、鼻閉塞のある人に起こる可能性があり、一般的に認識されているよりも一般的に普及している可能性があることを示唆している。
一酸化窒素の増加
一酸化窒素(NO)を増加させる薬剤、食品
ヒトの体内の一酸化窒素レベルを増加させるために考えられる他の選択肢としての一酸化窒素ドナー分子
- アルギニン、シトルリン
- ニトログリセリン
- ホスホジエステラーゼ阻害剤(例バイアグラなど)
- 葉緑野菜、ビートルーツ、ハーブスパイスなどの硝酸塩を多く含む食品の摂取
などが挙げられるが、これらの場合には呼吸器系への効果はあまり期待できないかもしれない。
www.healthline.com/nutrition/how-to-increase-nitric-oxide#section5
太陽を浴びる
https://alzhacker.com/covid-19-heliotherapy/
吸入一酸化窒素
SARS-CoV-2感染症に対して吸入一酸化窒素を使用する根拠は、この分子が肺および心血管生理学において重要な役割を果たしているという事実に由来する。一酸化窒素は活性酸素種(ROS)であり、一酸化窒素合成酵素(一酸化窒素(NO)S)を介して副鼻腔や鼻咽頭の上皮細胞によって継続的に産生されている。
人間の副鼻腔では10ppm(10parts per million)で生成され、一酸化窒素(NO)は気管支や肺に拡散することができ、そこで血管拡張作用や気管支拡張作用を誘導する。
また、一酸化窒素は毛様体運動や粘液分泌を活性化し、気道からの塵埃やウイルス粒子の除去を増加させることができる。特に、一酸化窒素は細菌、真菌、蠕虫類、原虫、ウイルスなど幅広い微生物に対して抗菌作用を発揮し、肺感染症の予防に役立つと考えられている。
高齢者、男性、睡眠中で一般的
例えば、睡眠中に鼻呼吸と口呼吸を切り替えることは、特に高齢者では一般的である。研究によると、睡眠中にいびきをかいたり、口呼吸をしたりする人(男性に多くみられる状態)は、気道感染症を発症する可能性が高いことが示されている 。
粘着テープで口を塞ぐ!
我々の実例観察では、粘着テープで口を塞ぐことで睡眠中の鼻呼吸を促進することで、一般的な風邪を軽減することも示唆されている。この現象は、吸入された空気に対する鼻のろ過および加湿効果と気道内の一酸化窒素レベルの上昇によるものであり、睡眠中のウイルス負荷を減少させ、免疫系が効果的な抗ウイルス反応を起こすための時間を増やすことができる。
逆に、気道上皮細胞のウイルス感染に続いて、日中および睡眠中に一定または断続的に口呼吸をすると、ウイルスに対する鼻および一酸化窒素の有益な効果が低下し、したがって、妨げられないウイルス複製につながる可能性がある。
したがって、睡眠中の口呼吸はCOVID-19の症状を悪化させる可能性があり、呼吸器感染症の症状は通常午前中に悪化するという観察と一致している。
ライフスタイルの改造 運動・睡眠・鼻呼吸
気道内の内因性一酸化窒素レベルを低下させる生活様式因子(口呼吸および喫煙など)を制限することは、気道内のより効率的な抗ウイルス防御機構を促進することにより、SARS-CoV-2ウイルス負荷およびCOVID-19肺炎の症状を減少させることにも役立つかもしれない。
SARS-CoV-2を標的とした有効な治療法がない場合、COVID-19の症状を軽減するために、これらの戦略が検討され、試験されるべきであると考えている。
最後に、鼻呼吸と運動、十分な睡眠、およびバランスのとれた食事を含む健康的なライフスタイルを組み合わせることで、疾患の全体的な重症度も低下するであろう。
COVID-19患者のためのホーム一酸化窒素療法
pubmed.ncbi.nlm.nih.gov/32437250/
アレルギー・クリティカルケア医学部門、ピッツバーグ大学医学部医学科、ピッツバーグ心臓・肺・血液・血管医学研究所
SARS-CoV-2ウイルスへの感染は、上気道症状から重度の急性呼吸窮迫症候群(ARDS)、ショック、急性腎障害、血栓塞栓性合併症に至るまで、様々な心肺・血管合併症を引き起こす(1, 2)。
SARS-CoV-2は最初は上気道上皮に感染するが、本疾患の最も重篤な合併症のいくつかは血管の炎症と損傷を介して生じるようである。さらなる機序解明と疫学的研究が必要とされているが、症例報告、画像研究、剖検シリーズなどから、SARS-CoV-2ウイルスが下気道に侵入すると、内皮細胞に直接感染し、血管閉塞、血管血栓、肺水腫、内皮剥離、肺血流の異常調節などのカスケードを引き起こす可能性が示唆されている(2、3)。
メカニズムにかかわらず、患者はしばしば低酸素血症を伴う重度の呼吸不全を発症し、酸素補給に難渋し、しばしば侵襲的な機械的換気を必要とすることが明らかである。
ウイルスが急速に拡散したため、多くの医療システムは COVID-19 の症例の急激な増加にストレスを感じ、それに伴う病床、集中治療室の病床、人工呼吸器、さらには酸素の必要性の増加に直面した。機械的に人工呼吸を行っている患者の多くは、加圧依存性ショックとそれに伴う高い死亡率を特徴とする多臓器不全症候群を発症する。
機械換気の助けを借りて生き延びた患者でさえ、長期の入院を必要とすることがある(4)。SARSCoV2感染によるこれらの副作用は、医療システムの資源に大きな負担をかけている。
肺動脈性高血圧症(PAH)患者の症例
このような背景から、Zamanian氏らは、ここで、肺動脈性高血圧症(PAH)患者の興味深い説得力のある症例を紹介している。
(吸入一酸化窒素)(5)。 血管反応性PAHを良好にコントロールしていたこの患者は、センターから300マイル以上離れた遠隔地に住んでおり、COVID-19と診断された後、息切れの悪化の症状を経験した。
介護を受けるために遠距離を移動することへの懸念を考慮し、また、吸入一酸化窒素への反応性が確認されていることから、遠隔で症状、バイタルサイン、機能能力をモニタリングしながら、外来吸入一酸化窒素システムで患者をサポートする計画を立てた。
介護者の評価による 6 分間の歩行距離と症状スコアが急速かつ持続的に改善し、数日後には救急科や病院での治療を必要とせずに回復した。 この事例報告は多くの疑問を投げかけている。
吸入一酸化窒素はどのようにこの患者に利益をもたらしたのだろうか?それとも、一酸化窒素ドナー、一酸化窒素前駆体、ホスホジエステラーゼ5阻害剤など、一酸化窒素軸に沿ってシグナル伝達を増加させる他の治療法も有用なのだろうか?
一酸化窒素は、患者の自宅で安全に投与することができるのか?
メカニズム
一酸化窒素は遊離ラジアルガスであり、人間の生理機能において重要なシグナル伝達分子として機能している。その常用受容体であるグアニル酸シクラーゼは血管平滑筋細胞に高発現しており、一酸化窒素がそのヘム部位に結合すると活性化し、グアニル酸-5′-三リン酸(GTP)から環状グアニル酸一リン酸(cGMP)への酵素変換を促進し、血管弛緩を促進する。
ガスとして、それは、それが局所的な血管拡張を促進する換気の良い肺ユニットへの配信を含むユニークな薬理学的特性を持っている。一酸化窒素が入ると、 血液の流れに一酸化窒素が入ると、急速に動脈内ヘモグロビンと反応する。
その結果、半減期が非常に短く、全身的な効果を制限する一酸化窒素を不活性化する。換気の良い肺ユニットの肺動脈を優先的に血管拡張することで、換気の悪い肺ユニットへの相対的な血流を減少させ、換気灌流(VQ)の整合性を高め、酸素化を増加させる(6)。
一酸化窒素はまた、軽度の気管支拡張を誘導し、好中球が介在する酸化バースト(6)を抑制する。
吸入一酸化窒素の臨床試験・改善例
これらの特性は数十年前からよく知られており、新生児の持続性肺高血圧症の治療薬としてUSFDAの承認を得ているほか、ARDS、心臓手術後の右室不全、急性肺塞栓症、さらに最近では長期の酸素療法を必要とする患者の肺線維症を含む無数の疾患を持つ患者に対する吸入一酸化窒素の様々な試験が行われている(6-10)。
重症急性呼吸器症候群(SARS)患者では、重症度をマッチさせた観察コホートにおいて、吸入一酸化窒素は酸素化の改善と関連した(11)。内因性および外因性一酸化窒素の両方がSARSのCoVウイルス複製を阻害することが示された(12)。
成人のARDS患者における機械換気時間の短縮や死亡率の低下は示されていないが、吸入一酸化窒素はARDS患者の酸素化を有意に改善し、肺血管抵抗の低下をもたらす(6) (図1)。
これらの治療反応は、侵襲的な機械換気の必要性を減らすために、COVID-19感染の早期に吸入一酸化窒素を使用することができることを示唆している。
ARDSにおける仰臥位と神経筋遮断薬の研究は、これらの治療法の早期導入の臨床試験では、先行研究では得られなかった効果が実証されていることから、その可能性を歴史的に思い起こさせるものである(13, 14)。
自宅治療の可能性
Zamanian氏の症例はまた、患者を自宅で治療するためのポータブル吸入一酸化窒素送達システムの実現可能性を強調している。これは病院の集中治療環境向けに設計されているが、このケースで実証されたように、タンクレス送達システムのような特徴があり、在宅での送達が可能であることを示している。
吸入一酸化窒素pulse®(Bellerophon Therapeutics、ニュージャージー州)、Nu-Med Plus(UT)、イリジウム電気式一酸化窒素ジェネレータ(Third Pole Therapeutics、マサチューセッツ州)などの他のシステムは、少なくともある程度の携帯性を考慮して設計されている。
吸入一酸化窒素のような治療法で患者を自宅で治療することには懸念があるだろうが、前例がある。長期的に酸素を必要とする線維性肺疾患の外来患者を対象とした無作為化プラセボ対照試験では、イノパルス療法はプラセボよりも高い運動量と関連しており、肺線維症を伴う肺高血圧症患者を対象とした急性用量漸増試験では、イノパルスシステムを介して吸入一酸化窒素を投与することで肺血管抵抗が30%減少し、心拍出量と肺動脈コンプライアンスが改善された(15)。
Zamanian博士の患者の経験は、COVID-19を有するすべての患者、あるいはCOVID-19を合併したPAHを有する患者を代表するものではないことを認識することが重要である。この患者は血管反応性PAHの診断が確立されており、医師として複雑な治療を行うことができる唯一の資格を持っていた。
しかし、この例は、この介入が酸素化を改善し、機械的換気の必要性を減らすことができるかどうかを確立するために、COVID-19を有する患者における吸入一酸化窒素療法を研究することの合理性を支持する興味深い概念実証研究として示唆されている。
内皮一酸化窒素(NO)産生とNOバイオアベイラビリティの低下がCOVID-19関連死の決定的な原因となりうるか?
www.sciencedirect.com/science/article/pii/S0306987720310744
ここ数ヶ月、突如として人類のアジェンダに現れたパンデミックがある。COVID-19関連死を分析すると、すべての症例シリーズ[1], [2], [3]で高齢者と男性の死亡率の高さが明らかになっている(表1)。
すべての研究において、高血圧は明らかに主要な併存疾患であり、次いで糖尿病、肥満、その他の心血管障害が続いている。SARS-CoV-2の受容体であるアンジオテンシン変換酵素2(ACE2)は、一酸化窒素(NO)の放出と酸化ストレスを調節することで血管機能を調節している[5]。
高齢者と若年者、高血圧者と健常者、男性と女性の比較において共通して見られる顕著な特徴は、内皮NO産生量の減少とNOバイオアベイラビリティの低下であり、これは心血管疾患や代謝性疾患にも共通した欠乏症であることがわかった。
表 1. CDC Weekly/Vol.2/No.8データによると、中国でのCovid-19の症例死亡率。

生理的なNOシグナル伝達は、内皮機能、代謝および血管の健康の重要な決定因子である。それは、血管の調子の主要なレギュレータであり、抗酸化、抗炎症、抗血栓活性を持っている[6]。内皮機能不全は、様々なケモカイン、サイトカインなどによる内皮細胞の作用のシフトをもたらし、最終的には炎症性、増殖性、血栓性の状態を誘導する[7], [8]。
これまでの研究では、加齢が内皮依存性血管拡張の最も重要な予測因子であり、NOの利用可能性は加齢とともに徐々に低下することが示されている[9], [10], [11], [12](図1)。内皮機能障害などの本態性高血圧に伴う血管変化は、一般的に加齢に見られる変化の加速形と考えられている[12]。
図1. 性別に基づく内皮一酸化窒素(NO)産生の仮定的表現(以前に発表された研究[9], [10], [11], [12], [26]から適応)
エストロゲン
エストロゲンは内皮一酸化窒素合成酵素(eNOS)の発現と活性を増加させ、NO産生は女性の全身血管系で高くなる[13]。また、女性は男性よりも高い自然免疫応答および適応免疫応答を産生することが知られており、これによりウイルスのクリアランスがより速くなる可能性がある[14]。
COVID-19による死亡率は、異なる年齢層および/または併存疾患における内皮NO産生およびバイオアベイラビリティーの低下と相関関係がある。これが直接的な抗ウイルス効果なのか、免疫調節と関連しているのかは、さらに調査する必要がある。このことは、内皮NOの利用可能性を増加させることが、COVID-19に対する抗ウイルス抵抗性に直接有効であることを示唆している。
ポリフェノール・カロリー制限・運動
ポリフェノールを豊富に含む食事、カロリー制限および定期的な運動は、内皮NO産生およびバイオアベイラビリティを増加させるための非薬理学的戦略である[6]、[15]。
内皮NO産生が損なわれる老化、心血管系および代謝障害のような状況では、ニトロソ化合物がNOの貯蔵プールおよびドナーとして機能し、不十分なeNOS活性を補うことができることを示唆するかなりの発表されたデータがある。ニトロソ化合物の全身レベルは、硝酸塩[15]、[16]、[17]、[18]、[19]、[20]を豊富に含む野菜によって大きく影響を受けることができる。
硝酸塩
ACE2の発現は、すべての臓器の血管内皮や動脈平滑筋、小腸の肺胞上皮細胞や腸球で確認されている[21]。この点から注目すべきは、硝酸塩の食餌摂取後に呼気NOの著しい増加があるという研究[22]、[23]や、上部腸内の亜硝酸塩から生成されるNOは、酵素合成から組織内で発生する濃度の最大10,000倍であるという報告[12]もあることである。
タバコに含まれるニトロソ化合物?
もう一つの興味深い点は、広範な疾患の重要な危険因子であるにもかかわらず、タバコの煙には膨大な量の窒素酸化物が含まれており、喫煙習慣はニトロソ化合物の血中プールを増加させる可能性があるということである[24]。
SARS-CoVのNO抑制
Âkerströmらは、SARS-CoVに対するNOの抑制効果が細胞内で起こっていることを実証した。この研究におけるNOの総量を媒体中の細胞数で割ると、血管内皮における生理的なNO産生レベルに匹敵する結果が得られるのではないかと推測している。
このような観点から、血管内皮、特にウイルス侵入の初期段階では、ウイルス物質が少量でキャプシドの外に出ている場合には、細胞内で産生されるいかなる量のNOも、感受性の高いウイルスに影響を与えるはずであり、健全なeNOS機能は第一次防御として非常に価値のあるものであると考えられる。
結論
COVID-19パンデミックの緊急性のため、同時学習と実践は避けられない。NO産生量の減少とバイオアベイラビリティーの低下とCOVID-19の死亡率との関係は、代替的な予防法や治療法を切り開く可能性を秘めている。
COVID -19の間の神経学的、認知的、行動学的障害:一酸化窒素トラック
onlinelibrary.wiley.com/doi/full/10.1111/jgs.16671
コロナウイルス疾患2019(COVID-19)は、特に高齢者において、幅広い臨床徴候を示す1。Alkeridyらは最近、そうでなければ無症状のCOVID-19を有する73歳男性に下肢の感覚運動障害を伴うせん妄を認めた興味深い症例を報告した1)
著者らが提案したメカニズムは、COVID-19の原因物質である重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)による神経系への浸潤に基づいており、以前に脳炎を伴うCOVID-19症例で報告された2)。この仮定の価値は認めつつも、ここではCOVID-19患者における神経認知障害の発症を説明するための第三の因子、すなわち一酸化窒素(NO)の役割について議論する。
NOはもともと内皮由来のリラックス因子として知られており、L-アルギニン、酸素、ニコチンアミドアデニンジヌクレオチドリン酸から、様々な一酸化窒素合成酵素によって内因的に合成されるガス状の膜溶性神経伝達物質である3-5。
NOは脳内の細胞シグナル伝達に重要な役割を果たしているが、「型にはまらない」神経伝達物質と言われている。4 また、NOは膜に関連する受容体に結合して作用を媒介するのではなく、ニューロンからニューロンへと拡散して細胞内成分に作用する。環状ヌクレオチドcGMPは血管平滑筋を弛緩させ、その結果、血管拡張と血流増加をもたらする。また、細胞内のcGMP濃度の上昇は、神経細胞の過剰な興奮性や運動機能の亢進に寄与することが示されている6 。
このことから、COVID-19患者の神経学的徴候のいくつかは、ウイルスによる脳内NO濃度の低下と関連していることが示唆される。NO の産生はレニン-アンジオテンシン系(RAS)と密接に関連しており、SARS-CoV-27 によって正確に標的化され、スパイク(S)糖タンパク質を介して、大脳ニューロンを含む多くの細胞の表面に発現するメタロペプチダーゼ・アンジオテンシン変換酵素2(ACE2)受容体7 と相互作用することで RAS を過剰に活性化することが報告されている8。
RASにおいて、アンジオテンシンⅡは血管収縮因子である1型アンジオテンシンⅡ受容体(AT1R)に作用してNOの産生を低下させることが報告されている9 。NOは基本的にあまりにも反応性が高いため(半減期が5秒と非常に短い)、適切な治療標的を構成するために、戦略は、RASの過剰活性化に対抗し、したがって、神経系における適切なNOレベルを維持することであろう。興味深いことに、NO産生を上昇させることが知られている特定の薬剤を用いて脳内のNO濃度を上昇させた過去の研究では、実験動物の記憶力を向上させることが判明している。
ヒトCOVID-19において、RASの過剰活性化を制限/カウンターバランスをとるために提案されている化学療法薬は、ACE阻害薬(アンジオテンシンIからアンジオテンシンIIの産生を防ぐため)、ロサルタンやその誘導体のようなAT1Rのブロッカー/アンタゴニスト、およびいわゆるカウンターレギュラトリーRASに属するいくつかの天然の候補ペプチド薬である可能性がある(すなわち これらの分子はすべて、SARS-CoV-2によって誘発されたRASの過剰活性化を打ち消し、NO産生を維持し、COVID-19の神経学的認知・行動障害をある程度まで逆転させることが期待されている。
一酸化窒素を高濃度で短時間に投与すると、COVID-19に対する保護効果が得られる可能性がある。
pubmed.ncbi.nlm.nih.gov/32590117/
要約
以前から、NOがウイルスの複製の初期段階を阻害する可能性が示唆されている。さらに、試験管内試験(in vitro)試験では、NOが重症急性呼吸器症候群コロナウイルスの複製サイクルを阻害することが示されている。
喫煙がCOVID-19感染の危険因子として挙げられているにもかかわらず、2003年の中国ではSARS-コロナ感染、中国、欧米ではCOVID-19感染が認められた喫煙者の割合は低かった。我々は、タバコの煙に含まれる高濃度のNO濃度の断続的なバーストが、ウイルスから身を守るメカニズムではないかと仮説を立てた。
たばこの煙に含まれるNOのピーク濃度は250ppmから1350ppmであるのに対し、薬用では80ppmから最大160ppmである。ウイルスに到達するための細胞壁を介したNOの拡散は、古典的な物理学の法則によれば、煙の中の非常に高いNO濃度で有意に効果的であるはずである。
主流煙に含まれる窒素の酸化物はNOだけであり、吸い込まれるNO2濃度は非常に低いか検出不可能であり、メトヘモグロビン濃度は非喫煙者よりも喫煙者の方が低く、NOを洗い流すパフの間の空気の呼吸によって合理的に説明される。
特殊なiNOマシンは、現在、高濃度の用量で短いバーストで断続的に薬物を提供するために開発することができ、それはその後、喫煙に関連する健康被害を伴わずに、高リスクの人々のための予防薬だけでなく、効果的な治療法の両方を提供することになるだろう。
本文
本解説では、高濃度で短時間のバーストで送達される吸入一酸化窒素(iNO)がCOVID-19に対する保護効果を有するという仮説を提示する。長い間、NOがウイルス複製の初期段階を阻害し、その結果、ウイルスの拡散を防ぎ、ウイルスのクリアランスと宿主の回復を促進することが示唆されてきた[1]。
最近の書簡の中で、Ignarroは、これがNO(iNO)の吸入にも適用されると仮定した[2]が、以前のSARS-コロナパンデミックでの知見によって支持された。
この解説の著者の一人は、北京で限られた患者数のSARS患者にiNOを投与した[3]。iNOは、2-3日以内に、動脈酸素濃度(動脈酸素張力、PaO2を触発酸素分率、FIO2で割った値)で表される動脈酸素化を劇的に改善した。
PaO2/FIO2比は平均値97~260mmHgから上昇し、図1に示すように、経皮的酸素飽和度が上昇し、同時に呼吸支援が減少または中止された。PaO2/FIO2比の270%の増加は、20%の改善が有意であると考えられるiNOでARDS患者を治療する際に一般的に見られるよりも何倍も大きい[4]。
同様に低いPaO2/FIO2比(110 mmHg)もまた、より多くの患者数の別の研究で報告されている[5]。このことは、SARS患者では、「典型的な」ARDS患者よりも、非換気肺領域を通るシャントが顕著に減少したiNOの方が、より多くの恩恵を受けていることを示唆している。
また、肺浸潤も減少しており、SARS肺炎への効果を示唆していることが判明した[3]。さらに、試験管内試験(in vitro)試験では、NOが重症急性呼吸器症候群コロナウイルスの複製サイクルを抑制することが示されている[6,7]。
つまり、酸素化の改善に加えて、NOは細胞培養試験でSARSコロナウイルスを死滅させたのである。また、SARS-CoV-2ウイルスが感染した新たなパンデミックであるCOVID-19は、血液の酸素化に深刻な障害をもたらした。
発生が始まった中国・武漢からの研究では、COVID-19ではPaO2/FIO2比が中央値77mmHgと低い値を示した[8]。
図1

図1. 6人のSARS患者および同程度の重症度を持つ8人の対照患者において、1週間以上の機械的人工呼吸を行った場合の、パルスオキシメーターで測定した酸素飽和度(SpO2)(上段)および触発酸素分画(FIO2)(下段)に対する吸入一酸化窒素(INO)の効果。
INOを投与された患者ではSpO2が改善され、同時にFIO2が減少したことに注目してほしい。コントロール患者では変化は見られないであった。*#: INO患者と対照患者の間の有意差(p < 0.05 Chen et al. 2004 [3]より。
慢性閉塞性肺疾患であるCOPDの上に急性肺感染症を発症すると肺への負担が増えると推定されるため、喫煙はCOVID-19に感染する危険因子として挙げられている。
2002-3年にSARSに感染した喫煙者と現在のCOVID-19に感染した喫煙者では、より悪い転帰を示した[5,8]。これは、2020年4月にFDAが発表した。
「タバコを吸う人はCOVID-19からのリスクが高まる可能性があり、COVID-19からの転帰が悪くなる可能性がある。」という報告と一致している。
しかし、予想外の発見は、2003年に中国で行われた様々な研究のレビューでは、喫煙者の8%という低い割合でしかSARS-コロナ感染症に罹患しておらず[9]、一般的にはCOVID-19から10%を下回っていたことである[10]。これは中国の男性喫煙者の割合52%よりもはるかに少なく[11]、男性は女性よりも多くの頻度でこの病気に感染しているようである。
このデータは、中国の男性喫煙者の約80%がSARS-CoV-2ウイルスから保護されていたことを示唆しているが、喫煙による慢性的な影響の蓄積により、発症した場合のリスクが高まっていたことを示唆している。
また、フランス、アメリカ、イタリアの異なる研究でも高い保護率が報告されており、喫煙者のCOVID-19感染率は5~6%、喫煙者の基準母集団はフランスの研究[12]では25.4%、アメリカ(ニューヨーク)の研究[13]では13.7%、イタリア(主にミラノ地域)の研究[14]では14.9%であった。
このような4カ国の結果にもかかわらず、喫煙がCOVID-19に対して保護的である可能性があると述べることには消極的であり、19の研究のメタアナリシスでは喫煙がCOVID-19の進行の危険因子であると結論づけられている[15]。
しかし、メタアナリシスが実際に示しているのは、喫煙者がCOVID-19に罹患すると非喫煙者よりも悪化するということであって、比較的多くの喫煙者がCOVID-19に罹患するということではない。
この消極的な姿勢は、喫煙への一般的な反対と、進行中のパンデミックを防ぐためにタバコを使用することへの恐怖によるものかもしれない[16,17]。
たばこの主流の煙には、各パフ中に約250ppmから1350ppmの間のピーク濃度でNOが含まれていることは一般的に知られていない[18,19]。広い変動は、主にブランドに依存している。タバコの煙の非常に高いNO濃度は、それが単一のパフのために存在し、その後、次のパフの前に新鮮な空気の多数の呼吸が続くためにのみ許容されていると推定され、最大160 ppmの80以上の薬用と比較して、。
例えば、1 回の呼吸で 1000 ppm の NO が与えられ、その後 10 回の呼吸が行われた場合は、連続して 100 ppm の NO が与えられたことになるので、1 回のバーストとして与えられた NO は、連続して与えられた低用量の NO と同様の摂取量となる。
さらに、ウイルスに到達するための細胞壁を介したNOの拡散は、古典的な物理学の法則によれば、煙中の非常に高いNO濃度でのバーストで有意に効果的であるはずである。主流煙中の窒素の酸化物はNOだけであり、吸入されるNO2濃度は非常に低いか検出不可能である[20]ため、よく知られている気道刺激作用は存在しないか、または軽微である。
0.012-0.025 ppmの範囲[21]で、期限切れ、内因性に生成されたNOは、喫煙者[22]で減少することが知られているが、タバコのパフによって生成された約100,000倍の高濃度は、内因性の生産の減少を補う以上のものである。
また、メトヘモグロビンレベルは、もし何かあれば、非喫煙者[23]よりも喫煙者の方が低く、低レベルが合理的にNOを洗い流すパフの間に空気の呼吸によって説明することができる。我々 は、NO の我々 の知識と SARS のパンデミックで NO 吸入と肯定的な経験の観点から、タバコの煙の高 NO 濃度の断続的なバーストがウイルスからの保護の可能性が高いメカニズムである可能性がある仮説を立てたい。
ガスタンクからNOを吸い込むことによって間欠的に高いNO濃度をコピーすることは、NO2が空気で希釈されて潜在的に有毒な濃度まで蓄積されるので、問題がある。
高NO濃度のパルス状の短いバーストを行うには、ガスタンクからの供給に依存しない吸入NOのための送達システムが必要となる。このようなタンクレスシステムは存在し[24]、米国FDAによって承認されている。
たばこの煙には、ニコチン、一酸化炭素(もう一つの潜在的な抗ウイルス分子)、その他多くの多かれ少なかれ毒性のある成分や化合物など、他の成分も含まれていることが思い出されるかもしれない。
臨床試験は、この出版の時点では、それがアンジオテンシン変換酵素 2 (ACE-2) のダウンレギュレーションを介して保護の源であるニコチンであると仮定してフランスで開始された。しかし、喫煙者におけるACE-2の気道発現の増加が実証された後、このメカニズムは最近疑問視されている[25,26]。一酸化炭素や他の毒性化合物がどの程度の役割を果たしているかは明らかではない。
以上のことから、中国、ヨーロッパ、米国での独立した研究において、喫煙者の約56~80%がCOVID-19に感染しているという事実は、喫煙者の保護効果の背後にあるメカニズムの理解を刺激するはずである。間欠的な高用量NOがその化合物であることは、ここに提示された証拠から可能性が高いと思われる。
高濃度の短いバーストで断続的に薬剤を提供するために、特殊なiNOマシンを開発することができ、それはその後、喫煙に関連する健康被害なしで、高リスクの人々のための予防薬だけでなく、効果的な治療の両方を提供するであろう。
血中硝酸塩と亜硝酸塩が一酸化窒素のバイオアベイラビリティーを調節する。COVID-19における潜在的な治療機能
www.sciencedirect.com/science/article/pii/S1089860320301725
要旨
COVID-19の転帰のほとんどは、血管系、特に肺の機能障害と関連している。一酸化窒素(NO)ガスの吸入は、中等度から重度のCOVID-19患者の治療法として現在研究されている。期待される血管拡張効果に加えて、NOは潜在的にSARS-CoV-2による感染を予防することも示唆されている。
NOは、人体内の複数のメカニズムで容易に酸化される不安定なラジカル分子であるため、NOを必要とする病変部におけるその濃度を制御することは実質的に困難である。NOの前駆体として無機硝酸塩や亜硝酸塩が知られているが、これらは化学的にも酵素的にも還元されて生成される。
このNO合成酵素(NOS)に依存しないメカニズムは、現在の臨床治療法の開発において見落とされているように思われる。ここでは、硝酸塩とCOVID-19のミッシングリンクを低酸素NO生成の観点から示唆している。
コロナウイルス疾患2019(COVID-19)による肺損傷は、急性呼吸窮迫症候群(ARDS)に続いて「サイトカインストーム」による多臓器不全を伴って急速に進行することが多い。最近のランダム化臨床試験では、副腎皮質ステロイドであるデキサメタゾンの使用が、侵襲的機械換気または酸素のみの投与を受けていた患者の死亡率を低下させることが示唆されている[1]。
しかし、現在までのところ、重症の入院患者に対して有望な特異的薬剤や治療法はない。高用量ビタミンC(HDIVC)静注療法は、入院日数、ICU、死亡率の低下に有効であることが報告されている[2]。ビタミンC(Vit C、l-アスコルビン酸)療法は安全な補助療法として数十年前から知られており、SARS-CoVによる重症急性呼吸器症候群(SARS)をはじめとする様々な疾患で検討されてきた[3]。
その長い歴史的背景にもかかわらず,HDIVC治療については未だに議論がある[4]。ここでは、Vit Cレベルに応答して一酸化窒素(NO)のバイオアベイラビリティーを調節する可能性のある血中硝酸塩と亜硝酸塩に注目している。
SARS-CoV-2は肺の肺胞上皮II型(ATII)細胞上のACE2受容体に結合する[5]。感染後、ATII細胞は肺胞マクロファージ(AM)をリクルートし、サイトカインなどの免疫シグナルを放出しながらウイルスを除去する [6]。これらの細胞は、自然免疫における重要な機能を維持するために、高濃度の細胞間ビタミンC(mM)を必要とする [7]。ヒトは、L-グロノ-γ-ラクトンオキシダーゼ酵素が不足しているため、この必須ビタミンを毎日の食事から摂取することが義務づけられている。
血漿中のVit Cは、ナトリウム依存性のVit Cトランスポーターによって細胞に取り込まれる。並行して、Vit Cの酸化形態であるデヒドロアスコルビン酸(DHA)は、グルコース輸送体を介して取り込まれる。グルコースは、トランスポーター上でDHAと競合するので[8]、細胞内のVit Cの利用可能性は、高血糖状態では制限される可能性があり、糖尿病患者のCOVID-19の病理学的重症化の潜在的な理由である。
Vit Cは、主に炎症で過剰に生成される活性酸素種(ROS)を除去する強力な天然の抗酸化物質である。このような抗酸化機能に加えて、ビタミンは人間の生理において多面的な役割を果たしている。Vit Cは無機亜硝酸塩(NO2-)との化学反応によりNOの産生に関与することが知られている[9,10]。
この反応は酸性条件下で重要であるため、その生理的関連性は胃の胃液のみで検討されてきた[11]。ARDSのような呼吸性および/または代謝性アシドーシスを伴う肺損傷では、損傷した毛細血管内の局所的な低pHが亜硝酸塩からのNOの化学的生産を可能にする可能性がある。
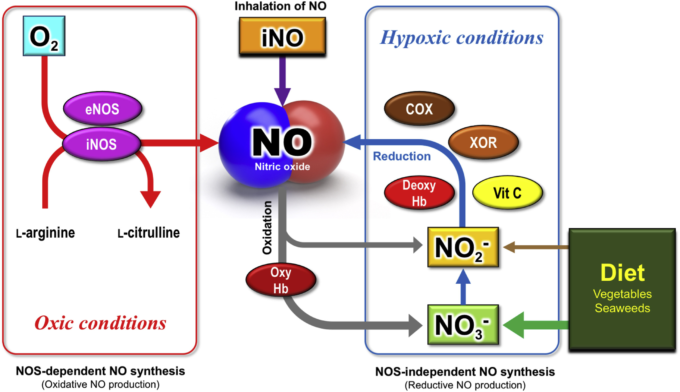
中性に近いpHであっても、亜硝酸は赤血球のデオキシヘモグロビン(デオキシHb)、感染症時の血液中のキサンチン酸化還元酵素(XOR)、ミトコンドリア呼吸鎖のチトクロム酸化酵素(COX)などの複数の酵素(9,11)によって低酸素状態でNOに還元される可能性がある(図1)。
図1
図1. NO生成経路の模式図。一酸化窒素(NO)は血管拡張作用など、ヒトにおいて複数の生理機能を発揮する。また、SARS-CoVをはじめとするウイルスの複製を抑制し、ウイルス感染を防ぐことが示唆されている。
NOの合成には、NOS依存性のNO生成機構とNOS非依存性のNO生成機構がある。経路に関係なく、無機硝酸塩(NO3-)および/または亜硝酸塩(NO2-)がNOの酸化生成物として生成される。ヒトでは、NO3-は、NOのバイオアベイラビリティをサポートするのに役立つかもしれない緑の野菜または海藻類を含む毎日の食事で供給される。
NO、一酸化窒素;iNO、吸入一酸化窒素;NOS、一酸化窒素合成酵素;eNOS、内皮NO合成酵素;iNOS、誘導性NO合成酵素;oxy-Hb、オキシヘモグロビン;deoxy-Hb、デオキシヘモグロビン;XO、キサンチン酸化還元酵素;COX、チトクローム酸化酵素。NO2-、無機亜硝酸塩。NO3-。無機硝酸塩;Vit C、ビタミンC(l-アスコルビン酸)。
NOは血管拡張を制御する短命の気体フリーラジカルであり、COVID-19の肺高血圧を逆転させることが期待されている[12]。最近、COVID-19に対する吸入NO(iNO)の治療効果の検討が提案されている[12,13]。中国ではCOVID-19の重症例の喘息患者がほとんどいなかったことは興味深いことである[14]。
喘息患者では、Tヘルパー細胞2型(Th2)が介在する気道炎症により、NOの放出量が多くなる。喘息を評価し管理するために、気道炎症の非侵襲的な指標として呼気NO(FeNO)が採用されている。血管拡張に加えて、そのような吸入および呼気NOは、SARS-CoV-2感染症に対して示唆されたように、SARS-CoV [12]に対して実質的な抗ウイルス活性を有する可能性がある。
たばこの煙はCOVID-19に感染する危険因子として挙げられているが、中国、ヨーロッパ、米国では喫煙者の割合が低いだけで、SARS-CoV-2感染症に罹患している。たばこの煙に含まれる高濃度NOの断続的なバーストは、ウイルス感染に対する保護のメカニズムとして提案されている[15]。
高血圧などの心血管疾患は、COVID-19患者における最も頻繁な併存疾患として認識されている。NO代謝の低下または障害がCOVID-19の病理学的重症度と関連していることが考えられる。HDIVCは亜硝酸塩との化学反応を通じてNOを需要に応じて供給するのに役立つかもしれない。
NOは主にヒトにおいてNO合成酵素(NOS)によって合成される。NOSによるNO合成は酸素を必要とし、ARDSでは低酸素のために阻害されることに注意することが重要である。その結果、血漿中のNO酸化生成物である亜硝酸塩や硝酸塩の濃度も低くなることが予想される。
これまでのVit C療法の臨床試験結果に一貫性がないのは、血漿中の亜硝酸塩および/または硝酸塩濃度の患者間でのばらつきが原因の一つと考えられる。
欧米とは対照的に、COVID-19による一人当たりの死亡率は、今のところ日本を含む東アジアでは低いようである。この日本のパラドックスは、最近、研究者だけでなく一般の人々からも注目されている[16]。
生物学的根拠としては、これらの国々の硝酸塩を多く含む食事が、NOSに依存しないメカニズムを介してNOのバイオアベイラビリティーを補っているのではないかという仮説が立てられる。
この仮説とよく一致し、日本人の硝酸塩を豊富に含む食事は高血圧やその他の血管疾患を改善することが報告されている[17]。最近の無作為化臨床試験でも、硝酸塩を豊富に含む葉緑野菜の血圧への効果が支持されている[18]。COVID-19に特異的な薬剤が開発されるまでは、NOのバイオアベイラビリティを調節する血中硝酸塩および亜硝酸塩は、臨床治療のみならず、SARS-CoV-2感染症の予防のためにも検討する価値がある。